ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2019, том 89, № 9, с. 1352-1360
УДК 547.1; 547.233
РЕАКЦИИ 2-ФОСФОНЭТИНИЛИРОВАННЫХ
2-(АРИЛАМИНО)МАЛОНАТОВ C ОСНОВАНИЯМИ
© 2019 г. А. В. Eгороваa, b, Н. Б. Викторовa, Г. Л. Староваc, А. В. Догадинаa, *
a Санкт-Петербургский государственный технологический институт (технический университет),
Московский пр. 26, Санкт-Петербург, 190013 Россия
*e-mail: dog_alla@mail.ru
b Научно-исследовательский центр экологической безопасности Российской академии наук,
Санкт-Петербург, Россия
c Санкт-Петербургский государственный университет, Санкт-Петербург, Россия
Поступило в Редакцию 15 мая 2019 г.
После доработки 15 мая 2019 г.
Принято к печати 21 мая 2019 г.
Реакция диалкил-2-[(диалкоксифосфорил)этинил]-2-(ариламино)малонатов с основаниями (СН3СО-
ОK, tert-ВuОK) может служить методом получения оригинальных дифосфонилированных 2,3-дигид-
ро-1Н-пирролов и 4-фосфонилированных 1-азабута-1,3-диенов. Предложена вероятная схема образова-
ния полученных новых соединений.
Ключевые слова: хлорэтинфосфонаты, аминомалонаты, фосфонилирование
DOI: 10.1134/S0044460X19090063
В результате систематических исследований
циклизацию с образованием фосфонилированных
реакционной активности хлорэтинфосфонатов
индолов (схема 1) [19, 20].
показано, что их реакции с моно- и полигетеро-
Опираясь на предположение, что действие ос-
нуклеофильными реагентами являются удобным
нований на 2-[(2-ариламиномалонил]этинфосфо-
подходом к синтезу разнообразных классов фос-
наты может привести к образованию соединений
форсодержащих соединений, таких как амидины,
азириновой структуры, мы провели исследования
амиды
[1-4], формазаны
[5], тиазолотриазолы
реакции последних с основаниями. В качестве
[6], тиазолотетразолы [7-9], оксазолины [9, 10],
оснований в работе были использованы как низ-
имидазотиазолы [11-14], тиазолотиадиазолы [15],
коосновные (СН3СООK, KSCN), так и высокоо-
имидазопиридины [16], пирролы [17].
сновные [СН3ОNa, (СН3)3СОK, DIPEA] нуклео-
Недавно нами было установлено, что диал-
филы. В качестве растворителей были выбраны
кил-2-[(диалкоксифосфорил)этинил]-2-(арила-
метиловый, этиловый, изопропиловый спирты и
мино)малонаты, полученные реакцией хлорэтин-
тетрагидрофуран. Эксперименты проводили при
фосфонатов с 2-(ариламино)малонатами [18], при
различных сочетаниях растворителей и основа-
действии кислот Льюиса (BF3·Et2O) претерпевают
ний. Установлено, что для достижения полной
Схема 1.
O
(R1O)
P
2
CO2Et
CO2Et
BF3·Et2O
(R1O)2PC C C
NHC6H4R2
R2
C6H6,
'
N
CO2Et
O
H CO2Et
1352
РЕАКЦИИ 2-ФОСФОНЭТИНИЛИРОВАННЫХ 2-(АРИЛАМИНО)МАЛОНАТОВ
1353
Схема 2.
O
O
O
(R1O)2P
CH2
CH
P(OR1)2
O
CO2Et
t-BuOK, ɌȽɎ
CO2Et
+
(R1O)2PCH CH C NC6H4R2
(R1O)2PC C
C
CO2Et
EtO2C
20oC, 1.5 ɱ
N
NHC6H4R2
NHC6H4R2
CO2Et
C6H4R2
1a ɝ
2a, ɛ, ɝ
Z,E-3a-ɝ
R1 = Me, R2 = 4-Br (a); R1 = Et, R2 = 4-Me (ɛ); 4-OMe (ɜ); 4-Cl (ɝ).
конверсии этинфосфонатов требуется избыток ос-
ного фрагмента у атомов фосфора при 0.99, 1.03,
нования.
1.10, 1.25 м. д. с константой 3JHН = 7.2 Гц и два
триплета СH3-групп карбоксильных фрагментов
В качестве модельной была выбрана реакция с
этиниламиномалонатом 1г. Наиболее результатив-
при 1.26 и 1.28 м. д. с константой 3JHН = 7.2 Гц. Не-
эквивалетные протоны PCH2-группы представле-
ными оказались реакции с трет-бутилатом калия
ны дублет-дублетным сигналами при 2.95 (2JHH =
в абсолютном спирте (MeOH, EtOH, i-PrOH) и
тетрагидрофуране или с ацетатом калия в ацето-
15.4, 2JHP = 20.9 Гц) и 3.58 м д. (2JHH = 15.4, 2JHP =
22.6 Гц). Неэквивалентные протоны группы OCH2
нитриле или изопропиловом спирте. Эти экспери-
менты привели к более селективному протеканию
у фосфорильных группировок резонируют муль-
реакции. Добавление 50 мол% трет-бутилата
типлетными сигналами (усложненная система AB
калия привело к частичной конверсии. В спектре
или АВМ3Х): δ 3.69, 3.93, 4.06, 4.07 м. д. с кон-
ЯМР 31Р реакционной смеси, помимо сигнала
стантами взаимодействия 3JHH = 7.2, 2JHH = 14.3 и
исходного хлорэтинфосфоната, наблюдались два
3JHP = 7.1 Гц. В немного более слабом поле прояв-
слабоинтенсивных сигнала с δР 13 и 15 м. д., а
ляются мультиплетные сигналы неэквивалентных
также и сигналы равной интенсивности с δР 16 и
протонов двух групп OCH2 карбоксильного фраг-
25 м. д. Увеличение количества трет-бутилата
мента (4.06 и 4.09 м. д., 3JHH = 7.2, 2JHH = 14.7 Гц).
калия (до 100-150 мол%) привело к полной кон-
Дублетным сигналом выходит =CHР-группа (5.59,
версии исходного этинилмалоната 1г. При этом
2JHР = 8.0 Гц). В слабом поле (~6.60-7.20 м. д.)
в спектре ЯМР 31Р незначительно увеличивалась
представлены характерными дублетными сигнала-
интенсивность сигналов с δР 16 и 25 м. д. (1:1).
ми протоны пара-замещенного бензольного коль-
В качестве основного продукта реакции был вы-
ца. Аминная группа резонирует синглетным сиг-
делен дигидропиррол 2г, в молекуле которого
налом при 6.20 м. д. Интегральные интенсивности
присутствуют две фосфонатных группы, и не-
сигналов соответствуют приведенной структуре.
большое количество смесевых фракций изомеров
В спектре ЯМР 13С дигидропиррола 2г в силь-
азадиенов 3г. Аналогично были получены ди-
ном поле наблюдаются сигналы метильных групп.
гидропирролы 2а-в (схема 2). Дигидропироллы
Углерод группы PCH2 регистрируется дублетным
2а, б, г были выделены в индивидуальном виде.
сигналом при 22.80 м. д. с 1JСР = 141.9 Гц. Атомы
Дигидропиролл 2в не удалось выделить в чистом
OCH2-групп у фосфора представлены дублетны-
виде, его спектральные данные аналогичны
ми сигналами в области 61.43-62.50 м. д. с 2JСP =
таковым для пироллов 2а, б, г.
4.9-5.2 Гц соответственно. Синглетами резониру-
Строение полученных фосфонилированных
ют углероды этоксикарбонильных групп (61.61,
пирролов доказано с помощью спектроскопии
62.58 м. д.). Углерод группы =СНР, связанной с
ЯМР 1Н, 13С, 15N. Так, в спектре ЯМР 1Н дигидро-
дигидропиррольным кольцом, проявляется ду-
пиррола 2г в сильном поле представлены четыре
блет-дублетным сигналом при 105.72 м. д. с 1JСP =
триплетных сигнала метильных групп этоксиль-
196.1 и 4JСP = 2.4 Гц. Атом C2 пирролинового
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 9 2019
1354
EГОРОВА и др.
1Н соединений 2а-г и азадиенов 3а-г были сняты
спектры двойного резонанса 1Н{31Р}.
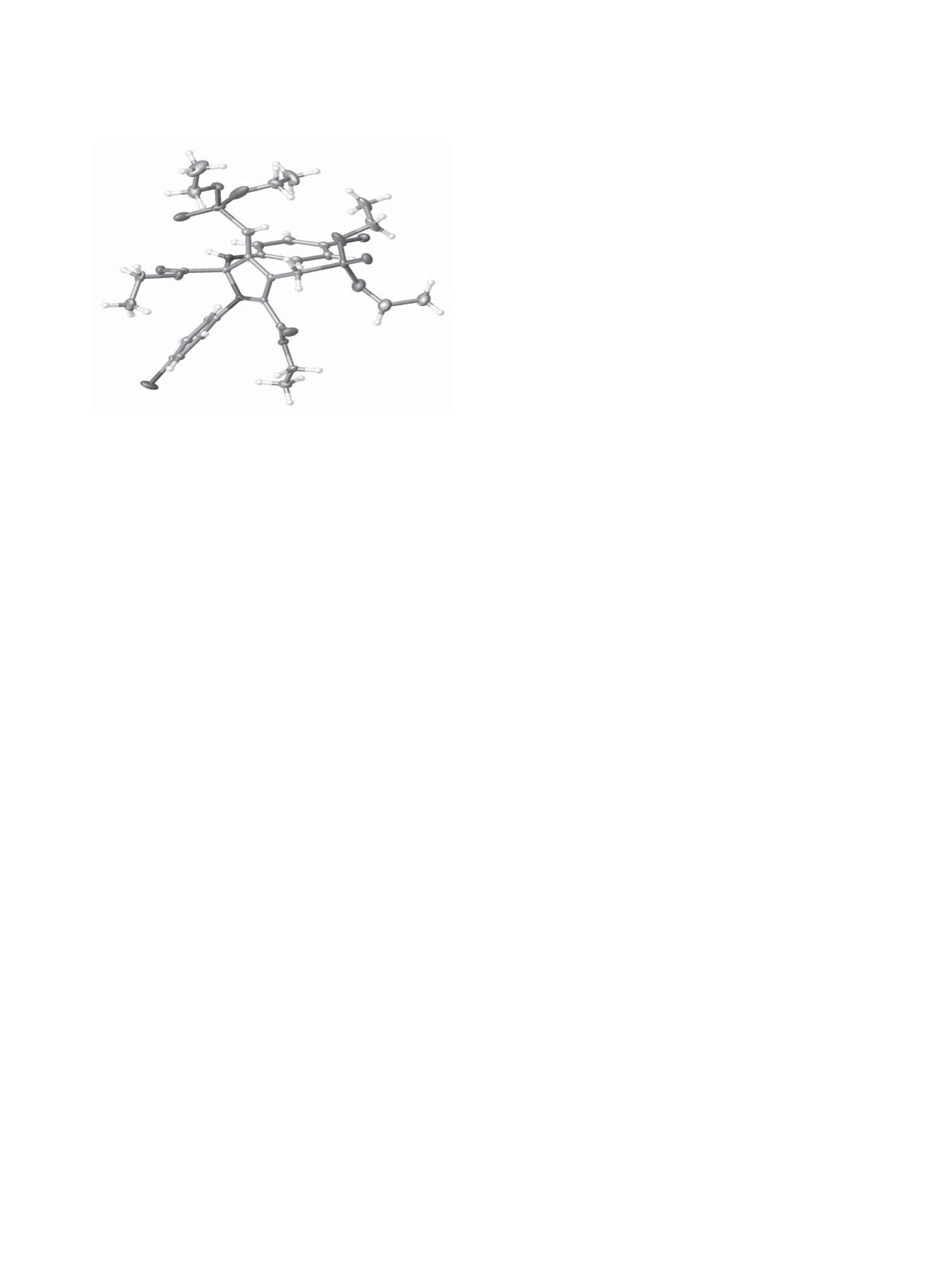
Молекулярная структура соединений 2а-г была
подтверждена данными РСА на примере дигидро-
пиррола 2г (см. рисунок).
Использование в реакции с фосфонилирован-
ными этинмалонатами 1а-г менее сильного ос-
нования, чем трет-бутилат калия, ацетата калия
в абсолютном изопропиловом спирте привело к
преимущественному образованию 4-фосфонили-
рованных 1-азабута-1,3-диенов E,Z-3а-г. Диги-
дропирролы 2а-г образуются в следовых количе-
ствах. Азадиены 3а-г оказались неустойчивыми
как при хранении, так и в условиях хроматографи-
Общий вид молекулы дифосфонилированного 2,3-ди-
гидро-1Н-пиррола 2г в кристалле (ССDC 1574363).
рования на SiO2, однако нам удалось выделить аза-
диен 3г и разделить Е,Z- геометрические изомеры.
кольца регистрируется дублетным сигналом при
Ход реакции контролировали методом ЯМР.
84.52 м. д. с 3JСP = 6.6 Гц. Углерод C4 кольца
В спектрах ЯМР 1Н реакционной массы в обла-
представлен дублет-дублетным сигналом при
сти 5-5.5 м. д. наблюдались характерные сигналы
160.01 м. д. с 2JСP = 4.3, 3JСP = 5.6 Гц. Дублетный
протона у второго углеродного атома фрагмента
сигнал при 144.27 м. д. с 3JСP = 8.8 Гц соответ-
РСН=СH с константами 3JHH = 14.1 и 3JHР = 48.8 Гц.
ствует атому C5. Атому C3 дигидропиррольного
Значения констант
3JHH и 3JHР соответствуют
кольца соответствует дублет-дублетный сиг-
цис-расположению протонов. В спектрах ЯМР
нал при 114.80 м. д. (2JСP = 13.9, 3JСP = 22.5 Гц).
31Р наблюдается интенсивный сигнал в области
В спектре также присутствуют характерные
~13 м. д. Повышение температуры до 60°С при-
интенсивные синглетные сигналы углерод-
вело к почти полному исчезновению сигнала при
ных атомов двух фенильных колец в интервале
~13 м. д. и появлению сигнала в области ~15 м. д.
~116-128 м. д. и сигналы слабой интенсивности
В спектрах ЯМР 1Н при этом появились сигналы
ипсо-углеродов в области ~123-141 м. д. В са-
фрагмента РСН=СН с константами 3JHH = 17.7,
мом слабом поле регистрируются сигналы кар-
3JHР = 21.6 Гц, что соответствует транс-располо-
бонильных углеродов. Карбонильный углерод
жению протонов. На основании этих результатов
у атома C5 цикла представлен дублет-дублет-
мы предположили, что при нагревании имел место
ным сигналом при 161.57 м. д. (4JСP = 2.2, 5JСP =
процесс изомеризации. Изомеризация наблюда-
2.7 Гц). В более слабом поле дублетным сигналом
ется и при хранении при комнатной температуре,
резонирует углерод другой карбонильной группы
а также в условиях хроматографии. В спектрах
(165.94 м. д., 5JСP = 3.6 Гц).
ЯМР 31Р азадиенов 3а-г наблюдается сигнал при
В спектрах ЯМР 31Р соединений 2а-г присут-
~13 м. д. (Z-изомер), с течением времени появля-
ется сигнал в области ~15-16 м. д., соответству-
ствуют дублетные сигналы в областях 16-18 и
24-27 м. д. с константой 5JРP = 2.1-2.4 Гц. В спек-
ющий Е-изомеру. В дальнейшем проходит полная
изомеризация Z-изомера в Е-изомер.
трах ЯМР 15N пирролинов 2а-г регистрируются
синглетные сигналы в области ~80 и ~114 м. д.
Следует отметить, что, помимо упомянутых
Для более четкого отнесения сигналов проведены
выше основных интенсивных сигналов фосфора,
двумерные гетерокорреляционные эксперимен-
в спектрах ЯМР 31Р реакционной массы присут-
ты 1Н-13С HSQC и HMBC. Их данные однознач-
ствовало большое количество сигналов малой ин-
но подтверждают правильность интерпретации
тенсивности при ~12-16 и ~16-30 м. д.
спектров. Для более убедительного доказательства
Таким образом, проведение реакции в изопро-
правильности отнесения сигналов в спектрах ЯМР
пиловом спирте с использованием СН3СООK в ка-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 9 2019
РЕАКЦИИ 2-ФОСФОНЭТИНИЛИРОВАННЫХ 2-(АРИЛАМИНО)МАЛОНАТОВ
1355
Схема 3.
O
O
CO2Et
CO2Et
ɛ
(RO)2PCŁC C
CO2Et
(RO)2PCH C C
CO2Et
N
NHPh
Ph
1
ȼ
a
O
O
(RO)2PCH C CH
CO2Et
(RO)2PC ŁC CH NHPh
N
CO2Et
Ph
Ⱥ
Ƚ
O
O
(RO)2PCH C C NHPh
(RO)2PCH2 C C
CO2Et
N
Et
CO2
Ph
Ȼ
Ⱦ
O
O
O
(RO)2P
CH2
CH
P(OR)2
(RO)2PCH
CH C NPh
CO2Et
CO2Et
EtO2C
3
N NHPh
Ph
2
честве основания приводит к образованию 4-фос-
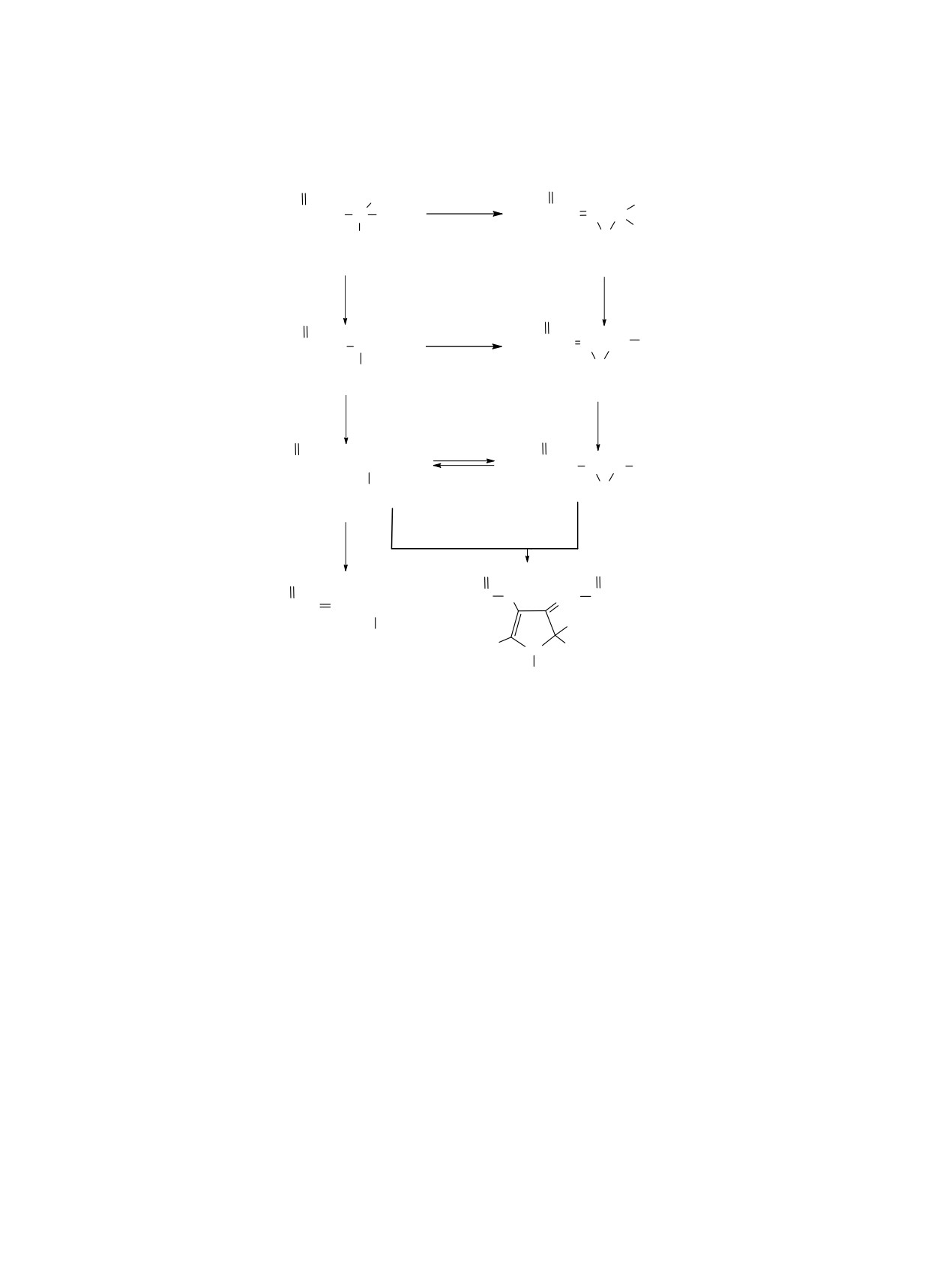
На наш взгляд, можно предположить два ве-
фонилированных
1-азабута-1,3-диенов E,Z-3а-г
роятных пути протекания исследуемой реакции
как основных продуктов. Пирролины 2а-г образу-
диалкил-2-[(диалкоксифосфорил)этинил]-2-(арил-
ются в следовых количествах.
амино)малонатов с основаниями (схема
3).
Поскольку в структуре дифосфорилированных
В индивидуальном виде удалось выделить аза-
диены Z-3г и Е-3г. Выделенные соединения 3а-г
2,3-дигидро-1Н-пирролов 2 имеются лишь два
представляют собой вязкие жидкости желтого
карбоксилатных фрагмента, а в состав полученных
цвета. Строение полученных азадиенов установ-
фосфонилированных азадиенов 3 входит только
лено на основании данных спектроскопии ЯМР
одна карбоксильная группа, мы предположили,
1Н, 13С, 31Р. Стоит отметить, что относительно
что под действием оснований реакция может на-
близкие по строению, не имеющие в заместителях
чинаться с первичного монодекарбоксилирования
фосфорную группу и полученные иным путем,
этинилфосфонатов 1 с образованием интермедиата
азадиены и пирролы описаны в литературе [21-
А (путь а) или циклизации с образованием азири-
24], и данные нашей работы согласуются с ними.
дина В (путь б). Оба пути могут привести к одно-
Как и в нашем случае, авторы работы [21] встре-
му соединению алленовой структуры Б. По пути
тились с большими трудностями при выделении
а аллен Б образуется через 1,3-миграцию протона
продуктов реакции и отмечают особую неустойчи-
в фосфонате А. В случае реализации пути б обра-
вость некоторых из них при хроматографировании
зование аллена протекает через декарбоксилиро-
на силикагеле.
вание азиридина В до интермедиата Г, последую-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 9 2019
1356
EГОРОВА и др.
щий 1,3-перенос протона приводит к образованию
1.5 экв. трет-бутилата калия. Ход реакции кон-
неустойчивого азирина Д - структурного изомера
тролировали методом ЯМР 31Р. Полная конверсия
алленфосфоната Б. Находящиеся в динамическом
достигалась через 1.5 ч. После удаления раствори-
равновесии структуры Б и Д димеризуются через
теля, вязкий остаток очищали колоночной хрома-
раскрытие азиринового цикла с атакой по диго-
тографией (элюент - петролейный эфир-этилаце-
нальному алленовому атому, образуя димер пир-
тат, 1:1).
рольной структуры 2. Параллельно аллен Б может
Z-2,5-Диэтил-1-(4-бромфенил)-2-[(4-бром-
переходить в Z,E- аза-1,3-диен 3.
фенил)амино]-4-[(диметоксифосфорил)метил]-
Таким образом, реакция диэтил-2-[(диалкок-
3-[(диметоксифосфорил)метилиден]-2,3-дигид-
сифосфорил)этинил]-2-(ариламино)малонатов с
ро-1H-пиррол-2,5-дикарбоксилат
(2а). Выход
основаниями (СН3СООK, t-BuOK) может служить
25% (70% по данным ЯМР 31Р), желтые кри-
удобным подходом к синтезу оригинальных ди-
сталлы, т. пл. 160-162°С (гексан-Et2O, 1:1). ИК
фосфонилированных 2,3-дигидро-1Н-пирролов и
спектр, ν, см-1: 760, 842, 887, 960, 1029, 1041,
4-фосфонилированных 1-азабута-1,3-диенов.
1061, 1257,1343, 1498,1502, 1715, 1744, 2989, 3391.
Спектр ЯМР 1H, δ, м. д.: 1.01 т (3H, CH3, 3JHH =
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
7.2 Гц), 1.13 т (3H, CH3, 3JHH = 7.2 Гц), 3.00 д. д
Спектры ЯМР зарегистрированы на спектро-
(1H, PCH2, 2JHH = 15.4, 2JHP = 20.9 Гц), 3.57 д. д
метрах Bruker Ascend 400 [400.13 (1H), 100.61
(1H, PCH2, 2JHH = 15.4, 2JHP = 22.6 Гц), 3.58 д (6H,
(13C), 161.98 (31P) и 40.54 МГц (15N)] в CDCl3.
POCH3, 3JHP = 11.2 Гц), 3.74 д (6H, POCH3, 3JHP =
Химические сдвиги фосфора приведены относи-
10.9 Гц), 4.09 м (2H, OCH2, 3JHH = 7.2, 2JHH =
тельно внешнего стандарта - 85%-ной фосфорной
10.8 Гц), 4.16 м (2H, OCH2, 3JHH = 7.2, 2JHH =
кислоты. Химические сдвиги азота 15N приведе-
10.8 Гц), 5.59 д. д (1H, =CHР, 2JHР = 8.7, 5JHP =
ны относительно внешнего стандарта - аммиака.
1.0 Гц), 6.14 с (1H, NH), 6.61 д (2H, α-Ph-NH, 3JHН =
ИК спектры записаны на спектрометре Shimadzu
8.8 Гц), 6.83 д (2H, α-Ph-N, 3JHН = 8.6 Гц), 7.27 д
FTIR-8400S в таблетках KBr. Масс-спектры высо-
(2H, β-Ph-NH, 3JHН = 8.8 Гц), 7.35 д (2H, β-Ph-N,
кого разрешения записаны на масс-спектрометре
3JHН = 8.6 Гц). Спектр ЯМР 13C, δC, м. д.: 13.61
Bruker MicrOTOF при ионизации вещества распы-
(CH3), 13.90 (CH3), 21.40 д (PCH3, 1JСР = 142.4 Гц),
лением в электрическом поле (ESI); температура
22.19 д (PCH2, 1JСР = 141.5 Гц), 51.85 д (POCH3,
ионизационной камеры - 180°С, напряжение ио-
2JСР = 5.3 Гц ), 52.18 д (POCH3, 2JСР = 5.9 Гц), 52.58
низации - 70 и 100 эВ). Температуры плавления
д (POCH3, 2JСР = 6.7 Гц), 52.82 д (POCH3, 2JСР =
измерены на столике Кофлера (VEB Wägetechnik
6.7 Гц), 61.76 (OCH2), 62.80 (OCH2), 84.29 д (C5,
Rapido, PHMK 81/2969).
3JСP = 6.1 Гц), 104.23 д (=СНР, 1JСP = 196.3 Гц),
Рентгеноструктурный анализ выполнен на
114.45 д. д (C4, 2JСP = 13.6, 3JСP = 22.3 Гц), 111.14
дифрактометрах Bruker APEX II CCD и SuperNova.
(NH-Ph-Br), 117.26 (α-Ph-NH), 127.26 (α-Ph-N),
Кристаллы дигидропиррола
2г моноклинные,
131.87 (β-Ph-N), 131.79 (β-Ph-NH), 120.23 (N-Ph-
C32H42N2O10P2Cl2, размер
кристалла
0.30×
Br), 138.94 (N-ipsо), 144.27 д (C2, 3JСP = 8.8 Гц),
0.16×0.08 мм3; параметры элементарной ячейки:
141.68 (NH-ipsо), 144.69 д (C2, 3JСP = 8.8 Гц), 160.01
a = 11.9928(2) Å, b = 13.9791(3) Å, c = 21.1491(4) Å,
д (C3, 2JСP = 4.3, 3JСP = 5.6 Гц), 161.46 д. д (CO, 5JСP =
β = 97.9184(19) °, V = 3511.79(12) Å3, простран-
2.6, 4JСP = 2.4 Гц), 165.973 д. д (CO, 5JСP = 2.6 Гц).
ственная группа P21/n, Z = 4, dвыч = 1.414 мг/м3.
Спектр ЯМР 31P, δP, м. д.: 18.91 д (5JРP = 2.1 Гц),
Значения R-фактора 0.0273, Rw = 0.0368 [8042 от-
27.55 д (5JРP = 2.1 Гц). Масс-спектр, m/z: 802.9948
ражений с I > 2σ(I)].
[M + Na]+ (вычислено для C28H34Br2N2NaO10P2:
802.9933.
Общая методика синтеза дифосфонилиро-
ванных 2,3-дигидро-1Н-пирролов 2а-г. К рас-
Z-2,5-Диэтил-1-(4-метилфенил)-2-[(4-метил-
твору аминомалоната в абсолютном ТГФ (или в
фенил)амино]-4-[(диэтоксифосфорил)метил]-
метиловом спирте) при интенсивном перемеши-
3-[(диэтоксифосфорил)метилиден]-2,3-дигид-
вании при комнатной температуре добавляли 1.0-
ро-1H-пиррол]-2,5-дикарбоксилат
(2б). Выход
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 9 2019
РЕАКЦИИ 2-ФОСФОНЭТИНИЛИРОВАННЫХ 2-(АРИЛАМИНО)МАЛОНАТОВ
1357
65% (75% по данным ЯМР31Р), желтое вязкое мас-
22.6 Гц), 3.69 м (2H, POCH2, 3JHH = 7.0, 3JHP =
ло. Спектр ЯМР 1H, δ, м. д.: 0.91 т (3H, CH3, 3JHH =
7.1, 2JНН = 14.3 Гц), 3.93 м (2H, POCH2, 3JHH =
7.2 Гц), 0.95 т (3H, CH3, 3JHH = 7.2 Гц), 1.09 т (3H,
7.0, 3JHP = 7.1, 2JНН = 14.3 Гц), 4.06 м (2H, POCH2,
CH3, 3JHH = 7.2 Гц), 1.26 т (3H, CH3, 3JHH = 7.2 Гц),
3JHH = 7.0, 3JHP = 7.1, 2JНН = 14.3 Гц), 4.07 м (2H,
1.27 т (3H, CH3, 3JHH = 7.2 Гц), 1.29 т (3H, CH3, 3JHH =
POCH2, 3JHH = 7.0, 3JHP = 7.1, 2JНН = 14.3 Гц), 4.09
7.2 Гц), 2.23 с (3H, CH3-Ph,), 2.27 c (3H, CH3-Ph),
м (2H, OCH2, 3JHH = 7.2, 2JНН = 14.7 Гц), 4.15 м
2.97 д. д (2H, PCH2, 2JHH = 15.4, 2JHP = 20.7 Гц), 3.57
(2H, OCH2, 3JHH = 7.2, 2JНН = 14.7 Гц), 5.59 д (1H,
д. д (2H, PCH2, 2JHH = 15.4, 2JHP = 22.4 Гц), 3.69 м
=CHР, 2JHР = 8.0 Гц), 6.19 с (1H, NH), 6.68 д (2H,
(2H, POCH2, 3JHH = 7.0, 3JHP = 7.1, 2JHH = 14.2 Гц),
α-Ph-NH, 3JHН = 8.7 Гц), 6.91 д (2H, α-Ph-N, 3JHН =
3.93 м (2H, POCH2, 3JHH = 7.0, 3JHP = 7.1, 2JHH =
8.6 Гц), 7.12 д (2H, β-Ph-NH, 3JHН = 8.7 Гц), 7.20 д
14.2 Гц), 4.06 м (2H, POCH2, 3JHH = 7.0, 3JHP =
(2H, β-Ph-N, 3JHН = 8.6 Гц). Спектр ЯМР 13C, δC,
7.1, 2JHH = 14.2 Гц), 4.07 м (2H, POCH2, 3JHH = 7.0,
м. д.: 13.59 (CH3), 13.89 (CH3), 15.98 д (CH3, 3JСР =
3JHP = 7.1, 2JHH = 14.2 Гц), 4.09 м (2H, OCH2, 3JHH =
7.3 Гц), 16.29 д (CH3, 3JСР = 6.6 Гц), 16.31 д (CH3,
7.2 Гц), 4.15 м (2H, OCH2, 3JHH = 7.2 Гц), 5.53 д
3JСР = 6.6 Гц), 16.37 д (CH3, 3JСР = 5.9 Гц), 22.19
(1H, =CHР, 2JHР = 8.0 Гц), 6.03 с (1Н, NH), 6.65 д
д (PCH2, 1JСР = 141.5 Гц), 61.45 д (OCH2, 2JСР =
(2H, α-Ph-NH, 3JHН = 8.0 Гц), 6.96 д (2H, α-Ph-N,
4.9 Гц), 61.59 д (OCH2, 2JСР = 4.9 Гц), 61.61 (OCH2),
3JHН = 8.0 Гц), 6.98 д (2H, β-Ph-NH, 3JHН = 8.0 Гц),
61.97 д (OCH2, 2JСР = 5.2 Гц), 62.03 д (OCH2,
7.00 д (2H, β-Ph-N, 3JHН = 8.0 Гц). Спектр ЯМР 13C,
2JСР = 5.2 Гц), 62.58 (OCH2), 84.52 д (C5, 3JСP =
δC, м. д.: 13.49 (CH3), 13.86 (CH3), 15.90 д (CH3,
6.6 Гц), 105.72 д. д (=СНР, 1JСP = 196.1, 4JСP = 2.4 Гц),
3JСР = 7.1 Гц), 16.27 д (CH3, 3JСР = 6.2 Гц), 16.29 д
114.85 д (C4, 2JСP = 13.9, 3JСP = 22.5 Гц), 116.83
(CH3, 3JСР = 6.8 Гц), 16.35 д (CH3, 3JСР = 6.7 Гц),
(α-Ph-NH), 123.81 (NH-Ph-Cl), 126.98 (β-Ph-NH),
22.17 д (PCH2, 1JСР = 142.2 Гц), 61.22 д (OCH2, 2JСР =
128.81 (α-Ph-N), 128.81 (β-Ph-N), 132.19 (N-Ph-Cl),
5.2 Гц ), 61.33 (OCH2), 61.59 д (OCH2, 2JСР = 5.5 Гц),
138.69 (PhN-ipsо), 141.61 (PhNH-ipsо), 144.27 д
61.95 д (OCH2, 2JСР = 5.7 Гц), 61.99 д (OCH2, 2JСР =
(C2, 3JСP = 8.8 Гц), 160.01 д (C3, 2JСP = 4.3, 3JСP =
6.5 Гц), 62.28 (OCH2), 84.79 д (C4, 3JСP = 6.3 Гц),
5.6 Гц), 161.57 д (CO, 4JСP = 2.2, 5JСP = 2.7 Гц),
104.01 д (=СНР, 1JСP = 195.7 Гц), 112.81 д. д (C3,
165.94 д (CO, 4JСP = 3.6 Гц). Спектр ЯМР 31P, δP,
2JСP = 13.7, 3JСP = 22.1 Гц), 115.64 (α-Ph-NH),
м. д.: 16.35 д (5JРP = 2.1 Гц), 24.91 д (5JРP = 2.1 Гц).
125.89 (α-Ph-N), 129.23 (β-Ph-N), 129.38 (β-Ph-NH),
Масс-спектр, m/z: 769.1591 [M + Na]+ (вычислено
127.00 (NH-Ph-CH3), 136.30 (N-Ph-CH3), 137.38
для C32H42Cl2N2NaO10P2: 769.1584).
(PhN-ipsо), 140.64 (PhNH-ipsо), 145.37 д (C2, 3JСP =
Общая методика синтеза фосфонилирован-
8.8 Гц), 161.17 д. д (C3, 2JСP = 3.9, 3JСP = 5.7 Гц),
ных азадиенов (E,Z)-3а-г. К раствору аминома-
161.95 д (CO, 4JСP = 2.3, 5JСP = 2.7 Гц), 166.26 д
лоната 1а-г в абсолютном изопропиловом спирте
(CO, 4JСP = 3.3 Гц). Спектр ЯМР 31P, δP, м. д.: 17.18
при интенсивном перемешивании при комнатной
д (5JРP = 2.4 Гц), 25.27 д (5JРP = 2.4 Гц).
температуре добавляли 2-3 экв. ацетата калия.
Z-2,5-Диэтил-1-(4-хлорфенил)-2-[(4-хлор-
Контроль за ходом реакции осуществляли мето-
фенил)амино]-4-[(диэтоксифосфорил)ме-
дом ЯМР 31P. Полная конверсия достигалась через
тил]-3-[(диэтоксифосфорил)метилиден]-2,3-ди-
3 ч. После удаления растворителя вязкий оста-
гидро-1H-пиррол-2,5-дикарбоксилат (2г). Выход
ток очищали колоночной хроматографией (элю-
35% (83% по данным ЯМР 31Р), светло-желтые
ент - петролейный эфир-этилацетат, 5:1). В слу-
кристаллы, т. пл. 119-120°С (гексан-Et2O, 2:1). ИК
чае азадиена 3г были выделены индивидуальные
спектр, ν, см-1: 762, 841, 884, 961, 1031,1041, 1061,
E- и Z-изомеры, кроме этого индивидуальными
1260, 1343, 1490, 1505, 1718, 1746, 2988, 3390.
получены Е-3б и Z-3в азодиены. Остальные
Спектр ЯМР 1H, δ, м. д.: 0.99 т (3H, CH3, 3JHH = 7.2
азодиены разделить хроматографией не удалось,
Гц), 1.03 т (3H, CH3, 3JHH = 7.2 Гц), 1.10 т (3H, CH3,
их ЯМР спектры описаны в тексте статьи
3JHH = 7.2 Гц), 1.25 т (3H, CH3, 3JHH = 7.2 Гц), 1.26
Этиловый эфир (3E)-2-[(4-метилфенил)ими-
т (3H, CH3, 3JHH = 7.2 Гц), 1.28 т (3H, CH3, 3JHH =
но]-4-(диэтилфосфорил)бут-3-еновой кислоты
7.2 Гц), 2.95 д. д (2H, PCH2, 2JHH = 15.4, 2JHP =
(3б). Спектр ЯМР 1H, δ, м. д.: 1.33 т (6H, CH3, 3JHH =
20.9 Гц), 3.61 д. д (2H, PCH2, 2JHH = 15.4, 2JHP =
7.0 Гц), 1.37 т (6H, CH3, 3JHH = 7.0 Гц), 2.33 c (CH3-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 9 2019
1358
EГОРОВА и др.
Ph), 4.10 д. к (4H, POCH2, 3JHH = 7.0, 3JHP = 7.9 Гц),
6.49 д. д (1H, C1, 3JHH = 17.7, 2JHP = 16.4 Гц), 7.20
4.16 к (1H, OCH2, 2JHH = 7.0 Гц), 4.43 к (1H, OCH2,
д. д (1H, C2, 3JHH = 17.7, 3JHP = 21.6 Гц), 6.84 д (2H,
2JHH = 7.0 Гц), 6.45 д. д (1H, C1, 3JHH = 17.8,
β-Ph, 3JHН = 8.5 Гц), 7.30 д (2H, α-Ph, 3JHН = 8.5 Гц).
2JHP = 17.7 Гц), 6.95 д. д (1H, C2, 3JHH = 17.8 Гц,
Спектр ЯМР 13C, δC, м. д.: 13.74 (CH3), 16.39 д
3JHP = 23.4 Гц), 7.43 д (2H, β-Ph, 3JHН = 8.2 Гц), 7.16
(CH3, 3JСР = 6.0 Гц), 62.01 (OCH2), 62.54 д (OCH2,
д (2H, α-Ph, 3JHН = 8.2 Гц). Спектр ЯМР 13C, δC,
2JСР = 6.1 Гц), 120.74 (α-Ph), 128.05 д (C1, 1JСP =
м. д.: 14.18 (CH3), 16.38 д (CH3, 3JСР = 6.6 Гц), 26.39
182.3 Гц), 128.90 (β-Ph), 131.40 (Ph-Cl), 142.60 д
(CH3-Ph), 61.74 (OCH2), 62.45 д (OCH2, 2JСР =
(C2, 2JСP = 6.6 Гц), 146.60 (Ph-N), 158.94 д (C=N,
5.7 Гц), 119.54 (α-Ph), 127.04 д (C1, 1JСP = 187.2 Гц),
3JСP = 28.2 Гц), 162.95 (CO). Спектр ЯМР 31P: δP
129.45 (β-Ph), 135.89 (Ph-CH3), 143.09 д (C2, 2JСP =
15.12 м. д.
6.4 Гц), 146.70 (Ph-N), 157.99 д (C=N, 3JСP = 27.8 Гц),
163.59 (CO). Спектр ЯМР 31P: δP 15.51 м. д.
ФОНДОВАЯ ПОДДЕРЖКА
Этиловый эфир
(3Z)-2-[(4-метоксифенил)-
Работа выполнена при финансовой поддержке
имино]-4-(диэтилфосфорил)бут-3-еновой кис-
Российского фонда фундаментальных исследова-
лоты (3в). Спектр ЯМР 1H, δ, м. д.: 1.29 т (6H,
ний (грант № 19-03-00365) в рамках базовой части
CH3, 3JHH = 7.0 Гц), 1.35 т (3H, CH3, 3JHH = 7.0 Гц),
государственного задания Министерства образо-
4.04 д. к (4H, POCH2, 3JHH = 7.0, 3JHP = 8.5 Гц),
вания и науки РФ (№ 4.5554.2017/8.9) с исполь-
4.32 к (2H, OCH2, 2JHH = 7.0 Гц), 6.01 д. д (1H, C1,
3JHH = 14.4, 2JHP = 15.8 Гц), 6.56 д. д (1H, C2, 3JHH =
зованием оборудования Инжиниригового центра
14.4, 3JHP = 48.9 Гц), 6.79 д (2H, β-Ph, 3JHН =
Санкт-Петербургского государственного техноло-
8.5 Гц), 6.91 д (2H, α-Ph, 3JHН = 8.5 Гц). Спектр
гического института.
ЯМР 13C, δC, м. д.: 14.06 (CH3), 16.27 д (CH3, 3JСР =
КОНФЛИКТ ИНТЕРЕСОВ
6.1 Гц), 55.33 (OCH3), 62.16 д (OCH2, 2JСР =
5.8 Гц), 62.22 (OCH2), 113.88 (β-Ph), 123.40 (α-Ph),
Авторы заявляют об отсутствии конфликта
125.01 д (C1, 1JСP = 185.0 Гц), 140.46 (C2), 140.56
интересов.
(Ph-N), 156.10 д (C=N, 3JСP = 7.4 Гц), 158.32 (Ph-
OCH3), 164.09 (CO). Спектр ЯМР 31P: δP 13.57 м. д.
СПИСОК ЛИТЕРАТУРЫ
Этиловый эфир (3Z)- 2-[(4-хлорфенил)ими-
1. Петров А.А., Догадина А.В., Ионин Б.И., Ионин Б.И.,
но]-4-(диэтилфосфорил)бут-3-еновой кислоты
Гарибина В.А., Леонов А.А. // Усп. хим. 1983. Т. 52.
(3г). Спектр ЯМР 1H, δ, м. д.: 1.29 т (6H, CH3, 3JHH =
С. 1793.
7.1 Гц), 1.38 т (3H, CH3, 3JHH = 7.2 Гц), 4.07 д. к
(4H, POCH2, 3JHH = 7.1, 3JHP = 8.0 Гц), 4.38 к (2H,
2. Гарибина В.А., Леонов А.А., Догадина А.В., Ионин Б.И.,
OCH2, 3JHH = 7.2 Гц), 6.01 д. д (1H, C1, 3JHH = 14.1,
Петров А.А. // ЖОХ. 1987. Т. 57. Вып. 7. С. 1481.
2JHP = 15.8 Гц), 6.51 д. д (1H, C2, 3JHH = 14.1, 3JHP =
3. Erkhitueva E., Panikorovskii T., Svintsitskaya N.,
48.6 Гц), 6.83 д (2H, β-Ph, 3JHН = 8.6 Гц), 7.25 д
Trifonov R., Dogadina А. // Synlett. 2018. Vol. 29.
(2H, α-Ph, 3JHН = 8.5 Гц). Спектр ЯМР 13C, δC,
P. 933. doi 10.1055/s-0036-1591919
м. д.: 14.06 (CH3), 16.31 д (CH3, 3JСР = 6.0 Гц),
4. Svintsitskaya N.I., Dogadina A.V. Trifonov R.E. //
62.29 д (OCH2, 2JСР = 5.7 Гц), 62.46 (OCH2), 121.69
Synlett. 2016. Vol. 27. P. 241. doi 10.1055/s-0035-
(α-Ph), 125.84 д (C1, 1JСP = 183.9 Гц), 128.90 (β-Ph),
1560505
131.31 (Ph-Cl), 139.81 (C2), 146.61 (Ph-N), 158.47 д
5. Ляменкова Д.В., Викторов Н.Б., Поняев А.И., До-
(C=N, 3JСP = 7.7 Гц), 163.55 (CO). Спектр ЯМР 31P:
гадина А.В. // ЖОХ. 2014. Т. 84. Вып. 12. С. 2054;
δP 13.04 м. д.
Lyamenkova D.V., Viktorov N.B., Ponyaev A.I.,
Этиловый эфир (3E)-2-[(4-хлорфенил)ими-
Dogadina A.V. // Russ. J. Gen. Chem. 2014. Vol. 84.
но)]-4-(диэтилфосфорил)бут-3-еновой кислоты
N 12. P. 2524. doi 10.1134/S1070363214120342
(3г). Спектр ЯМР 1H, δ, м. д.: 1.30 т (6H, CH3, 3JHH =
7.0 Гц), 1.38 т (3H, CH3, 3JHH = 7.0 Гц), 4.13 к (1H,
6. Erkhitueva E.B., Dogadina A.V., Khramchikhin A.V.,
OCH2, 3JHH = 7.0 Гц), 4.18 д. к (4H, POCH2, 3JHH =
Ionin B.I.// Tetrahedron Lett. 2012. Vol. 53. N 33.
7.1, 3JHP = 7.9 Гц), 4.45 к (1H, OCH2, 3JHH = 7.0 Гц),
P. 4304. doi 10.1016/j.tetlet.2012.05.157.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 9 2019
РЕАКЦИИ 2-ФОСФОНЭТИНИЛИРОВАННЫХ 2-(АРИЛАМИНО)МАЛОНАТОВ
1359
7. Erkhitueva E.B., Dogadina A.V., Khramchihin A.V.,
15. Egorov D.M., Piterskaya Y.L., Dogadina A.V.,
Ionin B.I. //Tetrahedron Lett. 2013. Vol. 54. N 38.
Svintsitskaya N.I. // Tetrahedron Lett. 2015. Vol. 56.
P. 5174. doi 10.1016/j.tetlet.2013.07.032.
N 12. P. 1552. doi 10.1016/j.tetlet.2015.02.027
8. Догадина А.В., Эрхитуева Е.Б., Ионин Б.И. // Изв.
16. Krylov A.S., Kaskevich K.I., Erkhitueva E.B.,
Svintsitskaya N.I., Dogadina A.V., // Tetrahedron
АН. Сер. хим. 2014. № 3. С. 716; Dogadina A.V.,
Lett. 2018. Vol. 59. N 49. P. 4326. doi 10.1016/j.
Erkhitueva E.B., Ionin B.I. // Russ. Chem. Bull. 2014.
tetlet.2018.10.052
N 3. P. 716. doi 10.1007/s11172-014-0497-7
17. Gotsko M.D., Sobenina L.N., Tomilin D.N., Ushakov I.A.,
9. Догадина А.В., Свинцицкая Н.И. // ЖОХ. 2015.
Dogadina A.V., Trofimov B.A. // Tetrahedron Lett. 2015.
Т. 85. Вып. 2. С. 177; Dogadina A.V., Svintsitskaya N.I. //
Vol. 56. N 32. P. 4657. doi 10.1016/j.tetlet.2015.06.043
Russ. J. Gen. Chem. 2015. Vol. 85. N 2. P. 351. doi
18. Егорова А.В., Викторов Н.Б., Ляменкова Д.В.,
10.1134/S1070363215020012
Свинцицкая Н.И., Гарабаджиу А.В., Догади-
10. Храмчихин В.А., Догадина А.В., Храмчихин А.В.,
на А.В. // ЖОХ. 2016. Т. 86. Вып. 11. С. 1803; Egoro-
Ионин Б.И. // ЖОХ. 2012. Т. 82. Вып. 4. С. 694;
va A.V., Viktorov N.B., Lyamenkova D.V., Svintsits-
Khramchikhin V.A., Dogadina A.V., Khramchikhin A.V.,
kaya N.I., Garabadziu A.V., Dogadina A.V. // Russ. J.
Ionin B.I. // Russ. J. Gen. Chem. 2012. Vol. 82. N 4.
Gen. Chem. 2016. Vol. 86. N 11. P. 2446. doi 10.1134/
P. 776. doi 10.1134/S1070363212040299
S1070428017080097
11. Егоров Д.М., Питерская Ю.Л., Догадина А.В. //
19. Egorova A.V., Viktorov N.B., Starova G.L., Svintsits-
ЖОХ. 2015. Т. 85. Вып. 2. С. 333; Egorov D.M.,
kaya N.I., Garabadziu A.V., Dogadina A.V. //
Piterskaya Yu.L., Dogadina A.V. // Russ. J. Gen.
Tetrahedron Lett. 2017. Vol. 58. N 30. P. 2997. doi
Chem. 2015. Vol. 85. N 2. P. 502. doi 10.1134/
10.1016/j.tetlet.2017.06.062
S1070363215020255
20. Eгоровa А.В., Свинцицкая Н.И., Догадина А.В. //
ЖОХ. 2018. Т. 88. № 11. C. 1796. doi 10.1134/
12. Егоров Д.М., Питерская Ю.Л., Миронов В.Ф., Дога-
S0044460X1809010X; Egorova A.V., Svintsitskaya N.I.,
дина А.В. // ЖОХ. 2015. Т. 85. Вып. 9. С. 1564; Ego-
Dogadina A.V. // Russ. J. Gen. Chem. 2018. Vol. 88. N
rov D.M., Piterskaya Yu.L., Mironov V.F., Dogadina A.V. //
11. P. 2276. doi 10.1134/S1070363218110063
Russ. J. Gen. Chem. 2015. 2015. Vol. 85. N 9. P. 2203.
21. Завьялов К.В., Новиков М.С., Хлебников А.Ф., Ро-
doi 10.1134/S1070363215090273
стовский Н.В., Старова Г.Л. // ЖОрХ. 2017.
13. Егоров Д.М., Питерская Ю.Л., Эрхитуева Е.Б.,
Т. 53. Вып. 8. С. 1199; Zavyalov K.V., Novikov M.S.,
Свинцицкая Н.И., Догадина А.В. // ЖОХ. 2017.
Khlebnikov А.F., Rostovskii N.V., Starova G.L. // Russ.
Т. 87. Вып. 9. С. 1440; Egorov D.M., Piterskaya Yu.L.,
J. Org. Chem. 2017. Vol. 53. N 8. P. 1214. doi 10.1134/
Erkhitueva E.B., Svintsitskaya N.I., Dogadina A.V. //
S1070428017080097
Russ. J. Gen. Chem. 2017. Vol. 87. N 9. P. 1924. doi
22. Novikov M.S., Smetanin I.A., Khlebnikov A.V., Rostov-
10.1134/S1070363217090067
skii N.V., Yufit D.S. // Tetrahedron Lett. 2012. Vol. 53.
14. Егоров Д.М., Питерская Ю.Л., Карцев Д.Д., По-
N 43. P. 5777. doi 10.1016/j.tetlet.2012.08.063
лукеев В.А., Кривчун М.Н., Догадина А.В. //
23. Smetanin I.A., Novikov M.S., Rostovskii N.V., Khlebni-
ЖОХ. 2018. Т. 88. Вып. 9. C. 1478. doi 10.1134/
kov A.V., Starova G.L., Yufit D.S. // Tetrahedron. 2015.
S0044460X1809010X; Egorov D.M., Piterskaya Yu.L.,
Vol. 71. N 28. P. 4616. doi 10.1016/j.tet.2015.05.022
Kartsev D.D., Polukeev V.A., Krivchun M.N., Dogadi-
24. Khlebnikov A.V., Novikov M.S., Rostovskii N.V. //
na A.V. // Russ. J. Gen. Chem. 2018. Vol. 88. N 9.
Tetrahedron. 2019. Vol. 75. N 18. P. 2555. doi 10.1016/j.
P. 1824. doi 10.1134/S1070363218090104
tet.2019.03.040
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 9 2019
1360
EГОРОВА и др.
Reactions of 2-Phosphonylethynylated 2-(Arylamino)malonates
with Some Bases
A. V. Egorovaa, b, N. B. Viktorova, G. L. Starovac, and A. V. Dogadinaa, *
a St. Petersburg State Institute of Technology (Technical University), Moskovskii pr. 26, St. Petersburg, 190013 Russia
*e-mail: dog_alla@mail.ru
b Scientific Research Center for Environmental Safety of the Russian Academy of Sciences, St. Petersburg, Russia
c St. Petersburg State University, St. Petersburg, Russia
Received May 15, 2019; revised May 15, 2019; accepted May 21, 2019
The reaction of dialkyl 2-[(dialkoxyphosphoryl)ethynyl]-2-(arylamino)malonates with bases (СН3СООK,
t-ВuOK) can serve as a method for preparing original diphosphonylated 2,3-dihydro-1Н-pyrroles and 4-phos-
phonylated 1-azabuta-1,3-dienes. A probable scheme for the formation of the obtained new compounds is
proposed.
Keywords: chloroethynylphosphonates, aminomalonates, phosphonylation
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 9 2019