ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2019, том 89, № 9, с. 1361-1366
УДК 547.979.733
ПЕРЕЭТЕРИФИКАЦИЯ СЛОЖНОЭФИРНОЙ ГРУППЫ
ЭКЗОЦИКЛА МЕТИЛФЕОФОРБИДА a
© 2019 г. Л. А. Тулаеваa, *, Н. В. Гилеваa, Д. В. Белыхb
a Сыктывкарский государственный университет имени П. Сорокина,
Октябрьский пр. 55, Сыктывкар, 167001 Россия
*e-mail: tulaeva65@mail.ru
b Институт химии Федерального исследовательского центра «Коми научный центр Уральского отделения
Российской академии наук», Сыктывкар, Россия
Поступило в Редакцию 14 февраля 2019 г.
После доработки 14 февраля 2019 г.
Принято к печати 22 февраля 2019 г.
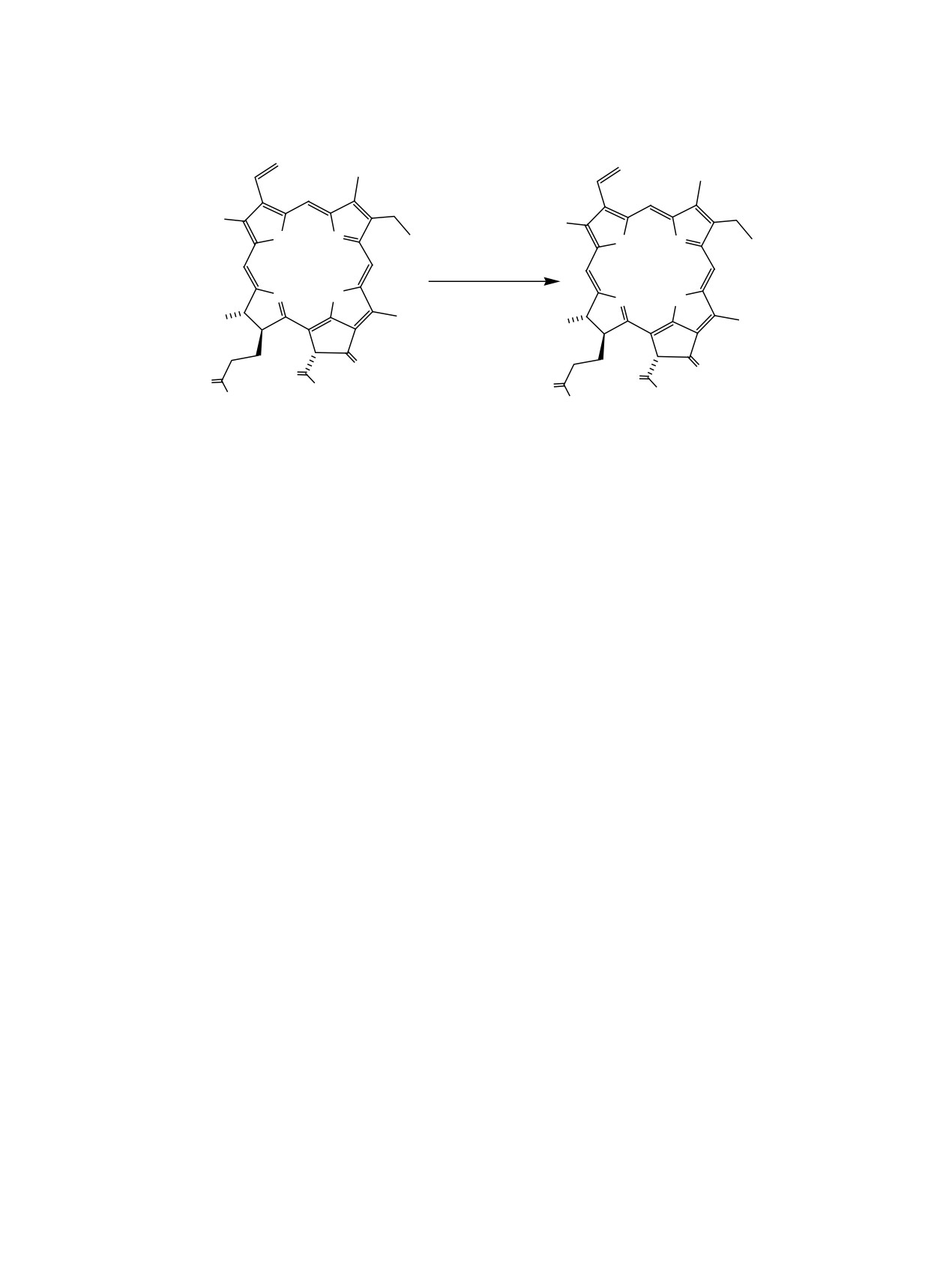
Исследовано взаимодействие метилфеофорбида а с различными спиртами в толуоле в присутствии
диметиламинопиридина в качестве основания. В указанных условиях протекает хемоселективная
переэтерификация сложноэфирной группы экзоцикла без использования активирующего агента (N-ме-
тил-2-хлорпиридинийиодид) или катализатора (молекулярный иод).
Ключевые слова: переэтерификация, метилфеофорбид а, енолизация, экзоцикл, хлорофилл a
DOI: 10.1134/S0044460X19090075
Изучение химических свойств хлорофилла а и
на то, что этот активирующий агент обычно при-
его производных, а так же разработка новых ме-
меняют для синтеза сложных эфиров из карбоно-
тодов химической модификации этих соединений
вых кислот, взаимодействия СМPI со сложными
представляют интерес в связи с использованием
эфирами, судя по механизму активирующего дей-
хлоринов а-ряда в качестве исходных соединений
ствия [13], происходить не должно. Интересно
в синтезе соединений, применяемых в различ-
также, что переэтерификация происходит хемосе-
ных областях медицины [1–4]. Метилфеофорбид
лективно. Авторы [12] не приводят никаких объ-
а является одним из наиболее доступных и удоб-
яснений относительно возможного механизма пе-
ных производных хлорофилла а, используемых
реэтерификации. По всей видимости, в этом слу-
в синтезе макрогетероциклических соединений.
чае происходит гидролиз сложноэфирной группы
Формирование сложноэфирной связи является од-
экзоцикла метилфеофорбида а 1 следовыми ко-
ним из наиболее распространенных способов вне-
личествами воды, содержащимися в растворите-
дрения на периферию хлоринового макроцикла
ле, с последующей этерификацей образующейся
фрагментов заданного строения, поэтому широко
карбоксильной группы при активации последней
используется при химической модификации хло-
СМPI. Реакция, описанная в работе [12], активно
ринов а-ряда, в том числе метилфеофорбида а [5].
использовалась затем для конъюгации хлориново-
Сложноэфирная группа экзоцикла метилфео-
го макроцикла с различными молекулами [5, 14-
форбида а и его аналогов имеет ряд особенностей
20]. Переэтерификация сложноэфирной группы
химического поведения, связанных с возможно-
экзоцикла может быть проведена в присутствии
стью енолизации экзоцикла [5-11]. В частности,
иода [21, 22], который может катализировать реак-
для синтеза 13(2)-эфиров метилфеофорбида а 1 с
ции переэтерификации и этерификации в качестве
успехом используют реагент Мукаяма (N-метил-2-
слабой кислоты Льюиса [23]. Катализ иодом был
хлорпиридинийиодид, СМPI) при кипячении с со-
использован для внедрения на периферию макро-
ответствующим спиртом в толуоле в присутствии
цикла карборанового фрагмента [21] и синтеза ди-
диметиламинопиридина (DMAP) [12]. Несмотря
ады со фталоцианином [22]. В обоих случаях пере-
1361
1362
ТУЛАЕВА и др.
Схема 1.
NH N
NH N
ROH, DMAP, толуол
N HN
, 1.5 ч
N HN
O
O
O
O
O
OCH3
O
OR
OCH3
OCH
3
1
25
R = СН2СН2СН3 (2), СН2Ph (3), СН
2СН2СН2СН2СН2OH (4), cyclo-С6H11 (5).
этерификация протекала хемоселективно по поло-
зуют DMAP. Нами исследовано взаимодействие
жению 13(2). Высокая реакционная способность
метилфеофорбида а 1 с различными спиртами в
сложноэфирной группы экзоцикла наблюдается не
присутствии основания в качестве катализатора
только в случае переэтерификации, но и при анало-
енолизации экзоцикла (схема 1).
гичном по механизму амидировании сложноэфир-
Взаимодействие спиртов с метилфеофорбидом
ной группы экзоцикла метилфеофорбида а 1 и его
а 1 проводили при кипячении в толуоле в присут-
аналогов [8, 9, 11, 15, 24-26]. Хемоселективное об-
ствии эквимольного количества DMAP. Для реак-
разование 13(2)-амидов метилфеофорбида а и его
ции использовали хорошо растворимые в толуоле
аналогов демонстрирует возможность реализации
спирты: пропанол, циклогексанол, бензиловый
подобных реакций в отсутствие активирующих
спирт и пентан-1,5-диол. Спирты использовали в
агентов, используя особенности экзоцикла этих
5-кратном мольном избытке. Показано, что пере-
соединений. Значительно большая реакционная
этерификация в этих условиях происходит хемо-
способность сложноэфирной группы экзоцикла по
селективно с участием сложноэфирной группы
сравнению со сложноэфирной группой заместите-
экзоцикла, как и в случае использования СМPI в
ля в положении 17 в реакциях переэтерификации,
качестве активирующего агента [12] или катали-
амидирования и им подобных связана с возможно-
за молекулярным иодом [21, 22]. Сложноэфирная
стью енолизации экзоцикла, представляющего со-
группа заместителя в положении 17 переэтерифи-
бой фрагмент метилового эфира циклической β-ке-
кации не подвергается.
токислоты, и образования внутримолекулярной
водородной связи между енольной гидроксильной
Строение соединений 2-5 доказано с привлече-
нием электронной (UV-Vis) и ЯМР спектроскопии,
и карбометоксильной группами, что способствует
нуклеофильной атаке этой сложноэфирной груп-
а также масс-спектрометрии. Положение полос
поглощения в ЭСП соединений 2-5 аналогично
пы за счет повышения положительного заряда на
атакуемом карбонильном атоме углерода [8, 9, 11,
таковому в спектрах исходного метилфеофорби-
15, 24-26]. Для реализации реакции требуется,
да 1, что свидетельствует о наличии форбинового
тем не менее, высокая температура (кипячение в
хромофора. Наличие в спектрах ЯМР 1Н соедине-
толуоле) и присутствие основания для катализа
ний 2-5 синглета при 6.3 м. д., соответствующего
енолизации. В случае амидирования сложноэфир-
протону в положении 13(2) экзоцикла, свидетель-
ной группы экзоцикла енолизацию катализирует
ствует о том, что экзоцикл не подвергается окис-
используемый в реакции амин, а при проведении
лительным превращениям или декарбоксилирова-
переэтерификации в качестве основания исполь-
нию. В масс-спектрах соединений 2-5 наблюдают-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 9 2019
ПЕРЕЭТЕРИФИКАЦИЯ СЛОЖНОЭФИРНОЙ ГРУППЫ
1363
ся пики, значения m/z которых соответствуют про-
ла протекает хемоселективно и может быть про-
тонированным молекулярным ионам и аддуктам
ведена без использования описанного в литера-
с катионом натрия продуктов переэтерификации.
туре активирующего агента (N-метил-2-хлор-
В спектрах ЯМР 1Н соединений 2-5 сохраняется
пиридинийиодид) или катализатора (молекуляр-
сигнал карбометоксильной группы заместителя
ный иод). Для успешного проведения реакции и
в положении 17, а сигнал группы 13(2)-СООСН3
получения приемлемых выходов продуктов пере-
отсутствует и вместо него в спектре проявляются
этерификации обязательным условиями являются
сигналы протонов фрагментов соответствующего
наличие основания, способствующего енолизации
спирта. Таким образом, взаимодействие метилфе-
экзоцикла метилфеофорбида а, и значительный
офорбида 1 с ранее не изученными в данной ре-
(5 раз) избыток спирта.
акции спиртами приводит к продуктам, аналогич-
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
ным описанным в литературе.
Высокая реакционная способность сложноэ-
Спектры ЯМР 1Н регистрировали на прибо-
фирной группы экзоцикла объясняется возмож-
ре Bruker AMХ-300 (300 МГц) с использованием
ностью енолизации последнего с образованием
сигналов остаточных протонов дейтерирован-
внутримолекулярной водородной связи с участи-
ного растворителя (CDCl3) в качестве стандарта.
Масс-спектры (ESI) регистрировали на приборе
ем енольноой гидроксильной и 13(2)-сложноэфир-
Thermo Finnigan LCQ Fleet. Электронные спектры
ной групп аналогично ранее описанным случаям
поглощения (ЭСП) записывали на спектрометре
[8, 9, 11-22, 24-26]. Увеличение частичного поло-
UV-1700 (PharmaSpec) SHIMADZU с диапазоном
жительного заряда на карбонильном атоме углеро-
длин волн 200-1100 нм. Съемку проводили в квар-
да сложноэфиной группы экзоцикла облегчает ну-
цевых кюветах толщиной 10 мм, образец сравне-
клеофильную атаку и, тем самым, повышает реак-
ния - хлороформ.
ционную способность этой сложноэфирной груп-
пы. Как уже отмечалось выше, основание (DMAP)
13(2)-Пропиловый эфир метилфеофорбида
а (2). К раствору 0.05 г (0.082 ммоль) метилфе-
катализирует енолизацию экзоцикла и, тем самым,
офорбида а в 20 мл толуола добавляли 0.0112 г
способствует переэтерификации сложноэфирной
(0.082 ммоль) DМАР и 0.03 мл (0.41 ммоль) про-
группы экзоцикла. Использование основания яв-
пилового спирта. Смесь кипятили в течение
ляется необходимым условием переэтерифика-
1.5 ч. За ходом реакции следили методом ТСХ
ции, поскольку в его отсутствие реакция не идет.
(элюент - CCl4-ацетон, 7:1). После окончания ре-
По всей видимости, в этом случае концентрация
акции смесь выливали в 50 мл хлороформа, про-
енола слишком мала для образования сколько-ни-
мывали разбавленной соляной кислотой (1:9) для
будь значительного количества продукта переэте-
удаления непрореагировавшего диметиламинопи-
рификации. Переэтерификация без использования
ридина, затем дистиллированной водой до ней-
активирующего агента протекает при относи-
тральной реакции промывных вод. Полученный
тельно большом (5 раз) мольном избытке спиртов
продукт после упаривания хроматографировали
(выход ≈40-50%), поэтому такой способ синтеза
на силикагеле (элюирование смесью CCl4-ацетон
13(2)-эфиров подходит только для тех спиртов, для
в соотношении от 100:1 до 20:1). Выход 0.0214 г
которых возможно большой мольный избыток не
(41%). Спектр ЯМР 1Н, δ, м. д.: 9.52 c (1Н, H10),
создает трудностей при проведении реакции или
9.37 c (1Н, H5), 8.60 c (1Н, H20), 7.99 д. д (1Н,
выделении продуктов. В противном случае лучше
H3(1), JНН = 11.0, 18.0 Гц), 6.30 д (1Н, H3(2)-транс,
использовать в качестве катализатора СМPI.
J
= 18.0 Гц), 6.19 д (1Н, H3(2)-цис, JНН = 11.0 Гц),
НН
Таким образом, изучено взаимодействие ме-
6.29 c [1Н, H13(2)], 4.23-4.57 м [4Н, Н18, Н17], 3.72
тилфеофорбида а с различными спиртами в
c [3Н, СН312(1)], 3.60 c [3Н, СН317(4)], 3.43 c [3Н,
присутствии DMAP в качестве основания в то-
СН32(1)], 3.22 c [3Н, СН37(1)], 3.67 к [2Н, СН28(2),
луоле. Установлено, что в этих условиях обра-
J
= 10.0 Гц], 2.17-2.76 м [4Н, СН217(1), СН217(2)],
НН
зуются 13(2)-эфиры метилфеофорбида а. Пере-
1.86 д [3Н, СН318(1), JНН = 7.0 Гц], 1.71 т [3Н,
этерификация сложноэфирной группы экзоцик-
СН38(2), JНН = 7.0 Гц], 0.87 т [3Н, СН2СН313(4),
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 9 2019
1364
ТУЛАЕВА и др.
JНН = 7.0 Гц], 0.96-0.82 м [2Н, СН2СН313(4)], 0.4
6.83; N 8.25; O 14.14. С40Н46N4О6. Вычислено, %:
c (NHI), -1.83 (NHIII). Масс-спектр, m/z: 635 [M +
С 70.80; Н 6.78; N 8.26; O 14.16.
H]+, 657 [M + Na]+. ЭСП (CHCl3), λmax, нм (Iотн,
13(2)-Циклогексиловый эфир метилфео-
%): 668 (43), 612 (8), 540 (7), 508 (10), 415 (100).
форбида а (5) получали аналогично из 0.056 г
Найдено, %: C 71.83; Н 6.80; N 8.88; О 12.57.
(0.092 ммоль) метилфеофорбида а и 0.05 мл
C38H43N4O5. Вычислено, %: C 71.81; Н 6.77; N
(0.46 ммоль) циклогексанола. Выход
0.0263 г
8.82; О 12.60.
(42%). Спектр ЯМР 1Н, δ, м. д.: 9.57 c (1Н, H10),
13(2)-Бензиловый эфир метилфеофорбида а
9.32 c (1Н, H5), 8.61 c (1Н, H20), 8.05 д. д [1Н, H3(1),
(3) получали аналогично из 0.05 г (0.082 ммоль)
J
= 24.0, 12.0 Гц], 6.32 д [1Н, H3(2)-транс, JНН =
НН
метилфеофорбида а и 0.04 мл (0.41 ммоль) бен-
19.0 Гц], 6.21 д [1Н, H3(2)-цис, JНН = 14.0 Гц], 6.24
зилового спирта. Выход
0.0239 г (43%). Спектр
с [1Н, H13(2)], 5.08 м [1Н, ОСН13(4)], 4.30-4.51 м
ЯМР 1Н, δ, м. д.: 9.59 c (1Н, H10), 9.38 c (1Н, H5),
(2Н, Н18, Н17), 3.73 c [3Н, СH312(1)], 3.58 c [3Н,
8.58 c (1Н, H20), 8.03 д. д [1Н, H3(1), JНН = 11.0,
СH317(4)], 3.44 c [3Н, СH32(1)], 3.27 c [3Н, СH37(1)],
18.0 Гц], 7.39 м [5Н, С6Н513(4)], 6.27 д [1Н,
3.69 к [2Н, СH28(2), JНН = 11.0 Гц], 2.17-2.74 м
H3(2)-транс, JНН = 18.0 Гц], 6.22 д [1Н, H3(2)-цис, JНН =
[4Н, СH217(1), СH217(2)], 1.84 д [3Н, СH318(1), JНН =
11.0 Гц], 6.34 c [1Н, H13(2)], 5.45 д [1Н, СН213(3),
7.0 Гц], 1.73 т [3Н, СH38(2), JНН = 8.0 Гц], 1.27 с и 0.94
JНН = 12.0 Гц], 5.37 д [1Н, СН213(3) , JНН = 13.0 Гц],
м (10Н, cyclo-С5H1013(5,6,7,8,9), 0.50 c (NHI), -1.39 c
(NHIII). Масс-спектр, m/z: 675 [M + H]+, 697 [M +
4.16-4.56 м (2Н, Н18, Н17), 3.74 c [3Н, CН312(1)),
3.55 c [3Н, СH317(4)], 3.41 c [3Н, СH32(1)], 3.27 c
Na]+. ЭСП (CHCl3), λmax, нм (Iотн, %): 668 (40),
611 (8), 539 (8), 509 (12), 415 (100). Найдено, %:
[3Н, СH37(1)], 3.68 к [2Н, СH28(2), JНН = 8.0 Гц],
С 72.98; Н 6.87; N 8.30; O 11.85. С41Н46N4О5.
2.11-2.71 м [4Н, СН217(1), СН217(2)], 1.81 д [3Н,
Вычислено, %: С 73.00; Н 6.82; N 8.31; O 11.87.
СН318(1), JНН = 7.0 Гц], 1.76 т [3Н, СН38(2), JНН =
7.0 Гц], 0.54 с (NHI), -1.68 с (NHIII). Масс-спектр,
КОНФЛИКТ ИНТЕРЕСОВ
m/z: 683 [M + H]+, 705 [M + Na]+. ЭСП (CHCl3),
Авторы заявляют об отсутствии конфликта
λmax, нм (Iотн, %): 668 (41), 612 (8), 540 (8), 508 (11),
интересов.
415 (100). Найдено, %: С 73.88; Н 6.20; N 8.20; O
11.72. С42Н42N4О5. Вычислено, %: С 73.90; Н 6.16;
СПИСОК ЛИТЕРАТУРЫ
N 8.21; O 11.73.
1. Feofanov A., Sharonov G., Grichine A., Refregier M.,
13(2)-(5'-Гидроксипентиловый) эфир метил-
Maurizot J.-C., Vigny P., Karmakova T., Pljutin-
феофорбида а (4) получали аналогично из 0.056 г
skaya A., Yakubovskaya R., Lebedeva V., Ruziyev R.,
Mironov A. // Photochem. Photobiol. 2004. Vol. 79.
(0.092 ммоль) метилфеофорбида а и 0.05 мл
P. 172. doi 10.1562/0031-8655(2004)079
(0.46 ммоль) 1,5-пентандиола. Выход
0.030 г
2. Nyman E.S., Hynninen P.H.J. // Photochem. Photobiol.
(48%). Спектр ЯМР 1Н, δ, м. д.: 9.54 c (1Н, H10),
(B).
2004. Vol.
73.
P.
1.
doi
10.1016/j.
9.40 c (1Н, H5), 8.60 c (1Н, H20), 8.01 д. д [1Н, H3(1),
jphotobiol.2003.10.002
JНН = 17.0, 11.0 Гц], 6.31 д [1Н, H3(2)-транс, JНН =
3. Рубин А.Б. Нанобиотехнологии. М.: БИНОМ. Лабо-
16.0 Гц], 6.21 д [1Н, H3(2)-цис, JНН = 11.0 Гц], 6.28
ратория знаний, 2011. 384 с.
с [1Н, H13(2)], 4.37 т [2Н, ОСН213(4), JНН = 6.0 Гц],
4. Ляпина Е.А., Ларкина Е.А., Ткачевская Е.П., Миро-
4.14-4.57 м (2Н, Н18, Н17), 3.50 т [2Н, СН2ОН13(8),
нов А.Ф., Мачнева Т.В., Осипов А.Н. // Биофизика.
JНН = 6.0 Гц], 3.72 c (3Н, СH312(1)), 3.61 c [3Н,
2010. Т. 55. № 2. С. 350; Lyapina E.A., Larkina E.A.,
СH317(4)], 3.43 c [3Н, СH32(1)], 3.25 c [3Н, СH37(1)],
Tkachevskaya E.P., Mironov A.F., Machneva T.V.,
Osipov A.N. // Biophysics. 2010. Vol. 55. P. 296. doi
2.17-2.76 м [4Н, СН217(1), СН217(2)], 1.85 д [3Н,
10.1134/S0006350910020223
СH318(1)], 1.72 т [3Н, СH38(2), JНН = 8.0 Гц], 1.69-
5. Белых Д.В. // Рос. хим. ж. 2017. T. 61. № 3. C. 69.
1.58 м (2Н СН2СН2СН213(5,6,7)) 1.57-1.37 м (4Н,
6. БелыхД.В.,ТарабукинаИ.С.,ГруздевИ.В.,КучинА.В.//
СН2СН2СН213(5,6,7)), 0.56 с (NHI), -1.42 с (NHIII).
ЖОрХ. 2009. Т. 45.
№ 3. C. 461; Belykh D.V.,
Масс-спектр, m/z: 679 [M + H]+, 701 [M + Na]+.
Tarabukina I.S., Gruzdev I.V., Kuchin A.V. // Russ. J.
ЭСП (CHCl3), λmax, нм (Iотн, %): 669 (41), 612 (9),
Org. Chem. 2009. Vol. 45. N 3. Р. 452. doi 10.1134/
540 (8), 508 (11), 415 (100). Найдено, %: С 70.78; Н
S1070428009030191
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 9 2019
ПЕРЕЭТЕРИФИКАЦИЯ СЛОЖНОЭФИРНОЙ ГРУППЫ
1365
7. Belykh D.V., Tarabukina I.S., Gruzdev I.V., Kodess M.I.,
18. Tarabukina (Khudyaeva) I.S., Startseva O.M., Patov S.A.,
Kutchin A.V. // J. Porph. Phthalocyan. 2009. Vol. 13.
Belykh D.V. // Мacroheterocycles. 2015. Vol. 8. N 2.
N 8-9. P. 949. doi 10.1142/S1088424609001133
P. 168. doi 10.6060/mhc150456b
8. Белых Д.В., Копылов Е.А., Груздев И.В., Кучин А.В. //
19. Belykh D.V., Startseva O.M., Patov S.A. // Macro-
ЖОрХ. 2010. Т. 46. № 4. C. 584; Belykh D.V., Ko-
heterocycles. 2014. Vol. 7. N 4. Р. 401. doi 10.6060/
pylov E.A., Gruzdev I.V., Kuchin A.V. // Russ. J.
mhc140500b
Org. Chem. 2010. Vol. 46. N 4. P. 577. doi 10.1134/
20. Мальшакова М.В., Фролова Л.Л., Алексеев И.Н., Ку-
S1070428010040238
чин А.В., Патов С.А., Белых Д.В. // Изв. АН. Сер.
9. Белых Д.В., Пушкарева Е.И. // ЖОХ. 2011. Т. 81.
хим. 2018. № 8. С. 1467; Mal’shakova M.V., Frolo-
№ 6. С.1023; Belykh D.V., Pushkareva E.I. // Russ. J.
va L.L., Alekseev I.N., Kutchin A.V., Patov V S.A., Be-
Org. Chem. 2011. Vol. 81. N 6. P. 1216. doi 10.1134/
lykh D.V. // Russ. Chem. Bull. 2018. Vol. 67. N 8.
S1070363211060259
P. 1467. doi 10.1007/s11172-018-2241-1
10. Белых Д.В., Буравлев Е.В., Мальшакова М.В., Паршу-
21. Ольшевская В.А., Зайцев А.В., Савченко А.Н.,
кова Н.Н., Копылов Е.А., Груздев И.В., Кучин А.В. //
Кононова Е.Г., Петровский П.В., Калинин В.Н. //
ХПС. 2011. № 1. С. 77; Belykh D.V., Buravlev E.V.,
Докл. АН. 2008. Т. 423. № 3. С. 345; Ol’shevskaya V.A.,
Malshakova M.V., Parshukova N.N., Kopylov E.A.,
Zaitsev A.V., Savchenko A.N., Kononova E.G., Petrov-
Gruzdev I.V., Kuchin A.V. // Russ. J.Chem. Nat. Com-
skii P.V., Kalinin V.N. // Doklady Chemistry. 2008.
pd. 2011. Vol. 47. N 1. P. 85. doi 10.1007/s10600-011-
Vol. 423. N 1. P. 294. doi 10.1134/S0012500808110086
9836-1
22. Balashova I.O., Pushkarev V.E., Shestov V.I., Tomi-
11. Пушкарева Е. И., Белых Д. В. // Бутлеровск. сообщ.
lova L.G., Koifman O.I., Ponomarev G.V. // Macro-
2016. Т. 48. № 12. C. 38.
heterocycles. 2015. Vol. 8. N 3. P. 233. doi 10.6060/
12. Shinoda S., Osuka A. // Tetrahedron Lett. 1996. Vol. 37.
mhc150767p
N 28. P. 4945. doi 10.1016/0040-4039(96)01075-1
23. Ramalinga K., Vijayalakshmi P., Kaimal T.N.B. //
13. Ли Дж.Дж. Именные реакции. Механизмы органи-
Tetrahedron Lett. 2002. Vol. 43. P. 879. doi 10.1016/
ческих реакций. М.: БИНОМ, 2009. 456 с.
S0040-4039(01)02235-3
14. Мальшакова М.В., Белых Д.В., Алексеевa И.Н., Ви-
24. Белых Д.В., Худяева И.С., Буравлёв Е.В., Чукиче-
тязева О.В., Кучин А.В. // Макрогетероциклы. 2013.
ва И.Ю., Шевченко О.Г., Кучин А.В. // ЖОрХ. 2017.
Т. 6. № 1. C. 62. doi 10.6060/mhc130219b
Т. 53. Вып. 4. С. 603; Belykh D.V., Khudyaeva I.S.,
15. Белых Д.В., Мальшакова М.В., Юдина Ю.А., Завад-
Buravlev E.V., Chukicheva I.Yu., Shevchenko O.G., Ku-
ская К.А., Худяев В.М., Кучин А.В. // Изв. АН. Сер.
chin A.V. // Russ. J. Org. Chem. 2017. Vol. 53. N 4.
хим. 2011. № 4. С. 705; Belykh D.V., Mal’shakova M.V.,
P. 610. doi 10.1134/S1070428017040182
Yudina Yu.A., Zavadskaya K.A., Khudyaev V.M., Ku-
25. Чукичева И.Ю., Буравлев Е.В., Белых Д.В, Худяе-
chin A.V. // Russ. Chem. Bull. 2011. Vol. 60. N 4. P. 719.
ва И.С., Федорова И.В, Шевченко О.Г., Максимо-
doi 10.1007/s11172-011-0112-0
ва М.А., Зайнуллина Л.Ф., Вахитова Ю.В., Кучин А.В. //
16. Старцева О.М., Белых Д.В., Шегера В.М., Тулае-
Изв. АН. Сер. хим. 2018. № 3. C. 548; ; Chukiche-
ва Л.А. // Бутлеровск. сообщ. 2014. Т. 38. № 6. С. 43.
va I.Y., Buravlev E.V., Belykh D.V., Khudyaeva I.S., Fe-
17. Худяева И.С., Белых Д.В., Шевченко О.Г., Максимо-
dorova I.V., Shevchenko O.G., Maximova M.A., Zainul-
ва М.А., Зайнуллина Л.Ф., Вахитова Ю.В., Щуки-
lina L.F., Vakhitova Y.V., Kutchin A.V. // Russ. Chem.
на О.В., Буравлев Е.В., Чукичева И.Ю., Кучин А.В. //
Bull. 2018. Vol. 67. N 3. P. 548. doi 10.1007/s11172-
Изв. АН. Сер. хим. 2017. № 11. С. 2157; Khudyae-
018-2109-4
va I.S., Belykh D.V., Shevchenko O.G., Maximova M.A.,
26. Белых Д.В., Мальшакова М.В., Худяев В.М., Ку-
Zainullina L.F., Vakhitova Y.V., Shchukina O.V., Burav-
чин А.В. // Докл. АН. 2011. Т. 436. № 4. С. 483;
lev E.V., Chukicheva I.Y., Kutchin A.V. // Russ. Chem.
Mal’shakova M.V., Belykh D.V., Hudyaev V.M., Ku-
Bull. 2017. Vol. 66. N 11. P. 2157. doi 10.1007/s11172-
chin A.V. // Doklady Chem. 2011. Vol. 436. Pt 2. P. 19.
017-1997-z
doi 10.1134/S0012500811020017
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 9 2019
1366
ТУЛАЕВА и др.
Transesterification of Ester Group of Methyl Pheophorbide a
Exocyclic Ring
L. A. Tulaevaa, *, N. V. Gilevaa, and D.V. Belykhb
a P. Sorokin Syktyvkar State University, Oktyabrskii pr. 55, Syktyvkar, 167001 Russia
e-mail: tulaeva65@mail.ru
b Institute of Chemistry, Federal Research Center “Komi Science Center of the Ural Branch
of the Russian Academy of Sciences”, Syktyvkar, Russia
Received February 14, 2019; revised February 14, 2019; accepted February 22, 2019
The reaction of methyl pheophorbide a with various alcohols in toluene in the presence of dimethylaminopyridine
as a base was investigated. Under these conditions, a chemoselective transesterification of the exocyclic ring
proceeds without the use of an activating agent (N-methyl-2-chloropyridinium iodide) or a catalyst (molecular
iodine).
Keywords: transesterification, methyl pheophorbide a, enolization, exocyclic ring, chlorophyll a
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 9 2019