ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2019, том 89, № 9, с. 1375-1378
УДК 539.1.044:535.683
ОТРИЦАТЕЛЬНЫЙ ФОТОХРОМИЗМ
ВОДНО-АЦЕТОНИТРИЛЬНЫХ РАСТВОРОВ
ФУНКЦИОНАЛИЗИРОВАННЫХ СПИРОПИРАНОВ
© 2019 г. Т. М. Валоваa, В. А. Барачевскийa, b, *, А. А. Хузинc, А. Р. Туктаровc
a Центр фотохимии Федерального научно-исследовательского центра «Кристаллография и фотоника»
Российской академии наук, ул. Новаторов 7а/1, Москва, 119421 Россия
*e-mail: barva@photonics.ru
b Межведомственный центр аналитических исследований при Президиуме Российской академии наук,
Москва, Россия
c Институт нефтехимии и катализа Российской академии наук, Уфа, Россия
Поступило в Редакцию 4 апреля 2019 г.
После доработки 4 апреля 2019 г.
Принято к печати 12 апреля 2019 г.
Спектрально-кинетическое исследование фотохромных функционализированных нитрозамещенных
индолиновых спиропиранов в смешанном растворителе вода-ацетонитрил показало наличие отри-
цательного фотохромизма, обусловленного самоорганизацией фотохромных молекул с образованием
водородных связей и протонных комплексов.
Ключевые слова: отрицательный фотохромизм, спектры поглощения, спиропираны, комплексы, водо-
родная связь
DOI: 10.1134/S0044460X19090099
В связи с поиском возможностей примене-
ческого исследования обратного фотохромизма
ния явления фотохромизма особое внимание об-
функционализированных индолиновых нитроза-
ращается на фотохромные системы с обратным
мещенных спиропиранов.
фотохромизмом, которые представляют интерес
Известно, что нитрозамещенные спиропираны
для создания фотохромных материалов различно-
обычно проявляют положительный фотохромизм
го назначения, в первую очередь для разработки
[6]. При этом исходная бесцветная форма А под
многофункциональной одежды и камуфляжных
действием УФ излучения претерпевает обратимую
покрытий с динамическим фотоиндуцированным
фотодиссоциацию связи С-О и последующую тем-
изменением окраски [1, 2]. В настоящей работе в
новую цис/транс-изомеризацию с образованием
развитие ранее выполненных исследований [3-5]
окрашенной мероцианиновой формы Б (схема 1).
представлены результаты спектрально-кинети-
Последняя спонтанно релаксирует в исходную
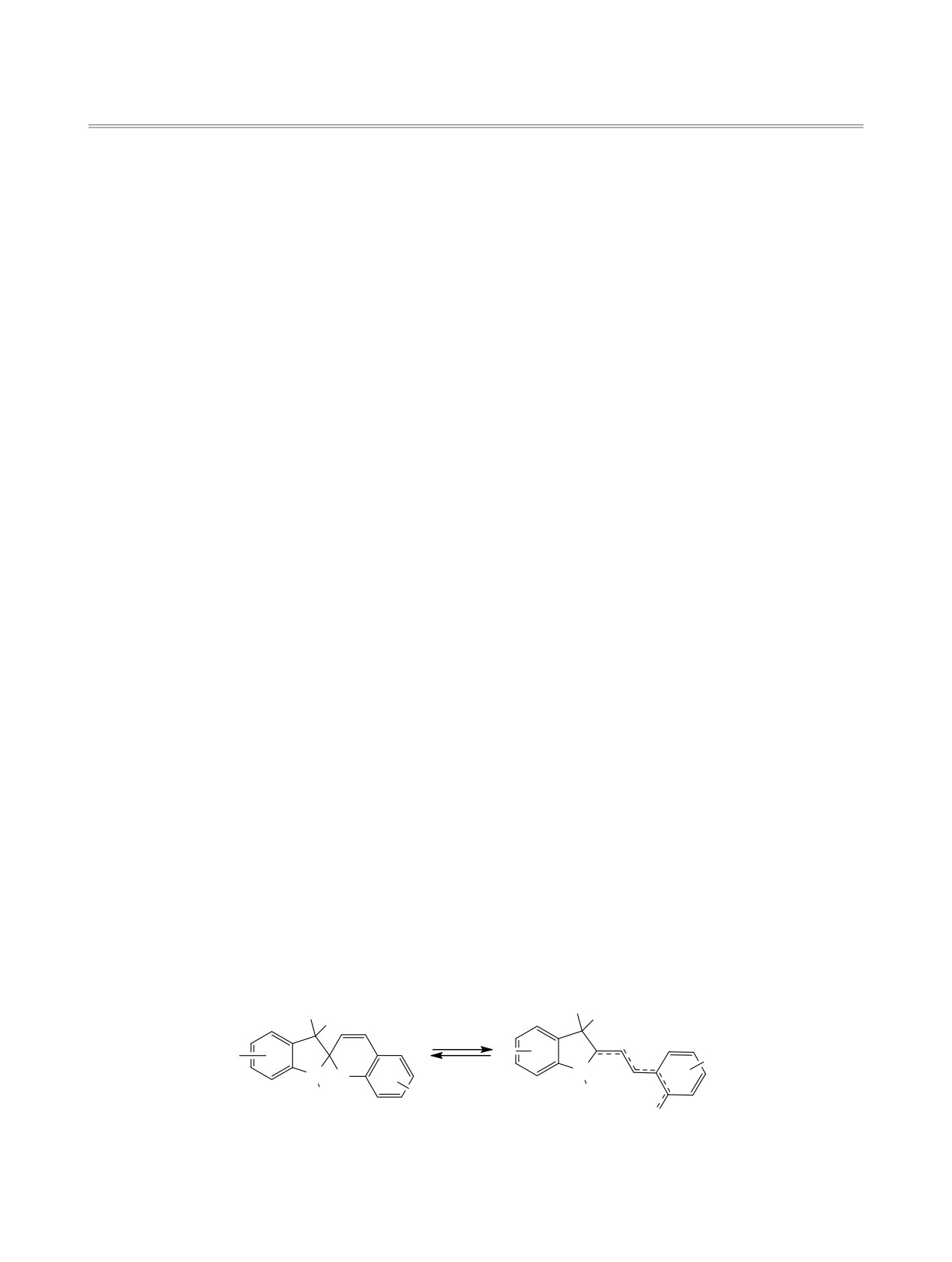
Схема 1.
R3 R4
R3 R4
hQ1
R1
R1
G
R5
hQ2
ɢɥɢ
'
N
N O
R2
R5
R2
OG
Ⱥ
Ȼ
1375
1376
ВАЛОВА и др.
Спектральные характеристики спиропиранов в раствореа
Соединение
Растворитель
λAmax, нм (DAmax)
λБmax, нм (DБmax)
Светофильтр
1
CH3CN
220 (0.48)
560 (0.68)
УФС-1
245 (0.45)
265(0.38)
300(0.18)
340(0.21)
CH3CN-H2O
220(0.32)
510 (0.00)
ЖС-10
(20 ч в темноте)
-
265(0.17)
360(0.30)
510(0.38)
2
CH3CN
220(0.53)
568(0,58)
УФС-1
240(0.52)
265(0.4)
335(0.24)
CH3CN-H2O
245(0.45)
520(0,04)
ЖС-10
(20 ч в темноте)
270(0.37)
350(0.31)
520(0.11)
а λAmax и λБmax - максимумы полос поглощения исходной А и длинноволновой фотоиндуцированной форм Б спиропиранов, со-
ответственно; DAmax и DБmax - величины оптической плотности в максимумах полос поглощения форм А и Б соответственно.
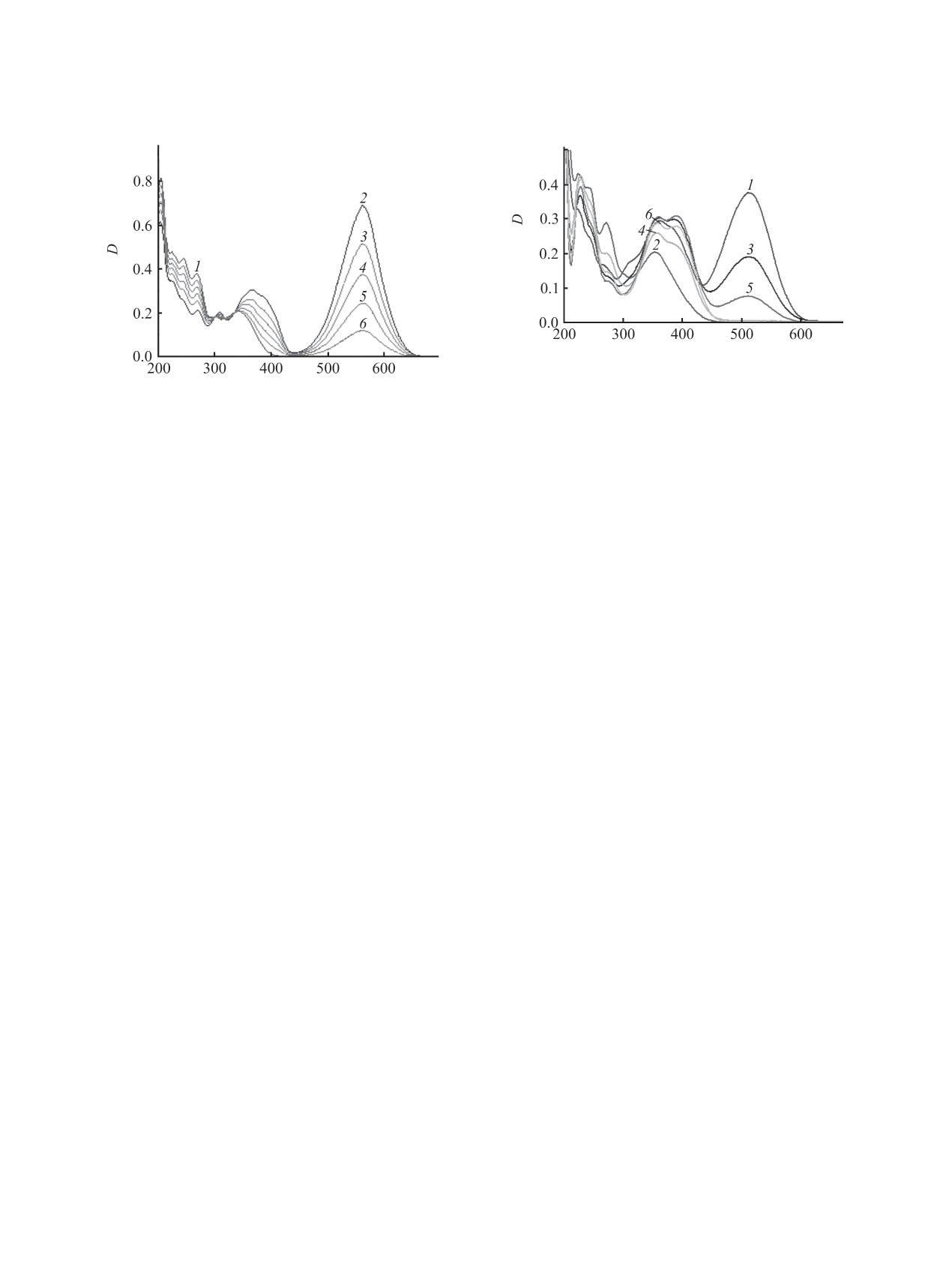
циклическую форму А. Этот процесс ускоряется
вращаясь при облучении УФ светом из цикличе-
под действием видимого излучения и при повыше-
ского бесцветного состояния (рис. 1, кривая 1) в
нии температуры.
окрашенную мероцианиновую форму (кривая 2) и
возвращаясь после выключения света в исходное
Объектами исследования служили индолино-
состояние (кривые 3-6).
вые нитрозамещенные спиропираны 1 и 2 (схема 2).
Из экспериментальных данных, представленных
Водно-ацетонитрильный раствор соединения
в таблице, видно, что соединение 1 в ацетонитри-
1 первоначально также был бесцветным, а спектр
ле проявляет положительный фотохромизм, пре-
подобен исходному спектру поглощения в ацето-
Схема 2.
H3C CH3
H3C CH3
N O
NO2
N O
NO2
O
O
OH
O
OEt
1
2
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 9 2019
ОТРИЦАТЕЛЬНЫЙ ФОТОХРОМИЗМ ВОДНО-АЦЕТОНИТРИЛЬНЫХ РАСТВОРОВ
1377
λ, нм
Рис. 2. Спектры поглощения соединения 1 в водно-а-
λ, нм
цетонитрильном растворе через 20 ч хранения в тем-
Рис. 1. Спектры поглощения соединения 1 в ацетони-
ноте (1), после облучения видимым светом через све-
триле до (1), после УФ облучения через светофильтр
тофильтр ЖС-10 (2, 4, 6) и последующей темновой
УФС-1 (2) и в процессе темновой релаксации (3-6).
релаксации через 72 (3) и 96 ч (5).
нитриле. Однако спустя 20 ч хранения в темноте
ции может быть объяснено образованием слабо
раствор окрашивался (рис. 2, кривая 1) с появле-
светочувствительных протонных комплексов.
нием полосы поглощения мероцианиновой формы
Таким образом, в результате проведенного ис-
спиропирана, сдвинутой на 50 нм в коротковолно-
следования впервые обнаружено и исследовано
вую область по сравнению с полосой поглощения
спектрально-кинетическим методом явление об-
в ацетонитриле (см. таблицу). Полученный окра-
разования фотохромных систем с отрицательным
шенный раствор проявлял обратный фотохромизм
фотохромизмом спиропиранов в водно-ацетони-
(рис. 2), однако возвращение исследуемого соеди-
трильных растворах. Выявленные особенности
нения в исходное состояние происходило в тече-
этого явления объяснены самоорганизацией фо-
ние длительного времени, достигающего десятков
тохромных молекул в смешанном растворителе с
часов (рис. 2, кривые 5, 6). В процессе чередующе-
участием водородных связей и образованием про-
гося фотообесцвечивания и темновой релаксации
тонных комплексов.
концентрация окрашенного продукта снижалась
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
(ср. кривые 1, 3, 6) с одновременным появлением
полосы поглощения с максимумом при 410 нм.
2-[3',3'-Диметил-6-нитроспиро(хромен-2,2'-
индол)-1'(3'H)-ил]этанол (1) получен по описан-
Подобные темновые и фотоиндуцированные
спектральные, но менее выраженные изменения
ной в литературе методике [7]; его спектральные
характеристики полностью соответствуют опи-
проявляет и спиропиран 2 (см. таблицу).
санным ранее.
Обращает на себя внимание тот факт, что сме-
щение равновесия от циклической формы спиро-
2-[3',3'-Диметил-6-нитроспиро(хромен-2,2'-
индол)-1'(3’Н)-ил]этил(этил)малонат
(2).
К
пирана к мероцианиновой структуре происходит
раствору спиропирана 1 (3.79 ммоль) в 30 мл без-
в процессе длительного хранения растворов в
темноте. Это, по-видимому, связано с самоорга-
водного хлористого метилена последовательно
добавляли этиловый эфир малоновой кислоты
низацией и структуризацией смешанного раство-
(3.79 ммоль), DCC (3.79 ммоль) и 4-диметилами-
ра. Гипсохромное смещение максимумов полос
поглощения может свидетельствовать об обра-
нопиридин (0.379 ммоль). Реакционную массу пе-
ремешивали при комнатной температуре в течение
зовании водородной связи между молекулами
2 ч, затем фильтровали. Растворитель упаривали,
спиропиранов и воды. Наблюдаемое снижение
остаток очищали с помощью колоночной хромато-
концентрации мероцианиновой формы и появле-
графии (петролейный эфир-этилацетат, 5:1).
ние новой полосы поглощения с максимумом при
410 нм в ходе чередующихся процессов фотообес-
Спектрально-кинетические исследования вы-
цвечивания видимым светом и темновой релакса-
полнены в ацетонитриле (Aldrich) и его сме-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 9 2019
1378
ВАЛОВА и др.
сях с бидистиллированной водой. Cпектрально-
СПИСОК ЛИТЕРАТУРЫ
кинетические характеристики растворов исследу-
1. Barachevsky V.A. // Rev. J. Chem. 2017. Vol. 7. N 3.
емых соединений получены на спектрофотометре
P. 334. doi 10.1134/S2079978017030013
Cary 60 bio (Agilent Technologies) в кварцевой
кювете с длиной оптического пути 0.2 см, концен-
2. Aiken S., Edgar R.J.L., C.D. Gabbutt C.D., Heron B.M.,
трация растворов составляла 2×10-4 М. Облучение
Hobson P.A. // Dyes and Pigments. 2018. Vol. 149.
проводили светом ксеноновой лампы L8253 осве-
P. 92. doi 10.1016/j.dyepig.2017.09.057
тителя LC-4 (Hamamatsu) с использованием для
3. Барачевский В.А., Валова Т.М., Атабекян Л.С., Лю-
УФ облучения светофильтра УФС-1, а для облу-
бимов А.В. // Химия высоких энергий. 2017. Т. 51.
чения видимым светом - светофильтров ЖС-10 и
№ 6. С. 436; Barachevsky V.A., Valova T.M., Atabe-
ЖС-11.
kyan L.S., Lubimov A.V. // High Energy Chem. 2017.
Vol. 51. N 6. P. 415. doi 10.7868/S0023119717060023
ФОНДОВАЯ ПОДДЕРЖКА
4. Барачевский В.А., Валова Т.М. // Оптика и спектр.
Работа выполнена при поддержке Министерства
2017. T. 123. № 3. C. 377; Barachevsky V.A., Valo-
науки и высшего образования в рамках госзадания
va T.M. // Opt. Spectr. 2017. Vol. 123. N 3. P. 404. doi
Федерального научно-исследовательского центра
10.1134/S0030400X17090065
«Кристаллография и фотоника» РАН (спектраль-
5. Барачевский В.А. // Матер. 12 Всерос. науч. конф.
но-кинетические исследования) и Российского
«Технология и материалы для экстремальных усло-
фонда фундаментальных исследований (проекты
вий», Москва, 2017. C. 171.
№ 18-33-20027, МК-3058.2018.3; синтез исследу-
емых соединений).
6. Photochromic Materials / Eds H. Tian, J. Zhang.
Weinheim: Wiley-VCH Verlag GmbH & Co., 2016.
КОНФЛИКТ ИНТЕРЕСОВ
421 p.
Авторы заявляют об отсутствии конфликта
7. Sakata T., Yan Y., Marriott G. // J. Org. Chem. 2005.
интересов.
Vol. 70. P. 2009. doi 10.1021/jo048207o
Negative Photochromism of Water-Acetonitrile Solutions
of Functionalized Spiropyrans
T. M. Valovaa, V. A. Barachevskya, b, *, A. A. Khuzinc, and A. R. Tuktarovc
a Photochemistry Center of the Federal Research Center “Crystallography and Photonics”
of the Russian Academy of Sciences, ul. Novatorov 7a/1, Moscow, 119421 Russia
*e-mail: barva@photonics.ru
b Interdepartmental Center for Analytical Research, the Presidium of the Russian Academy of Sciences, Moscow, Russia
c Institute of Petrochemistry and Catalysis of the Russian Academy of Sciences, Ufa, Russia
Received April 4, 2019; revised April 4, 2019; accepted April 12, 2019
A spectral-kinetic study of photochromic functionalized nitro-substituted indoline spiropyrans in a water-ace-
tonitrile mixed solvent showed the presence of negative photochromism due to the self-organization of photo-
chromic molecules with the formation of hydrogen bonds and proton complexes.
Keywords: negative photochromism, absorption spectra, spiropyrans, complexes, hydrogen bond
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 9 2019