ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2019, том 89, № 9, с. 1379-1384
УДК 544.353.3
ВЛИЯНИЕ ПРИРОДЫ ОРГАНИЧЕСКИХ
РАСТВОРИТЕЛЕЙ НА АССОЦИАЦИЮ
N-[3-(ДИМЕТИЛАМИНО)ПРОПИЛ](МЕТ)-
АКРИЛАМИДОВ1
© 2019 г. С. И. Каморинаa, А. Ю. Садиковa, b, Д. М. Каморинa, b,*, О. А. Казанцевa,
М. С. Румянцевa, М. С. Коротаевa, И. Н. Постниковаa
a Нижегородский государственный технический университет имени Р. Е. Алексеева,
ул. Минина 24, Нижний Новгород, 603950 Россия
*e-mail: d.kamorin@mail.ru
b Национальный исследовательский Нижегородский государственный университет имени
Н.И. Лобачевского, Нижний Новгород, Россия
Поступило в Редакцию 2 апреля 2019 г.
После доработки 9 июля 2019 г.
Принято к печати 12 июля 2019 г.
Методами ИК спектроскопии и компьютерного моделирования с использованием квантово-химических
расчетов на уровне B3LYP/6-31+G(d,p)/PCM изучена ассоциация N-[3-(диметиламино)пропил](мет)-
акриламидов в тетрахлорметане, тетрагидрофуране и N,N-диметилформамиде. Определено влияние
способности растворителей к образованию водородных связей на степень участия N-[3-(диметиламино)-
пропил](мет)акриламидов в водородном связывании с образованием самоассоциатов и гетероассоциатов
по типу амид-растворитель.
Ключевые слова: N-[3-(диметиламино)пропил]метакриламид, N-[3-(диметиламино)пропил]акриламид,
водородная связь, ассоциация, эффект растворителя
DOI: 10.1134/S0044460X19090105
Аминосодержащие (мет)акриламиды явля-
(диметиламино)пропил]акриламид 2, что откры-
ются перспективными исходными мономерами
вает возможности для широкого промышленного
для получения «умных» полимеров, сочетающих
применения соответствующих термо- и pH-чув-
высокую гидролитическую стабильность и нали-
ствительных полимеров.
чие термо- и pH-чувствительных свойств [1-3].
Для растворной гомо- и сополимеризации ами-
Подходящий гидрофильно-гидрофобный баланс
но- и(или) амидсодержащих (мет)акриловых мо-
и способность к образованию водородных свя-
номеров ранее были выявлены связанные с моно-
зей между мономерными звеньями макромоле-
мерной ассоциацией эффекты, которые делают эти
кул обусловливают проявление термочувстви-
процессы специфичными, не подчиняющимися
тельных свойств у многих полимеров на основе
закономерностям классической радикальной по-
амино(мет)акриламидов, а наличие аминогруппы
лимеризации [4-6]. Показано, что регулирование
обусловливает проявление pH-чувствительных
предреакционной мономерной ассоциации являет-
ся удобным инструментом для контроля кинетики
свойств. Важным аспектом является и коммер-
(со)полимеризации и степени однородности со-
ческая доступность таких мономеров, как N-[3-
става сополимеров N-[3-(диметиламино)пропил]-
(диметиламино)пропил]метакриламид 1 и N-[3-
(мет)акриламидов [4, 5]. Ранее с помощью мето-
1 К статье прилагаются дополнительные материалы.
дов ИК спектроскопии и компьютерного модели-
1379
1380
КАМОРИНА и др.
Схема 1.
O
O
H2
H2
H2
H2
H2C
C
C
CH3
H2C
C
C
CH3
C N
C
N
C
N
C
N
H
H2
H
H
H2
CH
CH3
CH3
3
1
2
рования с использованием квантово-химических
Для растворов амидов 1 и 2 в тетрахлормета-
расчетов на уровне B3LYP/6-31+G(d,p)/PCM были
не, ТГФ и ДМФА были получены ИК спектры при
определены степень ассоциации мономеров 1 и 2
различных концентрациях амидов. С увеличением
в толуоле, соотношение основных типов ассоциа-
концентрации амида 1 в растворе происходит из-
тов, образующихся при разных концентрациях мо-
менение формы сигналов, связанное с изменением
номеров, и установлена связь специфических кон-
соотношения свободных и ассоциированных мо-
центрационных эффектов при гомополимеризации
лекул амида. В случае полосы поглощения амид
N-[3-(диметиламино)пропил](мет)акриламидов с
А отчетливо наблюдаемый при низких концентра-
особенностями их ассоциации [4]. В данной ра-
циях амида сигнал в области 3460 см-1 (мономер-
боте продолжены исследования ассоциации ами-
ная форма) при переходе к более высоким концен-
носодержащих (мет)акриламидов в органических
трациям нивелируется, в то время как основной
растворителях разной природы, в которых можно
сигнал смещается в область 3380 см-1 (линейный
ожидать различного характера протекания ассоци-
ассоциат). Положение и форма сигнала амид I с
ации акриловых амидов и, как следствие, различ-
увеличением концентрации амида 1 также претер-
ной кинетики (со)полимеризации. В качестве рас-
певает заметные изменения.
творителей использованы органические вещества
Аналогичные изменения положения и формы
разной полярности с различной склонностью к об-
полос поглощения амид А и амид I наблюдаются
разованию водородных связей - тетрахлорметан,
на спектрах растворов амида 2 в тетрахлормета-
тетрагидрофуран и N,N-диметилформамид. Кроме
не: также можно видеть протекание образования
того, данные растворители хорошо растворяют как
водородных связей молекулами амида и перерас-
мономеры 1 и 2, так и полимеры на их основе в
пределение молекул амида между различными
широком интервале концентраций и часто приме-
формами.
няются для проведения радикальной полимериза-
Для определения положения полос поглощения
ции акриловых мономеров. Структурные формулы
свободного амида и его циклического и линейного
исследуемых веществ 1 и 2 представлены на схеме 1.
ассоциата, а также установления расчетных инте-
Для исследования особенностей образова-
гральных коэффициентов поглощения фрагмен-
ния водородных связей между молекулами N-[3-
тов молекул 1 и 2, соответствующих мономерным
(диметиламино)пропил](мет)акриламидов в орга-
формам и ассоциатам, было использовано ком-
нических растворителях был использован метод
пьютерное моделирование с использованием кван-
ИК спектроскопии и изучены одни из наиболее
тово-химических расчетов на уровне B3LYP/6-
информативных полос поглощения амидов: амид
31+G(d,p)/PCM. Расчетные величины (vtheor, см-1)
А (3400-3100 см-1), соответствующая валентным
и экспериментальные значения (vexp, см-1) частот
колебаниям связи N-H, и амид I (1700-1600 см-1),
поглощения мономерных и ассоциированных
отвечающая валентным колебаниям связи C=O
форм (полученные путем разделения эксперимен-
амидной группы. При образовании амидами во-
тальных пиков на составляющие компоненты), а
дородных связей в этих областях спектра в до-
также расчетные значения их интегральных коэф-
полнение к полосе поглощения свободного (не
фициентов поглощения (εicalc, км/моль) для полос
участвующего в водородном связывании) амида
поглощения амид А (А-А) и амид I (А-I) представ-
появляются полосы поглощения ассоциированных
лены в таблице. Следует отметить, что повышен-
молекул (происходит батохромный сдвиг) [6-9].
ная лабильность связей, образованных гетероато-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 9 2019
ВЛИЯНИЕ ПРИРОДЫ ОРГАНИЧЕСКИХ РАСТВОРИТЕЛЕЙ
1381
Расчетные и экспериментальные частоты поглощения и интегральные коэффициенты поглощения для амидов в раз-
личных формах в органических растворителях
Мономерная
Димерный
Линейный
форма
ассоциат
ассоциат
Область
Мономер
Растворитель
спектра
А-А
3546
3460
36
3223
3278
1895
3458
3380
404
ССl4
А-I
1627
-
105
1631
-
1064
1620
-
138
А-А
3407
-
558
3229
-
1941
3437
-
512
1
ТГФ
А-I
1658
-
51
1656
-
149
1607
-
289
А-А
3388
-
729
3233
-
1960
3424
-
604
ДМФА
А-I
1644
-
1037
1654
-
103
1600
-
404
А-А
3527
3452
36
3229
3192
1792
3401
3300
609
ССl4
А-I
1673
1680
193
1670
1668
734
1664
1659
335
А-А
3343
-
786
3239
-
1892
3370
-
770
2
ТГФ
А-I
1659
1681
145
1661
1673
620
1657
1663
241
А-А
3290
-
1076
3244
-
1928
3346
-
868
ДМФА
А-I
1656
-
55
1657
-
549
1654
-
193
мами (акцепторами водородной связи) и протоном
общей экспериментальной кривой. В случае рас-
(связи О-Н, N-H, S-H), почти всегда приводит к
творов амида 1 в тетрахлорметане (как и ранее в
более высокой погрешности при расчете колеба-
толуоле [4]) уверенное разделение полос погло-
тельных спектров соответствующих молекул в об-
щения мономерной и ассоциированных форм уда-
ласти деформационных колебаний связей О-Н и
лось выполнить для фрагмента спектра в области
N-H. Полная релаксация атомов C, N, H амидных
поглощения полосы амид А. Зависимости содер-
групп в ходе расчетов частот колебаний методами
жания свободного амида, циклического димера
DFT может приводить как к переоценке, так и к не-
и линейного ассоциата от концентрации амида
дооценке энергии водородного связывания в соот-
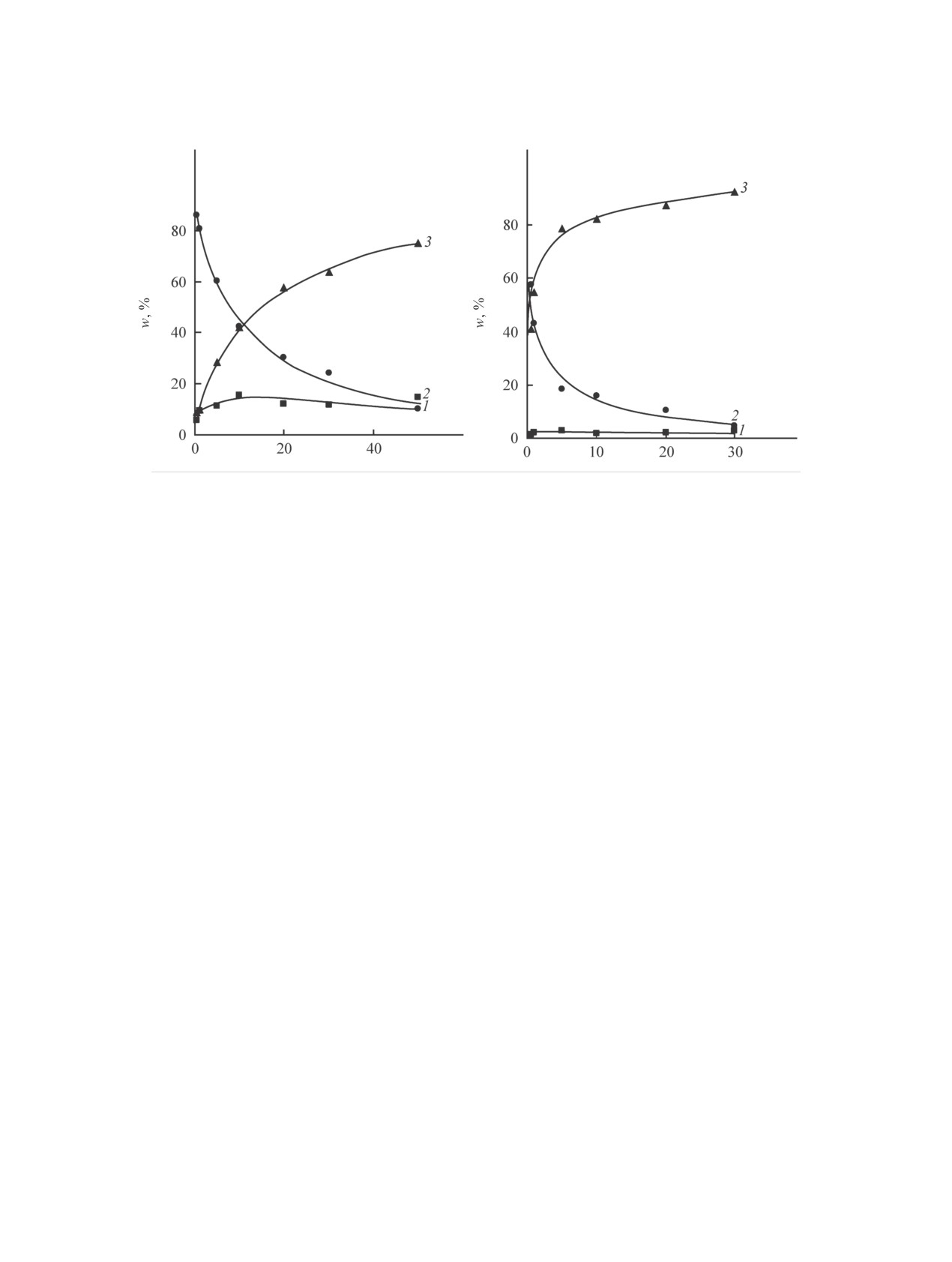
1 в тетрахлорметане представлены на рисунке.
ветствующих комплексах, что приводит к наблю-
Массовая доля свободных молекул 1 в тетрахлор-
даемым расхождениям в значениях эксперимен-
метане снижается при увеличении концентрации
тальных и расчетных частот. Чаще всего разница
амида и достигает 10% при концентрации амида
между наблюдаемыми (экспериментальными) и
1, равной 50 мас%, в то время как доля молекул
расчетными величинами волновых чисел находит-
в линейных ассоциатах, напротив, увеличивается
ся в интервале от 50 до 200 см-1 [10].
и доходит до 70-80%. Доля циклических димеров
слабо зависит от концентрации амида и составляет
При достаточном удалении полос поглощения
около 10-15%.
мономерной формы и различных типов ассоци-
атов друг от друга часто удается провести разде-
Для акрилового амида 2 в случае тетрахлорме-
ление экспериментального спектра и выделить
тана удалось провести разделение сигналов моно-
отдельные полосы поглощения каждой формы из
мерной формы и различных типов ассоциатов в
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 9 2019
1382
КАМОРИНА и др.
(а)
(б)
cамид, мас%
cамид, мас%
Изменение доли мономерной формы (1), циклической формы (2) и линейного ассоциата (3) при повышении концентрации
амида 1 (а) и 2 (б) в тетрахлорметане на основе данных ИК спектроcкопии в области полосы амид А.
обеих исследуемых областях спектра (см. таблицу).
2 какое-либо разделение мономерных и ассоции-
На рисунке представлены зависимости содержа-
рованных форм в явном виде отсутствует, но с уве-
ния различных форм амида 2 от концентрации
личением концентрации амидов происходит сме-
амида в тетрахлорметане, рассчитанные по полосе
щение сигналов в область низких частот. Полосы
поглощения амид А.
поглощения амид I для соединения 1 в случае са-
мого разбавленного раствора имеет вид, близкий к
Для растворов амида 2 в тетрахлорметане доля
свободных молекул мономера также снижается
унимодальному, а при концентрации аминоамида
10 мас% и более начинает прослеживаться слабая
при увеличении концентрации амида, но с несколь-
ко большей скоростью по сравнению с растворами
дополнительная полоса (1660 см-1). В растворах
амида 1. Преобладающим типом ассоциата явля-
амида 2 при таких же концентрациях происходит
ется линейный ассоциат, массовая доля которого
намного более заметное разделение полос - доста-
при высоких концентрациях амида составляет от
точное для получения концентрационных зависи-
85 до 90%. Доля циклических димеров невелика и
мостей содержания мономерной и ассоциирован-
слабо зависит от концентрации амида. Таким об-
ных форм.
разом, в не участвующем в образовании водород-
Сравнение результатов по ассоциации амида
ных связей растворителе (тетрахлорметане) доля
2 в ТГФ с описанными выше результатами, полу-
ассоциированных молекул амидов 1 и 2 растет с
ченными в растворах тетрахлорметана, показы-
увеличением их концентрации, достигая 80-90%,
вает, что концентрационные зависимости имеют
при этом наиболее активно протекает образование
общий характер и при высоких концентрациях
амидных ассоциатов линейного типа.
амида достигнуты примерно одинаковые доли со-
При замене инертного растворителя на более
держания различных форм. Отличием результатов
полярный ТГФ, атом кислорода которого способен
является лишь более низкая степень самоассоци-
выступать в качестве акцептора протонов при об-
ации мономера 2 в разбавленных растворах ТГФ.
разовании водородных связей, характер изменения
Это можно объяснить конкуренцией в образова-
формы экспериментальных пиков в областях по-
нии водородных связей типа амид-ТГФ и амид-
глощения полос амид А и амид I от концентрации
амид. Действительно, в ИК спектрах мономеров 1
амида в растворе несколько меняется. В области
и 2 при их низких концентрациях в ТГФ в области
сигналов амид А как для амида 1, так и для амида
полосы амид А отсутствует характерный сигнал
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 9 2019
ВЛИЯНИЕ ПРИРОДЫ ОРГАНИЧЕСКИХ РАСТВОРИТЕЛЕЙ
1383
свободной формы амида, который четко просле-
ленных инертных растворителях в разбавленных
живается в инертных растворителях - в тетрахлор-
растворах преобладает неассоциированная форма
метане в области 3460-3450 см-1 или в толуоле в
аминоамидов, то логично сделать вывод, что в
области 3450-3420 см-1 [6].
разбавленных растворах гораздо более активного
растворителя неассоциированные молекулы ами-
Это связано с тем, что в разбавленных раство-
ноамидов отсутствуют из-за того, что атом азота
рах в ТГФ молекулы аминоамидов, находясь в сре-
амидной группы амидов 1 и 2 образует водород-
де большого избытка молекул растворителя, окру-
ные связи с карбонильной группой ДМФА, моле-
жены акцепторами протона в виде атомов кисло-
кулы которого находятся в большом избытке.
рода ТГФ и образуют с ними водородные связи
типа N-H···O (эфир). При этом сигналы амид I в
При увеличении содержания амида 1 (в интер-
вале концентраций 0.5-50.0 мас%) наблюдает-
растворах амидов 1 и 2 при низких концентраци-
ся лишь гипсохромное смещение той же полосы
ях амидов имеют правильную форму, не расще-
поглощения, обусловленное изменением состава
плены и расположены в области, характерной для
поглощения связи С=О, не участвующей во взаи-
среды. При повышении концентрации амида 2 в
ДМФА смещение максимума указанной полосы
модействии (приблизительно 1670 и 1680 см-1 для
поглощения немного возрастает, но в 2 раза усту-
амидов 1 и 2 соответственно). Это явно отличается
от расщепления аналогичных сигналов, которое
пает аналогичному смещению при изменении
происходит уже в разбавленных растворах моно-
концентрации амида 2 в ТГФ. Эти факторы так-
же указывают на предпочтительность образования
меров в тетрахлорметане или толуоле [4]. Таким
ассоциатов типа мономер-растворитель по срав-
образом, в разбавленных растворах аминоамидов
в ТГФ отсутствуют водородные связи с участи-
нению с самоассоциацией мономеров 1 и 2. Таким
образом, в растворах в ДМФА аминоамиды как в
ем атома кислорода амидов и преобладают связи
разбавленных, так и в концентрированных раство-
атома азота амидов с растворителем. Однако уве-
личение концентрации амидов приводит к расще-
рах в основном связаны водородными связями с
плению сигнала в области амид I, что указывает
молекулами растворителя.
на участие карбонильной группы в образовании
Показано, что N-[3-(диметиламино)пропил]-
водородных связей. Таким образом, образование
(мет)акриламиды активно ассоциируются в орга-
линейных полиамидных ассоциатов становится
нических растворителях любой природы за счет
более предпочтительным, чем формирование во-
образования водородных связей, но закономерно-
дородных связей типа амид-ТГФ.
сти ассоциации сильно зависят от природы рас-
творителя и концентрации аминоамидов. В случае
ДМФА является наиболее полярным из исполь-
растворителя (тетрахлорметан), не участвующего
зованных в работе растворителем и выступает в
в образовании водородных связей, преобладает
качестве акцептора протона. В этом растворите-
образование линейных самоассоциатов мономе-
ле доступной для оценки поведения мономеров в
ров. В протоноакцепторном растворителе (ТГФ)
растворах является только область амид А ввиду
наблюдается конкуренция между образованием
наложения полос поглощения растворителя и мо-
водородных связей типов амид-амид и амид-рас-
номеров в других областях, характерных для коле-
творитель: связывание атома азота амидной груп-
баний связей амидных групп. Из прямой концен-
пы мономера с атомом кислорода растворителя
трационной зависимости спектров амидов 1 и 2 в
преобладает в разбавленных растворах, но при
области амид А можно сделать вывод о преоблада-
повышении концентрации аминоамидов предпоч-
ющем образовании водородных связей между мо-
тительным является образование их линейных са-
лекулами ДМФА и аминоамидов. Действительно,
моассоциатов. В амидном растворителе (ДМФА)
в спектрах даже наиболее разбавленных растворов
при концентрациях мономеров вплоть до 50 мас%
N-[3-(диметиламино)пропил](мет)акриламидов в
в основном образуются их ассоциаты с молекула-
ДМФА, в отличие от растворов в тетрахлорметане
ми растворителя.
(см. выше) или растворов в толуоле [4], в области
полосы амид А отсутствует полоса поглощения,
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
соответствующая мономерной форме аминоами-
Амиды 1 и 2 (Aldrich) перед использованием
дов (приблизительно 3460 см-1). Если в перечис-
были подвергнуты вакуумной перегонке, содер-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 9 2019
1384
КАМОРИНА и др.
жание основного вещества составляло не менее
СПИСОК ЛИТЕРАТУРЫ
99 мас%. Растворители тетрахлорметан, ДМФ и
1. Das A., Mehndiratta M., Chattopadhyay P., Ray A. //
ТГФ квалификации ЧДА использовали без допол-
J. Appl. Polym. Sci. 2010. Vol. 115. N 1. P. 393. doi
нительной очистки.
10.1002/app.30968
ИК спектры получены на приборе Shimadzu
2. Mishra R.K., Ramasamy K.А., Majeed A.B. // J. Appl.
IRAffinity-1 в ячейке со стеклами из KBr.
Polym. Sci. 2012. Vol. 126. N S2. P. E98. doi 10.1002/
Концентрация мономеров составляла от 0.5 до
app.36714
50.0 мас%. Для выделения отдельных сигналов,
3. Mishra R.K., Ray A.R. // J. Appl. Polym. Sci. 2011.
соответствующих свободным амидным группам
Vol. 119. N 6. P. 3199. doi 10.1002/app.32833
мономеров или связанным в циклические диме-
4. Kamorin D.M., Rumyantsev M.S., Kazantsev O.A.,
ры и линейные ассоциаты, экспериментальные
Sivokhin A.P., Kamorina S.I. // J. Appl. Polym. Sci.
спектры амидов в областях полос амид А и амид I
2017. Vol. 134. N 4. P. 44412. doi 10.1002/app.44412.
обрабатывали в программе OriginPro 8 с установ-
5. Kazantsev O.A., Kamorin D.M., Sivokhin A.P.,
лением экспериментальных частот поглощения
Samodurova S.I., Orekhov D.V., Korotkova T.V. // J.
отдельных пиков и их площадей [7].
Polym. Res. 2014. Vol. 21. N 2. P. 353. doi 10.1007/
s10965-013-0353-8
Квантово-химические расчеты изолирован-
6. Sivokhin A.P., Samodurova S.I., Kazantsev O.A.,
ных молекул N-[3-(диметиламино)пропил](мет)
Shirshin K.V., Kamorin D.M., Orekhov D.V. // Int.
акриламидов, а также их ассоциатов (циклические
Polym. Sci. Technol. 2014. Vol. 41. N 1. P. 41. doi
димеры, линейные тримеры) и расчет массовой
10.1177/0307174X1404100108
доли свободных и связанных водородной связью
7. Rumyantsev M., Kazantsev O.A., Kamorina S.I,
в циклические димеры и линейные ассоциаты мо-
Kamorin D.M., Sivokhin A.P. // J. Mol. Struct. 2016.
лекул амидов 1 и 2 осуществляли в соответствии с
Vol. 1121. P. 86. doi 10.1016/j.molstruc.2016.05.058
подходами, описанными в работе [4].
8. Kong J., Yu S. // Acta Biochim. Biophys. Sin. Vol. 39.
ФОНДОВАЯ ПОДДЕРЖКА
N 8. P. 549. doi 10.1111/j.1745-7270.2007.00320.x
Исследование выполнено при финансовой под-
9. Ludwig R., Reis O., Winter R., Weinhold F., Farrar T.C. //
держке Российского фонда фундаментальных ис-
J. Phys. Chem. (B). 1998. Vol. 102. N 46. P. 9312. doi
следований (проект № 18-33-00576).
10.1021/jp971575u
КОНФЛИКТ ИНТЕРЕСОВ
10. Lee C.M., Kubicki J.D., Fan B., Zhong L., Jarvis M.C.,
Авторы заявляют об отсутствии конфликта
Kim S.H. // J. Phys. Chem. (B). 2015. Vol. 119. N 49.
интересов.
P. 15138. doi 10.1021/acs.jpcb.5b08015
Effect of the Nature of Organic Solvents on the Association
of N-[3-(Dimethylamino)propyl](meth)acrylamides
S. I. Kamorinaa, A. Yu. Sadikova, b, D. M. Kamorina, b, *, O. A. Kazantseva,
M. S. Rumyantseva, M. S. Korotaeva, and I. N. Postnikovaa
a R. E. Alekseev Nizhny Novgorod State Technical University, ul. Minina 24, Nizhny Novgorod, 603950 Russia
*e-mail: d.kamorin@mail.ru
b N. I. Lobachevsky National Research Nizhny Novgorod State University, Nizhny Novgorod, Russia
Received April 2, 2019; revised July 9, 2019; accepted July 12, 2019
Using IR spectroscopy and computer simulation using quantum chemical calculations at the B3LY-
P/6-31+G(d,p)/PCM level, the association of N-[3-(dimethylamino)propyl](meth)acrylamides in tetrachlo-
romethane, tetrahydrofuran and N,N-dimethylformamide was studied. The effect of the ability of solvents to
form hydrogen bonds on the degree of participation of N-[3-(dimethylamino)propyl](meth)acrylamides in hy-
drogen bonding with the formation of amide-solvent type self-associates and heteroassociates was determined.
Keywords: N-[3-(dimethylamino)propyl]methacrylamide, N-[3-(dimethylamino)propyl]acrylamide, hydro-
gen bond, association, solvent effect
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 9 2019