ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2019, том 89, № 9, с. 1394-1403
УДК 541.49;547.574.4;547.814.5
СИНТЕЗ И ФИЗИКО-ХИМИЧЕСКОЕ
ИССЛЕДОВАНИЕ НОВЫХ МЕТАЛЛОКОМПЛЕКСОВ
С ОСНОВАНИЕМ ШИФФА НА ОСНОВЕ
7-ГИДРОКСИ-4-МЕТИЛ-8-ФОРМИЛКУМАРИНА И
1,3-ДИАМИНОПРОПАН-2-ОЛА
© 2019 г. Л. Д. Поповa,*, С. А. Бородкинa, Ю. В. Ревинскийb, И. Н. Щербаковa,
В. Г. Власенкоc, С. И. Левченковa, b
a Южный федеральный университет, ул. Зорге 7, Ростов-на-Дону, 344090 Россия
*e-mail: ldpopov@mail.ru
b Федеральный исследовательский центр «Южный научный центр Российской академии наук»,
Ростов-на-Дону, Россия
c Научно-исследовательский институт физики Южного федерального университета, Ростов-на-Дону, Россия
Поступило в Редакцию 28 марта 2019 г.
После доработки 28 марта 2019 г.
Принято к печати 14 апреля 2019 г.
Конденсацией 7-гидрокси-4-метил-8-формилкумарина и 1,3-диаминопропан-2-ола получен новый
бисазометин, на основе которого синтезированы металлохелаты меди(II), никеля(II), цинка(II). Стро-
ение и свойства соединений изучено спектральными методами и квантово-химическими расчетами.
Ключевые слова: основание Шиффа, 7-гидрокси-4-метил-8-формилкумарин, металлокомплексы, кван-
тово-химические расчеты, магнетохимия
DOI: 10.1134/S0044460X19090129
Постоянный интерес исследователей к азоме-
[21-25]. В настоящей работе для синтеза бисазоме-
тинам (основаниям Шиффа) обусловлен широким
тина на основе 1,3-диаминопропан-2-ола был ис-
спектром их полезных свойств в различных обла-
пользован 7-гидрокси-4-метил-8-формилкумарин.
стях химии: медицинской [1, 2], супрамолекуляр-
Хорошо известно, что производные кумарина обла-
ной [3, 4], координационной [5, 6], биоорганиче-
дают интересными флуоресцентными свойствами,
ской [7, 8], фотохимии [9-12] и др. Особый инте-
электролюминесценцией [26-29], разнообразной
рес представляют гетероциклические основания
ярко выраженной биологической активностью [30,
Шиффа, поскольку многие из них являются фар-
31], фотохромными свойствами [32-34] и т. д. В
макофорными, а также содержат в своем составе
литературе описаны некоторые основания Шиффа
гетероатомы, образующие устойчивые связи с ио-
на основе 4-метил-7-гидрокси-8-формилкумарина
нами металлов, что приводит к образованию моно-
[35-41], но биядерные комплексы с такими лиган-
и полиядерных комплексов с металлами [6, 13-20].
дами до настоящего времени получены не были.
Особое место среди таких систем занимают биса-
Цель данной работы заключалась в синтезе но-
зометины на основе 1,3-диаминопропано-2-ла, по-
вой лигандной системы, способной образовывать
скольку они способны образовывать как моно- так
как моно-, так и биядерные металлокомплексы и
и би(поли)ядерные металлохелаты.
изучении некоторых свойств полученных соедине-
Ранее нами были получены комплексы с лиган-
ний. Синтез основания Шиффа 1 был осуществлен
дами такого типа, изучены их строение и свойства
по схеме 1.
1394
СИНТЕЗ И ФИЗИКО-ХИМИЧЕСКОЕ ИССЛЕДОВАНИЕ НОВЫХ МЕТАЛЛОКОМПЛЕКСОВ
1395
Схема 1.
CH3
OH
+
2
H
N
2
NH2
O
O
OH
CHO
H3C
CH3
OH
HO
'
OH
i-PrOH
O
N
N
O
O
O
1
Соединение 1 может существовать в различных
В ИК спектре соединения 1 наблюдаются сле-
таутомерных формах, наиболее вероятными из ко-
дующие основные полосы поглощения: широ-
торых являются хиноновая и азометиновая. Кроме
кая несимметричная полоса поглощения в об-
того, возможна реализация цис/транс-изомерии
ласти 3100-3300 см-1, отвечающая валентным
из-за затруднения вращения вокруг связи C=N,
колебаниям ОН-групп, участвующих в образова-
характерной для некоторых азометинов.
нии водородной связи; полоса поглощения при
1720 см-1, соответствующая валентным колебани-
Для установления наиболее устойчивых тау-
ям карбонильной группы и полоса поглощения при
томерных форм для соединения 1 были проведе-
ны квантово-химические расчеты и сняты ИК и
1654 см-1, обусловленная валентными колебания-
ми связи C=N.
ЯМР 1Н спектры. В спектре ЯМР 1Н соединения
1 в ДМСО-d6 сигналы алифатических протонов
Хорошо известно, что производные 4-гидрок-
наблюдаются в области 3.6-4.1 м. д., ароматиче-
си-3-формилкумарина склонны к проявлению та-
ских - в области 6.0-7.6 м. д. Сигнал азометино-
утомерии и сольватохромии [32]. Для определения
вых протонов наблюдается в виде синглета в обла-
относительной устойчивости таутомерных форм
сти 8.86 м. д. Сигналы ОН-групп регистрируются
соединения 1 был проведен квантово-химический
при 14.45 (2Н) и 5.71 м. д. (1Н), причем последний
расчет методом функционала плотности (DFT)
проявляется в виде дублета с J = 5.1 Гц за счет рас-
(табл. 1). Как видно из приведенных данных, ги-
щепления на соседнем СН-протоне. Таким обра-
дроксииминный таутомер является более стабиль-
зом, в растворе соединение 1 присутствует в ги-
ными, чем енаминный за счет, скорее всего, обра-
дроксииминной формы Б.
зования внутримолекулярной водородной связи.
Таблица 1. Относительная устойчивость таутомеров азометина 1, вычисленная из полной энергии в газовой фазе
H3C
CH3
H3C
CH3
O
O
OH
HO
OH
OH
H
O
NH
N
O
O
N
N
O
O
O
O
O
Ⱥ
Ȼ
Таутомер
Изомер
ΔЕ, ккал/моль
Гидроксиимин
А
0.00
Енамин
Б
5.50
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 9 2019
1396
ПОПОВ и др.
Схема 2.
R
C
H3C
O O
CH3
O
O
Cu
Cu
O
O
O
N
O
N
O
R = CH3 (2), CF3 (3).
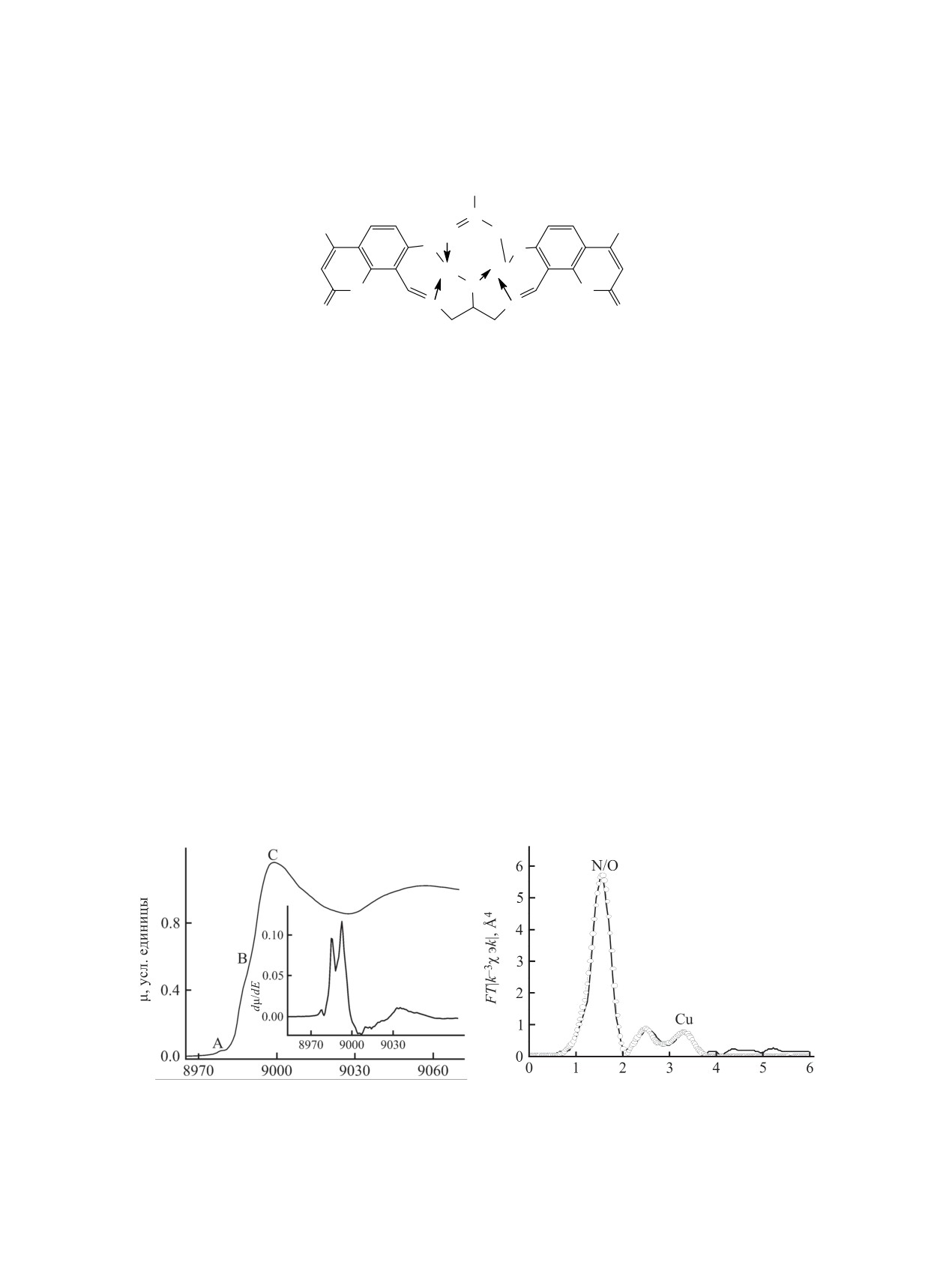
Наличие в молекуле азометина 1 нескольких
щения для комплексов 2 и 3. Незначительная ин-
донорных центров определяет возможность полу-
тенсивность предкраевого пика A, происхождение
чения металлокомплексов как моно-, так и полия-
которого связывают с p-d-смешиванием АО меди,
дерного строения. При взаимодействии лиганда 1
наличие плеча B непосредственно на K-краю, что
с ацетатом и трифторацетатом меди(II) в соотно-
особенно хорошо видно из расщепления первой
шении лиганд:металл = 1:2 были получены хелаты
производной края на рис. 1б, указывает на реали-
2 и 3 состава 1:2. В ИК спектрах комплексов 2 и
зацию искаженной плоскоквадратной конфигура-
3 наблюдается исчезновение валентных колебаний
ции координационного полиэдра в обоих комплек-
ОH-групп в области 3100-3300 см-1. Полоса по-
сах 2 и 3 [42, 43].
глощения карбонильной группы сдвигается в ко-
МФТ EXAFS для комплексов 2 и 3 (рис. 1в) так-
ротковолновую область на 15-20 см-1, в то время
же близки и имеют основной пик при r = 1.50 Å
как полоса поглощения группы С=N сдвигается на
вследствие рассеяния фотоэлектронных волн на
15-20 см-1 в длинноволновую область, что свиде-
ближайшей координационной сферы из атомов
тельствует о координации этой группы к иону ме-
азота и кислорода и двух последующих пиков
талла.
с меньшей амплитудой. Состав координацион-
Исходя из данных элементного анализа, наибо-
ных сфер, отвечающих этим пикам, определен с
лее вероятной является биядерная структура ком-
использованием вейвлет-преобразования (WT)
плексов 2 и 3 (схема 2), что подтверждается данны-
EXAFS [44]. Известно, что легкие атомы C, O, N
ми рентгеновской спектроскопии поглощения. На
наиболее эффективно рассеивают низкоэнергети-
рис. 1 показаны нормированные спектры XANES и
ческие фотоэлектроны с малыми волновыми век-
соответствующие МФТ EXAFS CuK-краев погло-
торами k (максимум рассеяния при k = 4-6 Å-1)
(a)
(в)
(б)
E, эВ
E, эВ
r, Å
Рис. 1. Нормированный спектр XANES CuK-края (а), производная dμ/dE (б) и МФТ EXAFS (в) комплекса 2. Эксперимент -
сплошная линия, теория - кружки.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 9 2019
СИНТЕЗ И ФИЗИКО-ХИМИЧЕСКОЕ ИССЛЕДОВАНИЕ НОВЫХ МЕТАЛЛОКОМПЛЕКСОВ
1397
Таблица 2. Параметры локального атомного окружения ионов Cu и Ni в комплексах 2-5а
Комплекс
N
R, Å
σ2, Å2
Атом
Q, %
2
4
1.94
0.0035
O/N
3.5б
1
3.50
0.0055
Cu
3
4
1.94
0.0040
O/N
3.7б
1
3.55
0.0055
Cu
4
4
1.96
0.0038
O/N
1.3в
5
2
1.85
0.0035
O/N
1.4в
2
1.93
0.0035
O/N
а R - межатомные расстояния, σ2 - фактор Дебая-Уоллера, Q - функция качества подгонки. б Размер окна Δr = 1.0-3.4 Å. в Δr =
1.0-1.9 Å.
тогда как для более тяжелых атомов максимум рас-
составляют 1.68 и 1.71 М. Б. соответственно и
сеяния сдвигается в сторону больших k. WT-Карта
уменьшаются до 1.22 М. Б. (1.27 М. Б.) при ох-
вейвлет-преобразования EXAFS позволяет уви-
лаждении до температуры кипения жидкого азота,
деть картину рассеяния на атомах как в простран-
что однозначно указывает на обменное взаимодей-
ственных r-координатах, так и в координатах вол-
ствие антиферромагнитного типа [2J = -110 см-1
новых векторов k, что позволяет разделить вклады
(2), 2J = -103 см-1 (3)].
в рассеяние от атомов различного вида, находя-
При взаимодействии лиганда 1 с перхлоратом
щихся на одинаковом расстоянии от поглощающе-
меди (II) в соотношении лиганд:металл = 1:2, в
го центра. Как видно из рассмотрения WT-карт для
отличие от продуктов взаимодействия с ацетатом
комплексов 2 и 3, область рассеяния фотоэлектро-
и трифторацетатом меди, был выделен комплекс
нов для пиков МФТ при r = 3.05, 3.25 Å имеет мак-
4 состава 1:1 (схема 3). В ИК спектре комплекса
симум при значениях k = 8-11 Å-1, указывая, что в
4, также как и в ИК спектрах комплексов 2 и 3,
составе соответствующих координационных сфер
наблюдается понижение частоты валентных ко-
содержится атом меди. Пикам МФТ при r = 2.50 Å
лебаний связи C=N с одновременным увеличе-
отвечают координационные сферы, состоящие из
нием частоты валентных колебаний связи С=О,
атомов углерода лигандов, для которых максиму-
а в области 3375 см-1 наблюдается интенсивная
мы рассеяния на WT-картах имеют значения около
полоса, соответствующая валентным колебаниям
k = 6 Å-1. Таким образом, можно утверждать, что в
ОН-группы. Данный комплекс оказался парамаг-
комплексах 2 и 3 реализуется биядерная структура
нитным, величина μэфф при комнатной температу-
молекул (схема 2).
ре составляет 1.93 М. Б. и не изменяется при ох-
Количественные характеристики ближайших
лаждении до температуры кипения жидкого азота,
координационных сфер комплексов 2 и 3, полу-
что дает возможность предположить моноядерное
ченные в результате многосферной подгонки пара-
строение хелата 4.
метров локального атомного окружения с исполь-
Схема 3.
зованием близких по строению моделей, приведе-
ны в табл. 2. Радиусы первой координационной
H3C
CH3
сферы для комплексов 2 и 3 равны, а расстояния
O O
Cu···Cu составляют 3.50-3.55 Å имеют значения,
M
как в димерных молекулах комплексов с близкими
O
O
N N
лигандами [45].
O
O
Исследование магнитных свойств комплексов
2 и 3 показало, что они являются парамагнитны-
OH
ми. Величины μэфф при комнатной температуре
M = Cu (4), Ni (5), Zn (6).
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 9 2019
1398
ПОПОВ и др.
(a)
(в)
(б)
E, эВ
E, эВ
r, Å
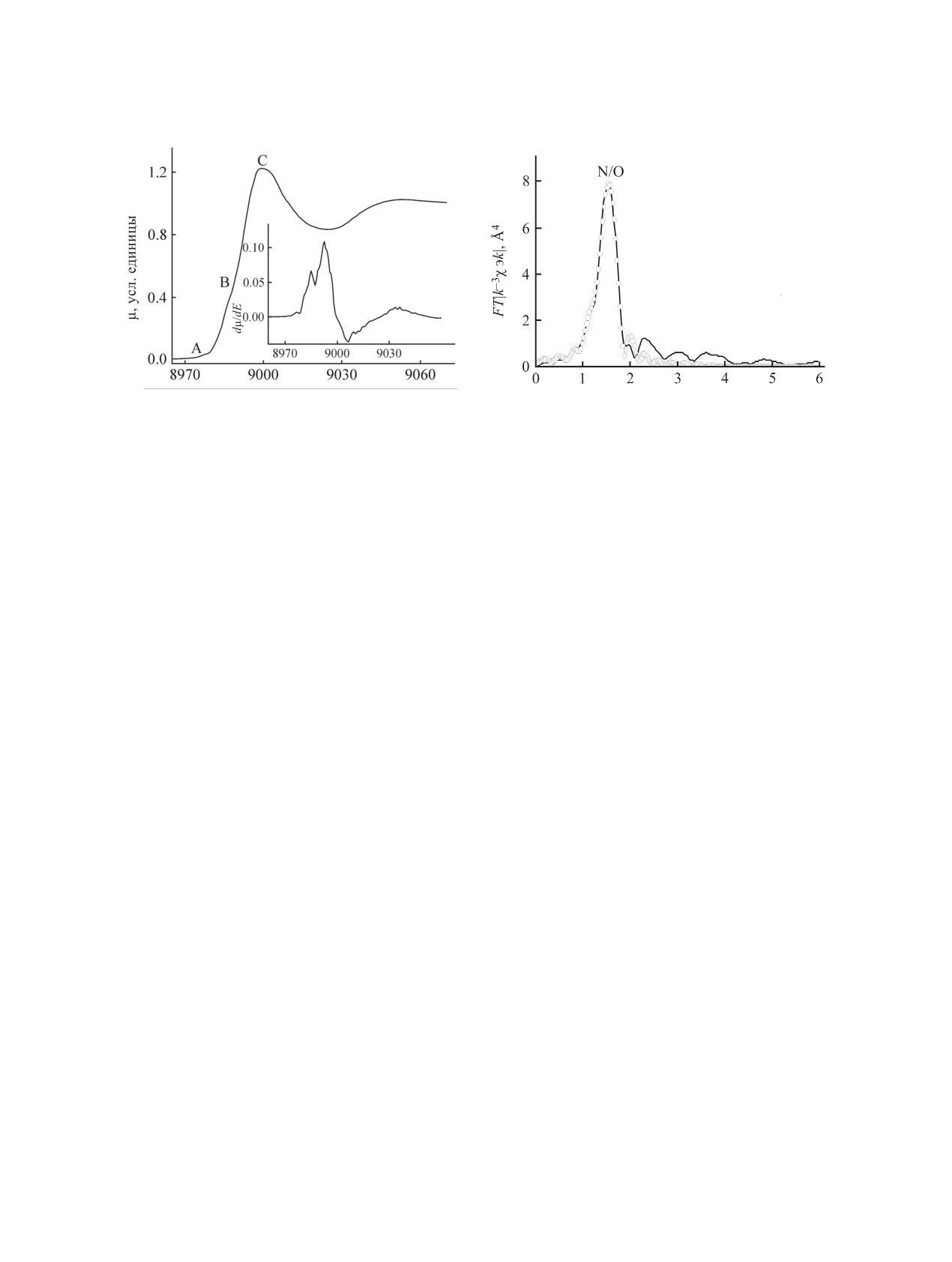
Рис. 2. Нормированный спектр XANES CuK-края (а), первая производная dμ/dE (б) и МФТ EXAFS (в) комплекса 4.
Эксперимент - сплошная линия, теория - кружки.
Подтверждением этого вывода может служить
области рассеяния с максимумом при больших
рассмотрение МФТ и WT-карты EXAFS CuK-края
значениях волнового вектора k. Таким образом,
комплекса 4 (рис. 2). В отличие от МФТ и WT-карт
комплекс 5 имеет моноядерное строение с пара-
комплексов 2 и 3, в МФТ комплекса 4 пики, кото-
метрами для ближайших координационных сфер,
рые могли бы служить кандидатами на проявление
приведенными в табл. 2.
Cu···Cu расстояния, имеют малые амплитуды, со-
При взаимодействии лиганда 1 с ацетатом цин-
поставимые с проявлением экспериментального
ка(II) в соотношении лиганд:металл = 1:2 также
шума, а на WT-карте отсутствуют области рассея-
был выделен комплекс 6 состава 1:1 (схема 3),
ния с максимумом при больших значениях волно-
ИК спектр которого почти аналогичен ИК спек-
вого вектора k. Количественные значения параме-
трам хелатов меди 4 и никеля 5. В спектре ЯМР
тров ближайшего атомного окружения иона меди в
1Н хелата 6 в ДМСО-d6, по сравнению со спектром
4 приведены в табл. 2.
лиганда, исчезает сигнал, отвечающий двум ОН-
При взаимодействии лиганда 1 с ацетатом ни-
группам фенольного фрагмента. Остальные сигна-
келя(II) в соотношении лиганд:металл = 1:2 был
лы, в том числе и сигнал ОН-группы спиртового
выделен комплекс 5 состава 1:1 (схема 3). ИК
фрагмента, своего положения и мультиплетности
спектр комплекса 5 не сильно отличается от ИК
существенно не меняют.
спектра комплекса 4. Валентные колебания ОН-
Как хорошо известно, многие основания
группы наблюдаются в области 3405 см-1, что
Шиффа и внутрикомплексные соединения цин-
согласуется с моноядерным строении хелата 5.
ка(II) на их основе часто обладают ярко выражен-
Измерение магнитной восприимчивости показало,
ной люминесценцией. В связи с этим нами были
что комплекс диамагнитен, что свидетельствует о
сняты электронные спектры поглощения и спек-
плоском строении хелатного узла. Данные XANES
тры люминесценции азометина 1 и комплекса цин-
NiK-края комплекса 5 (незначительная интенсив-
ка(II) на его основе 6. В электронном спектре по-
ность предкраевого пика А, ярко выраженный пик
глощения (ЭСП) соединения 1 в ДМСО наблюда-
В непосредственно на протяжении края поглоще-
ются полосы поглощения, наиболее интенсивные
ния, первая производная dμ/dE расщеплена на не-
из которых представляют собой: широкие полосы
сколько максимумов) также однозначно указыва-
с λmax = 292 нм (lgε = 4.90) и λmax = 345 нм (lgε =
ют на плоскоквадратное окружение ионов никеля
4.50) и еще одну широкую полосу при 450 нм
(рис. 2). В МФТ EXAFS нет пика, который мог бы
(lgε = 4.03), которая, вероятно, обусловлена π-π-пе-
являться проявлением рассеяния на атомах ни-
реходами в ароматических фрагментах. В ЭСП
келя. Соответственно, на WT-карте отсутствуют
комплекса цинка(II) 6 в ДMCO наблюдаются две
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 9 2019
СИНТЕЗ И ФИЗИКО-ХИМИЧЕСКОЕ ИССЛЕДОВАНИЕ НОВЫХ МЕТАЛЛОКОМПЛЕКСОВ
1399
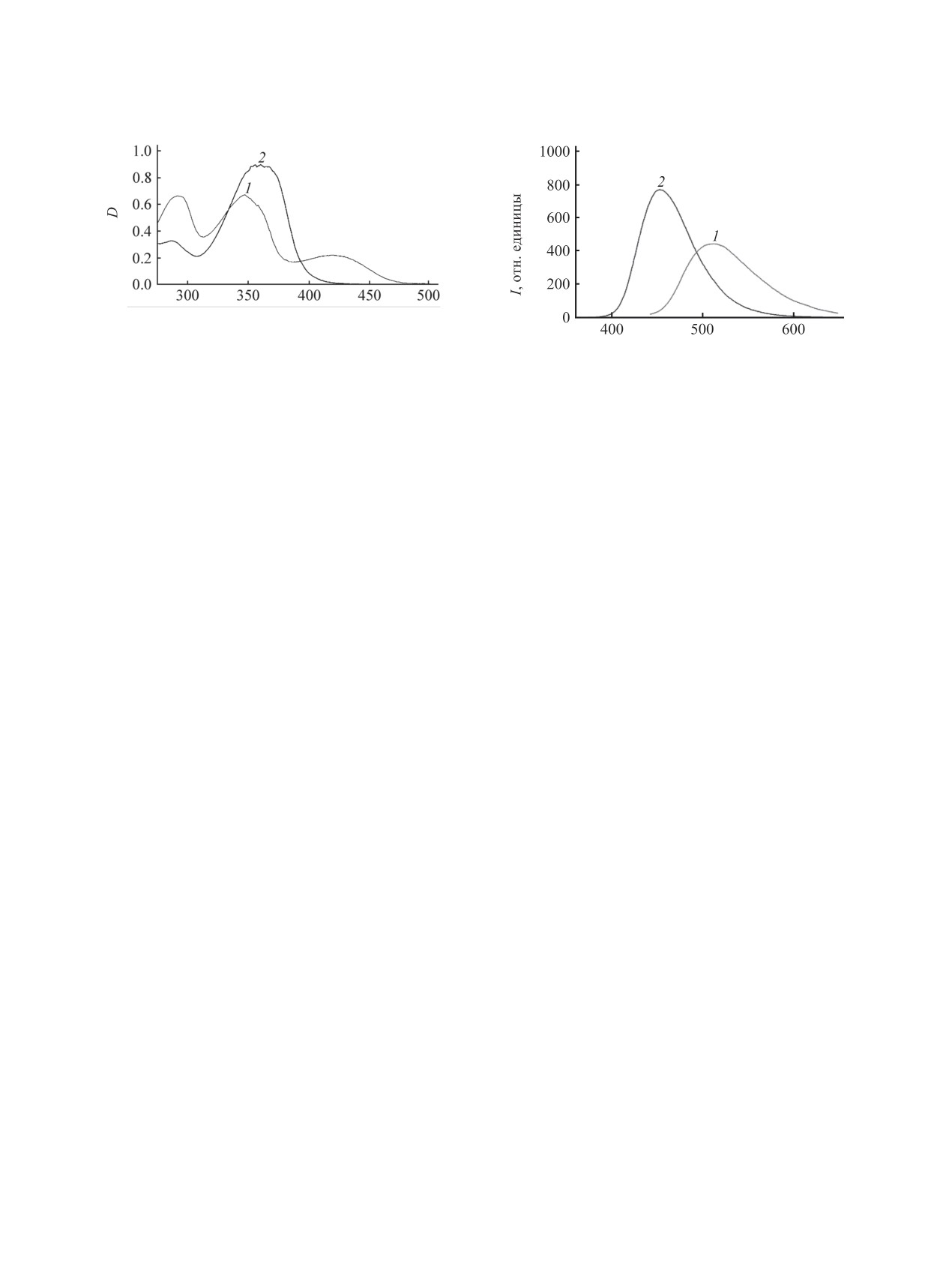
λ, нм
Рис. 3. Электронные спектры поглощения лиганда 1
λ, нм
(9.0×10-6 М., 1) и цинкового комплекса 6 (7.7×10-6 М.,
Рис. 4. Спектры флуоресценции лиганда 1 (9.0×10-6 М.,
2) в ДМСО.
1) и цинкового комплекса 6 (7.7×10-6 М., 2) в ДМСО.
широкие полосы поглощения с λmax = 287 нм (lgε =
в 0.1 н. серной кислоте. Магнитная восприимчи-
4.70) и λmax = 362 нм (lgε = 5.02) (рис. 3).
вость поликристаллических образцов определена
В спектрах люминесценции лиганда и комплек-
относительным методом Фарадея в температурном
интервале 77.4-300 K. Измерение проводили при
са цинка(II), полученных при длине волны возбуж-
дения, соответствующей максимумам поглощения
напряженности магнитного поля 7.16×105 А/м. В
(420 и 350 нм соответственно), наблюдается по
качестве эталона для калибровки использовали
одной среднеинтенсивной полосе с максимумами
Hg[Co(CNS)4]. Рентгеновские спектры Сu- и NiK-
при λ = 510 (для лиганда) и 450 нм (для комплекса)
краев поглощения комплексов в твердом состоя-
(рис. 4). При этом интенсивность люминесценции
нии зарегистрированы в режиме пропускания на
для комплекса цинка увеличивается почти вдвое
EXAFS-спектрометре станции «Структурного ма-
по сравнению со спектром лиганда.
териаловедения» в Курчатовском синхротронном
центре (Москва) [47]. Энергия электронного пуч-
Таким образом, нами синтезированы новый
ка, использованного в качестве источника рент-
азометин, содержащий кумариновый и диамино-
геновского синхротронного излучения - 2.5 ГэВ
пропанольный фрагменты и металлохелаты на
его основе с медью(II), никелем(II), цинком(II). С
при токе около 100 мА. Для монохроматизации
рентгеновского излучения использован Si(111) мо-
привлечением совокупности физико-химических
методов предложено строение синтезированных
нохроматор. Обработка полученных спектров осу-
ществлена стандартными процедурами выделения
соединений. Азометин и комплекс цинка обладают
зеленой люминесценцией.
фона, нормирования на величину скачка K-края и
, после чего
выделения атомного поглощения μ0
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
было проведено Фурье-преобразование получен-
ных EXAFS (χ)-спектров в интервале волновых
Элементный анализ выполнен на приборе
векторов фотоэлектронов k от 2.5 до 13.0 Å-1 с
PerkinElmer 240C в Лаборатории микроанализа
весовой функцией k3. Полученные модули Фурье-
Южного федерального университета. Спектры
трансформант (МФТ) соответствуют радиальному
ЯМР 1Н получены на спектрометре Bruker (300
распределению атомов без учета фазового сдвига
МГц) при 20°С. ИК спектры зарегистрированы
фотоэлектронных волн. Пороговая энергия иони-
на приборе Varian Scimitar 1000 FT-IR в вазелино-
зации E0 выбрана по значению максимума первой
вом масле в области 400-4000 см-1. Электронные
производной K-края и в дальнейшем варьирована
спектры получены на приборе Varian Cary 5000 в
при подгонке.
области 200-800 нм. Спектры флуоресценции сня-
ты на спектрофлуориметре Cary Exlipse (Varian).
Точные значения параметров структуры бли-
Значения квантовых выходов флуоресценции
жайшего окружения ионов металлов в соединени-
определены методом Паркера-Риса [46], в каче-
ях определяли путем нелинейной подгонки пара-
стве стандарта был использован бисульфат хинина
метров соответствующих координационных сфер
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 9 2019
1400
ПОПОВ и др.
при сопоставлении рассчитанного EXAFS-сигнала
метанола приливали раствор 0.086 г (0.42 ммоль)
и выделенного из полного EXAFS-спектра мето-
Cu(CН3СОО)2·H2O в 10 мл метанола. Полученную
дом Фурье-фильтрации МФТ. Указанную нелиней-
смесь кипятили 24 ч. Полученный осадок отфиль-
ную подгонку производили с использованием па-
тровывали, промывали кипящим метанолом, аце-
кета программ IFFEFIT-1.2.11 [48]. Необходимые
тоном и сушили в вакууме. Выход 0.048 г (47%),
для построения модельного спектра фазы и ампли-
темно-зеленый мелкокристаллический порошок,
туды рассеяния фотоэлектронной волны рассчи-
т. пл. >250°С. ИК спектр, ν, см-1: 452, 537, 547, 612,
тывали с использованием программы FEFF7 [49] и
777, 817, 840, 933, 1060, 1137, 1200, 1345, 1402,
атомных координат соединений с близкой атомной
1533, 1582, 1624 (C=N), 1738 (С=О). Найдено,
структурой.
%: C 50.8; H 3.0; Cu 19.5; N 4.5. C27H22Cu2N2O9.
Квантово-химический расчет проводили в
Вычислено, %: C 50.25; H 3.41; Cu 19.69; N 4.34.
рамках теории функционала плотности с исполь-
Комплекс с трифторацетатом меди(II) (3)
зованием гибридного обменно-корреляционного
получен аналогично комплексу 2 из Cu(CF3СОO)2·
функционала B3LYP [50] в валентно-расщеплен-
H2O. Выход 0.048 г (47%), светло-зеленый амор-
ном базисе гауссовых функций, расширенного по-
фный порошок, т. пл. >250°С. ИК спектр, ν, см-1:
ляризационными d-функциями на тяжелых атомах
454, 544, 570, 612, 775, 815, 841, 931, 1059, 1089,
6-311G(d). Использовали программу Gaussian’09
1131, 1198, 1223, 1341, 1403, 1531, 1581, 1625
[51]. Оптимизацию геометрии проводили без огра-
(C=N), 1739 (С=О). Найдено, %: C 46.1; H 2.8; Cu
ничения по симметрии, минимумы на поверхности
17.7; N 3.7. C27H19Cu2F3N2O9. Вычислено, %: C
потенциальной энергии характеризовали отсут-
46.37; H 2.72; Cu 18.17; N 4.00.
ствием мнимых частот рассчитанных нормальных
Комплекс с перхлоратом меди(II) (4) полу-
колебаний. Влияние среды учитывали в рамках
чен аналогично комплексу 2 из Cu(ClO4)2·6H2O.
модели непрерывной поляризуемой среды (PCM)
Светло-зеленый аморфный порошок. Выход 47%,
[57] с использованием параметров для раствори-
т. пл. >250°С. ИК спектр (вазелин), v, см-1: 454,
теля (ДМСО), принятых в программе Gaussian’09
544, 570, 612, 775, 815, 841, 931, 1059, 1089, 1131,
по умолчанию.
1198, 1223, 1341, 1403, 1531, 1581, 1625 (C=N),
Бисазометин (1). К кипящей суспензии 2.00 г
1739 (С=О), 3375 (OH). Найдено, %: C 57.5; H 3.7;
(0.0049 моль) 7-гидрокси-4-метил-8-формилкума-
Cu 12.4; N 5.1. C25H21CuN2O7. Вычислено, %: C
рина [35] в 15 мл изопропанола добавляли горя-
57.21; H 4.00; Cu 12.10; N 5.34.
чий раствор 0.44 г (0.0024 моль) 1,3-диаминопро-
Комплекс c ацетатом никеля(II) (5) получен
пан-2-ола в 5 мл изопропанола. Полученную смесь
аналогично комплексу 2. Выход 49%, светло-зеле-
кипятили 5 ч, затем осадок отфильтровывали, про-
ный аморфный порошок, т. пл. >250°С. ИК спектр,
мывали горячим изопропанолом и перекристали-
ν, см-1: 419, 465, 560, 773, 837, 934, 1060, 1095,
зовывали из смеси изопропанол-ДМФА (1:1) и
1134, 1202, 1226, 1349, 1413, 1534, 1579, 1624
сушили в вакууме. Выход 1.33 г (57%), желтый
(C=N), 1739 (С=О), 3405 (OН). Найдено, %: C 57.9;
аморфный порошок, т. пл. >250°С. ИК спектр, ν,
H 3.8; Ni 11.0; N 5.5. C25H21N2NiO7. Вычислено,
см-1: 454, 779, 840, 936, 1036, 1078, 1112, 1184,
%: C 57.75; H 4.04; Ni 11.29; N 5.38.
1218, 1509, 1624, 1654 (C=N), 1720 (С=О), 3100-
3300 (OН). Спектр ЯМР 1Н (ДМСО-d6), δ, м. д.:
Комплекс с ацетатом цинка(II) (6) получен
2.32 с (6H, СH3), 3.63-3.78 м (2H, CH2), 3.85-3.95
аналогично комплексу 2 из Zn(CH3СОO)2·2H2O.
м (2H, CH2), 4.01-4.05 м (1H, CH), 5.71 д (1H, ОН,
Выход 47%, светло-желтый аморфный порошок, т.
3JHН = 5.1 Гц), 6.00 с (2H1), 6.53 д (2H2, 3JHН =
пл. >250°С. ИК спектр, ν, см-1: 451, 534, 598, 775,
9.3 Гц), 7.57 д (2H3, 3JHН = 9.3 Гц), 8.86 с (2H,
809, 845, 930, 1057, 1082, 1131, 1193, 1222, 1307,
СH=N), 14.54 с (2H, OH). Найдено, %: C 65.3; H
1530, 1583, 1626 (C=N), 1735 (С=О). Найдено,
4.5; N 6.0. C25H22N2O7. Вычислено, %: C 64.93; H
%: C 56.9; H 4.3; N 5.5; Zn 12.3. C25H21N2O7Zn.
4.79; N 6.06.
Вычислено, %: C 57.01; H 3.99; N 5.32; Zn 12.41.
Комплекс с ацетатом меди(II) (2). К горячей
Исследование выполнено с использованием
суспензии 0.10 г (0.21 ммоль) соединения 1 15 мл
оборудования Центра коллективного пользования
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 9 2019
СИНТЕЗ И ФИЗИКО-ХИМИЧЕСКОЕ ИССЛЕДОВАНИЕ НОВЫХ МЕТАЛЛОКОМПЛЕКСОВ
1401
«Молекулярная спектроскопия» Южного феде-
10. Ужинов Б.М., Химич М.Н. // Усп. хим. 2011. Т. 80.
рального университета.
№ 6. С. 580; Uzhinov B.M., Khimich M.N. // Russ.
Chem. Rev. 2011. Vol. 80. N 6. P. 553. doi 10.1070/
ФОНДОВАЯ ПОДДЕРЖКА
RC2011v080n06ABEH004144
11. Ohshima A., Momotake A., Arai T. // J. Photochem.
Работа выполнена в рамках внутреннего гран-
Photobiol. (A). 2004. Vol. 162. N 2-3. P. 473. doi
та Южного федерального университета (№ ВнГр-
10.1016/S1010-6030(03)00388-5
07/2017-29).
12. Harada J., Uekusa H., Ohashi Y. // J. Am. Chem. Soc.
КОНФЛИКТ ИНТЕРЕСОВ
1999. Vol. 121. N 24. P. 5809. doi 10.1021/ja9842969
13. Гарновский А.Д., Васильченко И.С. // Усп. хим. 2005.
Авторы заявляют об отсутствии конфликта
Т. 74. № 3. С. 211; Garnovskii A.D., Vasil’chenko I.S. //
интересов.
Russ. Chem. Rev. 2005. Vol. 74. N 3. P. 193. doi
10.1070/RC2005v074n03ABEH001164
СПИСОК ЛИТЕРАТУРЫ
14. Гарновский А.Д. // Коорд. хим. 1992. Т. 18. № 7.
1. Krause M., Rouleau A., Stark H., Luger P., Lipp R.,
С. 675.
Garbarg M., Schwartz J.-C., Schunack W. // J. Med.
15. Vigato P.A., Tamburini S. // Coord. Chem. Rev.
Chem. 1995. Vol. 38. N 20. P. 4070. doi 10.1021/
2004. Vol. 248. N 17-20. P. 1717. doi 10.1016/j.
jm00020a022
cct.2003.09.003
2. Hui M.B.V., Lien E.J., Trousdale M.D. // Antivir.
16. Минбаев Б.У. Шиффовы основания. Алма-Ата: На-
Res. 1994. Vol. 24. N 4. P. 261. doi 10.1016/0166-
ука, 1989. 140 с.
3542(94)90074-4
17. Lewinski J., Zachara J., Justyniak I., Dranka М. //
3. Lewinski J., Zachara J., Justyniak I., Dranka M. //
Coord. Chem. Rev. 2005. Vol. 249. Р. 1185. doi
Coord. Chem. Rev. 2005. Vol. 249. N 11-12. P. 1185.
10.1016/j.ccr.2004.11.013
doi 10.1016/j.ccr.2004.11.013
18. Гарновский А.Д. // Коорд. хим. 1993. Т. 19. № 5.
4. Kleij A.W. // Chem. Eur. J. 2008. Vol. 14. N 34. P. 10520.
С. 394.
doi 10.1002/chem.200801149
19. Коган В.А., Луков В.В., Щербаков И.Н. // Коорд.
5. Garnovskii A.D., Nivorozhkin A.L., Minkin V.I. //
хим. 2010. Т. 36. № 6. С. 403; Kogan V.A., Lu-
Coord. Chem. Rev. 1993. Vol. 126. N 1-2. P. 1. doi
kov V.V., Shcherbakov I.N. // Russ. J. Coord. Chem. 2010.
10.1016/0010-8545(93)85032-Y
Vol. 36. N 6. P. 401. doi 10.1134/S1070328410060011
20. Cozzi P.G. // Chem. Soc. Rev. 2004. Vol. 33. P. 410. doi
6. Гарновский А.Д., Бурлов А.С., Васильченко И.С., Гар-
10.1039/B307853C
новский Д.А., Ураев А.И., Сенникова Е.В. // Коорд.
21. Popov L.D., Tupolova Yu.P., Lukov V.V., Shcherba-
хим. 2010. Т. 36. № 2. С. 83; Garnovskii A.D., Bur-
kov I.N., Burlov A.S., Levchenkov S.I., Kogan V.A.,
lov A.S., Vasil’chenko I.S., Garnovskii D.A., Uraev A.I.,
Lyssenko K.A., Ivannikova E.V. // Inorg. Chim. Acta.
Sennikova E.V. // Russ. J. Coord. Chem. 2010. Vol. 36.
2009. Vol. 362. P. 1673. doi 10.1016/j.ica2008.08.012
N 2. P. 81. doi 10.1134/S1070328410020016
22. Popov L.D., Levchenkov S.I., Shcherbakov I.N.,
7. Chattopadhyay A., Meier M., Ivaninskii S., Burkhard
Lukov V.V., Suponitsky K.Yu., Kogan V.A. // Inorg.
P., Speroni F., Campanini B., Bettati S., Mozzarelli A.,
Chem. Commun. 2012. Vol. 17. P. 1. doi 10.1016/j.
Rabeh W.M., Li L., Cook P.F. // Biochem. 2007. Vol. 46.
inoche.2011.11.020
N 28. P. 8315. doi 10.1021/bi602603c
23. Туполова Ю.П., Щербаков И.Н., Попов Л.Д., Лев-
8. Montagner C., de Souza S.M., Groposo C., Delle
ченков С.И., Аскалепова О.И., Мищенко А.В.,
Monache F., Smania, E.F.A., Smania A., Jr. // Z.
Луков В.В., Коган В.А. // ЖОХ. 2010. Т. 80. Вып.
Naturforsch. (C). 2008. Vol. 63. N 1-2. P. 21. doi
11. С. 1866; Tupolova Yu.P., Shcherbakov I.N., Po-
10.1515/znc-2008-1-205
pov L.D., Levchenkov S.I., Askalepova O.I.,
9. Minkin V.I., Tsukanov A.V., Dubonosov A.D., Bren V.A. //
Mishchenko A.V., Lukov V.V., Kogan V.A. // Russ. J.
J. Mol. Struct. 2011. Vol. 998. N 1-3. P. 179. doi
Gen. Chem. 2010. Vol. 80. N 11. P. 2329. doi 10.1134/
10.1016/j.molstruc.2011.05.029
S1070363210110174
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 9 2019
1402
ПОПОВ и др.
24. Левченков С.И., Попов Л.Д., Туполова Ю.П., Мо-
pin N.E., Minkin V.I. // Mol. Cryst. Liq. Cryst. 1994.
розов А.Н., Распопова Е.А., Старикова З.А., Щер-
Vol. 246. N 1. P. 37. doi 10.1080/10587259408037784
баков И.Н. // Коорд. хим. 2017. Т. 43. № 10. С. 592;
35. Травень В.Ф., Иванов И.В., Панов А.В., Сафроно-
Levchenkov S.I., Popov L.D., Tupolova Yu.P., Moro-
ва О.Б., Чибисова Т.А. // Изв. АН. Сер. хим. 2008.
zov A.N., Raspopova E.A., Starikova Z.A., Shcherba-
Т. 57. № 9. С. 1954; Traven’ V.F., Ivanov I.V., Pa-
kov I.N. // Russ. J. Coord. Chem. 2017. Vol. 43. N 10.
nov A.V., Safronova O.B., Chibisova T.A. // Russ. Chem.
P. 630. doi 10.1134/S1070328417100049
Bull. 2008. Vol. 57. N 9. P. 1989. doi 10.1007/s11172-
25. Щербаков И.Н., Левченков С.И., Попов Л.Д.,
008-0267-5
Александров Г.Г., Этметченко Л.Н., Коган В.А.
36. Bagihalli G.B., Avaji P.G., Badami P.S., Patil S.A. //
// Коорд. хим. 2015. Т. 41. № 2. С. 67; Shcherba-
J. Coord. Chem. 2008. Vol. 61. N 17. P. 2793. doi
kov I.N., Levchenkov S.I., Popov L.D., Aleksan-
10.1080/00958970801975109
drov G.G., Etmetchenko L.N., Kogan V.A. // Russ. J.
37. Yan M-h., Li T-r., Yang Z-y. // Inorg. Chem. Commun.
Coord. Chem. 2015. Vol. 41. N 2. P. 69. doi 10.1134/
2011. Vol. 14. N 3. P. 463. doi 10.1016/j.in-
S1070328415020098
oche.2010.12.027
26. Lin W., Long L., Tan W. // Chem. Commun. 2010.
38. An J-m., Yang Z-y., Yan M-h., Li T-r. // J. Lumin. 2013.
Vol. 46. N 9. P. 1503. doi 10.1039/B922478E
Vol. 139. P. 79. doi 10.1016/j.jlumin.2013.02.019
27. Park S., Kwon J.E., Kim S.H., Seo J., Chung K.,
39. Xie L., Chen Y., Wu W., Guo H., Zhao J., Yu X. // Dyes
Park S-Y., Jang D-J., Medina B.M., Gierschner J.,
Pigm. 2012. Vol. 92. N 3. P. 1361. doi 10.1016/j.
Park S.Y. // J. Am. Chem. Soc. 2009. Vol. 131. N 39.
dyepig.2011.09.023
P. 14043. doi 10.1021/ja902533f
40. Kulkarni A.D., Bagihalli G.B., Patil S.A., Badami P.S.
28. Lin W., Long L., Feng J., Wang B., Guo C. // Eur. J.
// J. Coord. Chem. 2009. Vol. 21. N 18. P. 3060. doi
Org. Chem. 2007. Vol. 26. P. 4301. doi 10.1002/
10.1080/00958970902914569
ejoc.200700475
41. Chen F., Liu G., Shi Y., Xi P., Cheng J., Hong J., Shen R.,
29. Li H., Cai L., Li J., Hu Y., Zhou P., Zhang J. // Dyes
Yao X., Bai D., Zeng Z. // Talanta. 2014. Vol. 124. P. 139.
doi 10.1016/j.talanta.2014.02.034
Pigm. 2011. Vol. 91. N 3. P. 309. doi 10.1016/j.
dyepig.2011.05.011
42. Левченков С.И., Щербаков И.Н., Попов Л.Д., Вла-
сенко В.Г., Супоницкий К.Ю., Цатурян А.А., Лу-
30. Laurin P., Ferroud D., Klich M., Dupuis-Haelin C.,
ков В.В., Коган В.А. // Коорд. хим. 2014. Т. 40.
Mauvais P., Lassaigne P., Bonnefoy A., Musicki B. //
№ 8. С. 451; Levchenkov S.I., Shcherbakov I.N., Po-
Bioorg. Med. Chem. Lett. 1999. Vol. 9. N 14. P. 2079.
pov L.D., Vlasenko V.G., Suponitsky K.Yu., Tsatu-
doi 10.1016/S0960-894X(99)00329-7
ryan A.A., Lukov V.V., Kogan V.A. // Russ. J. Coord.
31. Rehman S.U., Chohan Z.H., Gulnazl F., Supuran C.T. //
Chem. 2014. Vol. 40. N 8. P. 523. doi 10.1134/
J. Enz. Inhib. Med. Chem. 2005. Vol. 20. N 4. P. 333.
S1070328414080041
doi 10.1080/14756360500141911
43. Власенко В.Г., Ураев А.И., Зубавичус Я.В., Черны-
32. Барачевский В.А., Карпов Р.Е., Венедиктова О.В.,
шев А.А., Гарновский А.Д., Мамин Р.К // Изв.
Валова Т.М., Строкач Ю.П., Мирошников В.С.,
АН. Сер. физ. 2008. Т. 72. № 4. С. 500; Vlasenko
Чибисова Т.А., Травень В.Ф. // Изв. АН. Сер. хим.
V.G., Uraev A.I., Zubavichus Ya.V., Chernyshov A.A.,
2005. Т. 54. № 10. С. 2350; Barachevsky V.A., Kar-
Garnovskii A.D., Mamin R.K.
// Bull. Russ. Acad.
pov R.E., Venediktova O.V., Valova T.V., Strokach Yu.P.,
Sci. Phys. 2008. Vol. 72. 4. P. 468. doi 10.3103/
Miroshnikov V.S., Chibisova T.A., Traven V.F. // Russ.
S1062873808040114
Chem. Bull. 2005. Vol. 54. N 10. P. 2425. doi 10.1007/
44. Funke H., Scheinhost A.C., Chukalina M. // Phys.
s11172-006-0132-3
Rev. (B). 2005. Vol. 71. P. 094110. doi 10.1103/
33. Захс Э.Р., Мартынова В.П., Эфрос Л.С. Теоретиче-
PhysRevB.71.094110
ские и прикладные вопросы химии гетероциклов.
45. Власенко В.Г., Попов Л.Д., Щербаков И.Н., Лу-
Рига: Зинатне, 1985. 128 с.
ков В.В., Левченков С.И., Панков И.В., Зуба-
34. Metelitsa A.V., Knyazhansky M.I., Ivanitsky V.V.,
вичус Я.В., Тригуб А.Л. // ЖСХ. 2017. Т. 58. № 6. С.
Nikolaeva O.I., Palchkov V.A., Panina A.P., Shele-
1274; Vlasenko V.G., Popov L.D., Shcherbakov I.N.,
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 9 2019
СИНТЕЗ И ФИЗИКО-ХИМИЧЕСКОЕ ИССЛЕДОВАНИЕ НОВЫХ МЕТАЛЛОКОМПЛЕКСОВ
1403
Lukov V.V., Levchenkov S.I., Pankov I.V., Zubavichus
Bloino J., Zheng G., Sonnenberg J.L., Hada M., Ehara M.,
Ya.V., Trigub A.L. // J. Struct. Chem. 2017. Vol. 58. N 6.
Toyota K., Fukuda R., Hasegawa J., Ishida M.,
P. 1226. doi 10.1134/S0022476617060221
Nakajima T., Honda Y., Nakai H., Vreven T.,
46. Паркер C.A. Фотолюминесценция растворов. М.:
Montgomery J.A., Peralta J.E., Ogliaro F., Bearpark M.,
Мир, 1972. С. 247.
Heyd J.J., Brothers E., Kudin K.N., Staroverov V.N.,
47. Chernyshov A.A., Veligzhanin A.A., Zubavichus Ya.V. //
Kobayashi R., Normand J., Raghavachari K., Ren-
Nucl. Instr. Meth. Phys. Res. (A). 2009. Vol. 603. P. 95.
dell A., Burant J.C., Iyengar S.S., Tomasi J., Cossi M.,
doi 10.1016/j.nima.2008.12.167
Rega N., Millam J.M., Klene M., Knox J.E.,
48. Newville M. // J. Synchrotron Rad. 2001. Vol. 8. P. 96.
doi 10.1107/S0909049500016290
Cross J.B., Bakken V., Adamo C., Jaramillo J.,
49. Zabinski S.I., Rehr J.J., Ankudinov A., Alber R.C. //
Gomperts R., Stratmann R.E., Yazyev O., Austin A.J.,
Phys. Rev. (B). 1995. Vol. 52. P. 2995. doi 10.1103/
Cammi R., Pomelli C., Ochterski J.W., Martin R.L.,
PhysRevB.52.2995
Morokuma K., Zakrzewski V.G., Voth G.A., Salva-
50. Becke A.D. // J. Chem. Phys. 1993. Vol. 98. N 7. P. 5648.
dor P., Dannenberg J.J., Dapprich S., Daniels A.D.,
doi 10.1063/1.464913
Farkas O., Foresman J.B., Ortiz J.V., Cioslowski J.,
51. Frisch M.J., Trucks G.W., Schlegel H.B., Scuseria G.E.,
Fox D.J. Gaussian 09, Revision A.02. 2009.
Robb M.A., Cheeseman J.R., G. Scalmani V.B.,
52. Tomasi J., Mennucci B., Cammi R. // Chem. Rev. 2005.
Mennucci B., Petersson G.A., Nakatsuji H., Carica-
to M., Li X., Hratchian H.P., A.F. Izmaylov,
Vol. 105. N 8. P. 2999. doi 10.1021/cr9904009.
Synthesis and Some Properties of New Metal Complexes
with Bis-Azomethine Based on 7-Hydroxy-4-methyl-
8-formylcoumarin and 1,3-Diaminopropan-2-ol
L. D. Popova, *, S. A. Borodkina, Yu. V. Revinskiib, I. N. Shcherbakova,
V. G. Vlasenkoc, and S. I. Levchenkova, b
a Southern Federal University, ul. Zorge 7, Rostov-on-Don, 344090 Russia
*e-mail: ldpopov@mail.ru
b Federal Research Center “Southern Scientific Center of the Russian Academy of Sciences”, Rostov-on-Don, Russia
c Scientific Research Institute of Physics, Southern Federal University, Rostov-on-Don, Russia
Received March 28, 2019; revised March 28, 2019; accepted April 14, 2019
The condensation of 7-hydroxy-4-methyl-8-formylcoumarin and 1,3-diaminopropan-2-ol yielded a new
bis-azomethine, based on which copper(II), nickel(II), zinc(II) metal chelates were synthesized. Structure and
properties of the obtained compounds were studied by spectral methods and quantum chemical calculations.
Keywords: Schiff base, 7-hydroxy-4-methyl-8-formylcoumarin, metal complexes, quantum chemical calcu-
lations, magnetochemistry
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 9 2019