ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2019, том 89, № 9, с. 1404-1413
УДК 541.49:546.98:547.859
СИНТЕЗ И СТРОЕНИЕ ХЛОРОКОМПЛЕКСА
ПАЛЛАДИЯ(II) С {[6-АМИНО-2-(БУТИЛСУЛЬФАНИЛ)-
ПИРИМИДИН-4-ИЛ]ОКСИ}УКСУСНОЙ КИСЛОТОЙ
© 2019 г. Л. Г. Голубятниковаa, Р. А. Хисамутдиновa,*, С. А. Грабовскийa,
Е. С. Мещеряковаb, Л. М. Халиловb, Н. Н. Кабальноваa, Ю. И. Муриновa
a Уфимский институт химии Уфимского федерального исследовательского центра Российской академии наук,
пр. Октября 69, Уфа, 450054 Россия
*e-mail: hisam@anrb.ru
b Институт нефтехимии и катализа Уфимского федерального исследовательского центра Российской академии
наук, Уфа, Россия
Поступило в Редакцию 3 апреля 2019 г.
После доработки 18 апреля 2019 г.
Принято к печати 6 июня 2019 г.
Методом лигандного замещения синтезирован хлорокомплекс палладия(II) с {[6-амино-2-(бутилсуль-
фанил)пиримидин-4-ил]окси}уксусной кислотой. Состав и строение координационного соединения
установлены по совокупности данных элементного анализа и спектроскопии. Координация {[6-ами-
но-2-(бутилсульфанил)пиримидин-4-ил]окси}уксусной кислоты осуществляется за счет образования
донорно-акцепторной связи иона палладия(II) с атомами азота в положении 1 пиримидиновых колец,
хлорид-ионы входят во внутреннюю координационную сферу комплекса PdCl2L2 - транс-бис({[6-ами-
но-2-(бутилсульфанил)пиримидин-4-ил]окси}гидроксиацетил)дихлоропалладия(II).
Ключевые слова: тетрахлоропалладат(II) лития, бис(бензонитрил)дихлоропалладий(II), {[6-амино-2-(бу-
тилсульфанил)пиримидин-4-ил]окси}уксусная кислота, транс-бис({[6-амино-2-(бутилсульфанил)пири-
мидин-4-ил]окси}гидроксиацетил)дихлоропалладий(II)
DOI: 10.1134/S0044460X19090130
Лечение онкологических заболеваний - одна
токсичны по сравнению с соединениями платины.
из наиболее актуальных задач современной ме-
Некоторые транс-комплексы палладия(II) превос-
дицины. Особое место среди методов лечения за-
ходят по активности цисплатин и соединения пал-
нимает химиотерапия. Противоопухолевые и ци-
ладия цис-конфигурации [3, 4].
тотоксические свойства соединений платиновых
Структурные аналоги пиримидиновых основа-
металлов стимулировали интенсивные исследова-
ний, входящие в состав молекул ДНК, использу-
ния с целью поиска и создания новых высокоэф-
ются как прекурсоры для создания новых видов
фективных препаратов на их основе. В настоящее
биологически активных соединений, обладающих
время ведущее место среди противоопухолевых
широким спектром действия, в том числе противо-
препаратов данного класса занимают лекарства
микробным, противовоспалительным, обезболи-
на основе комплексных соединений платины [1].
вающим, противовирусным [5-9], и принадлежа-
Учитывая токсичность и ограниченный спектр
щих к важной группе лекарственных препаратов,
действия комплексов платины, следует отметить
применяемых в онкологии.
прогресс в синтезе и изучении разнообразных ко-
Координационные соединения палладия(II)
ординационных соединений палладия и других
с функционализированными пиримидиновыми
платиноидов [2]. Комплексы палладия(II) облада-
основаниями, способными встраиваться в со-
ют высокой биологической активностью, но менее
ответствующие клеточные компоненты, могут
1404
СИНТЕЗ И СТРОЕНИЕ ХЛОРОКОМПЛЕКСА ПАЛЛАДИЯ(II)
1405
обладать высокой биологической активностью.
Таблица 1. Относительная энергия образования ком-
Ранее были синтезированы и изучены коорди-
плексов, рассчитанная методом TPSSTPSS/6-31+G(d,p)а
национные соединения производных урацила с
δΔG, ккал/моль
Донорный центр
некоторыми благородными металлами
[10-14].
лиганда
газовая фаза
ДМФА
Комплексообразование палладия(II) с произво-
дными урацила, содержащими атомы серы в по-
N1
0.0
0.0
ложениях 2 и 5, сопровождается образованием
N3
7.2
2.3
цис-комплексов с координационной связью се-
NH2
5.3
6.7
ра→палладий(II) [15].
SBu
5.7
7.2
Нами синтезирован новый транс-комплекс
хлоропалладия(II) с
{[6-амино-2-(бутилсульфа-
а Для атома палладия(II) использовали базисный набор
нил)пиримидин-4-ил]окси}уксусной
кислотой
LANL2TZ ECP (с псевдопотенциалом).
(L), координирующейся к металлу атомoм азота
N1 урацильного кольца. Сопряженные кратные
связи способствуют делокализации неподеленной
могут быть атомы азота аминогруппы и пири-
электронной пары на атоме серы в положении 2,
мидинового кольца, атом серы. Анализ заселен-
вследствие чего понижается ее донорная способ-
ностей орбиталей, выполненный для лиганда L с
ность к образованию координационной связи с
использованием метода TPSSTPSS/6-31+G(d,p),
атомом палладия [16]. Заместители урацильного
свидетельствует о снижении донорной способ-
кольца в положениях 2, 4 и 6 проявляют достаточ-
ности атомов серы, азота N3 и группы NH2, что
ную гибкость, позволяющую формировать межце-
связано с делокализацией их неподеленных
почечные аддукты с ДНК за счет нековалентных
электронных пар. Наименее делокализована
взаимодействий.
неподеленная электронная пара атома азота
{[6-Амино-2-(бутилсульфанил)пиримидин-
N1, что, по-видимому, и предопределяет его
4-ил]окси}уксусная кислота (L) впервые получена
участие в образовании координационной связи
щелочным гидролизом этил-{[6-амино-2-(бутил-
с атомом палладия(II). Для оценки наиболее
сульфанил)пиримидин-4-ил]окси}ацетата в среде
энергетически выгодного способа координации
этанола (схема 1).
лиганда к палладию(II) были выполнены расчеты
Потенциальными донорными атомами кислоты
относительной энергии образования комплексов
L при комплексообразовании с ионом палладия(II)
методом TPSSTPSS/6-31+G(d,p) в газовой фазе и
Схема 1.
O
O
O
O
EtO
Cs2CO3
HN
+
N
Br
ȾɆɎȺ
OEt
BuS
N
NH
49%
2
BuS
N
NH2
O
11
O
12
OH
3
4
5
NaOH
N
9
7
1
EtOH
S
2
N 6 NH2
91%
10
8
L
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 9 2019
1406
ГОЛУБЯТНИКОВА и др.
Таблица 2. Данные элементного анализа для {[6-амино-2-(бутилсульфанил)пиримидин-4-ил]окси}уксусной кисло-
ты и ее хлорокомплекса с палладием(II)
Найдено, %
Вычислено, %
Т. пл.,
Соединение
М
Формула
°С
С
Н
S
N
зола
Cl
С
Н
S
N
зола
Cl
L
265
257.31
46.6
5.9
12.4
16.3
-
-
C10H15N3O3S
46.7
5.9
12.5
16.3
-
-
PdCl2L2
133
692.00
способ а
33.2
3.9
8.9
12.4
18.8
10.2
C20H30Cl2N6O6PdS2
34.7
4.4
9.3
12.2
15.4
10.2
способ б
34.2
4.3
9.9
12.6
15.8
10.0
34.7
4.4
9.3
12.2
15.4
10.2
в растворе в ДМФА с учетом неспецифической
В спектре комплекса полосы поглощения
сольватации методом SMD (табл. 1). Комплекс
νas(NH2) и νs(NH2) аминогруппы смещаются
с координацией палладия(II) к атому азота N1
незначительно по сравнению с спектром кислоты
пиримидинового кольца энергетически наиболее
L. Положение полос поглощения валентных
устойчив как в газовой фазе, так и в ДМФА.
колебаний ν(СOOH), ν(С-О-С) и ν(С-S) не
изменяется. Полосы поглощения валентных
Хлорокомплекс палладия(II) с лигандом L
колебаний ν(С=N), а также комбинированных
синтезировали методом лигандного замещения,
колебаний группы NH2 и пиримидинового
используя два прекурсора иона Pd(II) (схема 2).
кольца кислоты L при 1566 и 1644 см-1 при
Продукты реакции представляют собой
комплексообразовании смещаются в дальнюю
порошкообразные желтые вещества, растворимые
область на
18 и
9 cм-1 соответственно. ИК
в ДМФА и ДМСО, ограниченно растворимые
спектры комплекса и кислоты L в дальней области
в метаноле, нерастворимые в воде и других
существенно различаются. В спектре комплекса
органических
растворителях.
Результаты
появляются две полосы поглощения при 510 и
элементного анализа представлены в табл.
2.
296 см-1, которые относятся, вероятно, к
При заданном отношении Pd:L = 1:1, независимо
валентным колебаниям ν(Pd-N) и ν(Pd-Cl)
от используемого прекурсора Pd(II), образуется
соответственно. Можно предположить, что в
соединение PdCl2L2.
комплексообразовании участвует один из атомов
Кристаллы, выращенные из раствора в
азота пиримидинового кольца, что не противоречит
ДМФА, были исследованы методами ИК, ЯМР
результатам работ [27, 28]. Одна сильная полоса
спектроскопии и рентгеноструктурного анализа.
валентных колебаний связи Pd-Cl при 296 см-1
Для установления способа координации кислоты
указывает на образование транс-конфигурации
L к Pd(II) и строения координационного узла
комплекса [22].
комплекса были записаны ЯМР и ИК спектры
В спектрах ЯМР 1Н комплекса по сравнению
лиганда и комплекса. Характеристические полосы
со спектром кислоты L наблюдается изменение
поглощения ИК спектров кислоты L и ее комплекса
положения сигналов протонов Н5 и Н7, которые
с хлоропалладием(II) приведены в табл. 3.
смещаются в слабое поле на 0.30 и 0.21 м. д.
Схема 2.
PdCl2(PhCN)2
O
CHCl3, 20oC
O
HO
PdCl2L2
N
Li2PdCl4
BuS
N
NH2
CH3OH, 50oC
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 9 2019
СИНТЕЗ И СТРОЕНИЕ ХЛОРОКОМПЛЕКСА ПАЛЛАДИЯ(II)
1407
Таблица 3. Характеристические полосы поглощения в ИК спектрах кислоты L и ее хлорокомплекса с палладием(II)
ν, см-1
Отнесение
L
PdCl
2
L2
ссылка
ν(О-Н)
3429 c
3451 с
[17]
νas(NH2)
3333 с
3340 с
[18, 19]
νs(NH2)
3226 ср
3185 сл
ν(С=О) в RCOOH
1724 ср
1730 с
[20]
δ(NH2) + колебания кольца
1644 с
1637 с
[21]
ν(С=С)
1599 с
1612 с
[17, 21, 22]
νas(COOH)
1588 с
1589 с
[21]
ν(С=N)
1566 с
1548 с
[18, 22, 23, 24]
νs(COOH)
1415 с
1447 с
[21]
νas(С-O-C)
1214 с
1207 с
[25, 26]
νs(С-O-C)
1071 с
1074 сл
ν(С-S)
718 cл
709 сл
[21, 23, 26]
ν(Pd-N)
510
[19, 23]
ν(Pd-Cl)
296
[18, 22]
Таблица 4. Химические сдвиги в спектрах ЯМР 13С (ДМФА-d7) кислоты L и ее комплекса с палладием(II)
δ, м. д.
Соединение
С2
C4
С5
С6
С7
С8
С9
С10
С11
С12
L
170.40
169.05
82.73
166.50
32.61
30.35
22.44
13.90
62.58
170.77
PdCl2L2
172.28
168.27
84.40
164.56
33.18
30.37
22.43
13.85
63.57
170.32
Δδ
1.88
-0.78
1.67
-1.94
0.57
0.02
-0.01
-0.05
0.99
-0.45
соответственно. Сигналы протонов группы NH2 в
ЯМР 13С при комплексообразовании связано,
спектре комплекса смещаются также в слабое поле
вероятно, смещением электронной плотности от
на 1.19 м. д. с одновременным уширением, что,
заместителей пиримидинового кольца к атому N1
возможно, связано с образованием водородной
и указывает на координацию лиганда L к иону
связи с атомом хлора.
металла донорным атомом азота в положении 1
пиримидинового кольца.
Химические сдвиги в спектрах ЯМР
13С
соединения L и комплекса приведены в табл. 4.
Данные ИК и ЯМР спектров полученного
В спектрах ЯМР 13С комплекса по сравнению
хлорокомплекса палладия(II) подтверждаются
со спектром кислоты L наибольшее изменение
результатами РСА. Рентгенодифракционные
химических сдвигов наблюдается для сигналов
исследования монокристаллов хлорокомплекса
атомов углерода в положениях 2 и 6 пиримидинового
палладия(II), полученного разными способами
кольца. Сигнал атома углерода С2 смещается в
показали, что их кристаллические решетки
слабое поле, а сигнал атома углерода С6 - в сильное
аналогичны. Согласно полученным данным,
поле. Изменение положения сигналов в спектрах
комплексное соединение палладия(II) кристалли-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 9 2019
1408
ГОЛУБЯТНИКОВА и др.
Таблица 5. Параметры кристалла и условия рентгеноструктурного эксперимента PdCl2L2
Параметр
Значение
Брутто-формула
C20H30Cl2N6O6PdS2
М
691.92
Температура, K
293(2)
Сингония
Моноклинная
Пространственная группа
P21/c
a, Å
11.7275(12)
b, Å
10.2548(5)
c, Å
12.3177(10)
β, град
100.708(10)
V, Å3
1455.6(2)
Z
2
dвыч, г/см3
1.579
μ, мм-1
1.009
F(000)
704.0
λ, Å
0.71073
2θ, град
5.206-58.946
Интервал измеренных индексов
-15 ≤ h ≤ 10, -12 ≤ k ≤ 13, -15 ≤ l ≤ 16
Измерено отражений
6729
Число наблюдаемых отражений с I ≥ 2σ(I)
3424
Число отражений используемых при уточнении/число уточняемых
3424/171
параметров
Параметр подгонки
1.089
Окончательные значения факторов расходимости для отражений
R1 = 0.0816, wR2 = 0.1747
с I ≥ 2σ(I)
Окончательные значения факторов расходимости для всех отражений
R1 = 0.1616, wR2 = 0.2116
Остаточная электронная плотность e, Å-3
2.52/-1.39
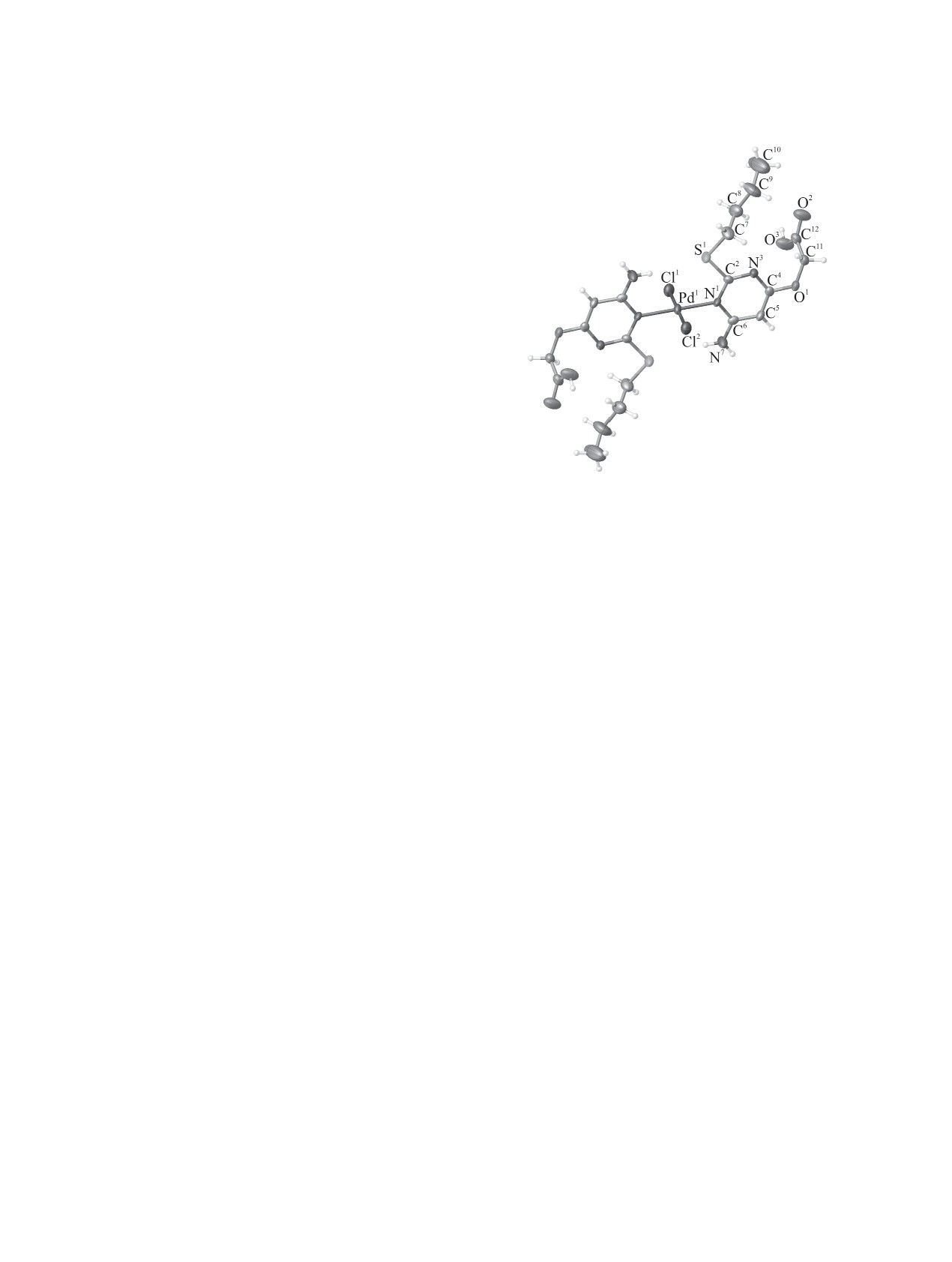
зуется в центросимметричной моноклинной
плоский квадрат. Гетероциклические фрагменты
кристаллической решетке (пространственная
лигандов лежат в одной плоскости. Длины противо-
группа Р21/с). Элементарная ячейка вмещает в себя
положных связей Pd-N и Pd-Cl эквивалентны и
половину молекулы (Z' = 0.5), так как ион металла
составляют 2.039 и 2.300 Å соответственно, что
находится в частном положении. Комплекс имеет
меньше ионных радиусов Шеннона (Pd-N 2.10,
моноядерное строение (см. рисунок, табл. 5), в
Pd-Cl 2.45 Å [29]). Углы при атоме Pd составляют
котором к атому палладия координированы два
89.41(4) и
90.59(4)°. Длины связей гетро-
атома хлора и два атома азота N1 двух лигандов
циклического фрагмента лиганда, а также расстоя-
L в транс-конфигурации. Координационное
ния C2-S1, C6-N7 и C4-O1 незначительно отличают-
окружение атома палладия представляет собой
ся от связей в аналогичных молекулах [30].
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 9 2019
СИНТЕЗ И СТРОЕНИЕ ХЛОРОКОМПЛЕКСА ПАЛЛАДИЯ(II)
1409
Сравнительная оценка цитотоксичности ком-
плекса по сравнению с цисплатином показала,
что комплекс по цитотоксичности (IC50 = 83.6±
3.9 мкM.) сравним с цисплатином (IC50 = 32.4±
2.4 мкM.), что делает перспективным дальнейшее
изучение его противоопухолевых свойств на раз-
личных линиях клеток, а также изучение избира-
тельности действия в отношении опухолевых и
нормальных клеток.
Таким образом, при взаимодействии тетрахло-
ропалладата(II) лития и бис(бензонитрил)дихло-
ропалладия(II) с
{[6-амино-2-(бутилсульфанил)
пиримидин-4-ил]окси}уксусной кислотой обра-
зуется комплекс транс-конфигурации PdCl2L2,
в котором координация лиганда осуществляется
за счет образования донорно-акцепторной связи
Общий вид молекулы транс-бис({[6-амино-2-(бутил-
иона палладия(II) с атомом азота в положении 1
сульфанил)пиримидин-4-ил]окси}уксусная кислота)
пиримидинового кольца, хлорид-ионы входят во
дихлоропалладия(II).
внутреннюю координационную сферу комплекса.
Атомы азота аминогруппы и N3 пиримидинового
60.6 (OCH2CH3), 62.0 (OCH2C), 81.9 (CH), 165.3
кольца, а также серы в комплексообразовании не
(CNH2), 167.6 (N=C-O), 168.7 (O=COH), 169.2
участвуют.
(N=C-S). Найдено, %: С 50.48; H 6.73; N 14.70;
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
S 11.19. C12H19N3O3S. Вычислено, %: С 50.51; H
ИК спектры регистрировали на спектрофото-
6.71; N 14.73; S 11.24.
метре Specord M80 в области 4000-250 см-1
{[6-Амино-2-(бутилcульфанил)пирими-
(вазелиновое масло, KRS-5). Спектры ЯМР
дин-4-ил]окси}уксусная кислота (L) получена
записывали на спектрометре Bruker Avance III [500
щелочным гидролизом соответствующего этило-
(1Н) и 125 МГц (13С)]. Температуры плавления
вого эфира. К раствору 5 г (15.5 ммоль) этил-{[6-
определяли на нагревательном столике Boеtius.
амино-2-(бутилсульфанил)пиримидин-4-ил]-
Этил-{[6-амино-2-(бутилсульфанил)пирими-
окси}ацетата в 70 мл этанола прибавляли 70 мл
дин-4-ил]окси}ацетат. К смеси 10 г (50.2 ммоль)
0.5 M. раствора гидроксида натрия. Взвесь переме-
2-бутилсульфанил-6-аминопиримидин-4(3H)-
шивали 4 ч при 40°С, затем раствор нейтрализовали
она [31] и 21.3 г (65.4 ммоль) Cs2CO3 в 100 мл
1 М. раствором HCl до pH = 3. Осадок отфильтро-
ДМФА в атмосфере аргона при 0 °С добавляли
вывали, промывали водой и перекристаллизовы-
по каплям в течение 20 мин 5.9 мл (53.2 ммоль)
вали из этанола. Выход 91%, т. пл. 265°С. Кислота
этилбромацетата. Через 5 ч раствор фильтровали,
L растворима в ДМСО, ДМФА, умеренно - в эта-
фильтрат упаривали при пониженном давлении,
ноле и метаноле. Спектр ЯМР 1H (ДМСО-d6), δ,
остаток перекристаллизовали из этанола. Выход
м. д.: 0.89 т (3H, CH3, J = 7.4 Гц), 1.38 секстет (2H,
49 %. Спектр ЯМР 1H (ДМСО-d6), δ, м. д.: 0.89 т
СH3CH2, J = 7.4 Гц), 1.58 квинтет (2H, SCH2CH2,
[3H, S(СH2)3CH3, J = 7.4 Гц], 1.18 т (3H, OСH2CH3,
J = 7.4 Гц), 2.95 т (2H, SCH2, J = 7.4 Гц), 4.73 с
J = 7.1 Гц), 1.38 септет (2H, СH3CH2CH2, J =
(2H, OCH2), 5.48 c (1H, CH), 6.72 c (2H, NH2), 12.85
7.4 Гц), 1.56 квинтет (2H, SCH2CH2, J = 7.4 Гц),
уш. с (1H, OH). Спектр ЯМР 13С (ДМСО-d6), δС,
2.93 т (2H, SCH2, J = 7.4 Гц), 4.122 к (2H, OCH2CH3,
м. д.: 13.6 (CH3), 21.5 (CH3CH2), 29.4 (SCH2), 31.5
J = 7.1 Гц), 4.810 с (2H, OCH2C), 5.50 с (1H, CH),
(SCH2CH2), 61.8 (NCH2), 81.9 (CH), 165.2 (CNH2),
6.76 с (2H, NH2). Спектр ЯМР 13С (ДМСО-d6),
167.7 (N=C-O), 169.1 (N=C-S), 170.1 (O=COH).
δС, м. д.:
13.6
[S(СH2)3CH3], 14.0 (OCH2CH3),
Спектр ЯМР 15N (ДМСО-d6), δN, м. д.: 83.2 (NH2),
21.5 (СH3CH2CH2), 29.3 (SCH2), 31.4 (SCH2CH2),
219.2, 230.8. Найдено, %: С 46.62; H 5.90; N 16.27;
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 9 2019
1410
ГОЛУБЯТНИКОВА и др.
S 12.44. C10H15N3O3S. Вычислено, %: С 46.68; H
нены с использованием программы Mercury [36].
5.88; N 16.33; S 12.46.
Кристаллографические характеристики и параме-
тры уточнения представлены в табл. 5. Координаты
транс-Бис({[6-амино-2-(бутилсульфанил)-
атомов комплекса и их температурные параметры
пиримидин-4-ил]окси}гидроксиацетил)дихло-
депонированы в Кембриджской базе кристалло-
ропалладий(II). а. В качестве прекурсора для
структурных данных (CCDC 1898784).
синтеза комплекса палладия(II) использовали те-
трахлоропалладат(II) лития Li2PdCl4 [32]. К су-
Квантово-химические расчеты выполнены с
спензии хлорида палладия (0.135 г) в 10 мл ме-
помощью пакета программ Gaussian 09 C.01 [37] c
танола прибавляли 0.065 г хлорида лития. Смесь
использованием метода TPSSTPSS [38] с комбини-
перемешивали 30 мин при 50°С до образования
рованным базисным набором, в котором для атома
темно-красного раствора комплекса Li2PdCl4. К
палладия применяли базисный набор LANL2TZ
полученному раствору (0.200 г, 0.760 ммоль) в ме-
ECP (с псевдопотенциалом) [39, 40], для осталь-
таноле прибавляли 0.196 г (0.760 ммоль) кислоты
ных атомов - 6-31+G(d,p). Все геометрические
L. При перемешивании реакционной смеси в те-
параметры молекул оптимизированы без ограни-
чение 2 ч постепенно образовывался желтый оса-
чения по симметрии. Природу оптимизированных
док, который отфильтровывали через бумажный
структур определяли с помощью анализа соб-
фильтр («синяя лента»), промывали метанолом
ственных значений матрицы Гессе - матрицы вто-
(3×20 мл) и сушили без нагревания. Выход 85%.
рых производных энергии по координатам, кото-
рые рассчитывали аналитически. Энергетические
б. Прекурсор бис(бензонитрил)дихлоропалла-
параметры рассчитывали на том же уровне теории.
дий(II) PdCl2(PhCN)2 получен известным методом
Рассчитанные энергии корректировали с учетом
[33]. Навеску 0.113 г (0.295 ммоль) PdCl2(PhCN)2
энергий нулевых колебаний для соответствующих
растворяли в 10 мл хлороформа. К полученно-
структур, взятых без поправочного коэффициен-
му раствору добавляли 10 мл раствора (0.076 г,
та. Неспецифическую сольватацию учитывали
0.295 ммоль) кислоты L в хлороформе. После пе-
с помощью модели SMD [41] реализованной в
ремешивания смеси в течение 2 ч образовавший-
Gaussian 09 с использованием настроек, заданных
ся желтый осадок отфильтровывали, промывали
по умолчанию.
гексаном (3×20 мл) для удаления бензонитрила и
сушили при комнатной температуре. Выход 78%.
Цитотоксичность комплекса1 исследовали на
линии MCF-7 клеток рака молочной железы че-
Комплексные соединения растворяли в ДМФА
ловека. Клетки культивировали в среде DMEM
и получали насыщенные растворы. При медленном
(Dulbecco’s Modified Eagle’s Medium), дополнен-
испарении растворителя (20°С, 1 атм) в течение
ной 10%-ной сывороткой плода коровы (FCS), пе-
2 нед из раствора выделялись блестящие игольча-
нициллином и стрептомицином. Цитотоксичность
тые ярко-желтые кристаллы, пригодные для РСА.
оценивали с использованием стандартного теста
Рентгеноструктурный анализ соединения вы-
МТТ [42]. Клетки высевали 1×103 клеток/лунку в
полняли на автоматическом четырехкружном
96-луночные планшеты. Через 24 ч культуральную
дифрактометре XCalibur Gemini Eos (графитовый
среду меняли на свежую, содержащую 2-кратные
монохроматор, MoKα-излучение, ω-сканирова-
серийные разведения производных (3 реплики;
ние, 2θmax = 62°), оснащенном пространственным
0.2-1000 мкмол/л; рН 7.4, фосфатно-солевой бу-
CCD-детектором. Первичную обработку данных
фер). Клетки, культивируемые без тестируемого
проводили с использованием программного ком-
соединения, были использованы в качестве кон-
плекса CrysAlisPro [34]. Структура расшифрована
троля. Клетки инкубировали с исследуемыми со-
прямым методом и уточнена методом наимень-
единениями 72 ч, затем выполняли стандартный
ших квадратов в полноматричном анизотропном
тест МТТ, согласно протоколу производителя те-
приближении по программе SHELX [35]. Атомы
водорода посажены геометрически и включе-
1 Исследование выполнено в Федеральном центре токсико-
ны в расчет с фиксированными позиционными и
логической, радиационной и биологической безопасности
температурными параметрами. Рисунки выпол-
(Казань).
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 9 2019
СИНТЕЗ И СТРОЕНИЕ ХЛОРОКОМПЛЕКСА ПАЛЛАДИЯ(II)
1411
ста. Значение концентрации, вызывающее 50%-
8. Pałasz А, Ciez D. // Eur. J. Med. Chem. 2015. Vol. 97.
ное ингибирование роста популяции клеток (IC50),
P. 582. doi 10.1016/j.ejmech.2014.10.008
оценивали на основе дозозависимых кривых с
9. Brulikova L., Hlavac J. // Beilstein J. Org. Chem. 2011.
использованием пакета программ Origin TM (p ≤
Vol. 7. P. 678. doi 10.3762/bjoc.7.80
0.05).
10. Хисамутдинов Р.А., Афзалетдинова Н.Г., Криво-
Авторы выражают благодарность центру
ногов В.П., Муринов Ю.И., Васильева Е.В. // ЖНХ.
коллективного пользования «Химия» Уфимского
1993. Т. 38. № 11. С. 1816. // Khisamutdinov R.A.,
института химии РАН за предоставленную
Afzaletdinova N.G., Krivonogov V.P., Murinov Yu.I. //
возможность проведения элементного анализа и
Russ. J. Inorg. Chem. 1993. Vol. 38. N 11. P. 1804.
ЯМР спектроскопических исследований и Центру
11. Пат. РФ 2035467 // Б. И. 20.05.95. № 14.
коллективного пользования «Агидель» Института
12. Пат. РФ 2028300 // Б. И. 09.02.95. № 4.
нефтехимии и катализа РАН за проведение
ренгеноструктурного анализа соединения.
13. Потапов В.В. Хисамутдинов Р.А., Кривоногов В.П.,
Муринов Ю.И., Спирихин Л.В., Уразбаев В.Н. //
ФОНДОВАЯ ПОДДЕРЖКА
ЖНХ. 2001. Т. 46. № 12. С. 1998; Khisamutdinov R.A.,
Potapov V.V., Krivonogov V.P., Murinov Yu.I., Spiri-
Работа выполнена в рамках научно-исследо-
khin L.V., Urazbaev V.N. // Russ. J. Inorg. Chem. 2001.
вательских работ Уфимского института химии РАН
Vol. 46. N 12. P. 1824.
(№ госрегистрации АААА-А17-117011910033-1,
14. Хисамутдинов Р.А., Муринов Ю.И., Байкова И.П. //
АААА-А17-117011910035-5) и Института нефте-
химии и катализа РАН
(№ госрегистрации
ЖHX. 2007. Т. 52. № 11. С. 1908; Khisamutdinov R.A.,
АААА-А19-119022290004-8).
Murinov Yu.I., Baikova I.P. // Russ. J. Inorg. Chem.
2007. Vol. 52. N 11. P. 1798. doi 10.1134/
КОНФЛИКТ ИНТЕРЕСОВ
S0036023607110265
15. Голубятникова Л.Г., Хисамутдинов Р.А., Грабов-
Авторы заявляют об отсутствии конфликта ин-
ский С.А., Кабальнова Н.Н., Муринов Ю.И. // ЖОХ.
тересов.
2017. Т. 87. Вып. 1. С. 123; Golubyatnikova L.G.,
СПИСОК ЛИТЕРАТУРЫ
Khisamutdinov R.A., Grabovskii S.A., Kabal’nova N.N.,
Murinov Y.I. // Russ. J. Gen. Chem. 2017. Vol. 87. N 1.
1. Florio D., Malfitano A.M., Somma S.D., Mügge C.,
P. 117. doi 10.1134/S1070363217010182
Weigand W., Ferraro G., Iacobucci I., Monti M., Mo-
16. Мазалов Л.Н. // ЖСХ. 2003. Т. 44. № 11. С. 7;
relli G., Merlino A., Marasco D. // Int. J. Mol. Sci. 2019.
Mazalov L.N. // J. Struct. Chem. 2003. Т. 44. N 1. P. 1.
Vol. 20. P. 829. doi 10.3390/ijms20040829
doi 10.1023/A:1024902712590
2. Стеценко А.И., Преснов М.А., Коновалова А.Л. // Усп.
17. Hueso-Urefia F., Moreno-Carretero M.N., Salas-
хим. 1981. Т. 50. № 4. С. 68; Stetsenko A.I., Presnov
Peregrh J.M., Alvarez de Cienhegos-Lcipez G. // J.
M., Konovalova A.L. // Russ. Chem. Rev. 1981. Vol. 50.
Inorg. Biochem. 1991. Vol. 43. P. 17.
N 4. P. 353. doi 10.1070/RC1981v050n04ABEH002605
18. Mostafa S.I., El-Morsy F.A., Butler I.S. // Inorg. Chem.
3. Mohammed L.S., Hamza I.S., AL-Deen F.M., Muhyedeen
Ind. J. 2014. Vol. 9. N 1. P. 15.
R.J. // J. Applicable Chem. 2014. Vol. 3. N 5. P. 2102.
19. Ajibade P.A., Idemudia O.G. // Bioinorg. Chem. Appl.
4. Muhyedeen R.J., A-Ali Drea A. // J. Multifunct. Mater.
2013. P. 1. doi 10.1155/2013/549549
Photosci. 2014. Vol. 5. N 1. P. 1.
20. Khan B.T., Rounaq Ali Khan S., Annapoorna K. // Ind.
5. Mohamed S.F., Flefel E.M., Amr A.E., Abd El-
J. Chem. (А). 1995. Vol. 34. P. 878.
Shafy D.N. // Eur. J. Med. Chem. 2010. Vol. 45. N 4.
21. Kolawole G.A., Adeyemo A.O. // Synth. React. Inorg.
P. 1494. doi 10.1016/j.ejmech.2009.12.057
Met.-Org. Chem. 1992. Vol. 22. N 8. P. 1073. doi
6. Dhorajiya B.D., Malani M.H., Patel J.R., Dholakiya B.Z. //
10.1080/15533179208020253
Pharma Chemica. 2012. Vol. 4. N 1. P. 141.
22. Gutiérrez M.D., López R., Romero M.A., Salas J.M. //
7. Upadhyay D.N., Ram V.J. // Ind. J. Chem. (B). 1999.
Can. J. Chem. 1988. Vol. 66. N 2. P. 249. doi 10.1139/
Vol. 38. N 2. P. 173.
v88-042
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 9 2019
1412
ГОЛУБЯТНИКОВА и др.
23. Abou-Melha K.S. // Spectrochim. Acta. Part A:
36. Macrae C.F., Edgington P.R., McCabe P., Pidcock E.,
Molecular and Biomolecular Srectro. 2012. Vol. 97.
Shields G.P., Taylor R., Towler M., Streek J. // J.
P. 6. doi 10.1016/j.saa.2012.05.017.
Appl. Cryst. 2006. Vol. 39. P. 453. doi 10.1107/
S002188980600731X
24. Mlahi M.R., Mostafa M.M. // Inorg. Chem. Ind. J. 2017.
Vol. 12. N 2. P. 1.
37. Frisch M.J., Trucks G.W., Schlegel H.B., Scuseria G.E.,
25. Comprehensive analytical chemistry / Ed. G. Svehla.
Robb M.A., Cheeseman J.R., Scalmani G., Barone V.,
Amsterdam; Oxford; New York: Elsevier Scientific
Mennucci B., Petersson G.A., Nakatsuji H., Caricato M.,
Publishing Company, 1976. Vol. 6. 555 p.
Li X., Hratchian H.P., Izmaylov A.F., Bloino J., Zheng G.,
Sonnenberg J.L., Hada M., Ehara M., Toyota K., Fukuda
26. Ponticelli G., Spanu A., Cocco M.T., Onnis V. // Trans.
R., Hasegawa J., Ishida M., Nakajima T., Honda Y.,
Met. Chem. 1999. Vol. 24. P. 370.
Kitao O., Nakai H., Vreven T., Montgomery J.A.,
27. Mohamed T.A., Shaaban I.A., Farag R.S., Zoghaib W.M.,
Jr., Peralta J.E., Ogliaro F., Bearpark M., Heyd J.J.,
Afifi M.S. // Spectrochim. Acta(A). 2015. Vol. 135. P.
Brothers E., Kudin K.N., Staroverov V.N., Keith T.,
417. doi 10.1016/j.saa.2014.07.018
Kobayashi R., Normand J., Raghavachari K., Rendell A.,
28. Ajibade P.A., Idemudia O.G. // Bioinorg. Chem. Appl.
Burant J.C., Iyengar S.S., Tomasi J., Cossi M., Rega N.,
2013. P. 1. doi 10.1155/2013/549549
Millam J.M., Klene M., Knox J.E., Cross J.B., Bakken V.,
29. Shannon R.D. // Acta Crystallogr. (A). 1976. Vol. 32.
Adamo C., Jaramillo J., Gomperts R., Stratmann R.E.,
P. 751. doi 10.1107/S0567739476001551
Yazyev O., Austin A.J., Cammi R., Pomelli C., Ochter-
30. Quijano M.L., Cobo J., Nogueras M., Low J.N. // Acta
ski J.W., Martin R.L., Morokuma K., Zakrzewski V.G.,
Crystallogr. (E). 2006. Vol. 62. P. 3142. doi 10.1107/
Voth G.A., Salvador P., Dannenberg J.J., Dapprich S.,
S1600536806024536
Daniels A.D., Farkas O., Foresman J.B., Ortiz J.V.,
Cioslowski J., Fox D.J., Gaussian 09, Revision C.01,
31. Marchetti F., Sayle K.L., Bentley J., Clegg W.,
Inc., Wallingford CT.
Curtin N.J., Endicott J.A., Golding B.T., Griffin R.J.,
Haggerty K., Harrington R.W., Mesguiche V., Ne-
38. Tao J., Perdew J.P., Staroverov V.N., Scuseria G.E. //
well D.R., Noble M.E.M., Parsons R.J., Pratt D.J.,
Phys. Rev. Lett. 2003. Vol. 91. P.146401. doi 10.1103/
Wang L.Z., Hardcastle I.R. // Org. Biomol. Chem. 2007.
PhysRevLett.91.146401
Vol. 5. N 10. P. 1577. doi 10.1039/B703241B
39. Hay P.J., Wadt W.R. // J. Chem. Phys. 1985. Vol. 82.
32. Гурьева Я.А., Залевская О.А., Алексеев И.А., Слепу-
P. 270. doi 10.1063/1.448799
хин П.А., Кучин А.В. // ЖОрХ. 2018. Т. 54. Вып. 9.
40. Schuchardt K.L., Didier B.T., Elsethagen T., Sun L.,
С. 1274; Gur’eva Ya.A., Zalevskaya O.A., Alekseev I.A.,
Gurumoorthi V., Chase J., Li J., Windus T.L. // J. Chem.
Slepukhin P.A., Kutchin A.V. // Russ. J. Org. Chem. 2018.
Inf. Model. 2007. Vol. 47. N 3. P.1045. doi 10.1021/
Vol. 54. N 9. P. 1285. doi 10.1134/S1070428018090026
ci600510j
33. Szłyk E., Barwiołek M. // Thermochim. Acta. 2009.
41. Marenich A.V., Cramer C.J., Truhlar D.G. // J. Phys.
Vol. 495. P. 85. doi 10.1016/j.tca.2009.06.002
Chem. (B). 2009. Vol. 113. N. 18. P.6378. doi 10.1021/
34. Technologies A., CrysAlisPRO. 2012: Yarnton,
jp810292n
Oxfordshire, England.
42. Mather J.P., Roberts P.E. Introduction to cell and tissue
35. Sheldrick G.M. // Acta Crystallogr. (A). 2008. Vol. 64.
culture. Theory and technique. New York: Plenum
P. 112. doi 10.1107/S0108767307043930
Press, 1998. P. 241.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 9 2019
СИНТЕЗ И СТРОЕНИЕ ХЛОРОКОМПЛЕКСА ПАЛЛАДИЯ(II)
1413
Synthesis and Structure of Palladium(II) Chloro Complex
with {[6-Amino-2-(butylsulfanyl)pyrimidin-4-yl]oxy}acetic Acid
L. G. Golubyatnikovaa, R. A. Khisamutdinova, *, S. A. Grabovskiia,
E. S. Meshcheryakovab, L. M. Khalilovb, N. N. Kabalnovaa, and Yu. I. Murinova
a Ufa Institute of Chemistry, Ufa Federal Research Center of the Russian Academy of Sciences,
pr. Oktyabrya 69, Ufa, 450054 Russia
*e-mail: hisam@anrb.ru
b Institute of Petrochemistry and Catalysis, Ufa Federal Research Center of the Russian Academy of Sciences, Ufa, Russia
Received April 3, 2019; revised April 18, 2019; accepted June 6, 2019
Using the ligand substitution method, the palladium(II) chloro complex with {[6-amino-2-(butylsulfanyl)-
pyrimidin-4-yl]oxy}acetic acid was synthesized. Composition and structure of the coordination compound
were established by the combination of elemental analysis and spectroscopy data. The coordination of {[6-ami-
no-2-(butylsulfanyl)pyrimidin-4-yl]oxy}acetic acid is carried out by the formation of a donor-acceptor bond
of the palladium(II) ion with the nitrogen atoms in position 1 of the pyrimidine rings, chloride ions enter the
inner the coordination sphere of the PdCl2L2 complex, trans-bis({[6-amino-2-(butylsulfanyl)pyrimidin-4-yl]-
oxy}hydroxyacetyl)dichloropalladium(II).
Keywords: lithium tetrachloropalladate(II), bis(benzonitrile)dichloropalladium(II), {[6-amino-2- (butylsulfa-
nyl)pyrimidin-4-yl]oxy}acetic acid, trans-bis({[6-amino-2-(butylsulfanyl)pyrimidin-4-yl]oxy}hydroxyacetyl)
dichloropalladium(II)
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 9 2019