ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2019, том 89, № 9, с. 1414-1419
УДК 546.185;547.551.2;547.53.024;548.312.3
СИНТЕЗ И СТРОЕНИЕ
ГЕКСАХЛОРОПЛАТИНАТНЫХ КОМПЛЕКСОВ
© 2019 г. А. Р. Ткачёваa, *, В. В. Шарутинa, О. К. Шарутинаa, П. А. Слепухинb
a Национальный исследовательский Южно-Уральский государственный университет,
пр. Ленина 76, Челябинск, 454080 Россия
*e-mail: aesya@mail.ru
b Институт органического синтеза имени И. Я. Постовского
Уральского отделения Российской академии наук, Екатеринбург, Россия
Поступило в Редакцию 19 марта 2019 г.
После доработки 19 марта 2019 г.
Принято к печати 23 марта 2019 г.
Взаимодействием хлоридов тетраорганилфосфония и триметиламмония с гидратом гексахлоропла-
тиноводородной кислоты в растворе ацетонитрил-диэтилсульфоксид синтезированы комплексы
[Ph3PCH=CHCH3]2[PtCl6], [Ph3PCH2OCH3]2[PtCl6] и [Me3NH]2[PtCl6]. Строение полученных комплексов
платины изучено методом рентгеноструктурного анализа.
Ключевые слова: хлорид (пропенил)трифенилфосфония, хлорид (метоксиметил)трифенилфосфония,
хлорид триметиламмония гексахлороплатиноводородная кислота, ацетонитрил
DOI: 10.1134/S0044460X19090142
Разработка противоопухолевых и цитотоксиче-
ектами для изучения реакций лигандного обмена
ских препаратов платины является одной из глав-
[14-18]. Например, в растворах тетрахлоро- и гек-
ных задач в области исследований лекарственных
сахлороплатинатов тетраорганилфосфония в ди-
веществ на основе металлорганических соедине-
метилсульфоксиде происходит замещение одного
ний уже в течение нескольких десятилетий [1-3].
из атомов хлора на молекулу S-координированного
Платиновые комплексы проявляют каталитиче-
ДМСО [19, 20].
ские свойства. Так, в их присутствии происходит
В настоящей работе изучена возможность об-
гидросилилирование стирола и его производных
мена лигандов в гексахлороплатинатном анионе.
разнообразными гидросиланами [4, 5] и окисление
Нами установлено, что взаимодействие хлоридов
алкинов кислородом воздуха по тройной связи до
(пропенил)трифенилфосфония, (метоксиметил)-
дикарбонильных соединений [6, 7].
трифенилфосфония и триметиламмония с гек-
Известно, что платина имеет малое сродство
сахлороплатиноводородной кислотой в ацетони-
к кислородным лигандам и легко связывает-
триле с добавлением диэтилсульфоксида (deso)
ся с аминами, сульфидами и фосфинами [8-10].
(мольное соотношение реагентов 1:1:2) сопрово-
Исследование устойчивых комплексов платино-
ждается образованием комплексов 1-3 (схема 1).
вых металлов с органическими лигандами являет-
Следуетотметить,чтореакциикомплексообразо-
ся важным как с точки зрения фундаментальной
вания, проводимые в присутствии диалкил-
науки, так и в связи с их практической ценностью
сульфоксида, часто сопровождаются лигандным
[11]. Так вариация и количество лигандов, коор-
обменом с вхождением в координационную
динированных к атому платины, позволяют моде-
сферу
катиона
платины
молекулы
лировать и повышать противоопухолевую актив-
диалкилсульфоксида. Ранее мы синтезировали
ность [12, 13]. Также комплексы платины с орга-
и структурно идентифицировали диэтилсуль-
ническими лигандами являются удобными объ-
фоксидопентахлороплатинаты
тетраорганил-
1414
СИНТЕЗ И СТРОЕНИЕ ГЕКСАХЛОРОПЛАТИНАТНЫХ КОМПЛЕКСОВ
1415
Схема 1.
deso
[Ph3PR]Cl + H2[Ptɋl6]
o
[Ph3PR]2[PtCl6] + 2HCl,
1, 2
R = CH=CHCH3 (1), CH2OCH3 (2).
deso
[Me3NH]Cl + H2[Ptɋl6]
o [Me3NH][PtCl6] + 2HCl
3
аммония и -фосфония путем замещения одного из
углы СlPtCl в комплексах 1-3 практически равны
атомов хлора на молекулу S-координированного
теоретическому значению [179.999(2)-180.0° (1),
диэтилсульфоксида [21].
180.0° (2), 179.2(1)-179.7(2)° (3)], цис-углы состав-
ляют 88.29(7)-91.07(7)° (1), 89.37(10)-90.63(10)°
Комплексы 1-3 представляют собой оранже-
(2), 88.82(17)-91.09(12)° (3). Расстояния Pt-Cl ва-
вые кристаллы, выход которых составил 83, 78
рьируются в пределах 2.324(2)-2.3497(16) Å (1),
и 76% соответственно. Методом рентгенострук-
2.332(3)-2.343(3) Å (2), 2.317(5)-2.334(3) Å (3) и
турного анализа (РСА) установлено строение
близки к суммам ковалентных радиусов указан-
комплексов 1-3. Кристаллографические данные
ных атомов (2.35 Å [22]).
и основные параметры уточнения для соедине-
ний 1-3 приведены в табл. 1. По данным РСА,
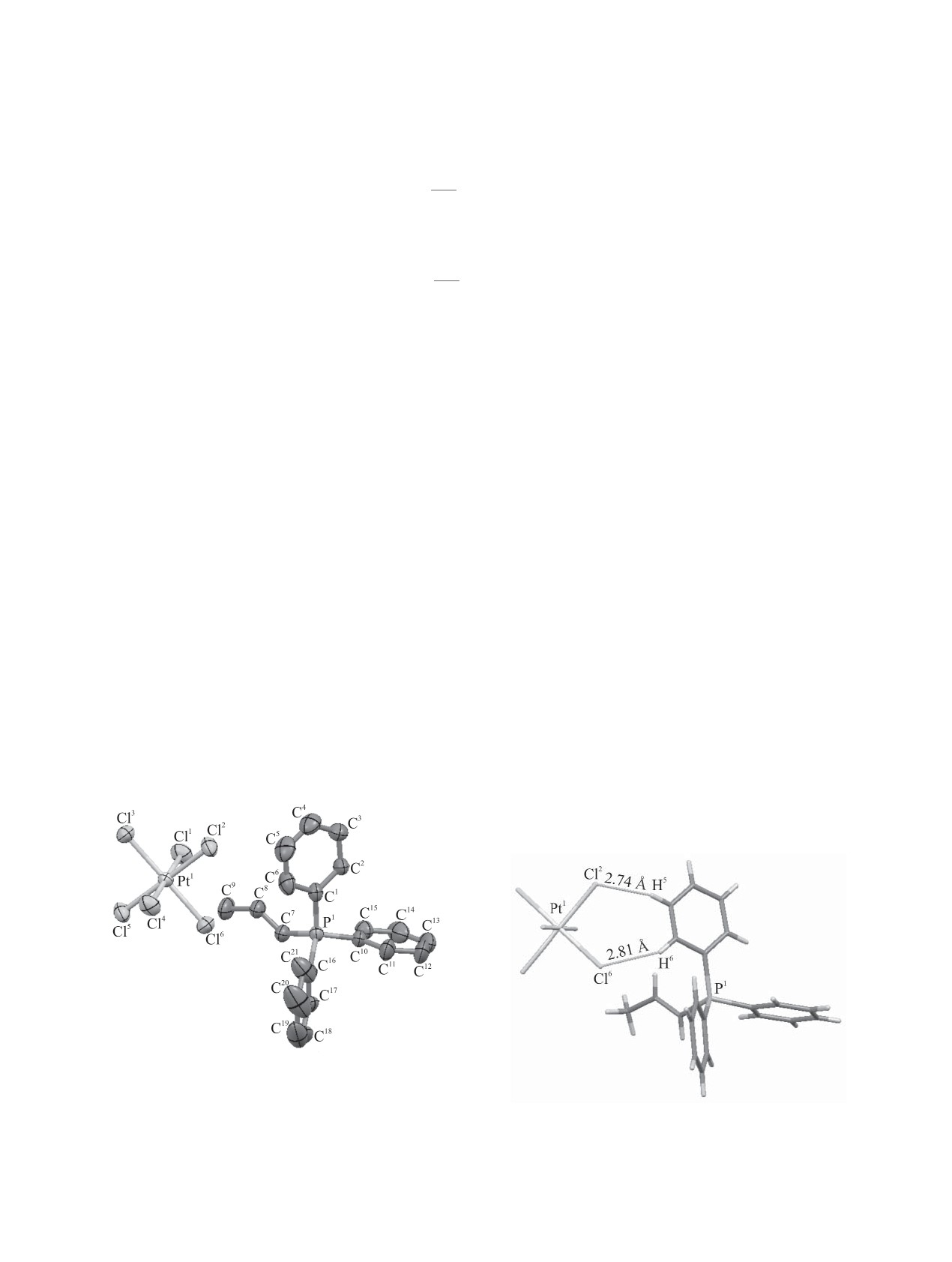
Анионы и катионы в комплексах 1-3 образуют
атомы фосфора и азота в катионах имеют мало
цепочки, ориентированные вдоль кристаллогра-
искаженное тетраэдрическое окружение (рис. 1).
фической оси с, связанные между собой водород-
Значения валентных углов СРС и CNC в 1-3
ными связями (рис. 2). В кристаллах комплексов
приближаются к идеальному тетраэдрическому
1, 2 цепочки из анионов не связаны друг с другом
[107.34(11)-113.71(12)° (1), 107.2(4)-112.3(3)° (2),
и чередуются с катионами [расстояния C5-H…Cl2
109.0(16)-115(3)° (3)] (табл. 2). Расстояния P-С
2.74 Å, C6-H…Cl6 2.81 Å (1), C5-H…Cl3 2.81 Å,
[1.787(2)-1.816(3) Å (1), 1.791(7)-1.842(8) Å (2)]
C6-H…Cl1 2.93 Å (2)] (рис. 3). В кристалле ком-
близки к сумме ковалентных радиусов атомов
плекса 1 каждый катион имеет короткие контакты
фосфора и углерода (1.88 Å [22]), расстояния N-C
с тремя анионами, в молекуле комплекса 2 - с че-
1.44(3)-1.49(2) Å в молекуле комплекса 3 близки
тырьмя анионами. В кристалле комплекса 3 каж-
между собой. В октаэдрических анионах транс-
дый анион связан с двумя катионами водородными
Рис. 1. Общий вид молекулы (пропенил)трифенил-
фосфонийгексахлороплатината 1 в кристалле (атомы
показаны в виде термальных эллипсоидов для вероят-
Рис. 2. Водородные связи типа Cl∙∙∙H-C в кристалле
ности 50%).
комплекса 1.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 9 2019
1416
ТКАЧЁВА и др.
Таблица 1. Кристаллографические данные, параметры эксперимента и уточнения структуры комплексов 1-3
Параметр
1
2
3
М
1014.47
1022.45
528.03
Сингония
Триклинная
Триклинная
Ромбическая
Пространственная группа
P1-
P1-
Pnma
a, Å
10.350(8)
10.272(12)
19.243(11)
b, Å
10.658(9)
10.422(15)
9.857(5)
c, Å
10.761(11)
10.800(13)
10.065(5)
α, град
68.01(4)
79.51(5)
90.00
β, град
81.95(5)
69.40(5)
90.00
γ, град
74.89(4)
74.22(7)
90.00
V, Å3
1061.5(16)
1037(2)
1909(18)
Z
1
1
8
dвыч, г/см3
1.587
1.638
3.674
μ, мм-1
3.787
3.882
16.339
F(000)
502.0
506.0
2000.0
Размер кристалла, мм
0.32 × 0.38 × 0.64
0.42 × 0.32 × 0.2
0.43 × 0.39 × 0.08
Область сбора данных по θ, град
5.44-111.1
6.02-69.14
5.78-82.5
Интервалы индексов отражений
-22 ≤ h ≤ 22,
-16 ≤ h ≤ 16,
-35≤ h ≤ 31,
-22 ≤ k ≤ 22,
-16 ≤ k ≤ 16,
-18 ≤ k ≤ 18,
-22 ≤ l ≤ 22
-16 ≤ l ≤ 16
-17 ≤ l ≤ 18
Измерено отражений
182104
55535
63676
Rint
0.0804
0.0580
0.0930
Независимых отражений
22084
8426
6590
Переменных уточнения
233
246
83
GOOF
0.983
1.065
1.105
R-Факторы по
R1 = 0.0428,
R1 = 0.0635,
R1 = 0.0999,
F2 > 2σ(F2)
wR2 = 0.0799
wR2 = 0.1604
wR2 = 0.3098
R-Факторы по всем отражениям
R1 = 0.1312,
R1 = 0.0813,
R1 = 0.1334,
wR2 = 0.1028
wR2 = 0.1765
wR2 = 0.33042
Остаточная электронная плотность
0.62/-2.33
5.87/-4.29
9.70/-6.28
(min/max), e/A3
связями [расстояние N1-H…Cl(2) 2.59 Å, N1-H…Cl6
Таким образом, взаимодействие хлоридов те-
2.59 Å, N2-H…Cl4 2.66 Å, N2-H…Cl2 2.73 Å,
траорганилфосфония, триметиламмония с гек-
N2-H…Cl5 2.73 Å]. В катионе комплекса 3 одна ме-
сахлороплатиноводородной кислотой в растворе
тильная группа разупорядочена по двум позициям.
ацетонитрила с добавлением диэтилсульфоксида
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 9 2019
СИНТЕЗ И СТРОЕНИЕ ГЕКСАХЛОРОПЛАТИНАТНЫХ КОМПЛЕКСОВ
1417
Таблица 2. Основные длины связей и валентные углы в молекулах комплексов 1-3
Связь
d, Å
Угол
ω, град
1
Pt1-Cl1
2.3352(15)
Cl2Pt1Cl5
180.0
Pt1-Cl4
2.3351(15)
Cl1Pt1Cl4
179.999(2)
Pt1-Cl2
2.3496(17)
Cl3Pt1Cl6
180.0
Pt1-Cl3
2.324(2)
Cl1Pt1Cl2
90.94(6)
Pt1-Cl6
2.324(2)
Cl1Pt1Cl5
89.06(6)
P1-C1
1.816(1)
Cl4Pt1Cl3
91.07(7)
P1-C11
1.798(2)
Cl3Pt1Cl1
88.93(7)
P1-C21
1.798(2)
Cl3Pt1Cl2
90.71(7)
P1-C7
1.787(2)
C21P1C7
107.10(12)
C7-C8
1.321(3)
C11P1C7
110.52(11)
C8-C9
1.496(3)
C1P1C7
109.16(10)
C11P1C1
108.98(11)
C11P1C21
107.34(11)
C21P1C1
113.71(12)
2
Pt1-Cl1
2.343(3)
Cl1Pt1Cl5
90.63(10)
Pt1-Cl2
2.334(3)
Cl1Pt1Cl3
90.17(12)
Pt1-Cl3
2.332(3)
Cl1Pt1Cl2
89.37(10)
Pt1-Cl4
2.343(3)
Cl1Pt1Cl4
180.0
Pt1-Cl5
2.334(3)
Cl3Pt1Cl4
89.83(12)
Pt1- Cl6
2.332(3)
Cl3Pt1Cl2
89.43(10)
P1-C21
1.809(6)
Cl6Pt1Cl3
180.0
P1-C11
1.791(7)
Cl2Pt1Cl5
180.0
P1-C7
1.842(8)
C21P1C7
110.5(4)
P1-C1
1.798(7)
C1P1C21
110.0(3)
C7-O1
1.355(15)
C1P1C7
107.2(4)
C8-O1
1.355(18)
C11P1C1
112.3(3)
C11P1C21
108.7(3)
C11P1C7
108.2(4)
C7O1C8
119.4(15)
3
Pt1-Cl1
2.318(3)
Cl2Pt1Cl1
91.09(12)
Pt1-Cl2
2.334(3)
Cl2Pt1Cl4
89.80(13)
Pt1-Cl3
2.317(5)
Cl6Pt1Cl2
88.82(17)
Pt1-Cl4
2.318(3)
Cl3Pt1Cl4
179.7(2)
Pt1-Cl5
2.334(3)
Cl3Pt1Cl1
90.83(14)
Pt1-Cl6
2.368(5)
Cl3Pt1Cl2
90.00(14)
N1-C2
1.44(3)
Cl6Pt1Cl1
179.16(12)
N1-C1
1.486(19)
Cl2Pt1Cl5
179.17(12)
N1-C3
1.486(19)
C2N1C3
109.8(12)
N2-C4
1.48(2)
C2N1C1
109.8(12)
N2-C5
1.48(2)
C1N1C3
112(2)
N2-C6
1.51(3)
C4N1C5
115(3)
C6N1C5
109.0(16)
C6N1C4
109.0(16)
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 9 2019
1418
ТКАЧЁВА и др.
полученной смеси добавляли 0.2 мл диэтилсуль-
фоксида. Раствор концентрировали до объема
0.5 мл, образовавшиеся кристаллы фильтровали и
сушили. Выход 84 мг (83%), оранжевые кристаллы,
т. пл. 211°С. ИК спектр, ν, см-1: 3056, 2998, 2979,
2360, 1635, 1610, 1484, 1435, 1371, 1314, 1260,
1189, 1171, 1114, 998, 966, 816, 749, 720, 690, 540,
506. Найдено, %: С 49.61; Н 3.99. C42H40P2Cl6Pt.
Вычислено, %: С 49.70; Н 3.94. C42H40P2Cl6Pt.
Рис. 3. Упаковка катионов и анионов в кристалле ком-
Комплексы 2 и 3 получали аналогично.
плекса 1.
[Ph3PCH2OCH3]2[PtCl6] (2). Выход 78%, оран-
жевые кристаллы, т. пл. 184°С. ИК спектр, ν, см-1:
не сопровождается лигандным обменом в анионе,
3053, 2930, 1436, 1112, 758, 688, 530, 501. Найдено,
продуктами реакций являются гексахлороплати-
%: С 46.79; Н 4.03. C40H40P2Cl6PtO2. Вычислено,
наты тетраорганилфосфония, триметиламмония.
%: С 46.97; Н 3.91. C40H40P2Cl6PtO2.
Геометрические параметры координационных
[(CH3)3NH]2[PtCl6] (3). Выход 76%, оранжевые
узлов атомов платины в анионах [PtCl6]2- имеют
кристаллы, т. пл. 208°С. ИК спектр, ν, см-1: 2987,
близкие значения.
2940, 2908, 1717, 1654, 1557, 1455, 1406, 1374, 1309,
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
1280, 1183, 1144, 1068, 1003, 966, 783, 765, 700,
Pt.
485. Найдено, %: С 13.55; Н 3.84. C6H20N2Cl6
ИК спектры записывали на ИК спектрометре
Вычислено, %: С 13.63; Н 3.79. C6H20N2Cl6Pt.
Shimadzu IRAffinity-1S в таблетках KBr в обла-
сти 4000-400 см-1. Рентгеноструктурный анализ
ФОНДОВАЯ ПОДДЕРЖКА
проводили на дифрактометре Bruker D8 QUEST
Работа выполнена при финансовой поддержке
(MoKα-излучение, λ = 0.71073 Å, графитовый мо-
Министерства образования и науки РФ (грант №
нохроматор) при 296(2) K. Структуры расшифро-
4.6151.2017/8.9).
ваны прямым методом. Позиции и температур-
ные параметры неводородных атомов уточнены в
КОНФЛИКТ ИНТЕРЕСОВ
изотропном, а затем в анизотропном приближении
полноматричным МНК. Атомы водорода помеще-
Авторы заявляют об отсутствии конфликта ин-
ны в геометрически рассчитанные положения и
тересов.
включены в уточнение по модели наездника. Сбор,
СПИСОК ЛИТЕРАТУРЫ
редактирование данных и уточнение параметров
элементарной ячейки, а также учет поглощения
1. Cubo L., Quiroga A.G., Zhang J. // J. Chem. Soc. Dalton
проведены по программам SMART и SAINT-Plus
Trans. 2009. P. 3457. doi 10.1039/b819301k
[23]. Все расчеты по определению и уточнению
2. Johnstone T.C., Suntharalingam K., Lippard S.J. //
структур выполнены по программам SHELXL/PC
Chem. Rev. 2016. Vol. 116. P. 3436. doi 10.1021/acs.
[24] и OLEX2 [25]. Полные таблицы координат
chemrev.5b00597.
атомов, длин связей и валентных углов депониро-
ваны в Кембриджском банке структурных данных
3. Крылова Л.Ф., Матвеева Л.М. // ЖСХ. 2005. Т. 46.
[CCDC 1877554 (1), 1880723 (2), 1880846 (3)].
№ 1. С. 77; Krylov L.F., Matveeva L.M. // J. Struct.
Chem. 2005. Vol. 45. N 1. P. 75. doi 10.1007/s10947-
Синтез [Ph3PCH=CHCH3]2[PtCl6] (1). Раствор
006-0011-7
68 мг (0.1 ммоль) хлорида аллилтрифенилфосфо-
ния в 4 мл ацетонитрила приливали к раствору
4. Елисеева А.А., Спевак В.Н., Калинин А.В., Сквор-
50 мг (0.1 ммоль) гексагидрата гексахлороплати-
цов Н.К. // Изв. СПбГТИ(ТУ). 2014. T. 52. № 26.
новодородной кислоты в 4 мл ацетонитрила. К
C. 48.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 9 2019
СИНТЕЗ И СТРОЕНИЕ ГЕКСАХЛОРОПЛАТИНАТНЫХ КОМПЛЕКСОВ
1419
5. Ura Y., Gao G., Bao F., Ogasawara M., Takahashi T. //
16. Кукушкин Ю.Н., Хроменкова З.А. // ЖОХ. 1997.
Organometallics. 2004. Vol. 23. N. 21. P. 4804. doi
Т. 67. Вып. 7. С. 1206.
10.1021/om0493311
17. Кукушкин Ю.Н., Пахомова Т.Б. // ЖОХ. 1995. Т. 65.
6. Шарутин В.В., Шарутина О.К., Сенчурин В.С. //
Вып. 3. С. 514.
Бутлеровск. сообщ. 2013. Т. 36. № 11. С. 98.
18. Rochon F.D., Bensimon C., Tessier C. // Inorg. Chim.
7. Kukushkin V.Yu., Belsky V.K., Konovalov V.E., Aleksan-
Acta. 2008. Vol. 361. N 1. P. 16. doi 10.1016/j.
drova E.A., Pankova E.Yu., Moiseev A.I. // Phosphorus,
ica.2007.06.004
Sulfur, Silicon, Relat. Elem. 1992. Vol. 69. P. 103. doi
19. Шарутин В.В., Шарутина О.К., Сенчурин В.С.,
10.1080/10426509208036859
Ткачёва А.Р. // ЖОХ. 2018. Т. 88. Вып. 7. С. 1165;
Sharutin V.V.,Sharutina O.K., Senchurin V.S., Tkache-
8. Cotton F.A., Francis R. // J. Am. Chem. Soc. 1960.
va A.R. // Russ. J.Gen. Chem. 2018. Vol. 88. N 7.
Vol. 82. P. 2986. doi 10.1021/ja01497a003.9
P. 1456. doi 10.1134/S1070363218070174.
9. Meek D.W., Straub D.K., Drago R.S. // J. Am. Chem.
20. Шарутин В.В., Сенчурин В.С., Мосунова Т.В. //
Soc. 1960. Vol. 82. P. 6013. doi 10.1021/ja01508a012
Вестн. ЮУрГУ. 2017. Т. 9. Вып. 4. С. 61. doi
10. Кукушкин Ю.Н., Хроменкова З.А., Эсаулова В.А. //
10.14529/chem170410
ЖОХ. 1993. Т. 63. Вып. 10. С. 2386.
21. Ткачёва А.Р., Шарутин В.В., Шарутина О.К. // ЖОХ.
11. Шарутин В.В., Шарутина О.К., Сенчурин В.С //
2019. Т. 89. Вып. 2. С. 283; Tkacheva A.R., Sharu-
ЖОХ 2016. Т. 86. Вып. 9. С. 1536; Sharutin V.V.,
tin V.V., Sharutina O.K. // Russ. J. Gen. Chem. 2019.
Sharutina О.K., Senchurin V.S. // Russ. J. Gen.
Vol. 89. N 2. P. 277. doi 10.1134/S107036321902018X
Chem. 2016. Vol. 86. N 9. P. 2100. doi 10.1134/
22. Бацанов С.С. // ЖНХ. 1991. Т. 36. № 12. С. 3015.
S1070363216090206
23. SMART and SAINT-Plus. Versions 5.0. Data Collection
12. Quiroga A.G., Perez J.M., Alonso C. // J. Med. Chem.
and Processing Software for the SMART System.
2006. Vol. 49. N 1. P. 224. doi 10.1021/jm050804v
Bruker AXS Inc. 1998. Madison, Wisconsin, USA.
13. Ramos-Lima F.J., Quiroga A.G., Garcia-Serrelde B. //
24. SHELXTL/PC. Versions 5.10. An Integrated System
J. Med. Chem. 2007. Vol. 50. N 9. P. 2194. doi 10.1021/
for Solving, Refining and Displaying Crystal Structures
jm061219c
From Diffraction Data. Bruker AXS Inc. 1998. Madison,
14. Кукушкин Ю.Н. // Коорд. хим. 1998. Т. 24. № 3.
Wisconsin, USA.
С. 185.
25. Dolomanov O.V., Bourhis L.J., Gildea R.J., Ho-
15. Кукушкин Ю.Н., Пахомова Т.Б. // ЖНХ. 1997. Т. 42.
ward J.A.K., Puschmann H. // J. Appl. Cryst. 2009.
№ 1. С. 76.
Vol. 42. P. 339. doi 10.1107/S0021889808042726
Synthesis and Structure of Hexachloroplatinate Complexes
A. R. Tkachevaa, *, V. V. Sharutina, O. K. Sharutinaa, and P. A. Slepukhinb
a National Research South Ural State University, pr. Lenina 76, Chelyabinsk, 454080 Russia
*e-mail: aesya@mail.ru
b I. Ya. Postovskii Institute of Organic Synthesis, Ural Branch of the Russian Academy of Sciences, Yekaterinburg, Russia
Received March 19, 2019; revised March 19, 2019; accepted March 23, 2019
Reaction of tetraorganylphosphonium and trimethylammonium chlorides with hexachloroplatinic acid hydrate
in a solution of acetonitrile-diethyl sulfoxide afforded [Ph3PCH=CHCH3]2[PtCl6], [Ph3PCH2OCH3]2[PtCl6]
and [Me3NH]2[PtCl6] complexes. Structure of the obtained platinum complexes was studied by X-ray diffrac-
tion analysis.
Keywords: (propenyl)triphenylphosphonium chloride, (methoxymethyl)triphenylphosphonium chloride,
trimethylammonium chloride, hexachloroplatinic acid, acetonitrile
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 9 2019