ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2019, том 89, № 9, с. 1439-1447
УДК 547.621
ТЕРМОДИНАМИЧЕСКОЕ МОДЕЛИРОВАНИЕ СТАДИИ
ПРЕДПОДГОТОВКИ ПОЛИХЛОРБИФЕНИЛОВ
К ТЕРМОДЕСТРУКЦИИ
© 2019 г. А. В. Майороваa, b, *, Т. В. Куликоваa, b, К. Ю. Шуняевa, b,
Т. И. Горбуноваc, М. Г. Первоваc
a Институт металлургии Уральского отделения Российской академии наук,
ул. Амундсена 101, Екатеринбург, 620016 Россия
*e-mail: imeturoran@mail.ru
b Уральский федеральный университет имени первого Президента России
Б. Н. Ельцина, Екатеринбург, Россия
c Институт органического синтеза имени И. Я. Постовского Уральского отделения
Российской академии наук, Екатеринбург, Россия
Поступило в Редакцию 7 марта 2019 г.
После доработки 7 марта 2019 г.
Принято к печати 14 марта 2019 г.
Методом термодинамического моделирования исследовано взаимодействие технической смеси по-
лихлорбифенилов Совол с метоксидом натрия в среде диметилсульфоксида и метанола. Определены
оптимальные условия процесса: 1 атм, 115°С, 0.25 моль диметилсульфоксида, 0.085 моль метанола, моль-
ное соотношение полихлорбифенилы:метоксид натрия = 1:4. Экспериментальные данные, полученные с
использованием теоретически подобранных условий взаимодействия полихлорбифенилов с метоксидом
натрия, показывают спектр положительных эффектов: экономия реагентов, исчерпывающая конверсия,
образование потенциально менее токсичных веществ. Изученное взаимодействие может служить стадией
предподготовки токсичных полихлорбифенилов для пиролитического метода уничтожения.
Ключевые слова: полихлорбифенилы, химическая предподготовка, термодинамическое моделирование,
пиролитический метод
DOI: 10.1134/S0044460X1909018X
При разработке любого метода утилизации или
находится 35 тыс. т этих техногенных отходов в
уничтожения отходов необходимы такие техноло-
виде смесей полихлорбифенилов марок Совол,
гии, в результате которых образование дополни-
Совтол-10 (суммарно 21 тыс. т) и Трихлорбифенил
тельных невостребованных продуктов будет ми-
(14 тыс. т) [1]. Смесь полихлорбифенилов марки
нимизировано, а конверсия исходных материалов
Совол является самой масштабной из всех про-
будет исчерпывающей. Для опасных отходов, под-
изведенных видов опасных отходов среди тех-
лежащих только уничтожению, технологические
нических полихлорбифенилов. Согласно ГСО №
требования являются еще более жесткими: полное
7821-2000, разработанному на основе смеси Совол
отсутствие побочных продуктов и исчерпываю-
(ОСТ 6-01-24-75), продукт состоит из 35 конгене-
щая конверсия уничтожаемых материалов. К клас-
ров: три- (2.1%), тетра- (19.1%), пента- (51.5%),
су опасных отходов относятся полихлорбифенилы
гекса- (17.9%) и гептахлорбифенилов (1.9%) [2].
(полихлорбифенилов), уничтожение которых за-
Сегодня единственным технологически раз-
планировано до 2028 г. согласно Стокгольмской
витым и эффективным способом уничтожения
конвенции
(2001 г.). Сегодня на территории
полихлорбифенилов считается пиролитический
России, ратифицировавшей конвенцию в 2011 г.,
метод [3]. Однако в процессе сжигания этих хло-
1439
1440
МАЙОРОВА и др.
Схема 1.
Clx
Cly
Cly
Cly
MeONa
+
+
MeOH, ȾɆɋɈ
(OMe)a
(OH)
115 oC, 10 ɱ
b
(OH)b (OMe)a
1
2
3
4
x = 3 7 (1); y = 2, 3; a = 1 3 (2); y = 3
5; b = 1, 2 (3); y = 2-4; a = 1, 2; b = 1, 2 (4).
рароматических соединений в присутствии воз-
версии во взаимодействиях смеси полихлорбифе-
духа образуются такие высокотоксичные соеди-
нилов Совол с алкоксидами щелочных металлов:
нения как хлор, оксиды азота, фосген, полихлор-
MeO- [9], EtO-, PrO-, i-PrO-, n-BuO-, sec-BuO- и
дибензофураны и полихлордибензодиоксины [4].
tert-BuO- [10]. Впоследствии с помощью метода
Логично предположить, что перед сжиганием
термодинамического моделирования [11] удалось
смесей полихлорбифенилов необходимо предва-
подобрать такие реакционные условия, которые
рительно частично или полностью удалить атомы
способствовали исчерпывающей конверсии смеси
хлора из структуры конгенеров для минимизации
полихлорбифенилов Совол с MeO- [12]. Это взаи-
образования токсичных соединений в процессе
модействие осуществлено при мольном соотноше-
деструкции. Этого можно добиться с помощью
нии смесь Совол:MeONa, равном 1:5, температуре
химического метода - гидродехлорирования [5].
170°C и давлении 1 атм в среде ДМСО.
Но реализация реакций гидродехлорирования
Кроме того, дальнейшее совершенствование
осуществляется в растворах с применением доро-
экспериментальных подходов позволило осуще-
гостоящих катализаторов (обычно палладиевых),
ствить полное превращение смеси Совол 1 под дей-
требующих очистки и регенерации, и поэтому с
ствием MeO- (мольное соотношение 1:MeONa =
помощью восстановительного дехлорирования
1:5) при гораздо более низкой температуре в
осуществить предподготовку больших объемов
114-115°С благодаря введению в реакционную
смесей полихлорбифенилов к сжиганию слишком
массу абсолютного метанола для увеличения
затратно. Другой вариант удаления атомов хлора
растворимости хлораренов в среде растворите-
из конгенеров полихлорбифенилов - это использо-
лей (ДМСО и MeOH) [13, 14]. При этом через 8
вание реакций нуклеофильного замещения на дру-
ч наблюдалось образование метокси- (2, 21.5%),
гие функциональные группы, введение которых в
гидрокси- (3, 51.0%) и метоксигидроксипроизво-
бифенильную структуру потенциально приводит к
дных (4, 27.5%) полихлорбифенилов (схема 1).
снижению токсичности исходных материалов и не
способствует образованию высокотоксичных про-
Метод термодинамического моделирования для
данного вида взаимодействия не использовался,
дуктов при сжигании новых производных.
хотя, как показано ранее в работах [15, 16], ука-
Наиболее простыми методиками нуклеофиль-
занный теоретический подход в исследованиях по-
ного замещения (SN) атомов хлора в конгенерах
могает подобрать условия эксперимента, позволя-
полихлорбифенилов являются их взаимодействия
ющие увеличить степень превращения исходных
с алкоксидами щелочных металлов [6]. Здесь
конгенеров смеси полихлорбифенилов, миними-
особую трудность представляет сложный состав
зировать образование токсичных веществ, значи-
смесей полихлорбифенилов, так как реакционная
тельно снизить затраты на расходные материалы,
способность индивидуальных конгенеров являет-
трудозатраты и электроэнергию.
ся различной и зависит от количества и располо-
жения атомов хлора в структуре, что было доказа-
Настоящая работы направлена на исследование
но квантово-химическими расчетами на примере
взаимодействия смеси полихлорбифенилов Совол
реакций нуклеофильного замещения [7, 8]. Этим
с MeONa в среде ДМСО и MeOH методом тер-
можно объяснить отсутствие исчерпывающей кон-
модинамического моделирования и верификация
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 9 2019
ТЕРМОДИНАМИЧЕСКОЕ МОДЕЛИРОВАНИЕ
1441
(a)
(б)
T, °C
T, °C
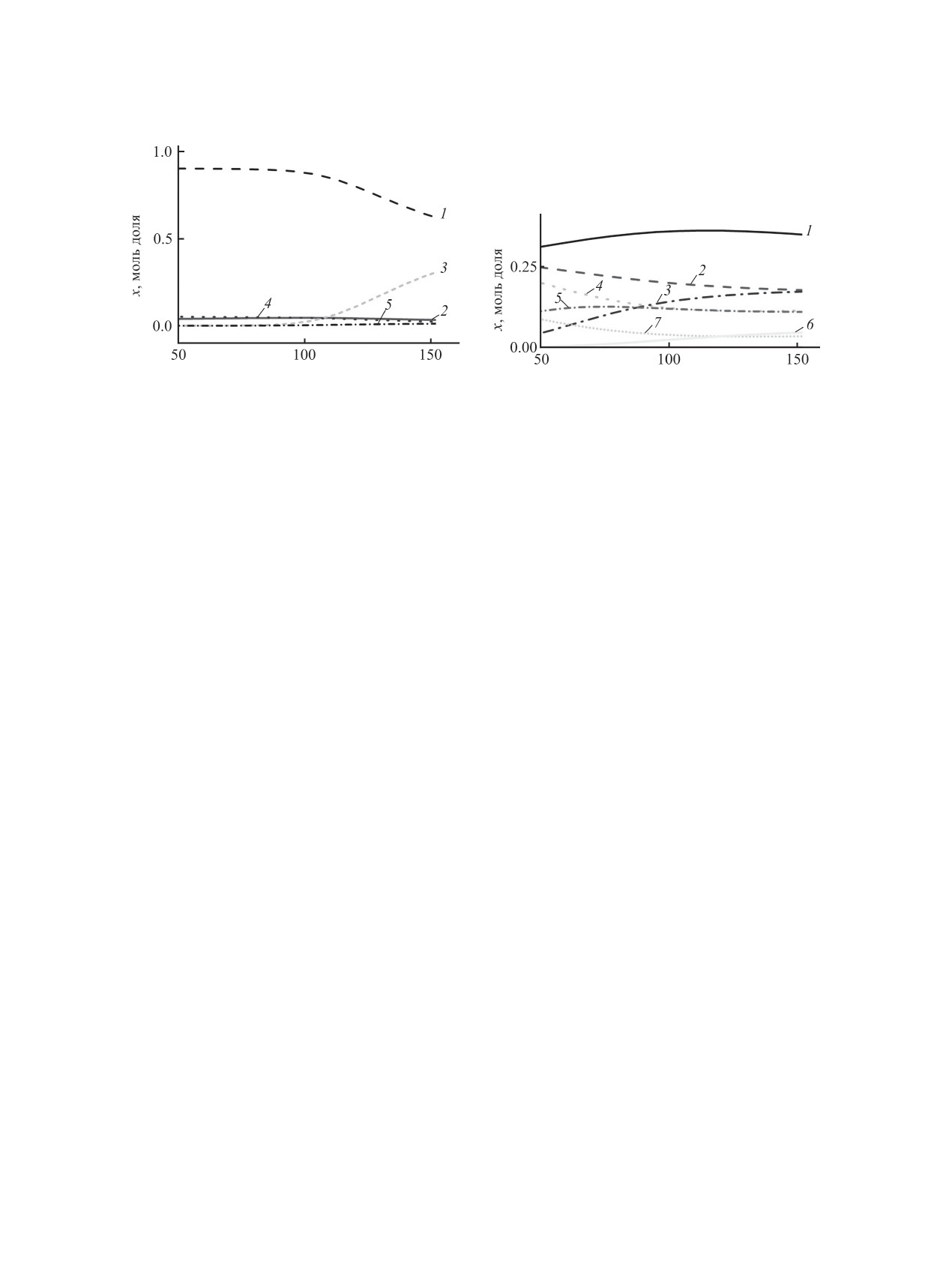
Рис. 1. Зависимость равновесного состава конгенеров и производных полихлорбифенилов от температуры. Исходный
состав: (а) 0.025 моль смеси полихлорбифенилов Совол 1, 0.025 моль МеОNa, 0.25 моль ДМСО; (б) 0.025 моль смеси
полихлорбифенилов Совол 1, 0.025 моль МеОNa, 0.25 моль ДМСО, 0.085 моль МеОН (50-150°С, 1 атм). Сумма мольных
долей всех конгенеров и производных полихлорбифенилов равна 1. (а), 1 - C12H7Cl3, 2 - C12H6Cl4, 3 - C12H3Cl5(OCH3)2,
4 - C12H5Cl5, 5 - C12H3Cl6(OCH3). (б), 1 - C12H7(OCH3)3, 2 - C
H7Cl(OCH3)2, 3 - C12H7Cl2(OCH3), 4 - C12H7Cl(OH)2, 5 -
12
C12H7Cl3, 6 - C12H7Cl2(OH), 7 - C12H7(OH)3.
полученных расчетных данных с экспериментом
[20]. Для расчетов используется программный
с целью разработки метода химической предпод-
комплекс HSC 8.2.0, содержащий модуль Benson
готовки токсичных полихлорбифенилов к сжига-
Estimation. Рассчитанные термохимические па-
нию.
раметры для производных полихлорбифенилов 4
Термодинамическое моделирование процес-
введены в базу данных HSC 8.2.0 и применены при
са химического взаимодействия смеси конге-
моделировании взаимодействия конгенеров по-
неров полихлорбифенилов Совол 1 с МеОNa в
лихлорбифенилов смеси Совол 1 с МеОNa в среде
среде ДМСО и МеОН. Необходимым условием
ДМСО и МеОН. Они представлены в табл. 1.
для проведения метода термодинамического мо-
С использованием метода термодинамического
делирования является наличие базы данных по
моделирования (модуль Equilibrium Composition)
термохимическим свойствам исследуемых сое-
и программного комплекса HSC проведено мо-
динений. Для выполнения метода термодинами-
делирование взаимодействия смеси полихлорби-
ческого моделирования необходимо знать следу-
фенилов Совол 1 (0.025 моль) с МеОNa (0.025-
ющие термохимические свойства метокси- (2),
0.15 моль) в среде ДМСО (0.25 моль) в отсутствие
гидрокси- (3) и метоксигидроксипроизводных (4)
и в присутствии сорастворителя МеОН
(0.085
полихлорбифенилов: стандартную энтальпию об-
моль). Экспериментально установлено, что тем-
разования (ΔH°298), приращение энтальпии от 0
пература кипения смеси растворителей ДМСО и
до 298 K (H°298 - H°0), стандартную теплоемкость
МеОН, взятых в указанном мольном соотношении,
(Ср°298) и ее зависимость от температуры [Ср(Т)],
составляетпримерно114-115°С[13,14].Термодина-
энтропию (S°298). Отметим, что термохимические
мическое моделирование проводили в диапазоне
свойства для метокси- (2) и гидроксипроизводных
температур от 50 до 150°С. При создании файла
(3) полихлорбифенилов рассчитаны нами ранее и
для моделирования в состав продуктов разложе-
представлены в работах [18, 19]. Данные по меток-
ния включали хлорид натрия, моно- и диоксид
сигидроксипроизводным 4 полихлорбифенилов в
углерода, воду и хлороводород. Термохимические
литературе отсутствуют.
свойства данных веществ были взяты из базы дан-
Расчет термохимических свойств метокси-
ных HSC. Моделирование выполнено при атмос-
гидроксипроизводных 4 полихлорбифенилов осу-
ферном давлении. Алгоритм расчета равновесного
ществлен с помощью разработанного ранее алго-
состава с помощью программного комплекса HSC
ритма, основанного на анализе структур молекул
подробно описан в работе [17].
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 9 2019
1442
МАЙОРОВА и др.
Таблица 1. Рассчитанные термохимические свойства производных полихлорбифенилов 4
S°,
Ср = a + b×10-3Т + c×105Т-2 +d×10-6Т2
∆Н°298,
∆G°298,
Н°298 - Н°0,
Соединение
Дж/
Дж/(моль·K) [17]
Дж /моль
кДж /моль
кДж/моль
(моль·K)
a
b
c
d
C12H6Cl2(OCH3)OH
-214.01
530.27
-28.97
37.19
71.672
702.524
-8.778
-279.123
C12H5Cl3(OCH3)OH
-241.22
557.41
-50.53
39.46
90.750
679.174
-6.722
-269.650
C12H5Cl2(OCH3)2OH
-378.34
573.81
-135.18
43.13
75.971
799.516
-0.013
-313.966
C12H4Cl4(OCH3)OH
-268.43
584.55
-72.09
41.73
109.828
655.813
-4.667
-260.176
C12H4Cl3(OCH3)2OH
-405.55
600.95
-156.74
45.41
111.171
717.944
-2.043
-230.627
C12H4Cl3(OCH3)(OH)2
-418.53
583.77
-205.15
42.14
102.636
681.342
-4.770
-268.246
C12H3Cl4(OCH3)(OH)2
-445.74
610.91
-226.71
44.41
121.714
657.882
-2.715
-258.832
C12H5Cl2(OCH3)(OH)2
-391.32
556.63
-183.59
39.87
83.558
704.803
-6.826
-277.780
C12H6Cl(OCH3)(OH)2
-364.11
529.49
-162.03
37.58
64.480
728.263
-8.881
-287.253
C12H6(OCH3)(OH)3
-514.21
528.71
-295.09
38.00
57.288
753.992
-8.985
-295.383
C12H6(OCH3)2(OH)2
-501.23
545.89
-246.68
41.25
59.446
813.581
-4.641
-286.924
C12H6(OCH3)3(OH)
-488.25
563.06
-198.27
44.53
78.746
811.481
-4.645
-199.924
C12H5Cl(OCH3)(OH)3
-541.42
555.85
-316.65
40.27
76.366
730.531
-6.929
-285.910
C12H5(OCH3)(OH)4
-691.52
555.07
-449.71
40.68
69.174
756.260
-7.033
-294.040
C12H5(OCH3)2(OH)3
-678.54
572.24
-401.30
43.94
69.393
822.838
-2.198
-294.462
C12H5(OCH3)3(OH)2
-665.56
589.42
-352.89
47.21
106.040
758.213
-6.593
-127.987
C12H5(OCH3)4(OH)
-652.58
606.60
-304.48
50.48
92.483
874.442
1.732
-191.523
C12H4Cl2(OCH3)(OH)3
-568.63
582.99
-338.21
42.54
95.444
707.071
-4.874
-276.436
C12H4Cl(OCH3)(OH)4
-718.73
582.21
-471.27
42.95
88.252
732.800
-4.977
-284.566
C12H4(OCH3)(OH)5
-868.63
582.10
-604.33
43.35
81.060
758.529
-5.081
-292.696
C12H4(OCH3)2(OH)4
-855.85
598.60
-555.92
46.62
73.473
853.242
1.733
-328.883
C12H4(OCH3)3(OH)3
-842.87
615.85
-507.53
49.88
65.888
948.056
8.545
-365.069
C12H4(OCH3)4(OH)2
-829.89
632.96
-459.10
53.15
58.300
1042.769
15.358
-401.256
C12H4(OCH3)5(OH)
-816.91
650.14
-410.69
56.42
50.713
1137.483
22.171
-766.482
C12H4Cl2(OCH3)2(OH)2
-555.65
600.50
-289.90
45.81
87.857
801.785
1.939
-312.623
C12H4Cl2(OCH3)3(OH)
-542.67
532.74
-241.39
49.08
80.270
896.598
8.752
-348.809
C12H4Cl(OCH3)2(OH)3
-705.75
599.38
-422.86
46.21
80.665
827.513
1.836
-320.753
C12H4Cl(OCH3)3(OH)2
-692.77
616.56
-374.45
49.48
91.037
857.595
4.098
-274.659
C12H4Cl(OCH3)4(OH)
-679.79
633.74
-326.04
52.75
65.492
1017.041
15.462
-393.126
C12H5Cl(OCH3)2(OH)2
-528.44
573.03
-268.24
43.54
68.779
825.245
-0.116
-322.096
C12H5Cl(OCH3)3(OH)
-515.46
590.20
-219.83
46.81
61.192
920.059
6.697
-358.283
C12H3Cl4(OCH3)2(OH)
-419.78
509.19
-129.89
50.94
114.127
752.595
4.098
-295.019
C12H3Cl3(OCH3)3(OH)
-569.88
644.48
-262.95
51.35
99.348
873.138
10.808
-339.336
C12H3Cl3(OCH3)2(OH)2
-582.86
627.31
-311.36
48.08
106.935
778.324
3.995
-303.149
C12H3Cl3(OCH3)(OH)3
-595.84
610.13
-359.77
44.81
92.278
763.789
2.818
-368.878
C12H3Cl2(OCH3)2(OH)3
-732.96
625.95
-444.25
48.48
99.743
804.053
3.891
-311.279
C12H3Cl2(OCH3)3(OH)2
-719.98
643.70
-396.01
51.75
92.156
898.867
10.704
-347.466
C12H3Cl2(OCH3)4(OH)
-707.00
660.88
-347.6
55.02
84.978
992.109
17.414
-381.782
C12H3Cl2(OCH3)(OH)4
-745.94
609.35
-492.83
45.22
107.330
709.339
-2.922
-275.092
C12H3Cl(OCH3)(OH)5
-896.04
608.57
-625.89
45.62
100.138
735.068
-3.025
-283.222
C12H3Cl(OCH3)5(OH)1
-844.12
677.28
-432.25
58.69
69.995
1113.287
24.175
-447.194
C12H3Cl(OCH3)4(OH)2
-857.1
660.10
-480.66
56.46
77.378
1019.309
17.414
-391.782
C12H3Cl(OCH3)3(OH)3
-870.07
642.95
-529.07
52.04
84.965
924.595
10.601
-355.596
C12H3Cl(OCH3)2(OH)4
-883.06
625.74
-577.48
48.75
92.551
829.782
3.788
-319.409
C12H3(OCH3)2(OH)5
-1033.16
624.96
-710.54
49.29
85.360
855.511
3.684
-327.539
C12H3(OCH3)(OH)6
-1046.14
607.79
-758.95
46.03
68.253
849.803
3.129
-404.488
C12H3(OCH3)6(OH)
-981.24
693.67
-516.9
62.36
55.012
1234.465
30.936
-472.285
C12H3(OCH3)5(OH)2
-994.22
676.49
-565.31
59.09
62.905
1138.648
24.046
-434.696
C12H3(OCH3)4(OH)3
-1007.2
659.32
-613.72
55.83
70.186
1045.038
17.310
-399.912
C12H3(OCH3)3(OH)4
-1020.18
642.14
-662.13
52.56
77.773
950.324
10.497
-363.726
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 9 2019
ТЕРМОДИНАМИЧЕСКОЕ МОДЕЛИРОВАНИЕ
1443
На рис. 1 показан равновесный состав системы,
полученный при моделировании взаимодействия
полихлорбифенилов Совол 1 с МеОNa в мольном
соотношении 1:1 в среде ДМСО в отсутствие и
в присутствии сорастворителя МеОН. При вза-
имодействии смеси полихлорбифенилов Совол
1 с МеONa в отсутствие сорастворителя МеОН в
составе продуктов реакции наибольшую концен-
трацию имеют непрореагировавшие трихлорби-
фенилы (до 0.9 мол. долей), а также тетра- и пен-
тахлорбифенилы (рис. 1а). Только с увеличением
Мол. соотношение ПХБ:MeONa
температуры процесса концентрация в продуктах
реакции исходных полихлорбифенилов 1 снижа-
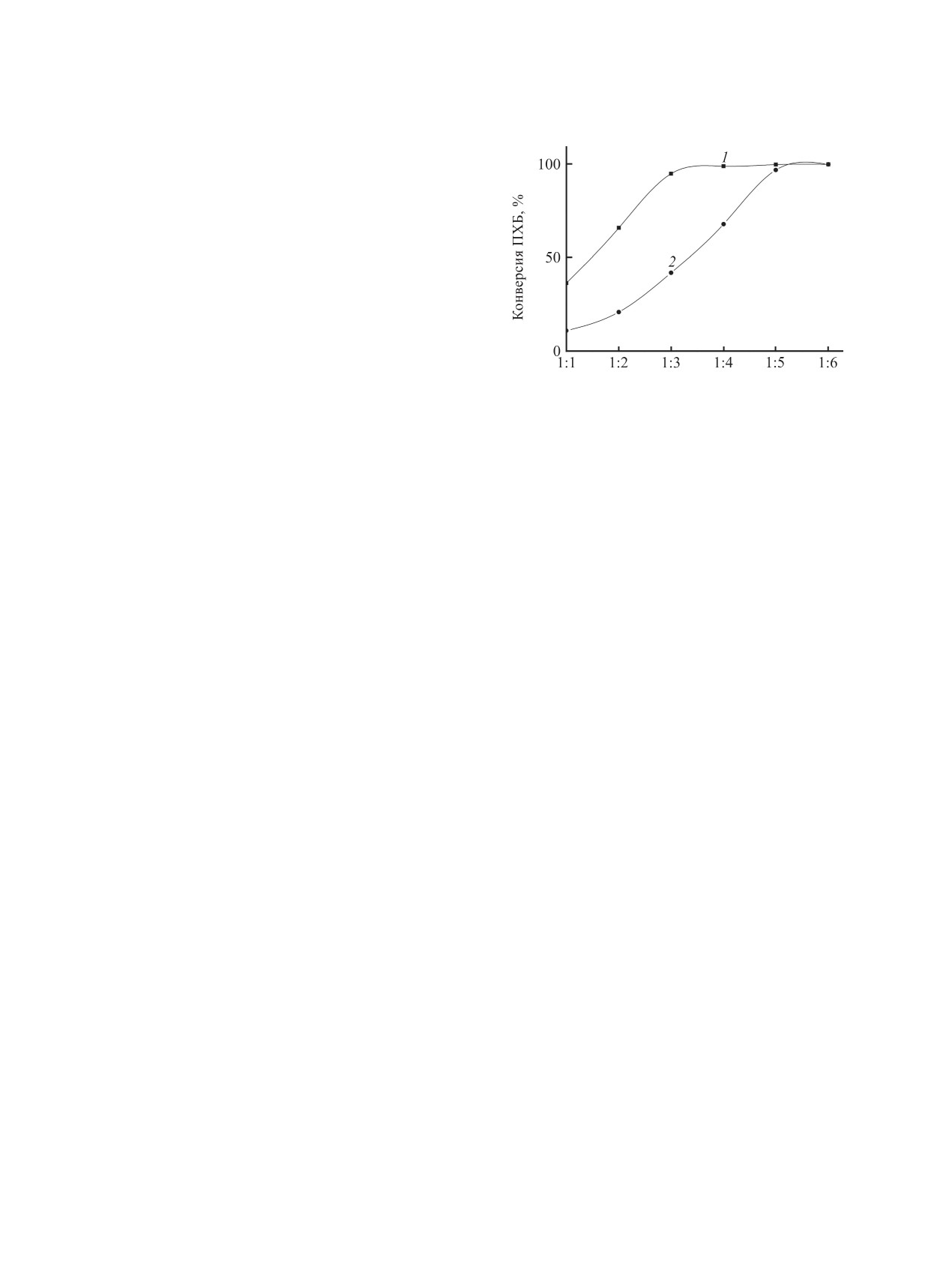
Рис. 2. Конверсия конгенеров полихлорбифенилов сме-
ется, а метоксипроизводных полихлорбифенилов
си Совол 1 в расчете на мольное соотношение смесь
2 увеличивается. Введение к ДМСО сорастворите-
полихлорбифенилов 1:МеОNa: 1 - 0.085 моль МеОН,
2 - без МеОН. Условия: 115°С, 1 атм.
ля МеОН (рис. 1б) приводит к резкому снижению
концентрации исходных конгенеров полихлор-
бифенилов смеси Совол 1 уже при 50°С, а в про-
фенилов Совол 1 на метокси- и гидроксигруппы в
дуктах реакции в значительных концентрациях
присутствии и в отсутствие сорастворителя МеОН
присутствуют как метокси- (2), так и гидроксипро-
протекает полностью при мольных соотношениях
изводные (3). Концентрация метоксигидроксипро-
смесь полихлорбифенилов 1-MeONa, равных 1:4
изводных полихлорбифенилов 4 в продуктах ре-
и 1:6 соответственно (рис. 2). Из вышесказанно-
акции незначительна и составляет менее 10-7 мол.
го можно сделать вывод, что добавление к ДМСО
долей. Полученные данные показывают, что ме-
сорастворителя МеОН приводит к резкому сни-
токсигидроксипроизводные полихлорбифенилов
жению концентрации исходных конгенеров по-
4 являются термодинамически нестабильными
лихлорбифенилов смеси Совол 1, а в продуктах
(промежуточными) продуктами. В реакциях ну-
реакции присутствуют как метокси- 2, так и ги-
клеофильного замещения в равновесных условиях
дроксипроизводные 3. При этом снижается коли-
продуктами являются преимущественно метокси-
чество MeONa, необходимого для полной конвер-
(2) и гидроксипроизводные (3).
сии смеси Совол 1.
Отметим, что MeOH является протонным рас-
Полученные результаты термодинамического
творителем и его использование в избытке мо-
моделирования следует рассматривать как мак-
жет препятствовать процессу замещения. Ранее
симально возможные значения конверсии, при
экспериментально установлено, что оптимальное
которых не учитываются каталитические и кине-
массовое соотношение ДМСО-МеОН, при кото-
тические эффекты. Реальный процесс, протекаю-
ром не зарегистрировано ингибирование реакции
щий за определенный промежуток времени, даже
замещения конгенеров смеси полихлорбифенилов
будучи разрешенным термодинамически, может
Совол 1 с МеОNa, составляет 1:7 (соответствует
быть кинетически подавлен из-за ничтожно малой
мольному 1:3) [13]. Это соотношение использова-
скорости протекания. По результатам метода тер-
лось в дальнейших исследованиях.
модинамического моделирования выявлены опти-
На рис. 2 представлены результаты термодина-
мальные условия взаимодействия, приводящие к
мического моделирования по оптимизации моль-
максимальной конверсии смеси Совол 1 в реакции
ного соотношения МеONa-смесь 1, необходимого
с МеОNa в среде МеОН и ДМСО при мольном
для полного замещения атомов хлора в структуре
соотношении растворителей 1:3 соответственно,
конгенеров полихлорбифенилов на метокси- и ги-
температуре 115°С (максимально возможная из-за
дроксигруппы. Установлено, что замещение ато-
кипения смеси растворителей), мольном соотно-
мов хлора в структуре конгенеров полихлорби-
шении смесь полихлорбифенилов 1:МеОNa = 1:4
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 9 2019
1444
МАЙОРОВА и др.
Таблица 2. Данные о продуктах взаимодействия смеси полихлорбифенилов Совол 1 с MeONa в среде ДМСО в при-
сутствии MeOH при 115°С, время реакции - 10 ч
Молекулярный ион,
Число
Относительное
№
Количество заместителей
m/z
изомеров
содержание, %
2
y = 2, a = 1
252
2
1.5
2
y = 2, a = 2
282
11
12.0
2
y =3, a = 1
286
7
5.8
3
y =3, b = 1
272
4
4.9
2
y =2, a = 3
312
5
1.7
2
y = 3, a = 2
316
2
0.5
3
y = 3, b = 2
288
5
0.9
3
y = 4, b = 1
306
15
31.1
4
y = 2, a = 2, b = 1
298
6
2.6
4
y = 3, a = 1, b = 1
302
17
19.9
3
y =4, b = 2
322
11
11.2
3
y = 5, b = 1
340
3
0.7
4
y = 3, a = 1, b = 2
318
1
0.1
4
y = 3, a = 2, b = 1
332
5
1.5
4
y = 4, a = 1, b = 1
336
10
3.4
4
y = 4, a = 1, b = 2
352
1
2.1
3
y = 5, b = 2
356
1
0.1
Итого:
100
и давлении в 1 атм. Время проведения реакции мо-
женной в экспериментальной части и проводили
жет быть подобрано только экспериментально.
анализ в условиях ГХ-ПИД и ГХ-МС. По резуль-
татам анализа установлено образование более ста
Экспериментальные исследования процесса
новых производных. Их относительное содержа-
химического взаимодействия смеси конгенеров
ние представлено в табл. 2.
полихлорбифенилов Совол 1 с МеОNa в среде
ДМСО и МеОН. Используемые условия реакции
Полученные данные показывают, что в ходе
соответствовали оптимальным данным, получен-
взаимодействия смеси полихлорбифенилов 1 с
ным из результатов термодинамического моде-
MeONa в среде ДМСО и MeOH происходит се-
лирования. Время химического взаимодействия
рия реакций, протекающих с разными скоростя-
смеси Совол 1 с МеОNa в среде ДМСО и МеОН
ми и различными наборами конечных продуктов
составляло 10 ч и выбрано с целью сравнения ре-
в зависимости от структуры исходного конгенера
зультатов эксперимента с данными, полученными
полихлорбифенилов. При этом одновременно или
при взаимодействии с МеОNa без использования
последовательно может протекать образование
МеОН в работе [12]. За отсчет времени реакции
метокси- (2), гидрокси- (3) и метоксигидрокси-
принимали достижение температуры глицерино-
производных (4) полихлорбифенилов, что совпа-
вой бани в 114–115°С после смешения всех реа-
дает с результатами, полученными ранее [12, 13].
гентов. Через каждые 2 ч из реакционной массы
Расхождение результатов метода термодинамиче-
отбирали пробы, обрабатывали по методике, изло-
ского моделирования и эксперимента по концен-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 9 2019
ТЕРМОДИНАМИЧЕСКОЕ МОДЕЛИРОВАНИЕ
1445
трации образующихся метоксигидроксипроизво-
реагенты имеют квалификацию ХЧ и произведены
дных полихлорбифенилов 4 связано с невозмож-
в России.
ностью учета при моделировании кинетических
Методика взаимодействия смеси полихлор-
факторов протекания реакции. При проведении
бифенилов Совол 1 с МеОNa в среде ДМСО и
реакции в условиях, полученных с помощью тер-
МеОН. Смесь 2.3 г (0.1 моль) металлического на-
модинамического моделирования, в течение 10 ч
трия и 30.0 мл (V0) абсолютного MeOH перемеши-
достигается полная конверсия исходной смеси по-
вали до окончания образования MeONa (0.1 моль).
лихлорбифенилов 1, но необходимое для этого ко-
Отгонкой удаляли избыток MeOH до тех пор,
личество MeONa снижено в сравнении с работой
пока реакционная масса не начинает пениться.
[12], что, безусловно, является положительным
Измеряли объем отогнанного MeOH (V1) и рассчи-
результатом. Кроме того, согласно элементному
тывали необходимое количество ДМСО. По урав-
анализу, смесь полихлорбифенилов Совол 1 со-
нению (1) рассчитывали необходимое для образо-
держит следующие количественные вклады хи-
вания MeONa in situ количество МеОН (объем V2).
мических элементов, %: С 44.28, H 1.65, Cl 54.07.
2Na + 2MeOH → 2MeONa + H2↑.
(1)
Смесь продуктов 2-4, выделенная после взаимо-
Затем определяли количество свободного
действия смеси полихлорбифенилов 1 с MeONa в
МеОН, оставшегося в реакционной колбе (V3) по
указанных условиях, характеризуется следующи-
формуле (2).
ми показателями элементного анализа, %: С 53.73,
V3 = V0 - (V1 + V2).
(2)
Н 4.60; Cl 27.26, т. е. фактически проведение дан-
ного химического процесса позволило примерно в
Исходя из V3, рассчитывали количество ДМСО
2 раза снизить содержание хлора как элемента в
так, чтобы мольное соотношение МеОН-ДМСО
конечных продуктах. Следовательно, при попыт-
соответствовало 1:3.
ке сжигания смеси продуктов 2-4, потенциально
В указанных здесь условиях V1 = 22.5 мл (m =
будет снижено образование опасных хлорсодержа-
17.78 г), V2 = 4 мл (m = 3.20 г), V3 = 3.5 мл (m =
щих веществ [4].
2.77 г, 0.085 моль). Далее, исходя из показателя V3,
вносили 19.25 г (0.25 моль, 17.5 мл) ДМСО, реак-
Таким образом, в результате метода термодина-
ционную массу перемешивали при 115°С в тече-
мического моделирования подобраны оптималь-
ние 0.1 ч, затем вносили 8.2 г (0.025 моль) техни-
ные экспериментальные условия взаимодействия
ческой смеси Совол 1 (соотношение 1:MeONa =
смеси полихлорбифенилов Совол 1 с MeONa в сре-
1:4). Далее при интенсивном перемешивании и при
де ДМСО и МеОН, реализация которых приводит
указанной температуре бани проводили процесс в
к исчерпывающей конверсии исходных веществ, к
течение 10 ч. По окончании смесь охлаждали, вно-
экономии реагентов, к потенциальному снижению
сили 50 мл разбавленной соляной кислоты до рН < 7
токсичности полученных продуктов 2- 4 по срав-
и экстрагировали смесь толуолом (4 × 20 мл).
нению со смесью Совол 1 и к уменьшению выбро-
Экстракт анализировали методом ГХ-МС.
сов токсичных хлорсодержащих веществ при сжи-
Качественная и количественная оценка про-
гании синтезированных производных полихлор-
дуктов взаимодействия. Для для идентификации
бифенилов. Полученные результаты имеют важ-
и количественной оценки продуктов реакций
ное значение при разработке комплексного подхо-
использовали газовый хромато-масс-спектро-
да уничтожения полихлорбифенилов посредством
метр Agilent GC 7890A MSD 5975C inert XL EI/
двух стадий: химической и пиролитической.
CI с кварцевой капиллярной колонкой НР-5MS
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
(длина 25 м, внутренний диаметр 0.25 мм, тол-
щина пленки неподвижной фазы 0.25 мкм, по-
В качестве исходных объектов в настоящей ра-
лидиметилсилоксан,
5% привитых фенильных
боте использована техническая смесь полихлорби-
групп) и квадрупольным масс-спектрометри-
фенилов Совол (ОСТ 6-01-24-75), металлический
ческим детектором (ГХ-МС). Газ-носитель
-
натрий, свежевысушенный и перегнанный MeOH
гелий, деление потока - 1:50, температура колон-
(d420 = 0.7917 г/мл), ДМСО (d420 = 1.10 г/мл). Все
ки - начальная 40°С (изотерма 3 мин), программи-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 9 2019
1446
МАЙОРОВА и др.
рование со скоростью 10 град/мин до 280°С (изо-
6. Горбунова Т.И., Первова М.Г., Салоутин В.И., Чупа-
терма 50 мин), температура испарителя - 250°С,
хин О.Н. Химическая функционализация полихлори-
рованных бифенилов: новые достижения. Екатерин-
детектора - 300°С.
бург: Уральский университет, 2018. 728 с.
Относительную количественную оценку про-
7. Gorbunova T.I., Subbotina J.O., Saloutin V.I., Chupa-
дуктов реакции проводили по методу внутренней
khin O.N. // J. Hazard. Mater. 2014. Vol. 278. P. 491. doi
нормализации, рассчитывая вклады отдельных со-
10.1016/j.jhazmat.2014.06.035
единений в суммарную площадь пиков, и по по-
8. Горбунова Т.И., Субботина Ю.О., Салоутин В.И.,
лученным расчетным площадям пиков оценивали
Чупахин О.Н. // ЖОХ. 2014. Т. 84. № 3. С. 428; Gor-
содержание продуктов. При обработке хромато-
bunova T.I., Saloutin V.I., Chupakhin O.N., Subboti-
грамм, зарегистрированных в условиях ГХ-МС,
na Yu.O.// Russ. J. Gen. Chem. 2014. Vol. 84. N 3.
P. 486. doi 10.1134/S107036321403013X
производилась реконструкция по селективным ио-
9. Забелина О.Н., Горбунова Т.И., Первова М.Г., Кири-
нам, отвечающим определенным типам произво-
ченко В.Е., Запевалов А.Я., Салоутин В.И. // ЖПХ.
дных, что позволяло идентифицировать индивиду-
2004. Т. 77. № 9. С. 1533; Zabelina O.N., Gorbuno-
альные соединения при совместном элюировании.
va T.I., Pervova M.G., Kirichenko V.E., Zapevalov A.Ya.,
Анализируя продукты в режиме сканирования по
Saloutin V.I., Chupakhin O.N. // Russ. J. Appl. Chem.
селективным ионам конгенеров полихлорбифени-
2004. Vol. 77. N 9. P. 1523. doi 10.1007/s11167-005-
лов, подтверждали данные о непрореагировавших
0064-y
конгенерах.
10. Забелина О.Н., Ятлук Ю.Г., Кириченко В.Е., Перво-
ва М.Г., Назаров А.С., Салоутин В.И. // Масс-спек-
ФОНДОВАЯ ПОДДЕРЖКА
трометрия. 2005. Т. 2. № 2. С. 139.
11. Метод, универсальный алгоритм и программа тер-
Работа выполнена при финансовой поддержке
модинамического расчета многокомпонентных ге-
Российского фонда фундаментальных исследо-
терогенных систем / Под ред. Г.Б. Синярева. М.:
ваний (грант № 18-29-24126) с использованием
МВТУ, 1978. 56 с.
оборудования Центра коллективного пользования
12. Kulikova T.V., Maiorova A.V., Bykov V.A., Shunyaev K.Y.,
«Спектроскопия и анализ органических соедине-
Gorbunova T.I., Pervova M.G., Plotnikova K.A. //
ний».
Intern. J. Environ. Sci. Technol. 2018. P. 1. doi 10.1007/
s13762-018-2022-2
КОНФЛИКТ ИНТЕРЕСОВ
13. Плотникова К.А., Первова М.Г., Горбунова Т.И., Хай-
Авторы заявляют об отсутствии конфликта
булова Т.Ш., Боярский В.П., Салоутин В.И., Чупа-
интересов.
хин О.Н. // Докл. АН. 2017. Т. 476. № 1. С. 45; Plot-
nikova K.A., Pervova M.G., Gorbunova T.I., Salou-
СПИСОК ЛИТЕРАТУРЫ
tin V.I., Chupakhin O.N., Khaibulova T.S., Boyar-
skii V.P. // Doklady Chem. 2017. Vol. 476. N 1. P. 206.
1. Трегер Ю.А. // Хим. ж. 2013. №1. С. 30.
doi 10.1134/S0012500817090038.
2. Кириченко В.Е., Первова М.Г., Промышленникова
14. Боярский В.П., Хайбулова Т.Ш., Горбунова Т.И., Пер-
Е.П., Пашкевич К.И. // Аналитика и контроль. 2000.
вова М.Г., Плотникова К.А., Салоутин В.И., Чупа-
Т. 4. № 1. С. 41.
хин О.Н. Патент 2623216 (2016) // 2017. № 18.
3. Занавескин Л.Н., Аверьянов В.А. // Усп. хим. 1998.
Т. 67. № 8. С. 788; Zanaveskin L.N., Averyanov V.A. //
15. Плотникова К.А., Горбунова Т.И., Первова М.Г., Ку-
Russ. Chem. Rev. 1998. Vol. 67. N 8. P. 713. doi
ликова Т.В., Майорова А.В., Салоутин В.И., Чупа-
10.1070/RC1998v067n08ABEH000412
хин О.Н. // ЖОХ. 2017. Т. 87. № 5. С. 742; Plotniko-
4. Занавескин Л.Н., Аверьянов В.А., Трегер Ю.А. // Усп.
va K.A., Gorbunova T.I., Pervova M.G., Saloutin V.I.,
хим. 1996. Т. 65. № 7. С. 667; Zanaveskin L.N., Averya-
Chupakhin O.N., Kulikova T.V., Maiorova A.V. // Russ.
nov V.A., Treger Yu.A. // Russ. Chem. Rev. 1996. Vol. 65.
J. Gen. Chem. 2017. Vol. 87. N 5. P. 934. doi 10.1134/
N 7. P. 617. doi 10.1070/RC1996v065n07ABEH000271
S1070363217050073
5. Wu B.-Z., Chen H.-Y., Wang S.-J., Wai C.-M., Liao W.,
16. Куликова Т.В., Майорова А.В., Быков В.А., Шуня-
Chiu K.-H. // Chemosphere. 2012. Vol. 88. N 7. P. 757.
ев К.Ю., Леонтьев Л.И. // Хим. технол. 2011. Т. 12.
doi 10.1016/j.chemosphere.2012.03.056
№ 1. С. 20.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 9 2019
ТЕРМОДИНАМИЧЕСКОЕ МОДЕЛИРОВАНИЕ
1447
2013. Т. 83. № 5. С. 754; Kulikova T.V., Mairova A.V.,
outotec.com/products/digital-solutions/hsc-chemistry/
Shunyaev K.Yu., GorbunovaT.I., Saloutin V.I., Chupa-
hsc-gem---equilibrium-compositions-module/ (дата
khin O.N. // Russ. J. Gen. Chem. 2013. Vol. 83. N 5.
обращения: 10.02.2019).
18. Куликова Т.В., Майорова А.В., Шуняев К.Ю., Горбу-
P. 893. doi 10.1134/S1070363213050034
нова Т.И., Салоутин В.И., Чупахин О.Н. // Экология
20. Kulikova T.V., Mayorova A.V., Bykov V.A., Shunyaev K.Y.,
и промышленность России. 2013. № 11. С. 23.
Il’inykh N.I. // Struct. Chem. 2013. Vol. 24. N 1.
19. Куликова Т.В., Майорова А.В., Шуняев К.Ю., Гор-
бунова Т.И., Салоутин В.И., Чупахин О.Н. // ЖОХ.
P. 285. doi 10.1007/s11224-012-0076-1
Thermodynamic Modeling of The Pretreatment Stage
of Polychlorobiphenyls to Thermodestruction
A. V. Mayorovaa, b, *, T. V. Kulikovaa, b, K. Yu. Shunyaeva, b,
T. I. Gorbunovac, and M. G. Pervovac
a Institute of Metallurgy of the Ural Branch of the Russian Academy of Sciences,
ul. Amundsena 101, Yekaterinburg, 620016 Russia
*e-mail: imeturoran@mail.ru
b Ural Federal University, Yekaterinburg, Russia
c I.Ya. Postovskii Institute of Organic Synthesis of the Ural Branch of the Russian Academy of Sciences,
Yekaterinburg, Russia
Received March 7, 2019; revised March 7, 2019; accepted March 14, 2019
The reaction of a technical mixture of polychlorobiphenyls Sovol with sodium methoxide in dimethyl sulfoxide
and methanol was studied using the thermodynamic modeling method. The optimal process conditions
were determined: 1 atm, 115°C, 0.25 mol of dimethyl sulfoxide, 0.085 mol of methanol, the molar ratio
of polychlorobiphenyls:sodium methoxide = 1:4. Experimental data obtained using theoretically selected
conditions for the interaction of polychlorobiphenyls with sodium methoxide show a spectrum of positive
effects: savings of reagents, exhaustive conversion, and the formation of potentially less toxic substances. The
studied interaction can serve as a stage for the pretreatment of toxic polychlorinated biphenyls for the pyrolytic
method of destruction.
Keywords: polychlorobiphenyls, thermodynamic modeling, pyrolytic method
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 9 2019