ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2019, том 89, № 9, с. 1471-1476
ПИСЬМА
В РЕДАКЦИЮ
УДК 547.743.1
СИНТЕЗ 4(5)-АРИЛИМИДАЗОЛИН-2-ОНОВ,
СОДЕРЖАЩИХ АЛКИЛФОСФОРИЛЬНЫЙ
ФРАГМЕНТ
© 2019 г. А. В. Смолобочкинa,*, А. С. Газизовa, К. В. Матылицкий b, Л. И. Вагаповаa,
А. Р. Буриловa, b, М. А. Пудовикa
a Институт органической и физической химии имени А. Е. Арбузова Фудурального исследовательского центра
«Казанский научный центр Российской академии наук», ул. Академика Арбузова 8, Казань, 420088 Россия
*e-mail: smolobochkin@iopc.ru
b Казанский национальный исследовательский технологический университет, Казань, Россия
Поступило в Редакцию 27 мая 2019 г.
После доработки 27 мая 2019 г.
Принято к печати 31 мая 2019 г.
Кислотно-катализируемой реакцией {2-[1-(2,2-диметоксиэтил)-3-(фенилкарбоксамидо)]этил}фосфоната
либо диэтил-[2-(2-оксо-3-фенил-2,3-дигидро-1H-имидазол-1-ил)этил]фосфоната с резорцином и его
производными были синтезированы новые 4(5)-арилимидазолин-2-оны. Показано, что на соотношение
образующихся региоизомеров существенное влияние оказывает строение исходных соединений, что
позволяет получать продукты с преобладанием одного региоизомера.
Ключевые слова: имидазолидин-2-оны, фенолы, фосфонаты, ацетали
DOI: 10.1134/S0044460X19090233
Циклические мочевины, в особенности произ-
производных, а также повышению устойчивости
водные имидазолидин-2-она, привлекают внима-
к гидролизу. В то же время, сведения о синтезе
ние исследователей в связи с их высокой и разно-
фосфорсодержащих имидазолидин-2-онов в ли-
образной биологической активностью. Так, пред-
тературе представлены единичными примерами.
ставители этого класса соединений проявляют
К настоящему моменту имеются только две пу-
противораковые [1, 2], антиоксидантные [3], анти-
бликации, в которых описаны способы введения
бактериальные [4], антидепресантные свойства [5,
фосфорного фрагмента в боковую цепь имидазо-
6], являются антагонистами рецепторов αvβ3 [7],
лидин-2-онов. Первый метод заключается в трех-
нейрокина-1 (NK1) [8], CCR5 [9], ингибиторами
компонентной конденсации альдегидов, имидазо-
ВИЧ-1 протеазы [10] и стеароил-CoA десатуразы
лидин-2-она и фосфитов [13], второй основан на
1 (SCD1) [11]. Производные имидазолидин-2,4-ди-
реакции N-метоксиметилмочевины с трифенил-
она, содержащие в своем составе фосфорильный
фосфином в присутствии газообразного хлористо-
фрагмент, проявляют бактерицидные свойства, в
го водорода [14].
частности, против золотистого стафилококка [12].
Ранее нами был разработан оригинальный
Следует отметить, что имидазолидин-2-оны, кото-
метод получения производных имидазолидин-2-
рые содержат связь N-P, гидролитически неустой-
она на основе кислотно-катализируемой реакции
чивы. Введение в структуру имидазолидин-2-она
1-(2,2-диметоксиэтил)-3-арилмочевин с резорци-
алкилфосфорильной группы может привести к
ном и его производными [15-17]. В данной работе
усилению фармакологической активности этих
представлено расширение границ этого метода, по-
1471
1472
СМОЛОБОЧКИН и др.
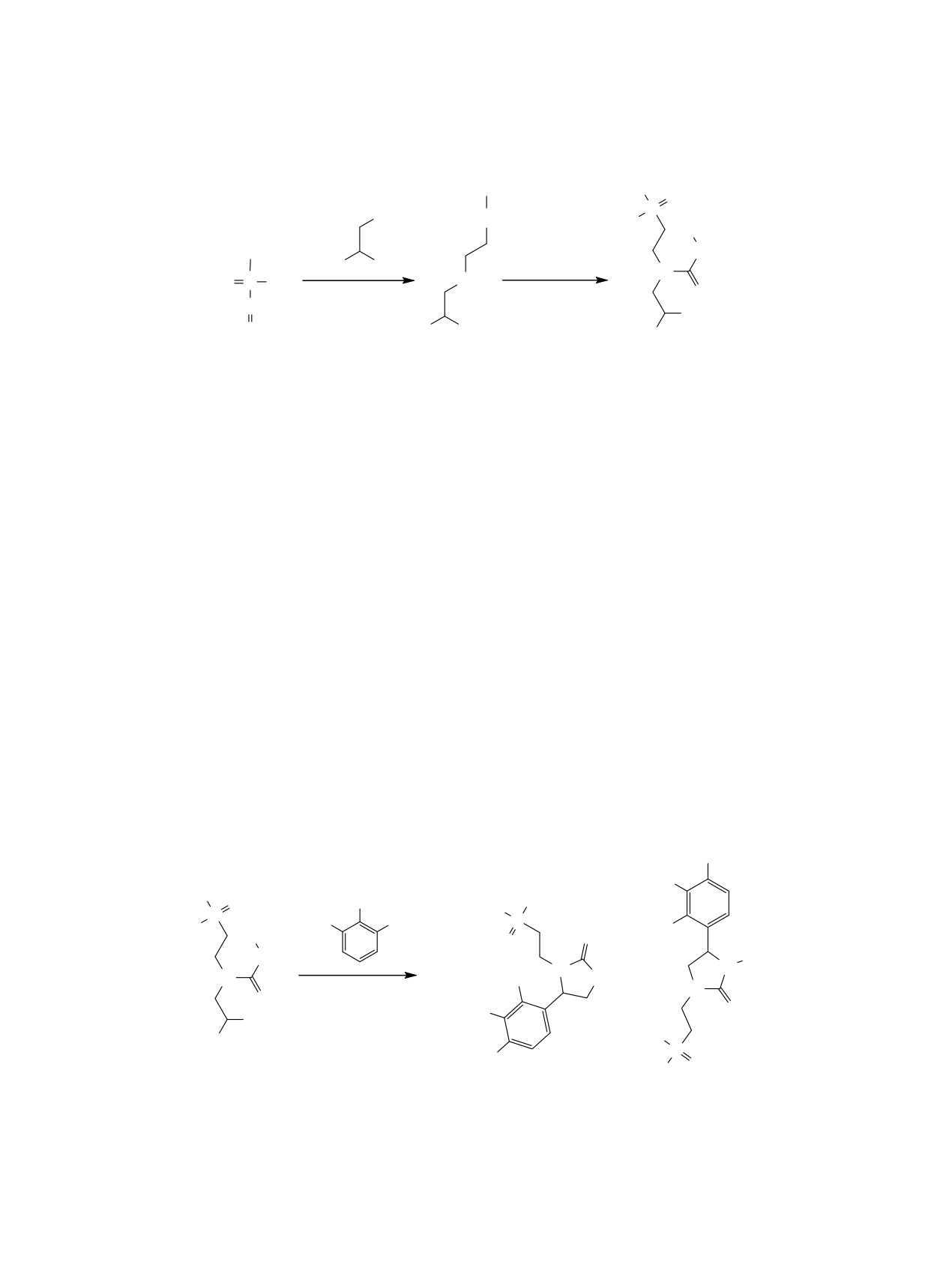
Схема 1.
EtO
OEt
O
P
NH2
EtO P O
EtO
Ph
PhNCO, CHCl3,
OEt
NH
MeO
OMe
20qC, 24 ɱ
N
O
P
OEt
NH
H2O, 100qɋ, 4 ɱ
O
CH
OMe
MeO OMe
CH2
MeO
1
2
3
зволяющего получать неизвестные ранее фосфор-
Взаимодействие фосфоната 3 с 2-метилрезор-
содержащие производные имидазолидин-2-она. С
цином также привело к образованию смеси реги-
этой целью на первом этапе был осуществлен син-
оизомерных имидазолин-2-онов 4б и 5б в соот-
тез
диэтил-{2-[1-(2,2-диметоксиэтил)-3-фенил-
ношении 9:1. В случае пирогаллола соотношение
карбоксамидо]этил}фосфоната
3 с использова-
региоизомеров составило 2:1 (схема 2).
нием двухстадийной методики (схема 1). На пер-
Ранее нами было показано, что 1-(2,2-диме-
вой стадии взаимодействием винилфосфоната 1 с
токсиэтил)-1-метил-3-фенилмочевина в хлоро-
2,2-диметоксиэтан-1-амином по реакции аза-Ми-
форме в присутствии трифторуксусной кислоты
хаэля был получен ацеталь 2, который при обра-
подвергается внутримолекулярной циклизации с
ботке фенилизоцианатом (вторая стадия) превра-
образованием производного 1,3-дигидро-2H-ими-
щается в фосфонат 3.
дазол-2-она, которое далее вступает в реакцию с
В результате реакции соединения 3 с резорци-
фенолами [18]. Мы предположили, что мочевина
ном в хлороформе при комнатной температуре с
3 также способна к внутримолекулярной циклиза-
использованием трифторуксусной кислоты в каче-
ции в присутствии кислот. Действительно, в ана-
стве катализатора была выделена смесь 5- и 4-ари-
логичных условиях нам удалось синтезировать
лимидазолин-2-онов 4а и 5а в соотношении 4:1.
циклическую мочевину 6. Дальнейшие исследо-
Соотнесение региоизомеров было осуществлено
вания показали, что имидазолин-2-он 6 вступает в
по данным ЯМР 1H [18].
реакцию с резорцином и его производными в хло-
Схема 2.
OH
R
EtO
O
R
OEt
EtO
P
HO
OH
P
EtO
HO
Ph
O
O
NH
Ph
+
N
N
N
HO
N Ph
N
O
CF3CO2H, CHCl3,
R
O
OMe
20oC, 20 ɱ
EtO
MeO
P
HO
O
EtO
3
4a ɜ
5a ɜ
R = H (a), Me (ɛ), OH (ɜ).
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 9 2019
СИНТЕЗ 4(5)-АРИЛИМИДАЗОЛИН-2-ОНОВ
1473
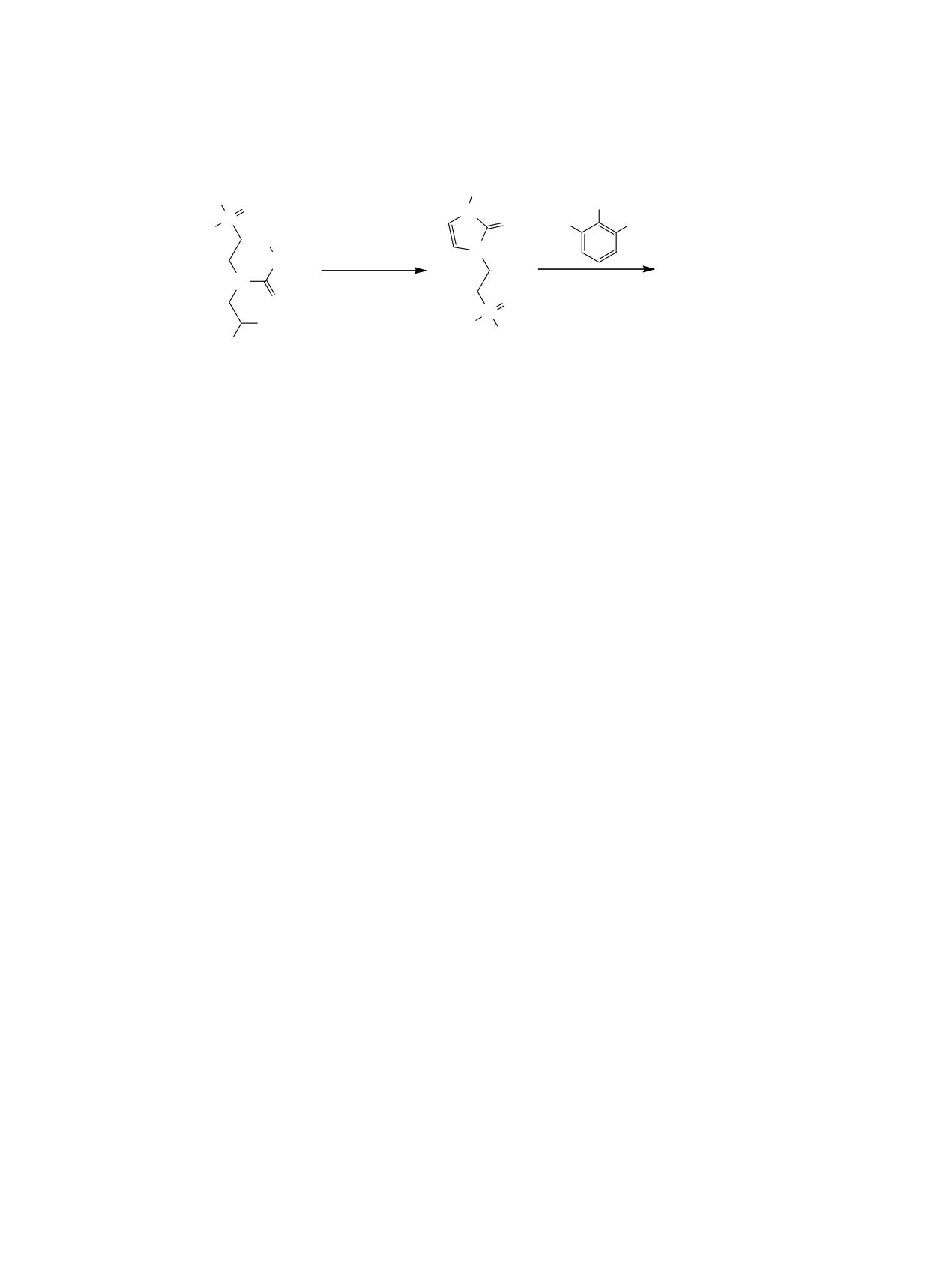
Схема 3.
Ph
EtO
R
O
N
P
O
HO
OH
EtO
Ph
CF3CO2H, CHCl3,
N
20oC, 20 ɱ
NH
4a ɜ +
5a ɜ
N
CF
3
CO2H, CHCl3,
O
O
20oC, 20 ɱ
P
OMe
EtO
OEt
MeO
3
6
роформе в присутствии трифторуксусной кисло-
1.26 т (6Н, СН3, 3JHH 7.1 Гц), 2.04-2.19 м (2Н, СН2),
ты. Продуктами реакции являются региоизомер-
3.28-3.37 м (2Н, СН2), 3.43 с (6Н, СН3), 3.53-3.62
ные смеси 5-арилимидазолин-2-онов 4а-в и 4-ари-
м (2Н, СН2), 3.96-4.09 м (4Н, СН2), 4.44 т (1Н, СН,
лимидазолин-2-онов 5а-в (4а:5а = 3:1, 4б:5б =
3JHH = 4.1 Гц), 6.92 т (1Н, СНAr, 3JHH = 7.3 Гц),
5:1, 4в:5в = 3:1) (схема 3).
7.19 т (2Н, СНAr, 3JHH = 7.9 Гц), 7.29 д (2Н, СНAr,
3JHH = 7.5 Гц). Спектр ЯМР 13С (CDCl3), δC, м. д.:
Таким образом, в результате реакции
{2-
[1-(2,2-диметоксиэтил)-3-фенилкарбоксамидо]-
16.09 д (3JСР = 5.6 Гц), 24.39 д (1JСР = 135.8 Гц),
43.21, 50.62, 55.14, 61.45 д (2JСР = 6.2 Гц), 104.38,
этил}фосфоната либо диэтил-[2-(2-оксо-3-фенил-
2,3-дигидро-1H-имидазол-1-ил)этил]фосфоната с
119.18, 122.03, 128.37, 139.69, 155.98. Спектр ЯМР
31Р (CDCl3): δP 29.72 м. д. Масс-спектр (ESI-TOF),
резорцином, 2-метилрезорцином и пирогаллолом
синтезированы новые фосфорсодержащие 5-ари-
m/z: 389 [M + Н]+.
лимидазолин-2-оны и
4-арилимидазолин-2-оны.
Диэтил-[2-(2-оксо-3-фенил-2,3-дигидро-1H-
Показано, что на соотношение образующихся ре-
имидазол-1-ил)этил]фосфонат (6). Смесь 1.1 г
гиоизомеров оказывает влияние как строение ис-
фосфоната 3, 0.6 г трифторуксусной кислоты и
ходного фосфоната, так и природа фенола.
10 мл хлороформа перемешивали 20 ч при 20°С.
Диэтил-{2-[(2,2-диметоксиэтил)амино]-
Послу удаления растворителя продукт получен в
этил}фосфонат (2). Смесь 3.6 г диэтилвинилфос-
виде масла. Выход 0.7 г (80%). ИК спектр, ν, см-1:
фоната, 2.3 г 2,2-диметоксиэтан-1-амина и 20 мл
1207, 1635, 1670, 3065, 3264. Спектр ЯМР 1Н
воды кипятили 4 ч. После удаления растворителя,
(CDCl3), δ, м. д.: 1.24 т (6Н, СН3, 3JHH = 7.1 Гц),
остаток промывали диэтиловым эфиром и сушили
2.36 д. т (2Н, СН2, 2JHР = 17.8, 3JHH = 6.8 Гц), 3.96
в вакууме. Выход 4.1 г (69%), масло. ИК спектр,
д. т (2Н, СН2, 2JHР = 18.8, 3JHH = 6.8 Гц), 4.03-4.12
ν, см-1: 1439, 1686, 3411. Спектр ЯМР 1Н (CDCl3),
м (4Н, СН2), 6.66 д (1Н, СН, 3JHH = 3.0 Гц), 6.79 д
δ, м. д.: 1.30 т (6Н, СН3, 3JHH = 7.1 Гц), 1.91-2.02
(1Н, СН, 3JHH = 3.0 Гц), 7.38 т (2Н, СНAr, 3JHH =
м (2Н, СН2), 2.72 д (2Н, СН2, 3JHH = 5.4 Гц), 2.87-
6.8 Гц), 7.45-7.53 м (4Н, СНAr). Спектр ЯМР 31Р
2.95 м (2Н, СН2), 3.35 с (6Н, СН3), 4.02-4.10 м (4Н,
(CDCl3): δР 29.32 м. д. Масс-спектр (ESI-TOF),
СН2), 4.44 т (1Н, СН, 3JHH = 5.4 Гц). Спектр ЯМР
m/z: 325 [M + Н]+, 347 [M + Na]+.
31Р (CDCl3): δР 34.30 м. д. Масс-спектр (ESI-TOF),
Общий метод синтеза 5-арилимидазолин-2-
m/z: 254 [M + Н]+.
онов 4а-в и 4-арилимидазолин-2-онов 5а-в. а.
Диэтил-{2-[1-(2,2-диметоксиэтил)-3-фенил-
Смесь ацеталя 3 (1.29 ммоль), фенола (1.29 ммоль)
мочевина]этил}фосфонат (3). Смесь 3.6 г фосфо-
и трифторуксусной кислоты (2.57 ммоль) в 10 мл
ната 2, 1.7 г фенилизоцианата, 10 мл безводного
хлороформа перемешивали 20 ч при 20°С. После
хлороформа перемешивали 9 ч при 20°С. После
удаления растворитель остаток промывали диэти-
удаления растворителя продукт получен в виде
ловым эфиром. Белый порошок сушили в вакуу-
масла. Выход 3.5 г (65%). ИК спектр, ν, см-1: 1242,
ме. Выход 33% (соотношение 4:1), т. пл. 76-80°С.
1440, 1665, 3334. Спектр ЯМР 1Н (CDCl3), δ, м. д.:
Масс-спектр (ESI-TOF), m/z: 435 [M + Н]+, 457
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 9 2019
1474
СМОЛОБОЧКИН и др.
[M + Na]+. Найдено, %: C 58.20; H 6.36; N 6.30; P
этил}фосфонат (4б). Спектр ЯМР 1Н (ДМСО-d6),
6.89. C21H27N2O6P. Вычислено, %: C 58.06; H 6.26;
δ, м. д.: 1.17 т. д (6Н, СН3, 3JHH = 7.0, 4JHР =
N 6.45; P 7.13.
3.1 Гц), 1.74-1.86 м (1Н, СН2), 2.01 с (3Н, СН3),
1.97-2.10 м (2Н, СН2), 2.80-2.90 м (1Н, СН2),
б. Смесь фосфоната 6 (1.54 ммоль), фенола
3.52-3.64 м (2Н, СН2), 3.85-3.96 м (4Н, СН2), 5.04-
(1.54 ммоль), трифторуксусной кислоты
(3.09
5.11 м (1Н, СН), 6.40 д (1Н, СНAr, 3JHH = 8.3 Гц),
ммоль) и 10 мл хлороформа перемешивали 20 ч
6.83 д (1Н, СНAr, 3JHH = 8.3 Гц), 6.98 т (1Н, СНAr,
при 20°С. После удаления растворителя остаток
3JHH = 7.3 Гц), 7.30 т (2Н, СНAr, 3JHH = 8.0 Гц),
промывали диэтиловым эфиром. Белый порошок
7.59 д (2Н, СНAr, 3JHH = 7.9 Гц), 8.50 с (1Н, ОН),
сушили в вакууме. Смесь региоизомеров идазо-
9.27 с (1Н, ОН). Спектр ЯМР 31Р (ДМСО-d6): δР
лин-2-онов 4а и 5а выделена в соотношении 3:1.
27.25 м. д.
Выход 40%, т. пл. 142-148°С.
Диэтил-{2-[4-(2,4-дигидрокси-3-метил-
Диэтил-{2-[5-(2,4-дигидроксифенил)-2-оксо-
фенил)-2-оксо-3-фенилимидазолидин-1-ил]
3-фенилимидазолидин-1-ил]этил}фосфонат
этил}фосфонат (5б). Спектр ЯМР 1Н (ДМСО-d6),
(4а). Спектр ЯМР 1Н (ДМСО-d6), δ, м. д.: 1.17 т.
δ, м. д.: 1.23 т. д (6Н, СН3, 3JHH = 7.0, 4JHР = 0.9 Гц),
д (6Н, СН3, 3JHH = 7.0, 4JHР = 3.1 Гц), 1.76-1.87
1.74-1.86 м (1Н, СН2), 2.08 с (3Н, СН3), 1.97-2.10
м (1Н, СН2), 1.98-2.07 м (2Н, СН2), 2.79-2.90
м (2Н, СН2), 2.80-2.90 м (1Н, СН2), 3.52-3.64 м
м (1Н, СН2), 3.50-3.62 м (2Н, СН2), 3.84-3.94
(2Н, СН2), 4.03-4.15 м (4Н, СН2), 5.47-5.52 м
м (4Н, СН2), 5.03-5.11 м (1Н, СН), 6.40 д (1Н,
(1Н, СН), 6.23 д (1Н, СНAr, 3JHH = 8.4 Гц), 6.60
СНAr, 3JHH = 8.3 Гц), 6.83 д (1Н, СНAr, 3JHH =
д (1Н, СНAr, 3JHH = 8.2 Гц), 6.90 т (1Н, СНAr,
8.3 Гц), 6.99 т (1Н, СНAr, 3JHH = 7.2 Гц), 7.30 т
3JHH = 7.5 Гц), 7.19 т (2Н, СНAr, 3JHH = 7.5 Гц),
(2Н, СНAr, 3JHH = 7.9 Гц), 7.59 д (2Н, СНAr, 3JHH =
7.41 д (2Н, СНAr, 3JHH = 7.9 Гц), 8.55 с (1Н, ОН),
8.3 Гц), 8.30 с (1Н, СНAr), 8.50 с (1Н, ОН), 9.28 с
9.11 с (1Н, ОН). Спектр ЯМР 31Р (ДМСО-d6): δР
(1Н, ОН). Спектр ЯМР 31Р (ДМСО-d6): δР 30.64 м. д.
29.27 м. д.
Диэтил-{2-[4-(2,4-дигидроксифенил)-2-оксо-
Смесь региоизомеров идазолин-2-онов 4в и
3-фенилимидазолидин-1-ил]этил}фосфонат
5в. а. Выход 30% (соотношение 2:1), масло. Масс-
(5а). Спектр ЯМР 1Н (ДМСО-d6), δ, м. д.: 1.23 т.
спектр (ESI-TOF), m/z: 451 [M + Н]+.
д (6Н, СН3, 3JHH = 7.0, 4JHР = 3.0 Гц), 1.76-1.87
б. Смесь региоизомеров идазолин-2-онов 4в
м (1Н, СН2), 1.98-2.07 м (2Н, СН2), 3.09-3.15
и 5в выделена в соотношении 3:1. Выход 33%,
м (1Н, СН2), 3.50-3.62 м (2Н, СН2), 3.97-4.04
масло.
м (4Н, СН2), 5.46-5.52 м (1Н, СН), 6.24 д (1Н,
Диэтил-{2-[2-оксо-3-фенил-5-(2,3,4-тригид-
СНAr, 3JHH = 8.4 Гц), 6.60 д (1Н, СНAr, 3JHH =
роксифенил)имидазолидин-1-ил]этил}фос-
8.4 Гц), 6.90 т (1Н, СНAr, 3JHH = 7.3 Гц), 7.19 т
фонат (4в). Спектр ЯМР 1Н (ацетон-d6), δ, м. д.:
(2Н, СНAr, 3JHH = 7.9 Гц), 7.41 д (2Н, СНAr, 3JHH =
1.19-1.27 м (6Н, СН3), 1.89-2.12 м (3Н, СН2), 3.07-
8.1 Гц), 8.55 с (1Н, СНAr), 8.97 с (1Н, ОН), 9.12 с
3.18 м (1Н, СН2), 3.74-3.84 м (2Н, СН2), 3.95-4.10
(1Н, ОН). Спектр ЯМР 31Р (ДМСО-d6): δР 30.93 м. д.
м (4Н, СН2), 5.04-5.13 м (1Н, СН), 6.40 д (1Н, СНAr,
Смесь региоизомеров идазолин-2-онов 4б и
3JHH = 8.4 Гц), 6.69 д (1Н, СНAr, 3JHH = 8.4 Гц), 7.01
5б. а. Выход 60% (соотношение 9:1), т. пл. 156-
т (1Н, СНAr, 3JHH = 8.8 Гц), 7.31 т (2Н, СНAr, 3JHH =
158°С. Масс-спектр (ESI-TOF), m/z: 449 [M + Н]+,
8.8 Гц), 7.53 д (2Н, СНAr, 3JHH = 8.1 Гц). Спектр
471 [M + Na]+. Найдено, %: C 59.08; H 6.70; N 6.29;
ЯМР 31Р (ацетон-d6): δР 29.56 м. д.
P 7.01. C22H29N2O6P. Вычислено, %: C 58.92; H
Диэтил-{2-[2-оксо-3-фенил-4-(2,3,4-тригид-
6.52; N 6.25; P 6.91.
роксифенил)имидазолидин-1-ил]этил}фос-
б. Смесь региоизомеров идазолин-2-онов 4б и
фонат (5в). Спектр ЯМР 1Н (ацетон-d6), δ, м. д.:
5б выделена в соотношении 5:1 Выход 22%, т. пл.
1.34-1.41 м (6Н, СН3), 1.89-2.12 м (3Н, СН2), 3.19-
146-153°С.
3.28 м (1Н, СН2), 3.74-3.84 м (2Н, СН2), 3.95-4.10
Диэтил-{2-[5-(2,4-дигидрокси-3-метил-
м (4Н, СН2), 5.41-5.46 м (1Н, СН), 6.22 д (1Н, СНAr,
фенил)-2-оксо-3-фенилимидазолидин-1-ил]-
3JHH = 8.4 Гц), 6.82 д (1Н, СНAr, 3JHH = 8.3 Гц), 6.91
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 9 2019
СИНТЕЗ 4(5)-АРИЛИМИДАЗОЛИН-2-ОНОВ
1475
т (1Н, СНAr, 3JHH = 7.6 Гц), 7.16 т (2Н, СНAr, 3JHH =
Naylor-Olsen A., Rodan G.A., Rodan S.B., Whit-
7.8 Гц), 7.40 д (2Н, СНAr, 3JHH = 7.9 Гц). Спектр
man D.B., Wesolowski G.A., Duggan M.E. // Bioorg.
Med. Chem. Lett. 2002. Vol. 12. P. 25. doi 10.1016/
ЯМР 31Р (ацетон-d6): δР 29.54 м. д.
S0960-894X(01)00687-4
Спектры ЯМР 1H и 13С получены на спектро-
8. Shue H.-J., Chen X., Shih N.-Y., Blythin D.J., Paliwal S.,
метре Bruker Avance 600 (600 и 150 МГц соот-
Lin L., Gu D., Schwerdt J.H., Shah S., Reichard G.A.,
ветственно) относительно сигналов остаточных
Piwinski J.J., Duffy R.A., Lachowicz J.E., Coffin V.L.,
протонов растворителя. ИК спектры сняты на
Liu F., Nomeir A.A., Morgan C.A., Varty G.B. // Bioorg.
спектрометре UR-20 в интервале 400-3600 см-1.
Med. Chem. Lett. 2005. Vol. 15. P. 3896. doi 10.1016/j.
bmcl.2005.05.111
Кристаллические образцы исследовали в таблет-
9. Duan M., Kazmierski W.M., Tallant M., Jun J.H.,
ках KBr. Элементный анализ выполнен на при-
Edelstein M., Ferris R., Todd D., Wheelan P., Xiong Z. //
боре Carlo Erba марки EA 1108. Масс-спектры
Bioorg. Med. Chem. Lett. 2011. Vol. 21. P. 6381. doi
ионизации электрораспылением получены на
10.1016/j.bmcl.2011.08.096
масс-спектрометре AmazonX (Bruker Daltonik
10. Kazmierski W.M., Furfine E., Gray-Nunez Y., Spalten-
GmbH, Бремен, Германия). Температуры плавле-
stein A., Wright L. // Bioorg. Med. Chem. Lett. 2004.
ния определены в стеклянных капиллярах на при-
Vol. 14. P. 5685. doi 10.1016/j.bmcl.2004.08.038
боре Stuart SMP 10.
11. Sun S., Zhang Z., Kodumuru V., Pokrovskaia N., Fona-
rev J., Jia Q., Leung P.-Y., Tran J., Ratkay L.G.,
ФОНДОВАЯ ПОДДЕРЖКА
McLaren D.G., Radomski C., Chowdhury S., Fu J.,
Hubbard B., Winther M.D., Dales N.A. // Bioorg.
Работа выполнена при финансовой поддержке
Med. Chem. Lett. 2014. Vol. 24. P. 520. doi 10.1016/j.
Российского фонда фундаментальных исследова-
bmcl.2013.12.036
ний и Правительства Республики Татарстан (про-
12. Li L., Pu T., Zhanel G., Zhao N., Ens W., Liu S. //
екта № 18-43-16004) с использованием оборудова-
Adv. Health. Mater. 2012. Vol. 1. P. 609. doi 10.1002/
ния Казанского научного центра Российской ака-
adhm.201200018
демии наук.
13. Mikroyannidis J.A.
// Phosphorus, Sulfur,
Silicon, Relat. Elem. 1982. Vol. 12. P. 249. doi
КОНФЛИКТ ИНТЕРЕСОВ
10.1080/03086648208077453
14. Petersen H., Reuther W. // J. Lieb. Ann. Chem. 1973.
Авторы заявляют об отсутствии конфликта
Vol. 766. P. 58. doi 10.1002/jlac.19727660108
интересов.
15. Хакимов М.С., Газизов А.C., Бурилов А.Р., Пудо-
СПИСОК ЛИТЕРАТУРЫ
вик М.А., Коновалов А.И. // ЖОХ. 2009. Т. 79.
№ 6. С. 991; Khakimov M.S., Gazizov A.S., Burilov A.R.,
1. Congiu C., Cocco M.T., Onnis V. // Bioorg. Med.
Pudovik M.A., Konovalov A.I. // Russ. J. Gen.
Chem. Lett. 2008. Vol. 18. P. 989. doi 10.1016/j.
Chem. 2009. Vol. 79. Р. 1163. doi 10.1134/
bmcl.2007.12.023
S107036320906022X
2. Kwak S.-H., Bang S.-C., Seo H.-H., Shin H.-R., Lee K.-C.,
16. Газизов А.С., Хакимов М.С., Бурилов А.Р., Пудо-
Hoang L.T.A., Jung S.-H. // Arch. Pharm. Res. 2006.
вик М.А., Криволапов Д.Б., Литвинов И.А., Коно-
Vol. 29. P. 721. doi 10.1007/BF02974070
валов А.И. // Изв. АН Сер. хим. 2009. № 1. С. 235;
3. Watanabe K., Morinaka Y., Hayashi Y., Shinoda M.,
Gazizov A.S., Khakimov M.S., Burilov A.R., Pudo-
Nishi H., Fukushima N., Watanabe T., Ishibashi A.,
vik M.A., Krivolapov D.B., Litvinov I.A., Konovalov A.I. //
Yuki S., Tanaka M. // Bioorg. Med. Chem. Lett. 2008.
Vol. 18. P. 1478. doi 10.1016/j.bmcl.2007.12.064
Russ. Chem. Bull. Int. Ed. 2009. N 58. Р. 238. doi
10.1007/s11172-009-0036-0
4. Bronson J.J., DenBleyker K.L., Falk P.J., Mate R.A.,
Ho H.-T., Pucci M.J., Snyder L.B. // Bioorg. Med.
17. Бурилов А.Р., Газизов А.С., Хакимов М.С., Пудо-
Chem. Lett. 2003. Vol. 13. P. 873. doi 10.1016/S0960-
вик М.А., Коновалов А.И. // ЖОХ. 2008. Т. 78. № 12.
894X(02)01076-4
С. 2065; Burilov A.R., Gazizov A.S., Khakimov M.S.,
5. Wright W.B., Brabander H.J., Hardy R.A., Oster-
Kharitonova N.I., Pudovik M.A., Konovalov A.I. // Russ.
berg A.C. // J. Med. Chem. 1966. Vol. 9. P. 852. doi
J. Gen. Chem. 2008. Vol. 78. Р. 2411. doi 10.1134/
10.1021/jm00324a017
S1070363208120220
6. Lien E.J., Hussain M., Golden M.P. // J. Med. Chem.
18. Burilov A.R., Khakimov M.S., Gazizov A.S., Pudo-
1970. Vol. 13. P. 623. doi 10.1021/jm00298a009
vik M.A., Syakaev V.V, Krivolapov D.B., Konova-
7. Meissner R.S., Perkins J.J., Duong L.T., Hartman G.D.,
lov A.I. // Mendeleev Commun. 2008. Vol. 18. Р. 54. doi
Hoffman W.F., Huff J.R., Ihle N.C., Leu C.-T., Nagy R.M.,
10.1016/j.mencom.2008.01.020
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 9 2019
1476
СМОЛОБОЧКИН и др.
Synthesis of Alkylphosphoryl-Containing
4(5)-Arylimidazolin-2-ones
A. V. Smolobochkina, *, A. S. Gazizova, K. V. Matylitskiib, L. I. Vagapovaa,
A. R. Burilova, b, and M. A. Pudovika
a A.E. Arbuzov Institute of Organic and Physical Chemistry of the Federal Research Center
“Kazan Scientific Center of the Russian Academy of Sciences”, ul. Akademika Arbuzova 8, Kazan, 420088 Russia
*e-mail: smolobochkin@iopc.ru
b Kazan National Research Technological University, Kazan, Russia
Received May 27, 2019; revised May 27, 2019; accepted May 31, 2019
The acid-catalyzed reaction of {2-[1-(2,2-dimethoxyethyl)-3-(phenylcarboxamido)]ethyl}phosphonate or diethyl
[2-(2-oxo-3-phenyl-2,3-dihydro-1H-imidazol-1-yl)ethyl]phosphonate with resorcinol and its derivatives afforded
new 4(5)-arylimidazolin-2-ones. The ratio of the resulting regioisomers is significantly affected by the structure
of the starting compounds, which allows one to obtain products with a predominance of one regioisomer.
Keywords: imidazolidin-2-ones, phenols, phosphonates, acetals
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 9 2019