ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2020, том 90, № 1, с. 10-17
УДК 547-327;541.62;544.18
ОБРАТИМЫЕ ПЕРЕГРУППИРОВКИ
2,4,6-ТРИНИТРОФЕНИЛЬНОЙ ГРУППЫ
В АМИДИНОВОЙ СИСТЕМЕ
© 2020 г. Г. А. Душенкоa,*, И. Е. Михайловa,b, В. И. Минкинa
a Научно-исследовательский институт физической и органической химии Южного федерального университета,
пр. Стачки 194/2, Ростов-на-Дону, 344090 Россия
b Федеральный исследовательский центр «Южный научный центр Российской академии наук»,
Ростов-на-Дону, 344006 Россия
*e-mail: dushenko@ipoc.sfedu.ru
Поступило в Редакцию 26 июня 2019 г.
После доработки 26 июня 2019 г.
Принято к печати 30 июня 2019 г.
Квантово-химическими расчетами по методу теории функционала плотности B3LYP/6-311++G(d,p)
изучены таутомерные 1,3-N,N'-миграции 2,4,6-тринитрофенильной группы в производных N,N’-
диарилбензамидина и N,N'-диарилформамидина.
Ключевые слова: перегруппировки, полинитроарилпроизводные амидинов, DFT расчеты
DOI: 10.31857/S0044460X20010023
Соединения c полинитроарильными и нитро-
ΔG≠298 = 17.3 ккал/моль, ΔH≠ = 15.5±0.2 ккал/моль,
бензоксадиазольными группами широко приме-
ΔS≠ = -6.0±0.5 э. е., k298 = 1.25 c-1 (1a); ΔG≠298 =
няются в фармакологии [1-3]. Биполярные гете-
17.6 ккал/моль, ΔH≠ = 16.3±0.1 ккал/моль, ΔS≠ =
роспиро-σ-комплексы Мейзенгеймера на их ос-
-4.9±0.2 э. е., k298 = 0.62 c-1 (1б) [15].
нове используются в качестве фото- и термохро-
N,N'-Миграции пикрильной группы могут
мов, а также высокоэффективных люминофоров
происходить как согласованные
1,3-сигматроп-
[4, 5]. Производные амидинов проявляют широ-
ные сдвиги, запрещенные правилами сохранения
кий спектр биологической активности и служат
орбитальной симметрии Вудворда-Хоффманна,
эффективными лигандами для получения разно-
или как внутримолекулярное ароматическое ну-
образных металлокомплексов, обладающих ката-
клеофильное замещение у мигрирующего sp2-ги-
литическими свойствами [6-14]. Изучение строе-
бридизованного атома углерода через образование
ния полинитроарилпроизводных амидинов и про-
биполярного четырехчленного спироциклическо-
текающей в их молекулах миграции нитроариль-
го интермедиата (комплекса Мейзенгеймера). В
ных групп представляет собой актуальную задачу.
подобных реакциях полинитроарилпроизводных
Ранее нами были синтезированы N-(2,4,6-
трополонов и других подобных соединений гете-
тринитрофенил)-N,N'-диарилбенз(форм)амиди-
роспироциклические интермедиаты были выделе-
ны 1a-г, соединение 1a было охарактеризовано
ны и охарактеризованы [4, 5]. В соответствующих
методом рентгеноструктурного анализа [15-17].
производных формамидинов 1в, г миграция пи-
В производных бензамидинов 1a и 1б методом
крильной группы не обнаружена в шкале времени
динамического ЯМР в хлорбензоле были зафик-
метода динамического ЯМР.
сированы быстрые обратимые внутримолекуляр-
ные 1,3-N,N'-миграции 2,4,6-тринитрофенильной
Для изучения детального механизма 1,3-N,N'-
(пикрильной) группы и определены кинетические
миграции пикрильной группы в амидиновой си-
и активационные параметры перегруппировки:
стеме, выявления устойчивости спироцикличе-
10
ОБР
АТИМЫЕ ПЕРЕГРУППИРОВКИ 2,4,6-ТРИНИТРОФЕНИЛЬНОЙ ГРУППЫ
11
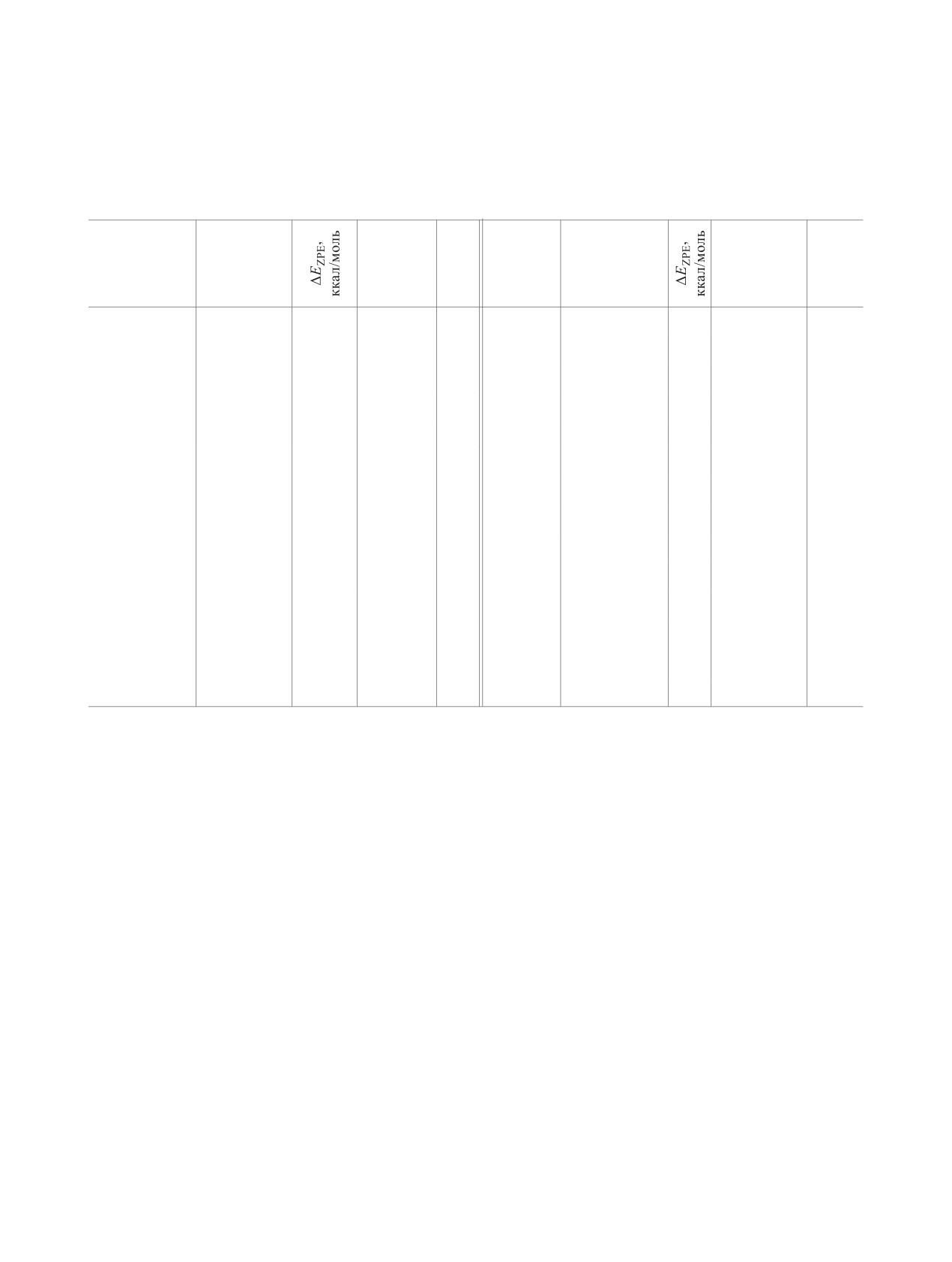
Полные, относительные энергии с включением энергии нулевых гармонических колебаний и свободные энергии
активации основного состояния структур 1a-4г, 6a-г и переходных состояний ПС-5a-г при 1,3-N,N'-миграции пи-
крильной группы, а также минимальные гармонические частоты, рассчитанные методом B3LYP/6-311++G(d,p) в
газовой фазе и с учетом сольватации (PCM) в ДМСОа,б
ΔG298,
ΔG298,
Структура
Eполн, а. е.
Структура
Eполн, а. е.
ккал/моль
ккал/моль
1a
-1917.24023
0
0
19
ПС-5б
-1766.76009
14.0
15.4
-213
2a
-1917.23207
5.0
5.4
13
6б
-1766.76271
12.9
13.3
18
3a
-1917.23132
5.6
6.3
15
1в
-1686.13727
0
0
21
4a
-1917.23607
2.4
2.4
17
2в
-1686.12532
7.5
7.8
16
ПС-5a
-1917.21811
13.3
13.6
-208
3в
-1686.12227
9.3
9.4
17
6a
-1917.22106
12.1
12.0
18
4в
-1686.13188
3.2
3.0
20
1a, ДМСО
-1917.26331
0
0
20
ПС-5в
-1686.09828
23.8
24.7
-167
ПС-5a, ДМСО
-1917.24369
11.6
12.3
-221
6в
-1686.09899
23.7
23.7
17
6a, ДМСО
-1917.24963
8.6
8.4
17
1г
-1535.68012
0
0
22
1б
-1766.78297
0
0
18
2г
-1535.66851
7.4
8.1
19
2б
-1766.77515
5.1
5.2
17
3г
-1535.66449
9.7
10.0
19
3б
-1766.77353
6.0
6.7
15
4г
-1535.67442
3.4
2.8
20
4б
-1766.77896
2.5
2.2
19
ПС-5г
-1535.64032
24.3
25.0
-154
6г
-1535.64087
24.2
22.9
13
a Eполн - полная энергия, ΔEZPE - относительная энергия с учетом энергии нулевых гармонических колебаний, ω1 - наименьшая
величина гармонической колебательной частоты или величина единственной мнимой гармонической колебательной частоты.
б EZPE = -1916.79022 (1a), -1916.81375 (1a, ДМСО), -1766.34339 (1б), -1685.76761 (1в), -1535.32065 (1г); G298 = -1916.86093
(1a), -1916.88409 (1a, ДМСО), -1766.41403 (1б), -1685.83265 (1в), -1535.38460 (1г).
ских интермедиатов и причины различия барье-
ΔEZPE = 2.4-9.7 ккал/моль (см. таблицу). Это со-
ров перегруппировок пикрильных производных
ответствует данным, полученным методами ЯМР,
бензамидинов 1a, б и формамидинов 1в, г рас-
ИК спектроскопии и РСА, согласно которым сое-
четным методом теории функционала плотности
динения 1a-г в растворах и в твердом состоянии
B3LYP/6-311++G(d,p) в газовой фазе и с учетом
существуют лишь в одной форме.
сольватации (PCM) в ДМСО нами исследованы
Рассчитанные геометрические параметры
изомерные и конформерные структуры соедине-
структуры 1a (рис. 1) хорошо согласуются с дан-
ний 1a-г, а также пути указанных миграций. По
ными РСА пикрильного производного бензами-
данным квантово-химических расчетов, в соеди-
дина 1a [17]. Небольшие различия рассчитанных
нениях 1a-г (схема 1) геометрические изомеры
длин связей в газовой фазе по сравнению с дан-
при связи C=N и конформеры, образующиеся в
ными РСА можно объяснить эффектами упаков-
результате вращения вокруг связи C-N, отвеча-
ки молекул в кристалле. Структуры минимумов
ют минимумам на поверхности потенциальной
N-пикрилбензамидинов
1a, б характеризуются
энергии. Пространственно менее перегруженные
устойчивой хиральной пропеллерной конформа-
E-син-изомеры 1a-г значительно более устойчи-
цией молекул вследствие того, что все 4 арильные
вы, чем Z-син-, Z-анти-, E-анти-изомеры 2a-4г,
группы выведены из плоскости амидиновой три-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 1 2020
12
ДУШЕНКО и др.
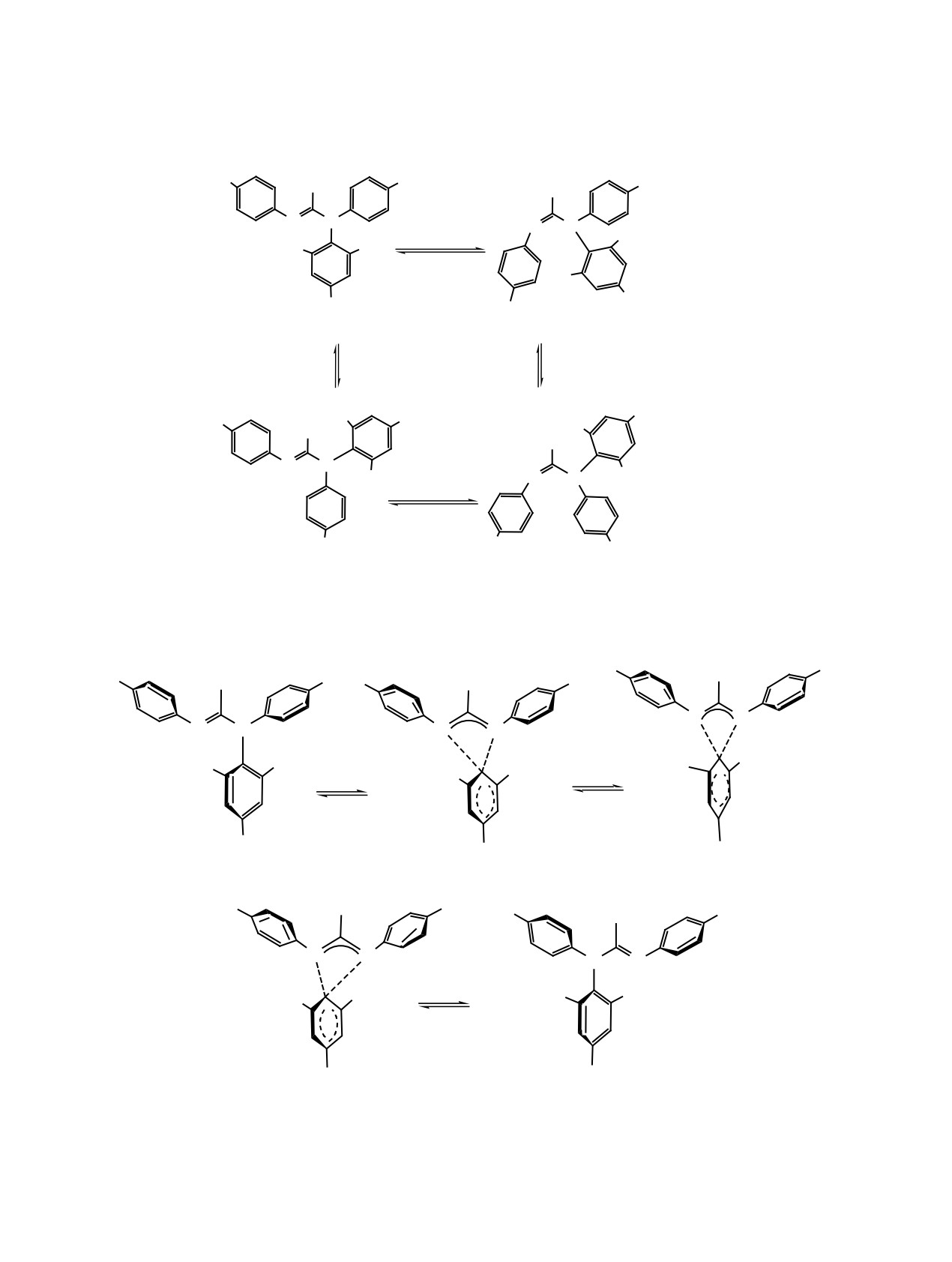
Схема 1.
R1
1
R
R1
R2
R2
N N
N
N
E/Z ɢɡɨɦɟɪɢɡɚɰɢɹ
NO2
O2N
NO2
O2N
1
NO2
NO2
R
E-ɫɢɧ- ɚ-ɝ
Z-ɫɢɧ- ɚ-ɝ
C N ɜɪɚɳɟɧɢɟ
C N ɜɪɚɳɟɧɢɟ
NO2
O2N
NO
2
R1
O2N
R2
R2
N
N
O2N
N N
NO2
E/Z ɢɡɨɦɟɪɢɡɚɰɢɹ
R1
R1
R1
E-ɚɧɬɢ- ɚ-ɝ
Z-ɚɧɬɢ- ɚ-ɝ
R1 = OMe, R2 = Ph (a); R1 = Me, R2 = Ph (ɛ); R1 = OMe, R2 = H (ɜ); R1 = Me, R2 = H (ɝ).
Схема 2.
1
R
R1
9
1
R2
R1
5
R
R2
R1
R2
R1
8
4
1
2
1
1
1
2
1
2
1
N
N
+
N
N
N
N
+
2
NO2
2
NO2
O2N
O2N
NO2
2
O2N
3
3
_
3
_
NO
2
NO
NO2
ɚ-ɝ
ɉɋ ɚ-ɝ
ɚ-ɝ
R1
R1
R2
R2
R2
R1
2
1
2
1
N
+
N
N
N
NO2
O2N
NO2
O2N
_
NO2
NO2
ɉɋ 5'ɚ-ɝ
1'ɚ-ɝ
R1 = OMe, R2 = Ph (ɚ); R1 = Me, R2 = Ph (ɛ); R1 = OMe, R2 = H (ɜ); R1 = Me, R2 = H (ɝ).
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 1 2020
ОБР
АТИМЫЕ ПЕРЕГРУППИРОВКИ 2,4,6-ТРИНИТРОФЕНИЛЬНОЙ ГРУППЫ
13
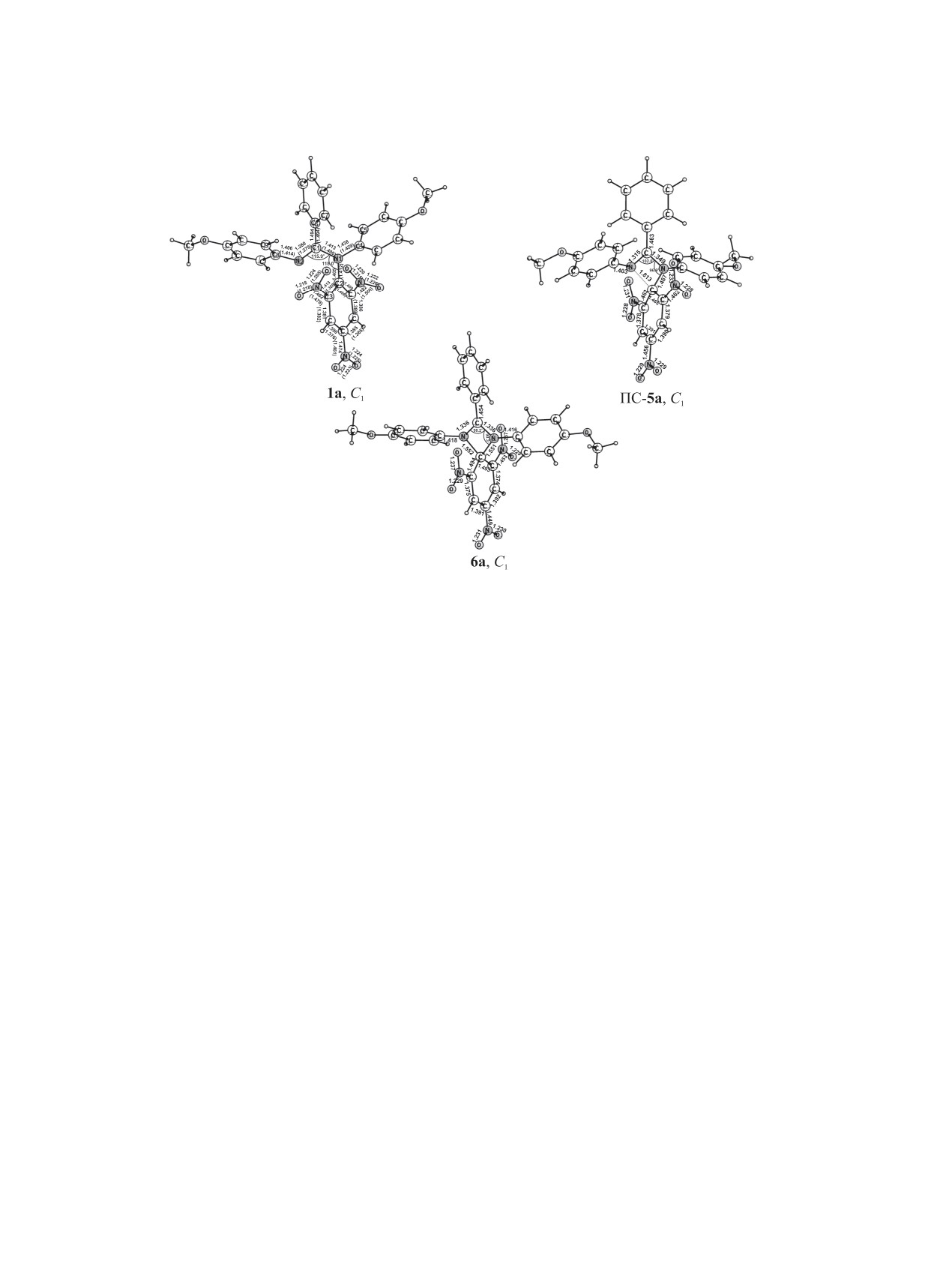
Рис. 1. Рассчитанные методом B3LYP/6-311++G(d,p) геометрические параметры структуры основного состояния пикриль-
ного производного бензамидина 1a, переходного состояния N,N'-миграции пикрильной группы ПС-5a и интермедиата 6a в
газовой фазе. Здесь и далее длины связей даны в Å, в скобках приведены данные РСА для соединения 1a [17].
ады и развернуты в одну и ту же сторону (торси-
мом углерода пикрильной группы и атомами азота
онные углы в соединении 1a: C1N2C8C9 -47.5°,
амидиновой триады лежат в пределах 1.487-1.516
N1C1C6C7 -55.9°, C1N1C4C5
-51.3°, C1N1C2C3
(C2-N1) и 1.716-1.813 Å (C2-N2), а углы N1C1N2 и
‒59.3°). В структурах 1a-г п-нитрогруппа нахо-
C1N1C2 на 14 и 21° соответственно меньше, чем в
дится в плоскости пикрильного кольца, тогда как
минимумах соединений 1a-г. Величины суммар-
о-нитрозаместители выведены из этой плоскости
ных зарядов на мигрирующей пикрильной группе
на 41.3-43.9° (рис. 1, 2).
[-0.289 (ПС-5a), -0.285 (ПС-5б), -0.317 (ПС-5в),
-0.310 e (ПС-5г)] указывают на значительное раз-
На поверхности потенциальной энергии N,N’-
деление зарядов между мигрантом и амидиновой
миграции пикрильной группы в амидиновой си-
системой.
стеме локализованы переходные состояния ПС-
5a-г симметрии С1, отвечающие взаимопревраще-
Для спироциклических интермедиатов
6a-г
нию минимумов амидинов 1a-г и четырехчленных
характерно плоское четырехчленное кольцо, орто-
спироциклических интермедиатов 6a-г (схема 2,
гональное расположение пикрильных групп отно-
рис. 1, 2). В переходных состояниях ПС-5a-г п-ни-
сительно плоскости амидиновой триады; все ни-
трогруппа находится в плоскости пикрильного
трогруппы находятся в плоскости кольца пикриль-
кольца, а о-нитрогруппы незначительно выведены
ной группы, что способствует делокализации от-
из его плоскости на 10.0-12.2°, при этом располо-
рицательного заряда на пикрильном фрагменте.
жение пикрильных групп относительно плоскости
Суммарные заряды на пикрильном фрагменте:
амидиновой триады близко к ортогональному (в
-0.398 (6a), -0.393 (6б), -0.376 (6в), -0.359 e (6г).
переходном состоянии ПС-5a торсионный угол
В интермедиатах 6a, б фенильный заместитель
C1N1C2C3
-106.2°). В переходных состояниях
при атоме углерода амидиновой триады выведен
ПС-5a-г расстояния между мигрирующим ато-
из ее плоскости в меньшей степени, чем в соеди-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 1 2020
14
ДУШЕНКО и др.
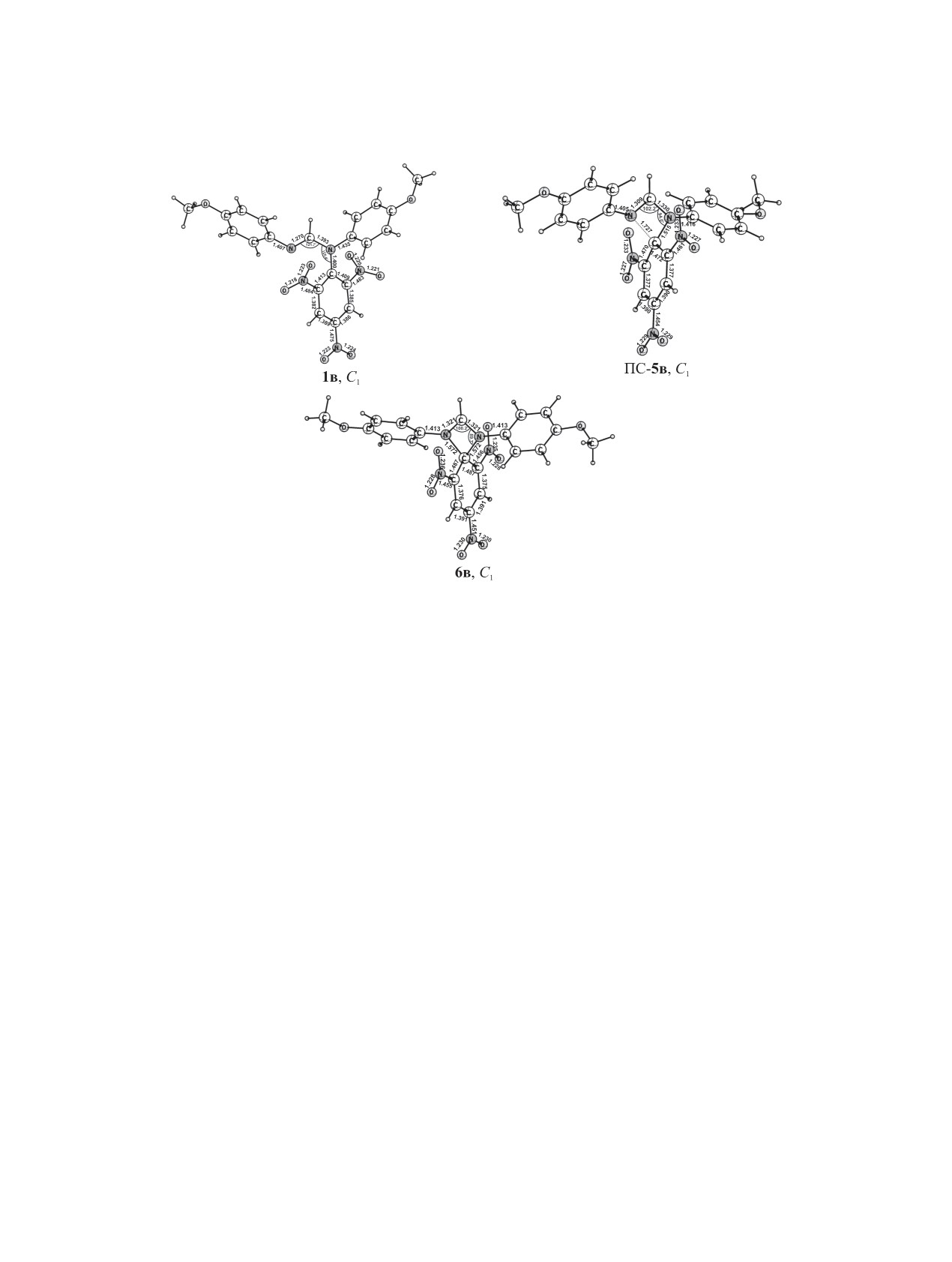
Рис. 2. Рассчитанные методом B3LYP/6-311++G(d,p) геометрические параметры структуры основного состояния пикриль-
ного производного формамидина 1в, переходного состояния ПС-5в N,N'-миграции пикрильной группы и интермедиата 6в
в газовой фазе.
нениях 1a, б (в интермедиате 6a торсионный угол
ющих производных формамидинов 1в, г (ΔG≠298 =
N1C1C6C7 -33.3°), что способствует делокализации
24.7, 25.0 ккал/моль) обусловливает невозмож-
положительного заряда на амидиновом фрагменте.
ность наблюдения миграции в шкале времени ди-
Длины связей между спироциклическим атомом
намического ЯМР (см. таблицу).
углерода пикрильной группы C2 и атомами азота
Разность энергии между интермедиатами 6a, б
амидиновой триады в интермедиатах 6a-г лежат
и переходными состояниями ПС-5a, б (ΔEZPE = 1.2,
в пределах 1.550-1.572 Å, а между атомом C2 и
1.1 ккал/моль) в производных бензамидина боль-
соседними углеродными атомами - 1.487-1.494 Å.
ше, чем между производными формамидина 6в, г
Углы в четырехчленном кольце в интермедиатах
и ПС-5в, г (ΔEZPE = 0.1 ккал/моль), что указывает
6a-г находятся в пределах 98.2-100.3 (N1C1N2),
на более высокую устойчивость интермедиатов
89.7-90.3 (C1N1C2, C1N2C2), 80.3-81.2° (N1C2N2)
6a, б. Более полная делокализация положительно-
(рис. 1, 2). Все это указывает на строение интер-
го заряда в амидиновом фрагменте производных
медиатов 6a-г, аналогичное биполярным комплек-
бензамидина ПС-5a, б и 6a, б из-за влияния фе-
сам Мейзенгеймера.
нильного заместителя при атоме C1 (по сравнению
Вычисленные активационные барьеры 1,3-N,N'-
с производными формамидина ПС-5в, г и 6в, г)
миграции пикрильной группы в производных
обусловливает существенно более низкие актива-
бензамидинов 1a, б →← ПС-5a, б →← 6a, б →← ПС-
ционные барьеры 1,3-N,N'-миграции пикрильной
5'a, б →← 1'a, б ΔG≠298 = 13.6 (Ar = 4-MeOC6H4) и
группы в бензамидинах 1a, б по сравнению с фор-
15.4 ккал/моль (Ar = 4-MeC6H4) хорошо согласу-
мамидинами 1в, г и бóльшую устойчивость интер-
ются с экспериментальными данными, получен-
медиатов 6a, б сравнению со структурами 6в, г.
ными методом динамического ЯМР. Рассчитанный
Кроме того, лучшая делокализация положитель-
высокий барьер для таких миграций в соответству-
ного заряда в амидиновом фрагменте переходно-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 1 2020
ОБР
АТИМЫЕ ПЕРЕГРУППИРОВКИ 2,4,6-ТРИНИТРОФЕНИЛЬНОЙ ГРУППЫ
15
го состояния ПС-5a с двумя электронодонорными
циалом B3LYP в валентно-расщепленном базисе
метоксигруппами по сравнению с переходным
6-311++G(d,p) в газовой фазе и с учетом сольва-
состоянием ПС-5б объясняет увеличение скоро-
тации (модель поляризационного континуума
сти 1,3-N,N'-миграции пикрильной группы в бен-
PCM) с использованием программного пакета
замидине 1a по сравнению с соединением 1б (см.
Gaussian-09. Идентификацию всех стационарных
таблицу).
точек проводили путем расчета матрицы Гессе.
По данным расчетов с учетом сольватации
Заряды на атомах рассчитаны по схеме NBO.
(PCM), барьер
1,3-N,N'-миграции пикрильной
ФОНДОВАЯ ПОДДЕРЖКА
группы в бензамидине 1a через переходное со-
стояние ПС-5a в ДМСО (ΔG≠298 = 12.3 ккал/моль)
Работа выполнена в рамках государственного
понижается на 1.3 ккал/моль по сравнению с со-
задания Министерства образования и науки России
ответствующим барьером в газовой фазе, а устой-
(проект № 4.979.2017/4.6) и Южного научного
чивость интермедиата 6a в ДМСО увеличивается
центра РАН (номер госрегистрации 01201354239).
(ΔEZPE = 3.5 ккал/моль, см. таблицу). Кроме того,
длины связей между спироциклическим атомом
КОНФЛИКТ ИНТЕРЕСОВ
углерода пикрильной группы и атомами азота ами-
Авторы заявляют об отсутствии конфликта
диновой триады в интермедиате 6a (ДМСО, N1-C2
интересов.
и N2-C2 1.537 и 1.538 Å) уменьшаются. При этом
перенос заряда в биполярном интермедиате 6a в
СПИСОК ЛИТЕРАТУРЫ
ДМСО (суммарный заряд на пикрильном фраг-
менте -0.426 e) больше, чем в газовой фазе.
1. Terrier F. Modern nucleophilic aromatic substitu-
tion. Weinheim: Wiley, 2013. 488 p. doi 10.1002/
B N-замещенныx амидинах возможны быстрые
9783527656141
в шкале времени ЯМР обратимые внутримолеку-
лярные 1,3-N,N'-миграции металлоорганических
2. Claramunt R.M., Santa María D., Alkorta I., Elguero J. //
остатков [18, 19], а также органических и элемен-
J. Heterocycl. Chem. 2018. Vol. 55. P. 44. doi 10.1002/
тоорганических групп: ацильных, аллильных, ци-
jhet.3026
клопентадиенильных, нитрозо, силлильных, фос-
3. Буров О.Н., Курбатов С.В., Клецкий М.Е., Загреба-
форных, тио- и селеногрупп [16, 20-29].
ев А.Д., Михайлов И.Е. // ХГС. 2017. Т. 53. № 3.
Таким образом, расчетом по методу B3LYP/6-
С. 335; Burov O.N., Kurbatov S.V., Kletskii M.E.,
311++G(d,p) показано, что
1,3-N,N'-миграция
Zagrebaev A.D., Mikhailov I.E. // Chem. Heterocycl.
пикрильной группы в производных N,N'-диарил-
Compd. 2017. Vol. 53. N 3. P. 335. doi 10.1007/s10593-
бензамидинa должна протекать с низким актива-
017-2055-3
ционным барьером в E-син-форме молекул с про-
4. Al-Kaysi R.O., Guirado G., Valente E.J. // Eur. J. Org.
пеллерной конформацией арильных групп по ме-
Chem. 2004. P. 3408. doi 10.1002/ejoc.200400260
ханизму внутримолекулярного нуклеофильного
5. Minkin V.I. // Chem. Rev. 2004. Vol. 104. P. 2751. doi
замещения у мигрирующего атома углерода через
10.1021/cr020088u
образование биполярного спироциклического ин-
6. Coles M.P. // Dalton Trans. 2006. P. 985. doi 10.1039/
термедиата, что находится в согласии с экспери-
b515490a
ментальными данными. Устойчивость интермеди-
ата в высокополярном ДМСО, по данным кванто-
7. Green R., Walker A.C., Blake M.P., Mountford P. //
во-химических расчетов, значительно выше, чем
Polyhedron. 2016. Vol. 116. P. 64. doi 10.1016/j.
poly.2016.02.028
в газовой фазе. Напротив, рассчитанные актива-
ционные барьеры таких миграций в соответству-
8. Abdou H.E., Mohamed A.A., Fackler J.P., Jr. // J. Cluster
ющих производных N,N'-диарилформамидина до-
Sci. 2007. Vol. 18. N 3. P. 630. doi 10.1007/s10876-
статочно высоки, что не позволяет наблюдать ми-
007-0119-8
гацию в шкале времени динамического ЯМР.
9. Lawson C.P.A.T., Slawin A.M.Z., Westwood N.J. //
Квантово-химические расчеты выполняли ме-
Chem. Commun. 2011. Vol. 47. P. 1057. doi 10.1039/
тодом DFT [30] с трехпараметрическим потен-
c0cc03624b
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 1 2020
16
ДУШЕНКО и др.
10. Moxey G.J., Ortu F., Sidley L.G., Strandberg H.N.,
21. Олехнович Л.П., Михайлов И.Е., Иванченко Н.М.,
Blake A.J., Lewis W., Kays D.L. // Dalton Trans. 2014.
Метлушенко В.П., Жданов Ю.А., Минкин В.И. //
Vol. 43. P. 4838. doi 10.1039/c3dt53234h
ЖОрХ. 1978. Т. 14. Вып. 2. С. 340.
11. Kazeminejad N., Munzel D., Michael T., Gamer M.T.,
22. Олехнович Л.П., Минкин В.И., Михайлов И.Е., Иван-
Roesky P.W. // Chem. Commun. 2017. Vol. 53. P. 1060.
ченко Н.М., Жданов Ю.А. // Докл. АН СССР. 1977.
doi 10.1039/c6cc08958e
Т. 233. №. 5. С. 874.
23. Михайлов И.Е., Душенко Г.А., Жунке А., Мюгге К.,
12. Hong J., Zhang L., Wang K., Chen Z., Wu L., Zhou X. //
Минкин В.И. // ЖОрХ. 1998. Т. 34. Вып. 8. С. 1181;
Organometallics. 2013. Vol. 32. P. 7312. doi 10.1021/
Mikhailov I.E., Dushenko G.A., Zhunke A., Miigge K.,
om400787j
Minkin V.I. // Russ. J. Org. Chem. 1998. Vol. 34. N 8.
13. Kalz K.F., Hausmann A., Dechert S., Meyer S., John M.,
P. 1127.
Meyer F. // Chem. Eur. J. 2016. Vol. 22. P. 18190. doi
24. Minkin V.I., Mikhailov I.E., Dushenko G.A. //
10.1002/chem.201603850
Chem. Commun. 1988. N 17. P. 1181. doi 10.1039/
14. Wang J., He Z., Chen X., Song W., Lu P., Wang Y. //
c39880001181
Tetrahedron. 2010. Vol. 66. P. 1208. doi 10.1016/j.
25. Dushenko G.A., Mikhailov I.E., Zschunke A., Reck G.,
tet.2009.12.034
Schulz B., Mugge C., Minkin V.I. // Mendeleev Commun.
15. Минкин В.И., Олехнович Л.П., Жданов Ю.А., Ми-
1999. Vol. 9. N 2. P. 67. doi 10.1070/MC1999v-
хайлов И.Е., Метлушенко В.П., Иванченко Н.М. //
009n02ABEH001064
ЖОрХ. 1976. Т. 12. Вып. 6. С. 1271.
26. Mikhailov I.E., Kompan O.E., Dushenko G.A., Min-
16. The Chemistry of Amidines and Imidates / Eds S. Patai,
kin V.I. // Mendeleev Commun. 1991. Vol. 1. N 4.
Z. Rappoport. Chichester: J. Wiley, 1991. Ch. 11. P. 525.
P. 121. doi 10.1070/MC1991v001n04ABEH000074
17. Фурманова Н.Г., Верин И.А., Михайлов И.Е., Мин-
27. Михайлов И.Е., Душенко Г.А., Reck G., Schulz B.,
кин В.И., Олехнович Л.П. // ЖОрХ. 1991. Т. 27.
Zschunke A., Минкин В.И. // Докл. АН. 2007. Т. 412.
Вып. 6. С. 1158.
№ 5. С. 645; Mikhailov I.E., Dushenko G.A., Reck G.,
18. Душенко Г.А., Михайлов И.Е., Михайлова О.И., Ми-
Schulz B., Zschunke A., Minkin V.I. // Doklady Chem.
няев Р.М., Минкин В.И. // Докл. АН. 2018. Т. 482.
2007. Vol. 412. P. 49. doi 10.1134/S0012500807020073
№ 3. С. 294; Dushenko G.A., Mikhailov I.E., Mikhailo-
28. Душенко Г.А., Михайлов И.Е., Reck G., Schulz B.,
va O.I., Minyaev R.M., Minkin V.I. // Doklady Chem.
Zschunke A., Харабаев Н.Н., Минкин В.И. // ЖОрХ.
2018. Vol. 482. Pt 1. P. 189. doi 10.1134/
2002. Т. 38. Вып. 7. C. 1024; Dushenko G.A., Mikhai-
S0012500818090069
lov I.E., Reck G., Schulz B., Zschunke A., Kharaba-
ev N.N., Minkin V.I. // Russ. J. Org. Chem. 2002. Vol. 38.
19. Кузьмина Л.Г., Бокий Н.Г., Стручков Ю.Т., Мин-
кин В.И., Олехнович Л.П., Михайлов И.Е. // ЖCX.
N 7. P. 982. doi 10.1023/A:1020897411534
1977. Т. 18. №. 1. С. 122; Kuz’mina L.G., Bokii
29. Душенко Г.А., Михайлов И.Е., Reck G., Schulz B.,
Zschunke A., Минкин В.И. // Изв. АН. Сер. хим. 2001.
N.G., Struchkov Yu.T., Minkin V.I., Olekhnovich L.P.,
Mikhailov I.E. // J. Struct. Chem. 1977. Vol. 18. N 1.
Т. 50. № 5. С. 852; Dushenko G.A., Mikhailov I.E.,
C. 96. doi 10.1007/BF00745437
Reck G., Schulz B., Zschunke A., Minkin V.I. //
Russ. Chem. Bull. 2001. Vol. 50. N 5. P. 890. doi
20. Минкин В.И., Михайлов И.Е., Душенко Г.А.,
10.1023/A:1011323629390
Жунке А. // Усп. хим. 2003. Т. 72. C. 978; Min-
kin V.I., Mikhailov I.E., Dushenko G.A., Zschunke A. //
30. Foresman J.B., Frisch E. Exploring Chemistry with
Russ. Chem. Rev. 2003. Vol. 72. P. 867. doi 10.1070/
Electronic Structure Methods. Pittsburg: Gaussian Inc.,
RC2003v072n10ABEH000848
1996. 302 p.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 1 2020
ОБР
АТИМЫЕ ПЕРЕГРУППИРОВКИ 2,4,6-ТРИНИТРОФЕНИЛЬНОЙ ГРУППЫ
17
Reversible Rearrangements of 2,4,6-Trinitrophehyl Group
in the Amidine System
G. A. Dushenkoa,*, I. E. Mikhailova,b, and V. I. Minkina
a Institute of Physical and Organic Chemistry of Southern Federal University,
pr. Stachki 194/2, Rostov-on-Don, 344090 Russia
b Federal Research Center “Southern Scientific Center of the Russian Academy of Science”,
Rostov-on-Don, 344006 Russia
*e-mail: dushenko@ipoc.sfedu.ru
Received June 26, 2019; revised June 26, 2019; accepted June 30, 2019
Tautomeric 1,3-N,N'-migrations of 2,4,6-trinitrophenyl group in derivatives of N,N'-diarylbenzamidine and
N,N’-diarylformamidine were studied by quantum-chemical calculations using the method of density functional
theory B3LYP/6-311++G (d, p).
Keywords: rearrangements, polynitroaryl derivatives of amidines, DFT calculations
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 1 2020