ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2020, том 90, № 1, с. 18-30
УДК 544.431
ТРАНСФОРМАЦИЯ
2,2-ДИ-(4-НИТРОФЕНИЛ)-1,1-ДИХЛОРЭТЕНА
ПРИ ВЗАИМОДЕЙСТВИИ С НИТРИТ-ИОНОМ
В АПРОТОННЫХ ПОЛЯРНЫХ РАСТВОРИТЕЛЯХ
© 2020 г. Е. А. Гузов, В. Н. Казин*
Ярославский государственный университет имени П. Г. Демидова, ул. Советская 14, Ярославль, 150003 Россия
*е-mail: kaz@uniyar.ac.ru
Поступило в Редакцию 20 июня 2019 г.
После доработки 28 ноября 2019 г.
Принято к печати 4 декабря 2019 г.
Изучено взаимодействие 2,2-ди-(нитрофенил)-1,1-дихлорэтена с нитрит-ионом в апротонных поляр-
ных растворителях. Идентифицированы продукты реакции; исследовано влияние различных факторов,
включая процессы диссоциации и сольватации реагентов, на константу скорости. Определены термоди-
намические параметры реакции. Выполнены квантово-химические расчеты многостадийного процесса.
Предложен механизм реакции 2,2-ди-(4-нитрофенил)-1,1-дихлорэтена с нитритом натрия в среде апро-
тонных полярных растворителей.
Ключевые слова: 2,2-ди-(4-нитрофенил)-1,1-дихлорэтен, 4,4'-динитробензофенон, нитрит-ион, процес-
сы диссоциации и сольватации, механизм реакции
DOI: 10.31857/S0044460X20010035
Химия хлораля и его конденсированных про-
2,2-дифенил-1,1,1-трихлорэтанов в реакции с
изводных - 2,2-диарил-1,1,1-трихлорэтанов - ши-
нитритами щелочных металлов в апротонных по-
роко представлена в российских и зарубежных пу-
лярных растворителях. Показано, что при взаимо-
бликациях. Соединения использованы в качестве
действии
2,2-ди-(4-нитрофенил)-1,1,1-трихлорэ-
инсектицидов, полупродуктов для синтеза моно-
тана с нитритом натрия при температуре 20-70°С
меров [1, 2], красителей, модификаторов и реаген-
протекает только реакция дегидрохлорирования и
тов для органического синтеза [3]. Использование
образуется 2,2-ди-(4-нитрофенил)-1,1-дихлорэтен
2,2-диарил-1,1,1-трихлорэтанов в качестве моно-
[7]. При температурах 80-130°С отмечено после-
меров ограничено из-за низкой термостойкости
дующее превращение дихлорэтиленовой группы в
полимерных материалов, получаемых на их осно-
карбонильную с образованием 4,4'-динитробензо-
ве. Трансформация трихлорэтилиденовой группы
фенона с выходом 96-98% (схема 1).
2,2-диарил-1,1,1-трихлорэтанов в дихлорэтиле-
В работах [13-15] по результатам кинетиче-
новую и карбонильную придает полимерам него-
ского и квантово-химического исследования с ис-
рючесть, способность к самозатуханию, высокую
пользованием неэмпирических методов квантовой
термостойкость [4].
химии определен механизм реакции дегидрохло-
Определенный интерес представляет исполь-
рирования 2,2-ди-(4-нитрофенил)-1,1,1-трихлорэ-
зование в качестве субстратов нитрозамещенных
тана нитрит-ионом (E2H).
соединений, что объясняется их высокой реакци-
Авторами работ [10,12] предложены возможные
онной способностью и многообразием маршрутов
пути трансформации 2,2-ди-(4-нитрофенил)-1,1-
преобразования. Авторами работ [5-12] изуче-
дихлорэтена в 4,4'-динитробезофенон с привлече-
на реакционная способность нитрозамещенных
нием полуэмпирических методов расчета. Однако
18
ТР
АНСФОРМАЦИЯ 2,2-ДИ-(4-НИТРОФЕНИЛ)-1,1-ДИХЛОРЭТЕНА
19
Схема 1.
O2N
NO2
O2N
NO2
H
NaNO2
20 70qC
C
C
Cl
Cl
Cl
Cl
Cl
O2N
NO2
NaNO2
80 130qC
O
комплексного исследования механизма данного
нитритом натрия. Реакцию проводили в ДМФА
превращения не проводилось.
при следующих концентрациях: [S]0=30 ммоль/л,
Цель данной работы - определение структуры
[NaNO2]0
=
600 ммоль/л. Полная конверсия
промежуточных, конечных и побочных продуктов
2,2-ди-(4-нитрофенил)-1-хлорэтена достигалась в
реакции, исследование кинетических закономер-
течение 0.5-1.0 ч при 50°С. В ходе реакции обра-
ностей с учетом процессов диссоциации и сольва-
зовывались 4,4'-динитробензофенон (50%), оксим
тации реагентов, а также квантово-химическое
4,4'-динитробензофенона (30%) и 6-нитро-3-(4-ни-
моделирование многостадийного механизма пре-
трофенил)-2,3-дигидробензизоксазол (20%).
вращения 2,2-ди-(4-нитрофенил)-1,1-дихлорэтена
Можно предположить, что в реакции
2,2-
в 4,4'-динитробезофенон под действием нитрит-и-
ди-(4-нитрофенил)-1,1-дихлорэтена с нитритом
она в среде апротонных полярных растворителей.
натрия образуется один из этих продуктов.
Нами изучено влияние концентрации субстра-
Добавление нами в реакционную смесь окси-
та и реагента, температуры и природы раствори-
ма
4,4'-динитробензофенона, синтезированного
теля на кинетические закономерности реакции в
встречным синтезом по известной методике [22],
следующих условиях: концентрация 2,2-ди-(4-ни-
сопровождалось ростом сигналов на хромато-
трофенил)-1,1-дихлорэтена [S]0 = 1-6 ммоль/л,
грамме ВЭЖХ и ГЖХ-масс-хроматограмме. Это
[NaNO2]0 = 10-100 ммоль/л, 353-393 K, раствори-
свидетельствует о том, что побочным продук-
тели - этанол, ДМФА, диметилацетамид, ДМСО,
том является оксим
4,4'-динитробензофенона.
N-метилпирролидон, бинарная смесь ДМФА-эта-
Экспериментально подтверждено, что при взаи-
нол (80:20, мол%), процесс гомофазный.
модействии оксима
4,4'-динитробензофенона с
Методами высокоэффективной жидкостной
нитритом натрия 4,4'-динитробензофенон не обра-
хроматографии (ВЭЖХ) и хромато-масс-спек-
зуется.
трометрии показано, что в результате реакции
Таким образом, показано, что продуктами реак-
2,2-ди-(4-нитрофенил)-1,1-дихлорэтена с нитри-
ции 2,2-ди-(4-нитрофенил)-1,1-дихлорэтена с ни-
том натрия помимо образования 4,4'-динитробен-
тритом натрия являются 4,4'-динитробензофенон
зофенона происходит накопление неизвестного
(выход 95-98%) и оксим 4,4'-динитробензофенона
соединения, причем интенсивность его сигнала не
(<2.5%), которые образуются согласно схеме 2.
изменяется после полной конверсии 2,2-ди-(4-ни-
трофенил)-1,1-дихлорэтена. Данные балансовых
При увеличении концентрации реагента в
опытов (373 K, ДМФА, [S]0 = 5 ммоль/л, [NaNO2]0 =
интервале [NaNO2] = 10-100 ммоль/л ([S]0 =
50 ммоль/л) свидетельствуют о том, что на обра-
5 ммоль/л, 373 K, ДМФА) отмечено снижение зна-
зование побочного продукта расходуется 2.5±0.4%
чений kэф, что, вероятно, связано с влиянием на
субстрата.
константу скорости процесса диссоциации реаген-
Ранее авторами работы [21] изучено взаимо-
та. Методом кондуктометрии изучен процесс дис-
действие
2,2-ди-(4-нитрофенил)-1-хлорэтена с
социации нитрита натрия в ДМФА. Определена
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 1 2020
20
ГУЗОВ, КАЗИН
Схема 2.
O2N
NO2
O2N
NO2
O
+ NaNO2
×
C
O2N
NO2
Cl
Cl
N
OH
степень диссоциации и рассчитана константа дис-
Изучено влияние концентрации субстрата в ин-
социации (373 K, Kд = 9.15×10-3). Получена корре-
тервале концентраций [S]0 = 1-6 ммоль/л на кон-
ляция эффективной константы скорости реакции
станту скорости реакции (373 K, ДМФА, [NaNO2] =
со степенью диссоциации (1), что свидетельствует
50 ммоль/л). Показано, что средние значения кон-
о непосредственном вкладе процесса диссоциации
стант скорости соответствуют значениям, полу-
в значение эффективной константы скорости.
ченным в предыдущей серии.
lgkэф = -3.06 + 1.60α,
(1)
Методом Вант-Гоффа определен первый част-
ный порядок реакции по реагенту и субстрату.
r = 0.986, N = 5.
Показано, что реакции описывается уравнением
С учетом диссоциации реагента определены
второго порядка, а для полной конверсии 2,2-
истинные значения констант скорости реакции
ди-(4-нитрофенил)-1,1-дихлорэтена в4,4'-динитро-
2,2-ди-(4-нитрофенил)-1,1-дихлорэтена с нитри-
бензофенон необходимо 2 моля нитрита натрия.
том натрия. Средние значения констант скорости,
Исследовано влияние температуры на кон-
рассчитанные по расходованию субстрата и об-
станту скорости реакции
2,2-ди-(4-нитрофе-
разованию продукта, составляли 11.25±0.11×103
нил)-1,1-дихлорэтена с нитритом натрия в ДМФА,
и 10.27±0.13 ×103 л·моль-1·с-1 соответственно.
определены термодинамические параметры
Отличие значений констант скорости подтвержда-
(табл. 1). Отрицательное значение энтропии ак-
ет образование побочного продукта (оксима
тивации свидетельствует о том, что лимитирую-
4,4'-динитробензофенона).
щая стадия трансформации
2,2-ди-(4-нитрофе-
нил)-1,1-дихлорэтена в
4,4'-динитробензофенон
Таблица 1. Эффективные константы скорости и термо-
является бимолекулярным процессом.
динамические параметры реакции 2,2-ди-(4-нитрофе-
Изучено влияние природы растворителя на
нил)-1,1-дихлорэтена с нитритом натрияа
константу скорости реакции. Отмечено, что в про-
kэф×103,
Термодинамические
тонном растворителе (например, этаноле) реакция
T, K
л·моль-1·с-1
параметры
не протекает. Определены эффективные констан-
353
0.78
Ea= 84.11 кДж/моль,
ты скорости (373 K, [S]0 = 5 ммоль/л, [NaNO2]=
ΔH = 82.76 кДж/моль,
50 ммоль/л) в ряду растворителей (kэф×103,
363
1.56
lnA = 22.05,
л·моль-1·с-1): 11.03 (N-метилпирролидон),
6.31
373
3.25
ΔS298
= -72.53 Дж/(моль·K)
(диметилацетамид), 3.25 (ДМФА), 1.31 (ДМСО),
0.61 (ДМФА-этанол, 80:20).
383
7.42
Полученная корреляционная зависимость в ко-
393
14.83
ординатах уравнения Димрота-Рейнхардта дает
а ДМФА, [S]0 = 5 ммоль/л, [NaNO2] = 50 ммоль/л.
основание предполагать значительный вклад спец-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 1 2020
ТР
АНСФОРМАЦИЯ 2,2-ДИ-(4-НИТРОФЕНИЛ)-1,1-ДИХЛОРЭТЕНА
21
Таблица 2. Энергии граничных орбиталей 2,2-ди-(4-нитрофенил)-1,1-дихлорэтена и нитрит-иона
Реагирующая молекула
EНСМО, эВ
EВЗМО, эВ
|EВЗМО - EНСМО|, эВ
2,2-Ди-(4-нитрофенил)-1,1-дихлорэтен
-3.282
-6.998
3.716
Нитрит-ион [6]
-0.751
-5.885
5.134
ифической сольватации в процесс взаимодействия
диапазона базисных наборов Попла и Даннинга.
2,2-ди-(4-нитрофенил)-1,1-дихлорэтена c нитри-
Для квантово-химического исследования выбран
том натрия (2).
метод теории функционала плотности, который
logkэф = 13.38 - 0.086ET,
(2)
позволяет достаточно точно определять простран-
ственную структуру молекул и применяется для
r = 0.975, N = 5.
моделирования механизмов химических реакций.
Показано, что при увеличении сольватирую-
Гибридный функционал B3LYP, в котором обмен-
щих свойств среды (параметр ЕТ) скорость про-
ная энергия рассчитывается с привлечением точ-
цесса снижается, т. е. исходное состояние сольва-
ного результата, полученного методом Хартри-
тируется лучше переходного.
Фока, считается наиболее универсальным.
Полученные данные являются необходимыми
Первоначальной задачей моделирования являл-
для последующего квантово-химического моде-
ся поиск реакционных центров взаимодейству-
лирования с использованием неэмпирических ме-
ющих молекул. Пространственная стуктура, кон-
тодов квантовой химии и обсуждения механизма
формации, ВЗМО и НСМО нитрит-иона детально
реакции.
разобраны в работе [15]. Нормальная конформация
Трансформация 2,2-ди-(4-нитрофенил)-1,1-ди-
является предпочтительным состоянием для ни-
хлорэтена в 4,4'-динитробензофенон в присуствии
трит-иона вследствии наименьшего значения пол-
нитрита натрия является многостадийным про-
ной энергии. Рассмотрены энергии граничных ор-
цессом. Для каждой последовательной стадии вы-
биталей исходных реагентов (табл. 2). Граничные
полнены квантово-химические расчеты исходных
орбитали получены для предварительно оптими-
структур, предреакционного, переходного и пост-
зированных (равновесных) структур после расчета
реакционного состояний.
матриц Гессе.
В настоящее время наиболее популярными
Из приведенных данных следует, что реаген-
квантово-химическими методами являются тео-
ты являются мягкими (разница энергий более
рия функционала плотности (DFT) [16-18] и тео-
1 эВ). Положение реакционных центров в мяг-
рия возмущений Мюллера-Плессета третьего по-
ких реагентах определяется граничной плотно-
рядка (MP3) [19, 20] с использованием широкого
стью электронов на атомах. Следует отметить, что
ɚ
ɛ
ɜ
ɉɋ
ɉɋ
ɉɋ
±
±
±
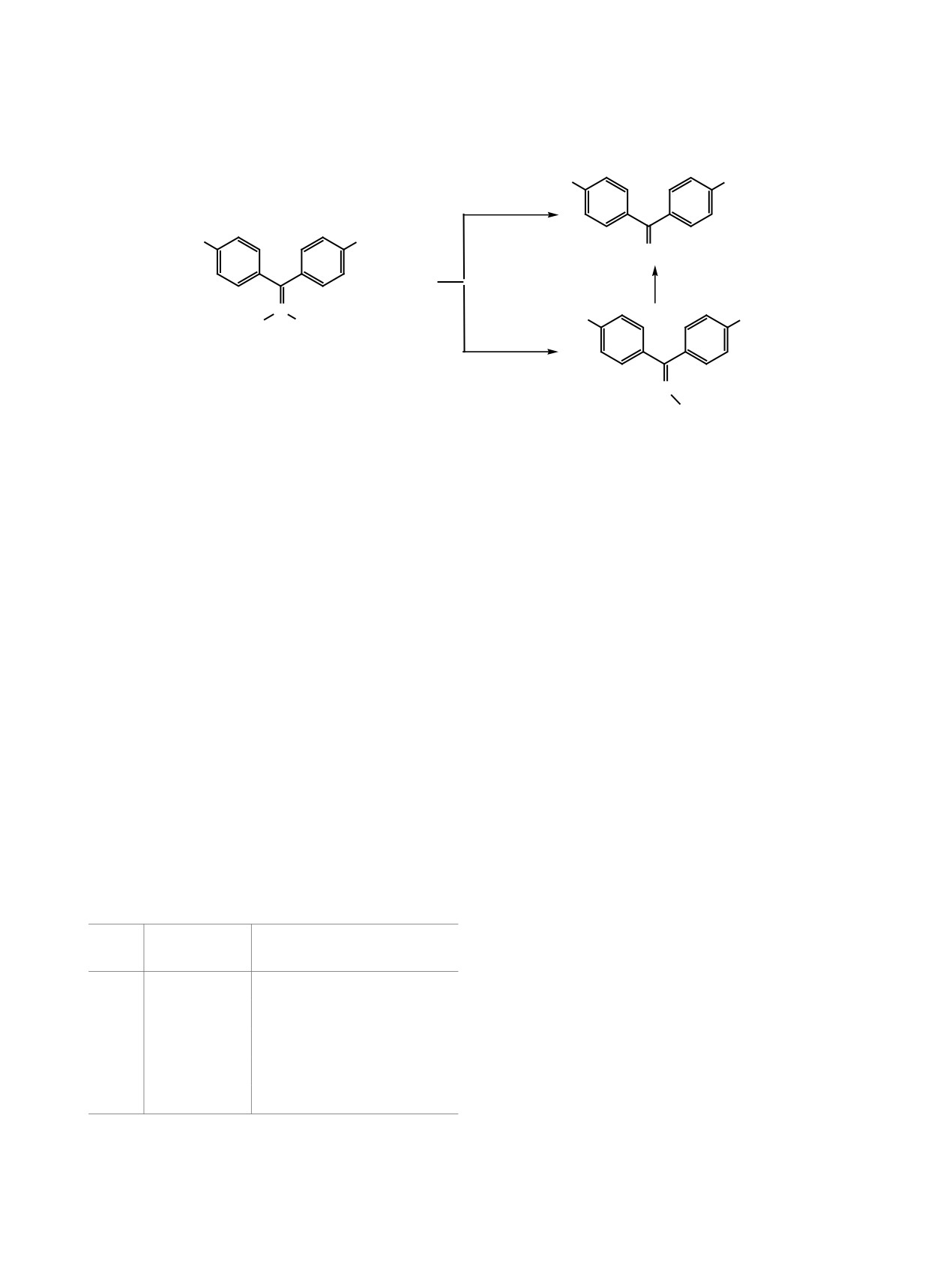
Рис. 1. Структура и энергии (Хартри) переходных состояний для стадии нуклеофильного замещения.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 1 2020
22
ГУЗОВ, КАЗИН
-2074.15
-2074.16
-2074.17
-2074.18
Ea =
ɤȾɠ ɦɨɥɶ
-2074.179541
-2074.19
-2074.20
ǻH = -
ɤȾɠ ɦɨɥɶ
-2074.21
Ʉɨɨɪɞɢɧɚɬɚ ɪɟɚɤɰɢɢ
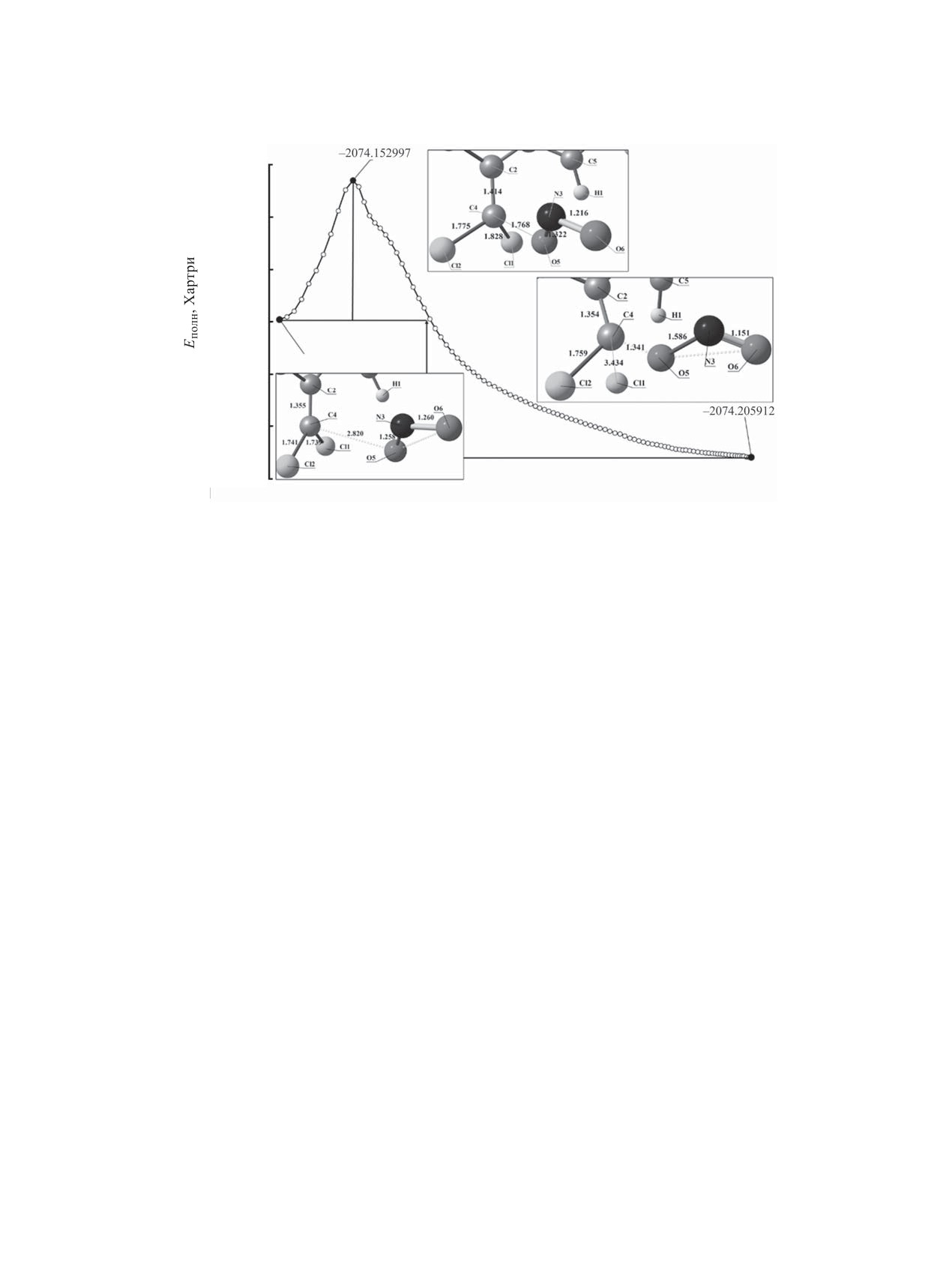
Рис. 2. Энергетический профиль реакции нуклеофильного замещения 2,2-ди-(4-нитрофенил)-1,1-дихлорэтена с нитрит-ионом.
оба реагента являются электрофилами (значения
ский профиль стадии нуклеофильного замещения
энергий НСМО молекул отрицательные). Однако
(рис. 2).
нитрит-ион обладает менее выраженными элек-
В предреакционном состоянии нитрит-ион
трофильными свойствами и в данной системе вы-
ориентирован по отношению к π-связи (С2-С4)
ступает нуклеофилом. На основании полученных
субстрата. Данная пространственная ориентация
данных моделировали переходное состояние (ПС)
свидетельствует об образовании π-комплекса.
между углеродным атомом С4 (рис. 1) и атомом
Образование переходного состояния сопровожда-
кислорода (O5) нитрит-иона в режиме поиска сед-
ется снижением порядка химической связи С2-С4
ловой точки.
с 1.665 до 1.235, что свидетельствует о разрыве
В ходе предварительных расчетов отмечено,
π-связи и перераспределении электронной плотно-
что пространственное расположение нитрит-иона
сти посредством мезомерных электронных эффек-
в переходном состоянии может различаться. В за-
тов нитрогрупп. Это подтверждается увеличением
висимости от положения реагента по отношению
значения отрицательного заряда на кислородных
к субстрату определены три возможных переход-
атомах. Наличие электронно-акцепторных нитро-
ных состояния. Корректность переходных состоя-
групп облегчает реализацию механизма нуклео-
ний подтверждена расчетом колебательного спек-
фильного замещения у винильного углеродного
тра, в котором присутствует одна мнимая частота.
атома. Увеличение длины связи С4-Cl1 с 1.744 до
Переходное состояние ПС-3 имеет самое высокое
1.828, изменение заряда на атоме Cl1 с 0.055 до
абсолютное значение полной энергии и в даль-
-0.065 и порядка связи С4-Cl1 с 1.049 до 0.990 сви-
нейшем нами не рассматривалось. При сравнении
детельствуют о том, что уходящим является атом
полной энергии переходных состояний следует
Cl1. В постреакционном состоянии анион хлора
отметить, что пространственное расположение
нитрит-аниона в ПС-2 является наиболее энерге-
отщепляется от углеродного атома (расстояние
тически выгодным.
3.434 Å).
Рассмотрен спуск по внутренней координате
Определены термодинамические параметры
реакции в долины исходных реагентов и продук-
рассматриваемой стадии: энергия активации со-
тов, определены энергии предреакционого и по-
ставляет 69.69 кДж/моль, тепловой эффект равен
стреакционного состояний, построен энергетиче-
-69.24 кДж/моль (экзотермический процесс).
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 1 2020
ТР
АНСФОРМАЦИЯ 2,2-ДИ-(4-НИТРОФЕНИЛ)-1,1-ДИХЛОРЭТЕНА
23
Таблица 3. Динамика изменения длины связи в предреакционном, переходном и постреакционном состоянии при
внутримолекулярном элиминировании 2,2-ди-(4-нитрофенил)-1,1-дихлорэтена
Длина связи, Å
Связь
предреакционное состояние
переходное состояние
постреакционное состояние
С4-О5
2.820
1.768
1.341
С4-Cl1
1.744
1.828
3.434
C2-C4
1.355
1.414
1.354
O5-N3
1.258
1.322
1.586
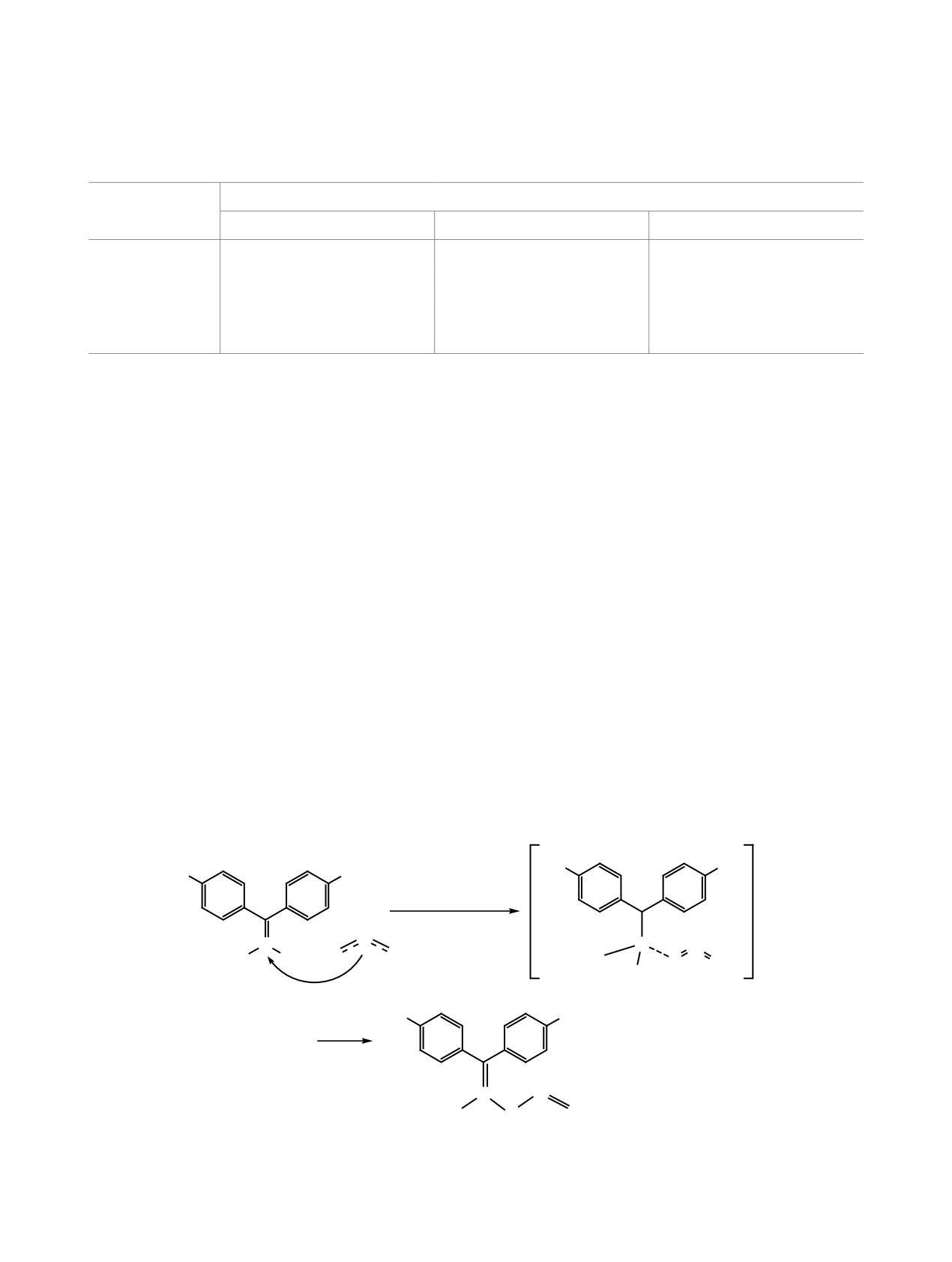
Для определения механизма стадии нуклео-
присоединение-отщепление (AdN-E) (схема
3).
фильного замещения (присоединение-отщепление
В результате образуется
2,2-ди-(4-нитрофе-
или отщепление-присоединение) детально рас-
нил)-1-хлор-1-нитрозооксиэтен 2, в котором по-
смотрена динамика изменения длин химических
рядок связи между углеродными атомами мости-
связей (табл. 3). Так, при сближении реагентов с
ковой группы составляет 1.590 (двойная связь со
2.820 до 1.768Å (присоединение нитрит-иона) до
смещенной электронной плотностью на электро-
момента образования переходного состояния про-
ноакцеторные группы). Порядки связей С4-O5 и
исходит незначительное увеличение длины связи
О5-N3 составляют 1.040 и 0.557 соответственно,
С4-Cl1 (с 1.744Å до 1.828Å). В результате, на мо-
т. е. электронная плотность смещена в сторону
мент присоединения нитрит-иона связь хлора-ну-
связи С4-О5.
клеофуга с углеродным атомом не разрывается, а
Проведено
моделирование
гипотетиче-
незначительно увеличивается. Дальнейшее умень-
ских путей трансформации
2,2-ди-(4-нитрофе-
шение длины связи между нитрит-ионом и атомом
нил)-1-хлор-1-нитрозооксиэтена: (1) нуклеофиль-
углерода (С4) мостикового фрагмента на каждый
ная атака нитрит-иона на углеродный атом С4 с
шаг оптимизации по внутренней координате про-
последующим отщеплением галогена; (2) возмож-
исходит значительно быстрее, чем отщепление
ность О-атаки нитрит-иона на атом азота мости-
хлорид-аниона.
кового фрагмента [24] соединения 2; (3) внутри-
Таким образом, нуклеофильное замещение у
молекулярная перестройка интермедиата 2. Для
винильного углеродного атома протекает по типу
маршрутов (1) и (2) при сближении реакционных
Схема 3.
z -
O2N
NO2
O2N
NO2
Ea = 69.69 ɤȾɠ/ɦɨɥɶ
N
C
C
N
O
O
Cl
Cl
Cl
O
O
Cl
1
O2N
NO2
Cl
C
N
Cl
O
O
2
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 1 2020
24
ГУЗОВ, КАЗИН
ɚ
ɛ
ɜ
C
11
H6
C2
0.006
0.072
1.371
H8
–0.116
1.429
C4
2.179
0.262
0.577
0.146
1.205
1.597
C11
O5
-0.313
-0.402
2.335
2.474
0.145
0.355
N3
0.135
1.111
2.426
O6
0.333
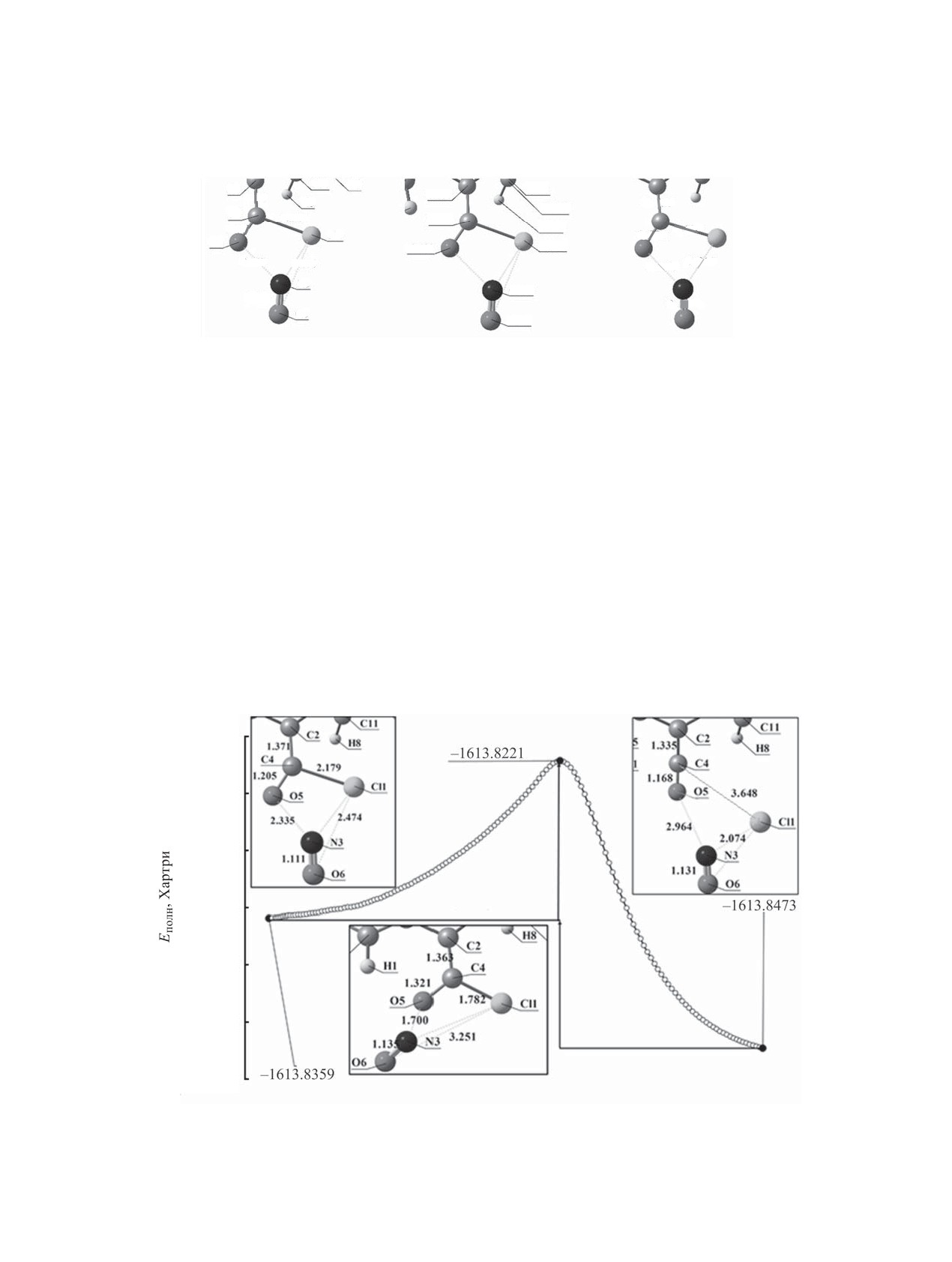
Рис. 3. Структура переходного состояния внутримолекулярного элиминирования 2,2-ди-(4-нитрофенил)-1-хлор-1-нитрозо-
оксиэтена 2. (а) расстояние между атомами, Å; (б) значения зарядов по Малликену; (в) порядок химической связи.
центров отмечено отсутствие максимумов на про-
и отмечено наличие единственной мнимой часто-
филе поверхности потенциальной энергии (обра-
ты (-188.81 см-1).
зование переходного состояния невозможно).
Рассмотрен энергетический профиль внутри-
На рис. 3 представлена структура переходно-
молекулярного элиминирования 2,2-ди-(4-нитро-
го состояния внутримолекулярной перестройки
фенил)-1-хлор-1-нитрозооксиэтена (рис. 4). В по-
2,2-ди-(4-нитрофенил)-1-хлор-1-нитрозооксиэте-
стреакционном состоянии возникает удлинение
на 2, которое сопровождается увеличением длины
связей C4-Cl1 с 1.782 до 3.648 Å и O5-N3 c 1.700 до
связи C4-Cl1 c 1.779 до 2.179 Å и снижением по-
2.964 Å. Следует отметить, что уходящим продук-
рядка связи с 1.055 до 0.577, что свидетельствует
том является хлорид нитрозила, так как уменьша-
о ее разрыве. Аналогичная тенденция отмечена
ется расстояние Cl1-N3 c 3.251 до 2.074 Å (образо-
для связи O5-N3: длина связи возрастает с 1.695
вание связи). Параметры пространственной струк-
до 2.335 Å, а порядок связи изменяется с 0.557 до
туры молекулы хлорида нитрозила сопоставимы
0.145. Для подтверждения корректности найден-
с литературными данными: длина связей Cl1-N3
ного переходного состояния проведен расчет Гессе
равна 2.074 Å (1.960 Å [25]) и O6-N3 1.131 Å
-1613.82
-1613.83
-1613.84
-1613.85
Ea =
ɤȾɠ ɦɨɥɶ
–1613.86
-1613.87
ǻH = -
ɤȾɠ ɦɨɥɶ
–1613.88
Ʉɨɨɪɞɢɧɚɬɚ ɪɟɚɤɰɢɢ
Рис. 4. Энергетический профиль внутримолекулярного элиминирования 2,2-ди-(4-нитрофенил)-1-хлор-1-нитрозооксиэтена 2.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 1 2020
ТР
АНСФОРМАЦИЯ 2,2-ДИ-(4-НИТРОФЕНИЛ)-1,1-ДИХЛОРЭТЕНА
25
Схема 4.
z
O2N
NO2
O2N
NO2
Ea = 36.23 ɤȾɠ/ɦɨɥɶ
C
N
C
Cl
O
O
Cl
O
N
2
O
O2N
NO
2
Cl
C
O
N
O
3
(1.160 Å [25]), валентный угол O6N3Cl1 составляет
Структура соединения
3 оптимизирована
113.94° (113° [25]).
(отсутствуют мнимые частоты). Следует отме-
тить, что после внутримолекулярной перестрой-
Дальнейшие пути превращения хлорида ни-
ки
2,2-ди-(4-нитрофенил)-1-хлор-1-нитритэтана
трозила в рассматриваемой системе могут быть
происходит формирование сопряженной π-си-
различны. С одной стороны, в реакционной смеси
стемы (образование фрагментов C=C и С=O).
хлорид нитрозила может вступать в реакцию с ни-
Образование сопряженной связи создает условия
тритом натрия, в ходе чего образуются азотистый
для последующей нуклеофильной атаки второй
ангидрид и хлорид натрия. Азотистый ангидрид
молекулой нитрит-иона.
термически нестабилен и разлагается до оксидов
В результате анализа возможности взаимодей-
азота. С другой стороны, при температуре свыше
ствия реагента по атому кислорода с углеродным
373 K хлорид нитрозила может разлагаться до мо-
атом С4 мостикового фрагмента соединения 3 от-
лекулярного хлора и оксида азота(II).
мечено отсутствие максимума на профиле поверх-
Нами проведено потенциометрическое титрова-
ности потенциальной энергии (образование пе-
ние реакционной смеси. Показано, что при полной
реходного состояния невозможно). Показано, что
конверсии 2,2-ди-(4-нитрофенил)-1,1-дихлорэтена
атака нитрит-аниона сопровождается образова-
в реакционной смеси присутствуют хлорид-анио-
нием четырехцентрового переходного состояния
ны в количестве 70% от теоретического значения.
(рис. 5), подтвержденного наличием одной мни-
По результатам квантово-химического модели-
мой частоты (-558.15 см-1) в расчете матриц Гессе.
рования можно заключить, что трансформация со-
Известно, что для незамещенных кетенов ха-
единения 2 является внутримолекулярным элими-
рактерна атака на углеродный атом карбониль-
нированием, при котором происходит образование
ной группы, однако нитрит-анион является амби-
2,2-ди-(4-нитрофенил)этенона 3 по схеме 4.
дентным реагентом и может вступать в реакцию
По природе уходящих фрагментов внутримо-
несколькими реакционными центрами (азотом и
лекулярное элиминирование схоже с реакцией
кислородом). В данном случае следует отметить,
Боорда, протекающей в системе простых β-гало-
что первичное сближение реагента с 2,2-ди-(4-ни-
геноэфиров.
трофенил)этеноном возникает между атома азота
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 1 2020
26
ГУЗОВ, КАЗИН
ɚ
ɛ
ɜ
H1
0.393
C2
O6
C2
O6
H2
1.017
1.097
1.804
3
C4
N
N3
C4
O5
O7
O7
0.183
O5
1.620
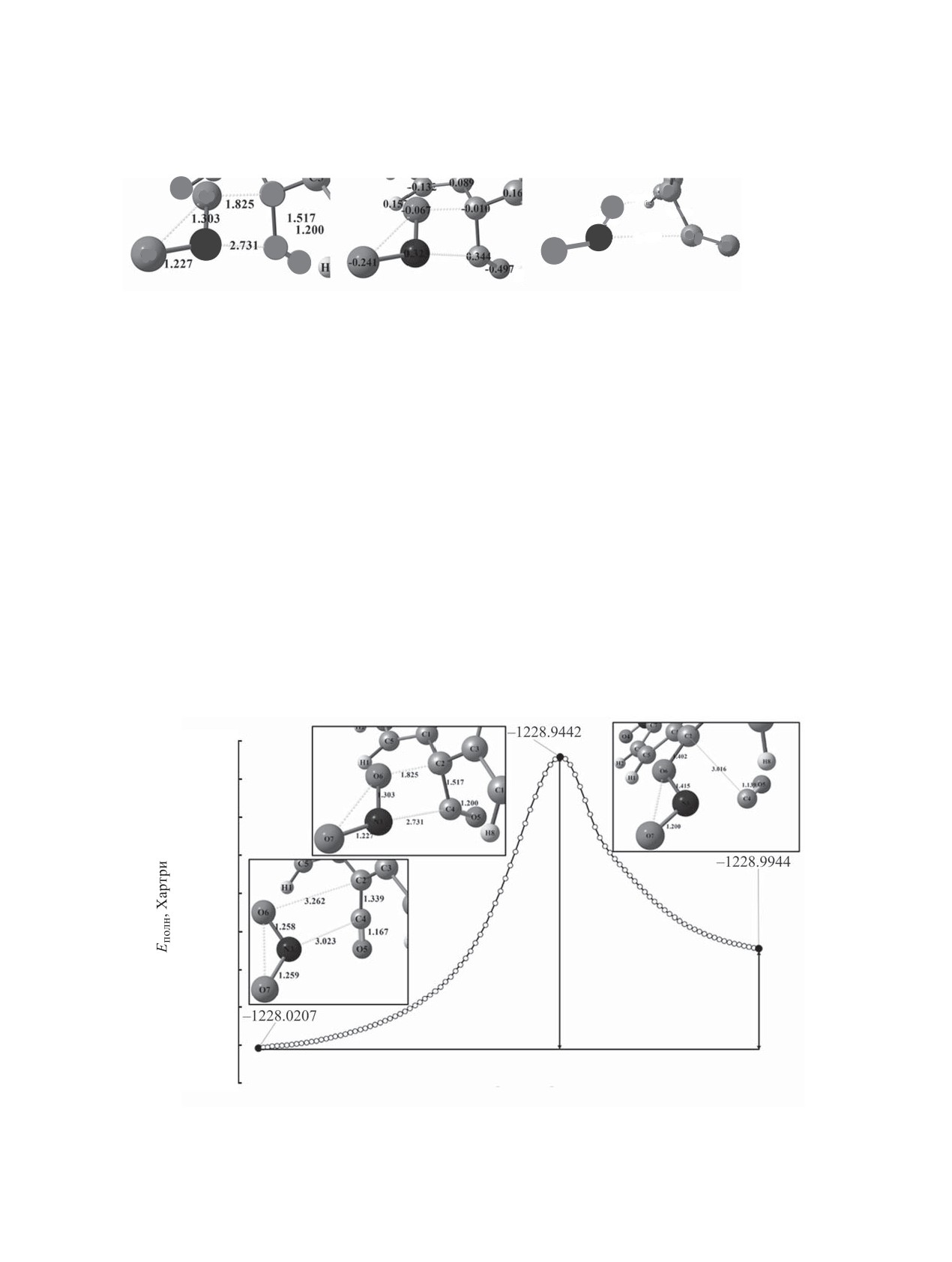
Рис. 5. Структура переходного состояния нуклеофильного замещения 2,2-ди-(4-нитрофенил)этенона 3 с нитрит-ионом. (а)
расстояние между атомами, Å; (б) заряды на атомах по Малликену; (в) порядок связи.
нитрит-аниона и углерода С4 карбонильной груп-
реакционном состоянии отмечена ориентация
пы (рис. 5). Возникающее электростатическое
нитрит-иона по направлению к π-сопряженной
притяжение (значение зарядов по Малликену N3
системе связи C2-C4 мостикового фрагмента.
-0.323 и С4 +0.344) обеспечивает стабилизацию
Уменьшение длины связи О6-С2 с 3.262 Å до
переходного состояния, о чем свидетельствуют
1.825 Å происходит с одновременным удлинени-
снижение расстояния между атомами N3 и С4 (с
ем связи С2-С4 с 1.339 Å до 1.517 Å. Дальнейшее
3.023 до 2.733 Å) и возрастающая кратность хи-
сближение атомов О6 и С2 до 1.402 Å приводит к
мической связи (0.183, слабое взаимодействие).
отщеплению фрагмента С4-О5 и образованию кар-
Однако данное сближение не приводит к форми-
баниона 4. Оксид углерода(II) окисляется до диок-
рованию максимума на профиле поверхности по-
сида углерода. Наличие диоксида углерода экспе-
тенциальной энергии, но существенно облегчает
риментально подтверждено образованием осадка
взаимодействие атома кислорода (второй реакци-
при пропускании газовой фазы из реакционной
онный центр реагента) и атома С2 (порядок связи
зоны через раствор гидроксида кальция.
0.393).
Энергия активации данного превращения со-
Рассмотрен энергетический профиль стадии
ставляется 200.95 кДж/моль, следовательно, оно
нуклеофильного замещения при взаимодействии
является лимитирующей стадией химической ре-
соединения 3 с нитрит-ионом (рис. 6). В пред-
акции. Тепловой эффект равен 68.40 кДж/моль
-1228.94
-1228.95
-1228.96
-1228.97
-1228.98
-1228.99
-1229.00
-1229.01
-1229.02
E
a
=
ɤȾɠ ɦɨɥɶ
ǻH =
ɤȾɠ ɦɨɥɶ
Ʉɨɨɪɞɢɧɚɬɚ ɪɟɚɤɰɢɢ
-1229.03
Рис. 6. Энергетический профиль стадии взаимодействия 2,2-ди-(4-нитрофенил)этенона 3 c нитрит-ионом.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 1 2020
ТР
АНСФОРМАЦИЯ 2,2-ДИ-(4-НИТРОФЕНИЛ)-1,1-ДИХЛОРЭТЕНА
27
Схема 5.
z
O2N
NO2
O2N
NO2
Ea = 200 ɤȾɠ/ɦɨɥɶ
O O
C
N
O
O
C
N
O
O
3
O2N
NO2
O
N
O
C
O
4
(эндотермический процесс). Рассматриваемая ста-
Нами проанализирована возможность атаки
дия химической реакции протекает по типу присо-
азотом нитрит-иона по углеродному атому С2 мо-
единение-отщепление AdN-E (схема 5).
стикового фрагмента кетена 3, при этом не зафик-
сирован максимум на профиле поверхности потен-
Стабильность карбаниона
4 обеспечива-
циальной энергии и, следовательно, переходное
ют природа жидкой фазы (апротонный раство-
состояние не может быть образовано.
ритель) и электронные эффекты нитрогрупп.
Отрицательный заряд полученного карбаниона не
Таким образом, на основании результатов
имеет локализации благодаря π-сопряженной си-
квантово-химического моделирования трансфо-
стеме и мезомерному эффекту электронно-акцеп-
рмация 2,2-ди(4-нитрофенил)-1,1-дихлорэтена в
торных нитрогрупп в ароматическом кольце.
4,4'-динитробензофенон протекает через ряд
Схема 6.
O2N
NO2
O2N
NO2
O2N
NO2
ONO
Cl
ONCl
C
C
N
C
Ea = 69.24 ɤȾɠ/ɦɨɥɶ
Ea = 29.88 ɤȾɠ/ɦɨɥɶ
Cl
Cl
Cl
O
O
O
1
2
3
-CO
ONO
Ea = 200.95 ɤȾɠ/ɦɨɥɶ
O2N
NO2
O2N
NO2
H+
HNO
O
O
N
O
5
4
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 1 2020
28
ГУЗОВ, КАЗИН
последовательных стадий (схема
6): нуклео-
Исследуемые соединения анализировали на
фильное замещение атома хлора нитрит-
хромато-масс-спектрометре, сочетающем газо-
ионом у винильного углеродного атома по мех-
жидкостной хроматограф PerkinElmer Clarus 680
анизму присоединения-отщепления (AdN-E);
(GC) и масс-спектрометрический детектор Clarus
внутримолекулярное элиминирование в син-
SQ 8T (МС). В качестве неподвижной фазы вы-
положении по отношению к уходящим группам;
ступала капиллярная колонка ELITE-5ms 30 м×
последующее нуклеофильное замещение по
0.25 мм×0.25 мкм. Условия хроматографирования
механизму присоединения- отщепления (AdN-E).
и детектирования: газ-носитель - гелий, wпотока =
Определена лимитирующая стадия процесса -
1 мл/мин, Tинжектора = 280°C, Tколонки = 200-220°C
нуклеофильное замещение с образованием
(в зависимости от соединения), деление пото-
карбаниона.
ка 1:30, Vпробы = 1 мкл, температура источника и
трансфер-линии - 150°С, ионизирующее напря-
Дальнейшее превращение интермедиата 4 в
жение - 70 эВ. Регистрацию ИК спектров прово-
4,4'-динитробензофенон происходит при изме-
дили на приборе PerkinElmer Spectrum 65 FT-IR
нении природы растворителя. Например, в ходе
Spectrometer на приставке UATR методом НПВО.
добавления воды на стадии выделения конечных
Для получения спектров ЯМР 1Н использовали
продуктов реакции или при проведении анализа
спектрометр Bruker DRX500 SF-500, растворитель -
реакционной смеси методом ВЭЖХ (подвижная
ДМСО-d6-CCl4, внутренний стандарт - ТМС.
фаза - ацетонитрил:вода = 70:30). При разрушении
сольватной оболочки апротонного растворителя и
4,4'-Динитробензофенон. Т. пл. 192-194°С.
в присутствии протонов возникает безбарьерная
ИК спектр, ν, см-1: 1532 [νas(NO2)], 1352 [νs(NO2)],
трансформация интермедиата 4 в 4,4'-динитробен-
1676 (C=O). Спектр ЯМР 1Н, δ, м. д.: 8.43 м и 8.07
зофенон 5.
м (8H, ArН). Масс-спектр, m/z (Iотн, %): 272 (47.18)
[М]+, 242 (5.79) [M - NO]+, 226 (3.37) [M – NO2]+,
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
180 (5.34) [M - 2NO2]+, 150 (100) [M - Ar-NO2,]+,
2,2-Ди-(4-нитрофенил)-1,1-дихлорэтен и 4,4'-
120 (24.48) [M - Ar-NO2 - NO]+, 104 (21.59) [M -
динитробензофенон получали по известным мето-
Ar-NO2 - NO2]+, 92 (19.76) [M - CO - Ar-NO2 -
дикам [8]. Оксим 4,4'-динитробензофенона синте-
NO]+, 76 (10.13) [Ar].
зирован по методике [22].
Оксим 4,4'-динитробензофенона. Т. пл. 194-
Кинетические исследования реакции проводи-
196°С. ИК спектр, ν, см-1: 1340, 1520 (NO2); 1655
ли в стеклянном реакторе, снабженном мешалкой,
(С=N), 3200 (О-Н). Спектр ЯМР 1Н, δ, м. д.: 7.59 м
обратным холодильником, термометром и капил-
(2Н, ArH), 7.66 м (2Н, ArH), 8.18 м (2Н, ArH), 8.33
ляром для ввода азота. В реактор загружали рас-
м (2Н, ArH), 12.0 c (1H, OH). Масс-спектр, m/z (Iотн,
творитель и субстрат, систему термостатировали
%): 271 (25.1) [М - O]+, 254 (78.2) [M - O - OH]+,
(±0.5°С). При перемешивании вносили расчетное
224 (99.9) [M - OH - NO2]+, 179 (73.9) [M - O -
количество реагента. Пробы отбирали в ходе реак-
2NO2]+, 149 (58.2) [M - O - Ar-NO2]+, 103 (71.6)
ции, охлаждали и анализировали методом ВЭЖХ.
[M - O - Ar-NO2 - NO2]+, 76 (81.16) [Ar].
Концентрации
2,2-ди-(4-нитрофенил)-1,1-ди-
Полученные экспериментальные спектры со-
хлорэтена и 4,4'-динитробензофенона определяли
гласуются с литературными данными для 4,4'-ди-
на высокоэффективном жидкостном хроматографе
нитробензофенона [23, 26] и оксима 4,4'-динитро-
PerkinElmer с УФ детектором, длина колонки -
бензофенона [22].
15 см, внутренний диаметр - 4.6 мм, размер пор -
100 Å, Tколонки = 30°С, состав элюента H2O:МеCN =
Расчеты проведены в программном обеспе-
30:70, wпотока=0.8 мл/мин, λдетектора = 254 нм,
чении FireFly 8.2 [27] методом DFT в корреляци-
Vпробы = 10 мкл. Внутренний стандарт - 2,2-ди-
онно-обменном гибридном потенциале (B3LYP)
(3-нитро-4-хлорфенил)-1,1,1-трихлорэтан. Время
c базисным набором 6-31G++(d,p). Для учета
удерживания 4,4'-динитробензофенона - 4.27 мин,
сольватационых эффектов исследуемые струк-
2,2-ди-(4-нитрофенил)-1,1-дихлорэтена - 8.9 мин.
туры помещались в поляризационный континум
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 1 2020
ТР
АНСФОРМАЦИЯ 2,2-ДИ-(4-НИТРОФЕНИЛ)-1,1-ДИХЛОРЭТЕНА
29
сольватационной модели PCM-D [28], в которой
11. Савинский Н.Г., Сапожникова Н.Г., Сибриков С.Г.,
Казин В.Н. // Изв. вузов. Сер. хим. и хим. технол.
использовались такие параметры растворителя,
2003. Т. 46. Вып. 5. С. 26.
как сольватационный радиус и диэлектрическая
12. Казин В.Н., Сибриков С.Г., Подаруев С.О., Сапожни-
проницаемость при 373 K. Визуализация про-
кова Н.Г., Плахтинский В.В. // Изв. вузов. Сер. хим.
странственной структуры молекул выполнена в
и хим. технол. 2009. Т. 52. Вып. 8. С. 16.
программном пакете Chemcraft [29]. Корректность
13. Казин В.Н., Кужин М.Б., Сирик А.В., Гузов Е.А. //
полученных стационарных состояний подтвержде-
ЖОрХ. 2016. Т. 52. Вып. 9. С. 1290; Kazin V.N.,
на отсутствием мнимых частот, переходных состо-
Kuzhin M.B., Sirik A.V., Guzov E.A. // Russ. J. Org.
Chem. 2016. Vol. 52. N 9. P. 1277. doi 10.1134/
яний - наличие одной мнимой частоты в расчете
S1070428016090049
матриц гессиана.
14. Казин В.Н., Кужин М.Б., Сибриков С.Г.,
КОНФЛИКТ ИНТЕРЕСОВ
Сирик А.В., Гузов Е.А., Плахтинский В.В. // ЖОХ.
2017. Т. 87. Вып. 3. С. 362; Kazin V.N., Kuzhin M.B.,
Авторы заявляют об отсутствии конфликта
Sibrikov S.G., Sirik A.V., Guzov E.A., Plakhtinskii V.V. //
интересов.
Russ. J. Gen. Chem. 2017. Vol. 87. N 3. P 381. doi
10.1134/S1070363217030033
СПИСОК ЛИТЕРАТУРЫ
15. Гузов Е.А., Казин В.Н., Жукова А.А. // ЖОХ. 2018.
1. Русанов А.Л., Кештов М.Л., Кириллов А.А., Кире-
Т. 88. Вып. 10. С. 1595; Guzov E.A., Kazin V.N.,
ев В.В., Кештова С.В., Петровский П.В. // Высоко-
Zhukova A.A. // Russ. J. Gen. Chem. 2018. Vol. 88.
мол. соед. 2000. Т. 42. № 11. С. 1947; Rusanov, A.L.,
N 10. P. 2044. doi 10.1134/S1070363218100031
Keshtov M.L., Kirillov, A.A., Kireev V.V., Keshtova S.V.,
16. Шлютер М., Шэм Л. Теория функционала плотно-
Petrovskii P.V. // Polym. Sci. (B). 2000. Vol. 42.
сти. М.: Мир, 1983. С. 203.
N 11-12. P. 314.
17. Koch W., Holthausen M.C. A Chemist’s Guide to
2. Кештов М.Л., Русанов А.Л., Киреев В.В., Кешто-
Density Functional Theory. Toronto: Willey-VCH,
ва С.В., Петровский П.В., Кириллов А.А. // Высо-
2001. P 293.
комол. соед. 2001. Т. 43. № 6. С. 963; Keshtov M.L.,
18. Кон В. // Усп. физ. наук. 2002. Т. 172. № 3. С. 336.
Rusanov A.L., Kireev V.V., Keshtova S.V., Petrov-
19. Pople J. A., Binkley J. S., Seeger R. // Int. J. Quantum
skii P.V., Kirillov A.A. // Polym. Sci. (A). 2001. Vol. 43.
Chem. Suppl. Proc. Int. Symp. Quantum Biol. Quantum
N 6. P. 588.
Pharmacol. 1976. Vol. 10. N 10. P. 1. doi 10.1002/
3. Batanero B., Ramirez-Moreno M., Barba F. //
qua.560100802
Tetrahedron Lett. 2016. Vol. 57. P. 2290. doi 10.1016/j.
20. Pople J. A., Seeger R., Krishnan R. // Int. J. Quantum
tetlet.2016.04.046
Chem. Suppl. Proc. Int. Symp. Atom. Mol. Solid-State
4. Русанов А.Л., Кештов М.Л., Кештова С.В., Петров-
Theory, Collision Phenom. Comput. Meth. 1977. Vol.
ский П.В., Кундина Ю.Ф. // Высокомол. соед. 2000.
12. N S11. P. 149. doi 10.1002/qua.560120820
Т. 42. № 11. С. 1931; Rusanov A.L., Keshtov M.L.,
21. Казин В.Н., Сибриков С.Г., Сапожникова Н.Г., Орло-
Keshtova S.V., Petrovskii P.V. Kundina Y.F. // Polym.
ва Т.Н. // Баш. хим. ж. 2008. Т. 15. № 3. С.61.
Sci. (B). 2000. Vol. 41. N 11-12. P 301.
22. Pat. US 5879657A (1999).
5. Казин В.Н., Сибриков С.Г., Копейкин В.В., Миро-
23. Suzuki H., Murashima T. // J. Chem. Soc. Perkin Trans.
нов Г.С., Русанов А.Л., Казакова Г.В. А. с. 1606507
1. 1994. Vol. 1 N 7. P. 903. doi 10.1039/p19940000903
(1990) // Б. И. 1990. № 42.
24. Broxton T. J., Muir D. M., Parker A. J. // J. Org. Chem.
6. Казин В.Н., Сибриков С.Г., Копейкин В.В., Миро-
1975. Vol. 40. N 22. P 3230. doi 10.1021/jo00910a015
нов Г.С. // ЖОрХ. 1991. Т. 27. Вып. 2. С. 380.
25. Holleman A.F., Wiberg E. Inorganic Chemistry. San
7. Сибриков С.Г., Казин В.Н., Копейкин В.В. //
Diego: Academic Press, 2001. P. 1884.
ЖОрХ.1994. Т. 30. Вып. 7. С. 1080.
26. Jarczewski A., Schroeder G., Dworniczak M. // J. Chem.
8. Сибриков С.Г., Казин В.Н., Копейкин В.В., Орло-
Soc. Perkin Trans. 2. 1986. Vol. 1. N 55. P. 55. doi
ва Т.Н. // Изв. вузов. Сер. хим. и хим. технол. 1995.
10.1039/p29860000055
Т. 38. Вып. 6. С. 32.
9. Сибриков С.Г., Сапожникова Н.Г., Савинский Н.Г.,
msu.su/gran/firefly/index.html
Миронов Г.С., Казин В.Н. // Хим. технол. 2003.
28. Marenich A.V., Cramer C.J., Truhlar D.G. // Phys
Вып. 6. С. 13.
Chem (B). 2009. Vol. 113. N 18. P. 6378. doi 10.1021/
10. Казин В.Н., Савинский Н.Г., Сибриков С.Г., Сапо-
jp810292n
жникова Н.Г., Яблонский О.П. // Изв. вузов. Сер.
хим. и хим. технол. 2004. Т. 47. Вып. 6. С. 28.
chemcraftprog.com
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 1 2020
30
ГУЗОВ, КАЗИН
Transformation of 2,2-Di-(4-nitrophenyl)-1,1-dichloroethene
in the Reaction with Nitrite-Ion in Aprotic Polar Solvents
E. A. Guzov and V. N. Kazin*
P.G. Demidov Yaroslavl State University, ul. Sovetskaya 14, Yaroslavl, 150003 Russia
*е-mail: kaz@uniyar.ac.ru
Received June 20, 2019; revised November 28, 2019; accepted December 4, 2019
The reaction of 2,2-di-(nitrophenyl)-1,1-dichloroethene with a nitrite ion in aprotic polar solvents was studied.
The reaction products were identified; the influence of various factors, including the processes of dissociation
and solvation of reagents, on the rate constant was investigated. The thermodynamic parameters of the reac-
tion were determined. Quantum-chemical calculations of the multi-stage process were performed. A plausible
reaction mechanism was proposed.
Keywords: 2,2-di-(4-nitrophenyl)-1,1-dichloroethene, 4,4'-dinitrobenzophenone, nitrite ion, dissociation and
solvation processes, reaction mechanism
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 1 2020