ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2020, том 90, № 1, с. 42-49
УДК 542.91
НОВЫЕ МОДУЛЯТОРЫ NMDA-РЕЦЕПТОРОВ НА
ОСНОВЕ АЛКИН-АЗИДНОЙ КЛИК-РЕАКЦИИ ЭФИРОВ
2-АМИНОТИОФЕН-3-КАРБОНОВЫХ КИСЛОТ С
N-ПРОПАРГИЛСОДЕРЖАЩИМИ ФАРМАКОФОРАМИ
© 2020 г.
В. Б. Соколов,
А. Ю. Аксиненко*, Т. В. Горева, Т. А. Епишина,
А. В. Габрельян, В. В. Григорьев
Институт физиологически активных веществ Российской академии наук,
Северный проезд 1, Черноголовка, 142432 Россия
*e-mail: alaks@ipac.ac.ru
Поступило в Редакцию 1 июля 2019 г.
После доработки 1 июля 2019 г.
Принято к печати 4 июля 2019 г.
Изучено медь-катализируемое алкин-азидное 1,3-диполярное циклоприсоединение метиловых эфиров
N-азидоацетил-2-аминотиофен-3-карбоновых кислот к N-пропаргилсодержащим фармакофорам, приво-
дящее к соответствующим конъюгатам с 1,2,3-триазолсодержащим алкиленовым спейсером. Методом
радиолигандного связывания показано сильное модулирующее действие синтезированных соединений
на нейрональные NMDA-рецепторы
Ключевые слова: алкины, азиды, 1,4-замещенные 1,2,3-триазолы, 1,3-диполярное циклоприсоединение,
NMDA-рецепторы, радиолигандное связывание
DOI: 10.31857/S0044460X20010059
Производные
2-аминотетрагидробензотио-
на основе 2-аминотиофен-3-карбоновых кислот
фен-3-карбоновых кислот, которые в последнее
представлены на схеме 1. Ранее нами было пока-
время рассматриваются как потенциальные тера-
зано, что метил-6-трет-бутил-2-амино-4,5,6,7-
певтические средства для лечения ряда психонев-
тетрагидробензо[b]тиофен-3-карбоксилат (TBTC,
рологических заболеваний, проявляют свойства
1) и тиомочевина 2 обладают как блокирующей,
позитивных и негативных аллостерических моду-
так и потенциирующей активностью в отношении
ляторов NMDA-рецепторов. Они продемонстри-
токов кальций-активируемых хлорных каналов [3].
ровали возможность как ингибирования, так и
На примере 2-аминотиофенов 3, имеющих 4-триф-
потенциации активных сайтов NMDA-рецептора
торметилимидазолоновый цикл при аминогруппе,
[1,2]. Известные модуляторы NMDA-рецепторов
продемонстрировано увеличение степени связы-
Схема 1.
O
O
O
O
O
O
S
F3C
Ph
N
NH2
NH
N
S
S
S
H
N
HN
R
R1
O
1
2
3
42
НОВЫЕ МОДУ
ЛЯТОРЫ NMDA-РЕЦЕПТОРОВ
43
Схема 2.
O
O
O
O
NaN
3
H
H
N
N
Cl
N3
S
S
R
R
O
O
4a-ɜ
5a-ɜ
NX
O
O
6 11
H
Cu+
N
N
N
S
N
R
O
12a- ɜ
NX
N
N
R = H (a), Me (ɛ), t-Bu (ɜ); NX =
(6, 12),
(7, 13),
F
N
N
N
(8, 14),
(9, 15),
(10, 16),
N
N
S
F
HN
(11, 17).
вания меченых лигандов как с сайтом связывания
чить большое
разнообразие
1,4-дизамещенных
МК-801, так и с сайтом связывания ифенпродила
1,2,3-триазолов. Для синтеза целевых конъюга-
NMDA-рецептора [4].
тов в качестве азидной компоненты клик-реак-
ции были получены N-азидоацетамиды 2-ами-
Целью настоящего исследования явился син-
тез новых производных 2-аминотетрагидробензо-
нотиофенов 5а-в, которые легко циклизуются с
тиофен-3-карбоновых кислот на основе медь-ка-
N-пропаргилсодержащими фармакофорами, для
тализируемой алкин-азидной
клик-реакции
которых ранее были выявлены нейропротектор-
N-азидоацетамидов метиловых эфиров этих кис-
ные, когнитивно-стимулирующие или пронейро-
лот с N-пропаргилсодержащими фармакофорами
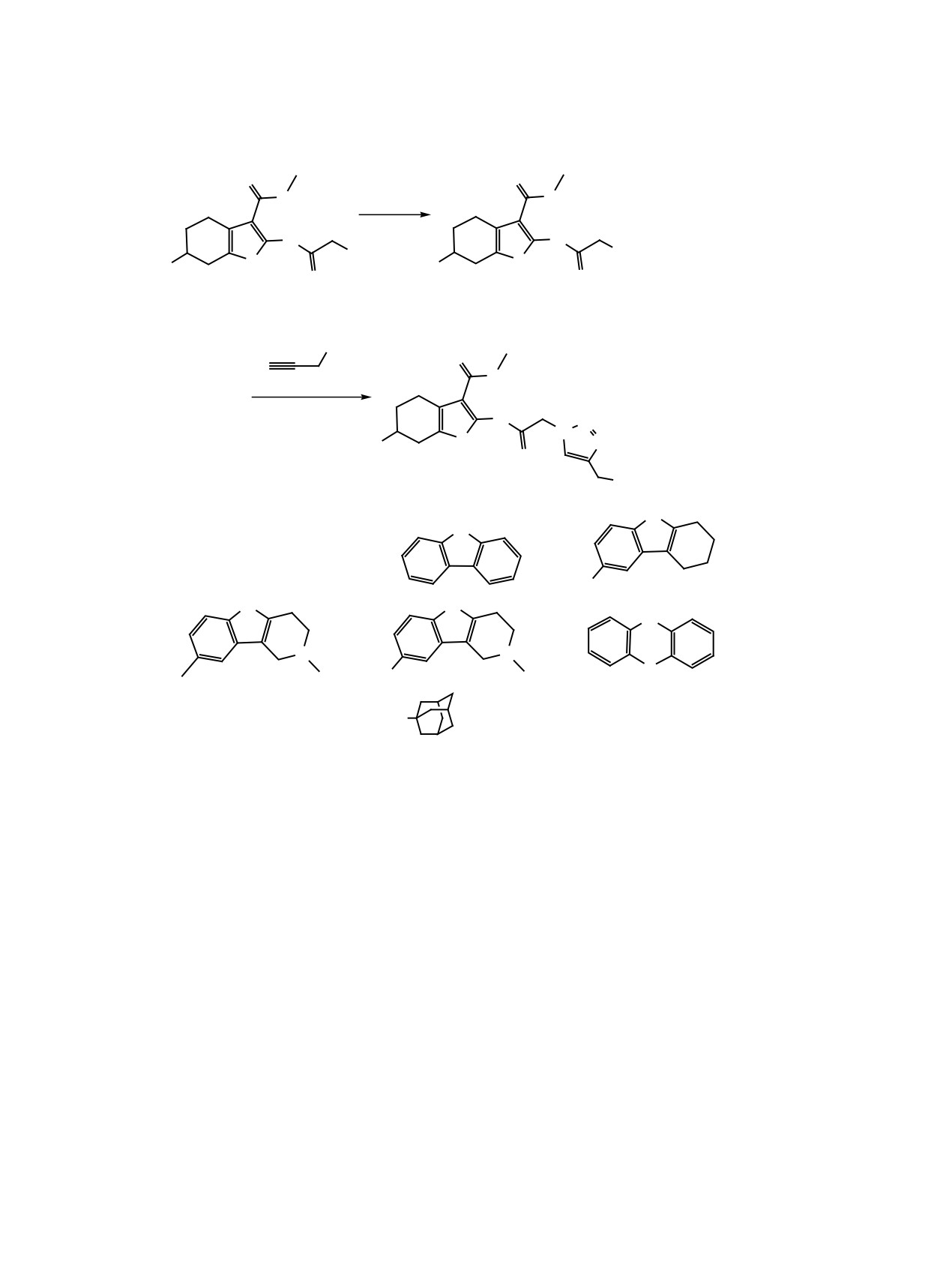
генные свойства [5], а именно карбазолом 6, тетра-
и изучение биологической активности синтези-
гидрокарбазолом 7, тетрагидро-гамма-карболина-
рованных соединений как модуляторов NMDA-
ми 8 и 9, фенотиазином 10 и аминоадамантаном
рецепторов.
11.
Медь-катализируемое алкин-азидное
1,3-ди-
Азидоацетамиды 5a-в получены с выходом
полярное циклоприсоединение, являющееся
62-86% взаимодействием хлорацетамидов 4а-в
одним из стандартов клик-химии - класса бы-
[6, 7] с NaN3 в растворе ДМФА (схема 2). В при-
стрых, универсальных и селективных реакций,
сутствии каталитических количеств Cu(I) азидо-
характеризующихся высокими выходами и про-
ацетамиды 5a-в взаимодействуют с N-пропаргил-
стым выделением продуктов, - позволяет полу-
содержащими фармакофорами 6-11, практически
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 1 2020
44
СОКОЛОВ и др.
Таблица 1. Действие соединений 12-14 на связывание [3H]MK-801 и [3H]ифенпродила со своими участками на
NMDA-рецепторах
№
χ, %a
№
χ, %a
[3H]MK-801
[3H]ифенпродил
[3H]MK-801
[3H]ифенпродил
12a
172±13.6
193±15.4
15a
140±12.5
18.3±2.4
12б
151±12.6
141±1.1
15б
-
-
12в
191±16.8
239±20.5
15в
151±11.4
147±11.4
13a
167±12.7
141±12.2
16a
176±159.8
183±15.2
13б
168±14.9
135±11.7
16б
-
-
13в
177±15.5
139±9.9
16в
200±17.5
159±14.3
14a
169±13.9
127±10.6
17a
62.3±5.9
84.9±5.8
14б
136±12.2
27.4±2.6
17б
43.3±4.8
88.3±5.1
14в
174±17.7
134±10.1
17в
27.4±3.4
65.3±5.4
а Блокада/потенциация при 100 мкМ. по сравнению с контролем. Связывание с контролем принято за 100%.
Таблица 2. Значения IC50 (мкМ.) блокирования соединениями 12б, 13б, 14б, 16в и 17a-в связывания [3H]MK-801 и
[3H]ифенпродила со своими участками на NMDA-рецепторах
IC50, мкМ.
IC50, мкМ.
№
№
[3H]MK-801
[3H]ифенпродил
[3H]MK-801
[3H]ифенпродил
12б
>100
>100
17a
39.8±3.6
6.15±1.1
13б
>100
>100
17б
71.3±1.1
6.35±1.1
14б
>100
>100
17в
68.4±5.7
16.8±1.1
16в
>100
>100
количественно образуя соответствующие 1,4-за-
характерным сигналом СН-протона триазольного
мещенные 1,2,3-триазолы 12-17.
цикла в области 7.12-8.47 м. д.
Реакции протекали при перемешивании эк-
Биологическая активность соединений 12-17
вимолярных количеств азидоацетамидов 5a-в и
изучена методом радиолигандного связывания
соответствующих N-пропаргилсодержащих фар-
[8, 9], который позволяет количественно оценить
макофоров 6-11 в хлористом метилене в присут-
влияние соединений на нейрональные, в частно-
ствии каталитических количеств сульфата меди и
сти, NMDA-рецепторы - один из трех главных
аскорбата натрия в течение 3 ч при 40°С. Выход
типов ионотропных глутаматных рецепторов
соответствующих
1,4-замещенных
1,2,3-триазо-
центральной нервной системы млекопитающих,
лов 12-17 составил 70-92%. Полученные соеди-
играющих ключевую роль в механизмах нейро-
нения представляют собой кристаллические ве-
протекции и нейротоксичности. В табл. 1 и 2 пред-
щества, структура и состав которых установлены
ставлены результаты по исследованию влияния
на основании данных спектроскопии ЯМР 1Н и
соединений 12-17 на связывание меченых МК-801
элементного анализа. Спектры ЯМР 1Н 1,2,3-триа-
и ифенпродила c участками связывания NMDA-
золов 12-17 представляют суперпозицию 2-ацета-
рецепторов в опытах in vitro в концентрации 10-8-
мидотетрагидробензотиофенового и фармакофор-
10-4 моль/л. Полученные результаты показывают,
ного фрагментов и триазолсодежащего спейсера с
что практически все исследованные соединения
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 1 2020
НОВЫЕ МОДУ
ЛЯТОРЫ NMDA-РЕЦЕПТОРОВ
45
увеличивают связывание меченых лигандов как с
c (1H, NH). Найдено, %: С 49.11; Н 4.72; N 19.23.
сайтом связывания МК-801, так и с сайтом связы-
C12H14N4O3S. Вычислено, %: C 48.97; H 4.79; N
вания ифенпродила.
19.04.
Соединения 17а-в оказали высокое и умерен-
Метил-2-(2-азидоацетамидо)-6-метил-
ное блокирующее действие на сайт связывания
4,5,6,7-тетрагидробензо[b]тиофен-3-карбокси-
ифенпродила, при этом триазолы 17а и 17б одно-
лат (5б) получали аналогично. Выход 0.98 г (64%),
временно умеренно или слабо блокировали сайт
т. пл. 105-107°С. Спектр ЯМР 1Н (CDCl3), δ, м. д.
связывания МК-801. Менее активно в этом плане
(J, Гц): 1.05 д (3H, CH3CH, 3JHH = 6.4), 1.24-1.48 м
соединение 17в. Часть соединений усиливало свя-
(1H, CH3CH), 1.73-2.00 м (2H, CH2), 2.14-2.37 м
зывание меченных лигандов - это проявлялось в
(1H, CH2), 2.51-2.80 м (2H, CH2), 2.82-3.02 м (1H,
отношении обоих сайтов связывания, хотя и име-
CH2), 3.89 c (3H, CH3O), 4.23 c (2H, CH2N), 11.85
ются количественные различия для каждого из
c (1H, NH). Найдено, %: С 48.42; Н 5.52; N 18.13.
C13H16N4O3S. Вычислено, %: C 50.64; H 5.23; N
сайтов и вещества.
18.17.
Таким образом, на основе алкин-азидной
Метил-2-(2-азидоацетамидо)-6-трет-бутил-
клик-реакции представлен достаточно простой и
4,5,6,7-тетрагидробензо[b]тиофен-3-карбокси-
эффективный метод объединения в одну молекулу
лат (5в) получали аналогично. Выход 1.33 г (83%),
триазолсодержащим спейсером эфиров 2-амино-
т. пл. 118-120°С. Спектр ЯМР 1Н (CDCl3), δ, м. д.
тиофен-3-карбоновых кислот с различными фар-
(J, Гц): 0.94 c [9H, (CH3)3C], 1.14-1.58 м (2H, CH +
макофорами. Установлено, что синтезированные
CH2), 1.91-2.14 м (1H, CH2), 2.27-2.80 м (3H, CH2),
соединения обладают всеми свойствами нового
2.91-3.15 м (1H, CH2), 3.90 c (3H, CH3O), 4.24 c
класса модуляторов NMDA-рецепторов и могут
(2H, CH2N), 11.80 c (1H, NH). Найдено, %: С 54.97;
рассматриваются как потенциальные терапевтиче-
Н 6.51; N 16.11 C16H22N4O3S. Вычислено, %: C
ские средства для лечения ряда психоневрологиче-
54.84; H 6.33; N 15.99.
ских заболеваний [10, 11].
Метил-2-(2-{4-[(9H-карбазол-9-ил)метил]-
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
1H-1,2,3-триазол-1-ил}ацетамидо)-4,5,6,7-те-
трагидробензо[b]тиофен-3-карбоксилат
(12a).
Спектры ЯМР 1H и 19F записывали на спектро-
К раствору 1 ммоль азидоацетамида 5a в 20 мл
метре Bruker DPX 200 относительно тетраметил-
хлористого метилена прибавляли
1 ммоль
силана (внутренний стандарт) и CF3COOH (внеш-
N-пропаргилкарбазола 6, 0.05 ммоль CuSO4 в 0.5 мл
ний эталон) соответственно. Температуры плавле-
Н2О и 0.05 ммоль аскорбата натрия в 0.5 мл Н2О.
ния определяли в стеклянном капилляре.
Реакционную смесь перемешивали 3 ч при 40°С,
N-Пропаргилкарбазол
6
[12], N-пропаргил-
затем промывали 10 мл 1%-ного раствора водного
тетрагидрокарбазол
7
[13], N- пропаргилтетра-
аммиака. Органический слой отделяли и сушили
гидро-γ-карболины 8 и 9 [14], N-пропаргилфено-
Na2SO4. Хлористый метилен упаривали, оста-
тиазин 10 [15] и N-пропаргиладамантан 11 [16] по-
ток хроматографировали на силикагеле (60 меш,
лучали по соответствующим методикам.
элюент метанол-хлороформ, 1:10). Выход 0.41 г
Метил-2-(2-азидоацетамидо)-4,5,6,7-тетра-
(83%), т. пл. 232-234°С. Спектр ЯМР 1Н (CDCl3),
гидробензо[b]тиофен-3-карбоксилат (5а). К рас-
δ, м. д. (J, Гц): 1.60-1.96 м (4H, CH2), 2.52-2.82 м
твору 5 ммоль тиофена 4a в 20 мл ДМФА прибав-
(4H, CH2), 3.01 c (3H, CH3O), 5.17 c (1H, CH2N),
ляли 12 ммоль азида натрия. Реакционную массу
7.22-7.65 м (6H, CArH), 8.20 д (1H, CArH, 3JHH =
перемешивали 30 мин при 50°С, затем выливали
7.6), 10.70 c (1H, NH). Найдено, %: С 64.73; Н 5.27;
в 100 мл воды. Осадок отфильтровывали и пере-
N 14.23. C27H25N5O3S. Вычислено, %: C 64.91; H
кристаллизовывали из этанола. Выход 1.1 г (76%),
5.04; N 14.02.
т. пл. 93-95°С. Спектр ЯМР 1Н (CDCl3), δ, м. д.
Метил-2-(2-{4-[(9H-карбазол-9-ил)метил]-
(J, Гц): 1.65-1.94 м (4H, CH2), 2.53-2.88 м (4H,
1H-1,2,3-триазол-1-ил}ацетамидо)-6-метил-
CH2), 3.89 c (3H, CH3O), 4.22 c (4H, CH2N), 11.82
4,5,6,7-тетрагидробензо[b]тиофен-3-карбокси-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 1 2020
46
СОКОЛОВ и др.
лат (12б) получали аналогично. Выход 0.4 г (78%),
2.85 м (6H, CH2), 2.85-3.03 м (1H, CH2), 3.86 c (3H,
т. пл. 192-193°С. Спектр ЯМР 1Н (CDCl3), δ, м. д.
CH3O), 5.21 c (2H, CH2N), 5.42 c (2H, CH2N), 6.87
(J, Гц): 1.07 д (3H, CH3CH, 3JHH = 6.4), 1.24-1.49 м
т. д (1H, CArH, 3JHF = 9.0, 4JHH = 2.4), 7.13 д. д (1H,
(1H, CH3CH), 1.77-2.00 м (2H, CH2), 2.13-2.34 м
CArH, 3JHF = 9.5, 4JHH = 2.4), 7.25 д. д (1H, CArH,
(1H, CH2), 2.50-2.77 м (2H, CH2), 2.83-3.02 м (1H,
3JHH = 9.0, 4JHF = 4.4), 7.34 c (1H, =CHN), 11.44 c
CH2), 3.82 c (3H, CH3O), 5.13 c (2H, CH2N), 5.72 c
(1H, NH). Спектр ЯМР 19F (CDCl3), δF, м. д. (J, Гц):
(2H, CH2N), 7.20-7.60 м (7H, CArH + =CHN), 8.11 д
-49.2 т. д (3JHF = 9.2, 4JHF = 4.4). Найдено, %: С
(2H, CArH, 3JHH = 7.7), 11.37 c (1H, NH). Найдено, %:
62.89; Н 5.46; N 13.17. C28H30FN5O3S. Вычислено,
С 65.38; Н 5.13; N 13.56. C28H27N5O3S. Вычислено,
%: C 62.79; H 5.65; N 13.07.
%: C 65.48; H 5.30; N 13.64.
Метил-2-[2-(4-{[6-фтор-3,4-дигидро-1H-
Метил-2-(2-{4-[(9H-карбазол-9-ил)метил]-
карбазол-9(2H)-ил]метил}-1H-1,2,3-триазол-1-
1H-1,2,3-триазол-1-ил}ацетамидо)-6-трет-
ил)ацетамидо]-6-трет-бутил-4,5,6,7-тетрагид-
бутил-4,5,6,7-тетрагидробензо[b]тиофен-3-кар-
робензо[b]тиофен-3-карбоксилат (13в) получали
боксилат (12в) получали аналогично. Выход 0.47 г
аналогично. Выход 0.45 г (80%), т. пл. 130-131°С.
(86%), т. пл. 146-148°С. Спектр ЯМР 1Н (CDCl3), δ,
Спектр ЯМР 1Н (CDCl3), δ, м. д. (J, Гц): 0.92 c [9H,
м. д. (J, Гц): 0.88 c [9H, (CH3)3C], 1.06-1.52 м (2H,
(CH3)3C], 1.12-1.52 м (3H, CH + CH2), 1.72-2.08 м
CH + CH2), 1.81-2.08 м (1H, CH2), 2.19-2.74 м (3H,
(5H, CH2), 2.23-2.53 м (2H, CH2), 2.53-2.83 м (4H,
CH2), 2.79-3.05 м (1H, CH2), 3.73 c (3H, CH3O), 5.52
CH2), 2.87-3.06 м (1H, CH2), 3.79 c (3H, CH3O),
c (2H, CH2N), 5.73 c (2H, CH2N), 7.21 т (2H, CArH,
5.14 c (2H, CH2N), 5.35 c (2H, CH2N), 6.80 т. д (1H,
3JHH = 7.6), 7.46 т (2H, CArH, 3JHH = 7.6), 7.78 д (2H,
CArH, 3JHF = 9.0, 4JHH = 2.4), 7.06 д. д (1H, CArH,
CArH, 3JHH = 7.6), 8.08 c (1H, =CHN), 8.15 д (2H,
3JHF = 9.5, 4JHH = 2.4), 7.19 д. д (1H, CArH, 3JHH =
CArH, 3JHH = 7.6), 11.00 c (1H, NH). Найдено, %: С
9.0, 4JHF = 4.4), 7.29 c (1H, =CHN), 11.32 c (1H,
67.13; Н 6.13; N 12.86. C31H33N5O3S. Вычислено,
NH). Спектр ЯМР 19F (CDCl3), δF, м. д. (J, Гц):
%: C 67.00; H 5.99; N 12.60.
-49.4 т. д (3JHF = 9.2, 4JHF = 4.4). Найдено, %: С
64.38; Н 6.20; N 12.32. C31H36FN5O3S. Вычислено,
Метил-2-[2-(4-{[6-фтор-3,4-дигидро-1H-
%: C 64.45; H 6.28; N 12.12.
карбазол-9(2H)-ил]метил}-1H-1,2,3-триазол-1-
ил)ацетамидо]-4,5,6,7-тетрагидробензо[b]тио-
Метил-2-{2-[4-({2,8-диметил-3,4-дигидро-
фен-3-карбоксилат (13a) получали аналогично.
1H-пиридо[4,3-b]индол-5(2H)-ил}метил)-1H-
Выход 0.41 г (78%), т. пл. 211-212°С. Спектр ЯМР
1,2,3-триазол-1-ил]ацетамидо}-4,5,6,7-тетрагид-
1Н (CDCl3), δ, м. д. (J, Гц): 1.70-2.05 м (8H, CH2),
робензо[b]тиофен-3-карбоксилат (14а) получали
2.58-2.90 м (8H, CH2), 3.86 c (3H, CH3O), 5.22 c
аналогично. Выход 0.37 г (69%), т. пл. 206-207°С.
(2H, CH2N), 5.42 c (2H, CH2N), 6.87 т. д (1H, CArH,
Спектр ЯМР 1Н (CDCl3), δ, м. д. (J, Гц): 1.68-1.92
3JHF = 9.0, 4JHH = 2.4), 7.13 д. д (1H, CArH, 3JHF = 9.5,
м (4H, CH2), 2.40 c (3H, CH3C), 2.60 c (3H, CH3N),
4JHH = 2.4), 7.25 д. д (1H, CArH, 3JHH = 9.0, 4JHF =
2.56-2.83 м (4H, CH2), 2.91-3.12 м (4H, CH2), 3.86
4.4), 7.30 c (1H, =CHN), 11.45 c (1H, NH). Спектр
c (3H, CH3O), 4.22 c (2H, CH2N), 4.71 c (2H, CH2N),
ЯМР 19F (CDCl3), δF, м. д. (J, Гц): -49.2 т. д (3JHF =
5.18 c (2H, CH2N), 6.98 д (1H, CArH, 3JHH = 7.7),
9.2, 4JHF = 4.4). Найдено, %: С 62.38; Н 5.27; N
7.13 д (1H, CArH, 3JHH = 7.7), 7.27 c (2H, CArH +
13.57. C27H28FN5O3S. Вычислено, %: C 62.17; H
=CHN), 11.31 c (1H, NH). Найдено, %: С 63.29;
5.41; N 13.43.
Н 6.34; N 15.67. C28H32N6O3S. Вычислено, %: C
63.14; H 6.06; N 15.78.
Метил-2-[2-(4-{[6-фтор-3,4-дигидро-1H-
карбазол-9(2H)-ил]метил}-1H-1,2,3-триазол-
Метил-2-{2-[4-({2,8-диметил-3,4-дигидро-
1-ил)ацетамидо]-6-метил-4,5,6,7-тетрагидро-
1H-пиридо[4,3-b]индол-5(2H)-ил}метил)-
бензо[b]тиофен-3-карбоксилат
(13б) получали
1H-1,2,3-триазол-1-ил]ацетамидо}-6-ме-
аналогично. Выход 0.36 г (68%), т. пл. 113-114°С.
тил-4,5,6,7-тетрагидробензо[b]тиофен-3-кар-
Спектр ЯМР 1Н (CDCl3), δ, м. д. (J, Гц): 1.08 д
боксилат (14б) получали аналогично. Выход 0.33 г
(3H, CH3CH, 3JHH = 6.4), 1.25-1.50 м (1H, CH3CH),
(60%), т. пл. 119-120°С. Спектр ЯМР 1Н (CDCl3),
1.72-2.06 м (6H, CH2), 2.15-2.36 м (1H, CH2), 2.53-
δ, м. д. (J, Гц): 1.03 д (3H, CH3CH, 3JHH = 6.4), 1.20-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 1 2020
НОВЫЕ МОДУ
ЛЯТОРЫ NMDA-РЕЦЕПТОРОВ
47
1.46 м (1H, CH3CH), 1.64-2.01 м (3H, CH2), 2.09-
1.47 м (1H, CH3CH), 1.63-2.00 м (3H, CH2), 2.09-
2.44 м (2H, CH2), 2.37 c (3H, CH3C), 2.56 c (3H,
2.44 м (2H, CH2), 2.56 c (3H, CH3N), 2.44-2.77 м
CH3N), 2.44-2.77 м (2H, CH2), 2.77-3.10 м (4H,
(2H, CH2), 2.77-3.10 м (4H, CH2), 3.83 c (3H, CH3O),
CH2), 3.84 c (3H, CH3O), 4.19 c (2H, CH2N), 4.69
4.16 c (2H, CH2N), 4.69 c (2H, CH2N), 5.18 c (2H,
c (2H, CH2N), 5.16 c (2H, CH2N), 6.97 д (1H, CArH,
CH2N), 6.86 т. д (1H, CArH, 3JHF = 9.0, 4JHH = 2.4),
3JHH = 7.8), 7.11 д (1H, CArH, 3JHH = 7.8), 7.26 c (2H,
7.04-7.18 м (2H, CArH), 7.27 c (1H, =CHN), 11.33 c
CArH + =CHN), 11.32 c (1H, NH). Найдено, %: С
(1H, NH). Спектр ЯМР 19F (CDCl3), δF, м. д. (J, Гц):
63.54; Н 6.31; N 15.62. C28H32N6O3S. Вычислено,
-48.7 т. д (3JHF = 9.2, 4JHF = 4.4). Найдено, %: С
%: C 63.71; H 6.27; N 15.37.
61.28; Н 5.43; N 15.37. C28H31FN6O3S. Вычислено,
%: C 61.07; H 5.67; N 15.26.
Метил-2-{2-[4-({2,8-диметил-3,4-дигидро-
1H-пиридо[4,3-b]индол-5(2H)-ил}метил)-1H-
Метил-2-{2-[4-({8-фтор-2-метил-3,4-дигидро-
1,2,3-триазол-1-ил]ацетамидо}-6-трет-бу-
1H-пиридо[4,3-b]индол-5(2H)-ил}метил)-1H-
тил-4,5,6,7-тетрагидробензо[b]тиофен-3-кар-
1,2,3-триазол-1-ил]ацетамидо}-6-трет-бу-
боксилат (14в) получали аналогично. Выход 0.33 г
тил-4,5,6,7-тетрагидробензо[b]тиофен-3-кар-
(60%), т. пл. 142-145°С. Спектр ЯМР 1Н (CDCl3),
боксилат (15в) получали аналогично. Выход 0.46 г
δ, м. д. (J, Гц): 0.96 c [9H, (CH3)3C], 1.17-1.58 м
(77%), т. пл. 215-216°С. Спектр ЯМР 1Н (CDCl3),
(3H, CH + CH2), 1.94-2.14 м (1H, CH2), 2.40 c (3H,
δ, м. д. (J, Гц): 0.96 c [9H, (CH3)3C), 1.16-1.59 м
CH3C), 2.29-2.80 м (3H, CH2), 2.58 c (3H, CH3N),
(3H, CH + CH2), 1.94-2.14 м (1H, CH2), 2.29-2.80
2.86-3.14 м (4H, CH2), 3.85 c (3H, CH3O), 4.21 c (2H,
м (3H, CH2), 2.60 c (3H, CH3N), 2.86-3.22 м (4H,
CH2N),4.70 c (2H, CH2N), 5.18 c (2H, CH2N), 6.98
CH2), 3.86 c (3H, CH3O), 4.20 c (2H, CH2N), 4.72 c
д (1H, CArH, 3JHH = 7.8), 7.12 д (1H, CArH, 3JHH =
(2H, CH2N), 5.21 c (2H, CH2N), 6.88 т. д (1H, CArH,
7.8), 7.27 c (2H, CArH + =CHN), 11.29 c (1H, NH).
3JHF = 9.0, 4JHH = 2.4), 7.06-7.23 м (2H, CArH),
Найдено, %: С 65.52; Н 6.57; N 14.25. C32H40N6O3S.
7.26 c (1H, =CHN), 11.35 c (1H, NH). Спектр ЯМР
Вычислено, %: C 65.28; H 6.85; N 14.27.
19F (CDCl3), δF, м. д. (J, Гц): -48.9 т. д (3JHF = 9.2,
4JHF = 4.4). Найдено, %: С 62.62; Н 6.46; N 14.37.
Метил-2-{2-[4-({8-фтор-2-метил-3,4-дигидро-
C31H37FN6O3S. Вычислено, %: C 62.82; H 6.29; N
1H-пиридо[4,3-b]индол-5(2H)-ил}метил)-1H-
14.18.
1,2,3-триазол-1-ил]ацетамидо}-4,5,6,7-тетрагид-
робензо[b]тиофен-3-карбоксилат (15а) получали
Метил-2-(2-{4-[(10Н-фенотиазин-10-ил)-
аналогично. Выход 0.32 г (60%), т. пл. 208-209°С.
метил]-1H-1,2,3-триазол-1-ил}ацетами-
Спектр ЯМР 1Н (CDCl3), δ, м. д. (J, Гц): 1.68-1.92
до)-4,5,6,7-тетрагидробензо[b]тиофен-3-карбок-
м (4H, CH2), 2.60 c (3H, CH3N), 2.56-2.83 м (4H,
силат (16а) получали аналогично. Выход 0.35 г
CH2), 2.93-3.16 м (4H, CH2), 3.86 c (3H, CH3O),
(66%), т. пл. 113-115°С. Спектр ЯМР 1Н (CDCl3),
4.20 c (2H, CH2N), 4.73 c (2H, CH2N), 5.21 c (2H,
δ, м. д. (J, Гц): 1.60-1.90 м (4H, CH2), 2.52-2.86 м
CH2N), 6.90 т. д (1H, CArH, 3JHF = 9.0, 4JHH = 2.4),
(4H, CH2), 3.83 c (3H, CH3O), 5.22 c (4H, CH2N),
7.08-7.21 м (2H, CArH), 7.28 c (1H, =CHN), 11.37
6.65-7.18 м (8H, CArH), 7.58 c (1H, =CHN), 11.35
c (1H, NH). Спектр ЯМР 19F (CDCl3), δ, м. д. (J,
c (1H, NH). Найдено, %: С 61.04; Н 4.51; N 13.42.
Гц): -49.4 т. д (3JHF = 9.2, 4JHF = 4.4). Спектр ЯМР
C27H25N5O3S2. Вычислено, %: C 61.00; H 4.74; N
19F (CDCl3), δF, м. д. (J, Гц): -49.2 т. д (3JHF = 9.2,
13.17.
4JHF = 4.3). Найдено, %: С 60.29; Н 5.34; N 15.69.
Метил-2-(2-{4-[(10Н-фенотиазин-10-ил)ме-
C27H29FN6O3S. Вычислено, %: C 60.43; H 5.45; N
тил]-1H-1,2,3-триазол-1-ил}ацетамидо)-6-ме-
15.66.
тил-4,5,6,7-тетрагидробензо[b]тиофен-3-кар-
Метил-2-{2-[4-({8-фтор-2-метил-3,4-
боксилат (16б) получали аналогично. Выход 0.38 г
дигидро-1H-пиридо[4,3-b]индол-5(2H)-ил}ме-
(70%), т. пл. 113-115°С. Спектр ЯМР 1Н (CDCl3),
тил)-1H-1,2,3-триазол-1-ил]ацетамидо}-6-ме-
δ, м. д. (J, Гц): 1.09 д (3H, CH3CH, 3JHH = 6.4),
тил-4,5,6,7-тетрагидробензо[b]тиофен-3-кар-
1.20-1.48 м (1H, CH3CH), 1.78-2.04 м (2H, CH2),
боксилат (15б) получали аналогично. Выход 0.34 г
2.14-2.38 м (1H, CH2), 2.52-2.80 м (2H, CH2), 2.82-
(62%), т. пл. 175-176°С. Спектр ЯМР 1Н (CDCl3),
3.02 м (1H, CH2), 3.89 c (3H, CH3O), 5.26 c (2H,
δ, м. д. (J, Гц): 1.04 д (3H, CH3CH, 3JHH = 6.4), 1.19-
CH2N), 5.32 c (2H, CH2N), 6.70-7.23 м (8H, CArH),
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 1 2020
48
СОКОЛОВ и др.
7.57 c (1H, =CHN), 11.42 c (1H, NH). Найдено, %: С
м (4H, CH ), 2.29-2.80 м (4H, NH + CH2), 2.90-3.14
61.51; Н 5.12; N 12.63. C28H27N5O3S2. Вычислено,
м (1H, CH2), 3.84 c (3H, CH3O), 4.01 c (2H, CH2N),
%: C 61.63; H 4.99; N 12.83.
5.31 c (2H, CH2N), 7.81 c (1H, =CHN), 11.37 c
Метил-2-(2-{4-[(10Н-фенотиазин-10-ил)
(1H, NH). Найдено, %: С 64.37; Н 6.71; N 12.75.
метил]-1H-1,2,3-триазол-1-ил}ацетамидо)-
C29H41N5O3S. Вычислено, %: C 64.53; H 7.66; N
6-трет-бутил-4,5,6,7-тетрагидробензо[b]тио-
12.98.
фен-3-карбоксилат (16в) получали аналогично.
ФОНДОВАЯ ПОДДЕРЖКА
Выход 0.48 г (84%), т. пл. 119-120°С. Спектр ЯМР
1Н (CDCl3), δ, м. д. (J, Гц): 0.96 c [9H, (CH3)3C],
Работа выполнена при финансовой поддержке
1.16-1.58 м (2H, CH + CH2), 1.94-2.13 м (1H, CH2),
Российского фонда фундаментальных исследова-
2.29-2.83 м (3H, CH2), 2.93-3.15 м (1H, CH2), 3.88
ний (проект № 17-03-00413, синтез соединений 4,
c (3H, CH3O), 5.26 c (2H, CH2N), 5.33 c (2H, CH2N),
5, 12-17) и Министерства образования и науки в
6.72-7.23 м (8H, CArH), 7.64 c (1H, =CHN), 11.37
рамках государственного задания (тема № 0090-
c (1H, NH). Найдено, %: С 63.52; Н 5.78; N 11.69.
2019-0001, синтез соединений 6-11).
C31H33N5O3S2. Вычислено, %: C 63.35; H 5.66; N
11.92.
КОНФЛИКТ ИНТЕРЕСОВ
Метил-2-(2-{4-[(адамант-1-иламино)ме-
Авторы заявляют об отсутствии конфликта
тил]-1H-1,2,3-триазол-1-ил}ацетамидо)-4,5,6,7-
интересов.
тетрагидробензо[b]тиофен-3-карбоксилат (17а)
получали аналогично. Выход 0.41 г (85%), т. пл.
СПИСОК ЛИТЕРАТУРЫ
115-116°С. Спектр ЯМР 1Н (CDCl3), δ, м. д. (J,
1. Katzman B.M., Perszyk R.E., Yuan H., Tahirovic Y.A.,
Гц): 1.50-1.90 м (16H, CH2), 2.02-2.16 м (3H, CH),
Sotimehin A.E., Traynelis S.F., Liotta D.C. // Bioorg.
2.50-2.80 м (5H, NH + CH2), 3.82 c (3H, CH3O),
Med. Chem. Lett. 2015. Vol. 25. P. 5583. doi 10.1016/j.
3.97 c (2H, CH2N), 5.36 c (2H, CH2N), 7.83 c (1H,
bmcl.2015.10.046
=CHN), 11.32 c (1H, NH). Найдено, %: С 62.31;
2. Perszyk R., Katzman B.M., Kusumoto H., Kell S.A.,
Н 6.72; N 14.63. C25H33N5O3S. Вычислено, %: C
62.09; H 6.88; N 14.48.
Epplin M.P., Tahirovic Y.A., Moore R.L., Menaldino D.,
Burger P., Liotta D.C., Traynelis S.F. // eLife. 2018.
Метил-2-(2-{4-[(адамант-1-иламино)ме-
Vol. 7. e34711. doi 10.7554/eLife.34711
тил]-1H-1,2,3-триазол-1-ил}ацетамидо)-6-ме-
тил-4,5,6,7-тетрагидробензо[b]тиофен-3-кар-
3. Григорьев В.В., Замойский В.Л., Аксиненко А.Ю., Со-
колов В.Б., Бачурин С.О. // Докл. АН. 2018. Т. 483. № 1.
боксилат (17б) получали аналогично. Выход 0.42 г (
84%), т. пл. 110-111°С. Спектр ЯМР 1Н (CDCl3),
С. 94; Grigoriev V.V., Zamoyski V.L.,. Aksinenko A.Yu.,
Sokolov V.B., Bachurin S.O. // Doklady Biochem.
δ, м. д. (J, Гц): 1.05 д (3H, CH3CH, 3JHH = 6.4),
1.20-1.50 м (1H, CH3CH), 1.50-2.01 м (14H, CH2),
Biophys. 2018. Vol. 483. N 1. P. 293. doi 10.1134/
S1607672918060042
2.02-2.14 м (4H, CH + NH), 2.14-2.38 м (1H, CH2),
2.52-2.82 м (2H, CH2), 2.83-3.04 м (1H, CH2), 3.85
4. Соколов В.Б., Аксиненко А.Ю., Драный О.А., Григо-
c (3H, CH3O), 4.06 c (2H, CH2N), 5.31 c (2H, CH2N),
рьев В.В. // Изв. АН. Сер. хим. 2018. № 12. С. 2253;
7.80 c (1H, =CHN), 11.39 c (1H, NH). Найдено, %:
Sokolov V.B., Aksinenko A.Yu., Dranyi O.A., Grigo-
С 62.89; Н 7.22; N 14.23. C26H35N5O3S. Вычислено,
riev V.V. // Russ. Chem. Bull. 2018. Vol. 67. N 12.
%: C 62.75; H 7.09; N 14.07.
P. 2253. doi 10.1007/s11172-018-2365-3
Метил-2-(2-{4-[(адамант-1-иламино)метил]-
5. Соколов В.Б., Махаева Г.Ф., Аксиненко А.Ю., Гри-
1H-1,2,3-триазол-1-ил}ацетамидо)-6-трет-бу-
горьев В.В., Шевцова Е.Ф., Бачурин С. О. // Изв.
тил-4,5,6,7-тетрагидробензо[b]тиофен-3-кар-
АН. Сер. хим. 2017. № 10. С. 1821; Sokolov V.B.,
боксилат (17в) получали аналогично. Выход 0.40 г
Makhaeva G.F., Aksinenko A.Yu., Grigoriev V.V.,
(76%), т. пл. 110-111°С. Спектр ЯМР 1Н (CDCl3),
Shevtsova E.F., Bachurin S.O. // Russ. Chem. Bull.
δ, м. д. (J, Гц): 0.92 c [9H, (CH3)3C], 1.16-1.53 м
2017. Vol. 66. N 10. P. 1821. doi 10.1007/s11172-017-
(2H, CH + CH2), 1.50-1.88 м (10H, CH2), 1.94-2.24
1953-y
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 1 2020
НОВЫЕ МОДУ
ЛЯТОРЫ NMDA-РЕЦЕПТОРОВ
49
6. Lee B.H., Geary T.G., Davis J.P., Bowman J.W. Pat.
12. Kolli S.K., Prasad B., Babu P.V., Ashfaq M.A., Ehte-
WO 2003101979 (2003).
sham N.Z., Raju R.R., Pal M. // Org. Biomol. Chem.
7. Хачатрян Д.С., Осипов В.С., Санду Р.А., Даниленко
2014. Vol. 12. N 12. P. 6080. doi 10.1039/c4ob00686k
В.Н., Колотаев А.В., Жданович О.А., Беккер О.Б.,
13. Walser A., Flynn T., Mason C., Crowley H., Maresca
Матевосян К.Р. Пат. РФ 2629369 (2017).
K., Yaremko B., O’Donnel M. // J. Med. Chem. 1991.
8. Dana C., Benavides J., Schoemaker H., Scatton B. //
Vol. 34. N 3. P. 1209. doi 10.1021/jm00107a048
Neurosci. Lett. 1991. Vol. 125. N 1. P. 45. doi
14. Schiefer I.T., VandeVrede L., Fa’ M., Arancio O.,
10.1016/0304-3940(91)90127-F
Thatcher G.R.J. // J. Med. Chem. 2012. Vol. 55. N 7.
9. Nowak G., Trullas R., Layer R.T., Skolnick P., Paul I.A. //
P. 3076. doi 10.1021/jm201504s
J. Pharmacol. Exp. Ther. 1993. Vol. 265. N 3. P. 1380.
15. Sae-Lim C., Sandman D.J., Foxman B.M.,
10. Yao L., Zhou Q. // Neural Plast. 2017. Vol. 2017. ID.
Sukwattanasinitt M. // J. Macromol. Sci. (A). 2006.
2875904. doi 10.1155/2017/2875904
Vol. 43. N 12. P. 1929. doi 10.1080/10601320600996114
11. Warikoo N., Brunwasser S.J., Benz A., Shu H.J., Paul
16. Соколов В.Б., Аксиненко А.Ю., Епишина Т.А., Го-
S.M., Lewis M., Doherty J., Quirk M., Piccio L.,
рева Т.В. // Изв. АН. Сер. хим. 2018. № 8. С. 1401;
Zorumski C.F., Day G.S., Mennerick S.J. // J. Neurosci.
Sokolov V.B., Aksinenko A.Yu., Epishina T.A., Go-
2018. Vol. 38. N 13. P. 3218. doi 10.1523/
reva T.V. // Russ. Chem. Bull. 2018. Vol. 67. N 8.
JNEUROSCI.3377-17.2018
P. 1401. doi 10.1007/s11172-018-2231-3
New Modulators of NMDA-Receptors Based on Alkyne-Azide
Click-Reaction Between 2-Aminothiophene-3-Carboxylic Acid
Esters and N-Propargyl-Containing Pharmacophores
V. B. Sokolov,
A. Yu. Aksinenko*, T. V. Goreva, T. A. Epishina,
A. V. Gabrel’yan, and V. V. Grigoriev
Institute of Physiologically Active Compounds of the Russian Academy of Sciences,
Severnyi proyezd 1, Chernogolovka, 142432 Russia
*e-mail: alaks@ipac.ac.ru
Received July 1, 2019; revised July 1, 2019; accepted July , 2019
Copper-catalyzed alkyne-azide 1,3-dipolar cycloaddition of methyl esters of N-azidoacetyl-2-aminothiophene-
3-carboxylic acids to N-propargyl-containing pharmacophores, resulting in the corresponding conjugates
combined by 1,2,3-triazole-containing alkylene, was studied. The method of radioligand binding shows a strong
modulating effect of the synthesized compounds on neuronal NMDA receptors.
Keywords: alkynes, azides, 1,4-substituted 1,2,3-triazoles, 1,3-dipolar cycloaddition, conjugates, NMDA
receptors, radioligand binding
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 1 2020