ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2020, том 90, № 1, с. 63-71
УДК 547.814.1; 547.815.1
СИНТЕЗ НОВЫХ 4,4а-ДИГИДРОКСАНТОНОВ С
ПОМОЩЬЮ РЕАКЦИИ [4+2]-ЦИКЛОПРИСОЕДИНЕНИЯ
© 2020 г. Н. М. Черновa,*, Т. В. Морозa, Р. В. Шутовa, Н. Н. Кузьмичb,c, А. Е. Щеголевa,
М. В. Соповаa, И. П. Яковлевa
a Санкт-Петербургский государственный химико-фармацевтический университет,
ул. Профессора Попова 14/А, Санкт-Петербург, 197376 Россия
b Первый Московский государственный медицинский университет имени И. М. Сеченова, Москва, 119146 Россия
c Научно-исследовательский институт гриппа имени А. А. Смородинцева, Санкт-Петербург, 197376 Россия
*e-mail: nikita.chernov@pharminnotech.com
Поступило в Редакцию 5 сентября 2019 г.
После доработки 5 сентября 2019 г.
Принято к печати 12 сентября 2019 г.
Исследовано влияние электронной природы заместителей в молекулах реагентов на ход реакции
[4+2]-циклоприсоединения хромонсодержащих диенов и N-винилпирролидинов (диенофилы). Выяснены
условия, определяющие образование 4,4а-дигидроксантонов либо бензофенонов в качестве основных
продуктов. Приведена квантовохимическая интерпретация ароматизации 4,4а-дигидроксантонов с
раскрытием пиронового цикла. В ходе работы получен широкий ряд новых 4,4а-дигидроксантонов и
бензофенонов.
Ключевые слова: [4+2]-циклоприсоединение, 3-винилхромоны, енамины, 4,4а-дигидроксантоны,
бензофенон
DOI: 10.31857/S0044460X20010084
Производные ксантонов составляют обширный
матизации. Так, [4+2]-циклоприсоединение элек-
класс соединений природного и синтетического
тронодефицитного 3-винилхромона 1 к енаминам
происхождения. Природные полифункциональ-
3 (схема 1), теоретически протекающее через об-
ные ксантоны являются вторичными метаболи-
разование
4,4а-дигидроксантонов, приводило к
тами растений, грибов и бактерий [1-3]. Методы
бензофенонам 4 и только в одном случае, к 3,4-ди-
получения и свойства их частично гидрированных
гидроксантону 5 [12]. Использование хромонила-
производных изучены недостаточно, несмотря на
криловых кислот 2 вместо их эфиров 1 позволило
то, что среди известных природных тетра- и ди-
нам выделить целевые 4,4а-дигидроксантоны 6
гидроксантонов обнаружено большое количество
[11], однако границы применения данного подхода
биологически активных веществ [4]. Особенно ин-
были изучены недостаточно.
тересны в данном аспекте 4,4а-дигидроксантоны,
Целью настоящей работы явилось развитие ме-
некоторые представители которых обладают ярко
тода получения 4,4а-дигидроксантонов с помощью
выраженной противоопухолевой активностью (на-
реакции [4+2]-циклоприсоединения и определе-
пример, нидулалин A [5] и его производные [6]).
ние влияния электронной природы заместителей
Ранние подходы к получению данных струк-
в диене 2 и енамине 3 на границы ее применения.
тур заключались в окислительной циклизации
бензофенонов [7, 8], однако современной тенден-
На первом этапе исследовалось взаимодействие
цией является использование реакций [4+2]-ци-
6,7,8-замещенных хромонилакриловых кислот
клоприсоединения [9-11]. Необходимо отметить
2a-м с енамином 3a (схема 2, табл. 1). Реакцию
и трудности в получении 4,4а-дигидроксантонов,
проводили в дихлорметане при 20°C с последу-
которые связаны с их высокой склонностью к аро-
ющим подкислением реакционной массы. В ре-
63
64
ЧЕРНОВ и др.
Схема 1.
O
CO2Et
EWG = CO2Et
O
R3 = H
R4
EWG
OH
R1
4
R2
O
O
CO2Et
1, 2
EWG = CO2Et
+
R1 = H
R2 = R3 = CH3
O
5
H3C CH3
O
N
R4
CO2H
R3
EWG = CO2H
R1
R1 = H
R2
O
3
R2 = R3 = CH
3
H3C CH3
6
1, EWG = CO2Et; 2, EWG = CO2H; 6, R4 = H, CH3, CH3O, Cl, Br.
зультате был получен ряд 4,4-диметил-4,4а-диги-
нений представлены в табл. 2, спектральные ха-
дроксантонов 6a-м, состав и строение которых
рактеристики - в табл. 3.
доказано методами масс-спектрометрии и спек-
Так, в спектрах ЯМР 1H соединений 6a-м при-
троскопии ЯМР 1H и 13C. Температуры плавления
сутствуют характерные сигналы протонов ци-
и данные масс-спектрометрии полученных соеди-
клогексадиеновой системы в области 5.21-5.56
Таблица 1. Параметры реакции хромонилакриловых кислот 2a-м с енамином 3a в дихлорметане при 20°C
Диен
R1
R2
R3
Время реакции, ч
Выход 6a-м, %
2a
NO2
H
H
2а
45
2б
F
H
H
12
78
2в
H
CH3
H
36
65
2г
CH3
CH3
H
48
58
2д
F
F
H
12
73
2е
Br
CH3O
H
72
55
2ж
CH3
H
Br
24
71
2з
Cl
H
Br
1
78
2и
Br
H
Br
1
70
2к
CH3
H
NO2
2
62
2л
CH3
CH3
Br
36
80
2м
Br
CH3O
Br
48
60
а При 0°C; при 20°С реакция сопровождалась сильным осмолением.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 1 2020
СИНТЕЗ НОВЫХ 4,4а-ДИГИДРОКСАНТОНОВ
65
Таблица 2. Температуры плавления и данные масс-спектрометрии для соединений 6-8
m/z [M - H]-
m/z [M - H]-
№
Т. пл., °С
Формула
№
Т. пл., °С
Формула
найдено
вычислено
найдено
вычислено
6a
244-246
C16H13NO6
314.0656
314.0670
6л
325-326
C18H17BrO4
375.0234
375.0237
6б
196-198
C16H13FO4
287.0731
287.0725
6м
310-312
C17H14Br2O5
454.9128
454.9135
6в
224-226
C17H16O4
283.0967
283.0975
7б
200-202
C18H17ClO4
331.0756
331.0743
6г
218-220
C18H18O4
297.1129
297.1132
7в
211-213
C19H17ClO4
343.0747
343.0743
6д
221-223
C16H12F2O4
305.0633
305.0631
8г
209-210
C14H9ClO4
275.0111
275.0117
6е
294-296
C17H15BrO5
377.0031
377.0030
8д
238-240
C15H11ClO4
289.0259
289.0273
6ж
270-271
C17H15BrO4
361.0079
361.0081
8е
229-231
C16H13ClO4
303.0433
303.0430
6з
290-292
C16H12BrClO4
380.9547
380.9535
8ж
205-207
C20H13ClO4
351.0438
351.0430
6и
315-317
C16H12Br2O4
424.9021
424.9029
8з
335 (разл.)
C29H18Cl2O8
563.0297
563.0306
6к
268-270
C17H15NO6
328.0826
328.0827
8и
212-214
C15H11ClO4
289.0266
289.0273
(д. д, J = 1.5, 3.0 Гц, 4a-H), 7.00-7.13 (псевдо-т, J =
присоединение с участием диенов 2б, д, з, и за-
1.5 Гц, 3-H) и 7.31-7.38 м. д. (д. д, J = 1.5, 3.0, 1-H),
вершалось за 1-12 ч, приводя к соответствующим
а также синглеты аксиальной и экваториальной
4,4а-дигидроксантонам с выходами 73-78%.
метильных групп при 1.42-1.49 и 1.03-1.09 м. д.
Важно отметить, что ни в одном из опытов не
соответственно.
наблюдалась изомеризация соединений 6a-м в
Как следует из данных табл. 1, электронная
3,4-дигидроксантоны, характерная для 4,4а-диги-
природа заместителей в ароматической систе-
дропроизводных со сложноэфирной группой [12].
ме диенов 2a-м заметно влияет на ход реакции.
Ранее мы предположили, что это может быть связа-
Электроноакцепторные заместители ускоряют
но с каталитической ролью пирролидина, который
процесс, а электронодонорные группы замедля-
выделяется в ходе реакции [11]. Карбоксильная
ют его. Особенно ярко это проявляется в случае
группа в 4,4а-дигидроксантонах 6a-м, вероятно,
нитрозамещенного диена 2а, реакция с которым
связывает амин и, таким образом, предотвращает
при 20°C сопровождалась сильным осмолением.
изомеризацию в 3,4-дигидроксантоны.
Целевой 4,4а-дигидроксантон 6а удалось полу-
Вторым этапом работы стало изучение взаимо-
чить лишь при 0°C, хотя и в этом случае его вы-
действия хлорзамещенного диена 2н с енамина-
ход (45%) был заметно ниже выходов остальных
ми 3б-и с целью получения 4-монозамещенных
соединений 6b-м. Введение сильного электроно-
4,4а-дигидроксантонов (схема 3, табл. 4). Однако
донора (метоксихромон 2е) значительно замедля-
4,4а-дигидроксантоны были получены лишь в ре-
ет реакцию. Наиболее гладко реакция протекала в
акциях с 2,2-дизамещенными енаминами 3б, в. В
случае галогензамещенных производных: цикло-
остальных случаях были выделены бензофеноны
Схема 2.
O
O
1
R1
CO2H
R1
2
CO2H
N
(1) CH2Cl2, 20°C
+
4a
H3C
(2) 2 M. HCl
4
3
R2
O
R2
O
R3
H3C CH3
CH3
R3
ɚ-ɦ
ɚ
ɚ-ɦ
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 1 2020
66
ЧЕРНОВ и др.
Таблица 3. Данные спектроскопии ЯМР 1H и 13C (ДМСО-d6) для соединений 6-8
№
δ, м. д. (J, Гц)
δС, м. д.
6a
1.08 c (3H, CH3), 1.48 c (3H, CH3), 5.56 д. д (1H, J = 1.5,
17.44, 25.65, 38.82, 83.48, 120.47, 120.62,
3.0, H4a), 7.13 псевдо-т (1H, J = 1.5, H3), 7.33 д (1H, J = 9.0,
123.21,
126.37,
128.47,
128.71,
131.04,
H5), 7.38 д. д (1H, J = 1.5, 3.0, H1), 8.40 д. д (1H, J = 2.8,
142.18, 153.34, 164.61, 165.64, 178.00
9.0, H6), 8.54 д (1H, J = 2.8, H8), 13.09 уш. с (1H, COOH)
6б
1.04 c (3H, CH3), 1.44 c (3H, CH3), 5.28 д. д (1H, J = 1.5,
17.53, 25.80, 38.64, 82.06, 111.97 д (JCF =
3.0, H4a), 7.08 псевдо-т (1H, J 1.5, H3), 7.15 м (1H, Ar),
22.9), 120.95 д (JCF = 7.4), 122.01 д (JCF =
7.32 д. д (1H, J = 1.5, 3.0, H1), 7.47 м (2H, Ar), 13.11 уш. с
6.1), 124.36 д (JCF = 24.2), 126.32, 127.52,
(1H, COOH)
129.79, 153.05, 156.84, 157.3 д (JCF = 240.3),
165.81, 178.75
6в
1.03 c (3H, CH3), 1.43 c (3H, CH3), 2.33 c (3H, CH3), 5.27 д.
17.45, 21.83, 25.82, 38.64, 81.94, 118.58,
д (1H, J = 1.5, 3.0, H4a), 6.91 с (1H, H5), 6.93 д (1H, J = 8.3,
119.16,
123.78,
126.35,
126.51,
127.26,
H7), 7.05 псевдо-т (1H, J = 1.5, H3), 7.28 д. д (1H, J = 1.5,
130.57, 148.22, 152.60, 160.47, 165.89, 178.91
3.0, H1), 7.70 д (1H, J = 8.3, H8), 12.98 уш. с (1H, COOH)
6г
1.03 c (3H, CH3), 1.43 c (3H, CH3), 2.20 с (3H, CH3), 2.25
17.53,
18.87,
20.38,
25.97,
38.57,
81.96,
c (3H, CH3), 5.21 д (1H, J = 2.5, H4a), 6.90 с (1H, H5), 7.00
119.05, 119.25, 126.93, 127.08, 127.26, 130.55,
c (1H, H3), 7.31 д (1H, J = 2.5, H1), 7.56 c (1H, H8), 12.93
130.87, 147.25, 151.70, 158.81, 166.37, 179.00
уш. с (1H, COOH)
6д
1.06 c (3H, CH3), 1.44 c (3H, CH3), 5.28 д. д (1H, J = 1.5,
17.49, 25.85, 38.64, 82.89, 107.75 д (JCF =
3.0, H4a), 7.03 пс. т (1H, J = 1.5, H3), 7.08 д. д (1H, JHF =
20.2), 114.69 д (JCF = 18.2), 118.08, 126.45,
6.5, 11.3, H5), 7.36 д. д (1H, J = 1.5, 3.0, H1), 7.68 псевдо-т
127.92, 129.06, 145.95 д. д (JCF = 13.5, 243.7),
(1H, JHF = 9.6, H8), 12.90 уш. с (1H, COOH)
152.51, 155.02 д. д (JCF = 14.8, 257.2), 157.50
д (JCF = 11.4), 165.66, 177.56
6е
1.05 c (3H, CH3), 1.46 c (3H, CH3), 3.94 c (3H, CH3O), 5.34
17.47, 25.78, 38.70, 57.65, 82.74, 102.09,
д. д (1H, J = 1.5, 3.0, H4a), 6.78 с (1H, H5), 7.06 псевдо-т
105.16, 115.86, 126.35, 126.72, 129.75, 130.93,
(1H, J = 1.5, H3), 7.28 д. д (1H, J = 1.5, 3.0, H1), 7.90 c (1H,
152.51, 161.81, 161.85, 165.85, 177.01
H8), 13.05 уш. с (1H, COOH)
6ж
1.06 c (3H, CH3), 1.48 c (3H, CH3), 2.28 c (3H, CH3), 5.33 c
17.65, 20.14, 25.80, 38.75, 82.44, 111.50,
(1H, H4a), 7.09 c (1H, H3), 7.30 c (1H, H1), 7.59 c (1H, H6),
122.18, 126.39, 126.65, 127.46, 129.60, 132.90,
7.74 с (1H, H8), 13.09 уш. с (1H, COOH)
140.09, 152.73, 154.44, 165.80, 178.85
6з
1.09 c (3H, CH3), 1.50 c (3H, CH3), 5.36 д. д (1H, J = 1.5,
17.69, 25.88, 38.79, 83.02, 113.18, 122.98,
3.0, H4a), 7.07 псевдо-т (1H, J = 1.5, H3), 7.38 д. д (1H, J
125.92, 126.55, 126.81, 128.53, 128.63, 138.14,
= 1.5, 3.0, H1), 7.74 д (1H, J =2.5, H6), 7.78 д (1H, J = 2.5,
152.74, 155.40, 165.60, 177.78
H8), 12.88 уш. с (1H, COOH)
6и
1.07 c (3H, CH3), 1.49 c (3H, CH3), 5.46 д (1H, J = 1.5, H4a),
17.69, 25.74, 38.83, 83.01, 113.54, 114.00,
7.12 c (1H, H3), 7.34 д (1H, J = 1.5, H1), 7.86 д (1H, J = 1.5,
123.45, 126.39, 126.29, 128.77, 128.91, 140.87,
H6), 8.15 д (1H, J = 1.5, H8), 13.16 уш. с (1H, COOH)
153.10, 155.83, 165.70, 177.80
6к
1.07 c (3H, CH3), 1.42 c (3H, CH3), 2.36 c (3H, CH3), 5.46
17.68, 20.04, 25.61, 38.78, 83.40, 123.15,
д. д (1H, J = 1.5, 3.0, H4a), 7.11 псевдо-т (1H, J = 1.5, H3),
126.35, 128.11, 129.11, 131.60, 132.11, 132.58,
7.34 д. д (1H, J = 1.5, 3.0, H1), 7.93 д (1H, J = 1.5, H6), 8.10
139.26, 151.20, 153.06, 165.69, 177.94
д (1H, J = 1.5, H8), 13.16 уш. с (1H, COOH)
1.05 c (3H, CH3), 1.49 c (3H, CH3), 2.28 с (3H, CH3), 2.35 c
17.67,
20.51,
20.66,
25.84,
38.76,
82.53,
6л
(3H, CH3), 5.25 д (1H, J = 1.5, H4a), 7.08 с (1H, H3), 7.27 д
114.56, 119.76, 126.23, 126.39, 126.98, 129.66,
(1H, J = 1.5, H1), 7.54 c (1H, H8), 12.11 уш. с (1H, COOH)
131.74, 145.80, 152.52, 154.79, 165.83, 178.57
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 1 2020
СИНТЕЗ НОВЫХ 4,4а-ДИГИДРОКСАНТОНОВ
67
Таблица 3. (Продолжение)
№
δ, м. д. (J, Гц)
δС, м. д.
6м
1.07 c (3H, CH3), 1.49 c (3H, CH3), 3.87 c (3H, CH3O), 5.44
17.10, 25.75, 38.84, 61.11, 83.42, 108.59,
д. д (1H, J = 1.5, 3.0, H4a), 7.11 псевдо-т (1H, J = 1.5, H3),
110.39, 119.71, 126.39, 128.03, 128.67, 130.15,
7.32 д. д (1H, J = 1.5, 3.0, H1), 7.96 c (1H, H8), 13.13 уш. с
152.87, 157.48, 159.86, 165.71, 177.24
(1H, COOH)
7б
0.78 т (3H, J = 7.5, CH3), 0.96 т (3H, J = 7.5, CH3), 1.41 м
9.63, 10.43, 26.02, 29.28, 45.15, 78.54, 121.14,
(1H, CH2), 1.74-1.88 м (3H, CH2), 5.66 д. д (1H, J = 1.5, 3.0,
122.36, 126.18, 126.48, 127.36, 128.27, 130.19,
H4a), 7.01 псевдо-т (1H, J = 1.5, H3), 7.13 д (1H, J = 9.0,
136.39, 150.22, 159.18, 165.64, 178.47
H5), 7.29 д. д (1H, J = 1.5, 3.0, H1), 7.62 д. д (1H, J = 2.8,
9.0, H6), 7.74 д (1H, J = 2.8, H8), 13.14 уш. с (1H, COOH)
7в
1.16 м (2H, CH2), 1.50 м (1H, CH2), 1.59-1.75 м (6H, CH2),
21.15, 22.22, 25.84, 27.22, 31.77, 40.43, 81.98,
1.99 м (1H, CH2), 5.22 м (1H, H4a), 7.15 д (1H, J = 9.0, H5),
121.11, 122.23, 126.09, 126.51, 127.31, 127.66,
7.34 д. д (1H, J = 1.5, 3.0, H1), 7.46 м (1H, H3), 7.62 д. д
129.64, 136.45, 146.31, 159.10, 165.73, 178.41
(1H, J = 2.8, 9.0, H6), 7.72 д (1H, J = 2.8, H8), 13.18 уш. с
(1H, COOH)
8г
7.01 д (1H, J = 8.8, H3’), 7.39 д (1H, J = 2.5, H6’), 7.47 д. д
118.76, 123.27, 127.58, 129.38, 129.65, 130.55,
(1H, J = 2.5, 8.8, H4’), 7.67 псевдо-т (1H, J = 7.8, H5), 7.99
131.54, 132.75, 133.70, 134.15, 137.65, 155.04,
д (1H, J = 7.8, H6), 8.20 д (1H, J = 7.8, H4), 8.23 с (1H, H2),
167.07, 194.84
10.43 c (1H, OH), 13.34 уш. с (1H, COOH)
8д
2.43 c (3H, CH3), 7.01 д (1H, J = 8.8, H3’), 7.36 д (1H, J =
21.10, 118.81, 123.24, 127.70,
2.8, H6’), 7.46 д. д (1H, J = 2.8, 8.8, H4’), 7.80 с (1H, H6),
128.10,
129.30,
131.54,
132.67,
133.79,
8.02 c (2H, H2, H4), 10.40 c (1H, OH), 13.22 уш. с (1H,
134.64, 137.77, 139.22, 155.11, 167.13, 195.01
COOH)
8е
1.21 т (3H, J = 7.5, CH3), 2.74 к (2H, J = 7.5, CH2), 7.01 д
15.78, 28.16, 118.81, 123.27, 127.62, 128.50,
(1H, J = 8.5, H3’), 7.36 д (1H, J = 2.5, H6’), 7.46 д. д (1H, J
129.38,
131.65,
132.65,
132.72,
133.49,
= 2.5, 8.5, H4’), 7.84 с (1H, H6), 8.03 м (2H, H2, H4), 10.40
137.80, 145.34, 155.15, 167.15, 194.99
c (1H, OH), 13.18 уш. с (1H, COOH)
8ж
7.03 д (1H, J = 8.8, H3’), 7.43-7.54 м (5H, H4’, H6’, Ph), 7.72
118.93, 123.41, 127.38, 128.84, 129.48, 129.66,
д (2H, J = 7.3, Ph), 8.19 с (1H, H6), 8.21 c (1H, H4), 8.40 c
129.73, 131.49, 131.97, 132.44, 133.05, 138.51,
(1H, H2), 10.47 c (1H, OH), 13.41 уш. с (1H, COOH)
138.87, 141.48, 155.26,166.96, 194.68
8з
4.32 c (1H, CH2), 7.02 д (1H, J = 8.8, H3’), 7.36 д (1H, J =
42.37, 118.74, 123.33, 127.76,
2.8, H6’), 7.46 д. д (1H, J = 2.8, 8.8, H4’), 7.99 с (1H, H6),
128.01, 129.34, 131.55, 132.59, 133.72, 134.60,
8.04 c (1H, H4), 8.12 c (1H, H2), 10.43 c (1H, OH), 13.28 уш.
137.81, 139.23, 155.05, 166.92, 195.19
с (1H, COOH)
8и
2.62 c (3H, CH3), 7.00 д (1H, J = 8.8, H3’), 7.32 д (1H, J =
21.98, 118.82, 123.27, 127.47, 129.33, 131.04,
2.5, H6’), 7.44 м (2H, H5, H4’), 7.79 д. д (1H, J = 1.4, 7.9,
131.87, 132.37, 132.49, 132.60, 135.17, 145.27,
H4), 8.17 д (1H, J = 1.4, H2), 10.35 c (1H, OH), 13.04 уш. с
155.23, 168.30, 194.55
(1H, COOH)
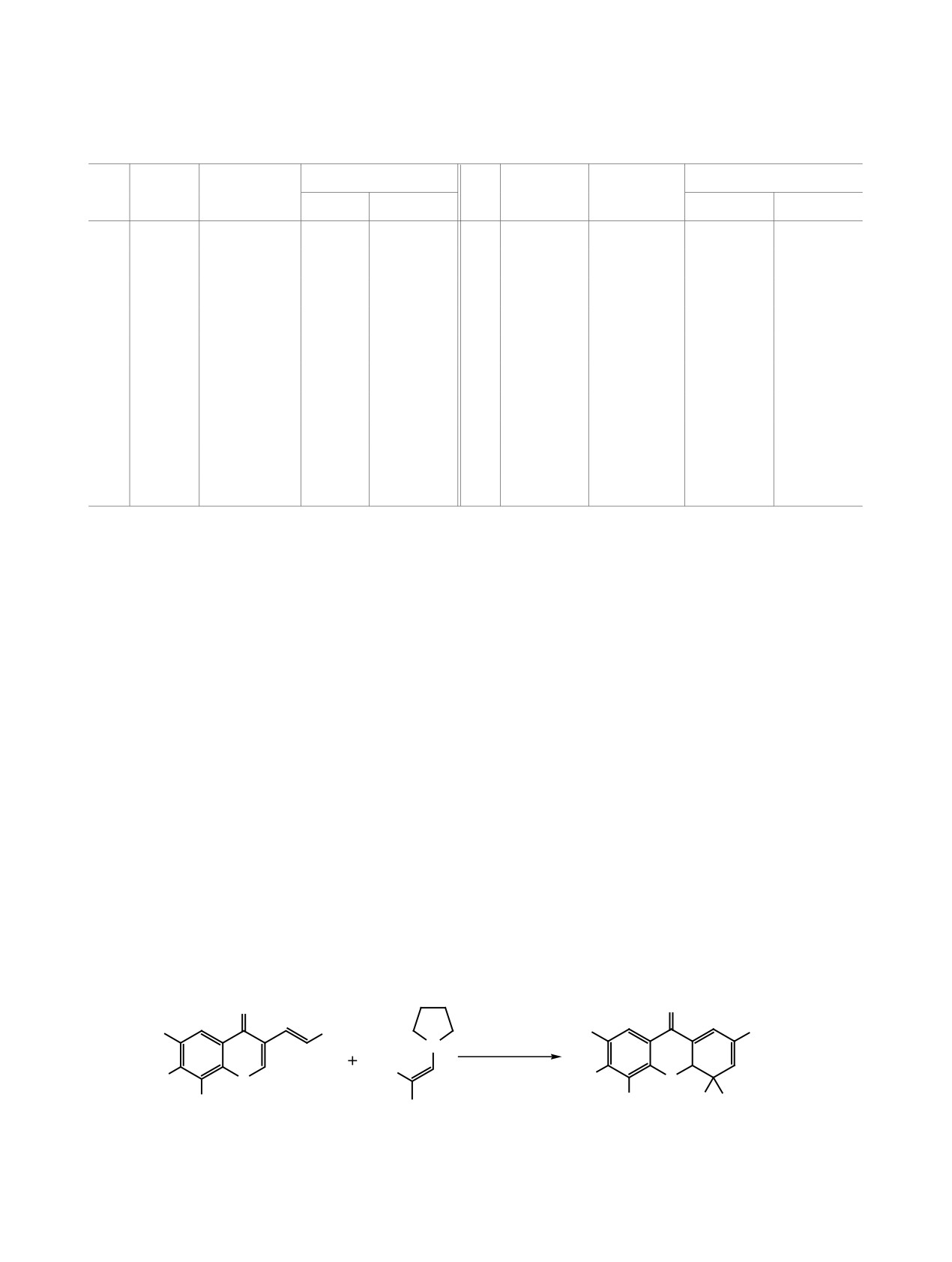
8г-и с умеренными выходами (38-68%), причем
присутствие уширенного синглета протона фе-
в качестве енаминов были использованы произ-
нольной ОН-группы в области 10.35-10.47 м. д. в
водные алифатических альдегидов (3г-ж), аце-
спектрах ЯМР 1H соединений 8г-и, а также сигнал
тона 3з и глутарового альдегида 3и (схема 4). Об
карбонильного атома углерода в области 194.55-
ароматизации и раскрытии цикла свидетельствует
195.19 м. д. в спектрах ЯМР 13С.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 1 2020
68
ЧЕРНОВ и др.
Таблица 4. Параметры реакции диена 2н с енаминами 3б-з в дихлорметане при 20°C
Енамин
R1
R2
R3
Время реакции, ч
Продукт (выход, %)
3б
H
C2H5
C2H5
4
7б (59)
3в
H
(CH2)5
1
7в (82)
3г
H
H
H
1
8г (67)
3д
H
CH3
H
1
8д (64)
3е
H
C2H5
H
1
8е (63)
3ж
H
Ph
H
2
8ж (56)
3з
CH3
H
H
2
8з (68)
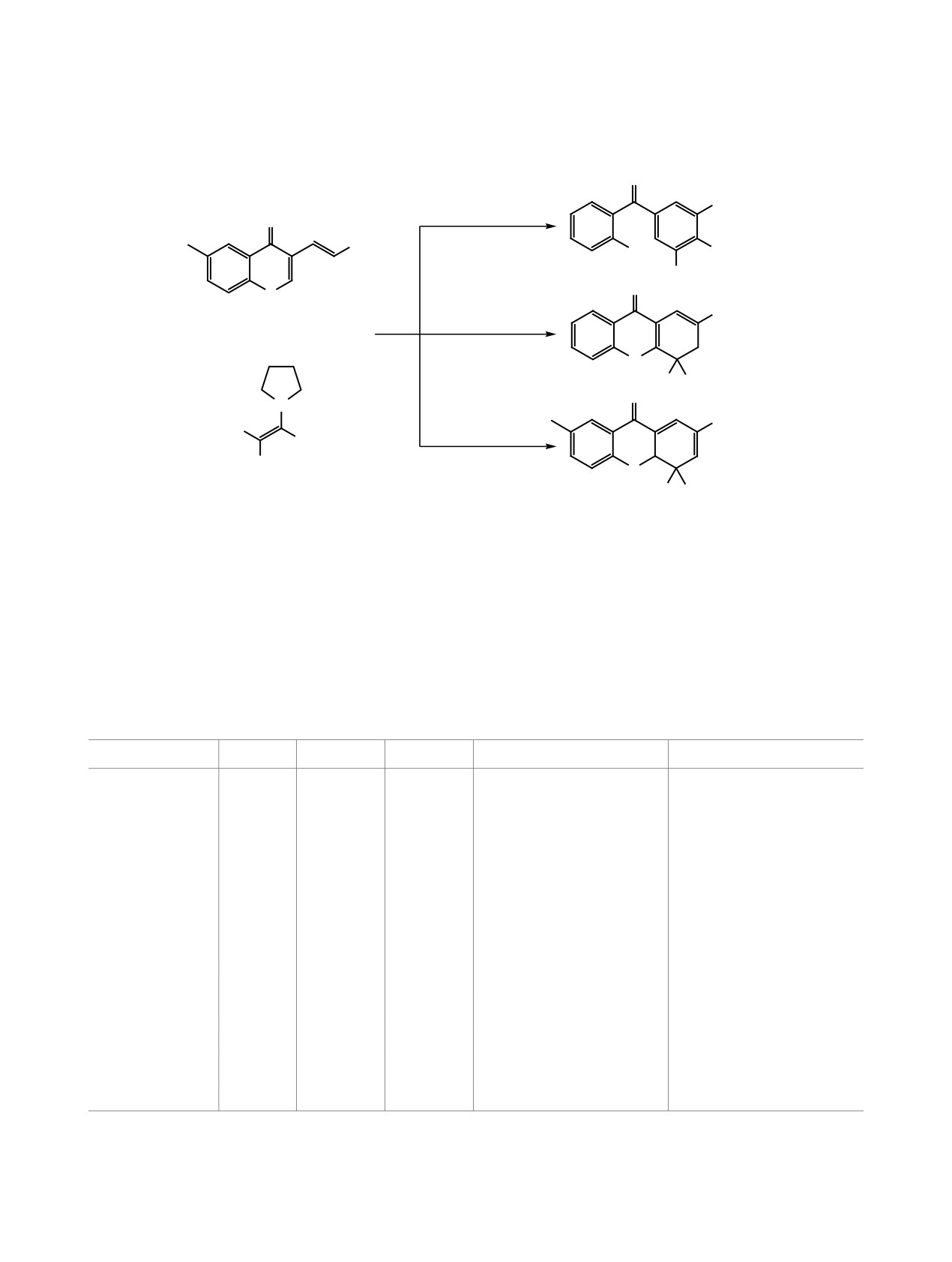
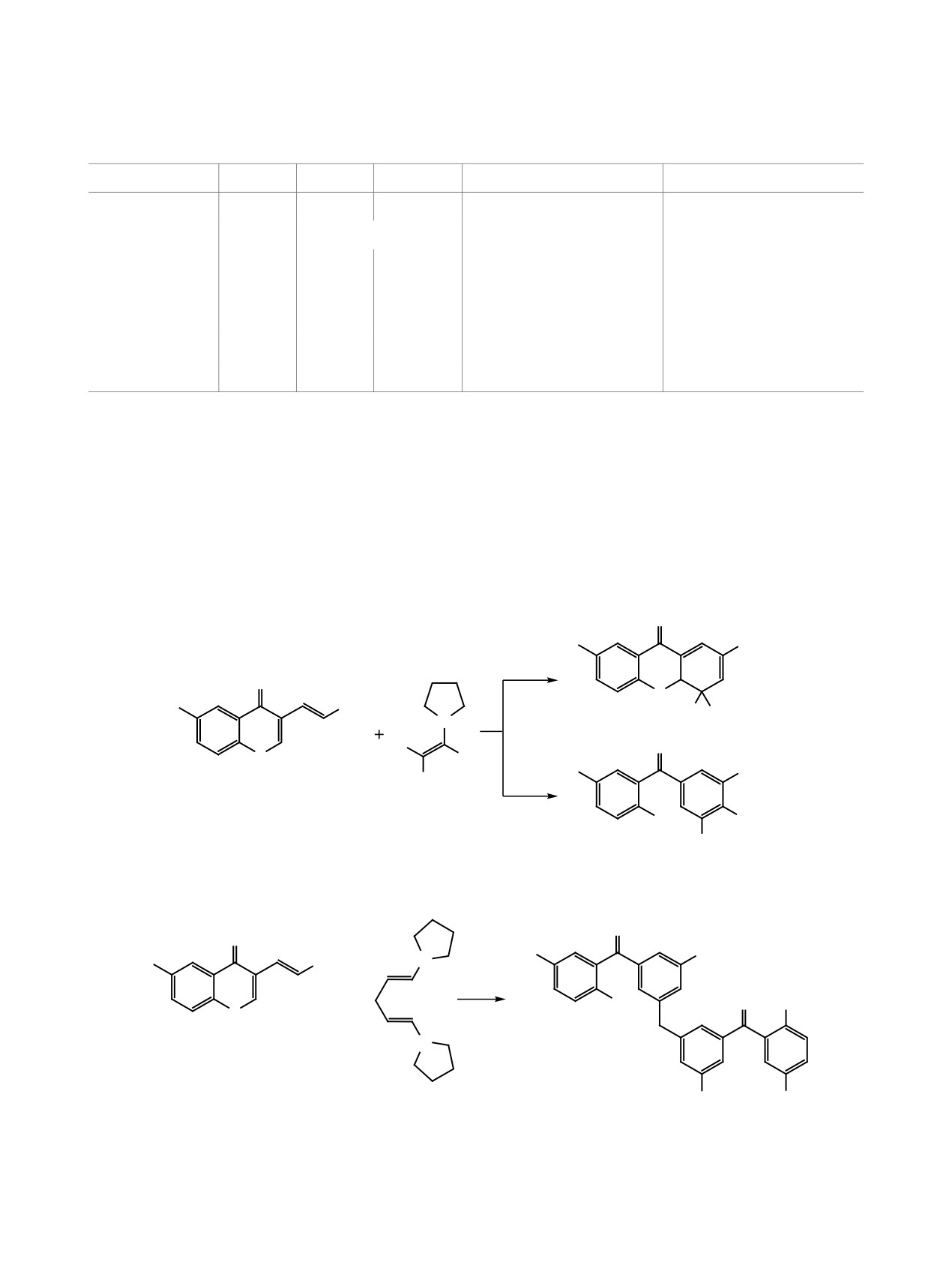
Неустойчивость 4-незамещенного или 4-мо-
на близость условий реакции (апротонная среда,
нозамещенных 4,4а-дигидроксантонов в наших
вторичный амин в качестве катализатора), авторы
исследованиях тем более удивительна, поскольку
работы [10] не наблюдали образования бензофенонов.
известно о получении соединений аналогичной
Данный факт позволил нам предположить
структуры (например, соединение 9), но не содер-
путь ароматизации 4,4а-дигидроксантонов 7з и 9
жащих электроноакцепторную группу (EWG) в
(схема 5), а также обосновать его с помощью кван-
положении 2 ксантоновой системы [10]. Несмотря
товохимических расчетов, выполненных в про-
Схема 3.
O
Cl
CO2H
O
O
Cl
CO2H
R3 R2
N
ɛ, ɜ
+
3
R
2
O
O
1
R1
2
Cl
1'
3
1
CO2H
R2
ɧ
ɛ-ɡ
4'
2'
OH
R1
3'
R2
ɝ-ɡ
Схема 4.
O
O
Cl
CO2H
N
Cl
CO2H
+
OH
O OH
O
ɦ
N
CO2H
Cl
ɢ
ɢ (38%)
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 1 2020
СИНТЕЗ НОВЫХ 4,4а-ДИГИДРОКСАНТОНОВ
69
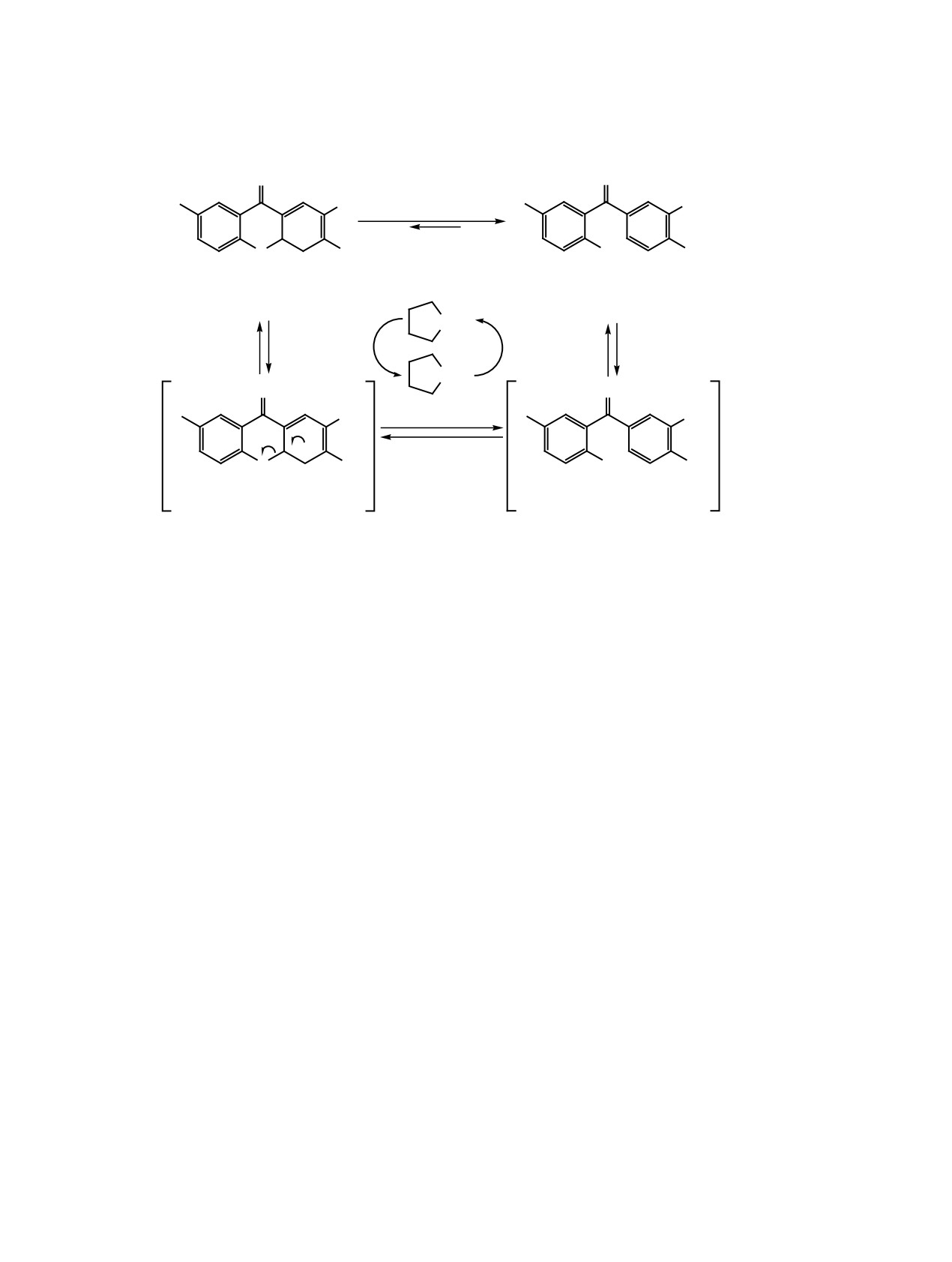
Схема 5.
O
O
Cl
X
Cl
X
O
CH3
OH
CH3
ɡ (X = CO2+
;
+
ɡ
NH
+
NH2
O
O
Cl
X
Cl
X
–
-
O
CH3
O
CH3
ɡ
ɡ
(ǻGz
ɤȾɠ ɦɨɥɶ ǻG° -
ɤȾɠ ɦɨɥɶ
(ǻGz
ɤȾɠ ɦɨɥɶ ǻG° -
ɤȾɠ ɦɨɥɶ
грамме Gaussian 16 [13] на уровне теории M06-
матической системе хромонов. Строение про-
2X/6-31+G(d,p). Вероятно, реакция катализирует-
дуктов реакции определяется выбором енаминов
ся амином и начинается с депротонирования поло-
3a-и; 4,4а-дигидроксантоны 6a-м и 7б, в образу-
жения 4 цикла. Важно заметить, что вычисленная
ются лишь из 2,2-дизамещенных енаминов 3a-в.
разница свободных энергий образования (ΔΔG°)
Реакция с енаминами 3г-и, содержащими нераз-
солей 7з' и 9' составила 62.00 кДж/моль, что го-
ветвленный алкенильный заместитель, по-види-
ворит о большей стабильности аниона 7з' за счет
мому, также протекает с образованием 4,4а-диги-
электроноакцепторного влияния карбоксильной
дроксантонов, которые в условиях реакции изоме-
группы.
ризуются в бензофеноны 8г-и. Проведенные кван-
Последующая ароматизация анионов 7з' и 9
товохимические расчеты позволяют предполагать,
сопровождается раскрытием пиранового цикла
что склонность 4-монозамещенных или 4-незаме-
и образованием солей 8з' и 10' соответственно.
щенных 4,4а-дигидроксантонов к ароматизации
Рассчитанные энергетические барьеры данного
связана с кислотностью протона в положении 4
процесса (ΔG≠) оказались довольно малы (22.18 и
ксантонового фрагмента, которая возрастает с
9.37 кДж/моль для соединений 8з' и 10' соответ-
введением электроотрицательной карбоксильной
ственно), что говорит о легкости протекания этой
группы в положение 2.
стадии. Бoльшее значение ΔG≠ для карбоксипро-
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
изводного 8з' также косвенно указывает на повы-
шенную стабильность аниона 7з' по сравнению с
Спектры ЯМР 1H и 13C ( ДМСО-d6) зарегистри-
анионом 9 и, как следствие, бóльшую склонность
рованы на спектрометре Bruker Avance III (400 и
2-карбокси-4,4а-дигидроксантона 7з к ароматизации.
100 МГц соответственно) с использованием оста-
Таким образом, проведенное нами исследова-
точного сигнала дейтерированного растворителя
ние реакции [4+2]-циклоприсоединения хромони-
в качестве внутреннего стандарта. Масс-спектры
лакриловых кислот 2a-н с N-винилпирролидинами
высокого разрешения (HRMS) с ионизацией элек-
3a-и показало, что на скорость реакции заметно
троспреем (ESI) записаны на спектрометре Bruker
влияет электронная природа заместителей в аро-
micrOTOF. Тонкослойную хроматографию для
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 1 2020
70
ЧЕРНОВ и др.
доказательства индивидуальности соединения и
СПИСОК ЛИТЕРАТУРЫ
полноты прохождения реакции выполняли на пла-
1. Ruan J., Zheng C., Liu Y., Qu L., Yu H., Han L., Zhang Y.,
стинах Silica gel 60 F254 (Merck), элюент - эти-
Wang T. // Molecules. 2017. Vol. 22. P. 1698. doi
лацетат-этанол (50 : 50), проявление в УФ свете.
10.3390/molecules22101698
Температуры плавления определяли капиллярным
2. Hakim E.H., Achmad S.A., Juliawaty L.D., Makmur L.,
методом и не корректировали.
Syah Y.M., Aimi N., Kitajima M., Takayama H.,
Хромонилакриловые кислоты 2а-н синтези-
Chisalberti E.L. // J. Nat. Med. 2006. Vol. 60. P. 161.
ровали реакцией Кнёвенагеля из соответствую-
doi 10.1007/sl l418-006-0048-0
щих 3-формилхромонов [14, 15]. Енамины 3a-и
3. Blunt J.W., Copp B.R., Keyzers R.A., Munro M.H.G.,
получали по известной методике или in situ [15].
Prinsep M.R. // Nat. Prod. Rep. 2014. Vol. 31. P. 160.
Растворители очищали и сушили обычными мето-
doi 10.1039/c3np70117d
дами.
4. Masters K.-S., Bräse S. // Chem. Rev. 2012. Vol. 112.
Общая методика получения 4,4а-дигидрок-
P. 3717. doi 10.1021/cr100446h
сантонов 6a-м, 7б, в и бензофенонов 8г-и. Смесь
5. Sato S., Nakagawa R., Fudo R., Fukuda Y., Yoshimura T.,
диена 2 (4 ммоль) и енамина 3 (6 ммоль) в 10 мл
Kaida K., Ando T., Kameyama T., Tsuji T. // J. Antibiot.
1997. Vol. 50. P. 614. doi 10.7164/antibiotics.50.614
дихлорметана перемешивали при 20°С до исчез-
6. Sato S., Suga Y., Yoshimura T., Nakagawa R., Tsuji T.,
новения исходного диена по данным ТСХ. Далее
Umemura K., Andoh T. // Bioorg. Med. Chem.
к реакционной массе прибавляли 10 мл 2 М. со-
Lett. 1999. Vol. 9. P. 2653. doi 10.1016/S0960-
ляной кислоты, образовавшуюся эмульсию ин-
894X(99)00440-0
тенсивно перемешивали в течение 30 мин, осадок
7. Franck B. // Angew. Chem. 1969. Vol. 81. P. 269. doi
отфильтровывали, промывали дихлорметаном и
10.1002/ange.19690810802
сушили. При необходимости продукт может быть
8. Tatsuta K., Yoshihara S., Hattori N., Yoshida S.,
перекристаллизован из этанола.
Hosokawa S. // J. Antibiot. 2009. Vol. 62. P. 469. doi
Температуры плавления и данные масс-спек-
10.1038/ja.2009.52
трометрии полученных соединений представлены
9. Sosnovskikh V.Y., Korotaev V.Y., Barbov A.Y., Kutya-
в табл. 2, спектральные характеристики - в табл. 3.
shev I.B., Safrygin A.V. // Eur. J. Org. Chem. 2015.
Квантовохимические расчеты геометрии и
Vol. 2015. P. 1932. doi 10.1002/ejoc.201403585
свободной энергии выполнены в программе
10. Albrecht A., Bojanowski J. // Adv. Synth. Catal. 2017.
Gaussian 16 B.01 [13] с использованием гибридно-
Vol. 359. P. 2907. doi 10.1002/adsc.201700400
го функционала M06-2X [16] в базисе 6-31+G(d,p).
11. Chernov N.M., Shutov R.V., Sharoyko V.V., Kuz’mich N.N.,
Геометрия переходных состояний найдена с помо-
Belyakov A.V., Yakovlev I.P. // Eur. J. Org. Chem. 2017.
щью процедуры QST2. С целью подтверждения
Vol. 2017. P. 2836. doi 10.1002/ejoc.201700310
соответствия найденных стационарных точек ми-
12. Bodwell G.J., Hawco K.M., da Silva R.P. // Synlett.
нимумам и максимумам (для переходных состоя-
2003. P. 179. doi 10.1055/s-2003-36800
ний) энергии и внесения термических поправок к
13. Frisch M.J., Trucks G.W., Schlegel H.B., Scuseria G.E.,
Robb M.A., Cheeseman J.R., Scalmani G., Barone V.,
свободной энергии были рассчитаны частоты ну-
Petersson G.A., Nakatsuji H., Li X., Caricato M.,
левых колебаний.
Marenich A.V., Bloino J., Janesko B.G., Gomperts R.,
ФОНДОВАЯ ПОДДЕРЖКА
Mennucci B., Hratchian H.P., Ortiz J.V., Izmaylov A.F.,
Sonnenberg J.L., Williams-Young D., Ding F., Lipparini F.,
Работа выполнена при стипендиальной под-
Egidi F., Goings J., Peng B., Petrone A., Henderson T.,
держке Совета по грантам Президента Российской
Ranasinghe D., Zakrzewski V.G., Gao J., Rega N.,
Федерации (конкурс СП-2019).
Zheng G., Liang W., Hada M., Ehara M., Toyota K.,
Fukuda R., Hasegawa J., Ishida M., Nakajima T.,
КОНФЛИКТ ИНТЕРЕСОВ
Honda Y., Kitao O., Nakai H., Vreven T., Throssell K.,
Авторы заявляют об отсутствии конфликта
Montgomery J.A.Jr., Peralta J.E., Ogliaro F.,
интересов.
Bearpark M.J., Heyd J.J., Brothers E.N., Kudin K.N.,
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 1 2020
СИНТЕЗ НОВЫХ 4,4а-ДИГИДРОКСАНТОНОВ
71
Staroverov V.N., Keith T.A., Kobayashi R., Normand J.,
P. 34. doi 10.1021/jm00235a008
Raghavachari K., Rendell A.P., Burant J.C., Iyengar S.S.,
15. Chernov N.M., Shutov R.V., Barygin O.I., Dron M.Y.,
Tomasi J., Cossi M., Millam J.M., Klene M., Adamo C.,
Starova G.L., Kuz’mich N.N., Yakovlev I.P. // Eur. J.
Cammi R., Ochterski J.W., Martin R.L., Morokuma K.,
Org. Chem. 2018. Vol. 2018. P. 6304. doi 10.1002/
Farkas O., Foresman J.B., Fox D.J. GAUSSIAN 16,
ejoc.201801159
Revision B.01, Gaussian, Inc., Wallingford CT, 2016.
14. Nohara A., Kuriki H., Saijo T., Ukawa K., Murata T.,
16. Zhao Y., Truhlar D.G. // Theor. Chem. Acc. 2008.
Kanno M., Sanno Y. // J. Med. Chem. 1975. Vol. 18.
Vol. 120. P. 215. doi 10.1007/s00214-007-0310-x
Synthesis of New 4,4a-Dihydroxanthones
by [4+2]-Cycloaddition Reaction
N. M. Chernova,*, T. V. Moroza, R. V. Shutova, N. N. Kuz’michb, c, A. E. Shchegoleva,
M. V. Sopovaa, and I. P. Yakovleva
a St. Petersburg State Chemical Pharmaceutical University, ul. Professora Popova 14/A, St. Petersburg, 197376 Russia
b Institute of Biotechnology and Translational medicine,
I.M. Sechenov First Moscow State Medical University, Moscow, 119146 Russia
c A.A. Smorodintsev Research Institute of Influenza, St. Petersburg, 197376 Russia
*e-mail: nikita.chernov@pharminnotech.com
Received September 5, 2019; revised September 5, 2019; accepted September 12, 2019
The effect of the substituent nature in the reactants on the [4+2]-cycloaddition of chromone-containing dienes
with N-vinylpyrrolidines (dienophiles) has been studied, and factors responsible for the formation of 4,4a-dihy-
droxanthones or benzophenones as the major products have been determined. Quantum chemical interpretation
of the aromatization of 4,4a-dihydroxanthones with pyranone ring opening has been proposed. A number of
new 4,4a-dihydroxanthones and benzophenones have been obtained.
Keywords: [4+2]-cycloaddition, 3-vinylchromone, enamine, 4,4a-dihydroxanthone, benzophenone
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 1 2020