ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2020, том 90, № 1, с. 85-91
УДК 547.56.563.364
СИНТЕЗ И СВОЙСТВА
АМИНОМЕТОКСИПРОИЗВОДНЫХ
1-(п-ТОЛИЛОКСИ)-3-(ПРОПИЛСУЛЬФАНИЛ)ПРОПАНА
© 2020 г. Э. Г. Мамедбейлиа,*, И. А. Джафаровb, А. Д. Астановаb,
Л. М. Магеррамовас, Н. А. Джафаровас
а Институт нефтехимических процессов национальной академии наук Азербайджана,
пр. Ходжалы 30, Баку, AZ 1025 Азербайджан
b Азербайджанский педагогический университет, Баку, AZ 1000 Азербайджан
с Азербайджанский государственный университет нефти и промышленности, Баку, AZ 1010 Азербайджан
*e-mail: eldar_mamedbeyli@mail.ru
Поступило в Редакцию 25 июня 2019 г.
После доработки 25 июня 2019 г.
Принято к печати 29 июня 2019 г.
Конденсация по Манниху 1-(п-толилокси)-3-(пропилсульфанил)пропана-2-ола с формальдегидом и вто-
ричными аминами приводит к образованию новых аминометоксипроизводных 1-(п-толилокси)-3-(про-
пилсульфанил)пропана с выходом 68-80%. Исследована антимикробная активность полученных сое-
динений.
Ключевые слова: 1-(п-толилокси)-3-(пропилсульфанил)пропан-2-ол, аминометоксипроизводные, реак-
ция Манниха, алифатические амины, антимикробные присадки, антисептические вещества
DOI: 10.31857/S0044460X20010102
Основания Манниха, содержащие различные
а также разнообразных аминных и альдегидных
функциональные группы и гетероатомы, такие как
компонентов позволяет получать обширный круг
сера и азот, в частности аминометильные произ-
полифункциональных производных данного клас-
водные алкил(арил)сульфанилалканов, играют
са соединений [8]. Многокомпонентная реакция
огромную роль как в развитии синтетической ор-
Манниха представляет собой экологически чи-
ганической химии, так и для исследований при-
стый классический метод получения биологиче-
кладного характера. Они широко используются в
ски активных и медицинских препаратов и явля-
качестве биологически активных веществ и ме-
ется одной из наиболее важных и перспективных
дицинских препаратов, а также в качестве доба-
реакций органический химии [9].
вок для улучшения качеств масел и топлив [1-3].
Аминометильные производные различных
Задача целенаправленного синтеза указанных сое-
классов органических соединений проявляют
динений является весьма актуальной [4, 5]. В свя-
противоопухолевую активность [10], влияют на
зи с этим синтез новых поколений различных ами-
сердечно-сосудистую систему, снижают кровяное
нометоксипроизводных на основе доступного сы-
давление, используются в качестве препаратов
рья и усовершенствованных методик всегда были
для лечения болезни Паркинсона, входят в состав
в центре внимания исследователей [6, 7]. Одним
противомалярийных препаратов, проявляют ан-
из удобных методов синтеза новых представите-
тидепрессантные свойства [11]. Также отмечено
лей серосодержащих аминометоксипроизводных
их эффективное спазмолитическое, анестезиру-
является трехкомпонентная реакция Манниха, так
ющее и диуретическое действие [12]. Продолжая
как использование широкого ассортимента исход-
исследования в области аминометоксипроизвод-
ных соединений с активной метиленовой группой,
ных алкилтиоалканов [13, 14] в настоящей статье
85
86
МАМЕДБЕЙЛИ и др.
Схема 1.
1
3
C3H7
NaOH
2
CH3
OH + Cl
S
CH3
O
S
NaCl, H2O
OH
OH
1
2
3
мы приводим результаты синтеза и исследования
нений 3, 11-17 подтверждены данными элемент-
свойств новых аминометоксипроизводных 1-(п-то-
ного анализа, ИК, ЯМР 1Н и 13С спектроскопии,
лилокси)-3-(пропилсульфанил)пропана 11–17.
а также масс-спектрометрии. Индивидуальность
исходных и синтезированных соединений, а также
На первом этапе был синтезирован исходный се-
состав реакционных смесей контролировали мето-
росодержащий вторичный спирт, 1-(п-толилокси)-
дом ГЖХ.
3-(пропилсульфанил)пропан-2-ол
3, взаимодей-
ствием п-крезола
1 с
1-хлор-3-пропилтиопро-
В ИК спектре соединения 3 наблюдается ши-
пан-2-олом 2 (схема 1).
рокая полоса поглощения валентных колеба-
ний νОН вторичной спиртовой группы в области
Реакцию проводили при эквимолярном соот-
3400 см-1 [15], которая отсутствует в спектрах сое-
ношении реагентов при 75-80°С в течение 4 ч в
динений 11-17. Для всех синтезированных соедине-
водном растворе NaOH (40%). Выход целевого
ний обнаружены полосы поглощения в области 737-
продукта 3 составил 72%.
730 см-1, характерные для валентных колебаний
Новые представители аминометоксипроизво-
связи C-S. Кроме того, имеются интенсивные по-
дных 1-(n-толилокси)-3-(пропилсульфанил)пропа-
лосы поглощения δС-Н в области 700-650 см-1,
на 11-17 были получены реакцией 1-(п-толилок-
а также полосы в областях 2920-2890 и 2880-
си)-3-(пропилтио)пропан-2-ола 3 с формальдеги-
2840 см-1, принадлежащие колебаниям связи С-Н
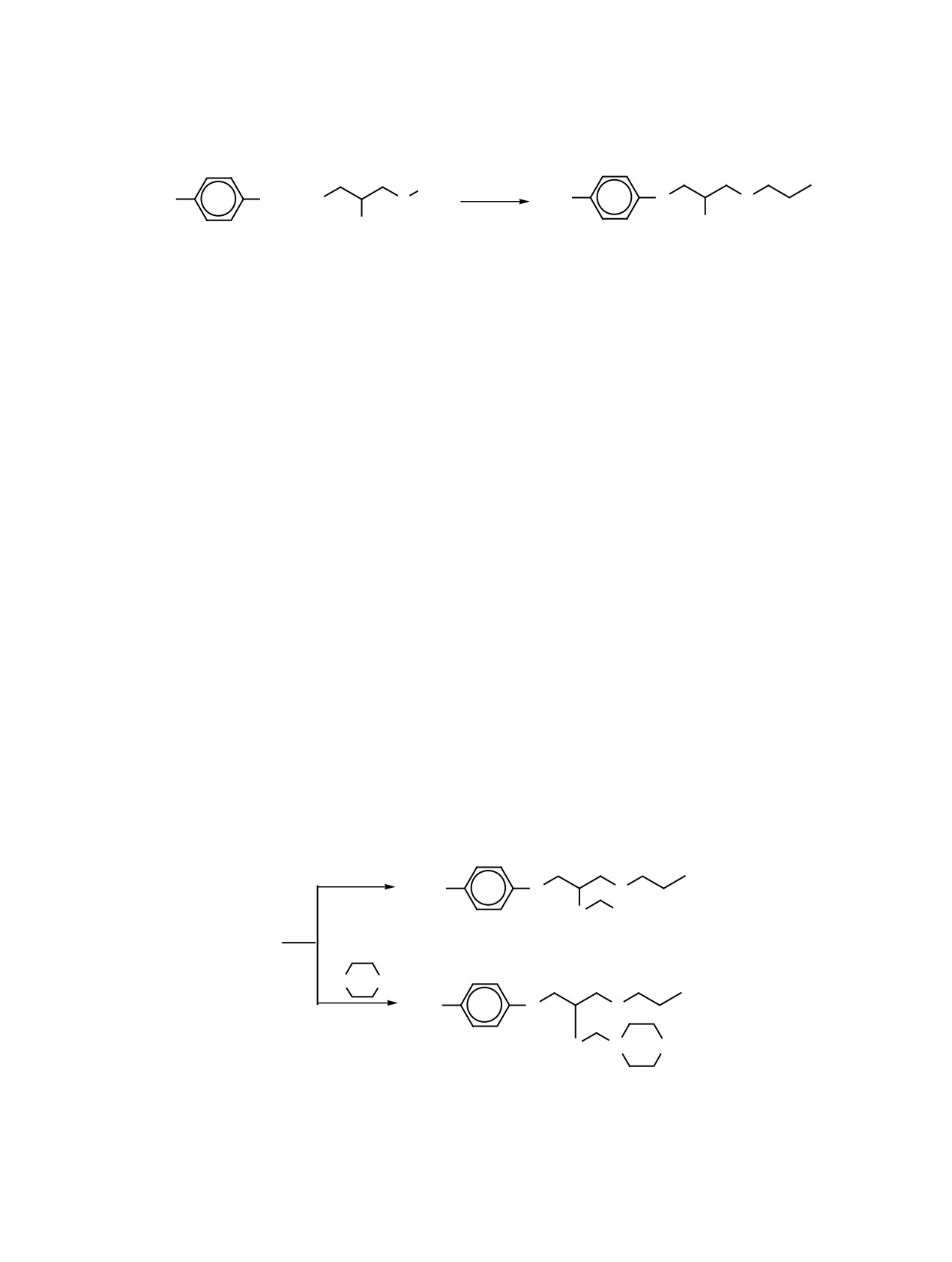
дом и вторичными аминами 4-10 по схеме 2.
групп СН3 и СН2 соответственно. Валентные ко-
Синтез аминометоксипроизводных 11-17 по ре-
лебания νС-N в спектрах соединений 11-17 прояв-
акции Манниха проводили при 45-50°С в течение
ляются в области 1140-1130 см-1. Валентные коле-
3-4 ч, выход составил 68-80%. Соединения 11-17
бания связи С-О (νС-О) проявляются в виде полос
представляют собой жидкости с характерным запа-
средней интенсивности в области 1100-1050 см-1.
хом, нерастворимые в воде, хорошо растворимые в
В масс-спектрах соединений 3, 11-17 отмечены
органических растворителях (этанол, ацетон, бен-
пики молекулярных ионов и продуктов их фраг-
зол, ССl4, CHCl3 и др.). Состав и строение соеди-
ментации.
Схема 2.
1
3
HNR2
2
CH3
O
S
4 7
O
NR2
3 + CH2O
11 14
HN
Z
1
3
2
CH3
O
S
8 10
O N Z
15 17
R2 = (C2H5)2 (4, 11), (C3H7)2 (5, 12), (C4H9)2 (6, 13), (C5H11)2 (7, 14);
Z = CH2 (8, 15), O (9, 16), -CH2CH2- (10, 17).
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 1 2020
СИНТЕЗ И СВОЙСТВА АМИНОМЕТОКСИПРОИЗВОДНЫХ
87
Антибактериальная активность соединений 11-17а
Соединение
Микроорганизм
с, %
11
12
13
14
15
16
17
S. aureus
0.005
-
-
-
-
-
-
-
0.0025
-
-
-
-
-
-
-
0.00125
-
-
-
-
-
±
-
0.000625
±
+
+
+
+
+
+
0.0003125
+
+
+
+
+
+
+
E. coli
0.005
-
-
-
-
-
-
-
0.0025
-
-
-
-
-
-
-
0.00125
-
±
-
±
±
-
-
0.000625
±
+
+
+
+
+
+
0.0003125
+
+
+
+
+
+
+
C. albicans
0.005
-
-
-
-
-
-
-
0.0025
-
-
-
-
-
±
-
0.00125
-
+
±
-
+
+
+
0.000625
+
+
+
+
+
+
+
0.0003125
+
+
+
+
+
+
+
а «+» - рост, «-» - отсутствие роста, «±» - слабый рост.
Полученные соединения были испытаны в ка-
грибы (рода Candida). Показано, что соединения
честве антимикробных присадок к смазочному
11-17 проявляют более ярко выраженную антими-
маслу М-11. Результаты испытаний показали, что
кробную активность, чем применяемые на практи-
соединения 11-17 обладают бактерицидными и
ке этанол, карболовая кислота, хлорамины, рива-
фунгицидными свойствами и эффективно пода-
нол и нитрофунгин. Указанные соединения могут
вляют рост микроорганизмов в масле М-11 при
быть рекомендованы в качестве антимикробных
концентрации 0.5 и 1.0%. При этом эффективность
препаратов.
соединений 13, 14, 17 оказалась выше, чем у про-
Также были определены минимальная инги-
мышленной присадки - пентахлорфенолята на-
бирующая концентрация (МИК) и минимальная
трия, взятой в качестве эталона. Остальные соеди-
бактерицидная концентрация (МБК) для соедине-
нения показывают близкие к эталону результаты.
ний 11-17 по отношению к некоторым вышеука-
Соединения 11-17 были испытаны на антими-
занным микроорганизмам (золотистый стафило-
кробную активность в сравнении с применяемы-
кокк, синегнойная палочка, грибы рода Candida).
ми на практике препаратами: этанолом, карболо-
Результаты представлены в таблице. Как следует
вой кислотой (фенол), хлораминами, риванолом
из данных таблицы, полученные соединения пода-
и нитрофунгином. Антимикробную активность
вляют рост микроорганизмов в очень низких кон-
центрациях.
веществ изучали методом серийных разведений. В
качестве тест-культур использовали грамотрица-
Таким образом, синтезированы и охарактеризо-
тельные (кишечная и синегнойная палочка), грам-
ваны новые основания Манниха на основе 1-(n-то-
положительные (золотистый стафилококк), споро-
лилокси)-3-(пропилсульфанил)пропана, вторич-
носные бактерии (антракоид) и дрожжеподобные
ных аминов и формальдегида. На основании ис-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 1 2020
88
МАМЕДБЕЙЛИ и др.
следования антимикробной активности можно
порошка, который деполимеризуется при нагрева-
заключить, что синтезированные соединения об-
нии.
ладают высокой биологической активностью, в
1-(n-Толилокси)-3-(пропилсульфанил)про-
частности антимикробной и антисептической ак-
пан-2-ол (3). К смеси 27 г (0.25 моль) п-крезола
тивностью в отношении указанных микроорганиз-
1 и 25 г 40%-ного водного раствора NаОН при
мов (S. aureus, E. coli, K. pneuomonial, C. albicans),
75-80°С и энергичном перемешивании по каплям
более сильной, чем у широко используемых в
добавляли 42.2 г (0.25 моль) 1-хлор-3-пропанил-
медицинской практике контрольных препаратов.
тиопропан-2-ола 2. Полученную смесь перемеши-
Кроме того, определены минимальная ингибиру-
вали в течение 3-4 ч. После охлаждения к смеси
ющая концентрация и минимальная бактерицид-
добавляли бензол, органический слой отделяли и
ная концентрация синтезированных соединений.
промывали 5%-ным раствором NаОН, затем водой
Установлено, что полученные соединения воз-
до нейтральной реакции и сушили MgSO4. После
действуют на микроорганизмы при очень низких
отгонки растворителя остаток перегоняли в вакуу-
концентрациях. Результаты исследований создают
ме. Выход 43.3 г (72%), т. кип. 150-152°С (1 мм
предпосылки для рекомендации синтезированных
рт. ст.), nD20 1.5442, d420 1.0836. MRD 70.05, вычис-
новых аминометоксипроизводных 1-(п-толилок-
лено 70.16. ИК спектр, ν, см-1: 735 (С-S), 3340
си)-3-(пропилсульфанил)пропана к применению в
(OH), 2850 (CH2), 2930 (CH3). Спектр ЯМР 1Н, δ,
качестве антимикробных веществ.
м. д.: 0.98 т (3Н, СН3, J = 7.1 Гц), 1.2 т (2Н, СН2,
J = 7.1 Гц), 2.35 с (3Н, n-СН3), 2.49 д. д (1Н, СН2S,
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
J = 14.0, 7.7 Гц), 2.61 д. д (1Н, СН2S, J = 14.0, 7.7
ИК спектры сняты на приборе Spectrum BX и
Гц), 2.7 д (2Н, СН2S), 3.01 с (1Н, ОН), 7.15-7.68 м
Bruker ALPHA IR FURYE (Германия) в области
(4Н, С6Н4). Спектр ЯМР 13С, δС, м. д.: 14.4, 15.2,
4000-400 см-1. Спектры ЯМР 1Н и 13С записаны на
17.5, 18.2, 20.4, 35.8, 37.4, 38.6, 69.5, 86.4, 88.15.
спектрометре Bruker АМ-300 при частоте 300 МГц
Масс-спектр, m/z (Iотн, %): 241 (8) [М + Н]+, 240 (2)
в С6D6, внутренний стандарт - ГМДС. Элементный
[М]+, 223 (25) [М - ОН]+, 209 (18) [М - ОН - СН2]+,
анализ выполнен на приборе Carlo Erba, модель
196 (6) [М - С3Н8]+, 179 (10) [М - С3Н7 - Н2О]+,
ЕА 1108. ГЖХ-Анализ выполнен на хроматографе
97 (100), 89 (15). Найдено, %: С 64.75; Н 8.31; S
ЛМХ-МД; условия эксперимента: колонка 300×
13.26. С13Н20О2S. Вычислено, %: С 64.96; Н 8.39;
3 мм, 5% полиэтиленгликольсукцината на динохро-
S 13.34.
ме П, газ-носитель - гелий (40 см3/мин), детектор
Общая методика синтеза аминометокси-
катарометр, температура колонки - 150°С, испари-
производных 1-(n-толилокси)-3-(пропилсульфа-
теля - 230°С. Показатель преломления определяли
нил)пропана (11-17). К раствору 0.02 моль спирта
на рефрактометре AbbeMAT 350/500. Плотность
3 и 0.02 моль формальдегида в 30 мл абсолютного
измеряли на приборе DMA 4500М. Масс-спектры
бензола прибавляли по каплям при 20-22°С и пе-
получены на масс-спектрометре VG-7070Е (иони-
ремешивании 0.02 моль свежеперегнанного амина
зирующее напряжение 70 эВ). Чистоту продуктов
4-10. Полученную смесь перемешивали 3-4 ч при
реакции определяли по температуре кипения, дан-
45-50°С. После отгонки растворителя остаток пе-
ным элементного анализа и ГЖХ.
регоняли в вакууме.
Для синтеза аминометоксипроизводных 11-17
1-(n-Толилокси)-3-(пропилсульфанил)-2-
использовали соединение 3, формальдегид и ком-
(N,N-диэтиламинаметокси)пропан
(11)
по-
мерческие вторичные амины: диэтиламин 4, ди-
лучали из 4.8 г (0.02 моль) соединения 3, 0.6 г
пропиламин 5, дибутиламин 6, дипентиламин 7,
(0.02 моль) формальдегида и 1.46 г (0.02 моль) ди-
пиперидин 8, морфолин 9, гексаметиленимин 10.
этиламина 4. Выход 4.43 г (68%), т. кип. 168-170°С
Перед использованием амины перегоняли. Бензол
(1 мм рт. ст.), nD20 1.5442, d420 1.0086. MRD 97.20,
очищали и сушили по известным методикам [16].
вычислено 97.42. ИК спектр, ν, см-1: 3070 (С-НAr),
Аммиак использовали в виде 10%-ного раствора в
2849 (CH2), 2930 (CH3), 1600 (С=СAr), 1200 (СN),
воде. Параформ использовали в виде реактивного
1100 (С-О), 735 (С-S). Спектр ЯМР 1Н, δ, м. д.:
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 1 2020
СИНТЕЗ И СВОЙСТВА АМИНОМЕТОКСИПРОИЗВОДНЫХ
89
1.01 т (6Н, СН3, J = 7.4 Гц), 1.18 т (3Н, СН3, J =
СН2S, J = 14.0, 7.7 Гц), 2.61 д. д (1Н, СН2S, J =
7.2 Гц), 1.21 т (2Н, СН2, J = 7.2 Гц), 1.32-1.41 м
14.0, 7.7 Гц), 3.03 к (4Н, СН2N, J = 7.1 Гц), 3.62 м
(4Н, СН2), 2.35 с (3Н, n-СН3), 3.03 к (4Н, СН2N,
(2Н, СН2О), 4.04 м (1Н, СНО), 4.59 с (2Н, ОСН2N),
J = 7.1 Гц), 3.62 м (2Н, ОСН2), 4.04-4.11 м (1Н,
7.17-7.34 м (4Н, С6Н4). Спектр ЯМР 13С, δС, м. д.:
СНО), 4.59 с (2Н, ОСН2N), 7.15-7.34 м (4Н, С6Н4).
14.4, 15.2, 16.4, 18.2, 20.2, 35.4, 38.6, 69.9, 86.4,
Спектр ЯМР 13С, δC, м. д.: 14.4, 15.2, 17.5, 18.2,
88.5. Масс-спектр, m/z (Iотн, %): 382 (9) [М + Н]+,
20.2, 37.4, 38.6, 69.5, 86.4, 88.5. Масс-спектр, m/z
381 (8) [М]+, 292 (12) [М - С4Н9S]+, 233 (15) [М -
(Iотн, %): 325 (7) [М]+, 250 (9) [М - С3Н7S]+, 223
С9Н20NО ]+, 203 (13) [С11Н23SО]+, 190 (100) [М -
(15) [М - С5Н12NО]+, 205 (13) [С11Н25SО]+, 193
С10Н23SО]+, 82.33. Найдено, %: С 69.05; Н 10.27; N
(100), 158 (80) [С8Н16NО2]+, 100 (75) [С4Н8N2О]+,
3.65; S 8.35. С22Н39NО2S. Вычислено, %: С 69.24;
79 (7), 58 (50). Найдено, %: С 66.23; Н 9.54; N 4.27;
Н 10.30; N 3.67; S 8.40.
S 9.79. С18Н31NО2S. Вычислено, %: С 66.42; Н
1-(n-Толилокси)-3-(пропилсульфанил)-2-
9.60; N 4.27; S 9.85.
(N,N-дипентиламинометокси)пропан
(14) по-
1-(n-Толилокси)-3-(пропилсульфанил)-2-
лучали из 4.8 г (0.02 моль) соединения 3, 0.6 г
(N,N-дипропиламинометокси)пропан
(12) по-
(0.02 моль) формальдегида и 3.14 г (0.02 моль) ди-
лучали из 4.8 г (0.02 моль) соединения 3, 0.6 г
пентиламина 7. Выход 6.53 г (80%), т. кип. 214-
(0.02 моль) формальдегида и 2.02 г (0.02 моль) ди-
216°С (1 мм рт. ст.), nD20 1.5018, d420 0.9672. MRD
пропиламина 5. Выход 5.09 г (68%), т. кип. 186-
124.96, вычислено 125.30. ИК спектр, ν, см-1: 3060
188°С (1 мм рт. ст.), nD20 1.5086, d420 0.9902, MRD
(С-НAr), 2910 (CH3), 2845 (CH2), 1585 (С=СAr),
106.55, вычислено 106.71. ИК спектр, ν, см-1: 3070
1200 (С-N), 1050 (С-О), 750 (С-S). Спектр ЯМР
(С-НAr), 2910 (CH3), 2840 (CH2), 1600 (С=СAr),
1Н, δ, м. д.: 0.95 т (6Н, СН3, J = 7.4 Гц), 1.07 т (3Н,
1205 (С-N), 1050 (С-О), 735 (С-S). Спектр ЯМР
СН3, J = 7.5 Гц), 1.21-1.32 м (12Н, СН2), 1.45 (2Н,
1Н, δ, м. д.: 0.98 т (6Н, СН3, J = 7.4 Гц), 1.08 т (3Н,
СН2), 1.65 м (2Н, СН2), 2.30 с (3Н, n-СН3), 2.49 д. д
СН3, J = 7.5 Гц), 1.21-1.32 м (8Н, СН2), 1.65 (2Н,
(1Н, СН2S, J = 14.0, 7.7 Гц), 2.61 д. д. (1Н, СН2S,
СН2), 2.35 с (3Н, n-СН3), 2.49 д. д (1Н, СН2S, J =
J = 14.0, 7.7 Гц), 3.03 к (4Н, СН2N, J = 7.2 Гц), 3.62
14.0, 7.7 Гц), 3.03 к (4Н, СН2N, J = 7.3 Гц), 3.62 м
м (2Н, СН2О), 4.59 с (2Н, ОСН2N), 7.14-7.35 м
(2Н, СН2О), 4.04 м (1Н, СНО), 4.59 с (2Н, ОСН2N),
(4Н, С6Н4). Спектр ЯМР 13С, δС, м. д.: 14.4, 15.2,
7.15-7.34 м (4Н, С6Н4). Спектр ЯМР 13С, δС,
16.5, 18.2, 20.2, 24.3, 35.4, 38.6, 69.9, 86.4, 88.6.
м. д.: 14.4, 15.2, 16.4, 18.2, 20.2, 35.4, 37.5, 39.6,
Масс-спектр, m/z (Iотн, %): 409 (15) [М]+, 392 (70)
69.5, 88.4, 91.5. Масс-спектр, m/z (Iотн, %): 353
[М - ОН]+, 378 (70) [М - ОН - СН2]+, 336 (10) [М -
(11) [М]+, 336 (10) [М - ОН]+, 322 (69) [М - ОН -
С4Н10СН3]+, 332 (100) [М - С3Н9S]+, 109 (80)
СН2]+, 278 (100) [М - С3Н7S]+, 113 (21) [С7Н15N]+,
[С8Н13]+, 82.33. Найдено, %: С 70.25; Н 10.52; N
82 (33). Найдено, %: С 67.72; Н 9.92; N 3.93; S 9.02.
3.40; S 7.80. С24Н43NО2S. Вычислено, %: С 70.36;
С20Н35NО2S. Вычислено, %: С 67.94; Н 9.98; N
Н 10.58; N 3.42; S 7.83.
3.96; S 9.07.
1-(п-Толилокси)-3-(пропилсульфанил)-2-пи-
1-(n-Толилокси)-3-(пропилсульфанил)-2-
перидинометоксипропан
(15)
получали из
(N,N-дибутиламинометокси)пропан
(13)
по-
4.8 г (0.02 моль) соединения 3, 0.6 г (0.02 моль)
лучали из 4.8 г (0.02 моль) соединения 3, 0.6 г
формальдегида и 1.7 г (0.02 моль) пиперидина
(0.02 моль) формальдегида и 2.58 г (0.02 моль)
8. Выход 4.92 г (78%), т. кип. 194-196°C (1 мм
дибутиламина 6. Выход 5.95 г (78%), т. кип. 210-
рт. ст.), nD20 1.5288, d420 1.0426. MRD 99.8, вычисле-
212°С (1 мм рт. ст.), nD20 1.5030, d420 0.9752, MRD
но 100.02. ИК спектр, ν, см-1: 3050 (С-НAr), 2895
115.68, вычислено 116.01. ИК спектр, ν, см-1: 3060
(СН3), 2850 (СН2), 1585 (С=СAr), 1250 (С-N), 1050
(С-НAr), 2910 (CH3), 2850 (CH2), 2585 (С=СAr),
(С-О), 650 (С-S). Спектр ЯМР 1Н, δ, м. д.: 1.01 т
1200 (С-N), 1050 (С-О), 735 (С-S). Спектр ЯМР
(3Н, СН3, J = 7.3 Гц), 1.21 м (2Н, СН2), 1.32 м (6Н,
1Н, δ, м. д.: 0.98 т (6Н, СН3, J = 7.1 Гц), 1.08 т (3Н,
СН2цикл), 2.35с (3Н, п-СН3) 2.49 д. д (1Н, СН2S, J =
СН3), 1.21-1.32 м (10Н, СН2), 1.45-1.51 (2Н, СН2),
14.0, 7.7 Гц), 2.61 д. д (1Н, СН2S, J = 14.0, 7.7 Гц),
1.65 м (2Н, СН2), 2.35 с (3Н, n-СН3), 2.49 д. д (1Н,
3.01 к (4Н, СН2N, J = 7.2 Гц), 3.62 м (2Н, ОСН2),
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 1 2020
90
МАМЕДБЕЙЛИ и др.
4.04 м (1Н, ОСН), 4.51 с (2Н, ОСН2N), 7.15-7.34 м
4.51 с (2Н, ОСН2N), 7.15-7.34 м (5H, С6Н5).
(4H, С6Н4). Спектр ЯМР 13С, δС, м. д.: 14.4, 15.2,
Спектр ЯМР 13С, δС, м. д.: 14.4, 15.2, 17.5, 18.2,
17.5, 20.45, 26.21, 35.4, 36.4, 39.6, 69.9, 86.4, 88.5.
20.45, 21.33, 35.4, 39.6, 69.9, 86.4, 88.15. Масс-
Масс-спектр, m/z (Iотн, %): 337 (20) [М]+, 262 (17)
спектр, m/z (Iотн, %):
352
(7)
[М + Н]+,
351
[М - С3Н7S]+, 254 (10) [М - С5Н9N]+, 244 (8) [М -
(5) [М]+, 276 (18) [М - С3Н7S]+, 268 (11) [М -
С3Н7S - Н2О]+, 226 (25) [М - С7Н7O - Н2О]+, 216
С5Н9N]+, 258 (8) [М - С3Н7S - Н2О]+, 230 (100)
(100) [М - С7Н7NO]+, 147 (25) [С10Н11О]+, 75 (60)
[М - С7Н7NO]+, 122 (91) [С7Н6S]+, 93 (6) [С6Н5О],
[С3Н7S]+. Найдено, %: С 67.42; Н 9.21; N 4.13; S
75 (60) [С3Н7S]+. Найдено, %: С 68.14; Н 9.41; N
9.44. С19Н31NО2S. Вычислено, %: С 67.61; Н 9.26;
3.96; S 9.08. C20H33NO2S. Вычислено, %: С 68.33;
N 4.15; S 9.50.
Н 9.46; N 3.98; S 9.12.
1-(п-Толилокси)-3-(пропилсульфанил)-2-
Антимикробную активность соединений 11-17
морфолинометоксипропан
(16) получали из
изучали методом серийных разведений для раство-
4.8 г (0.02 моль) соединения 3, 0.6 г (0.02 моль)
ров в масле концентрацией 0.5 и 1.0% в термовла-
формальдегида и 1.74 г (0.02 моль) морфолина
гокамере, а также методом лунки при температуре
9. Выход 5.16 г (76%), т. кип. 195-197°C (1 мм
28-30°С в течение 2-3 сут. В качестве тест-орга-
рт. ст.), nD20 1.5308, d420 1.0838. MRD 96.88, вычис-
низмов использовали грибные (Aspergillus niger,
лено 97.13. ИК спектр, ν, см-1: 3060 (С-НAr), 2900
Candida tropicalis) и бактериальные (Mycobacterium
(СН3), 2840 (СН2), 1600, 1500 (С=СAr), 1250 (С-N),
lacticola, Pseudomonas aeruginosa) культуры. В
1100 (С-О), 750 (С-S). Спектр ЯМР 1Н, δ, м. д.:
качестве питательных средств использовали мя-
1.01 т (3Н, СН3, J = 7.1 Гц), 1.21-1.32 м (4Н, СН2),
сопептонный агар с рН = 7.2-7.4 (для бактерий)
1.45 м (2Н, СН2), 2.35 с (3Н, п-СН3) 2.49 д. д (2Н,
и среду Сабуро (для грибов). Степень разведения
СН2S, J = 14.0, 7.7 Гц), 2.61 д. д (2Н, СН2S, J =
1:200, 1:400, 1:800, 1:1600 и 1:3200. В качестве эта-
14.0, 7.7 Гц), 3.03 к (4Н, СН2N, J = 7.1 Гц), 3.75 м
лонов для сравнения были исследованы в тех же
(4Н, СН2Оцикл), 3.82 м (2Н, ОСН2), 4.04 м (1Н,
разведениях этиловый спирт, фенол, хлорамины,
СНО), 4.51 с (2Н, ОСН2N), 7.13-7.36 м (4H, С6Н4).
риванол и нитрофунгин. Высевы проводили через
Спектр ЯМР 13С, δС, м. д.: 14.4, 15.2, 17.5, 19.2,
10, 20, 30, 40 и 60 мин для бактерий и грибов.
20.45, 26.21, 35.4, 36.4, 39.6, 69.6, 69.9, 86.4, 88.15.
Определены МИК и МБК синтезированных со-
Масс-спектр, m/z (Iотн, %): 339 (10) [М]+, 269 (5) [М -
единений 11-17 по отношению бактериям и гри-
С4Н8N]+, 246 (7) [М - С3Н7S - Н2О]+, 240 (8) [М -
бам (S. aureus, E. coli, C. albicans). В качестве пи-
С5Н9NO]+, 229 (9) [М - С6Н9ОN - Н2О]+, 218 (100)
тательной среды для бактерий использовали мясо-
[М - С7Н7NO]+, 200 (26) [М - С7Н7NO - Н2О]+,
пептонный бульон, для грибов - сладкий бульон.
101 (25), 75 (54) [С3Н7S]+. Найдено, %: С 63.47; Н
Исследования проводили методом разведений,
8.56; N 4.11; S 9.38. С18Н29NО3S. Вычислено, %: С
время инкубации составило 24 ч.
63.68; Н 8.61; N 4.13; S 9.44.
1-(п-Толилокси)-3-пропилсульфанил-2-
КОНФЛИКТ ИНТЕРЕСОВ
гексаметилениминометоксипропан
(17)
по-
лучали из 4.8 г (0.02 моль) соединения 3, 0.6 г
Авторы заявляют об отсутствии конфликта
(0.02 моль) формальдегида и 1.98 г (0.02 моль)
интересов.
гексаметиленимина 10. Выход 5.27 г (75%), т. кип.
СПИСОК ЛИТЕРАТУРЫ
196-198°C (1 мм рт. ст.), nD20 1.5282, d420 1.0378.
MRD 104.34, вычислено 104.67. ИК спектр, ν,
1. Кулиев А.М. Химия и технология присадок к маслам
см-1: 3050 (С-НAr), 2895 (СН3), 2830 (СН2), 1600,
и топливам. М.: Химия, 1972. 358 с.
1500 (С=СAr), 1200 (С-N), 1050 (С-О), 750 (С-
2. Мамедбейли Э.Г., Джафарова И.А., Рагимова С.К.,
S). Спектр ЯМР 1Н, δ, м. д.: 1.01 т (3Н, СН3, J =
Гаджиева Г.Э. // Процессы нефтехимия и не-
7.1 Гц), 1.21-1.32 м (10Н, СН2), 2.35 с (3Н, п-СН3)
фтепереработки. 2015. Т. 17. № 2 (62). С. 139;
2.49 д. д (1Н, СН2S, J = 14.0, 7.7 Гц), 2.61 д. д
Mammadbayli E.H., Jafarov I.A., Rahimova S.K.,
(1Н, СН2S, J = 14.0, 7.7 Гц), 3.03 к (4Н, СН2N, J =
Hajiyeva G.E. // Proc. Petrochem. Оil Refin. 2015.
7.2 Гц), 3.75 м (4Н, СН2О), 4.04 м (1Н, СНО),
Vol. 17. N 2 (62). P. 131.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 1 2020
СИНТЕЗ И СВОЙСТВА АМИНОМЕТОКСИПРОИЗВОДНЫХ
91
3. Tramontini M., Angiolini L. // Tetrahedron. 1990. Vol. 46.
10. Konishi M., Ohkuma H., Tsuna T., Tsuno T., Oki T.,
N 6. P. 1791. doi 10.1016/S0040-4020(01)89752-0
Van Duyne G.D., Clardy J. // J. Am. Chem. Soc. 1990.
Vol. 112. N 9. P. 3715. doi 10.1021/ja00165a097
4. Головач Н.М., Ткачук В.Н., Сукач В.А., Вовк М.В. //
ЖОрХ. 2012. T. 48. № 9. C. 1188; Golovach N.M.,
11. Гринев А.Н., Архангельская Н.В., Урецкая Г.Я. // Хим.-
Tkachuk V.N., Sukach V.A., Vovk M.V. // Russ. J. Org.
фарм. ж. 1979. Т. 13. № 3. С. 29; Grinev A.N., Arkhan-
Chem. 2012. Vol. 48. N 9. P. 1187. doi 10.1134/
gel’skaya N.V., Uretskaya G.Ya., Stolyarchuk A.A.,
S1070428012090060
Galenko-Yaroshevskii P.A. // Pharm. Chem. J. 1979.
Vol. 13. N 3. P. 252. doi 10.1007/BF00772045
5. Климочкин Ю.Н., Юдашкин А.В., Жилкина Е.О,
Ивлева Е.А., Моисеев И.К., Ошис Я.Ф. // ЖОрХ.
12. Allochino Filho J.F., Lemos B.C., Desauza A.S.,
2017. Т. 53. № 7. Р. 959; Klimochkin Yu.N., Yudashkin
Pinheiro S., Greco S.J. // Tetrahedron. 2017. Vol. 73.
A.V., Zhilkina E.O., Moiseev I.K., Oshis Yu.F. // Russ.
N 50. P. 6977. doi 10.1016/j.tet.2017.10.063
J. Org. Chem. 2017. Vol. 53. N 7. P. 971. doi 10.1134/
13. Джафаров И.А., Мамедбейли Э.Г., Джафаро-
S1070428017070028
ва Н.А., Талыбов Г.М. // ЖОрХ. 2019. Т. 55. № 4.
6. Гулюкина Н.С., Макухин Н.Н., Белецкая И.П. //
С. 538; Jafarov I.A., Mammadbayli E.H., Jafarova N.A.,
Усп. хим. 2016. T. 85. № 7. С. 667; Gouliokina N.S.,
Talybov G.M. // Russ. J. Org. Chem. 2019. Vol. 55. N 4.
Makukhin N.N., Beletskaya I.P. // Russ. Chem. Rev.
P. 448. doi 10.1134/S1070428019040055
2016. Vol. 85. N 7. P. 667. doi 10.1070/rcr4579
14. Мамедбейли Э.Г., Гаджиева Г.Э., Ибрагимли С.И.,
7. Kumar S.V., Subramanian M.R., Chinnaiyan S.K. //
Джафарова Н.А // ЖОХ. 2018. Т. 88. № 10. C. 1718;
J. Young Pharmacists. 2013. Vol. 5. N 4. P. 154. doi
Mammadbayli E.H., Hajiyeva G.E., Ibrahimli S.I.,
10.1016/j.jyp.2013.11.004
Jafarova N.A. // Russ. J. Gen. Chem. 2018. Vol. 88. N 10.
P. 2204. doi 10.1134/S1070363218100298
8. Anu K., Saman B., Neha Sh., Sunil K., Vipin S. //
Int. J. Med. Chem. 2014. Vol. 2014. P. 1. doi.
15. Миронов В.А., Янковский С.А. Спектроскопия в ор-
10.1155/2014/761030
ганический химии. М.: Химия. 1985. 232 с.
9. Subramaniapillai S.G. // J. Chem. Sci. 2013. Vol. 125.
16. Юрьев Ю.К. Практические работы по органической
N 3. P. 467.
химии. М.: Изд. Московск. унив., 1961. 420 с.
Synthesis and Some Properties of Aminomethoxy Derivatives
of 1-(p-Tolyloxy)-3-(propylsulfanyl)propane
E. H. Mammadbaylia,*, I. A. Jafarovb, A. D. Astanovab,
L. M. Maharramovac, and N. A. Jafarovac
a Institute of Petrochemical Processes of the National Academy of Sciences of Azerbaijan,
pr. Khojaly 30, Baku, AZ 1025 Azerbaijan
b Azerbaijan Pedagogical University, Baku,AZ 1000 Azerbaijan
с Azerbaijan State University of Petroleum and Industry, Baku, AZ 1010 Azerbaijan
*e-mail: eldar_mamedbeyli@mail.ru
Received June 25, 2019; revised June 25, 2019; accepted June 29, 2019
Mannich condensation of 1-(p-tolyloxy)-3-(propylsulfanyl)propane-2-ol with formaldehyde and secondary
amines leads to the formation of new aminomethoxy derivatives of 1-(p-tolyloxy)-3- (propylsulfanyl)propane
in yield of 68 -80%. Antimicrobial activity of the obtained compounds was investigated.
Keywords: 1-(p-tolyloxy)-3-(propylsulfanyl)propan-2-ol, aminomethoxy derivatives, Mannich reaction, aliphatic
amines, antimicrobial additives, antiseptic substances
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 1 2020