ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2020, том 90, № 1, с. 92-103
УДК 546.922:546.287:547.371
ГИДРОСИЛИЛИРОВАНИЕ АЛЛИЛОВЫХ ЭФИРОВ
В ПРИСУТСТВИИ ПЛАТИНЫ(II),
ИММОБИЛИЗОВАННОЙ НА ПОЛИМЕТИЛЕНСУЛЬФИДЕ
© 2020 г. М. А. Ильина*, Д. А. де Векки
Санкт-Петербургский государственный технологический институт (технический университет),
Московский пр. 26, Санкт-Петербург, 190013 Россия
*e-mail: ilina_Masha@list.ru
Поступило в Редакцию 10 июля 2019 г.
После доработки 10 июля 2019 г.
Принято к печати 15 июля 2019 г.
Исследованы реакции аллилэтилового, аллилбутилового, аллилглицидилового, аллилбензилового и ал-
лилфенилового эфиров с 1,1,3,3-тетраметилдисилоксаном в присутствии платины(II), иммобилизованной
на полиметиленсульфиде.
Ключевые слова: гидросилилирование, аллиловые эфиры, тетраметилдисилоксан, закрепленный ком-
плекс платины(II), полиметиленсульфид
DOI: 10.31857/S0044460X20010114
Каталитическое гидросилилирование олефи-
высокоэффективный
комплексообразователь,
нов - ключевая реакция в производстве промыш-
атомы серы которого равномерно распределены
ленно важных кремнийорганических соедине-
по всей цепи и выступают в роли макролиганда
ний, генерируемых с использованием комплексов
(сульфидный и алкилтиолятный лиганды). При
платины. Bысокая и неустойчивая цена платины
хемосорбции K2PtCl4 полиметиленсульфидом
обусловливает необходимость ее многократного
образуется иммобилизованный цис-комплекс.
использования, что возможно при пролонгирован-
Полиметиленсульфид успешно испытан в ряде
ной работе металлокомплексов. Один из способов
регионов РФ в качестве коллектора (сорбента)
стабилизации каталитических свойств контактов,
тяжелых металлов в отработанных катализаторах
т. е. возможность многократного их применения, -
(золото, платина, палладий), шламах и промывных
использование металлозакрепленных систем.
водах катализаторных фабрик (палладий, сере-
Разработано большое количество закреплен-
бро), при переработке кино- и фотоматериалов и
ных платиновых и родиевых комплексов, что об-
др. [4], а комплекс [Pt-PMS] хорошо зарекомендо-
условлено их востребованностью и эффективно-
вал себя в реакции гидросилилирования винилси-
стью при гидросилилировании олефинов [1-3].
локсанов [5].
Некоторые из предложенных методов получения
В связи со стремительным развитием областей
таких катализаторов многостадийны и трудоемки,
применения кремнийорганических соединений
это приводит к существенному удорожанию ком-
и, соответственно, с расширением круга субстра-
плексов такого типа и сводит на нет их преиму-
тов целесообразно исследовать каталитическую
щества.
активность
[Pt-PMS] при гидросилилировании
В качестве альтернативного закрепленного ка-
аллилглицидилового (AllOGlyc), аллилфенилово-
тализатора нами исследован комплекс платины(II)
го (AllOPh), аллилбензилового (AllOBn), аллилэ-
на полимерном носителе - полиметиленсульфиде
тилового (AllOEt) и аллилбутилового (AllOBu)
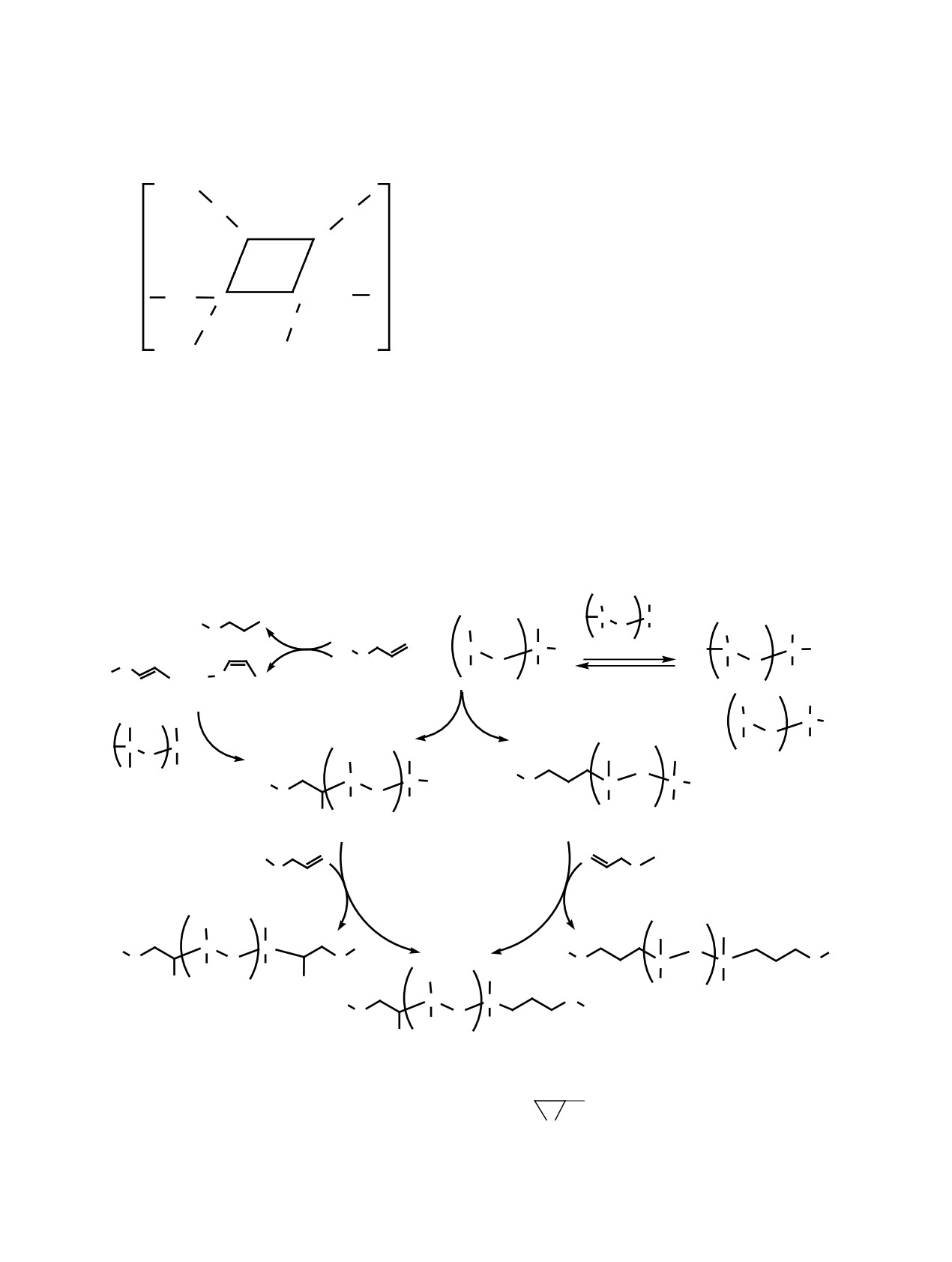
[Pt-PMS] (схема 1). Полиметиленсульфид, обра-
эфиров 1,1,3,3-тетраметилдисилоксаном. Особое
зующийся при очистке нефти от сероводорода, -
внимание в рассматриваемом ряду эфиров заслу-
92
ГИДРОСИЛИЛИРОВАНИЕ АЛЛИЛОВЫХ ЭФИРОВ В ПРИСУТСТВИИ ПЛАТИНЫ(II)
93
Гидросилилирование аллиловых эфиров
Схема 1.
1,1,3,3-тетраметилдисилоксаном в присутствии
[Pt-PMS] протекает преимущественно с образова-
CH2
CH2
нием продуктов γ- и γ,γ-присоединения, т. е. реали-
S
S
зуется антимарковниковский тип присоединения
как за счет одной, так и обеих групп SiH гидроси-
Pt
локсана (схема 2). Продукты β-, β,β- и β,γ-присое-
CH2
S
S CH2
динения образуются в значительно меньшем коли-
CH2
CH2
честве, что характерно для гидросилилирования в
n
присутствии платиновых катализаторов [8].
[Pt-PMS]
Аллиловые эфиры, наряду с основной реак-
цией, подвергаются аллил-пропенильной изоме-
ризации и восстановлению, а 1,1,3,3-тетраметил-
живает AllOGlyc, так как эпоксисиланы и эпокси-
дисилоксан диспропорционирует с образованием
силоксаны, получаемые при его гидросилилирова-
линейных силоксанов НMe2Si(OSiMe2)nH (n =
нии, применяют в качестве материалов для элек-
2-4); кроме того, происходит гидросилилирование
троники, судовых покрытий, полупроникающих
аллиловых эфиров образовавшимися силоксана-
мембран, материалов с пониженной воспламеняе-
ми НMe2Si(OSiMe2)nH, протекающее аналогич-
мостью, материалов для космоса и др. [6, 7].
но гидросилилированию исходным (HMe2Si)2O.
Схема 2.
CH3
CH3
H
Si
Si
H
R
CH3
CH3
O
CH3
CH3
O
CH
CH3
3
[H]
m
R
+
H Si
Si
H
H
Si
Si
H
O
O
O
O
CH3
CH3
CH3
CH
R
+
R
O
n
n+1
3
E
Z
CH3
CH3
', cat
CH3
CH3
+
H Si
Si
H
O
H
Si
Si
H
CH3
CH3
O
CH3
CH3
CH3
CH3
m-1
CH3
n
CH3
R
O
R
Si
Si
H
O
Si
Si H
O
O
CH3
CH
3
CH3
n
CH3
n
CH
3
E-ɩɪɢɫɨɟɞɢɧɟɧɢɟ
J-ɩɪɢɫɨɟɞɢɧɟɧɢɟ
R
R
O
O
CH3
CH3
CH3
CH3
R
Si
Si
R
R
O
R
O
O
O
O
Si
Si
O
CH3
CH3
CH3
CH3
CH3
n
CH3
CH3
n
CH3
R
Si
Si
O
E,E-ɩɪɢɫɨɟɞɢɧɟɧɢɟ
O
O
R
J,J-ɩɪɢɫɨɟɞɢɧɟɧɢɟ
CH3
CH3
n
CH3
E,J-ɩɪɢɫɨɟɞɢɧɟɧɢɟ
CH2
m, n = 1-4; m n; R = Et, Bu, Glyc
(
), Bn, Ph.
O
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 1 2020
94
ИЛЬИНА, ДЕ ВЕККИ
Таблица 1. Гидросилилирование аллиловых эфиров 1,1,3,3-тетраметилдисилоксаном в присутствии [Pt-PMS]а
Состав катализата, %
продукт присоединения
Эфир
(HMe
Si)2O
2
β-
γ-
β,β-
β,γ-
γ,γ-
AllOBu
8
120
99
96.1
97.3/2.7
1.5
60.2
0.4
0.4
13.4
0.2
23.9
AllOEt
7.75
98
95.3
99.7/0.3
0.2
59.2
0
0
14.2
4.0
24.4
AllOBn
8
90
89.8
97.0/3.0
1.7
56.7
0
0.5
14.3
4.6
22.2
AllOPh
22
97
89.8
92.1/7.9
3.9
45.2
0.3
1.3
16.1
3.1
30.1
AllOGlyc
1.25
94
86.4
99.0/1.0
0.6
60.3
0
0
17.3
6.0
15.8
1.67б
98
93.8
95.2/4.8
3.2
63.6
0
0
16.2
4.3
12.7
2.3
100
91
95.4
88.4/11.6
3.2
65.0
0
0
9.5
6.2
16.1
6.5б
91
89.3
92.5/7.5
5.4
61.6
0
2.0
13.8
5.2
12
7
80
92
92.1
81.9/18.1
5.2
61.0
0
0
9.0
5.2
19.6
а cPt = 3×10-3 моль/л, мольное отношение эфир:силоксан = 1:1.5. б cPt = 3×10-4 моль/л.
Такое побочное превращение аллиловых эфиров
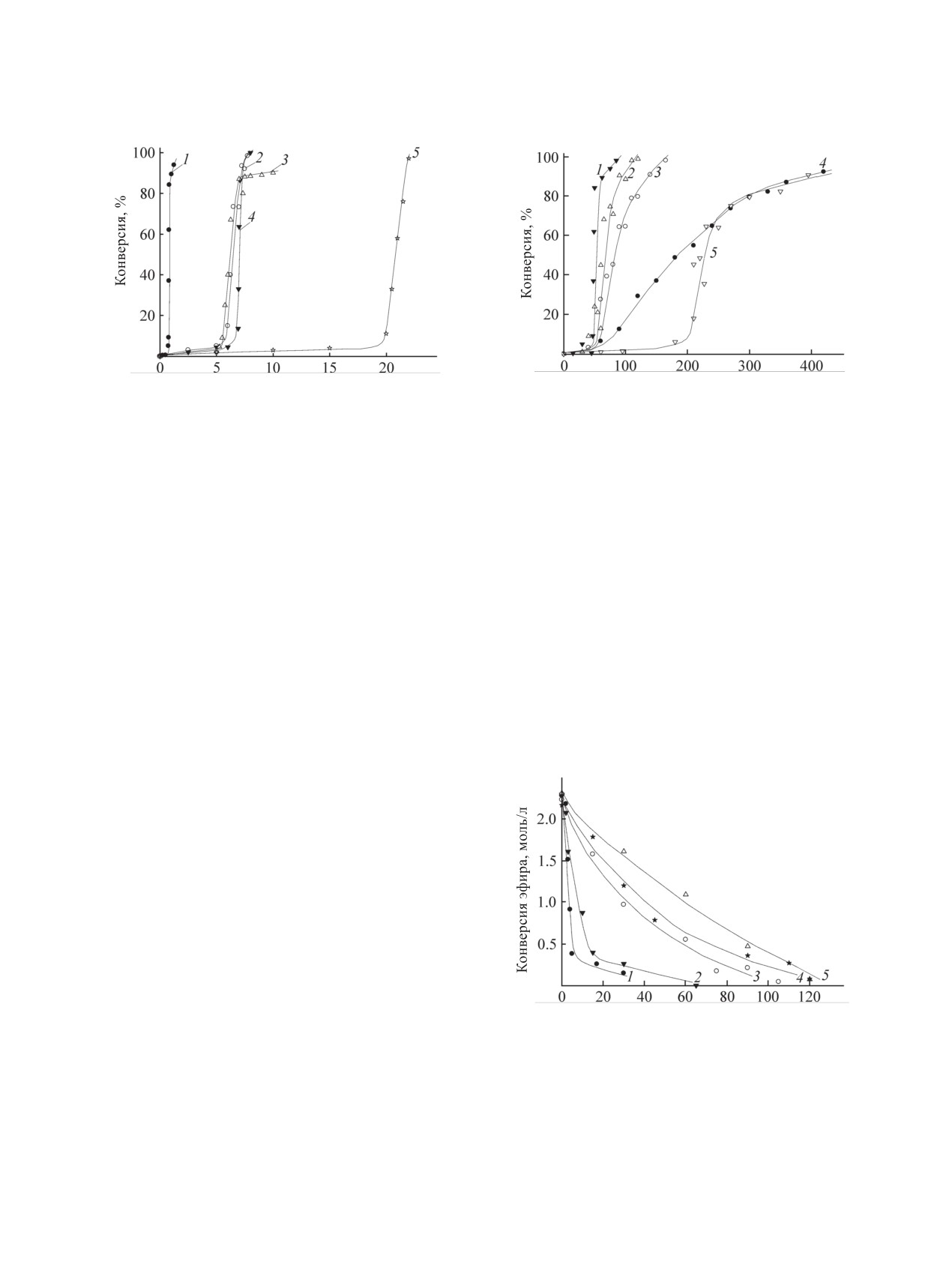
Величина индукционного периода зависит от
и (HMe2Si)2O согласуется с общими закономер-
природы заместителя R в аллиловом эфире AllOR,
ностями протекания гидросилилирования при ис-
концентрации катализатора и температурного ре-
пользовании как гомогенных, так и гетерогенных
жима. Минимальный индукционный период на-
комплексов платины и родия, однако другие по-
блюдается при гидросилилировании AllOGlyc
бочные реакции: раскрытие оксиранового кольца
при 120°С (35 мин, сPt = 3×10-3 моль/л) (рис. 1, 2,
и образование глицидилакрилата [9, 10], α-присо-
табл. 1). Снижение температуры реакции на 20°С
единение [8], дегидрогенативное силилирование
увеличивает индукционный период на 10 мин
[11, 12], элиминирование пропилена [10], диме-
(45 мин, 100°С), уменьшение температуры до 80°С
ризация и полимеризация эфиров [8, 11, 13, 14],
прибавляет еще 10 мин к индукционному перио-
циклизация силоксанов [15] и т. п. - в присутствии
ду (55 мин) (рис. 2). Уменьшение концентрации
наших каталитических систем отсутствуют.
катализатора на порядок вызывает увеличение
Кинетические кривые взаимодействия алли-
индукционного периода при 120°С на 5 мин, при
ловых эфиров и (HMe2Si)2O имеют выраженный
100°С - в 5 раз (до 3 ч). Таким образом, оптималь-
S-образный характер, определяющийся индукци-
ный температурный режим работы катализатора
онным периодом и разноскоростными этапами
[Pt-PMS] при гидросилилировании 1,1,3,3-тетра-
гидросилилирования (рис. 1). Индукционный пе-
метилдисилоксаном составляет 100-120°С (сPt =
риод, по-видимому, связан с труднодоступностью
3×10-3 моль/л). Гидросилилирование AllOGlyc по-
платины в полиметиленсульфидном комплексе;
лисилоксаном, в котором присутствуют кремний-
последующий низкоскоростной этап гидросили-
гидридные группы, в присутствии Н2PtCl6 (ката-
лирования вызван медленным формированием ис-
лизатора Спайера) протекает в близком интервале
тинного катализатора; этап с высокой скоростью
температур (110-130°С) [16], тогда как оптималь-
соответствует накоплению достаточного количе-
ная температура гидросилилирования
1,3-диви-
ства каталитически активных частиц.
нил-1,1,3,3-тетраметилдисилоксана (HMe2Si)2O
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 1 2020
ГИДРОСИЛИЛИРОВАНИЕ АЛЛИЛОВЫХ ЭФИРОВ В ПРИСУТСТВИИ ПЛАТИНЫ(II)
95
ȼɪɟɦɹ ɱ
ȼɪɟɦɹ ɱ
Рис. 1. Изменение конверсии эфиров во времени при их
Рис. 2. Изменение конверсии аллилглицидилового эфи-
взаимодействии с (НMe2Si)2O в присутствии [Pt-PMS]
ра во времени при взаимодействии с (НMe2Si)2O в при-
(cPt = 3×10-3 моль/л, мольное отношение эфир:силоксан =
сутствии [Pt-PMS] (мольное отношение эфир:силоксан =
1:1.5, 120°С). 1 - AllOGlyc, 2 - AllOEt, 3 - AllOBn, 4 -
1:1.5) при cPt = 3×10-3 (1, 3, 4), 3×10-4 моль/л (2, 5). 1,
AllOBu, 5 - AllOPh.
2 - 120°С, 3, 5 - 100°С, 4 - 80°С.
на [Pt-PMS] существенно ниже (55°С; уменьше-
температура. Снижение сPt на порядок при 120°С
ние температуры до 45°С вызывает появление ин-
приводит к увеличению продолжительности ги-
дукционного периода) [5].
дросилилирования в 1.5-1.7 раза (60 мин, конвер-
Индукционный период при гидросилилиро-
сия 98%), однако при 100°С продолжительность
вании AllOEt и AllOBu значительно больше, чем
реакции значительно возрастает (3.5 ч, конверсия
AllOGlyc, и составляет 5 и 6.75 ч (120°С, сPt = 3×
91%).
10-3 моль/л) соответственно. На величину индукци-
Максимальная конверсия AllOBu (99%, 8 ч,
онного периода существенно влияет удаленность
120°С) выше, чем конверсия AllOGlyc, и гидро-
фенильного кольца от аллильной группы: индук-
силилирование без учета индукционного пери-
ционный период при гидросилилировании AllOPh
ода длится 1.25 ч (табл. 1). Гидросилилирование
максимален (20 ч, 120°С, сPt = 3×10-3 моль/л),
AllOEt протекает медленнее (~2 ч вместо 1.25 ч),
тогда как при взаимодействии AllOBn и 1,1,3,3-те-
траметилдисилоксана индукционный период
близок к таковому для AllOEt (5.5 ч, 120°С, сPt = 3×
10-3 моль/л). Таким образом, индукционный пери-
од при гидросилилировании уменьшается в следу-
ющем ряду эфиров: AllOPh >> AllOBu > AllOBn >
AllOEt >> AllOGlyc.
Время достижения максимальной конверсии
AllOGlyc 1.25 ч (94%,120°С, сPt = 3×10-3 моль/л),
т. е. продолжительность гидросилилирования без
учета индукционного периода, - минимальное
среди всех рассматриваемых эфиров (35-40 мин).
Снижение температуры реакции до 100°С увели-
ȼɪɟɦɹ ɦɢɧ
чивает продолжительность гидросилилирования
Рис. 3. Изменение концентрации эфиров во времени
в 2.4-2.7 раза (95 мин, конверсия 91%, рис. 2),
после окончания индукционного периода при их вза-
дальнейшее уменьшение температуры еще более
имодействии с (НMe2Si)2O в присутствии [Pt-PMS]
критично (6 ч, конверсия 92%, 80°С). Понижение
(cPt = 3×10-3 моль/л, мольное отношение эфир:силоксан =
концентрации [Pt-PMS] в реакционной смеси в
1:1.5, 120°С). 1 - AllOGlyc, 2 - AllOBu, 3 - AllOEt, 4 -
меньшей степени влияет на скорость реакции, чем
AllOBn, 5 - AllOPh.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 1 2020
96
ИЛЬИНА, ДЕ ВЕККИ
Таблица 2. Выход НMe2Si(OSiMe2)nH (n = 2-4) при гидросилилировании аллиловых эфиров 1,1,3,3-тетраметилдиси-
локсаном в присутствии [Pt-PMS]а
n = 2
n = 3
n = 4
Т, °С
Эфир
Время, ч
А
Б
А
Б
А
Б
1.00
1.9
1.9
0.3
0.3
0
0
80
7.00
0.3
2.2
2.0
3.8
0.3
0.4
0.75
1.2
1.2
0.2
0.2
0
0
100
2.30
0.3
2.2
1.9
3.6
0.2
0.4
3.00б
4.5
4.5
1.7
1.7
0.6
0.6
AllOGlyc
6.50б
0.3
2.3
1.2
2.9
0.2
0.5
0.50
4.7
4.7
1.2
1.2
0
0
1.15
0.3
3.3
0.9
3.1
0.1
0.1
0.67б
1.9
1.9
0.5
0.5
0
0
1.67б
0
3.1
0.6
1.4
0.7
0.8
5.00
10.7
10.7
3.7
3.7
1.1
1.1
AllOBu
6.75
9.3
11.8
6.3
6.3
1.8
2.1
120
7.00
3.3
13.1
1.7
3.5
0.6
0.9
5.00
14.4
15.6
2.9
3.3
0.3
0.3
AllOEt
7.75
1.2
14.8
1.5
3.1
0.4
0.4
5.50
6.7
7.1
5.3
5.3
0.7
0.7
AllOBn
9.00
0.6
11.7
0.8
2.1
0.2
1.1
20.00
42.6
43.8
1.9
1.9
0.6
0.6
AllOPh
22.00
18.8
27.7
0.6
5.9
0.4
2.2
а сPt = 3×10-3 моль/л, мольное отношение эфир:силоксан = 1:1.5. А - выход свободного силоксана НMe2Si(OSiMe2)nH, Б -
суммарный выход свободного силоксана НMe2Si(OSiMe2)nH и связанного в продукты гидросилилирования. б сPt = 3×10-4 моль/л.
и на момент завершения реакции (7 ч) конверсия
Аллил-пропенильная изомеризация и восста-
AllOEt достигает 94% (рис. 1, 3). Кинетическая
новление аллиловых эфиров, сопровождающие
кривая гидросилилирования AllOBn практически
гидросилилирование, определяются природой за-
совпадает с кинетической кривой для AllOEt (вре-
местителя R в эфире AllOR. Лидер по количеству
мя реакции около 2 ч). Угол наклона кинетической
образующихся геометрических изомеров пропени-
кривой гидросилилирования и, соответственно,
ловых эфиров - AllOGlyc. На момент завершения
реакционная способность аллилфенилового эфира
гидросилилирования доля пропенилглицидило-
оказываются минимальными среди всех исследуе-
вых эфиров достигает 6.0%; снижение температу-
мых эфиров. Таким образом, реакционная способ-
ры реакции и концентрации [Pt-PMS] не приводит
ность аллиловых эфиров при гидросилилирова-
к значительному изменению их количества. Доля
нии убывает в ряду: AllOGlyc > AllOBu > AllOEt ≈
пропилглицидилового эфира - продукта восста-
AllOBn > AllOPh
новления - также достаточно высока (3.6%) и не
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 1 2020
ГИДРОСИЛИЛИРОВАНИЕ АЛЛИЛОВЫХ ЭФИРОВ В ПРИСУТСТВИИ ПЛАТИНЫ(II)
97
зависит от температуры реакции и концентрации
температурного режима, концентрации металло-
катализатора. Склонность AllOGlyc к побочным
комплекса и косвенно определяется реакционной
превращениям хорошо согласуется с его высокой
способностью используемого эфира, влияющей на
реакционной способностью.
продолжительность целевой реакции.
При гидросилилировании AllOBu образуются
Побочные превращения 1,1,3,3-тетраметилди-
только следовые количества продуктов изомериза-
силоксана при гидросилилировании AllOGlyc в
ции и восстановления AllOBu (120°С). На момент
силу минимального индукционного периода и сум-
завершения гидросилилирования их выход не пре-
марного времени целевой реакции протекают ме-
вышает 0.2%. Выход пропенилбутиловых эфиров
нее интенсивно. Суммарный выход образовавших-
в конце индукционного периода достигает 0.9%.
ся НMe2Si(OSiMe2)nH, с учетом их расходования
Снижение выхода пропениловых эфиров по мере
на взаимодействие с AllOGlyc, на момент завер-
протекания гидросилилирования характерно и для
шения гидросилилирования составляет 3.3, 3.1 и
других аллиловых эфиров и обусловлено их рас-
0.1% (n = 2, 3 и 4 соответственно, 1.15 ч при 120°С,
ходованием на гидросилилирование, приводящее
табл. 2). Снижение температуры реакции на 20°С
преимущественно к β-аддукту [17]. Таким обра-
понижает выход трисилоксана до 2.2%, однако
возрастает суммарный выход НMe2Si(OSiMe2)3H
зом, селективность реакции снижается. Однако
и НMe2Si(OSiMe2)4H. В результате, общее количе-
низкая концентрация пропениловых эфиров в
ство продуктов побочного превращения исходно-
присутствии [Pt-PMS] в совокупности с меньшей
го силоксана снижается незначительно (на 0.5%).
активностью эндо-связей С=С по сравнению с тер-
Последующее понижение температуры на 20°С (до
минальными при гидросилилировании [14, 18-20]
80°С) практически не изменяет суммарный выход
позволяют предположить, что вклад гидросилили-
продуктов побочного превращения (НMe2Si)2O. В
рования пропениловых эфиров несуществен.
свою очередь, снижение концентрации [Pt-PMS]
Изомеризация AllOEt протекает значительно
на порядок при 100°С приводит к уменьшению
интенсивнее, чем для AllOBu. Доля пропенилэ-
суммарного выхода НMe2Si(OSiMe2)3H в 1.5 раза
тиловых эфиров по завершении реакции превы-
(табл. 2).
шает количество пропенилбутиловых эфиров в 20
Присоединение (HMe2Si)2O к AllOBu харак-
раз (4.0%), пропилэтиловый эфир не образуется.
теризуется большим индукционным периодом
В свою очередь, изомеризация и восстановление
и продолжительностью гидросилилирования,
AllOBn протекают в 2 раза более интенсивно, чем
поэтому диспропорционирование более замет-
AllOEt (суммарно 8.0%, 8 ч, 120°С), что в конеч-
но, чем при гидросилилировании AllOGlyc, и
ном итоге снижает селективность гидросилилиро-
позволяет проследить динамику образования
вания AllOBn по сравнению с AllOEt и AllOBu.
и расходования побочных силоксанов. Выход
Побочные реакции превращения AllOPh огра-
НMe2Si(OSiMe2)2H,
НMe2Si(OSiMe2)3H
и
ничиваются образованием только пропенилфени-
НMe2Si(OSiMe2)4H через 5 ч при 120°С составля-
ловых эфиров (3.1%); возможно, они образуются в
ет 10.7, 3.7 и 1.1%, через 6.75 ч - 9.3, 6.3 и 1.8%
большем количестве, но постепенно расходуются
соответственно, т. е. НMe2Si(OSiMe2)2H расходу-
на гидросилилирование до β-аддукта, что согла-
ется, а НMe2Si(OSiMe2)3H накапливается. На мо-
суется с довольно низкими показателями региосе-
мент исчерпания AllOBu выход побочных силок-
лективности при гидросилилировании AllOPh.
санов 3.3, 1.7 и 0.6%, что обусловлено их расхо-
Другая побочная реакция при гидросилилиро-
дованием на гидросилилирование. Более наглядно
вании - диспропорционирование исходного гидро-
данные процессы иллюстрируют кинетические
силоксана в НMe2Si(OSiMe2)nH (n = 2-4), которые
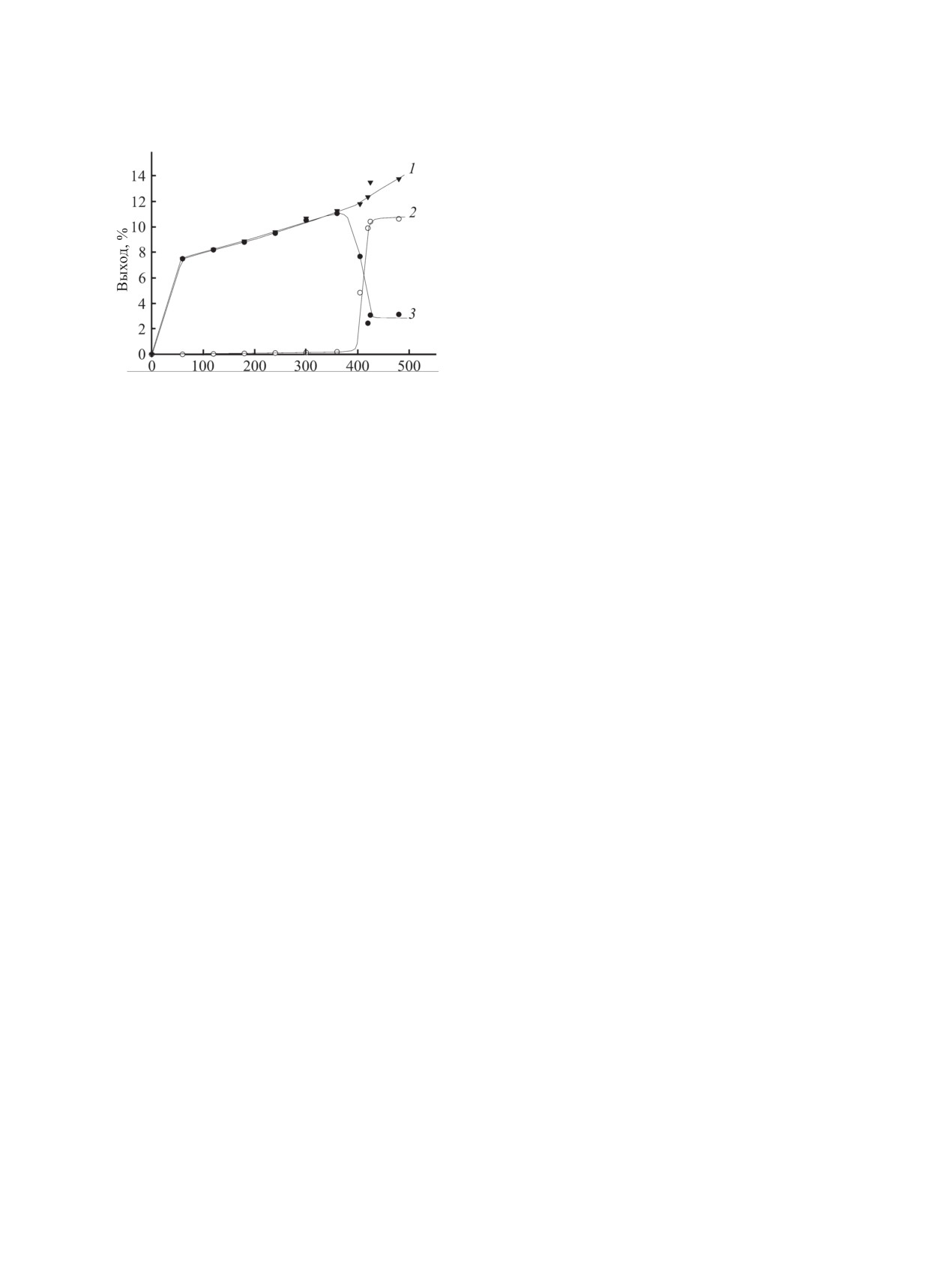
кривые (рис. 4). Например, кинетическая кривая
по мере их образования гидросилилируют алли-
накопления НMe2Si(OSiMe2)2H сначала плавно
ловый эфир (количество таких продуктов гидро-
возрастает, по достижении достаточного количе-
силилирования может достигать 30%). Основная
ства активных центров металлокомплекса (завер-
масса НMe2Si(OSiMe2)nH образуется во время ин-
шение индукционного периода) она скачкообразно
дукционного периода и зависит от используемого
снижается, так как наступает высокоскоростной
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 1 2020
98
ИЛЬИНА, ДЕ ВЕККИ
реакции практически не отличаются от значений
для AllOBu (табл. 2).
Максимальный индукционный период при ги-
дросилилировании AllOPh приводит к тому, что
побочные превращения гидросилоксанов при ги-
дросилилировании
1,1,3,3-тетраметилдисилокса-
ном интенсивнее, чем для остальных эфиров. На
момент завершения индукционного периода вы-
ход НMe2Si(OSiMe2)nH составляет 42.6, 3.5 и 1.0%
(n = 2, 3 и 4 соответственно, табл. 2). По завер-
шении главной реакции выход НMe2Si(OSiMe2)nH
ȼɪɟɦɹ ɦɢɧ
с учетом расходования на гидросилилирование
(22 ч) равен 27.7, 5.9 и 2.2% (n = 2, 3 и 4 соот-
Рис. 4. Изменение выхода НMe2Si(OSiMe2)2H во вре-
мени при взаимодействии AllOBu и (HMe2Si)2О в при-
ветственно). Снижение доли НMe2Si(OSiMe2)2H
сутствии [Pt-PMS] (cPt = 3×10-3 моль/л, 120°С). 1-
не пропорционально возрастанию количества
суммарный выход свободного силоксана и связанного
НMe2Si(OSiMe2)3H и НMe2Si(OSiMe2)4H, что,
в продукты гидросилилирования; 2 - выход силоксана,
по-видимому, является результатом его боль-
связанного в продукты гидросилилирования; 3 - выход
свободного силоксана.
шей реакционной способности по сравнению с
НMe2Si(OSiMe2)3H и НMe2Si(OSiMe2)4H, а также
O и
его диспропорционированием на (HMe2Si)2
этап гидросилилирования, и количество свобод-
НMe2Si(OSiMe2)3H [8].
ного НMe2Si(OSiMe2)2H уменьшается, после чего
Таким образом, продолжительность индукци-
опять происходит ее плавное возрастание. Во вре-
онного периода и непосредственного гидросили-
мя индукционного периода образуются только
лирования - основные факторы, влияющие как на
следовые количества продуктов гидросилилирова-
количество образующихся побочных силоксанов,
ния AllOBu 1,1,3,3,5,5-гексаметилтрисилоксаном
так и на протекание аллил-пропенильной изомери-
(кинетическая кривая едва заметно возрастает),
зации аллиловых эфиров.
по завершении которого кривая накопления про-
Наличие в образующихся моноаддуктах второй
дуктов реакции скачкообразно поднимается (вы-
группы Si-H предопределяет их взаимодействие с
сокоскоростной этап гидросилилирования) с по-
аллиловым эфиром и образование продуктов двой-
следующим выходом на плато (завершение гидро-
ного присоединения даже в избытке (НMe2Si)2O.
силилирования). Кинетическая кривая изменения
Гидросилилирование AllOGlyc в силу высокой ак-
суммарного количества свободного и связанного
в продукты гидросилилирования 1,1,3,3,5,5-гек-
тивности эфира протекает только с образованием
γ,γ-аддукта, доля которого при 120°С 17.3%. При
саметилтрисилоксана
[оценить расходование
НMe2Si(OSiMe2)2H на диспропорционирование не
снижении температуры его количество уменьша-
представляется возможным] на протяжении всей
ется практически в 2 раза (доли γ,γ-аддукта - 9.5 и
реакции плавно возрастает. Подобный характер
9.0% при 100 и 80°С соответственно).
имеют и кинетические кривые накопления и рас-
Выход продукта γ,γ-присоединения при взаи-
ходования НMe2Si(OSiMe2)nH (n = 3, 4); суммар-
модействии AllOBu и (НMe2Si)2O меньше (13.4%),
ный выход НMe2Si(OSiMe2)nH (с учетом расхода
чем в случае AllOGlyc, однако при этом наблюда-
на гидросилилирование) - 13.1, 3.5 и 0.9% при n =
ются продукты β,β- и β,γ-присоединения (выход
2, 3 и 4 соответственно (табл. 2).
менее 0.8%). Количество продуктов гидросилили-
Накопление свободных НMe2Si(OSiMe2)nH во
рования AllOEt и AllOBn активной группой Si-H
время индукционного периода и их дальнейшее
моноаддуктов на момент завершения основной
расходование на гидросилилирование характерно
реакции лишь незначительно отличается от гидро-
и для гидросилилирования AllOEt и AllOBn, при
силилирования AllOBu (14.2 и 14.8% для AllOEt и
этом суммарные выходы силоксанов по окончании
AllOBn соответственно), однако при гидросилили-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 1 2020
ГИДРОСИЛИЛИРОВАНИЕ АЛЛИЛОВЫХ ЭФИРОВ В ПРИСУТСТВИИ ПЛАТИНЫ(II)
99
ровании AllOBn образуются γ,γ- и β,γ-аддукты, а в
AllOGlyc, несмотря на минимальный индукци-
случае AllOEt - только γ,γ-аддукт (табл. 1).
онный период при 120°С, селективность реакции
не отличается от селективности гидросилилиро-
Количество продуктов двойного присоедине-
вания других эфиров из-за большей склонности
ния при гидросилилировании AllOPh и AllOGlyc
AllOGlyc к побочным реакциям и значительного
сопоставимо и больше, чем для других эфиров
образования продукта γ,γ-присоединения (60.3%);
(17.7%). При этом выход β,γ-аддукта в 2-3 раза
снижение температуры реакции позволяет повы-
выше, чем при гидросилилировании AllOBu и
сить селективность (65%). Как и в случае присо-
AllOBn, а β,β-аддукт образуется в следовых коли-
единения (HMe2Si)2O, селективность реакции для
чествах.
AllOPh принимает минимальное значение среди
Гидросилилирование аллиловых эфиров обра-
всех эфиров (45.2%).
зовавшимися моноаддуктами со свободной крем-
Оценка суммарного γ-присоединения (γΣ-се-
нийгидридной группой протекает значительно
лективности) с учетом вклада всех образующихся
медленнее, чем 1,1,3,3-тетраметилдисилоксаном
при гидросилилировании γ-аддуктов, в том числе
и при необходимости целенаправленного синтеза
побочными силоксанами, а также продуктов двой-
продуктов двойного присоединения требует из-
ного присоединения, с целью экстраполировать
быточного количества аллилового эфира и значи-
полученные данные на гидросилилирование оли-
тельного времени. Аналогичная картина наблю-
гомерными и полимерными кремнийгидридами,
далась при сравнительном гидросилилировании
поскольку в них процессы диспропорционирова-
алифатических эфиров терефталоилбис(4-гидрок-
ния практически не влияют на среднюю молеку-
сибензоатов)
1,1,3,3-тетраметилдисилоксаном и
лярную массу и на характеристики конечного про-
1-(1'-арилэтокси)-1,1,3,3-тетраметилдисилокса-
дукта реакции, при гидросилилировании AllOBu и
ном [21].
AllOEt даёт значения 96.1 и 95.3% соответственно,
Как правило, селективность при гидросилили-
т. е. почти на 36% выше, чем селективность при-
ровании аллиловых эфиров рассматривается как
соединения (HMe2Si)2O. γΣ-Селективность гидро-
соотношение γ- и β-аддукта (региоселективность)
силилирования AllOGlyc, AllOBn и AllOPh состав-
без учёта побочных реакций. В нашем случае ре-
ляет 86.4, 89.8 и 89.8% соответственно. Однако
гиоселективность присоединения (HMe2Si)2O при
селективность на закрепленном и гомогенных
гидросилилировании AllOGlyc и AllOEt близка к
циклооктадиеновом (85%), дибензилсульфидном
максимальному значению - 99.0 и 99.7% (сPt = 3×
(87%) и диметилсульфоксидном (84%) комплексах
10-3 моль/л, 120°С) соответственно. Соотношение
платины уступает селективности в присутствии
продуктов γ- и β-присоединения (HMe2Si)2O при
катализатора Уилкинсона
[Rh(Ph3P)3Cl]
(95%)
гидросилилировании AllOBu и AllOBn одинаково
[14]. Расчеты γΣ-селективности по данным ГЖХ и
(97.3 и 97.0% соответственно) и только в случае
селективности, определенной из анализа спектров
AllOPh оно 92.1%.
ЯМР 1Н, совпадают [определение селективности
Селективность реакции, т. е. отношение про-
гидросилилирования только продукта γ-присоеди-
дукта γ-присоединения (HMe2Si)2O ко всем об-
нения (HMe2Si)2O по данным 1Н ЯМР невозможно
разовавшимся из AllOR соединениям [включая
из-за наложения сигналов продуктов гидросили-
продукты побочных реакций, а также продукты
лирования исходным гидросилоксаном и побочно
моно- и диприсоединения к AllOR побочно обра-
образовавшимися гидридами НMe2Si(OSiMe2)nH
зовавшихся силоксанов НMe2Si(OSiMe2)nH, (n =
(n = 2, 3)].
2-4)] ниже региоселективности и при 120°С ва-
Важная характеристика закрепленного ме-
рьируется в диапазоне 45.2-60.3% из-за образова-
таллокомплекса - возможность его многократ-
ния продуктов двойного присоединения и высокой
ного применения. Иммобилизованная на PMS
активности НMe2Si(OSiMe2)nH (табл. 1). Можно
платина(II) при гидросилилировании AllOGlyc
предположить, что низкая селективность при ги-
(120°С, сPt = 3×10-3 моль/л) выдерживает не менее
дросилилировании AllOR преимущественно об-
10 циклов; TONAllOGlyc > 8550, TOFAllOGlyc =
условлена индукционным периодом, однако для
3.5683 c-1, TOFAllOBu
= 0.9416 c-1, TOFAllOEt =
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 1 2020
100
ИЛЬИНА, ДЕ ВЕККИ
Таблица 3. Многократное применение [Pt-PMS] при гидросилилировании аллилглицидилового эфира 1,1,3,3-тетра-
метилдисилоксанома
Продукт присоединения
(HMe2Si)2O, %
№
Прочее, %
цикла
β-
γ-
β,γ-
γ,γ-
1
80
7.00
92
93.3
92.1/7.9
5.3
62.6
0
9.3
5.4
17.4
2
94
92.5
91.0/1.0
6.1
61.6
0
10.0
4.9
17.4
3
90
98.8
98.6/1.4
1.0
67.6
0
11.8
5.6
14.0
4
59
92.1
90.8/9.2
6.6
65.7
0
12.0
6.5
9.2
5
56
92.0
91.7/8.3
5.9
65.0
1.0
11.8
7.7
8.6
6
33
93.1
91.9/8.1
6.2
70.4
0
8.6
6.1
8.7
1
120
1.25
99
96.0
95.5/4.5
2.8
58.5
0
9.3
5.6
23.8
2
99
96.5
95.8/4.2
2.5
57.6
0.7
12.7
5.7
20.7
3
94
95.8
96.3/3.7
2.1
53.0
0.8
17.1
6.1
20.8
4
84
94.9
94.4/5.6
3.3
55.6
1.3
12.5
5.8
21.6
2.00
99
96.0
94.8/5.2
3.6
66.0
0
15.0
3.7
11.7
5
2.50
97
95.5
93.9/6.1
4.1
63.5
0
18.7
3.4
10.3
6
97
96.7
94.8/5.2
2.9
53.1
0
26.0
5.0
13.0
7
3.00
94
96.9
93.4/6.6
2.7
38.6
0
40.7
5.2
12.8
8
6.00
92
96.0
93.7/6.3
3.6
53.0
0
26.7
5.3
11.5
9
7.50
96
95.5
93.1/6.9
4.0
54.1
0
23.1
5.1
13.7
10
95
95.0
92.8/7.2
4.4
56.1
0
18.7
3.8
17.0
а сPt = 3×10-3 моль/л, мольное отношение эфир:силоксан = 1:1.5.
0.1283 c-1, TOFAllOBn = 0.1121 c-1, TOFAllOPh =
ное применение при гидросилилировании 1,3-ди-
0.1022 c-1. Для сохранения высокой конверсии
вил-1,1,3,3-тетраметилдисилоксана
1,1,3,3-тетра-
эфира после 3-го цикла требуется увеличивать вре-
метилдисилоксаном [5].
мя контакта катализатора с реакционной смесью
Селективность реакции, региоселективность и
(табл. 3). Снижение температуры до 80°С отрица-
γ
-селективность при многократном применении
Σ
тельно сказывается на количестве продуктивных
[Pt-PMS] практически не изменяются (табл. 3);
циклов (в силу низкой активности катализатора),
на прежнем уровне остается и количество продук-
что согласуется с результатами работ [22, 23]. По
тов побочного превращения силоксанов и эфиров.
многократности применения комплекс [Pt-PMS]
Промывка катализатора метиленхлоридом не вли-
сравним с закрепленной на кремнеземе Pt(0),
яет на селективность реакции.
содержащей этиленоксидные фрагменты
[24].
Для понимания механизма каталитического дей-
Комплекс
[Pt-PMS] выдерживает четырехкрат-
ствия [Pt-PMS] нами исследовано влияние пред-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 1 2020
ГИДРОСИЛИЛИРОВАНИЕ АЛЛИЛОВЫХ ЭФИРОВ В ПРИСУТСТВИИ ПЛАТИНЫ(II)
101
варительной обработки каталитического комплек-
Первоначальная обработка [Pt-PMS] аллилгли-
са 1,1,3,3-тетраметилдисилоксаном или AllOGlyc
цидиловым эфиром вызывает дезактивацию ком-
(2 ч, 80°С) с последующим сравнительным гидро-
плекса. При последующем добавлении силоксана
силилированием на полученных продуктах взаи-
к обработанному образцу конверсия эфира всего
модействия. Предварительная активация [Pt-PMS]
2% через 2 ч при 80°С что, возможно, связано с
1,1,3,3-тетраметилдисилоксаном сопровождается
образованием малоэффективного π-аллильного
изменением цвета раствора с бесцветного на жел-
комплекса, однако ИК спектр обработанного ал-
то-зеленый, что характерно для образования пла-
лилглицидиловым эфиром катализатора не изме-
тина-кремнийгидридных комплексов [25].
няется. Предварительная активация гомогенных
В ИК спектре образца, полученного после об-
серосодержащих комплексов cis-[Pt(Me2SO)2Cl2]
работки 1,1,3,3-тетраметилдисилоксаном и про-
и cis-[Pt(Et2SO)2Cl2] при гидросилилировании
мывания комплекса CH2Cl2, наблюдаются две
α-метилстирола также приводит к заметному сни-
полосы метильных групп силоксана при 804 и
жению скорости реакции [27].
1259 см-1, появляется новая полоса при 1093 см-1,
Анализ полученных данных с учетом ранее
которая может быть отнесена к валентным колеба-
проведенных исследований [3, 5] и существую-
ниям фрагмента νas(Si-O-Si), сигнал ν(Si-H) в об-
щих представлений о механизме гидросилили-
ласти 2300-2400 см-1 отсутствует. Изменения ИК
рования позволяет предположить, что ключевая
спектра [Pt-PMS] после его обработки 1,1,3,3-те-
стадия реакции - первичное взаимодействие [Pt-
траметилдисилоксаном, вероятно, вызваны окис-
PMS] с (НMe2Si)2O. Последующая атака аллиль-
лительным присоединением кремнийгидрида с
ной группы с образованием соответствующего
образованием связи Pt-Si [25, 26].
интермедиата (внедрение в связь Pt-Si) приводит
Каталитическая активность
[Pt-PMS] после
к гидросилилированию, в то время как другие
обработки 1,1,3,3-тетраметилдисилоксаном и до-
превращения кремниевого комплекса платины ак-
бавления AllOGlyc при комнатной температуре
тивируют побочные процессы гидросилоксанов.
(18-25°С) сопоставима с активностью исходного
Формирование интермедиата зависит от строения
[Pt-PMS], однако если после обработки введение
силоксана и аллилового эфира и обусловливает
AllOGlyc проводить при более высокой темпера-
наблюдающийся в ряде случаев индукционный
туре (30-40°С), конверсия аллилглицидилового
период. В свою очередь, первичная координация
эфира (80% через 2 ч при 80°С) существенно увели-
аллилового эфира - основной источник изомери-
чивается по сравнению с единовременным добавле-
зации двойной связи эфира или его восстановле-
нием реагентов (29%). Подобная тенденция увели-
ния при дальнейшей атаке получившегося интер-
чения конверсии алкена в результате предваритель-
медиата гидросилоксаном.
ной активации гомогенных cis-[Pt(Me2SO)2Cl2],
cis-[Pt(Et2SO)2Cl2] и [Pt(MeCOD)Cl2] 1,1,3,3-те-
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
траметилдисилоксаном наблюдалась ранее при
В опытах использовали 1,1,3,3-тетраметилди-
гидросилилировании α-метилстирола
[27], что
силоксан и аллилглицидиловый эфир (Acros), ал-
позволяет предположить общность механизма их
лилбутиловый, аллилфениловый и аллилбензило-
действия. Предварительная активация [Pt-PMS]
вый эфиры (Aldrich), аллилэтиловый эфир (Fluka),
1,1,3,3-тетраметилдисилоксаном оказывает по-
толуол и метиленхлорид квалификации ЧДА.
ложительный эффект на селективность гидроси-
Комплекс [Pt-PMS] получен по методике [5].
лилирования: возрастает количество продуктов
γ-присоединения (НMe2Si)2O к AllOGlyc (соот-
Хроматографический анализ продуктов гидро-
ношение γ/β-аддуктов составляет
92.8/7.2); на
силилирования аллиловых эфиров проводили на
5.8% увеличивается селективность гидросилили-
хроматографе Agilent 7890A с детектором по тепло-
рования, на 1.2% - γΣ-селективность; кроме того,
проводности. Колонка капиллярная DB-1 (30 м×
уменьшается количество продуктов побочного
0.32 мм, толщина пленки фазы 1 мкм), объем про-
превращения AllOGlyc (доли пропенил- и пропил-
бы 0.5 мкл, температура испарителя - 250°С. Для
глицидилового эфиров составляют 3.3 и 3.2% со-
реакционных смесей на основе AllOPh и AllOBn
ответственно).
температура колонки - 150°С (4 мин), нагрев до
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 1 2020
102
ИЛЬИНА, ДЕ ВЕККИ
290°С со скоростью 42 град/мин, выдерживание
Приютово, 2000. 20 с.
35 мин при 290°С; газ-носитель - гелий с делени-
5. де Векки Д.А., Кучаев Е.А., Афонин М.В., Симано-
ем потока 1:300. Для реакционных смесей на осно-
ва С.А. // ЖОХ. 2008. Т. 78. Вып. 4. С. 594; de Vekki D.A.,
ве AllOEt, AllOBu и AllOGlyc температура колон-
Kuchaev E.A., Afonin M.V., Simanova S.A. // Russ. J.
ки - 70°С (5 мин), нагрев до 200°С со скоростью
Gen. Chem. 2008. Vol. 78. N 4. P. 575. doi 10.1134/
5 град/мин, нагрев до 225°С со скоростью 25 град/
S1070363208040105
мин, выдерживание 45 мин при 225°С; газ-носи-
6. Ильина М.А., Машляковский Л.Н., Дринберг А.С.,
тель - гелий с делением потока 1:250.
Хомко Е.В., Гарабаджиу А.В. // ЖПХ. 2019. Т. 92.
ИК спектры снимали на спектрометре Shimadzu
Вып. 4. С. 491; Il’ina M.A., Mashlyakovskii L.N.,
FTIR-8400S (4000-400 см-1) в таблетках KBr.
Drinberg A.S, Khomko E.V., Garabadzhiu A.V. // Russ.
J. Appl. Chem. 2019. Vol. 92. N 4. P. 530. doi 10.1134/
Гидросилилирование аллиловых эфиров
S0044461819040091
проводили в ампулах при 80-120°С. В ампулу
7. Chrusciel J.J., Lesniak E. // Prog. Polym. Sci. 2015.
помещали навеску катализатора, затем прилива-
Vol. 41. P. 67. doi 10.1016/j.progpolymsci.2014.08.001
ли заранее приготовленную смесь силоксана, ал-
лилового эфира и толуола в мольном соотноше-
8. Ильина М.А., де Векки Д.А., Скворцов Н.К. // ЖОХ.
нии 6:4:1 соответственно; концентрация платины
2014. Т. 84. Вып. 1. С. 43; Il’ina M.A., de Vekki D.A.,
Skvortsov N.K. // Russ. J. Gen. Chem. 2014. Vol. 84.
3×10-4-3×10-3 моль/л реакционной смеси при
N 1. P. 40. doi 10.1134/S1070363214010095
сPt = 8×10-5 моль/г носителя. Конверсию и селек-
тивность определяли методом ГЖХ (кинетически)
9. Safa K.D., Bahadori A., Tofangdarzadeh S., Nasirtab-
с использованием внутреннего стандарта (толуо-
rizi M.H. // J. Iran. Chem. Soc. 2008. Vol. 5. N 1. P. 37.
ла) по методике работы [3].
doi 10.1007/BF03245813
10. Чернышев Е.А., Белякова З.В., Князева Л.К., Хро-
ФОНДОВАЯ ПОДДЕРЖКА
мых Н.Н. // ЖОХ. 2007. Т. 77. Вып. 1. С. 61;
Chernyshev E.A., Belyakova Z.V., Knyazeva L.K.,
Работа выполнена при поддержке Министерства
Khromykh N.N. // Russ. J. Gen. Chem. 2007. Vol. 77.
науки и высшего образования РФ в рамках государ-
N 1. P. 55. doi 10.1134/S1070363207010082
ственного задания (11.5362.2017/8.9) и комплекс-
ного проекта по созданию высокотехнологичного
11. Marciniec B., Walczuc E., Blazejewska-Chadyniak P.,
Kujawa-Welten M., Krompiec S. // Organosilicon Chem.
производства Министерства ауки и высшего обра-
Vol. 2003. P. 415. doi 10.1002/9783527619924.ch67
зования РФ (договор № 03.G25.31.0237).
12. Белякова З.В., Померанцева М.Г., Ефимова Л.А.,
КОНФЛИКТ ИНТЕРЕСОВ
Чернышев Е.А., Стороженко П.А. // ЖОХ. 2010.
Т. 80. Вып. 4. С. 568; Belyakova Z.V., Pomerantse-
Авторы заявляют об отсутствии конфликта
va M.G., Efimova L.A., Chernyshev E.A., Storozhen-
интересов.
ko P.A. // Russ. J. Gen. Chem. 2010. Vol. 80. N 4. P. 728.
СПИСОК ЛИТЕРАТУРЫ
doi 10.1134/S1070363210040079
13. Feng S., Cui M. // React. Funct. Polym. 2000. Vol. 45.
1. Advances in Silicon Science / Ed. B. Marciniec.
N 2. P. 79. doi 10.1016/S1381-5148(00)00013-4
London: Springer, 2009. Vol. 1. P. 32. doi 10.1007/978-
14. Андреев С.А., Ильина М.А., Волкова А.М., де
1-4020-8172-9
Векки Д.А., Скворцов Н.К. // ЖПХ. 2010. Т. 83.
2. Де Векки Д.А., Ильина М.А., Н.К. Скворцов // Изв.
Вып. 11. С. 1830; Andreev S.A., Il’ina M.A., Volkova A.M.,
СПбГТИ(ТУ). 2015. № 32(58). С. 54. doi 10.15217/
de Vekki D.A., Skvortsov N.K. // Russ. J. Appl.
issn998984-9.2015.32.54.
Chem. 2010. Vol. 83. N 11. P. 1962. doi 10.1134/
3. Де Векки Д.А., Ильина М.А., Скворцов Н.К. // ЖОХ.
S1070427210110133
2018. Т. 88. Вып. 1. С. 28; de Vekki D.A., Il’ina M.A.,
15. де Векки Д.А., Н.К. Скворцов // ЖОХ. 2009. Т. 79.
Skvortsov N.K. // Russ. J. Gen. Chem. 2018. Vol. 88.
Вып. 4. С. 762; de Vekki D.A., Skvortsov N.K. // Russ.
N 1. P. 25. doi 10.1134/S107036321801005X
J. Gen. Chem. 2009. Vol. 79. N 4. P. 598. doi 10.1134/
4. Гафиатуллин Р.Р. Автореф. дис
канд. техн. наук.
S107036320904015X
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 1 2020
ГИДРОСИЛИЛИРОВАНИЕ АЛЛИЛОВЫХ ЭФИРОВ В ПРИСУТСТВИИ ПЛАТИНЫ(II)
103
16. Wang W. // Eur. Polym. J. 2003. Vol. 39. N 6. P.1117.
ska M. // Monatsh. Chem. 2006. Vol. 137. N 5. P. 605.
doi 10.1016/S0014-3057(02)00374-9
doi 10.1007/s00706-006-0461-9
17. Schilling C.L. // J. Organomet. Chem. 1971. Vol. 29.
23. Maciejewski H., Szubert K., Marciniec B., Pernak J. //
N 1. P. 93.
Green Chem. 2009. Vol. 11. N 7. P. 1045. doi 10.1039/
18. Comprehensive Handbook on Hydrosilylation / Ed.
b819310j
B. Marciniec. Oxford: Pergamon Press, 1992. 776 p.
24. Alauzun J., Mehdi A., Reye C., Corriu R. // Chem.
19. Андрианов К.А., Соучек И., Хананашвили Л.М. // Усп.
Matter. 2007. Vol. 19. N 26. P. 6373. doi 10.1021/
хим. 1979. Т. 48. № 7. С. 1233.
cm7019087
20. Зуев В.В., де Векки Д.А. // ЖОрХ. 2006. Т. 42.
25. Huang J., Liu Zh., Liu X., He Ch., Chow Sh.Y., Pan J. //
Вып. 8. С. 1127; Zuev V.V., de Vekki D.A. // Russ. J.
Langmuir. 2005. Vol. 21. N 2. P. 699. doi 10.1021/
Org. Chem. 2006. Vol. 42. N 8. P. 1108. doi 10.1134/
la0482148
S107042800608001X
26. Stein J., Lewis L.N., Gao Y., Scott R.A. // J. Am. Chem.
21. Rozga-Wijas K., Chojnowski J., Fortuniak W., Scibio-
Soc.1999. Vol. 121. N 15. P. 3693. doi 10.1021/
rek M., Michalska Z., Rogalski L. // J. Mater. Chem.
ja9825377
2003. Vol. 13. P. 2301. doi 10.1039/B304134D
27. Петренко М.Ю., де Векки Д.А., Скворцов Н.К. // Изв.
22. Marciniec B., Maciejewski H., Szubert K., Kurdykow-
СПбГТИ(ТУ). 2009. Вып. 5(31). С. 53.
Hydrosilylation of Allyl Ethers in the Presence
of Platinum(II) Immobilized on Polymethylene Sulfide
M. A. Il’ina* and D. A. de Vekki
St. Petersburg State Institute of Technology (Technical University), Moscovskii pr. 26, St. Petersburg, 190013 Russia
*e-mail: ilina_Masha@list.ru
Received July 10, 2019; revised July 10, 2019; accepted July 15, 2019
The reactions of allyl ethyl, allyl butyl, allyl glycidyl, allyl benzyl and allyl phenyl ethers with 1,1,3,3-tetrameth-
yldisiloxane in the presence of platinum(II) immobilized on polymethylene sulfide were studied.
Keywords: hydrosilylation, allyl ethers, tetramethyldisiloxane, immobilized platinum(II) complex, poly-
methylene sulfide
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 1 2020