ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2020, том 90, № 1, с. 104-110
УДК 547.245
СИНТЕЗ 2,2'-БИС(СИЛИЛ)АЗОБЕНЗОЛОВ
ОКИСЛЕНИЕМ 2-(СИЛИЛ)АНИЛИНОВ
© 2020 г. Н. Ф. Лазарева*, Б. А. Гостевский
Иркутский институт химии имени А. Е. Фаворского Сибирского отделения Российской академии наук,
ул. Фаворского 1, Иркутск, 664033 Россия
*е-mail: nataly_lazareva@irioch.irk.ru
Поступило в Редакцию 20 июня 2019 г.
После доработки 20 июня 2019 г.
Принято к печати 25 июня 2019 г.
Разработан метод синтеза 2,2'-бис(триметилсилил)- и 2,2'-бис(триэтоксисилил)азобензолов на основе
реакции окисления 2-(силил)анилинов окисью триметиламина и N-метилморфолина в присутствии
CuX (X = Cl, Br).
Ключевые слова: 2-(силил)анилины, окисление, 2,2'-бис(триметилсилил)азобензол, 2,2'-бис(триэток-
сисилил)азобензол
DOI: 10.31857/S0044460X20010126
Молекулярный дизайн, разработка новых ме-
этих исследований заключается в установлении
тодов синтеза и изучение физико-химических
взаимосвязи между процессом обратимой цис/
свойств ароматических азосоединений привле-
транс-фотоизомеризации 2-(фторсилил)замещен-
кают внимание исследователей на протяжении
ных азобензолов и изменением координационного
нескольких десятилетий (см., например, обзоры
числа атома кремния. Эта способность обеспечи-
[1-8]). Повышенный интерес обусловлен как их
вает потенциальную возможность применения
способностью к цис/транс-фотоизомеризации, так
таких соединений при создании молекулярных пе-
и их широким применением в химии материалов,
реключателей, нелинейных оптических устройств,
медицинской и аналитической химии, химической
систем записи и хранения информации, альтерна-
и пищевой промышленности. В 2001 г. были син-
тивных источников энергии. Поэтому разработка
тезированы первые представители 2-силилзаме-
эффективных способов синтеза Si-содержащих
щенных азобензолов A (схема 1), представляющих
азобензолов является одной из приоритетных за-
особый интерес [9-18].
дач кремнийорганической химии. В настоящее
Способность атома кремния к расширению
время существует несколько подходов к синтезу
координационного числа при взаимодействии с
2-силилзамещенных азобензолов. Основным и
азотсодержащими лигандами (см., например, [19,
хорошо апробированным методом их получения
20]) проявилась и в 2-(фторсилил)азобензолах об-
является взаимодействие хлорсиланов с литииро-
разованием внутримолекулярной координацион-
ванными азобензолами (схема 2) [9-15]. Согласно
ной связи N=N→Si-F. Наиболее важный результат
данным работы [9], в качестве исходного соеди-
Схема 1.
Схема 2.
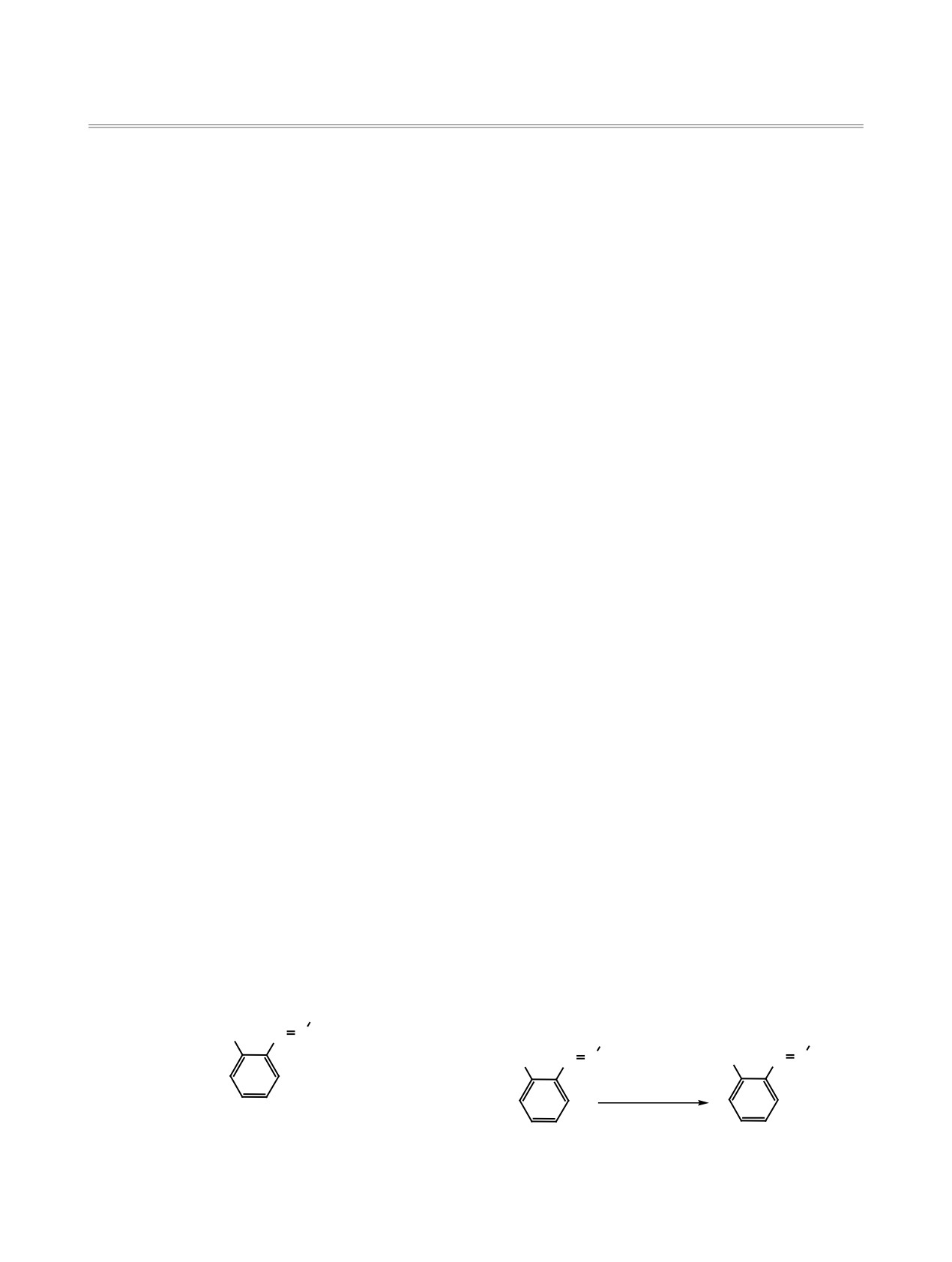
Ar
R3Si
N N
Ar
Ar
X N N
R3Si
N N
(1) n %X/L ɌȽɎ
(2) R3SiCl
A
104
СИНТЕЗ 2,2'-БИС(СИЛИЛ)АЗОБЕНЗОЛОВ
105
Схема 3.
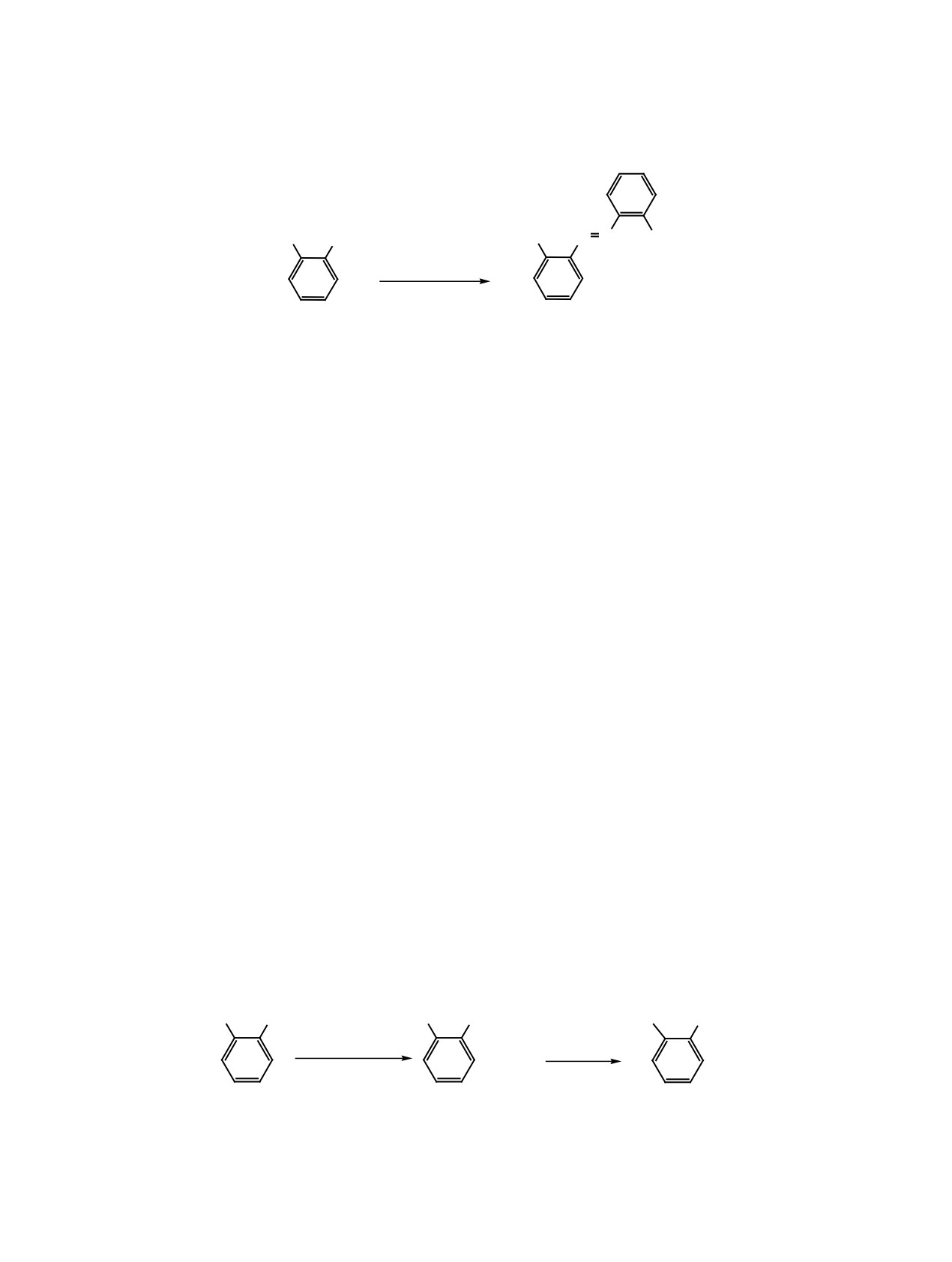
Me3Si
NH2
Me3Si
N N
SiMe3
KMnO4,
CuSO4·5H2O
CHCl3, '
22%
нения в этих реакциях предпочтительно исполь-
химии в качестве окислителей [30, 31]. В частно-
зовать 2-иодазобензол, так как применение 2-бро-
сти, недавно были синтезированы симметричные
мазобензола значительно снижает выход целевого
органические азобензолы окислением анилинов
продукта (выход 2-триметилсилилазобензола со-
системой CuBr-окись N-метилморфолина с выхо-
ставляет 80 и 25% соответственно).
дами 69-90% [23]. Анализ литературных данных
показал, что окись N-метилморфолина может быть
В последнее время интенсивно изучаются ме-
тоды прямого СН-силилирования ароматических
использована для окисления 2-силилзамещенных
анилинов: связи Si-O-C, Si-C, Si-OSi кремний-
соединений [21]. 2-(Триэтилсилил)азобензол был
содержащего олигодезоксирибонуклеотида оказа-
синтезирован по реакции СН-силилирования азо-
лись стабильны в условиях окисления его аллиль-
бензола триэтилсиланом в присутствии Ru3(CO)12
ной группы окисью N-метилморфолина и ожидае-
с выходом 49% [22]. Авторами [9] был разработан
мое производное 1,2-диола было выделено с выхо-
метод получения симметричного 2,2'-бис(триме-
дом 90% [32].
тилсилил)азобензола с выходом 22% окислени-
ем соответствующего 2-(триметилсилил)анилина
Цель настоящей работы заключается в раз-
перманганатом калия (схема 3).
работке эффективной методики синтеза симме-
тричных
2,2'-бис(силил)азобензолов на основе
К сожалению, этот метод не получил дальнейше-
реакций окисления 2-(триметилсилил)анилина 1
го развития. Однако методы синтеза органических
азобензолов, основанные на реакциях окисления
и 2-(триэтоксисилил)анилина 2 окисями тримети-
ламина (TMAO) и N-метилморфолина (NMМO).
анилинов различными окислителями интенсивно
2-(Триметилсилил)анилин 1 и 2-(триэтоксисилил)
развиваются в последние годы. Наличие кремний-
анилин 2 были синтезированы из 2-иоданилина в
содержащего заместителя в бензольном кольце,
две стадии (cхема 4).
особенно содержащего лабильные, легко гидроли-
зующиеся связи Si-X (X = Hlg, OR или NR1R2),
Ранее было показано, что N,N-бис(силил)-
накладывает ряд ограничений на использование
анилины образуются с хорошими выходами при
этого метода. Однако можно надеяться, что при-
взаимодействии соответствующих анилинов с
менение мягких окислителей позволит избежать
N-(триметилсилил)диэтиламином в присутствии
или свести к минимуму протекание побочных ре-
MeI [33]. В этих условиях 2-иод-N,N-бис(триме-
акций по связям Si-C и Si-X. Известно, что окиси
тилсилил)анилин 3 был выделен с выходом 81%.
аминов используют в синтетической органической
Соединения 1 и 2 были получены металлирова-
Схема 4.
I
NH
2
I
N(SiMe3)2
X3Si
NH2
(1) n-BuLi
Et2NSiMe3, MeI
(2) ClSiX3
PhMe
3
1, 2
SiX3 = SiMe3 (1), Si(OEt)3 (2).
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 1 2020
106
ЛАЗАРЕВА, ГОСТЕВСКИЙ
Таблица 1. Влияние условий реакции окисления 2-триметилсилиланилина на выход соединения 4
№
Окислитель
Растворитель
Катализатор, (25 мол%)
Время, ч
Выход, %
1
NMMO
MeCN
-
48
-
2
NMMO
MeCN
CuBr
12
58
3
NMMO
MeCN
CuBr
48
76
4
NMMO
MeCN
CuBr
72
77
5
NMMO
MeCN
CuBr
24
60
6
NMMO
MeOH
CuBr
48
51
7
NMMO
MeCN
CuCl
48
71
8
NMMO
MeOH
CuCl
48
42
9
NMMO
MeCN
CuI
48
67
10
NMMO
MeOH
CuI
48
59
11
TMAO
MeCN
-
48
-
12
TMAO
MeCN
CuBr
24
59
13
TMAO
MeCN
CuBr
48
72
14
TMAO
MeCN
CuCl
48
78
15
TMAO
MeCN
CuI
48
63
16
Воздух
MeCN
CuBr
24
12
нием анилина 3 раствором n-BuLi в гексане с по-
тализатора реакция окисления не идет (табл. 1, оп.
следующей обработкой cоответствующим хлорси-
№ 1, 11). Максимальные выходы 2,2'-бис(триме-
ланом. N-Триметилсилильную защитную группу
тилсилил)азобензола 4 получены при окислении
удаляли кипячением с этанолом, после перегонки
соединения 1 в системе NMMO-CuBr и TMAO-
выходы составили 69 и 51% для анилинов 1 и 2
CuCl (76 и 78% соответственно) при комнатной
соответственно.
температуре. При использовании в качестве ка-
Взаимодействие 2-силилзамещенных анилинов
тализатора CuI выход продукта несколько ниже
1 и 2 с TMAO и NMМO в растворе ацетонитрила
(при прочих равных условиях). Оптимальное вре-
приводит к образованию симметричных 2,2'-бис-
мя реакции составило 48 ч, увеличение времени
(силил)азобензолов 4 и 5 (cхема 5). Оптимизация
до 72 ч не привело к существенному изменению
условий реакции окисления выполнена на приме-
выхода целевого продукта. 2,2'-Бис[(триэтокси)-
ре соединения 1 (табл. 1).
силил)]азобензол 5 образуется с низким выходом
Реакцию проводили при комнатной температу-
при окислении анилина 2 как системой NMMO-
ре, кипячение реакционной смеси резко снижает
CuBr, так и системой TMAO-CuCl (19 и 23% соот-
выход целевого продукта и приводит к образова-
ветственно). По-видимому, это связано с тем, что
нию значительного количества неидентифициро-
вода, выделяющаяся в результате реакции окисле-
ванных побочных продуктов. В качестве катализа-
ния (схема 6), приводит к гидролизу Si-OEt связей
торов использовали соли меди(I), в отсутствие ка-
реагента 2 и продукта 5.
Схема 5.
2-Me3SiC6H4NH2
2-Me3SiC6H4N=NC6H4SiMe3-2
1
4
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 1 2020
СИНТЕЗ 2,2'-БИС(СИЛИЛ)АЗОБЕНЗОЛОВ
107
Схема 6.
NMMO, MeCN,
CuCl
2-(EtO)3SiC6H4NH2
2-(EtO)3SiC6H4N=NC6H4Si(OEt)3-2
2
5
Поэтому было изучено влияние добавок, сорби-
(400.13, 100.61 и 161.90 МГц соответственно) в
рующих или химически связывающих воду, на вы-
растворах CDCl3 и CD3CN, внутренний стандарт –
ход соединения 5 (табл. 2). В качестве добавок апро-
ГМДС или циклогексан.
бировали молекулярные сита и окись алюминия,
2-(Триметилсилил)анилин
(1).
К охлаж-
а в качестве реагентов - безводные соли Na2SO4,
денному до -78°С раствору 11 г (0.03 моль)
MgSO4 и дициклогексилкарбодиимид (DСС).
2-иод-N,N-бис(триметилсилил)анилина 3 в 75 мл
Применение DСС, взаимодействующего с водой
диэтилового эфира при интенсивном перемеши-
с образованием N,N'-дициклогексилмочевины, по-
вании добавляли по каплям 19.5 мл (~ 0.03 моль)
зволяет получить соединение 5 с более высоким
1.6 М. раствора н-бутиллития в гексане.
выходом по сравнению с другими добавками (вы-
Реакционную смесь выдерживали при этой тем-
деленный выход 52%). Соединение 5 выделено в
пературе в течение 4 ч, затем медленно добав-
виде вязкого оранжевого масла, после хранения в
ляли
3.33 г
(0.03 моль) триметилхлорсилана.
течение месяца в запаянной ампуле наблюдается
Реакционную смесь оставляли на ночь, затем
рост тонких кристаллов, однако выделить кри-
добавляли 5 мл метанола и нагревали при темпе-
сталлы, пригодные для РСА не удалось.
ратуре 40-45°С в течение 8 ч. После охлаждения
Таким образом, показано, что 2-силилзамещен-
осадок отфильтровывали и промывали эфиром
ных анилины окисляются окисями аминов в при-
(2×10 мл). Растворитель из объединенного филь-
сутствии солей меди с сохранением связей Si–C
трата удаляли, остаток перегоняли. Выход 3.42 г
и Si-OC, образуя симметричные 2,2'-бис(силил)-
(69%), бесцветное масло, т. кип. 81-83°С (1.5 мм
азобензолы. Разработанные методы синтеза могут
рт. ст.), nD = 1.5246. Спектр ЯМР 1Н, δ, м. д.: 0.35
найти применение в лабораторной практике при
с (9H, SiMe3), 3.85 уш. c (2H, NH2), 6.76-7.21 м
получении азобензолов с лабильными функцио-
(4H, Ar). Спектр ЯМР 13C, δС, м. д.: -0.52, 115.34,
нальными группами.
118.25, 119.63, 130.28, 136.13, 151.72. Спектр ЯМР
29Si: δSi -6.25 м. д. Найдено, %: C 65.24; H 9.03; N
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
8.62. C9H15NSi. Вычислено, %: C 65.39; H 9.15; N
2-Иоданилин, раствор n-BuLi, окиси тримети-
8.47.
ламина и N-метилморфолина, триметилхлорсилан,
2-(Триэтоксисилил)анилин (2) получали ана-
MeI, CuCl, CuBr, CuI - коммерческие продукты.
логично из 18 г (0.05 моль) 2-иод-N,N-бис(триме-
Растворители сушили по стандартным методикам
тилсилил)анилина 3 и 10.0 г (~0.05 моль) хлор(три-
[34]. Хлортриэтоксисилан синтезировали по ранее
этокси)силана. Выход 6.5 г (51%), желтоватое
описанной методике [35]. Все реакции проводили
масло, т. кип. 181-183°С (0.6 мм рт. ст.). Спектр
в атмосфере сухого аргона.
ЯМР 1Н, δ, м. д.: 1.22 т (9H, CH3CH2, J = 7.0 Гц),
Спектры ЯМР 1Н, 13С и 29Si регистрировали на
3.91 к (6H, CH3CH2, J = 7.0 Гц), 4.02 уш. с (2H,
спектрометрах Bruker DPX-400 и Bruker AV-400
NH2), 7.36-7.78 м (4H, Ar). Спектр ЯМР 13C, δС,
Таблица 2. Влияние добавок, связывающих воду, на выход соединения 5
№
Сорбент
Количество, га
Выход
№
Реагент
Количество, ммольа
Выход, %
1
Молекулярные сита 4Å
1
27
4
Na2SO4
6
21
2
Молекулярные сита 3Å
1
29
5
MgSO4
6
35
3
Аl2O3
1.5
19
6
DCC
4
52
а В расчете на 2 ммоль соединения 2.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 1 2020
108
ЛАЗАРЕВА, ГОСТЕВСКИЙ
м. д.: 17.87, 59.08, 116.52, 119 .12, 119.26, 131.23,
температуре в течение 48 ч, осадок отфильтровы-
137.48, 154.68. Спектр ЯМР 29Si: δSi -57.62 м. д.
вали. Легколетучие вещества удаляли в вакууме.
Найдено, %: C 56.19; H 8.03; N 5.57. C12H21NO3Si.
Перекристаллизацией из циклогексана выдели-
Вычислено, %: C 56.44; H 8.29; N 5.48.
ли вязкое оранжевое, трудно кристаллизующееся
масло, выход указан в табл. 2. Спектр ЯМР 1Н, δ,
2-Иод-N,N-бис(триметилсилил)анилин
(3).
м. д.: 1.17 т (18H, CH3CH2, J = 7.1 Гц), 3.94 к (12H,
К раствору 32 г (0.22 моль) N-(триметилсилил)ди-
CH3CH2, J = 7.1 Гц), 7.68-8.32 м (8H, Ar). Спектр
этиламина в 100 мл толуола при комнатной темпе-
ратуре прибавляли по каплям 31.25 г (0.22 моль)
ЯМР 13C, δС, м. д.: 18.26, 58.56, 124.76, 128.69,
129.18, 130.64, 137.62, 159.84. Спектр ЯМР 29Si:
метилиодида. Смесь перемешивали 4 ч при 50°С,
δSi -58.02 м. д. Найдено, %: 57.05; H 7.82; N 5.41.
затем при энергичном перемешивании прибавляли
C24H38N2O6Si2. Вычислено, %: C 56.89; H 7.56; N
по каплям раствор 22 г (0.1 моль) 2-иоданилина в
5.53.
150 мл толуола. Температуру реакционной смеси
поднимали до 75°С и перемешивали при этой тем-
ФОНДОВАЯ ПОДДЕРЖКА
пературе в течение 18 ч. Осадок отфильтровывали,
промывали бензолом (2×25 мл). Растворители из
Работа выполнена при финансовой поддержке
объединенного фильтрата отгоняли, остаток пе-
Российского фонда фундаментальных исследова-
регоняли в вакууме. Выход 32.3 г (89%), т. кип.
ний (грант № 19-03-00143) с использованием ана-
122-125°С (2 мм рт. ст.). Спектр ЯМР 1Н, δ, м. д.:
литического оборудования Байкальского центра
0.14 с (18H, Me3Si); 6.78-6.90 м, 7.22 м, 7.84 м (4H,
коллективного пользования СО РАН.
Ar). Спектр ЯМР 13C, δС, м. д.: 2.06, 95.36, 122.58,
КОНФЛИКТ ИНТЕРЕСОВ
122.78, 126.75, 140.72, 151.12. Спектр ЯМР 29Si:
δSi 7.1 м. д. Найдено, %: C 39.92; H 6.34; N 3.97.
Авторы заявляют об отсутствии конфликта
C12H22INSi2. Вычислено, %: C 39.66; H 6.10; N
интересов.
3.85.
СПИСОК ЛИТЕРАТУРЫ
2,2'-Бис(триметилсилил)азобензол
(4).
2-(Триметилсилил)анилин 0.16 г (1 ммоль) раство-
1. Громов С.П., Дмитриева С.Н., Чуракова М.В. //
ряли в 10 мл безводного ацетонитрила, добавляли
Усп. хим. 2005. Т. 74. № 5. C. 503; Gromov S.P.,
эквимольное количество соответствующего окис-
Dmitrieva S.N., Churakova M.V. // Russ. Chem.
лителя и 0.25 ммоль катализатора. Реакционную
Rev. 2005. Vol. 74. N 5. P. 461. doi 10.1070/
смесь перемешивали при комнатной температуре в
RC2005v074n05ABEH001163
течение времени, указанного в табл. 1, затем филь-
2. Зацепин Т.С. , Абросимова Л.А. , Монахова М.В., Хи-
тровали обратным фильтрованием. Растворитель
ен Ле Тхи, Пингуд А. , Кубарева Е.А., Орецкая Т.С. //
удаляли, остаток перекристаллизовывали из сме-
Усп. хим. 2013. T. 82. № 10. С. 942; Zatsepin T.S.,
си хлороформ-циклогексан-пентан (1:1:5). Выход
Abrosimova L.A, Monakhova M.V., Hien Le Thi,
указан в табл. 1, мелкокристаллический порошок
Pingoud A., Kubareva E.A., Oretskaya T.S. // Russ.
оранжевого цвета, т. пл. 121-124°C. Спектр ЯМР
Chem. Rev. 2013. Vol. 82. N 10. P. 942. doi 10.1070/
13H, δ, м. д.: 0.38 с (18 H, Me3Si); 7.64-7.88 м, 8.26
RC2013v082n10ABEH004355
м (8H, Ar). Спектр ЯМР 13C, δС, м. д.: - 0.49, 122.98,
3. Luo W., Feng Y., Feng. W. // Nanoscale. 2012. Vol. 4.
127.12, 130.04, 130.36, 134.23, 157.08. Спектр ЯМР
N 20. P. 6118. doi 10.1039/c2nr31505j
29Si: δSi -6.84 м. д. Найдено, %: C 66.54; H 8.27; N
4. Tylkowski B. Trojanowska A., Marturano V., Nowak M.,
8.71. C18H26N2Si2. Вычислено, %: C 66.20; H 8.02;
Marciniak L., Giamberini M., Ambrogi V., Cerruti P. //
N 8.58.
Coord. Chem. Rev. 2017. Vol. 351. P. 205. doi 10.1016/j.
2,2'-Бис(триэтоксисилил)азобензол
(5).
ccr.2017.05.009
2-(Триэтоксисилил)анилин 0.5 г (2 ммоль) раство-
5. Wei Y.-bo, Tanga Q., Gonga C.-bin, Hon-Wah Lamb M. //
ряли в 10 мл безводного ацетонитрила, добавляли
Anal. Chim. Acta. 2015. Vol. 900. P. 10. doi 10.1016/j.
0.25 г (2 ммоль) NMMO, 0.5 ммоль CuBr и реагент,
aca.2015.10.022
связывающий воду (количество указано в табл. 2).
6. Beharry A.A., Woolley G.A. // Chem. Soc. Rev. 2011.
Реакционную смесь перемешивали при комнатной
Vol. 40. N 8. P. 4422. doi 10.1039/c1cs15023e
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 1 2020
СИНТЕЗ 2,2'-БИС(СИЛИЛ)АЗОБЕНЗОЛОВ
109
7. Dhammika Bandarab H.M., Burdette S.C. // Chem.
Hayamizu T., Chatani N., Murai S. // J. Organometal.
Soc. Rev. 2012. Vol. 41. N 5. P. 1809. doi 10.1039/
Chem. 2003. Vol. 686. N 1-2. P. 134. doi 10.1016/
c1cs15179g
S0022-328X(03)00448-0
8. Merino E. // Chem. Soc. Rev. 2011. Vol. 40. N 7.
23. Singh S., Chauhan P., Ravi M., Taneja I., Wahajuddin,
P. 3835. doi 10.1039/c0cs00183j
Yadav P.P. // RSC Adv. 2015. Vol. 5. N 76. P. 61876. doi
10.1039/c5ra12535a
9. Kano N., Komatsu F., Kawashima T. // Chem. Lett.
2001. N 4. P. 338. doi:10.1246/cl.2001.338
24. John A.A., Lin Q. // J. Org. Chem. 2017. Vol. 82. N 18.
P. 9873. doi 10.1021/acs.joc.7b01530
10. Kano N., Komatsu F., Kawashima T. // J. Am. Chem.
Soc. 2001. Vol. 123. N 43. P. 10778. doi 10.1021/
25. Zhang C., Jiao N. // Angew. Chem. Int. Ed. 2010.
ja0165739
Vol. 49. N 35. P. 6174. doi 10.1002/anie.201001651
11. Kano N., Yamamura M., Komatsu F., Kawashima T. //
26. Wang J., He J., Zhi C., Luo B., Li X., Pan Y., Cao X.,
J. Organomet. Chem. 2003. Vol. 686. N 1-2. P. 192. doi
Gu H. // RSC Adv. 2014. Vol. 4. N 32. P. 16607. doi
10.1016/S0022-328X(03)00447-9
10.1039/c4ra00749b
12. Kano N., Yamamura M., Kawashima T. // J. Am. Chem.
27. Rajashekhar Reddy C.B., Rajasekhara Reddy S., Nai-
du S. // Catal. Comm. 2014. Vol. 56. P. 50. doi 10.1016/j.
Soc. 2004. Vol. 126. N 20. P. 6250. doi 10.1021/
catcom.2014.06.025
ja037404m
28. Cai S., Rong H., Yu X., Liu X., Wang D., He W., Li Y. //
13. Kano N., Komatsu F., Yamamura M., Kawashima T. //
ACS Catal. 2013. Vol. 3. N 4. P. 478. doi 10.1021/
J. Am. Chem. Soc. 2006. Vol. 128. N 21. P. 7097. doi
cs300707y
10.1021/ja060926s
29. Hudwekar A.D., Verma P.K., Kour J., Balgotra S.,
14. Yamamura M., Kano N., Kawashima T. // J. Organo-
Sawant S.D. // Eur. J. Org. Chem. 2019. N 6. P. 1242.
metal. Chem. 2007. Vol. 692. N. 1-3. P. 313. doi
doi 10.1002/ejoc.201801610
10.1016/j.jorganchem.2006.08.045
30. Knolker H.-J. // J. prakt. Chem. 1996. Bd 338. N 1.
15. Yamamura M., Kano N., Kawashima T., Matsumoto T.,
S. 190. doi 10.1002/prac.19963380138
Harada J., Ogawa K. // J. Org. Chem. 2008. Vol. 73.
N 21. P. 8244. doi 10.1021/jo801334a
31. Albini A. // Synthesis. 1993. N 3. P. 263. doi 10.1055/s-
1993-25843
16. Yamamura M., Kano N., Kawashima T. // Z. anorg. allg.
Chem. 2009. Vol. 635. N 9-10. P. 1295. doi 10.1002/
32. Зацепин Т.С., Качалова А.В., Романова Е.А., Стецен-
zaac.200900024
ко Д.А., Гейт М.Дж., Орецкая Т.С. // Биоорг. хим.
2001. 27. № 1. С. 45; Zatsepin T.S., Kachalova A.V., Ro-
17. Kakiage K., Yamamura M., Kyomen T., Unno M.,
manova E.A., Stetsenko D.A., Gait M.J., Oretskaya T.S. //
Hanaya M. // Key Eng. Mat. 2012. Vol. 497. P. 61. doi
Russ. J. Bioorg. Chem. 2001. Vol. 27. N 1. P. 39. doi
10.1023/A:1009579002330
18. Kano N., Yamamura M., Kawashima T. // Dalton Trans.
33. Hamada Y., Yamamoto Y., Shimizu H. // J. Organomet.
2015. Vol. 44. N 37. P. 16256. doi 10.1039/C5DT02038G
Chem. 1996. Vol. 510. N 1-2. P. l. doi 10.1016/0022-
19. Chuit C., Corriu R.J.P., Reye C., Young J.C. //
328X(95)05821-6
Chem. Rev. 1993. Vol. 93. N 4. P. 1371. doi 10.1021/
34. Armarego W.L.F. Purification of Laboratory Chemicals.
cr00020a003
Burlingto: Elsevier, 2009. 743 p.
20. Kost D., Kalikhman I. // Acc. Chem. Res. 2009. Vol. 42.
35. Казакова В.В., Горбацевич О.Б., Скворцова С.А.,
N 2. P. 303. doi 10.1021/ar800151k
Демченко Н.В., Музафаров А.М. // Изв. АН. Cер.
21. Xu Z., Huanga W.-S., Zhanga J., Xu L.-W. // Synthesis.
хим. 2005. № 5. С. 1309; Kazakova V.V., Gorbatse-
2015. Vol. 47. N 23. P. 3645. doi 10.1055/s-0035-
vich O.B., Skvortsova S.A., Demchenko N.V., Muzafa-
1560646
rov A.M. // Russ. Chem. Bull. 2005. Vol. 54. N 5.
22. Kakiuchi F., Matsumoto M., Tsuchiya K., Igi K.,
P. 1350. doi 10.1007/s11172-005-0409-y
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 1 2020
110
ЛАЗАРЕВА, ГОСТЕВСКИЙ
Synthesis of 2,2'-Bis(silyl)azobenzenes
by Oxidation of 2-(Silyl)anilines
N. F. Lazareva* and B. A. Gostevskii
A.E. Favorskii Irkutsk Institute of Chemistry, Siberian Branch of the Russian Academy of Sciences,
ul. Favorskogo 1, Irkutsk, 664033 Russia
*e-mail: nataly_lazareva@irioch.irk.ru
Received June 20, 2019; revised June 20, 2019; accepted June 25, 2019
A method was developed for the synthesis of 2,2'-bis(trimethylsilyl)- and 2,2'-bis(triethoxysilyl)azobenzenes
based on oxidation of 2-(silyl)anilines with trimethylamine and N-methylmorpholine oxide in the presence of
CuX (X = Cl, Br) .
Keywords: 2-(silyl)anilines, oxidation, 2,2'-bis(trimethylsilyl)azobenzene, 2,2'-bis(triethoxysilyl)azobenzene
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 1 2020