ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2020, том 90, № 1, с. 117-121
УДК 547.722:543.341
НЕКОТОРЫЕ ПРЕВРАЩЕНИЯ МОНО- И
ДИХЛОРФОСФОНУКСУСНОГО АЛЬДЕГИДА
© 2020 г. В. М. Исмаиловa, Г. Э. Аллахвердиеваb, Н. Д. Садыховаa, И. А. Мамедовa, Н. Н. Юсубовa,*
a Бакинский государственный университет, ул. З. Халилова 23, Баку, AZ 1148 Азербайджан
b Гянджинский государственный университет, Гянджа, AZ 2001 Азербайджан
*е-mail: yniftali@gmail.ru
Поступило в Редакцию 28 декабря 2018 г.
После доработки 13 ноября 2019 г.
Принято к печати 15 ноября 2019 г.
Изучены реакции присоединения спиртов и диалкилфосфитов по карбонильной группе дихлорфосфо-
нуксусного альдегида. Получены α-хлорэфир, ацетали и фосфорилированные производные хлорофоса.
Установлено, что дихлорсодержащие α-фосфорилированные карбонильные соединения под действием
оснований подвергается галоформному распаду. Показано, что моно- и дихлорфосфонуксусный альде-
гиды с триэтилфосфитом вступают в реакцию Перкова с образованием β-(диэтоксифосфато)винилфос-
фоната.
Ключевые слова: фосфонуксусный альдегид, алкоксивинилфосфонаты, галоформный распад, хлорэфир,
ацеталь, хлорофос
DOI: 10.31857/S0044460X2001014X
α-Фосфорилированные альдегиды являются
до настоящего времени являются трудоемкими и
удобными сырьевыми продуктами для решения
малоизученными [4-6]. C этой точки зрения, изу-
фундаментальных проблем химии фосфор-
чение реакционной способности моно- и дихлор-
органических соединений. В последнее время
фосфонуксусного альдегидов, которые по своей
среди замещенных α-фосфорилированных альде-
природе являются фосфорилированными произво-
гидов большое внимание привлекают их галоид-
дными хлораля, представляют интерес в органиче-
замещенные производные, поскольку введение
ском синтезе.
галогена в молекулу альдегида обеспечивает по-
В настоящей работе рассмотрены некоторые
явление дополнительных центров координации и
превращения моно- и дихлорфосфонуксусного
открывает пути к синтезу различных типов фосфо-
альдегида под действием спиртов, спиртовых рас-
рорганических соединений.
творов щелочи, диалкилфосфитов, триалкилфос-
Синтез монохлорфосфонмонохлоруксусного
фитов и сухого алкоголята с участием карбониль-
альдегида с низким выходом осуществлен путем
ной группы.
формилирования хлорметилфосфоната этилфор-
Диэтиловый эфир фосфондихлоруксусного аль-
миатом в присутствии металлического натрия [1].
дегида 2 легко присоединяет спирты с образовани-
Позже был предложен простой препаративный ме-
ем полуацеталя 3, который является стабильным
тод синтеза моно- (1) и дихлорфосфонуксусного
при комнатной температуре, и лишь при темпера-
(2) альдегидов путем хлорирования фосфонуксус-
туре свыше 50° распадается на исходный альдегид
ного альдегида молекулярным хлором на холоду
и спирт. Структура полуацеталя подтверждена
[2, 3]. В последние годы в результате систематиче-
данными ИК спектроскопии (отсутствует поло-
ских исследований на основе монохлорфосфори-
са поглощения карбонильной группы, имеются
лированных альдегидов получен целый ряд гете-
полосы поглощения гидроксильной группы при
роциклических систем, способы синтеза которых
3300-3600 см-1), а также рядом химических пре-
117
118
ИСМАИЛОВ и др.
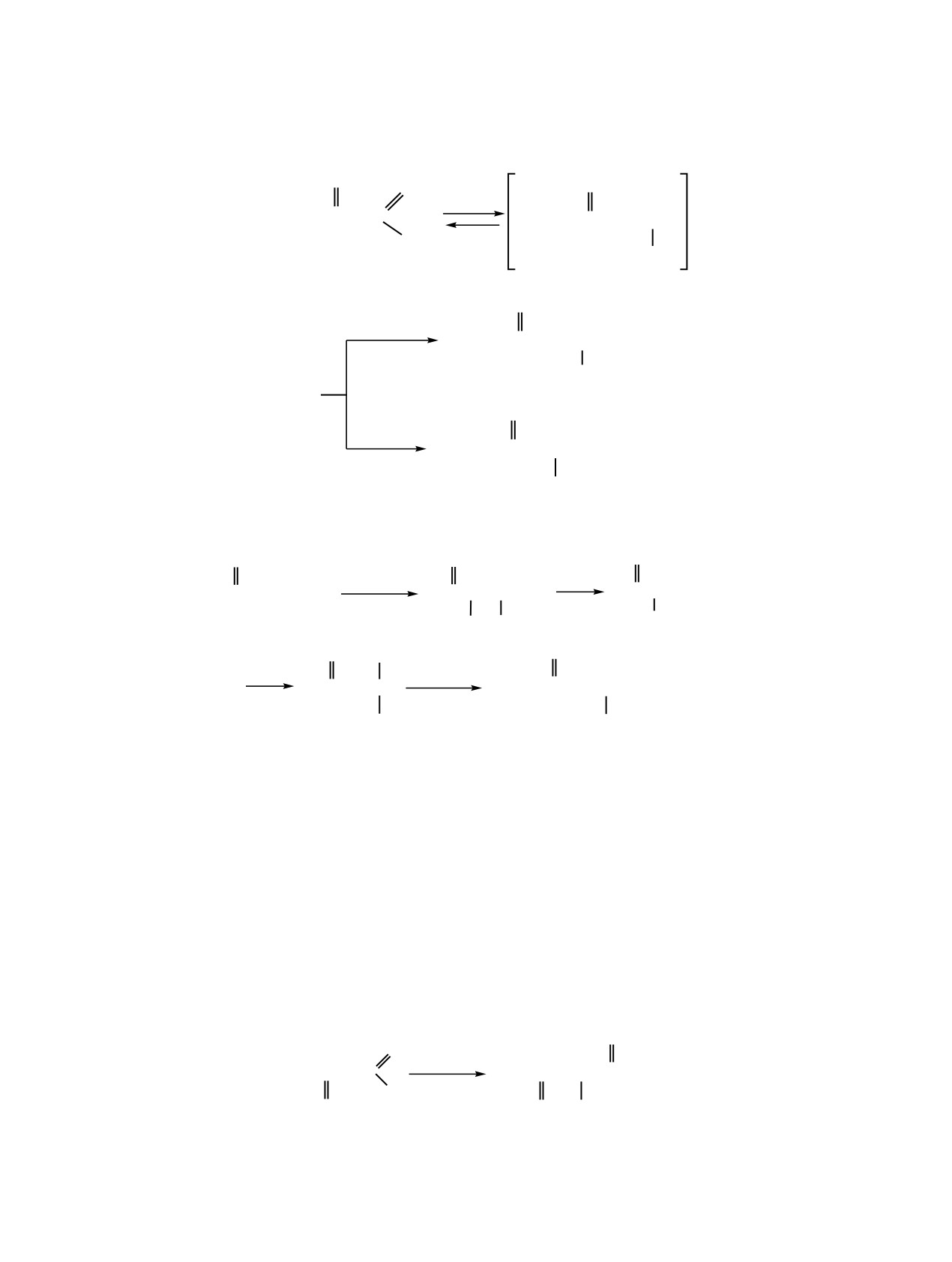
Схема 1.
O
O
O
C2H5OH
C
(C2H5O)2PC(Cl)2
(C2H5O)2PC(Cl)2CHOEt
H
OH
2
3
O
SOCl2
(C2H5O)2PC(Cl)2CHOEt
NEt3
4
Cl
O
CH3COCl
(C2H5O)2PC(Cl)2CHOEt
NEt
3
OCOCH3
5
Схема 2.
O
O
O
Cl2, 120qC
Cl2P CH=CH OEt
Cl2P CH CH OEt
Cl2P C=CH OEt
HCl
Cl
Cl
Cl
O
Cl
O
Cl2
2EtOH
Cl2P CCl2CH
(C2H5O)2P CCl CH OEt
2Et
3N
OEt
Cl
6
4
вращений (схема 1). Так, обработка полуацеталя 2
через нагретый до 120°С дихлорангидрид β-эток-
хлористым тионилом на холоду приводит к заме-
сивинилфосфоновой кислоты в результате после-
щению гидроксильной группы на хлор с образова-
довательных реакций хлорирования по кратной
нием диэтилового эфира α,α,β-трихлор-β-этокси-
связи и дегидрохлорирования образуется дихло-
этилфосфоновой кислоты 4, который является
рангидрид α,α,β-трихлор-β-этоксиэтилфосфоно-
устойчивым даже при длительном нагревании
вой кислоты 6, алкоголиз которого в присутствии
(120-150°С, 2 ч). Ацилированием полуацеталя в
третичного амина дает соединение 4 (схема 2).
присутствии третичного амина получен ацилаль 5.
Следует отметить, что соединения
4 и
5
α-Хлорэфир 4 был также получен встречным
обладают повышенной фибриолиотической актив-
синтезом. При пропускании молекулярного хлора
ностью.
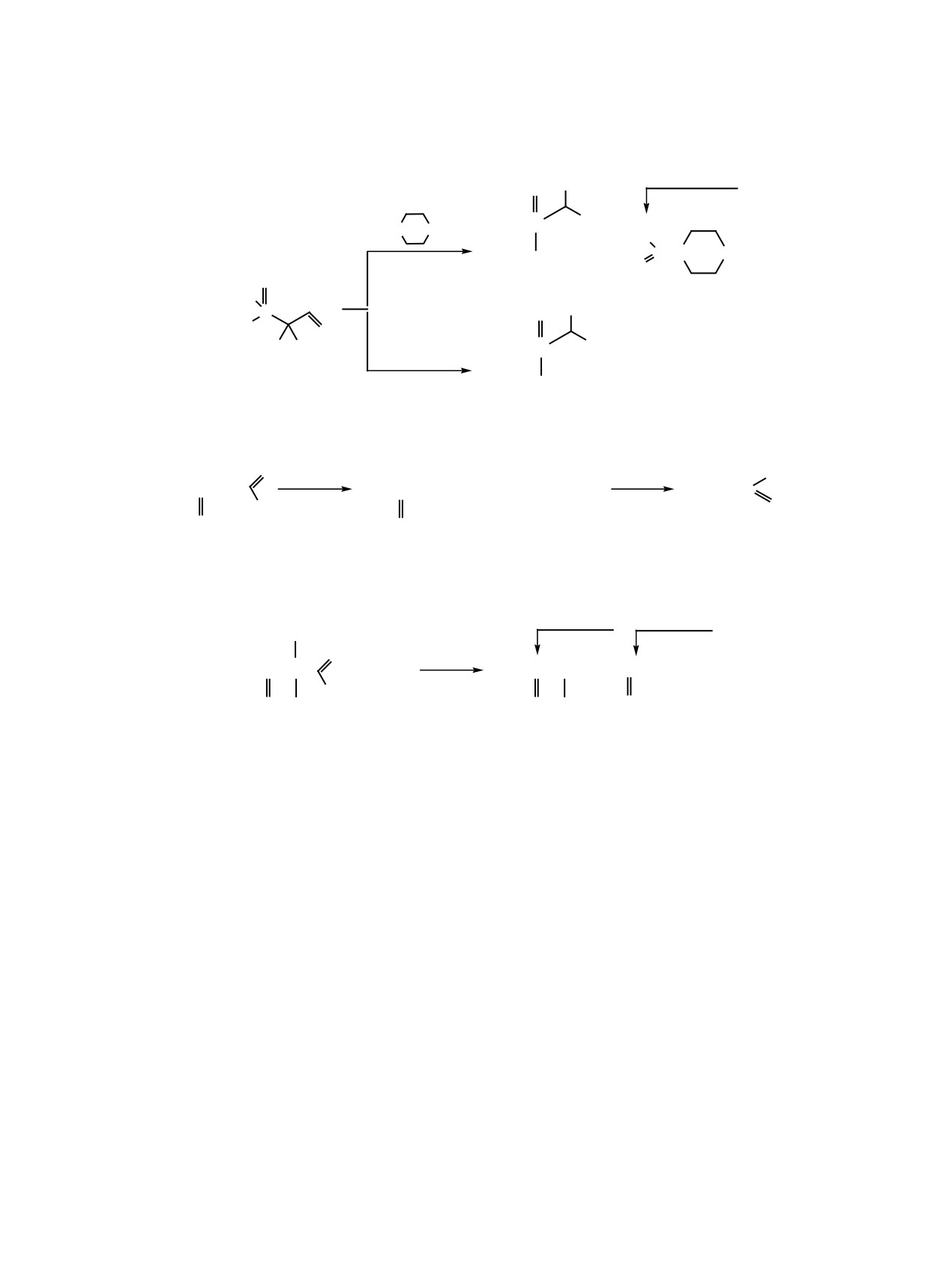
Схема 3.
O
O
(EtO)2PHO
(EtO)2PCCl2C
(EtO)2PCCl2CH P(OEt)2
H
O
O
OH
2
7
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 1 2020
НЕКОТОРЫЕ ПРЕВР
АЩЕНИЯ МОНО- И ДИХЛОРФОСФОНУКСУСНОГО АЛЬДЕГИДА
119
Схема 4.
GH = 7.85 ɦ. ɞ.
Cl
O
C2H5O P
Cl
HN O
H
+
C N O
OC2H5
O
O
8
C2H5O
P
O Cl
C
2H5O
O
Cl Cl
C2H5O P
Cl
EtOH + NaOH
2
OC
2H5
8
Схема 5.
O
C2H5ONa
H
HCl
(EtO)2PCCl2C
(EtO)2P OC2H5 + [CCl2=CH ONa]
HCCl2
C
Et2O, 36qC
O
H
O
O
9
10
Схема 6.
GP = 8.4 ɦ. ɞ.
GP =
5.4 ɦ. ɞ.
Cl
O
(EtO)2P C
+ (EtO)3P
(EtO)2P C=CH
OP(OEt)2
H
O R
O R
O
1, 2
ɚ,
ɛ
R = H (1, ɚ), Cl (2, ɛ).
Хлорсодержащие фосфонуксусные альдегиды
образованием триэтилфосфата 9 и енолята натрия
легко вступают в реакцию Абрамова с образова-
CCl2=CHONa, подкислением которого разбавлен-
нием оксидифосфоната 7, который можно рас-
ной HCl получен дихлоруксусный альдегид 10
сматривать как фосфорилированное производное
(схема 5).
хлорофоса и может быть использован в сельском
Подобно хлоралю моно- и дихлорфосфонук-
хозяйстве в качестве инсектицидов (схема 3).
сусные альдегиды реагируют с триэтилфосфитом
Под действием спиртовых растворов щелочи
по схеме реакции Перкова, образуя β-(диэтокси-
или аминов фосфондихлоруксусные альдегиды
фосфато)винилфосфонаты 11, которые, по дан-
подвергаются галоформному распаду по связи
ным ЯМР, имеют транс-строение (3JHH = 14.0 Гц)
Сα-Сβс образованием диалкиловых эфиров ди-
(схема 6).
хлорметилфосфонатов 8. В случае вторичных ами-
Таким образом, хлорированные фосфонуксус-
нов наблюдается их формилирование (схема 4).
ные альдегиды по своим химическим свойствам
В противоположность этому, фосфондихло-
проявляют аналогию с хлоралем и вступают в ре-
руксусный альдегид 2 с сухим алкоголятом натрия
акции присоединения по карбонильной группе,
в гетерогенных условиях подвергается расщепле-
галоформного распада и Перкова. Установлено,
нию по связи Р-С (без затрагивания Сα-Сβ связи) с
что под действием сухого алкоголята имеет место
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 1 2020
120
ИСМАИЛОВ и др.
расщепление Р-С связи с образованием триэтил-
этоксиэтилфосфоновой кислоты, 2.1 г (0.02 моль)
фосфата.
триэтиламина в 100 мл эфира при интенсивном пе-
ремешивании и охлаждении ледяной водой добав-
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
ляли 10 мл этилового спирта. Полученную смесь
перемешивали 2 ч при комнатной температуре,
Спектры ЯМР 1Н и 13С записывали на приборе
затем столько же при кипении эфира. Выпавшую
Bruker-300 (300 и 75 Гц), внутренний стандарт -
соль амина отфильтровывали, растворитель удаля-
ГМСД. ИК спектры регистрировали на приборе
ли. Остаток фракционировали. Выход 3.2 г (64%),
Specord-75-IR в вазелиновом масле.
т. кип. 106-108°С (0.5 мм рт. ст), d420 1.3134, nD20
Синтез диэтилового эфира α,α,β-трихлор-β-
1.4657.
этоксиэтилфосфоновой кислоты (4). К смеси
1,1-Дихлор-2-гидрокси-1,2-тетраэтокси-
10 г диэтилового эфира фосфондихлоруксусного
дифосфоноэтан (7). При перемешивании и охлаж-
альдегида, 2.8 мл этилового спирта и 5 г триэти-
дении (5-8°С) к 6.2 г дихлордиэтоксифосфонук-
ламина в 50 мл бензола при охлаждении (0-5°С)
сусного альдегида добавляли 2.7 г диэтилфосфо-
прибавляли 3.2 г SOCl2. Полученную смесь выдер-
ристой кислоты. Смесь выдерживали 3 ч при 50-
живали 3 ч при 30-40°С, затем отделяли осадок.
60°С, затем вакуумировали при 60-80°С. Выход
Из фильтрата отгоняли растворитель. Выход 8.2 г
5 г (70%). Спектр ЯМР 1Н (CDCl3), δ, м. д. (J, Гц):
(58%), т. кип. 105-108°С (0.5 мм рт. ст.), d420 1.3113,
1.15-1.25 м (12Н, СН3), 3.95-4.15 м (8Н, ОСН2),
nD20 1.4670. Спектр ЯМР 1Н (CDCl3) δ, м. д. (J, Гц):
3.36 д (1H, PCH, 2JHP = 18.0). Найдено, %: P 16.21;
1.1-1.25 м (9Н, СН3), 3.85-4.02 м (6Н, ОСН2), 5.85
Cl 18.62. С10Н22Сl2P2O. Вычислено,%: P 16.02; Cl
д (1Н, СН, 2JHP = 2.0). Найдено,%: Cl 33.44; P 9.77.
18.33.
C8H16Cl3O4P. Вычислено, %: Cl 33.97; P 9.89.
Диэтиловый эфир дихлорметилфосфоновой
Диэтиловый эфир α,α-дихлор-β-этокси-β-
кислоты (8). а. К раствору 1.6 г NaOH в 20 мл
ацетоксиэтилфосфоновой кислоты (5) получали
спирта добавляли 10 г диэтоксифосфондихлорук-
аналогично из 25 г диэтоксифосфондихлоруксус-
сусного альдегида. Происходит выделение тепла
ного альдегида, 11 мл этилового спирта, 6.7 г пири-
и образование осадка. Соль отфильтровывали, из
дина и 6.6 г хлористого ацетила. Выход 22 г (71%),
фильтрата выделяли 7 г (88%) диэтилового эфи-
т. кип. 120-121°С (0.5 мм рт. ст.), d420 1.2724, nD20
ра дихлорметилфосфоновой кислоты с т. кип.
1.4565. Спектр ЯМР 1Н (CDCl3), δ, м. д. (J, Гц): 1.1
77-79°С (0.5 мм рт. ст.), d420 1.2808, nD20 1.4520.
т (3Н, СН3, 3JHH = 6.9), 1.25 т (6Н, СН3, 3JHH = 7.2),
Спектр ЯМР 1Н (СDCl3), δ, м. д. (J, Гц): 1.5 т (6Н,
2.1 с (3Н, СН3СО), 3.75 м (2Н, ОСН2), 4.1 м (4Н,
СН3, 3JHH = 7.1), 4.3 м (4Н, ОСН3, 3JHH = 7.1), 5.5
ОСН2), 5.95 д (1Н, CH, 2JHP = 2.0). Найдено,%: Cl
д (1Н, СН, 2JHP = 12.7). Cпектр ЯМР 13С, δС, м. д.:
23.54; Р 10.55. С10Н19Cl2O6P. Вычислено,%: Cl
16.61 (СН3), 61.57 (СН), 65.39 (СН2). Найдено, %:
21.06; Р 10.54.
Р 14.21; Cl 31.65. C5H11Cl2O3P. Вычислено, %: P
Дихлорангидрид α,α,β-трихлор-β-этокси-
14.09; Cl 31.81.
этилфосфоновой кислоты (6). Через 10 г дихло-
б. К смеси 12 г диэтилового эфира фосфон-
рангидрида β-этоксивинилфосфоновой кислоты,
дихлоруксусного альдегида в 30 мл бензола добав-
нагретой до 120°С, пропускали ток сухого хлора
ляли 2.7 мл этилового спирта, затем 5 мл морфо-
в течение 2-3 ч, затем смесь фракционировали.
лина. Смесь перемешивали 2 ч при 40-60°С, затем
Выход 51%, т. кип. 89-90°С (0.2 мм рт. ст.), т. пл.
отгоняли растворитель. Остаток фракционирова-
48°С. Спектр ЯМР 1Н δ, м. д. (J, Гц): 1.22 т (3Н,
ли. Выход 13.7 (72%), т. кип. 77-78°С (0.5 мм рт.
СН3, 3JHH = 6.9), 3.75 м (2H, CH2O), 5.75 c (1H).
ст.), d420 1.2826, nD20 1.4511.
Найдено,%: P 3.67; Cl 22.14. C4H6Cl5PO2. P 3.82;
Реакция
диэтоксфосфондихлоруксусного
Cl 21.90.
альдегида сухим этилатом натрия. К смеси 5 г
Алкоголиз дихлорангидрида α,α,β-трихлор-
свежеприготовленного этилата натрия в 20 мл диэ-
β-этоксиэтилфосфоновой кислоты. К смеси 5 г
тилового эфира прибавляли 23 г диэтоксифосфон-
(0.02 моль) дихлорангидрида α,α,β-трихлор-β-
дихлоруксусного альдегида. При повышении тем-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 1 2020
НЕКОТОРЫЕ ПРЕВР
АЩЕНИЯ МОНО- И ДИХЛОРФОСФОНУКСУСНОГО АЛЬДЕГИДА
121
пературы до 34°С смесь бурно закипает. Осадок
(J, Гц): 82.6 (РС=, 1JCP = 158.0), 163.5 (=CO, 2JCP =
отфильтровывали. Из эфирного раствора получи-
20.0). Найдено,%: P 17.54; Cl 10.23. С10Н21О7Р2Cl.
ли триэтилфосфат (9). Выход 19.6 г (70%), т. кип.
Вычислено, %: С 34.23; Н 5.99; Р 17.68; Cl 10.12.
50-51°С (1 мм рт. ст.), d420 1.1007, nD20 1.4085 [7].
КОНФЛИКТ ИНТЕРЕСОВ
Осадок подкисляли разбавленной соляной кис-
Авторы заявляют об отсутствии конфликта
лотой. Получили 4.9 г (41%) дихлоруксусного
интересов.
альдегида (10) с т. кип. 90-92°С, d420 1.3740, nD20
1.4290 [8].
СПИСОК ЛИТЕРАТУРЫ
Диэтиловый эфир β-(диэтилфосфорилокси)
1. Иоффе С.Т., Вацуро К.В., Петровский П.В., Кабач-
винилфосфоновой кислоты
(11а). При пере-
ник М.И. // Изв. АН СССР. Сер. хим. 1971. № 4.
С. 731
мешивании и охлаждении (5-10°С) к смеси 6.5 г
2. Исмаилов В.М., Москва В.В., Дадашова Л.А., Зыко-
(0.02 моль) соединения 1 в 100 мл диоксана до-
ва Т.В., Гусейнов Ф.И. // ЖОХ. 1982. Т. 52. № 9.
бавляли 3.5 г (0.02 моль) триэтилфосфита. Смесь
С. 2140.
перемешивали 1 ч при комнатной температуре и
3. Исмаилов В.М., Москва В.В., Зыкова Т.В. // ЖОХ.
2-3 ч при 60-80°С. После удаления растворителя
1983. Т. 53. № 12. С. 2763.
4. Асадов Х.А., Бурангулова Р.Н., Гусейнов Ф.И. //
из остатка получили соединение 11а. Выход 6.4 г
ХГС. 2003. № 5. С. 772; Asadov Kh.A., Burangulo-
(76%), т. кип. 144-145°С (0.1 мм рт. ст.), nD20 1.4260.
va R.N., Guseinov F.I. // Chem. Heterocycl. Compd. 2003.
Спектр ЯМР 1Н (CDCl3) δ, м. д. (J, Гц): 1.15-1.25
Vol. 39. N 5. P. 671. doi 10.1023/A:1025118804568
м (12Н, СН3, 3JHH = 6.9), 4.01-4.20 м (8Н, 4ОСН2),
5. Асадов Х.А., Гуревич П.А., Егорова Е.А., Бурангуло-
5.4 д. д (1Н, РСН=, 3JHH = 14.0, 2JHP = 10.0), 7.20 д.
ва Р.Н., Гусейнов Ф.И. // ХГС. 2003. № 11. С. 1727;
д. д (1H, =CHO, 3JHH = 14.0, 3JHP = 6.5, 3JHP = 12.0).
Asadov Kh.A.,Gurevich P.A., Egorova E.F., Burangulo-
va R.N., Guseinov F.N. // Chem. Heterocycl.
Найдено, %: С 37.68; Н 10.12; Р 19.76. C10H22O7P2.
Compd. 2003. Vol. 39. N 11. P 1521. doi10.1023/
Вычислено, %: С 37.97; Н 9.96; Р 19.62.
B:COHC.0000014418.16494.f8
Диэтиловый эфир (α-хлор-β-диэтилфосфо-
6. Асадов Х.А. // Ж. хим. проблем. Баку. 2018. № 4.
рилокси)винилфосфоновой кислоты (11б) полу-
С. 601.
7. Нифантьев Э.Е. Химия фосфорорганических сое-
чали аналогично. Выход 7.9 г (82%), т. кип. 147-
динений. М.: МГУ, 1971. С. 154.
148°С (0.1 мм рт. ст.), nD20 1.4480. Спектр ЯМР 1Н
8. Jira R., Kopp E., McKusick B., Röderer G., Bosch A.,
(СDCl3), δ, м. д. (J, Гц): 1.25 т (6Н, СН3, 3JHH = 7.2),
Fleischeman G. Chloroacetaldehydes. Weinheim:
1.30 т (6Н, СН3, 3JHH = 7.1), 4.02 м (8Н, ОСН2), 7.2
Wiley-VCH, 2007. P. 125. doi 10.1002/14356007.
к (1Н, СН=, 3JHP = 9.0). Спектр ЯМР 13С, δС, м. д.
a06_527.pub.2
Some Transformations of Mono-
and Dichlorophosphonoacetaldehyde
V. M. Ismailova, G. E. Allahverdievab, N. D. Sadikhovaa, I. A. Mamedova, and N. N. Yusubova,*
a Baku State University, ul. Z. Halilova 23, Baku, AZ 1148 Azerbaijan
b Ganja State University, Ganja, AZ 2001 Azerbaijan
*e-mail: yniftali@gmail.ru
Received December 28, 2018; revised November 13, 2019; accepted November 15, 2019
The reactions of addition of alcohols and dialkyl phosphites at the carbonyl group of dichlorophosphonoacetic
aldehyde were studied. α-Chloroether, acetals and phosphorylated derivatives of chlorophos were obtained.
Dichloro-containing α-phosphorylated carbonyl compounds were found to undergo haloform decomposition
under the action of bases. It was shown that the Perkov reaction between mono- and dichlorophosphonoacetic
aldehydes and triethyl phosphite led to the formation of β-(diethoxyphosphato)vinylphosphonate.
Keywords: phosphonoacetic aldehyde, alkoxyvinylphosphonates, haloform decomposition, chloroester, acetal,
chlorophos
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 1 2020