ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2020, том 90, № 1, с. 129-135
К 80-летию со дня рождения Р. А. Черкасова
УДК 547.639.5;547.791.1;543.429.23
СИНТЕЗ ВОДОРАСТВОРИМОГО
ПОЛИАММОНИЙНОГО ПРОИЗВОДНОГО
ТИАКАЛИКС[4]АРЕНА И ЕГО ВЗАИМОДЕЙСТВИЕ
С ДНК ТИМУСА ТЕЛЕНКА
© 2020 г. В. А. Буриловa,*, Д. А. Мироноваa, И. А. Григорьевa, А. М. Валияхметоваa,
С. Е. Соловьеваb, И. С. Антипинa
а Казанский (Приволжский) федеральный университет, ул. Кремлевская 18, Казань, 420008 Россия,
b Институт органической и физической химии им. А.Е. Арбузова, Федеральный исследовательский центр
“Казанский научный центр Российской академии наук”, Казань, 420088 Россия
*e-mail: ultrav@bk.ru
Поступило в Редакцию 21 июня 2019 г.
После доработки 21 июня 2019 г.
Принято к печати 25 июня 2019 г.
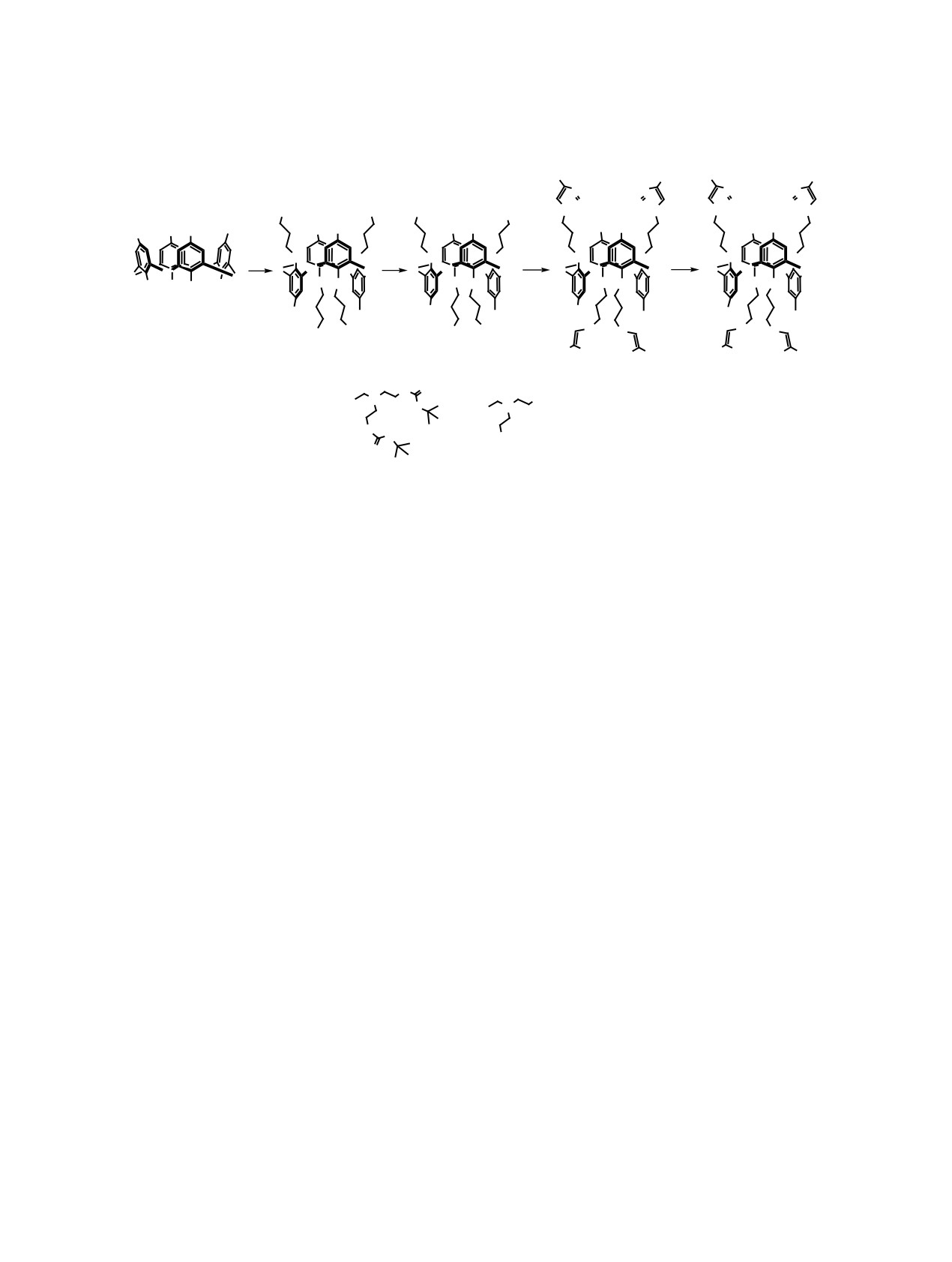
Впервые получено водорастворимое производное тиакаликс[4]арена в стереоизомерной форме
1,3-альтернат, содержащее четыре диэтилентриаминовых фрагмента. С использованием бромистого
этидия установлено, что полученный макроцикл способен взаимодействовать с ДНК тимуса теленка.
Обнаружено, что макроцикл взаимодействует с ДНК путем бороздочного связывания. Закрепление
четырех диэтилентриаминовых фрагментов на платформе каликсарена приводит к мультивалентным
взаимодействиям, в результате чего наблюдается рост константы связывания с ДНК на два порядка по
сравнению с индивидуальным диэтилентриамином.
Ключевые слова: каликс[4]арен, дезоксирибонуклеиновая кислота, флуориметрия, бромистый этидий
DOI: 10.31857/S0044460X20010163
В настоящее время внимание многих иссле-
кая функционализация верхнего и нижнего обода
довательских групп направлено на процессы не-
позволяют использовать каликсарены в качестве
ковалентного распознавания и связывания ДНК
универсальной молекулярной платформы для соз-
синтетическими молекулами [1]. Известно, что
дания молекулярных рецепторов, экстрагентов,
многие терапевтические агенты, в частности про-
стимул-чувствительных коллоидных систем и т.д.
тивораковые лекарственные средства, взаимодей-
[3, 4]. Ранее в нашей исследовательской группе
ствуют с нуклеиновыми кислотами через неко-
было показано, что амфифильные полиаминные
валентные связывания, такие как интеркаляция
производные п-трет-бутилтиакаликс[4]арена в
между парами оснований, связывание малыми/
стереоизомерной форме 1,3-альтернат являются
большими бороздками, внешнее связывание и
эффективными агентами для компактизации ДНК
сложные комбинированные взаимодействия [2].
[5]. Продолжая исследования в данной области, в
Поэтому поиск молекул, способных эффективно и
настоящей работе представлен синтез водораство-
избирательно взаимодействовать с нуклеиновыми
римого производного тиакаликс[4]арена, содержа-
кислотами, по-прежнему имеет решающее значе-
ние. Каликс[n]арены и их тиа-аналоги являются
щего четыре диэтилентриаминовых фрагмента в
широко распространенными макроциклическими
стереоизомерной форме 1,3-альтернат и исследо-
молекулами с весьма разнообразными свойствами.
вание его взаимодействия с модельной ДНК тиму-
Наличие нескольких стереоизомерных форм и лег-
са теленка.
129
130
БУРИЛОВ и др.
Схема 1.
R1
R1
R2
R2
N
N
N
N
N
N
N
N
Br
Br
N3
N3
N
N
N
N
t-Bu
t-Bu
t-Bu
t-Bu
t-Bu
t-Bu
t-Bu
t-Bu
t-Bu
t-Bu
t-Bu
t-Bu
O
O
O
O
O
O
O
O
ɚ
ɛ
ɜ
ɝ
S
S
S
S
S
S
S
S
S
S
S
S
S
S
S
S
S
S
S
S
O
O
O
O
O
O
O
O
OH OH HO
OH
1
t-Bu
t-Bu
t-Bu
t-Bu
t-Bu
t-Bu
t-Bu
t-Bu
Br
N3
N
N
Br
N3
N
N
N
N
2 (75%)
3 (73%)
N
N
R1
N
N R1
R2
N
N R2
4 (86%)
5 (95%)
H
N
O
N
NH2
R1 =
R2 =
N
O
,
·HCl
HN
O
NH
2
O
ɍɫɥɨɜɢɹ ɪɟɚɤɰɢɣ ɚ ɛɪɨɦɩɪɨɩɚɧ ɨɥ '($' 3K33 ɬɨɥɭɨɥ
ɋ ɱ ɛ) NaN3 ȾɆɎȺ
0: ȼɬ
ɋ ɱ ɜ) N,N ɛɢɫ> ɬɪɟɬ ɛɭɬɨɤɫɢɤɚɪɛɨɧɢɥɚɦɢɧɨ ɷɬɢɥ@ɩɪɨɩɚɪɝɢɥɚɦɢɧ
&X, (W31 ɬɨɥɭɨɥ
ɋ ɱ ɝ +&O ɞɢɨɤɫɚɧ
ɋ ɱ
Реакция Мицунобу является хорошей альтер-
пропаргиламином в присутствии йодида меди (I) в
нативой реакции Вильямсона для региоселектив-
толуоле и триазол 4 был выделен с выходом 86%.
ного синтеза тетразамещенных производных тиа-
В ИК спектре соединения 4 наблюдается интен-
каликс[4]арена в стереоизомерной форме 1,3-аль-
сивная характеристическая полоса при 1693 см-1,
тернат благодаря высоким выходам целевых про-
характерная для карбонильной группы. В спектре
дуктов, использованию эквимолярных количеств
ЯМР 1Н продукта 4 наблюдали синглет при 1.43 м.
реагентов и возможности проведения синтеза при
д., соответствующий сигналу протонов трет-бу-
тильных заместителей трет-бутоксикарбониль-
невысоких температурах за относительно неболь-
ного фрагмента, триплеты при 2.56 и 3.15 м. д. с
шой промежуток времени [6]. Так, при взаимодей-
J = 5.8 Гц, соответствующие сигналам протонов
ствии п-трет-бутилтиакаликс[4]арена и 3-бром-
метиленовых фрагментов диэтилентриаминового
пропан-1-ола в системе DEAD/Ph3P при нагреве
фрагмента, синглет при 4.87 м. д., соответствую-
70°C в течение 15 ч было получено производное 2
щий сигналу протонов при азоте амидных групп
в стереоизомерной форме 1,3-альтернат (схема 1)
и синглет при 7.92 м. д., соответствующий сиг-
с выходом 75 %. Спектральные характеристики
налу протона при атоме С5 триазольного цикла.
продукта 2 полностью согласуется с литературны-
В масс-спектре МАЛДИ зафиксирован пик с m/z
ми данными [7].
2443 [M + Na]+.
Тетрабромид 2 был использован в реакции
Снятие защитной трет-бутоксикарбонильной
нуклеофильного замещения с азидом натрия.
группы в соединении 4 было осуществлено с ис-
Известная в литературе методика синтеза соеди-
пользованием соляной кислоты в диоксане, а целе-
нения 3 [8] была нами оптимизирована с исполь-
вой амин 5 был выделен с выходом 95% (схема 1).
зованием микроволнового нагрева, в результате
В ИК спектре соединения 5 наблюдается интенсив-
чего удалось сократить время реакции с 12 до 5 ч.
ная характеристическая полоса при 3425 см-1, ха-
Целевое соединение было получено с выходом
рактерная для аминогруппы. Отсутствие в спектре
73%. Спектральные характеристики продукта 3
ЯМР 1Н синглета при 1.43 м. д., соответствующего
полностью совпали с литературными данными [8].
сигналу протонов трет-бутильных заместителей
Полученный тетраазид 3 был использован в
трет-бутоксикарбонильного фрагмента, позво-
реакции азид-алкинового циклоприсоединения с
ляет сделать вывод об образовании целевого про-
N,N-бис[2-(трет-бутоксикарбониламино)этил]-
дукта. По данным элементного анализа и рН-ме-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 1 2020
CИНТЕЗ ВОДОР
АСТВОРИМОГО ПОЛИАММОНИЙНОГО ПРОИЗВОДНОГО
131
Ȝ ɧɦ
Ȝ ɧɦ
Рис. 1. Спектры флуоресценции EthBr (1) и системы
Рис. 2. Спектры флуоресценции EthBr (1) и системы
EthBr-ДНК ТТ (2) в отсутствие и присутствии раз-
EthBr-ДНК ТТ (2) в отсутствие и присутствии разных
ных количеств макроцикла 5. [EthBr] = 2 мкмоль/л,
количеств диэтилентриамина. [EthBr] = 2 мкмоль/л,
[ДНК ТТ] = 5 мкмоль/л, [5] = 0-5 мкмоль/л, [ТРИС] =
[ДНК ТТ] = 5 мкмоль/л, [диэтилентриамин] = 0-
50 ммоль/л, рН = 7.3.
300 мкмоль/л, [ТРИС] = 50 ммоль/л, рН = 7.3.
трического титрования, соединение 5 выделено в
щейся константы связывания ДНК ТТ с макроци-
виде тетрагидрохлорида. В масс-спектре МАЛДИ
клом (Kкаж) по уравнению (1).
наблюдается пик с m/z 1619 [M - 4HCl + H]+.
KEthBr[EthBr] = Kкаж[5],
(1)
Было изучено взаимодействие макроцикла 5 с
где значение KEthBr известно и составляет 4.94×
ДНК тимуса теленка (ДНК ТТ) - одной из самых
105 М.-1 [12], [5] - концентрация каликсарена 5,
распространенных модельных нуклеиновых кис-
при которой интенсивность эмиссии EthBr сни-
лот, широко используемых при изучении взаимо-
жается на 50%. Значение Kкаж составило 4.29×
действий с производными каликсаренов [9, 10].
105 М-1, что в два раза больше соответствующей
В качестве зонда для спектральных исследований
константы для известного биогенного полиамина
взаимодействия каликсарен 5-ДНК ТТ был выбран
спермидина (2.23×105 М.-1) [13].
органический краситель бромистый этидий (EthBr).
Для выявления вклада каликсареновой плат-
Известно, что EthBr интеркалирует ДНК за
формы в эффективность взаимодействия с ДНК
счет стекинга со спаренными парами оснований,
было также изучено взаимодействие ДНК ТТ с
при этом происходит гипсофлорный сдвиг мак-
диэтилентриамином, не закрепленным на ма-
симума флуоресценции EthBr, сопровождающий-
кроциклической платформе (рис.
2). Согласно
ся существенным увеличением интенсивности
данным флуориметрии с использованием EthBr,
флуоресценции [11]. При взаимодействии ДНК с
кажущаяся константа связывания ДНК ТТ с ди-
конкурентными молекулами часть EthBr вытесня-
этилентриамином составила 6.88×103 М.-1, а для
ется, что приводит к изменению его спектральных
полного высвобождения EthBr пришлось добавить
характеристик (прежде всего, уменьшению интен-
сивности флуоресценции). Согласно полученным
300 мкмоль/л диэтилентриамина, в то время как
данным (рис. 1), флуоресценция этидийбромиба
при использовании макроцикла 5 уже при его кон-
в системе EthBr-ДНК эффективно тушится при
центрации 5 мкмоль/л наблюдали полное высво-
увеличении концентрации макроцикла. Такой эф-
бождение EthBr. Таким образом, закрепление че-
фект однозначно свидетельствует о вытеснении
тырех диэтилентриаминовых фрагментов на плат-
молекул красителя из центров связывания в ДНК
форме каликсарена приводит к мультивалентным
и таким образом о взаимодействии макроцикла 5
взаимодействиям, в результате чего эффектив-
с ДНК ТТ.
ность взаимодействия с нуклеиновой кислотой су-
Анализ графика в координатах Штерна-
щественно возрастает, приводя к росту константы
Фольмера позволил рассчитать значение кажу-
связывания на два порядка по сравнению с диэти-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 1 2020
132
БУРИЛОВ и др.
лентриамином, не закрепленным на макроцикли-
ческой платформе.
Используя уравнение Штерна-Фольмера, ту-
шение флуоресценции в системе EthBr-ДНК в
присутствии каликсарена 5 может быть описано
уравнением (2).
(I0/I) = 1 + Kqτ0[D] = 1 + KSV[D],
(2)
где I0 и I интенсивность флуоресценции EthBr-
ДНК в отсутствие и присутствии макроцикла 5
соответственно, Kq - бимолекулярная константа
тушения, τ0 - время жизни EthBr в возбужденном
Ȝ ɧɦ
состоянии, KSV - константа Штерна-Фольмера,
[D] - концентрация тушителя.
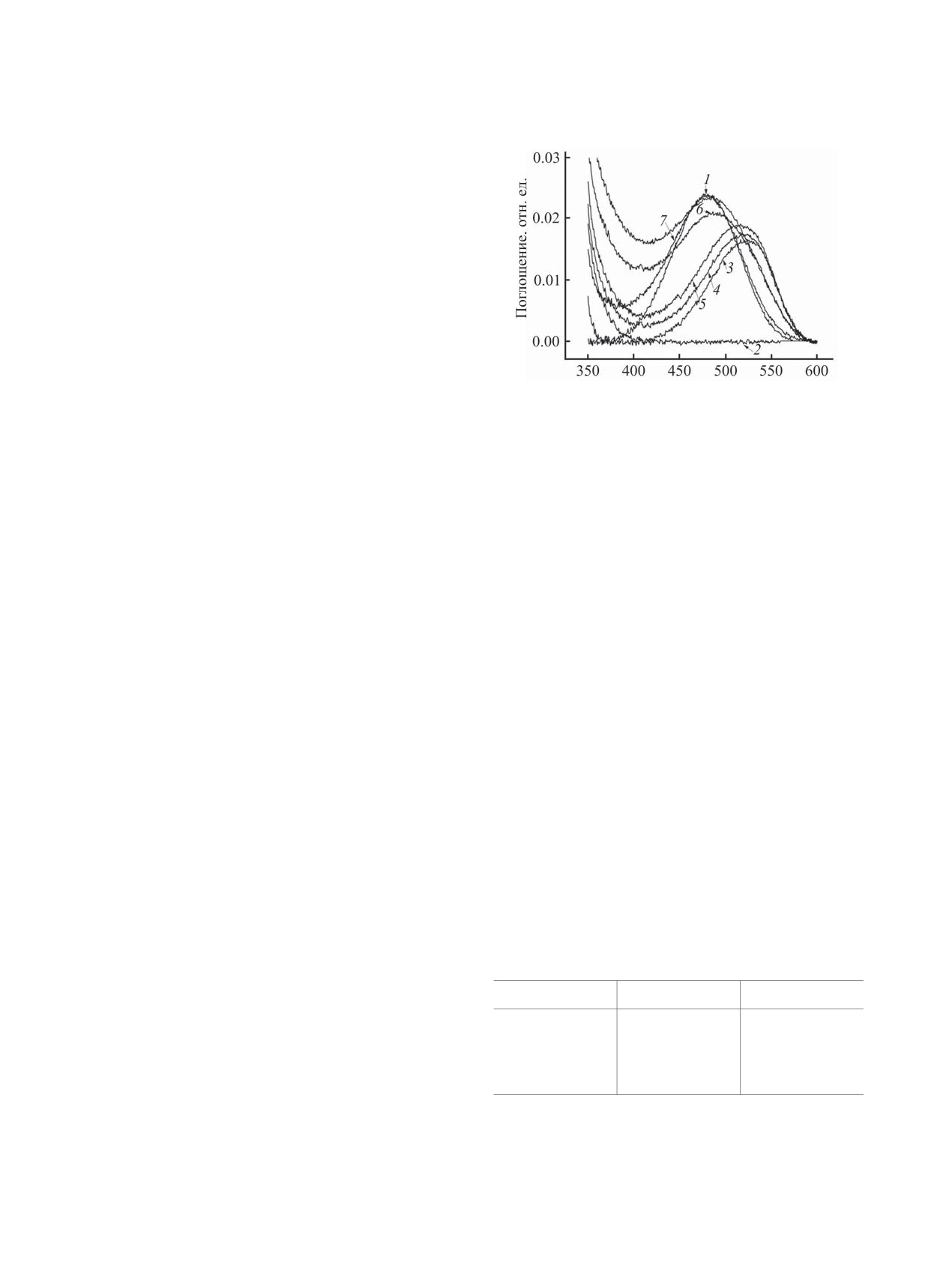
Рис. 3. Спектры поглощения свободного EthBr (1),
каликсарена 5 (2), двойной системы EthBr-ДНК ТТ (3)
Значение KSV было вычислено по наклону пря-
и тройной системы 5-EthBr-ДНК, содержащей 1 (4),
мой, полученной построением графика в коорди-
2 (5), 3 (6) или 4 (7) мкмоль/л каликсарена 5. [EthBr] =
натах Штерна-Фольмера (I0/I-[каликсарен]) и со-
2 мкмоль/л, [ДНК] = 5 мкмоль/л, [ТРИС] = 50 ммоль/л,
ставило 7.9×105 л/моль. Значение константы туше-
рН = 7.3.
ния составило 7.9×1012 л/(моль·с), что превышает
максимальное значение контролируемой диффу-
полностью соответствует поглощению свободного
зии в процессах тушения биологических макромо-
EthBr (рис. 3, 1). В пользу бороздочного связыва-
лекул [14]. Полученные данные свидетельствуют о
ния свидетельствуют также данные динамическо-
статическом механизме тушения.
го рассеяния света (см. таблицу).
Для системы макроцикл 5-EthBr-ДНК ТТ есть
В спектрах распределения по интенсивности,
две возможные причины тушения флуоресценции
объему и числу отсутствуют типичные признаки
при добавлении макроцикла. Одной из них явля-
интеркаляции, такие как раскручивание и удлине-
ется взаимодействие между интеркалированным
ние спирали. Наоборот, добавление макроцикла 5
EthBr и макроциклом, второй - высвобождение
к ДНК ТТ приводит к небольшой компактизации
интеркалированного EthBr из дуплексной ДНК
ДНК ТТ.
ТТ. Для выяснения механизма взаимодействия ка-
Таким образом, впервые получено водораство-
ликсарена 5 с ДНК были проведены эксперимен-
римое производное тиакаликс[4]арена в стереоизо-
ты с использованием УФ видимой спектроскопии
мерной форме 1,3-альтернат, содержащее четыре
(рис. 3).
диэтилентриаминовых фрагмента. Установлено,
Как правило, батохромные и гипохромные эф-
что полученный макроцикл эффективно взаимо-
фекты наблюдаются в спектрах поглощения мо-
действует с ДНК тимуса теленка путем бороздоч-
лекул, если они интеркалируют в ДНК ТТ [15].
ного связывания. Сравнительный эксперимент
Максимум длины волны поглощения макроцикла
5 при 270 нм не претерпевает батохромного сдви-
Величины среднего гидродинамического диаметра и
га при его введении в систему EthBr-ДНК ТТ,
индекса полидисперсности в водных растворах ДНК
что свидетельствует, по меньшей мере, о неклас-
ТТ в присутствии макроцикла 5a
сическом интеркаляционном связывании. Анализ
Соединение
D, нм
ИПД
видимой области спектров поглощения позволил
ДНК ТТ
468±17
0.196±0.104
сделать вывод о том, что EthBr в свободном виде
вытесняется в объем раствора. Так, постепенное
5
698±54
0.567±0.001
добавление макроцикла 5 к системе EthBr-ДНК
5-ДНК ТТ
400±23
0.324±0.056
ТТ, имеющей максимум поглощения при 520 нм
a [ДНК ТТ] = 5 мкмоль/л, [5] = 5 мкмоль/л, [ТРИС] =
(рис. 3, 3-7), приводит к гипсохромному сдвигу
50 ммоль/л, pH = 7.3.
максимума поглощения красителя до 475 нм, что
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 1 2020
CИНТЕЗ ВОДОР
АСТВОРИМОГО ПОЛИАММОНИЙНОГО ПРОИЗВОДНОГО
133
по взаимодействию ДНК с диэтилентриамином
Растворители марки ХЧ или ЧДА очищали в
показал, что кажущаяся константа связывания па-
соответствии со стандартными методиками [16].
дает на два порядка при переходе от каликсарена
Синтез п-трет-бутилтиакаликс[4]арена
[17] и
к диэтилентриамину. Таким образом, закрепление
N,N-бис[2-(трет-бутоксикарбониламино)этил]-
четырех диэтилентриаминовых фрагментов на
пропаргиламина [18] был осуществлен по извест-
платформе каликсарена приводит к мультивалент-
ным методикам.
ным взаимодействиям, в результате чего эффек-
5,11,17,23-Тетра-трет-бутил-25,26,27,28-
тивность взаимодействия с нуклеиновой кислотой
тетракис(3-бромпропилокси)-2,8,14,20-тетра-
существенно возрастает.
тиакаликс[4]арен (2). К смеси п-трет-бутил-
тиакаликс[4]арена (1 г, 1.4 ммоль), трифенил-
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
фосфина (3.67 г, 14 ммоль), 3-бромпропан-1-ола
(1.25 мл, 14 ммоль) и 30 мл абсолютного толуола
Спектры ЯМР снимали на спектрометре Avance
при охлаждении добавляли по каплям 40%-ный рас-
400 Nanobay Bruker в ДМСО-d6 или CD3OD-d4.
твор диэтилазодикарбоксилата в толуоле (2.25 мл,
ИК спектры регистрировали на спектрометре
14 ммоль). Реакционную смесь перемешивали при
Bruker Vector-22 в интервале волновых чисел 400-
70°C в течение 15 ч, затем растворитель удаляли
4000 см-1 в таблетках KBr. Анализ методом ТСХ
в вакууме. Продукт был очищен переосаждением
проводили на пластинах Merck UV 254 с прояв-
в системе метанол-дихлорметан, полученный оса-
лением ультрафиолетовой лампой VL-6.LC (6 Вт,
док отфильтровывали на фильтре Шотта и сушили
254 нм). Масс-спектры (MALDI) получены на
в вакуум-эксикаторе, получив продукт в виде по-
масс-спектрометре UltraFlex III TOF/TOF в ли-
рошка белого цвета с массой 1.25 г. Выход 75%.
нейном режиме, в качестве матрицы использовали
Все физико-химические характеристики соответ-
п-нитроанилин. Элементный анализ выполняли на
ствуют литературным данным [7].
анализаторе PerkinElmer PE 2400 СHNS/О.
5,11,17,23-Тетра-трет-бутил-25,26,27,28-
Эксперименты по динамическому и электрофо-
тетракис(3-азидопропилокси)-2,8,14,20-тетра-
ретическому рассеянию света проводили на прибо-
тиакаликс[4]арен (3). Смесь соединения 2 (0.5 г,
ре Zetasizer Nano ZS (Malvern Instruments, США) с
0.41 ммоль) и азида натрия (0.54 г, 8.3 ммоль) в
источником излучения He-Ne лампы с мощностью
20 мл абсолютного ДМФА нагревали при темпе-
4 мВт, длиной волны 633 нм и углом рассеяния све-
ратуре 110°С в микроволновом реакторе EasyPrep
та 173°. Данные обрабатывали программным обе-
(CEM corp.) в течение 5 ч в микроволновой
спечением DTS (Dispersion Technology Software
печи MARS 5 при мощности излучения 400 Вт.
5.00). Для каждой системы проводили минимум
Растворитель удаляли, затем сухой остаток рас-
три эксперимента в одноразовых пластиковых
творяли в 30 мл хлороформа, промывали водой
ячейках DTS 0012 (Sigma-Aldrich, США) при
(3×20 мл) и органическую фазу сушили MgSO4.
298 K. Обработку статистических данных прово-
Растворитель удаляли, к полученному маслу до-
дили с использованием коэффициента Стьюдента,
бавляли 50 мл метанола. Осадок отфильтровывали
погрешность определения размера частиц состав-
на фильтре Шотта и сушили в вакуум-эксикаторе.
ляла <2%. Спектры флуоресценции регистрирова-
Выход 73% (0.32 г), белый порошок. Физико-
ли в 10 мм кварцевых кюветах на спектрофлуори-
химические характеристики соответствуют лите-
метре Fluorolog FL-221 HORIBA Jobin Yvon в диа-
ратурным данным [8].
пазоне 350-430 нм при длине волны возбуждения
5,11,17,23-Тетра-трет-бутил-25,26,27,28-
500 нм с щелью 2.5 нм в диапазоне 540-670 нм.
тетракис(3-{4-[(бис-{2-[(трет-бутилоксикар-
Все исследования проводили в буферном растворе
бонил)амино]этил}амино)метил]-1Н-1,2,3-
(ТРИС, pH = 7.3) при 298 K. Спектры поглощения
триазол-1-ил}пропокси)-2,8,14,20-тетратиа-
регистрировали в 10 мм кварцевых кюветах на
каликс[4]арен (4). Смесь соединения 3 (0.2 г,
спектрофотометре UV-2600 (Shimadzu) в диапа-
0.19 ммоль), N,N-бис[2-(трет-бутоксикарбонил-
зоне 350-600 нм. Все исследования проводили в
амино)этил]пропаргиламина (0.29 г, 0.85 ммоль),
буферном растворе (ТРИС, pH = 7.3) при 298 K.
триэтиламина (2.40 мл, 17.09 ммоль), иодида ме-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 1 2020
134
БУРИЛОВ и др.
ди(I) (36 мг, 0.019 ммоль) и 5 мл толуола переме-
ФОНДОВАЯ ПОДДЕРЖКА
шивали в течение 12 ч при комнатной температуре.
Работа выполнена за счет средств субсидии,
После окончания реакции добавляли хлороформ
выделенной Казанскому федеральному универси-
(20 мл). Органическую фазу промывали раствором
тету для выполнения государственного задания
аммиака (2×10 мл), затем водой до pH = 7 и суши-
в сфере научной деятельности (4.1493.2017/4.6,
ли MgSO4. Растворитель упаривали, к полученно-
4.5151.2017/6.7).
му маслу добавляли гексан (30 мл). Полученный
осадок отфильтровывали на фильтре Шотта и су-
КОНФЛИКТ ИНТЕРЕСОВ
шили в вакуум-эксикаторе. Выход 86% (0.39 г), бе-
Авторы заявляют об отсутствии конфликта
лый порошок, Rf 0.15 (элюент - этилацетат), т. пл.
интересов.
91°C (разл.). ИК спектр, ν, cм-1: 1693 (СО). Спектр
СПИСОК ЛИТЕРАТУРЫ
ЯМР 1H (400 МГц, CD3OD-d4), δ, м. д.: 1.13 с (36H,
t-Bu), 1.43 с (72H, t-Bu), 1.73-1.81 м (8H, CH2),
1. Hannon M.J. // Chem. Soc. Rev. 2007. Vol. 36. P. 280.
2.56 т (16Н, NCH2, J = 5.9 Гц), 3.15 т (16Н, CH2NH,
doi 10.1039/b606046n
J = 5.9 Гц), 3.83 с (8Н, TrzCH2N), 4.02 т (8Н, CH2O,
2. Casnati A., Sansone F. // Reference module in chemistry,
J = 6.8 Гц), 4.24 т (8Н, CH2NTrz, J = 6.9 Гц), 4.87
molecular sciences and chemical engineering. 2015.
с (8Н, NH), 7.39 с (8H, HAr), 7.92 с (4H, H-Trz).
P. 1. doi 10.1016/B978-0-12-409547-2.10827-3
Спектр ЯМР
13C{1Н}
(101 МГц, CD3OD-d4),
3. Giuliani M., Morbioli I., Sansone F., Casnati A. //
δС, м. д.: 28.70, 30.98, 31.54, 35.04, 39.07, 54.13,
Chem. Commun. 2015. Vol. 51. P. 14140. doi 10.1016/j.
67.12, 79.79, 125.18, 128.49, 129.43, 144.69, 147.67,
cis.2019.04.004
157.70, 158.21. Масс-спектр, m/z: 2420 [M]+, 2443
4. Solovieva S.E., Burilov V.A., Antipin I.S. / /
[M + Na]+. Найдено, %: C 59.65; H 8.12; N 13.84; S
Macroheterocycles. 2017. Vol. 10. P.134. doi 10.6060/
5.21. C120H192N24O20S4. Вычислено, %: C 59.69; H
mhc170512a
8.16; N 13.75; S 5.12.
5. Ibragimova R.R., Burilov V.A., Aimetdinov A.R.,
5,11,17,23-Тетра-трет-бутил-25,26,27,28-
Mironova D.A., Evtugyn V.G., Osin Yu.N., Solovie-
тетракис[3-(4-{[бис(2-аминоэтил)амино]
va S.E., Antipin I.S. // Macroheterocycles. 2016. Vol. 9.
метил}-1Н-1,2,3-триазол-1-ил)пропокси]-
P. 433. doi 10.6060/mhc161180b
2,8,14,20-тетратиакаликс[4]арен
(5).
К
6. Bitter I., Csokai V. // Tetrahedron Lett. 2003. Vol. 44.
раствору соединения
4
(0.2 г, 0.08 ммоль) в
P. 2261. doi10.1016/S0040-4039(03)00285-5
10 мл диоксана по каплям добавляли 0.41 мл
7. Ovsyannikov A. Noamane M., Abidi R., Ferlay S.,
(4.96 ммоль) концентрированной соляной кислоты.
Solovieva S., Antipin I., Konovalov A., Kyritsakas N.,
Реакционную смесь перемешивали при комнатной
Hosseini M. // Cryst. Eng. Comm. 2016. V. 18. P. 691.
температуре в течение
3 ч. После удаления
doi 10.1039/c5ce02310f
растворителя был получен порошок светло-
8. Taouai M., Abidi R., Garcia J., Siriwardena A., Be-
желтого цвета. Выход 95% (0.13 г), т. пл. 247°C
nazza M. // J. Org. Chem. 2014.Vol. 79. P.10743. doi
(разл.). ИК спектр, ν, cм-1: 3425 (NH2). Спектр
10.1021/jo5015504
ЯМР 1H (400 МГц, ДМСО-d6), δ, м. д.: 1.08 уш. с
9. Puplampu J.B. Yakimova L.S., Vavilova A.A., Rizva-
(36H, t-Bu), 1.57 уш. т (8H, CH2), 2.65 уш. т (16Н,
nov I.K., Stoikov I.I. // Macroheterocycles. 2015. Vol. 8.
NCH2), 2.99 уш. т (16Н, CH2NH), 3.81-3.91 уш. м
P. 75. doi 10.6060/mhc140722s
(16Н, CH2O, TrzCH2N), 4.19 уш. т (8Н, CH2NTrz),
10. Валияхметова А.М., Султанова Э.Д., Бурилов В.А.,
7.31 с (8H, HAr), 8.07-8.15 уш. м (20H, H-Trz,
Соловьева С.Е., Антипин И.С. // Изв. АН. Сер. хим.
NH2). Cпектр ЯМР 13C{1Н} (101 МГц, ДМСО-d6),
2019. Т. 5. С. 1067; Valiyakhmetova A.M., Sultano-
δС, м. д.: 29.25, 30.81, 33.98, 36.43, 44.94, 46.75,
va E.D., Burilov V.A., Solovieva S.E., Antipin I.S. //
49.73, 65.92, 124.41, 127.27, 127.47, 140.76, 146.07,
Russ. Chem. Bull. 2019. Vol. 68. P. 1067. doi 10.1007/
156.04. Масс-спектр, m/z: 1764 [M]+, 1618 [M + H -
s11172-019-2521-4
4HCl]+. Найдено, %: C 54.55; H 7.63; Cl 8.23; N
11. Guo Q., Lu M., Marky L.A., Kallenbach N.R. //
19.18; S 7.2. C80H132Cl4N24O4S4. Вычислено, %: C
Biochemistry. 1992. Vol. 31. P. 2451. doi 10.1021/
54.47; H 7.54; Cl 8.04; N 19.06; S 7.27.
bi00124a002
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 1 2020
CИНТЕЗ ВОДОР
АСТВОРИМОГО ПОЛИАММОНИЙНОГО ПРОИЗВОДНОГО
135
12. Satyanarayana, S., Dabrowiak, J.C., Chaires, J.B.
16. Armarego W.L.F., Chai C.L. Purification of laboratory
// Biochemistry.1992. Vol. 31. P. 9319. doi 10.1021/
chemicals. New York: Elsevier, 2009. P. 743
bi00154a001
17. Iki N., Kabuto C., Fukushima T., Kumagai H., Takeya H.,
13. Kabir A, Kumar S. // PLOS ONE. 2013. Vol. 8.
Miyanari S., Miyashi T., Miyano S. // Tetrahedron. 2000.
P. e70510. doi 10.1371/journal.pone.0070510
Vol. 56. P. 1437. doi 10.1016/S0040-4020(00)00030-2
14. Fan P., Wan L., Shang Y., Wang J., Liu Y., Sun X., Chen
18. Brown N.G., VanderLinden R., Watson E.R., Qiao R.,
C. // Bioorg. Chem. 2014. Vol. 58. P. 88. doi 10.1016/j.
Grace C.R.R., Yamaguchi M., Weissmann F., Frye J.J.,
bioorg.2014.12.002
Dube P., Ei Cho S., Actis M.L., Rodrigues P., Fujii N.,
15. Pyle A.M., Rehmann J.P., Meshoyrer R., Kumar C.V.,
Peters J.M., Stark H., Schulman B.A. // Proc. Nat.
Turro N.J., Barton J.K. // J. Am. Chem. Soc. 1989.
Acad. Sci. 2015. Vol. 112. P. 5272. doi 10.1073/
Vol. 111. P. 3051. doi 10.1021/ja00190a046
pnas.1504161112
Synthesis of Water-Soluble Polyammonium Thiacalix[4]arene
Derivative and Its Interaction with Calf Thymus DNA
V. A. Burilova,*, D. A. Mironovaa, I. A. Grygorieva, A. M. Valiyakhmetovaа,
S. E. Solovievab, and I. S. Antipina
а Kazan (Volga region) Federal University, ul. Kremlevskaya 18, Kazan, 420008 Russia
*e-mail: ultrav@bk.ru
bArbuzov Institute of Organic and Physical Chemistry, Federal Research Center
“Kazan Scientific Center of the Russian Academy of Sciences”, Kazan, 420088 Russia
Received June 21, 2019; revised June 21, 2019; accepted June 25, 2019
For the first time, a water-soluble thiacalix[4]arene derivative containing four diethylenetriamine fragments
in 1,3-alternate stereoisomeric form was obtained. Using ethidium bromide, it was found that macrocycle is
able to interact with calf thymus DNA. The macrocycle was found to interact with DNA by fissile binding.
The presence of four diethylenetriamine fragments on the calixarene platform leads to multivalent interactions
with DNA, resulting in an increase of binding constant by two orders of magnitude compared to individual
diethylenetriamine.
Keywords: calix[4]arene, deoxyribonucleic acid, fluorimetry, ethidium bromide
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 1 2020