ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2020, том 90, № 1, с. 136-142
УДК 546.865;547.53.024;548.312.5;539.264
СИНТЕЗ И СТРОЕНИЕ
БИС(ДИГИДРОКСИБЕНЗОАТОВ) ТРИАРИЛСУРЬМЫ
© 2020 г. В. В. Шарутин, О. К. Шарутина, Ю. О. Губанова*, А. С. Фоминых
Национальный исследовательский Южно-Уральский государственный университет,
пр. Ленина 76, Челябинск, 454080 Россия
*e-mail: ulchik_7757@mail.ru
Поступило в Редакцию 6 июня 2019 г.
После доработки 6 июня 2019 г.
Принято к печати 13 июня 2019 г.
В реакциях окислительного присоединения к трифенил- и три(4-метилфенил)сурьме (окислитель - пе-
роксид водорода) 2,6- и 2,3-дигидроксибензойные кислоты проявляют себя как монофункциональные
соединения, образуя дикарбоксилаты триарилсурьмы. Молекулярные структуры синтезированных
соединений установлены методом рентгеноструктурного анализа. Выявлена склонность соединений в
кристаллах к димеризации с образованием межмолекулярных водородных связей О-Н∙∙∙О=С.
Ключевые слова: триарилсурьма, дигидроксибензойные кислоты, пероксид водорода, дикарбоксилаты
триарилсурьмы
DOI: 10.31857/S0044460X20010175
Окислительный синтез органических соеди-
трифенилсурьмы с фталевой кислотой вместо
нений сурьмы(V) [1] в настоящее время хорошо
ожидаемого макроциклического соединения был
разработан. Реакции триарилсурьмы с перокси-
выделен дифталат трифенилсурьмы со свободны-
дами в присутствии органических НО-кислот, как
ми карбоксильными группами [9]. Макроциклы,
правило, с хорошим выходом дают производные
включающие атом сурьмы, синтезированы из
Ar3SbX2 (при мольном соотношении триарилсу-
дихлорида трифенилсурьмы и дикарбоновых кис-
рьмы и кислоты 1:2) либо (Ar3SbX)2О (соотно-
лот по реакции замещения [10]. На немногочис-
шение 1:1), где Х - остаток кислоты [2-5]. В ряде
ленных примерах описан окислительный синтез с
работ сообщалось об использовании в окисли-
использованием гетерофункциональных соедине-
тельном синтезе бифункциональных соединений.
ний. 2-[(Гидроксиимино)метил]фенол, имеющий
Строение продукта реакции с дигидроксибензо-
две функциональные группы, проявляет себя как
лом определяется положением гидроксильных
моно- или как тридентатный лиганд в зависимо-
групп в ароматическом кольце: с пирокатехином
сти от арильного радикала при атоме сурьмы [11].
образуются мономерные 5-членные циклические
При взаимодействии
2,4-дигидроксибензойной
орто-фенилендиоксиды триарилсурьмы, с ре-
кислоты с пентафенилсурьмой инертной остается
зорцином - макроциклические соединения, с ги-
только одна гидроксильная группа, занимающая
дрохиноном - полимерные гидрохиноляты триа-
орто-положение [12].
рилсурьмы [6]. Взаимодействие триарилсурьмы,
Нами установлено, что реакции трифенил- и
пероксида, 1,2-этандиола [7] или вицинальных
три(4-метилфенил)сурьмы с 2,6- и 2,3-дигидрокси-
диолов приводит к образованию металлоциклов
бензойными кислотами в диэтиловом эфире в
[6]. Биядерный макроциклический комплекс по-
присутствии
пероксида
водорода
(1:2:1)
лучен в реакции трифенилсурьмы с диоксимом
протекают без участия гидроксильных групп с
2,2'-метиленди(циклопентан-1-она) в присутствии
образованием дикарбоксилатов триарилсурьмы
пероксида водорода [8]. В аналогичной реакции
Ar3Sb[C(O)OAr']2 (схема 1).
136
СИНТЕЗ И СТРОЕНИЕ БИС(ДИГИДРОКСИБЕНЗОАТОВ) ТРИАРИЛСУРЬМЫ
137
Схема 1.
Ar3Sb + 2HOC(O)Ar' + H2O2 → Ar3Sb[OC(O)Ar']2 + 2H2O
1-4
Ar = Ph (1,3), 4-МеС6Н4 (2,4); Ar' = 2,6-(OH)2C6H3 (1, 2), 2,3-(OH)2C6H3 (3, 4).
Полученные соединения - бесцветные кристал-
графически независимых молекул A, B) имеют
лические вещества, растворимые в бензоле, толу-
тригонально-бипирамидальную координацию с
оле, этиловом и изопропиловом спирте. При пе-
карбоксилатными лигандами в аксиальных поло-
рекристаллизации соединения 4 из ацетонитрила
жениях и арильными кольцами в экваториальных
был выделен сольват (4-МеС6Н4)3Sb[OC(O)-2,3-
(рис. 1, 2). О малом искажении координационного
(OH)2C6H3]2∙МеCN.
полиэдра свидетельствуют незначительный выход
Согласно данным рентгеноструктурного анали-
атома металла из экваториальной плоскости [С3]
за, атомы сурьмы в соединениях 1-4 (в кристалле
[0.022 (1), 0.01 (2), 0.018 (3), 0.021 (4A) и 0.026 Å
комплекса 4 присутствуют два типа кристалло-
(4B)] и суммы углов в экваториальных плоско-
стях, практически равные 360°. Аксиальные углы
OSbO отличаются от 180° и составляют 165.97(11)
(1), 166.07(6) (2), 170.96(11) (3), 170.14(13) (4А) и
170.58(15)° (4В). Значения углов между аксиаль-
ными и экваториальными связями O-Sb-C лежат
в диапазонах 82.50(13)-95.06(13) (1), 82.42(7)-
Рис. 2. Общий вид молекулы комплекса 4 в кристалле
Рис. 1. Общий вид молекулы комплекса 1 в кристалле.
(молекула A, сольватный растворитель не показан).
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 1 2020
138
ШАРУТИН и др.
Основные длины связей и валентные углы в молекулах соединений 1-4
Связь
d, Å
Угол
ω, град
1
Sb1-O1
2.141(3)
C1Sb1O1
82.50(13)
Sb1-С1
2.106(4)
C1Sb1O2
83.46(13)
Sb1-O1
2.120(3)
O2Sb1O1
165.97(11)
Sb1-C21
2.092(4)
C21Sb1O1
93.86(13)
Sb1-C11
2.099(4)
C21Sb1C1
115.63(16)
O1-C37
1.314(4)
C21Sb1O2
92.27(13)
O3-С37
1.229(4)
C21Sb1С11
129.45(16)
O2-C47
1.316(4)
C11Sb1O1
90.78(13)
O4-C47
1.234(5)
C11Sb1C1
114.89(17)
C11Sb1O2
95.06(13)
2
Sb1-O1
2.1379(15)
O1Sb1O5
166.07(6)
Sb1-O5
2.1412(15)
C1Sb1O1
82.42(7)
Sb1-C1
2.0905(18)
O1Sb1O5
83.67(7)
Sb1-C11
2.086(2)
C1Sb1C21
116.11(8)
Sb1-C21
2.0940(19)
C11Sb1O1
95.57(7)
O1-C37
1.308(2)
C11Sb1O5
89.80(7)
O2-С37
1.229(3)
C11Sb1С1
115.88(7)
O5-C47
1.316(2)
C1Sb1C21
128.01(8)
O6-С47
1.230(3)
C21Sb1O1
91.84(7)
C21Sb1O5
94.96(7)
3
Sb1-O1
2.119(3)
O5Sb1O1
170.96(11)
Sb1-O5
2.108(3)
C11Sb1O1
85.22(15)
Sb1-C11
2.105(4)
O11Sb1O5
85.79(15)
Sb1-C21
2.107(4)
C11Sb1C21
117.49(16)
Sb1-C1
2.102(4)
C21Sb1O1
92.03(14)
O1-C37
1.294(5)
C21Sb1O5
91.32(14)
O2-С37
1.231(5)
C11Sb1O1
90.51(13)
O5-C47
1.287(5)
C1Sb1O5
93.60(13)
O6-С47
1.234(5)
C1Sb1C11
111.29(16)
C1Sb1C21
131.20(15)
4
Sb1-O1
2.145(4)
O5Sb1O1
170.14(13)
Sb1-O5
2.115(4)
C1Sb1O1
84.64(18)
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 1 2020
СИНТЕЗ И СТРОЕНИЕ БИС(ДИГИДРОКСИБЕНЗОАТОВ) ТРИАРИЛСУРЬМЫ
139
Таблица (Продолжение)
Связь
d, Å
Угол
ω, град
4
Sb1-C1
2.099(5)
С1Sb1O5
86.75(18)
Sb1-C11
2.098(6)
C11Sb1O1
91.18(18)
Sb1-C21
2.097(6)
C11Sb1O5
87.94(18)
O1-C37
1.276(6)
C11Sb1C1
114.1(2)
O2-С37
1.239(6)
C21Sb1O1
91.26(18)
O5-C47
1.303(6)
C21Sb1O5
96.27(18)
O6-С47
1.243(6)
C21Sb1C1
110.5(2)
C21Sb1C11
135.4(2)
Sb2-O13
2.138(4)
O9Sb2O13
170.58(15)
Sb2-O9
2.101(4)
O1Sb2C71
86.07(19)
Sb2-C61
2.100(5)
C61Sb2C13
86.14(18)
Sb2-C71
2.112(6)
C61Sb2O9
93.38(18)
Sb2-C51
2.099(6)
C61Sb2C71
117.8(2)
O13-C97
1.289(6)
C71Sb2O13
85.85(19)
O14-С97
1.249(7)
C51Sb2O13
95.53(18)
O9-C87
1.309(6)
C51Sb2O9
91.84(18)
O10-С87
1.228(6)
C51Sb2C61
131.4(2)
C51Sb2C71
110.7(2)
95.57(7) (2), 85.22(15)-93.60(13) (3), 84.64(18)-
ными группами (1 и 3, 2 и 4) средние значения
96.27(18) (4A) и 86.07(19)-95.53(18)° (4B). Связи
связей Sb-O больше в тех, где имеются остатки
Sb-C изменяются в небольших интервалах зна-
2,6-дигидроксибензойной кислоты. В молекулах
чений [2.092(4)-2.106(4) (1), 2.086(12)-2.0940(19)
бис(2-гидроксибензоата) [17] и бис(5-бром-2-ги-
(2), 2.102(4)-2.107(4) (3), 2.097(6)-2.099(5) (4A),
дроксибензоата)
[18] трифенилсурьмы сред-
2.099(6)-2.112(6) Å (4B)] и не зависят от стро-
ние значения связей Sb-O составляют 2.109(3) и
ения арильного радикала (см. таблицу). Длины
2.131(4) Å.
связей Sb-O:
2.141(3) и 2.120(3)
(1), 2.1379(15)
Внутримолекулярные расстояния Sb∙∙∙O c кар-
и 2.1412(15)
(2), 2.119(3) и 2.108(3) (3), 2.145(4)
бонильным атомом кислорода [3.116(4), 3.187(3) Å
и 2.115(4) (4A), 2.138(4) и 2.101(4) Å (4B). В па-
(1), 3.255(2), 3.090(2) Å (2) 3.129(4), 3.137(4) Å (3),
рах соединений с одинаковыми остатками кислот
3.040(3), 3.101(4) Å (4A), 3.169(5), 3.083(4) Å (4В)]
(1 и 2, 3 и 4) средние значения указанных связей
свидетельствуют о выраженной асимметрии коор-
[2.130(3), 2.139(2), 2.113(3), 2.130(4) и 2.119(4) Å в
динации карбоксилатных лигандов. Асимметрия
комплексах 1-3, 4 А, B соответственно] несколько
координации лигандов согласуется с присутстви-
больше в толильных производных. Удлинение свя-
ем в карбоксильных группах ординарных (С-О)
зей Sb-O в дикарбоксилатах три(п-толил)сурьмы
и двойных (С=О) связей [1.314(4), 1.316(4) и
по сравнению с фенильными аналогами наблю-
1.229(4), 1.234(5) (1), 1.308(2), 1.316(2) и 1.229(3),
дается в диацетатах [13, 14], дифураинатах [15],
1.230(3) (2), 1.294(5), 1.287(5) и 1.231(5), 1.234(5)
бис(метилкарборанилкарбоксилатах)
[16] триа-
(3), 1.276(6), 1.303(6) и 1.239(6), 1.243(6) (4A),
рилсурьмы. В соединениях с одинаковыми ариль-
1.309(6), 1.289(6) и 1.228(6), 1.249(7) Å (4B)], кото-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 1 2020
140
ШАРУТИН и др.
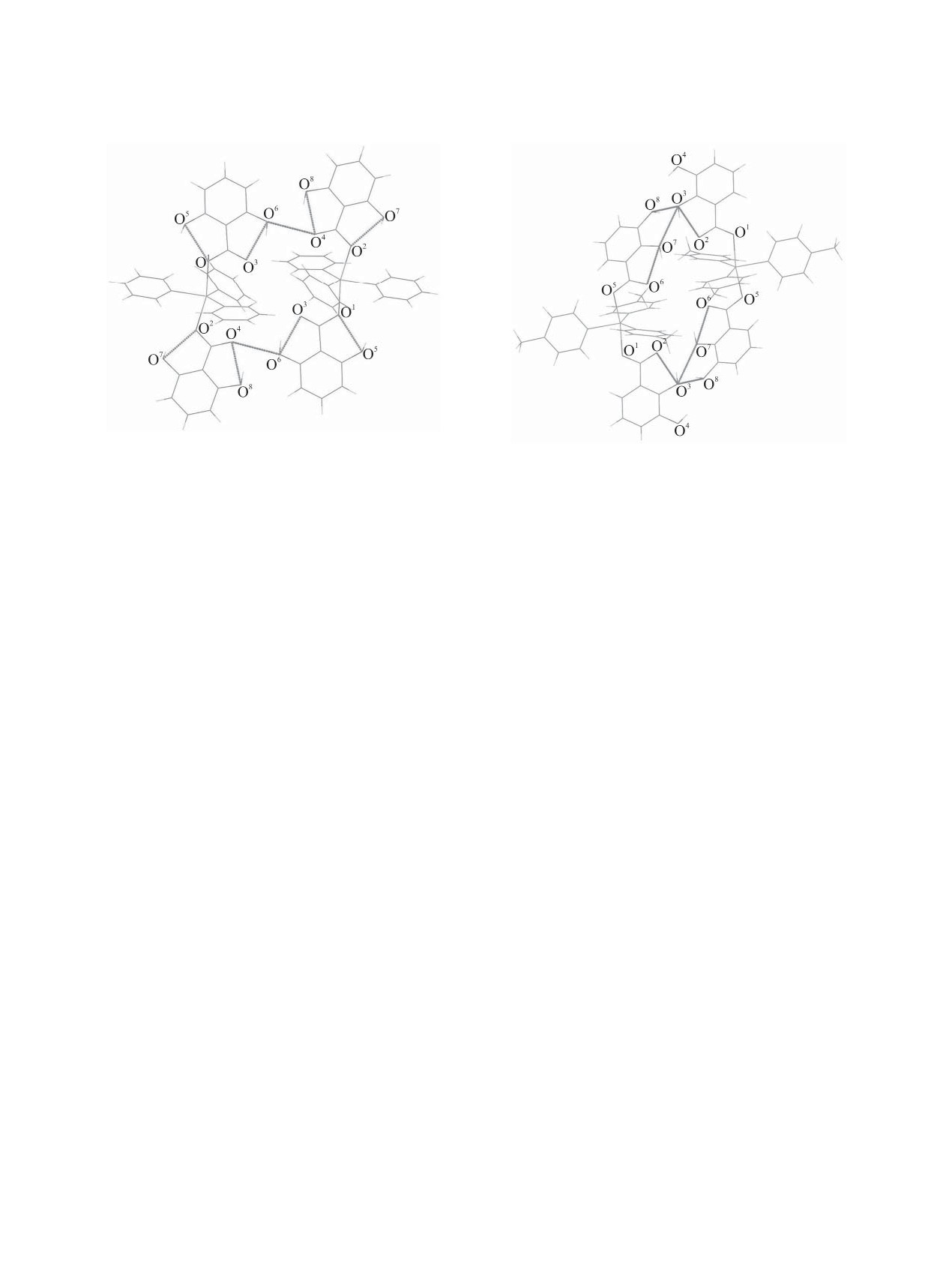
Рис. 3. Внутри- и межмолекулярные водородные связи
Рис. 4. Внутри- и межмолекулярные водородные связи
в комплексе 1.
в комплексе 4.
рые значительно различаются по длине. В некото-
PC [24] и OLEX2 [25]. Структуры определены
рых дикарбоксилатах триарилсурьмы расстояния
прямым методом и уточнены методом наимень-
Sb∙∙∙O=С существенно меньше суммы ван-дер-ва-
ших квадратов в анизотропном приближении для
альсовых радиусов атомов (3.7 Å) и не превышают
неводородных атомов. Основные длины связей и
2.80 Å [19-22].
валентные углы приведены в таблице. Полные та-
Гидроксильные группы в орто-положениях к
блицы координат атомов, длин связей и валентных
карбоксильной группе образуют внутримолеку-
углов депонированы в Кембриджском банке струк-
лярные водородные связи О-Н∙∙∙О=С, расстояния
турных данных [CCDC
1822185 (1), 1853658 (2),
O∙∙∙О изменяются в интервале 2.540(6)-2.634(4) Å.
1853665 (3), 1890830 (4)].
Посредством межмолекулярных водородных свя-
Кристаллы комплекса 1 бесцветные, призмати-
зей в кристаллах комплексов 1, 3, 4 формируются
ческие, триклинные, C32H25O8Sb, М 293.15 г/моль;
димеры (рис. 3, 4).
параметры элементарной ячейки: а = 9.437(6) Å,
Таким образом, в реакциях окислительного
b = 10.836(6) Å, c = 17.105(13) Å, α = 80.717(19)°,
присоединения триарилсурьмы с 2,6- и 2,3-ди-
β = 81.07(4)°, γ = 75.93(2)°, V = 1662.1(18) Å3,
гидроксибензойными кислотами последние про-
dвыч = 1.317 г/см3, Z = 2, пространственная
являют себя как монофункциональные соедине-
группа P¯1. . Измерено всего102337 отражений,
ния, при этом имеет место образование дикарбок-
14609 независимых отражений, μ = 0.874 мм-1.
силатов триарилсурьмы.
Окончательные значения факторов расходимости:
= 0.1757 (по всем рефлексам),
R1 = 0.0703 и wR2
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
R1 = 0.0579 и wR2 = 0.1757 [по рефлексам F2>
2σ(F2)].
ИК спектры записывали на ИК-Фурье спектро-
метре Shimadzu IR Affinity-1S в таблетках KBr.
Кристаллы комплекса
2 бесцветные, приз-
Рентгеноструктурный анализ проводили на диф-
матические, моноклинные, C32H25O8Sb, М
рактометре D8 Quest Bruker (MoKα-излучение,
293.15 г/моль; параметры элементарной ячейки:
λ = 0.71073 Å, графитовый монохроматор). Сбор,
а = 10.941(3) Å, b = 19.163(5) Å, c = 16.160(6) Å,
редактирование данных и уточнение параметров
α β = 107.991(14)°, V = 3222.4(18) Å3, dвыч =
элементарной ячейки, а также учет поглощения
1.446 г/см3, Z = 4, пространственная группа P21/c.
проведены по программам SMART и SAINT-Plus
Измерено всего 154579 отражений, 22739 незави-
[23]. Все расчеты для определения и уточнения
симых отражений, μ = 0.906 мм-1. Окончательные
структур выполнены по программам SHELXL/
значения факторов расходимости: R1 = 0.1246 и
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 1 2020
СИНТЕЗ И СТРОЕНИЕ БИС(ДИГИДРОКСИБЕНЗОАТОВ) ТРИАРИЛСУРЬМЫ
141
wR2 = 0.1252 (по всем рефлексам), R1 = 0.0590 и
кристаллы с выходом 69%, т. пл. 174°С. ИК спектр,
wR2 = 0.1045 [по рефлексам F2> 2σ(F2)].
ν, см-1: 3368, 3051, 2581, 1682, 1659, 1595, 1474,
1435, 1381, 1350, 1300, 1258, 1234, 1159, 1072, 839,
Кристаллы комплекса 3 бесцветные, призмати-
ческие, моноклинные, C32H25O8Sb, М 293.15 г/моль;
750, 739, 689, 636, 455. Найдено %: С 58.09; H 3.83.
параметры элементарной ячейки: а = 8.898(8) Å,
C32H25O8Sb. Вычислено, %: С 58.27; Н 3.79.
b = 15.219(13) Å, c = 21.027(18) Å , β = 92.20(3)°, V =
Бис(2,3-дигидроксибензоато)три(4-метил-
2845(4) Å3, dвыч = 1.539 г/см3, Z = 4, пространствен-
фенил)сурьма
(4). После перекристаллизации
ная группа P21/c. Измерено всего 26095 отраже-
из ацетонитрила получили коричневые кристал-
ний, 4894 независимых отражений, μ = 1.021 мм-1.
лы с выходом 63%, т. пл. 143°С. ИК спектр, ν,
Окончательные значения факторов расходимости:
см-1: 3529, 2924, 2853, 2357, 2341, 1655, 1591,
R1 = 0.0428 и wR2 = 0.097 (по всем рефлексам),
1470, 1306, 1267, 1173, 1153, 1071, 1013, 835, 797,
R1 = 0.0360 и wR2 = 0.093 [по рефлексам F2 >
756, 667, 484, 417. Найдено %: С 59.76; H 4.57.
2σ(F2)].
C70H62O16Sb2∙СН3СN. Вычислено, %: С 59.88; Н
Кристаллы комплекса 4 бесцветные, призматиче-
4.50
ские, моноклинные, C32H25O8Sb, М 293.15 г/моль;
ФОНДОВАЯ ПОДДЕРЖКА
параметры элементарной ячейки: а = 11.019(7) Å,
b = 15.020(8) Å, c = 21.053(19) Å, α = 106.51(4)°,
Работа выполнена при финансовой поддержке
β = 93.35(3)°, γ = 92.36(2)°, V = 3329(4) Å3,
Министерства образования и науки Российской
dвыч
=
1.440 г/см3, Z
=
2, пространственная
Федерации (грант № 4.6151.2017/8.9).
группа P¯1. . Измерено всего56818 отражений,
10607 независимых отражений, μ = 0.880 мм-1.
КОНФЛИКТ ИНТЕРЕСОВ
Окончательные значения факторов расходимости:
Авторы заявляют об отсутствии конфликта
R1 = 0.0924 и wR2 = 0.117 (по всем рефлексам), R1 = 0
интересов.
.0429 и wR2 = 0.0924 [по рефлексам F2 > 2σ(F2)].
Бис(2,6-дигидроксибензоато)трифенилсурь-
СПИСОК ЛИТЕРАТУРЫ
ма (1). Смесь 0.2 г (0.57 ммоль) трифенилсурьмы
1. Thepe T.C., Garascia R.J., Selvoski M.A., Patel A.N. //
и 0.17 г (1.14 ммоль)
2,6-дигидроксибензойной
Ohio J. Sci. 1977. Vol. 77. N 3. P. 134.
кислоты растворяли в 30 мл диэтилового эфира и
2. Гущин А.В., Шашкин Д.В., Прыткова Л.К. Сомов Н.В.,
прибавляли 0.064 г (0.57 ммоль) 30%-ного водного
Баранов Е.В., Шавырин А.С., Рыкалин В.И. //
пероксида водорода. После испарения растворите-
ЖОХ. 2011. Т. 81. № 3. 397; Gushchin A.V., Shash-
ля получили 0.29 г (77%) бесцветных кристаллов,
kin D.V., Prytkova L.K., Somov N.V., Baranov E.V.,
т. пл. 201°С. ИК спектр, ν, см-1: 3045, 2378, 1636,
Shavyrin A.S., Rykalin V.I. // Russ. J. Gen. Chem. 2011.
1578, 1473, 1458, 1429, 1348, 1271, 1201, 1155,
Vol. 81. N 3. P. 397. doi 10.1134/S107036321103008X
1115, 1065, 1030, 997, 814, 729, 694, 603, 636, 479,
3. Гущин А.В., Шашкин Д.В., Щербакова Т.С., Со-
453, 419. Найдено %: С 58.12; H 3.82. C32H25O8Sb.
мов Н.В., Баранов Е.В., Фукин Г.К., Шавырин А.С.,
Вычислено, %: С 58.27; Н 3.79
Рыкалин В.И., Додонов В.А. // Вестн. ННГУ. Сер.
Аналогично синтезировали соединения 2-4.
Химия. 2010. Т. 6. С. 68.
Бис(2,6-дигидроксибензоато)три(4-метилфе-
4. Ladilina E.Y., Semenov V.V., Fukin G.K., Gushchin A.V.,
нил)сурьма (2). Выход 71%, бесцветные кристал-
Dodonov V.A., Zhdanovich I.V., Finet J.-P. // J.
лы, т. пл. 178°С. ИК спектр, ν, см-1: 3267, 1643,
Organomet. Chem. 2007. Vol. 692. N 26. P. 5701. doi
1613, 1458, 1394, 1350, 1250, 1211, 1157, 1119,
10.1016/j.jorganchem.2007.09.019
1032, 818, 795, 762, 704, 665, 610, 482. Найдено
5. Шарутин В.В., Шарутина О.К., Сенчурин В.С., Кар-
%: С 59.82; H 4.58. C35H31O8Sb. Вычислено, %: С
цева М.К. // Вестн. ЮУрГУ. Сер. Химия 2017. Т. 9.
59.91; Н 4.42
№ 3. С. 71. doi 10.14529/chem170309
Бис(2,3-дигидроксибензоато)трифенилсурь-
6. Додонов В.А., Фёдоров А.Ю., Усятинский Р.И., За-
ма (3). После перекристаллизации из смеси бен-
бурдяева С.Н., Гущин А.В. // Изв. АН. Сер. хим. 1995.
зол-изопропиловый спирт получили коричневые
№ 4. С. 748.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 1 2020
142
ШАРУТИН и др.
7. Додонов В.А., Забурдяева С.Н., Невкина Н.Н. // Ме-
10.1023/A:1026020032214
таллоорг. хим. 1989. Т. 2. № 6. C. 1296.
16. Шарутин В.В., Шарутина О.К., Сенчурин В.С.,
8. Шарутин В.В., Шарутина О.К., Акимова Т.Л. //
Старикова З.А., Глазун С.А., Брегадзе В.И. // Бутле-
ЖОХ. 2009. Т. 79. № 8. С. 1636; Sharutin V.V,
ровск. сообщ. 2012. Т. 29. № 3. С 51.
Molokova O.V., Sharutina O.K., Akimo’ va T.I. // Russ.
17. Baruchki H. Coles S.L., Costello J.F., Gerbish T.,
J. Gen. Chem. 2009. Vol. 79. N 8. P. 1656. doi 10.1134/
Hursthouse M.B. // J. Chem. Soc. Dalton Trans. 2000.
S107036320908012X
N 14 P. 2319. doi 10.1039/b002337j
9. Шарутин В.В., Шарутина О.К., Сенчурин В.С. //
18. Quan L., Yin J.C., Hong M., Wang D. // J. Organomet.
ЖНХ. 2014. Т. 59. № 9. С. 1158; Sharutin V.V.,
Chem. 2009. Vol. 694. N 23. P. 3708. doi 10.1016/j.
Sharutina O.K., Senchurin V.S. // Russ. J. Inorg. Chem.
jorganchem.2009.07.040
2014. Vol. 79. P. 947. doi 10.1134/S0036023614090162
19. Wen L., Yin H., Li W., Wang D. // Inorg. Chim. Acta.
10. Hong M., Yin H.-D., Li W.-K., You X.-Y. // Inorg.
2010. Vol 363. N 4. P 676. doi 10.1016/j.ica.2009.11.022
Chem. Commun. 2011. Vol. 14. P. 1616. doi 10.1016/j.
20. Wen L.-Y., Yin H. -D., Wang D. // Chin. J. Inorg. Chem.
inoche.2011.06.023.
2009. Vol. 8. P. 1470.
11. Sharutin V.V., Sharutina O.K., Artem’eva E.V., Makero-
21. Yin H.-D., Wen L.-Y., Cui J.-C., Li W.-K. // Polyhedron.
va M.S. // Bull. South Ural State University. Ser.
2009. Vol. 28. N 14. P 2919. doi 10.1016/j.
Chemistry. 2014. Vol. 6. N 2. P. 5.
poly.2009.06.065
12. Шарутин В.В., Шарутина О.К., Губанова Ю.О. //
22. Ma Y., Li J., Xuan Z., Liu R. // J. Organometal. Chem.
Вестн. ЮУрГУ. Сер. Химия. 2017. Т. 9. № 4. С. 56.
2001. Vol. 620 N 2. P. 235. doi 10.1016/S0022-
doi 10.14529/chem170409
328X(00)00799-3
13. Qin W., Yasuike S., Kakusava N., Sugawara Y.,
23. Bruker (1998). SMART and SAINT-Plus. Versions
Kawahata М., Yamaguchi K., Kurita J. // J. Organomet.
5.0. Data Collection and Processing Software for the
Chem. 2008. Vol. 693. N 1. P 109. doi 10.1016/j.jor-
SMART System. Bruker AXS Inc., Madison, Wisconsin,
ganchem.2007.10.030
USA.
14. Sowerby D.B. // J. Chem. Res. Synop. 1979. N 3. P. 80.
24. Bruker (1998). SHELXTL/PC. Versions 5.10. An
15. Шарутин В.В., Шарутина О.К., Пакусина А.П.,
Integrated System for Solving, Refining and Displaying
Платонова Т.П., Жидков В.В., Пушилин М.А., Ге-
Crystal Structures from Diffraction Data. Bruker AXS
расименко А.В. // ЖНХ. 2003. Т. 29. № 10. С. 750;
Inc., Madison, Wisconsin, USA.
Sharutin V.V., Sharutina O.K., Pakusina A.P., Platono-
25. Dolomanov O.V., Bourhis L.J., Gildea R.J., Ho-
va T.P., Zhidkov V.V., Pushilin M.A. Gerasimenko A.V. //
ward J.A.K., Puschmann H. // J. Appl. Cryst. 2009.
Russ. J. Inorg. Chem. 2003. Vol. 99. N 10. P. 694. doi
Vol. 42. P. 33. doi 10.1107/ S0021889808042726
Synthesis and Structure
of Triarylantimony Bis(dihydroxybenzoates)
V. V. Sharutin, О. K. Sharutina, Yu. О. Gubanova*, and А. S. Fominykh
National Research South Ural State University, pr. Lenina 76, Chelyabinsk, 454080 Russia
*e-mail: ulchik_7757@mail.ru
Received 6 June, 2019; revised June 6, 2019; accepted June 13, 2019
In the oxidative addition reactions to triphenyl- and tri(4-methylphenyl)antimony in the presence of hydrogen
peroxide as an oxidizing agent, 2,6- and 2,3-dihydroxybenzoic acids act as monofunctional compounds, forming
triarylantimony dicarboxylates. Molecular structures of the synthesized compounds were determined by single
crystal X-ray diffraction analysis. The tendency of compounds in crystals to dimerization with the formation of
intermolecular hydrogen O-H∙∙∙O=C bonds was revealed.
Keywords: triarylantimony, dihydroxybenzoic acids, hydrogen peroxide, triarylantimony dicarboxylates
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 1 2020