ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2020, том 90, № 10, с. 1479-1485
УДК 547.594.3
СИНТЕЗ И БИОЛОГИЧЕСКАЯ АКТИВНОСТЬ
2-АРИЛ-4-ГИДРОКСИ-4-МЕТИЛ-
6-ОКСОЦИКЛОГЕКСАН-1,3-ДИКАРБОКСАМИДОВ
© 2020 г. Н. В. Носова, Д. Д. Лежнина, О. Н. Гейн, В. В. Новикова, В. Л. Гейн*
Пермская государственная фармацевтическая академия Министерства здравоохранения Российской Федерации,
ул. Полевая 2, Пермь, 614990 Россия
*e-mail: geinvl48@mail.ru
Поступило в Редакцию 16 мая 2020 г.
После доработки 16 мая 2020 г.
Принято к печати 31 мая 2020 г.
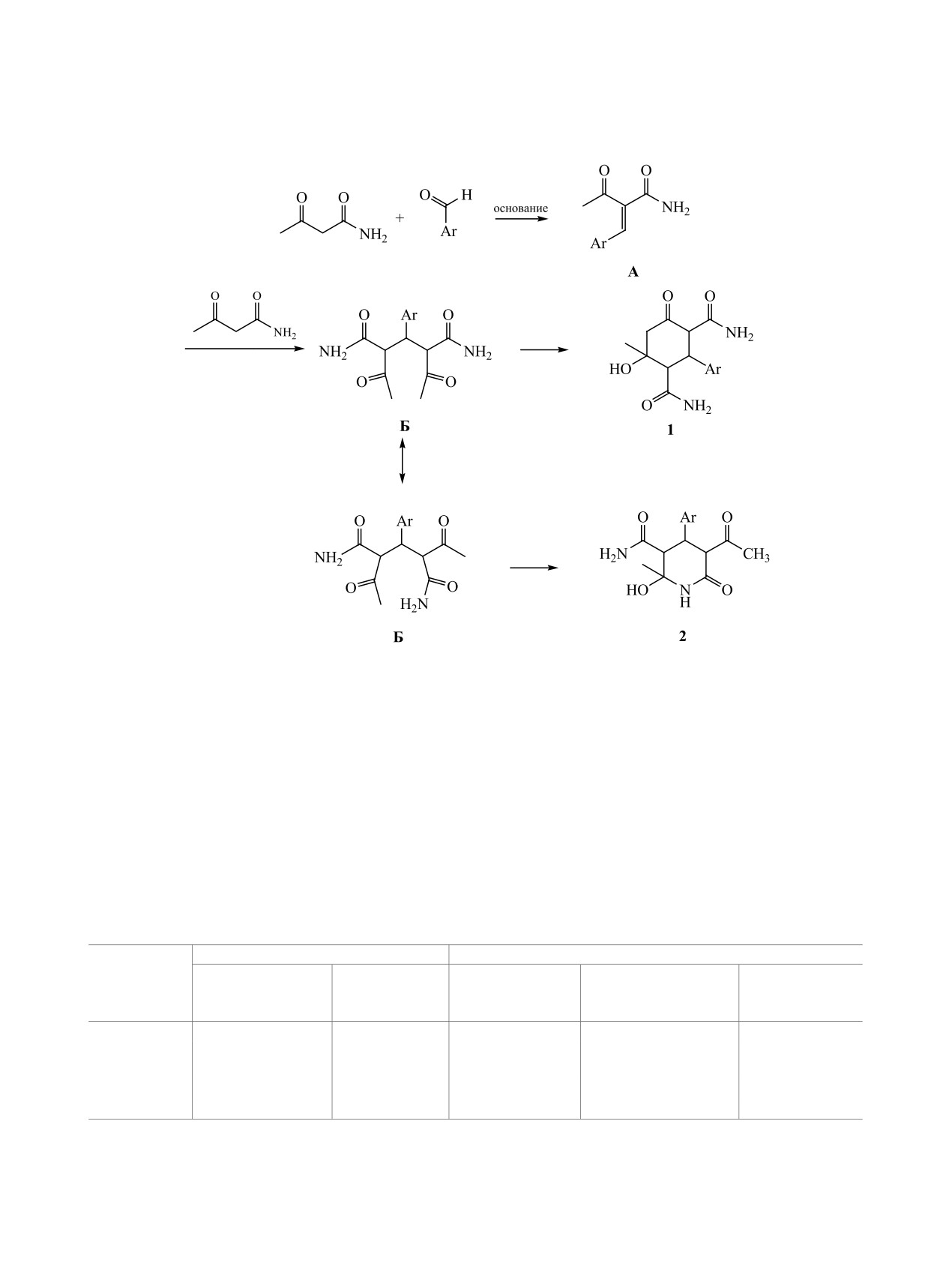
Взаимодействием незамещенного ацетоацетамида с ароматическими альдегидами в этаноле в присут-
ствии пиперидина получены 2-арил-4-гидрокси-4-метил-6-оксоциклогексан-1,3-дикарбоксамиды и
4-арил-5-ацетил-2-гидрокси-2-метил-6-оксопиперидин-3-карбоксамиды, строение которых установлено
на основании данных ИК, ЯМР 1H и 13C спектроскопии. Изучена противомикробная и анальгетическая
активность полученных соединений.
Ключевые слова: 6-оксоциклогексан-1,3-дикарбоксамиды, 6-оксопиперидин-3-карбоксамиды, ацетоа-
цетамид, противомикробная активность, анальгетическая активность, токсичность
DOI: 10.31857/S0044460X20100017
Функционализированные
циклогексаноны
щенного амида ацетоуксусной кислоты с арома-
представляют собой полифункциональные соеди-
тическими альдегидами в этаноле в присутствии
нения, содержащие в своем составе сложноэфир-
основного катализатора - пиперидина - были
ные или амидные группы, гидроксильную группу
получены
2-арил-6-гидрокси-6-метил-4-оксоци-
и ароматический заместитель. К настоящему вре-
клогексан-1,3-дикарбоксамиды [1]. Установлено,
мени разработана методика получения 6-оксоци-
что конденсация амидов ацетоуксусной кислоты
клогексан-1,3-дикарбоксамидов, в условиях ос-
с ароматическими альдегидами может менять на-
новного катализа, позволяющая получать данные
правление циклизации и протекать с образовани-
соединения с высоким выходом [1]. Среди полу-
ем функционализированных пиперидин-2-онов в
ченных соединений обнаружены вещества, обла-
случае орто-замещенных альдегидов с достаточ-
дающие слабой противомикробной активностью
но объемным заместителем в положении 2 арома-
и выраженным анальгетическим действием [2–6].
тического кольца [1], а также при использовании в
Ранее при взаимодействии ацетилацетона,
качестве катализатора кислот Льюиса [10].
алкилацетоацетата или N-замещенного ацетоаце-
С целью получения новых биологически актив-
тамида с ароматическими альдегидами в условиях
ных соединений и установления влияния природы
основного катализа были получены 3-арил-2,4-ди-
и положения заместителя в ароматическом альде-
ацетил-5-гидрокси-5-метилциклогексаноны,2-арил-
гиде на направление реакции и выходы образую-
6-гидрокси-6-метил-4-оксоциклогексан-1,3-дикар-
щихся соединений мы продолжили исследование
боксилаты и 2-арил-6-гидрокси-6-метил-4-оксоци-
клогексан-1,3-дикарбоксамиды [5, 7-9]. Cреди по-
данной реакции. Установлено, что при проведении
лученных веществ, были обнаружены соединения,
дикетонной конденсации ацетоацетамида с пара- и
проявляющие различные виды биологической
мета-замещенными ароматическими альдегидами
активности [5, 7]. При взаимодействии N-незаме-
в соотношении 2:1 в этиловом спирте образуются
1479
1480
НОСОВА и др.
Схема 1.
новые
2-арил-4-гидрокси-4-метил-6-оксоцикло-
ложении 5 алицикла (2.32-2.40 и 2.63-2.76 м. д.)
гексан-1,3-дикарбоксамиды 1а-е (схема 1).
в виде AB-системы (J = 14.0 Гц), два дублета про-
тонов в положениях 1 и 3 алицикла (2.90-3.05 и
При использовании в качестве карбонильной
3.54-3.73 м. д., J = 12.0 Гц), триплет протона в по-
компоненты 2-бромбензальдегида, а также при
наличии в пара-положении ароматического аль-
ложении 2 цикла (3.76-4.15 м. д., J = 12.0 Гц). В
дегида сильных электронодонорных заместителей
спектрах ЯМР 13C соединений 1а-е присутствуют
(Et2N, Me2N) были выделены продукты циклиза-
сигналы атомов углерода при 28.44-28.56 (CH3),
ции c участием амидной группы - 4-арил-5-аце-
168.78-169.97 (C1CO),
174.67-174.99 (C3CO),
тил-2-гидрокси-2-метил-6-оксопиперидин-3-кар-
203.87-204.27 м. д. (C6O).
боксамиды 2а-г (схема 1).
В ИК спектрах соединений 2а-г присутствуют
Полученные соединения 1а-е, 2а-г представ-
полосы валентных колебаний в областях 3159-
ляют собой кристаллические вещества белого или
3358 (NH), 3440-3468 (OH), 1650-1692 (CON) и
светло-желтого цвета, растворимые в диметил-
1700-1727 см-1 (CO). В спектрах ЯМР 1Н и 13С со-
формамиде, диметилсульфоксиде, этилацетате и
единений 2а-г присутствуют сигналы всех групп
уксусной кислоте, при нагревании - в этиловом и
и атомов. ИК и ЯМР спектры соединений 1а-е и
изопропиловом спиртах и нерастворимые в воде.
2а-г аналогичны таковым для ранее описанных
соединений, строение которых подтверждено дан-
В ИК спектрах соединений 1а-е присутствуют
ными РСА [1].
полосы валентных колебаний при 3174-3365 (NH),
3395-3458 (OH), 1657-1695 (CON), 1700-1729 см-1
Вероятный механизм образования 6-оксоци-
(CO). В спектрах ЯМР 1Н соединений 1а-е при-
клогексан-1,3-дикарбоксамидов 1а-е и 6-оксопи-
сутствуют синглет двух протонов амидной груп-
перидин-3-карбоксамидов 2а-г показан на схеме
пы в положении 3 цикла (6.79-7.10 м. д.) и два
2 и согласуется с литературными данными [1]. На
синглета протонов амидной группы в положе-
первой стадии протекает кротоновая конденса-
нии 1 цикла (6.60-6.73 и 7.14-7.34 м. д.), синглет
ция ацетоацетамида с ароматическим альдегидом,
протона гидроксильной группы (4.95-5.09 м. д.),
приводящая к 1,3-непредельному кетону A. Вторая
два дублета протонов метиленовой группы в по-
стадия - конденсация Михаэля - присоединение
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 10 2020
СИНТЕЗ И БИОЛОГИЧЕСКАЯ АКТИВНОСТЬ
1481
Схема 2.
второй молекулы ацетоацетамида к активирован-
сан-1,3-дикарбоксамида 1з [1]. Установлено, что
ной двойной связи кетона с образованием 1,5-ди-
внутрибрюшинное введение соединений в высо-
кетона Б. Третья стадия - внутримолекулярная
ких дозах (2000 мг/кг) не вызывало гибели живот-
циклизация 1,5-дикетона Б в присутствии основа-
ных. Следовательно, ЛД50 изучаемых соединений
ния, приводящая к образованию соответствующих
находится в дозах больших, чем 2000 мг/кг при
циклогексанонов 1 или пиперидинонов 2.
внутрибрюшинном введении, и исследуемые со-
Была исследована острая токсичность и аналь-
единения по классификации К.К. Сидорова отно-
сятся к практически нетоксичным [11].
гетическая активность (см. таблицу) полученных
ранее
4-гидрокси-4-метил-6-оксо-2-фенилцикло-
Как видно из таблицы, анальгетическая актив-
гексан-1,3-дикарбоксамида 1ж и 4-гидрокси-4-ме-
ность была выявлена у исследуемого вещества 1з
тил-6-оксо-2-(4-диэтиламинофенил)циклогек-
в тесте «уксусные корчи» при внутрибрюшинном
Анальгетическая активность соединений 1ж и 1за
Тест «горячая пластинка»
Тест «уксусные корчи»
длительность
уменьшение
Соединение
р по сравнению
количество
р по сравнению
латентного
корчей по сравнению
с контролем
корчей
с контролем
периода, с
с контролем, %
Контроль
12.96±0.91 (n = 8)
-
29.38±4.57 (n = 8)
-
-
Метамизол
19.63 ± 1.37 (n = 8)
<0.01
13.78±3.73 (n = 8)
53.10
<0.05
натрия
1ж
16.48±2.83 (n = 7)
>0.05
25.0±3.75 (n = 8)
14.91
>0.05
1з
16.19±1.91 (n = 7)
>0.05
16.88±1.91 (n = 8)
42.55
<0.05
а Результаты представлены в виде среднего и его стандартной ошибки (М±m); n - количество животных.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 10 2020
1482
НОСОВА и др.
введении в дозе 50 мг/кг. Количество корчей на
этилового спирта. Выход 57%, т. пл. 248-250°С
фоне введения вещества 1з достоверно уменьша-
(этанол). ИК спектр, ν, см-1: 3186.6, 3348.5 (NH),
лось на 42.55% по сравнению с контрольной груп-
3458.1 (OH), 1670 (CON), 1700 (CO). Спектр ЯМР
пой животных.
1Н, δ, м. д.: 1.23 с (3Н; СН3), 2.35 д (1Н, С5Н,
J
= 12.0 Гц), 2.68 д (1Н, С5H, JHH =16.3 Гц), 2.93
При изучении анальгетической активности
HH
соединений 1ж и 1з в тесте «горячая пластинка»
д (1H, С3Н, JHH =12.1 Гц), 3.60 д (1H, С1Н, JHH =
достоверного увеличения длительности пребы-
12.0 Гц), 3.80 т (1H, С2Н, JHH =12.0 Гц), 5.04 с (1Н,
вания животных на нагретой поверхности до на-
OН), 6.65 с (1H, NН2), 6.98 с (2H, NН2), 7.21 д (2Н,
ступления оборонительной реакции (облизывание
4-BrC6H4, JHH = 8.0 Гц), 7.22 с (1H, NH2), 7.44 д
задних лапок, потряхивания ими, подскакивания)
(2Н, 4-BrC6H4, JHH = 8.0 Гц). Спектр ЯМР 13C, δС,
выявлено не было.
м. д.: 28.44 (CH3), 168.78 (C1CO), 174.67 (C3CO),
203.87 (C6O). Найдено, %: C 48.86; H 4.71; N 7.49.
Противомикробную активность соединений
C15H17N2O4Br. Вычислено, %: C 48.79; H 4.64; N
1а-е, 2а-г исследовали по отношению к эталон-
ным штаммам Escherichia coli 25922 ATCC и
7.58.
Staphylococcus aureus 6538P ATCC. Были установ-
Соединения 1б-е получали аналогично.
лены минимальные подавляющие концентрации
4-Гидрокси-4-метил-2-(4-нитрофенил)-6-
(МПК), которые варьируют в интервале от 500 до
оксоциклогексан-1,3-дикарбоксамид
(1б).
1000 мкг/мл. Проведенное исследование свиде-
Выход 65%, т. пл. 178-182°С (этанол). ИК спектр,
тельствует о наличии у соединений низкой проти-
ν, см-1: 3184.1, 3301.1 (NH), 3438.1 (OH), 1662,
вомикробной активности.
1695 (CON), 1717 (CO). Спектр ЯМР 1Н, δ, м. д.:
Таким образом, реакцией ацетоацетамида с аро-
1.25 с (3Н, СН3), 2.38 д (1Н, С5Н, JHH = 12.0 Гц),
матическими альдегидами в условиях основного
2.74 д (1Н, С5H, JHH = 16.0 Гц), 3.03 д (1H, С3Н,
катализа получены новые 2-арил-4-гидрокси-4-ме-
JHH = 12.1 Гц), 3.72 д (1H, С1Н, JHH = 12.4 Гц), 3.97
тил-6-оксоциклогексан-1,3-дикарбоксамиды
и
т (1H, С2Н, JHH = 12.2 Гц), 5.09 с (1Н, OН), 6.71 с
5-ацетил-2-гидрокси-2-метил-4-арил-6-оксопипе-
(1H, NН2), 7.01 д (2H, 2NН, JHH = 20.1 Гц), 7.26 с
ридин-3-карбоксамиды. Среди полученных 6-ок-
(1Н, NH2), 7.55 д (2Н, 4-NO2C6H4, JHH = 8.3 Гц),
социклогексан-1,3-дикарбоксамидов
4-гидрок-
8.14 д (2H, 4-NO2C6H4, JHH = 8.3 Гц). Найдено, %:
си-4-метил-6-оксо-2-(4-диэтиламинофенил)цикло-
C 53.80; H 5.21; N 12.48. C15H17N3O6. Вычислено,
гексан-1,3-дикарбоксамид практически нетокси-
%: C 53.72; H 5.11; N 12.53.
чен и способен уменьшать выраженность перито-
4-Гидрокси-4-метил-2-(4-метоксикарбонил-
висцеральной боли.
фенил)-6-оксоциклогексан-1,3-дикарбоксамид
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
(1в). Выход 61%, т. пл. 220-222°С (этанол). Спектр
ЯМР 1Н, δ, м. д.: 1.23 с (3Н, СН3), 2.36 д (1Н, С5Н,
ИК спектры сняты на приборе Specord M-80 в
JHH = 14.0 Гц), 2.69 д (1Н, С5H, JHH = 14.0 Гц), 3.00
вазелиновом масле. Спектры ЯМР 1Н, 13C записа-
д (1H, С3Н, JHH = 12.1 Гц), 3.70 д (1H, С1Н, JHH =
ны на приборе Bruker DRX 400 с рабочей частотой
12.4 Гц), 3.82 с (1H, OCH3), 5.04 с (1Н, OН), 6.61
400 и 100 М Гц соответственно в ДМСО-d6, вну-
с (1H, NН2), 6.92 с, c (2H, NН), 7.19 с (1Н, NH2),
тренний стандарт - тетраметилсилан. Элементный
анализ проведен на приборе PerkinElmer 2400.
7.39 д (2Н, 4-COOCH3C6H4, JHH = 8.3 Гц), 7.82 д
Температуры плавления определены на приборе
(2H, 4-COOCH3C6H4, JHH = 8.3 Гц). Найдено, %: C
Melting Point M-565.
58.70; H 5.82; N 7.98. C17H20N2O6. Вычислено, %:
C 58.61; H 5.78; N 8.04.
2-(4-Бромфенил)-4-гидрокси-4-метил-6-ок-
социклогексан-1,3-дикарбоксамид (1а). К рас-
4-Гидрокси-4-метил-2-(4-метоксифе-
твору 0.02 моль ацетоацетамида в 10 мл этилового
нил)-6-оксоциклогексан-1,3-дикарбоксамид
спирта добавляли 0.01 моль ароматического альде-
(1г). Выход 51%, т. пл. 218-221°С (этанол). Спектр
гида и 1 мл пиперидина. Смесь выдерживали при
ЯМР 1Н, δ, м. д.: 1.21 с (3Н, СН3), 2.36 д (1Н, С5Н,
комнатной температуре в течение 1-3 сут. Осадок
JHH = 12.0 Гц), 2.62 д (1Н, С5H, JHH = 14.0 Гц),
отфильтровывали и перекристаллизовывали из
2.94 д (1H, С3Н, JHH = 12.1 Гц), 3.52 д (1H, С1Н,
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 10 2020
СИНТЕЗ И БИОЛОГИЧЕСКАЯ АКТИВНОСТЬ
1483
JHH = 12.4 Гц), 3.77 м (3H, CH3O; 1H, С2Н), 4.97 с
с (1Н, OН), 6.59 д (2H, C6H4, JHH = 12.1 Гц), 7.00
(1Н, OН), 6.79 м (2H, C6H4; 3H, NН2), 7.14 м (2H,
с (1H, NН2), 7.05 д (2H, C6H4, JHH = 8.3 Гц), 7.33 с
C6H4; 1H, NН2). Найдено, %: C 59.90; H 6.34; N
(1Н, NH2), 8.47 с (1H, NH). Найдено, %: C 61.33; H
8.68. C16H20N2O5. Вычислено, %: C 59.99; H 6.29;
6.81; N 12.58. C17H23N3O4. Вычислено, %: C 61.24;
N 8.74.
H 6.95; N 12.60.
2-(4-трет-Бутилфенил)-4-гидрокси-4-ме-
Соединения 2б-г получали аналогично.
тил-6-оксоциклогексан-1,3-дикарбоксамид (1д).
5-Ацетил-4-(2-бромфенил)-2-гидрокси-2-ме-
Выход 54%, т. пл. 222-224°С (этанол). ИК спектр,
тил-6-оксопиперидин-3-карбоксамид (2б). Вы-
ν, см-1: 3174.1, 3365.9 (NH), 3423.2 (OH), 1657.7,
ход 36%, т. пл. 212-214°С (этанол). ИК спектр, ν,
1682.6 (CON), 1729.9 (CO).Спектр ЯМР 1Н, δ, м. д.:
см-1: 3206, 3266, 3293.7 (NH), 3443.1 (OH), 1675.1
1.22 с (3H, CH3), 1.27 с [9H, CH(CH3)3], 2.34 д
(CON), 1712.5 (CO). Спектр ЯМР 1Н, δ, м. д.: 1.40
(1H, C5H, JHH = 16.0 Гц), 2.65 д (1H, C5H, JHH =
с (3H, CH3), 2.13 с (3H, COCH3), 2.76 д (1H, C5H,
12.0 Гц), 2.93 д (1H, C3H, JHH = 12.0 Гц), 3.58 д
J
= 4.1 Гц), 4.52 д (1H, С3H, JHH = 12.1 Гц), 4.68
HH
(1H, C1H, JHH = 12.0 Гц), 3.79 т (1H, C2H, JHH =
д. д (1H, C4H, JHH = 16.1 Гц), 5.95 с (1Н, OН), 6.76 с
12.2 Гц), 5.02 с (1H, OH), 6.60 с (1H, NH2), 6.96
(1H, NH), 7.33 с (3H, NН), 8.15 с (1H, NH). Найде-
с (2H, NH2), 7.18 д [2H, 4-C(CH3)3C6H4, JHH =
но, %: C 48.83; H 4.71; N 7.48. C15H17N2O4Br. Вы-
8.1 Гц], 7.26 д [2H, 4-C(CH3)3C6H4, JHH = 8.1 Гц].
числено, %: C 48.79; H 4.64; N 7.58; O 17.33.
Спектр ЯМР 13C, δС, м. д.: 28.56 (CH3), 168.97
5-Ацетил-2-гидрокси-4-(4-гидрокси-3-эток-
(C1CO), 174.99 (C3CO), 204.27 (C6O). Найдено, %:
сифенил)-2-метил-6-оксопиперидин-3-карбок-
C 65.93; H 7.61; N 7.98. C19H26N2O4. Вычислено,
самид (2в). Выход 37%, т. пл. 153-155°С (этанол).
%: C 65.87; H 7.56; N 8.08.
ИК спектр, ν, см-1: 3159.2, 3358.4 (NH), 3468 (OH),
4-Гидрокси-4-метил-6-оксо-2-(тиенил-2-ил)-
1667.7, 1692.6 (CON), 1702 (CO). Спектр ЯМР 1Н,
циклогексан-1,3-дикарбоксамид
(1е). Выход
δ, м. д.: 1.40 с (3Н, СН3), 2.00 с (3H, COCH3), 2.88
49%, т. пл. 212-215°С (этанол). ИК спектр, ν, см-1:
д (1H, C5H, JHH = 12.4 Гц), 3.65 д (1H, С3H, JHH =
3191.6, 3238.9, 3298.7 (NH), 3395.8 (OH), 1662,
12.4 Гц), 3.74 т (1H, C4H, JHH = 24.1 Гц), 4.0 д (2H,
1675.1, 1695.1 (CON), 1715.0 (CO).Спектр ЯМР
OCH2CH3, JHH = 4.2 Гц), 5.92 с (1Н, OН), 6.61 т
1Н, δ, м. д.: 1.24 с (3Н, СН3), 2.35 д (1H, С5H, JHH =
(2H, C6H4, JHH = 20.1 Гц), 6.82 с (1H, C6H4), 7.03
16.1 Гц), 2.65 д (1H, С5H, JHH = 16.1 Гц), 2.92 д (1H,
с (1Н, NH), 7.33 с (1Н, NH), 8.48 с (1H, NH), 8.58
С3Н, JHH = 12.1 Гц), 3.55 д (1H, С1Н, JHH = 12.1 Гц),
с (1H, OH). Найдено, %: C 58.33; H 6.41; N 7.88.
4.12 т (1H, С2Н, JHH = 24.1 Гц), 4.95 с (1Н, OН), 6.73
C17H22N2O6. Вычислено, %: C 58.27; H 6.32; N 7.99.
с (1H, NН2), 6.90 с (2H, C4H3S), 7.08 д (2H, 2NH,
JHH = 16.2 Гц), 7.30 с (1Н, С4H3S), 7.34 с (1H, NH2).
5-Ацетил-2-гидрокси-2-метил-6-оксо-
Найдено, %: C 52.73; H 5.51; N 9.38. C13H16N2O4S.
4-(4-диэтиламинофенил)пиперидин-3-карбокс-
Вычислено, %: C 52.68; H 5.44; N 9.45.
амид (2г). Выход 45%, т. пл. 178-182°С (этанол).
ИК спектр, ν, см-1: 3224, 3355 (NH), 3455 (OH),
5-Ацетил-2-гидрокси-2-метил-4-(4-диметил-
1650.2, 1675.1 (CON), 1727.4 (CO). Спектр ЯМР
аминофенил)-6-оксопиперидин-3-карбоксамид
1Н, δ, м. д.: 1.07 т [6H, N(CH2CH3)2, JHH = 12.1 Гц],
(2а). К раствору 0.06 моля ацетоацетамида в 20
1.39 с (3Н, СН3), 2.00 с (2H, CH3CH), 2.85 д (1H,
мл этилового спирта при охлаждении добавляли
C5H, JHH = 12.1 Гц), 3.26 с [6H, N(CH2CH3)2], 3.58
0.03 моль ароматического альдегида и 2 мл пипе-
д (1H, С3H, JHH = 12.1 Гц), 3.71 т (1H, C4H, JHH =
ридина. Смесь выдерживали при комнатной тем-
24.1 Гц), 5.92 c (1Н, OН), 6.53 д (2H, C6H4, JHH =
пературе в течение 1-3 сут. Осадок отфильтро-
12.1 Гц), 7.02 д (2H, C6H4NH, JHH = 8.3 Гц) 7.33 с
вывали и перекристаллизовывали из этилового
(1H, NН2), 8.47 с (1H, NH2). Найдено, %: C 63.23; H
спирта. Выход 53%, т. пл. 240-243°С (этанол). ИК
7.61; N 11.58. C19H27N3O4. Вычислено, %: C 63.13;
спектр, ν, см-1: 3191.6, 3303.6 (NH), 3440.6 (OH),
H 7.52; N 11.62.
1665 (CON), 1700 (CO).Спектр ЯМР 1Н, δ, м. д.:
1.39 с (3Н, СН3), 1.99 с (3H, COCH3), 2.87 д (7H,
Острую токсичность
4-гидрокси-4-ме-
(СH3)2N + CH, JHH = 8.3 Гц), 3.59 д (1H, С5H, JHH =
тил-6-оксо-2-фенилциклогексан-1,3-дикарбокса-
12.1 Гц), 3.74 т (1H, С3Н, C4H, JHH = 24.1 Гц), 5.92
мида
1ж и
4-гидрокси-4-метил-6-оксо-2-(4-ди-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 10 2020
1484
НОСОВА и др.
этиламинофенил)циклогексан-1,3-дикарбоксами-
Работа выполнена с соблюдением всех приме-
да 1з изучали, используя экспресс-метод В.Б. Про-
нимых международных, национальных и институ-
зоровского [12]. Исследуемые вещества вводили
циональных руководящих принципов по уходу и
внутрибрюшинно в дозах 500, 1000, 1260, 1580 и
использованию животных.
2000 мг/кг.
КОНФЛИКТ ИНТЕРЕСОВ
Анальгетическую активность соединений
Авторы заявляют об отсутствии конфликта
изучали методом термического раздражения «го-
интересов.
рячая пластинка» и методом специфической бо-
левой реакции «уксусные корчи» на беспородных
СПИСОК ЛИТЕРАТУРЫ
мышах [13]. В тесте «горячая пластинка» исследу-
1. Gein V.L., Nosova N.V., Yankin A.N., Bazhina A.Y.,
емые вещества вводили внутрибрюшинно в дозе
Dmitriev M.V. // Tetrahedron Lett. 2019. Vol. 60. N 24.
50 мг/кг в 2%-ной крахмальной слизи за 60 мин
P. 1592. doi 10.1016/j.tetlet.2019.05.023
до помещения животных на нагретую до 52°С ме-
2. Гейн В.Л., Гейн Н.В., Воронина Э.В., Кривень-
таллическую пластинку. Показателем ноцицепции
ко А.П. // Хим.-фарм. ж. 2002. Т. 36. № 3. С. 23;
служила длительность пребывания животного на
Gein V.L., Voronina E.V., Gein N.V., Krivenko A.P. //
«горячей пластинке» до наступления оборони-
Pharm. Chem. J. 2002. Vol. 36. N 3. P. 131. doi
тельной реакции (облизывание задних лапок, по-
10.1023/A:1019678210738
тряхивания ими, подскакивания), измеряемая в
3. Гейн В.Л., Зорина А.А., Гейн Н.В., Ворониина Э.В.,
секундах.
Кривенько А.П. // Хим.-фарм. ж. 2005. Т. 39. № 4.
С.21; Gein V.L., Zorina A.A., Gein N.V., Voronina E.V.,
Болевую реакцию в тесте «уксусные корчи» вы-
Krivenko A.P. // Pharm. Chem. J. 2005. Vol. 39. N 4.
зывали внутрибрюшинным введением 0.75%-ной
P. 188. doi 10.1007/s11094-005-0114-z.
уксусной кислоты (из расчета 0.1 мл на 10 г мас-
4. Гейн В.Л., Вагапов А.В., Носова Н.В., Воронии-
сы животного) через 30 мин после внутрибрюш-
на Э.В., Вахрин М.И., Кривенько А.П. // Хим.-фарм.
инного введения исследуемых соединений в дозе
ж. 2010. Т. 44. № 5. С. 29; Gein V.L., Vagapov A.V.,
50 мг/кг. В течение последующих 20 мин после
Nosova N.V., Voronina E.V., Vakhrin M.I., Krivenko
инъекции уксусной кислоты подсчитывали коли-
A.P. // Pharm. Chem. J. 2010. Vol. 44. N 5. P. 245. doi
чество корчей для каждого животного. Контроль-
10.1007/s11094-010-0440-7
ной группе животных вводили эквивалентный
5. Гейн В.Л., Одегова Т.Ф., Янкин А.Н., Носова Н.В.
объем 2%-ной крахмальной слизи. В качестве эта-
// Хим.- фарм. ж. 2015. Т. 49. № 4. С. 36; Gein V.L.,
лона сравнения использовали метамизол натрия
Odegova T.F., Yankin A.N., Nosova N.V. // Pharm. Chem.
(анальгин) в дозе 50 мг/кг, вводимый аналогично
J. 2015. Vol. 49. N 4. P. 246. doi 10.1007/s11094-015-
исследуемым соединениям. Результаты статисти-
1264-2
чески обрабатывали с использованием критерия
6. Сорокин В.В., Кривенько А.П., Виноградова Н.А.,
Стьюдента. Эффект считали достоверным при p <
Плотников О.П. // Хим.-фарм. ж. 2001. Т. 35. № 9.
0.05.
С. 24; Sorokin V.V., Krivenko A.P., Vinogadova N.A.,
Plotnikov O.P. // Pharm. Chem. J. 2001. Vol. 35. N 9.
Антимикробную активность соединений 1а-е,
P. 488. doi 10.1023/ A:1014090608261
2а-г по отношению к штаммам Escherichia coli
7. Гейн В.Л., Левандовская Е.Б., Носова Н.В., Анто-
ATCC 25922 и Staphylococcus aureus ATCC 6538-P
нова Н.В., Воронина Э.В., Вахрин М.И., Кривень-
определяли методом последовательных разведе-
ко А.П. // Хим.-фарм. ж. 2007. Т. 41. № 12. С. 21;
ний раствора исследуемых веществ в мясопептон-
Gein V.L., Levandovskaya E.V., Nosova N.V., Antono-
ном бульоне (МПБ) при бактериальной нагрузке
va N.V., Voronina E.V., Vakhrin M.I., Krivenko A.P.
250 тыс. микробных единиц на 1 мл раствора. За
// Pharm. Chem. J. 2007. Vol. 41. N 12. P. 643. doi
действующую дозу принимали минимальную по-
10.1007/s11094-008-0043-8
давляющую концентрацию (МПК) соединения -
8. Кривенько А.П., Сорокин В.В. // ЖОрХ. 1999. Т. 35.
максимальное разведение, приводящее к полному
Вып. 8. С. 1127; Krivenko A.P., Sorokin V.B. // Russ. J.
подавлению развития тест-микробов. В качестве
Org. Chem. 1999. Vol. 35. N 8. P. 1097.
препаратов сравнения использовали диоксидин и
9. Гейн В.Л., Левандовская Е.Б., Носова Н.В., Вах-
фурацилин.
рин М.И., Кривенко А.П., Алиев З.Г. // ЖОрХ. 2007.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 10 2020
СИНТЕЗ И БИОЛОГИЧЕСКАЯ АКТИВНОСТЬ
1485
Т. 43. Вып. 7. С. 1101; Gein V.L., Levandovskaya E.B.,
12. Прозоровский В.В., Прозоровская М.П., Демчен-
Nosova N.V., Vakhrin M.I., Kriven’ko A.P., Aliev Z.G.
ко В.М. // Фармакология и токсикология. 1978. Т. 41.
№ 4. С. 497.
Russ. J. Org. Chem. 2007. Vol. 43. N 7. P. 1096. doi
10.1134/S1070428007070275
13. Руководство по проведению доклинических ис-
следований лекарственных средств / Под ред.
10. Sengupta T., Gayen K.S., Pandit P., Maiti D.K. //
А.Н. Миронова, Н.Д. Бунатян, А.Н. Васильева,
Chem. Eur. J. 2012. Vol. 18. P. 1905. doi 10.1002/
О.Л. Верстаковой, М.В. Журавлевой, В.К. Лепахи-
chem.201103354
на, Н.В. Коробова, В.А. Меркулова, С.Н. Орехова,
11. Сидоров К.К. // Токсикология новых промышленных
И.В. Сакаевой, Д.Б. Утешева, А.Н. Яворского. М.:
химических веществ. 1973. № 13. С. 47.
Гриф и К, 2012. Ч. 1. 944 с.
Synthesis and Biological Activity of 2-Aryl-4-hydroxy-4-methyl-
6-oxocyclohexane-1,3-dicarboxamides
N. V. Nosova, D. D. Lezhnina, O. N. Gein, V. V. Novikova, and V. L. Gein*
Perm State Pharmaceutical Academy, Perm, 614990 Russia
*e-mail: geinvl48@mail.ru
Received May 16, 2020; revised May 16, 2020; accepted May 31, 2020
The reaction of unsubstituted acetoacetamide with aromatic aldehydes in ethanol in the presence of piperidine
gave 2-aryl-4-hydroxy-4-methyl-6-oxocyclohexane-1,3-dicarboxamides and 4-aryl-5-acetyl-2-hydroxy-2-
methyl-6-oxopiperidine-3-carboxamides. Structures of the products were proved using IR, 1H and 13C NMR
spectroscopy methods. The synthesized compounds were tested for antimicrobial and analgesic activities.
Keywords: 2-aryl-4-hydroxy-4-methyl-6-oxocyclohexane-1,3-dicarboxamides, acetoacetamide, aromatic
aldehydes, antimicrobial activity, analgesic activity, toxicity
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 10 2020