ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2020, том 90, № 10, с. 1486-1494
УДК 547.587.2:544.43:544.18
ФЕНОЛКАРБОНОВЫЕ КИСЛОТЫ В
РЕАКЦИИ С ЭЛЕКТРОГЕНЕРИРОВАННЫМ
ГИДРОПЕРОКСИЛЬНЫМ РАДИКАЛОМ
© 2020 г. Н. И. Белаяa,*, А. В. Белыйa, О. М. Заречнаяb,
И. Н. Щербаковc, В. С. Дорошкевичa
a Донецкий национальный университет, ул. Университетская 24, Донецк, 83001 Украина
b Институт физико-органической химии и углехимии имени Л.М. Литвиненко, Донецк, 83114 Украина
c Южный федеральный университет, Ростов-на-Дону, 344006 Россия
*e-mail: nat.iv.belaya@gmail.com
Поступило в Редакцию 21 мая 2020 г.
После доработки 21 мая 2020 г.
Принято к печати 1 июня 2020 г.
Исследование методом хроновольтамперометрии показало, что восстановление кислорода на ртутном
электроде в кислой среде в присутствии фенолкарбоновых кислот протекает, как обратимый электродный
процесс с последующей лимитирующей реакцией гидропероксильного радикала. Константы скорости
взаимодействия фенолкарбоновых кислот с радикалом НОО• рассчитаны в рамках теории электродного
процесса с последующей химической реакцией. Возможный механизм реакции - перенос электрона от
молекулярной формы кислоты к радикалу - подтверждается корреляцией между экспериментальными
константами скорости и потенциалами ионизации кислот, рассчитанными методом DFT.
Ключевые слова: фенолкарбоновая кислота, гидропероксильный радикал, антиоксидант, потенциал
ионизации
DOI: 10.31857/S0044460X20100029
Фенолкарбоновые кислоты относятся к одной
механизм, в котором важную роль играют природ-
из наиболее многочисленных групп растительных
ные антиоксиданты, в том числе фенолкарбоновые
фенольных соединений. Их важнейший структур-
кислоты и их производные. Изучение кинетики и
ный элемент - фенольная группа OH, ответствен-
механизма их радикального окисления, установле-
ная за антирадикальную и антиоксидантную ак-
ние молекулярных дескрипторов, ответственных
тивность [1, 2]. Благодаря карбоксигруппе COOH,
за скорость протекания этого процесса, а также оп-
диссоциирующей при низких значениях рН, фе-
тимизация условий его проведения - перспектив-
нолкарбоновые кислоты реагируют с радикалами
ные направления исследований в области химии,
в кислых средах в форме карбоксилат-ионов, бо-
биохимии, медицины и фармации.
лее активных, чем нейтральные молекулы [3, 4].
Нами проведено хроновольтамперометриче-
В широком спектре биологической активности
ское и квантово-химическое исследование ан-
фенолкарбоновых кислот наиболее важное место
тирадикальной активности фенолкарбоновых
занимает их способность дезактивировать актив-
кислот (НООСArОН) и их эфиров (ROOCArOH)
ные формы кислорода, такие как О2•-, НОО•, НО•
в реакции с электрогенерированным гидроперок-
и т. д. [5-7]. Активные формы кислорода участву-
сильным радикалом НОО•. Реакция протекла при
ют в важнейших физиологических процессах, но
электровосстановлении О2 до Н2О2 на ртутном
при повышенной концентрации могут негативно
пленочном электроде при рН = 2. Объекты иссле-
влиять на организм человека. Для регулирования
дования - моно- (1-6) и дигидроксибензойные
негативных последствий существует защитный
кислоты и их эфиры (7-14), относящиеся к груп-
1486
ФЕНОЛКАРБОНОВЫЕ КИСЛОТЫ
1487
Схема 1.
пе растительных фенолкарбоновых кислот
[8]
динения электрона к молекуле кислорода (1) [13].
(схема 1).
Нами проведено восстановление кислорода толь-
В качестве радикала выступала протонирован-
ко до пероксида водорода [реакции (1)-(3)]; обра-
ная форма супероксид-анион-радикала кислорода
зование в системе в кислых средах интермедиата
O•- - гидропероксильный радикал HOO•, генери-
НОО• подтверждали экспериментальными и рас-
руемый при электровосстановлении кислорода до
четными методами.
пероксида водорода при рН = 2 в цитратно-фос-
(1)
фатном буфере при 293±2 K. Применение сильно-
(2)
кислой среды необходимо для образования прото-
(3)
нированной формы O•- и подавления диссоциации
фенолкарбоновых кислот.
Вначале методом QSPR в программном пакете
Поляризацию рабочего ртутного пленочного
Marvin 18.14 рассчитывали распределение доли
•-
электрода проводили линейно изменяющимся на-
протонированной и депротонированной форм O
пряжением с амплитудой от 0.02 до 0.08 В/с. Ха-
рактерные поляризационные кривые имеют мак-
симумы (рис. 1), обусловленные нестационарной
диффузией вещества к электроду [9]. Пик электро-
восстановления О2 до Н2О2 (рис. 1) идентифици-
ровали при барботировании аргона через иссле-
дуемый раствор в течение 20 мин, после чего на
хроновольтамперограмме он исчезал полностью.
Величину полученного остаточного тока исключа-
ли при определении потенциала полуволны (Е1/2)
восстановления О2.
Потенциал восстановления Н2О2 до Н2О на
ртутном электроде значительно отрицательнее по-
тенциала его образования [10-12]. Это позволяет
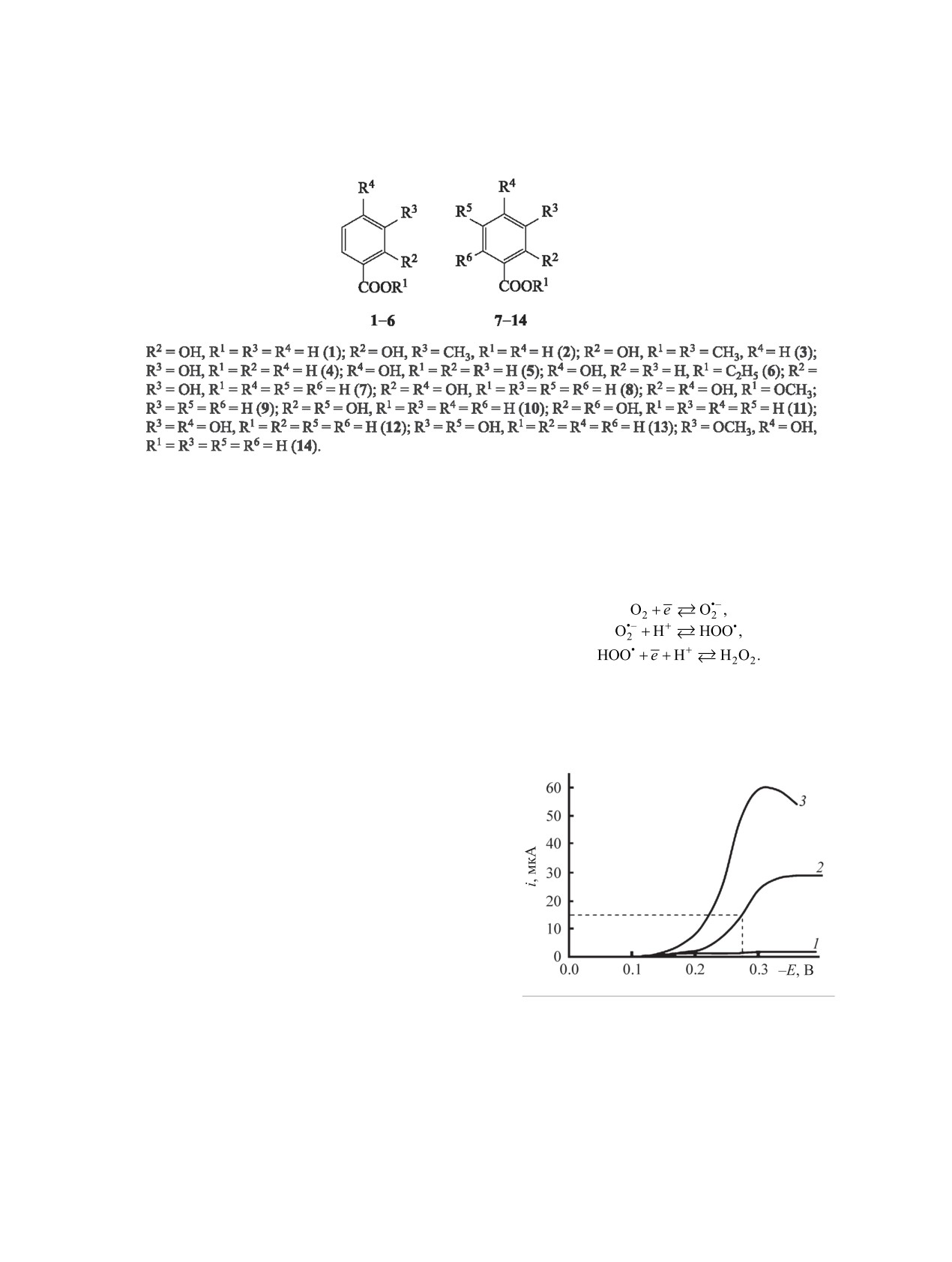
Рис. 1. Хроновольтамперометрические кривые элек-
наблюдать на поляризационных кривых две волны
тровосстановления О2 до Н2О2 на ртутном пленоч-
номэлектроде в цитратно-фосфатном буфере при рН =
электровосстановления О2, изучать кинетику вос-
9 (293±2 K): 1 - после 15 мин барботирования Ar (со-
становления О2 и Н2О2 в отдельности. На ртутном
ответствует величине остаточного тока); 2 - после
пленочном электроде восстановление при рН < 8
15 мин барботирования О2 в постоянно-токовом режи-
необратимо, при рН = 8-9 - квазиобратимо, при
ме при υ = 0.002 В/с; 3 - после 15 мин барботирования
рН ≥ 9 - обратимо с замедленной стадией присое-
О2 с разверткой напряжения υ = 0.04 В/с.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 10 2020
1488
БЕЛАЯ и др.
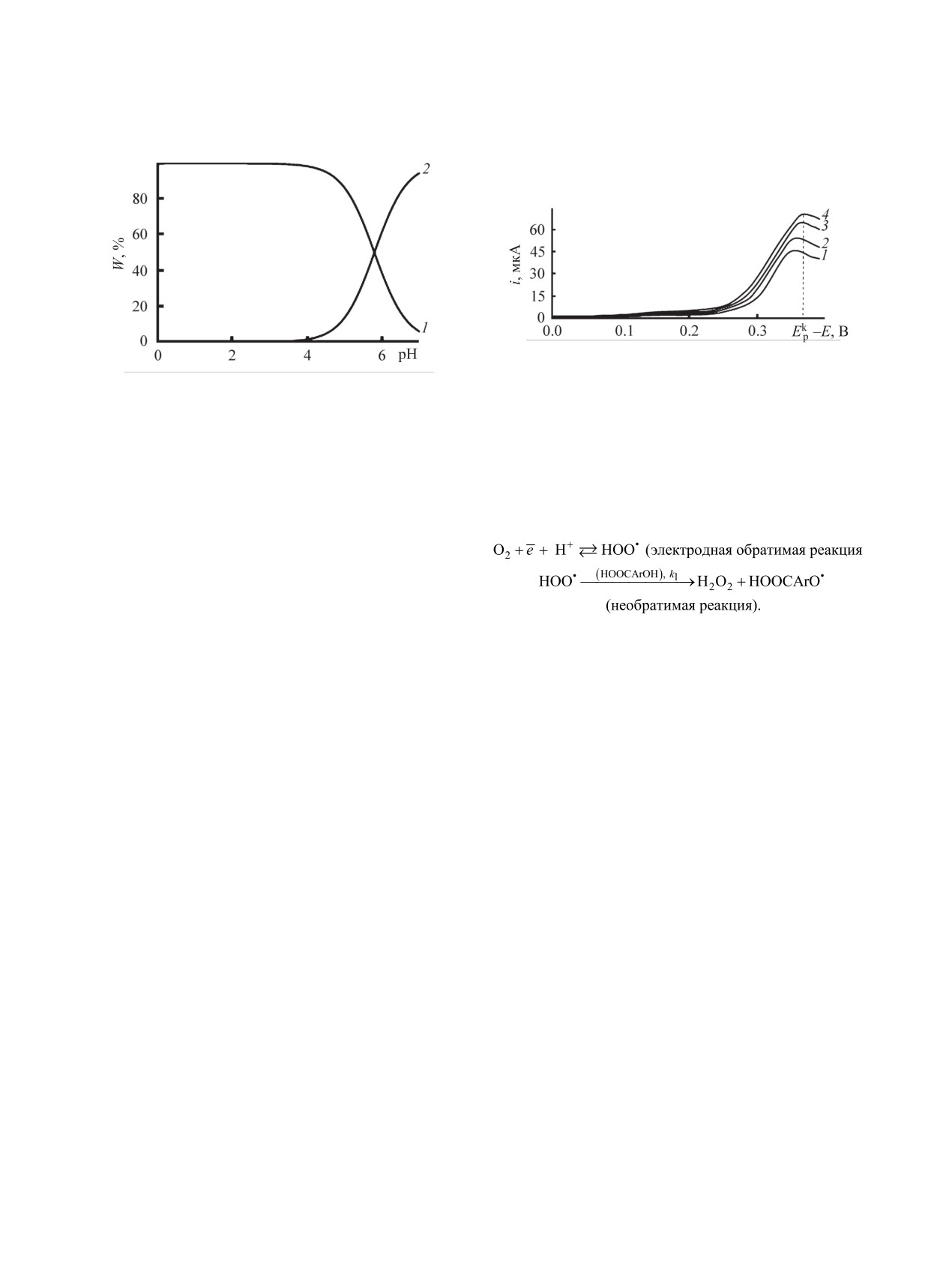
Рис. 3. Хроновольтамперограммы электровосстанов-
ления О2 до Н2О2 на ртутном пленочном электроде в
Рис. 2. Распределение доли (W) депротонированной (2)
цитратно-фосфатном буфере при рН = 2 (293±2 K) в
и протонированной (1) форм супероксид анион-радика-
присутствии салициловой кислоты (c = 5×10-4 моль/л)
ла кислорода O2
•- при различных значениях рН среды,
при разных скоростях развертки потенциала (В/с):
рассчитанное методом QSPR в программе Marvin 18.14.
1 - 0.02; 2 - 0.04; 3 - 0.06; 4 - 0.08.
при изменении рН среды [14]. В кислых средах до
ление О2 в присутствии фенолкарбоновой кислоты
рН = 3 присутствует только радикал НОО• (рис. 2),
протекает как обратимый электродный процесс с
•-
•-
а начиная с рН = 3 и выше - O
. Присутствие O2
последующей необратимой реакцией (4).
подтверждали исследованием реакционной смеси
с индикатором тетразолием нитросиним (NBT)
[15]. При электровосстановлении О2 с увеличени-
(4)
ем рН среды (от 7 и выше) возрастает максимум
поглощения на спектре реакционной смеси при
Влияние химической реакции, следующей за
530 нм, принадлежащий продукту взаимодействия
переносом электрона, заметно только, когда пе-
O•- и индикатором NBT (формазану). В кислом бу-
ренос заряда на электроде протекает быстро и об-
фере добавка индикатора не вызывает изменения
ратимо. Потенциал обратимого электрода в этом
окраски раствора, что свидетельствует о присут-
случае, согласно уравнению Нернста, определяет-
ствии в растворе только НОО•. Таким образом, при
ся отношением между концентрациями О2 и НОО•
электровосстановлении О2 до Н2О2 на ртутном
у его поверхности. Если скорость химического
пленочном электроде в кислых средах в качестве
превращения НОО• в H2O2 близка по порядку ве-
интермедиата генерируется протонированная фор-
личины к скорости удаления радикала от электро-
ма супероксид анион-радикала кислорода НОО•, а
да или превышает ее, то протекание химической
в щелочных - его депротонированная форма O
•-.
реакции НОО• с НООCArOH будет сопровождать-
При введении в систему фенолкарбоновой
ся изменением потенциала. При необратимом вос-
кислоты - потенциального акцептора НОО• - на-
становлении концентрация продукта электродной
блюдается смещение потенциала пика электровос-
реакции НОО• не влияет на электродный потенци-
становления О2 (Epk) в положительную область в
ал. Поэтому изменение концентрации НОО•, вы-
результате изменения механизма электрохимиче-
званное последующей реакцией, также не влияет
ской реакции (рис. 3). На основании литератур-
на потенциал [18].
ных данных [16, 17, 13] можно предположить, что
исследуемая реакция протекает как электродный
Согласно теории обратимого электродного про-
цесса с последующей химической реакцией [19],
процесс с последующей лимитирующей хими-
ческой реакцией. Для упрощения исследования
для реакций первого порядка (4) четко сформу-
кинетики реакции концентрацию фенолокислоты
лированы основные диагностические критерии
увеличивали в 20 и более раз против концентрации
[20, 21]: зависимость (5) потенциала кинетическо-
кислорода. В таком случае химическая реакция
го пика (Epk) от логарифма развертки потенциала
имеет псевдопервый порядок, и электровосстанов-
[ln(1/υ)] линейна с наклоном RT/2nF.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 10 2020
ФЕНОЛКАРБОНОВЫЕ КИСЛОТЫ
1489
Таблица 1. Экспериментальные кинетические и стехиометрические параметры реакции (4), а также расчетные зна-
чения рKa фенолкарбоновых кислот и их эфиров 1-14
Порядок реакции по
Соединение
k1, 1/с
Число электронов, n
k, л/(моль∙с)
pKa
кислоте, n
HOOCArOH
1
(1.01±0.03)×10-2
0.99
20.1±0.6
1.02
2.79
2
(3.25±0.11)×10-2
1.01
64.9±1.6
1.00
2.80
3
(4.05±0.13)×10-2
1.00
81.2±2.4
1.02
10.10
4
(7.51±0.23)×10-3
1.00
14.8±0.4
1.03
3.85
5
(2.55±0.11)×10-3
0.99
5.13±0.15
1.01
4.38
6
(4.05±0.13)×10-3
0.99
8.09±0.29
1.02
8.5
7
(11.9±0.4)×10-2
1.02
240±6
1.00
2.56
8
(1.42±0.04)×10-2
0.99
28.2±0.8
1.02
3.10
9
(1.78±0.05)×10-2
0.98
35.8±1.2
1.03
8.58
10
(4.1±1.2)×10-2
1.02
820±21
1.00
2.53
11
(8.5±0.3)×10-2
1.01
170±5
1.00
1.65
12
(3.85±0.12)×10-2
1.00
77.3±2.2
1.03
4.16
13
(2.06±0.06)×10-2
1.00
50.7±1.5
1.01
3.61
14
(10.08±0.3)×10-2
0.98
200±6
1.02
4.16
яние равновесия, и потенциал пика не изменяется.
(5)
При больших значениях υ > 0.08 В/с потенциал
пика Epk изменяется незначительно, поскольку хи-
мическая реакция не влияет на концентрацию пер-
вичного продукта (НОО•) электродной реакции, и
электровосстановление, согласно литературным
Здесь Epk - потенциал тока пика электровосстанов-
данным [18, 20], становится необратимым.
ления О2 до Н2О2 в присутствии фенолкарбоновой
Определение константы скорости k1 химиче-
кислоты, В; E1/2 - обратимый потенциал полувол-
ской реакции псевдопервого порядка в коорди-
ны электровосстановления О2 до Н2О2, В; k1 - кон-
натах зависимости Epk от ln(1/υ) не представляет
станта скорости последующей химической ре-
больших трудностей, если известно значение об-
акции НОО• с HOOCArOH первого порядка (при
ратимого потенциала полуволны (E1/2). Такая за-
условии избытка фенолокислоты), 1/с; n - число
висимость была успешно применена при исследо-
электронов, участвующих в лимитирующей ста-
вании кинетики образования интерметаллических
дии; υ - скорость развертки потенциала, В/с.
соединений в ртути [20]. По аналогии с указанной
Из уравнения (5) следует, что при восстановле-
работой мы впервые применили теорию электрод-
нии потенциал пика Epk смещается относительно
ного процесса с последующей необратимой хими-
обратимого потенциала полуволны Е1/2 в направ-
ческой реакцией для расчета констант скоростей
лении положительных значений (рис. 3). Это сме-
реакций с участием активных форм кислорода. Ве-
щение тем больше, чем выше константа скорости
личину E1/2 определяли в отдельном эксперименте
последующей химической реакции первого по-
при электровосстановлении О2 до H2O2 (без до-
рядка k1 и чем меньше скорость развертки напря-
бавки НООСArОН) в постоянно-токовом режиме
жения поляризации υ. Указанные закономерности
при υ = 0.002 В/с (рис. 1) в щелочной среде. При
выполняются при n = 1.
рН = 9 (в цитратно-фосфатном буфере) восстанов-
Строгая линейная зависимость Epk от ln(1/υ) (с
ление кислорода на ртутном пленочном электроде
коэффициентом корреляции r > 0.99) соблюдается
становится обратимым, что подтверждается как
только в диапазоне скоростей развертки потенци-
литературными данными [13], так и эксперимен-
алов от 0.02 до 0.08 В/с. При υ < 0.01 В/с скорость
тальными результатами: потенциал пика опере-
последующей реакции высока, достигается состо-
жает потенциал полуволны на 28 мВ (рис. 1), что
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 10 2020
1490
БЕЛАЯ и др.
характерно для обратимых процессов при n = 1
ет 1 (табл. 1), что свидетельствует о протекании
[18, 20]. Полученное значение E1/2 = -0.27 В мож-
элементарного химического акта НООСArОН с
но использовать и в кислых средах, поскольку по-
НОО• и об отсутствии влияния на кинетику реак-
тенциал полуволны электровосстановления О2 до
ции (4) продуктов превращения кислот.
H2O2 на ртутных электродах не изменяется в диа-
Из величин рKа фенолкарбоновых кислот и их
пазоне рН = 1-9 [11].
эфиров (по первой ступени диссоциации), рассчи-
В другой серии измерений при υ = 0.02-
танных методом QSPR в программе Marvin 18.14,
0.08 В/с восстановление О2 проводили в присут-
следует (табл. 1), что при рН = 2 в системе при-
ствии НООСArОН (рис. 2, а). Методом линейного
сутствуют только молекулярные формы реагентов.
регрессионного анализа из зависимости Epk - lnυ
В этом случае химическая реакция НООСArОН
по величине углового параметра вычисляли чис-
с НОО• может протекать по механизму (7) пере-
ло электронов (n), участвующих в лимитирующей
носа электрона с кислоты на гидропероксильный
стадии, а по свободному параметру - величину k1
радикал с последующей потерей протона (ET-
(табл. 1).
PT)
[23,
24] образующимся катион-радикалом
НООСArOH•+.
Вычисленные значения k1 коррелирова-
ли с кинетическим критерием оценки общей
антиоксидантной активности вещества
[K,
мкмоль/(л∙мин)] [13, 16, 22], определявшимся при
электровосстановлении О2 в аналогичных усло-
(7)
виях методом вольтамперометрии по измерению
предельного тока восстановления кислорода при
Механизм (НАТ) (8) отрыва атома Н с участи-
разных концентрациях антиоксиданта. Для моно-
ем молекулярной формы для данных реакций не
гидроксибензойных кислот и их эфиров наблю-
рассматривался, поскольку вероятность его про-
дается симбатное изменение указанных величин,
текания в полярных средах крайне мала, что под-
что свидетельствует об адекватности полученных
тверждается как литературными данными [25, 26],
констант.
так и проведенными ранее исследованиями [27].
Из значений k1 для разных начальных кон-
центраций
[HOOCArOH]0 (при условии, что
(8)
[HOOCArOH]0 >> [O2]0) рассчитывали порядок
Один из способов подтверждения механиз-
реакции по фенолкарбоновой кислоте (nHOOCArOH)
ма реакции - поиск и установление зависимости
и константу скорости реакции второго порядка (k)
реакционной способности вещества от его моле-
в координатах уравнения (6).
кулярных дескрипторов, рассчитанных кванто-
(6)
во-химическим методом. Квантово-химические
Если W = k1[HOO•], так как [HOOCArOH]0 >>
вычисления проводили с использованием пакета
[O2]0 , то k1
= k [HOOCArOH]nHOOCArOH [W -
Gaussian 09 [28]. Поиск стабильных конформе-
скорость химической реакции (4)].
ров фенолкарбоновых кислот предварительно
Поскольку путем линеаризации данных в коор-
устанавливали полуэмпирическим методом PM6.
динатах уравнения (5) установлен первый порядок
Структуры с минимальной энергией использова-
реакции по радикалу НОО• и порядок по кислоте
ли в качестве начального приближения для рас-
также не выше первого (табл. 1), общий порядок
четов в рамках теории функционала электронной
реакции НООСArОН с НОО• является вторым.
плотности (DFT) с набором базисных функций
Вычисленные константы скорости реакции второ-
6-311++G(d,p) и с гибридными функционалами
го порядка k могут быть характеристикой антира-
M06-2X и B3LYP, выбор которых обусловлен опу-
дикальной активности фенолкарбоновых кислот.
бликованными данными об успешном их примене-
Наиболее реакционноспособны по отношению к
нии для фенольных антиоксидантов [29, 27]. При
радикалу гентизиновая 10, пирокатеховая 7 и ва-
расчетах использовали ультратонкую сетку инте-
нилиновая 14 кислоты. Для всех соединений число
грирования (integral-ultrafine). Для систем с откры-
электронов, участвующих в реакции, не превыша-
тыми оболочками катион-радикалов (дублетное
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 10 2020
ФЕНОЛКАРБОНОВЫЕ КИСЛОТЫ
1491
основное состояние) применяли соответствующий
регрессии; p - уровень значимости, при котором
спин-неограниченный метод (UB3LYP и UM06-
может быть принята нуль-гипотеза (о равенстве
2X). Геометрия всех структур оптимизирована
нулю истинного углового коэффициента уравне-
по всем независимым переменным и без ограни-
ния регрессии); Sest - стандартная ошибка оценки
чений по симметрии для водной среды. Характер
(или стандартное отклонение ошибок предска-
всех стационарных точек определялся расчетом
зания) является мерой точности величин, пред-
матрицы Гессе. Частоты нормальных колебаний,
сказанных по предложенной линейной модели.
энергия нулевых колебаний и тепловые поправ-
Статистические показатели рассчитаны в системе
ки к энтальпии рассчитаны теми же методами в
Statistica Demo 6.0.
гармоническом приближении. Влияние раствори-
Сравнивая расчеты с использованем гибридно-
теля учитывали в рамках континуальных моделей
го функционала B3LYP в разных сольватационных
сольватации SMD (Solvation Model of Density) [30]
моделях (SMD и PCM), можно увидеть фактически
и РСМ (Polarizable Continuum Model) [31]. Первые
одинаковый коэффициент корреляции r зависимо-
адиабатические потенциалы ионизации (PI) вы-
сти ln k1 от PI [уравнения (10) и (12)], но при этом
числяли как разность сумм полных электронно-
по величине критерия Фишера F и стандартной
ядерных энергий (Etot), энергий нулевых колеба-
ошибки оценки Sest статистически более значимой
ний (EZPE) и температурных поправок к энтальпии
является линейная модель с расчетами в РСМ (12).
(Hcorr) катион-радикалов и соответствующих ней-
Проведенный однофакторный регрессионный
тральных молекул (9). Все полученные результаты
анализ связи антирадикальной активности с по-
относятся к температуре 298 K и давлению 1 атм в
тенциалами ионизации фенолкарбоновых кислот
водной среде.
показал, что с увеличением PI реакционная спо-
собность антиоксиданта закономерно снижается,
(9)
что обусловлено замедлением переноса электрона
от молекулы к радикалу (по механизму ET-РТ).
Мы оценили возможность протекания меха-
Изменение потенциала ионизации зависит от
низма ЕТ-РТ с участием в лимитирующей стадии
структуры фенолкарбоновой кислоты. Уменьше-
молекулярной формы НООСArOH [реакция (7)].
ние величины PI и соответственно увеличение ан-
Электронодонорные свойства антиоксиданта и ре-
тирадикальной активности наблюдаются при уве-
ализация указанного механизма связаны с потен-
личении количества групп ОН, при их взаимном
циалом ионизации фенолкарбоновых кислот [29].
орто- и пара-положении, а также при их мета-по-
Потенциалы, рассчитанные с использовани-
ложении относительно электроноакцепторной
ем континуальной модели SMD (табл. 2), имеют
карбоксильной группы. Наиболее реакционноспо-
более низкие значения при расчете с использова-
собны дигидроксибезойные кислоты 7, 10, 14 с
нием функционала B3LYP и лучше коррелируют
относительно низкими расчетными потенциалами
с антирадикальной активностью (lnk1) фенолкар-
ионизации (табл. 2).
боновых кислот (10), чем полученные на основе
M062X (11).
Полученная зависимость lnk1 от PI подтвержда-
ет не только возможность протекания реакции НО-
ln k = (59.9±1.7) - (7.8±0.3) PI (B3LYP, SMD),
ОСArОН с НОО• в кислых средах по механизму
n = 14; r = 0.992; r2 = 0.984; F = 731;
p < 0.00001; Sest = 0.18,
(10)
ЕТ-РТ, но и применимость представленного в дан-
ной работе способа расчета констант скоростей.
ln k = (51.6±2.1) - (7.6±0.3) PI (M062X, SMD),
n = 14; r = 0.988; r2 = 0.977; F = 508;
Таким образом, восстановление кислорода на
p < 0.00001; Sest
= 0.22,
(11)
ртутном пленочном электроде при рН = 2 в присут-
ln k = (51.5±1.7) - (7.52±0.26) PI (B3LYP, РСМ),
ствии природных фенолкарбоновых кислот может
n = 14; r = 0.993; r2 = 0.986; F = 819;
служить моделью in vitro для исследования кине-
p < 0.00001; Sest
= 0.17.
(12)
тики и механизма их антирадикального действия
Здесь n - число опытов; r - коэффициент корре-
в реакции с гидропероксильным радикалом. Кине-
ляции; r2 - коэффициент детерминации; F - кри-
тические параметры реакции хорошо коррелиру-
терий Фишера проверки значимости линейной
ют с величинами потенциалов ионизации молекул
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 10 2020
1492
БЕЛАЯ и др.
Таблица 2. Потенциалы ионизации фенолкарбоно-
ГОСТ 32937-2014 [33]. Хроновольтамперограм-
вых кислот и их эфиров 1-14, рассчитанные на уровне
мы снимали на полярографе ПУ-1 с пакетом про-
B3LYP/6-311++G(d,p) и M062X/6-311++G(d,p) в рамках
граммного обеспечения АЦП PowerGraph фирмы
моделей SMD и PCM, растворитель - вода
«LCARD» (Россия). Обработку хроновольтампе-
PI, эВ
рограмм, вычисление величин потенциала пика
Соединение
M06-2X,
B3LYP,
B3LYP,
тока Epk и потенциала полуволны E1/2 проводили,
SMD
SMD
РСМ
как указано в работе [34]. Концентрацию раство-
1
6.40
6.19
6.48
ренного кислорода в цитратно-фосфатном буфере
2
6.23
6.01
6.29
при рН = 2 контролировали с помощью анализато-
3
6.21
5.98
6.23
ра кислорода с термоэлектрическим преобразова-
4
6.40
6.20
6.53
телем Эксперт-001 (Россия).
5
6.52
6.31
6.62
6
6.48
6.25
6.54
Перед началом эксперимента цитратно-фос-
7
6.04
5.84
6.13
фатный буферный раствор 15 мин насыщали кис-
8
6.38
6.14
6.43
лородом при постоянном перемешивании. Для
9
6.35
6.10
6.35
изменения концентрации кислорода в растворе,
10
5.88
5.68
5.96
вплоть до его полного удаления, подавали газо-
11
6.10
5.88
6.17
образный аргон.
12
6.17
5.97
6.28
При определении кинетических параметров
13
6.23
5.99
6.31
концентрация кислорода в реакционной смеси
14
6.11
5.88
6.16
составляла от 5×10-6 до 7×10-6 моль/л, концен-
фенолкарбоновых кислот, рассчитанными на уров-
трация фенолкарбоновых кислот - от 4×10-3 до 5×
не B3LYP/6-311++G(d,p) и M062X/6-311++G(d,p)
10-4 моль/л. Фенолкарбоновые кислоты растворя-
с учетом эффектов неспецифической сольватации
ли в диметилсульфоксиде, затем аликвоту этого
в рамках континуальных моделей растворителя
раствора (0.5 мл) вводили в цитратно-фосфатный
PCM и SMD, что позволяет прогнозировать анти-
буферный раствор (19.5 мл) с рН = 2 и с заданной
радикальную активность фенолкарбоновых кис-
концентрацией кислорода. Так как добавки кис-
лот и идентифицировать механизм их действия в
лот были достаточно малы по сравнению с объе-
реакции с НОО• в водных средах, имитирующих
мом фонового электролита, то изменениями кон-
биологические объекты.
центрации молекулярного кислорода при добавке
раствора с антиоксидантом можно пренебречь.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Полученную смесь перемешивали 5 с, затем через
Гидроксибензойные кислоты 1-14 производ-
10 с снимали катодную хроновольтамперограмму
ства Fluka (Швейцария), Merck (Германия), Panreac
электровосстановления О2 (не менее 3 повторов
(Испания), Aldrich-Sigma (США) использовали без
при заданной скорости развертки).
предварительной очистки. Диметилсульфоксид
КОНФЛИКТ ИНТЕРЕСОВ
очищали по известной методике [32].
Идентификацию О•- проводили путем измере-
Авторы заявляют об отсутствии конфликта
ния оптической плотности цитратно-фосфатного
интересов.
буферного раствора при рН = 7-8 (через 2 ч элек-
СПИСОК ЛИТЕРАТУРЫ
тровосстановления О2) в присутствии тетразолия
1. Перевозкина М.Г. Тестирование антиоксидантной
синего (Aldrich-Sigma, США) при 530 нм на спек-
активности полифункциональных соединений ки-
трофотометре Specord S300 UV-VIS (Carl Zeiss
нетическими методами. Новосибирск: СибАК, 2014.
Jena, Германия) при 293±2 K.
240 c.
Электровосстановление О2 проводили в герме-
2. Меньщикова Е.Б., Ланкин В.З., Кандалинцева Н.В.
тичной ячейке с контролем атмосферы и подачи
Фенольные антиоксиданты в биологии и меди-
вещества в реакционную смесь. Электродом срав-
цине. Строение, свойства, механизмы действия.
нения служила донная ртуть, рабочим электродом -
Saarbrücken: Lap Lambert Academic Publishing, 2012.
ртутный пленочный электрод, приготовленный по
488 с.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 10 2020
ФЕНОЛКАРБОНОВЫЕ КИСЛОТЫ
1493
3. Galano A., Perez-Gonzalez A. // Theor. Chem. Accounts.
24. Milenković D., Yorović J., Jeremić S., Marković J.M.D.,
2012. Vol. 131. N 9. P. 1. doi 10.1007/s00214-012-
Avdović E.H., Marković Z. // J. Chem. 2017. Vol. 2017.
1265-0
P. 1. doi 10.1155/2017/5936239
4. Marković Z., Ðorović J., Dimitrić Marković J.M.,
25. Волков В.А., Мисин В.М. // Кинетика и катализ. 2015.
Živić M., Amić D. // Monatsh. Chem. 2014. Bd 145.
Т. 56. № 1. С. 48; Volkov V.A., Misin V.M. // Kinetics
H. 6. S. 953. doi 10.1007/s00706-014-1163-3
and Catalysis. 2015. Vol. 56. N 1. P. 43. doi 10.1134/
5. Marino T., Galano A., Russo N. // J. Phys. Chem. 2014.
S0023158415010139
Vol. 118. N 35. P. 10380. doi 10.1021/jp505589b
26. Mazzone G., Russo N., Toscano M. // Comput.
6. Sevgi K., Tepe B., Sarikurkcu C. // Food Chem. Toxicol.
Theoret. Chem. 2016. Vol. 1077. P. 39. doi 10.1016/j.
2015. Vol. 77. P. 12.
comptc.2015.10.011
7. Medina M.E., Galano A., Trigos Á. // J. Phys. Chem.
27. Белая Н.И, Белый А.В., Заречная О.М., Щерба-
(B). 2018. Vol. 122. N 30. P. 7514. doi 10.1021/acs.
ков И.Н., Дорошкевич В.С. // ЖОХ. 2018. Т. 88.
jpcb.8b04619
№ 7. С. 1057; Belaya N.I., Belyi A.V., Zarechnaya O.M.,
8. Vermerris W., Nicholson R. Phenolic Compound
Scherbakov I.N., Doroshkevich V.S. // Russ. J. Gen.
Biochemistry. Dodrecht: Springer, 2006. 275 p.
Chem. 2018. Vol. 88. N 7. P. 1351. doi 10.1134/
9. Будников Г.К., Майстренко В.Н., Вяселев М.Р. Осно-
S1070363218070010
вы современного электрохимического анализа. М.:
28. Frisch M.J., Trucks G.W., Schlegel H.B., Scuseria G.E.,
Мир: Бином ЛЗ, 2003. 592 с.
Robb M.A., Cheeseman J.R., Scalmani G., Barone V.,
10. Heyrovský M., Vavřička S. // J. Electroanal. Chem.
Mennucci B., Petersson G.A., Nakatsuji H., Caricato M.,
1993. Vol. 353. P. 335.
Li X., Hratchian H.P., Izmaylov A.F., Bloino J., Zheng G.,
11. Heyrovský M., Vavřička S. // J. Electroanal. Chem.
Sonnenberg J.L., Hada M., Ehara M., Toyota K.,
1992. Vol. 332. P. 309.
Fukuda R., Hasegawa J., Ishida M., Nakajima T.,
12. Hayyan M., Hashim M.A., Alnashef I.M. // Chem.
Honda Y., Kitao O., Nakai H., Vreven T., Montgo-
Rev. 2016. Vol. 116. N 5. P. 3029. doi 10.1021/acs.
mery J.A., Jr., Peralta J.E., Ogliaro F., Bearpark M.,
chemrev.5b00407
Heyd J.J., Brothers E., Kudin K.N., Staroverov V.N.,
13. Tur’yan Y.I., Gorenbein P., Kohen R. // J. Electroanal.
Keith T., Kobayashi R., Normand J., Raghavachari K.,
Chem. 2004. Vol. 571. N 2. P. 183. doi 10.1016/j.
Rendell A., Burant J.C., Iyengar S.S., Tomasi J.,
jelechem.2004.05.008
Cossi M., Rega N., Millam J.M., Klene M.,
Knox J.E., Cross J.B., Bakken V., Adamo C., Jaramillo J.,
15. Bo-Tao Z., Li-Xia Z., Jin-Ming L. // J. Environ. Sci.
Gomperts R., Stratmann R.E., Yazyev O., Austin A.J.,
2008. Vol. 20. N 8. P. 1006. doi 10.1016/s1001-0742
Cammi R., Pomelli C., Ochterski J.W., Martin R.L.,
(08)62200-7
Morokuma K., Zakrzewski V.G., Voth G.A., Salvador P.,
16. Korotkova E.I., Karbainov Y.A., Avramchik O.A. // Anal.
Dannenberg J.J., Dapprich S., Daniels A.D., Far-
Bioanal. Chem. 2003. Vol. 375. P. 465. doi 10.1007/
kas O., Foresman J.B., Ortiz J.V., Cioslowski J.,
s00216-002-1687-y
Fox D.J. Gaussian 09, Revision B.01 Gaussian, Inc.,
17. Сажина Н.Н., Мисин В.М., Короткова Е.И. // Химия
WallingfordCT, 2010.
растительного сырья. 2010. № 4. С. 77.
29. Galano A., Alvarez-Idaboy J.R. // Int. J. Quantum.
18. Майрановский C.Г. Каталитические и кинетические
Chem. 2019. Vol. 119. P. 1. doi 10.1002/qua.25665
токи в полярографии. М.: Наука, 1966. 288с.
30. Marenich A.V., Cramer C.J., Truhlar D.G. // J. Phys.
19. Nicholson R. S., Shain I. // Anal. Chem. 1964. Vol. 36.
Chem. (B). 2009. Vol. 113. P. 6378. doi 10.1021/
N 4. P. 706. doi 10.1021/ac60210a007
jp810292n
20. Галюс З. Теоретические основы электрохимического
31. Tomasi J., Mennucci B., Cammi R. // Chem. Rev. 2005.
анализа. М.: Мир, 1974. 552 с.
Vol. 105. N 8. P. 2999. doi 10.1021/cr9904009
21. Гороховская В.И., Гороховский В.М. Практикум по
32. Armarego W.L.F., Chai C.L.L. Purification of Laboratory
электрохимическим методам анализа. М.: Высшая
Chemicals. Burlington: Elsevier Science, 2003. 608 p.
школа, 1983. 191 с.
33. ГОСТ 32937-2014. Продукция парфюмерно-косме-
22. Короткова Е.И. Автореф. дис
док. хим. наук.
тическая. Инверсионно-вольтамперометрический
Томск, 2009. 44 с.
метод определения свинца. М.: Стандартинформ,
23. Galano A., Mazzone G., Alvarez-Diduk R., Marino T.,
2016. 15 с.
Alvarez-Idaboy J.R., Russo N. // Annu. Rev. Food Sci.
34. Хенце Г. Полярография и вольтамперометрия. Тео-
Technol. 2016. Vol. 7. P. 335. doi 10.1146/annurev-
ретические основы и аналитическая практика. М.:
food-041715-033206
Бином. Лаборатория знаний, 2008. 284 с.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 10 2020
1494
БЕЛАЯ и др.
Phenolcarboxylic Acids in the Reaction
with Electrogenerated Hydroperoxyl Radical
N. I. Belayaa,*, A. V. Belyia, O. M. Zarechnayab, I. N. Shcherbakovc, and V. S. Doroshkevicha
a Donetsk National University, Donetsk, 83001 Ukraine
b L.M. Litvinenko Institute of Physical and Organic Chemistry and Coal Chemistry, Donetsk, 83114 Ukraine
c Southern Federal University, Rostov-on-Don, 344006 Russia
*e-mail: nat.iv.belaya@gmail.com
Received May 21, 2020; revised May 21, 2020; accepted June 1, 2020
Using the chronovoltammetric method, it was shown that on a mercury electrode in an acidic medium the re-
duction of oxygen at the presence of phenolcarboxylic acids occurrs as a reversible electrode process with the
subsequent limiting chemical reaction involving the product of the electrode reaction - the hydroperoxyl radical.
The rate constants of the reaction of phenolcarboxylic acids with radicals were calculated using the theory of the
electrode process followed by a chemical reaction. A possible reaction mechanism, electron transfer from the
acid molecular form to the radical, was confirmed by the correlation between the experimental rate constants
and the ionization potentials of phenolcarboxylic acids calculated by the DFT method.
Keywords: phenolcarboxylic acid, hydroperoxyl radical, antioxidant, ionization potential
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 10 2020