ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2020, том 90, № 10, с. 1495-1500
УДК 542.91
КОНЪЮГИРОВАНИЕ 1-АМИНОАДАМАНТАНОВ
И 5-ТРИФТОРМЕТИЛГИДАНТОИНОВ
1,3-ДИПОЛЯРНЫМ ЦИКЛОПРИСОЕДИНЕНИЕМ
© 2020 г.
В. Б. Соколов,
А. Ю. Аксиненко*, Т. В. Горева, Т. А. Епишина, В. И. Шестов
Институт физиологически активных веществ Российской академии наук,
Северный проезд 1, Черноголовка, 142432 Россия
*e-mail: alaks@ipac.ac.ru
Поступило в Редакцию 25 мая 2020 г.
После доработки 25 мая 2020 г.
Принято к печати 9 июня 2020 г.
Предложен синтетический подход к объединению фармакофорных лигандов, а именно 1-аминоадаман-
танов и 5-трифторметилгидантоинов, реакцией медь-катализируемого алкин-азидного 1,3-диполярного
циклоприсоединения.
Ключевые слова: 1-аминоадамантаны, 5-трифторметилгидантоины, имины метилтрифторпирувата,
1,4-замещенные 1,2,3-триазолы, 1,3-диполярное циклоприсоединение
DOI: 10.31857/S0044460X20100030
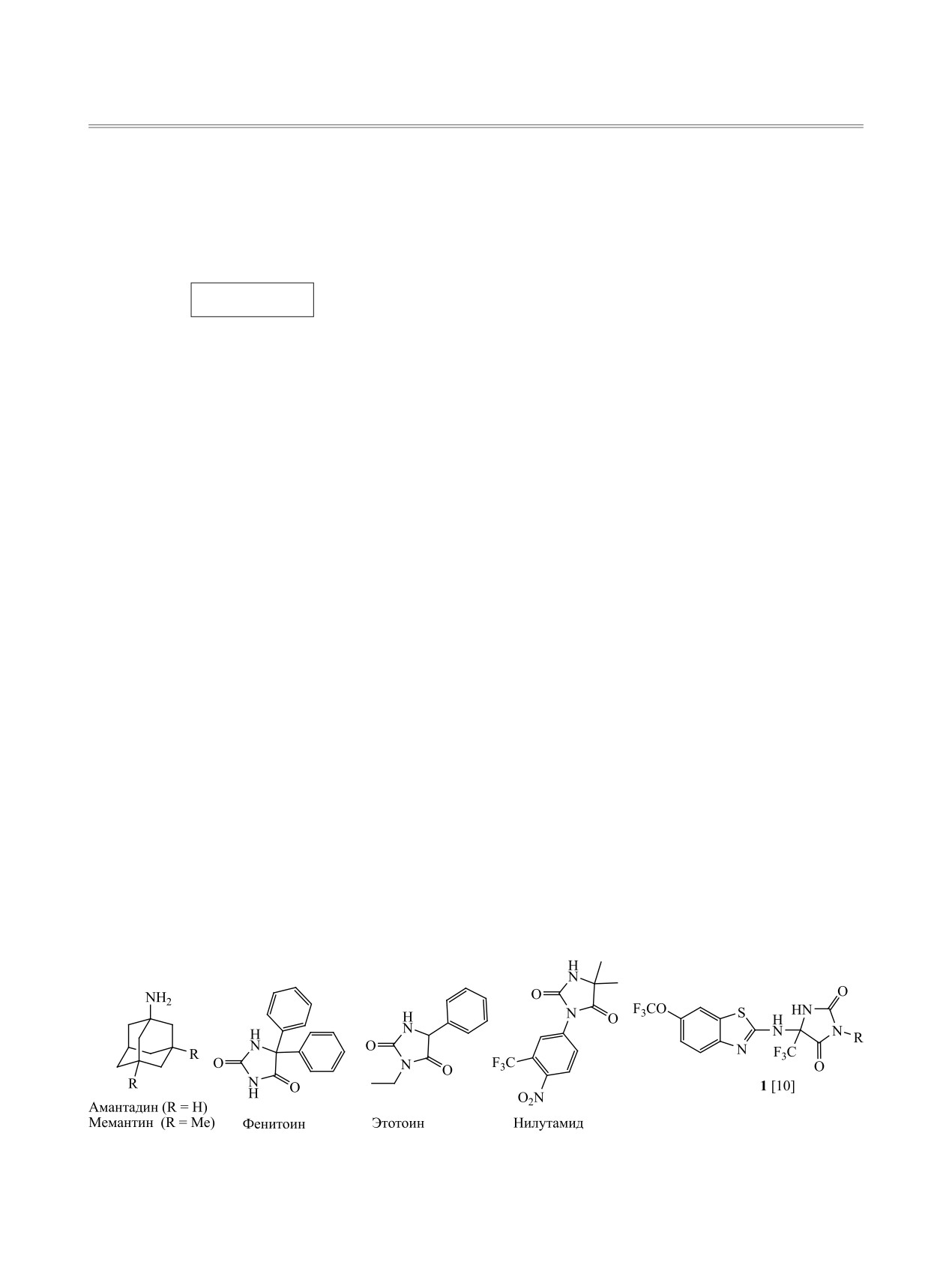
Адамантановый фрагмент играет важную роль
нитивно-стимулирующими или пронейрогенными
в медицинской химии как фармакофор в поис-
свойствами. Другие известные лекарственные пре-
ке новых физиологически активных соединений
параты, применяющиеся в медицинской практике
и его введение в биоактивные молекулы может
многие годы (например, фенитоин и этотоин как
привести к улучшению их биодоступности и мо-
антиконвульсанты, нилутамид - антиандрогенный
дификации терапевтической эффективности. Ами-
препарат) являются по своей молекулярной осно-
ноадамантаны и их производные [1, 2], применя-
ве имидазолидин-2,4-дионами или гидантоинами.
ющиеся много лет в качестве противовирусных
Обзор, посвященный последним успехам в синте-
[3-5] препаратов, а также для лечения диабета
зе гидантоинов, подчеркивает их медицинскую и
2 типа [6, 7], болезней Паркинсона [3] и Альцгей-
фармацевтическую значимость и постоянный ин-
мера [8] (амантадин и мемантин, схема 1), явля-
терес к новым направлениям синтеза и модифика-
ются значимыми фармакоактивными фрагмента-
ции этой молекулярной структуры [9].
ми для создания мультитаргетных лекарств, в том
Ранее нами было показано, что введением
числе, обладающими нейропротекторными, ког-
5-трифторметилгидантоинового фрагмента в мо-
Схема 1.
1495
1496
СОКОЛОВ и др.
Схема 2.
Схема 3.
Схема 4.
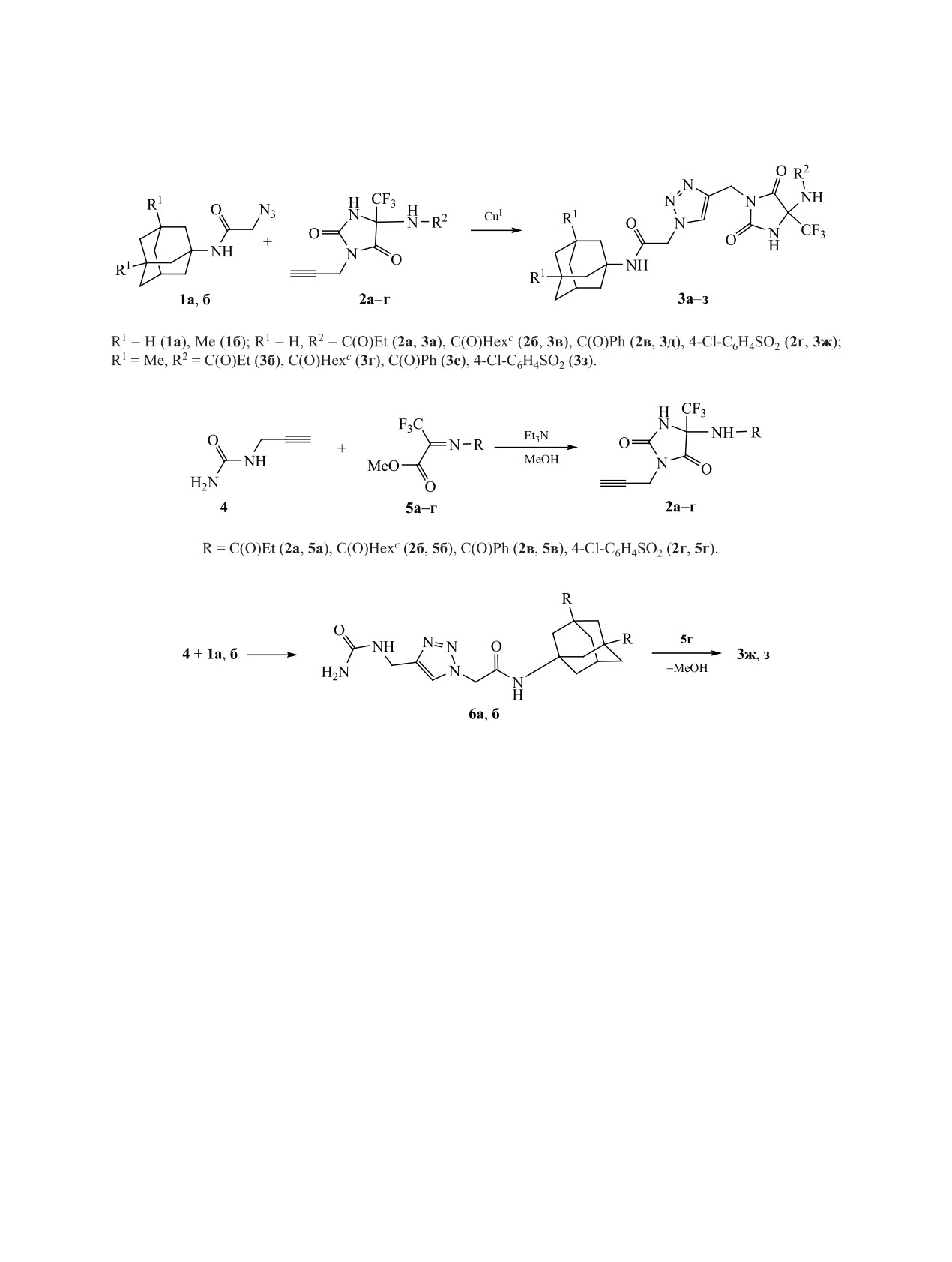
лекулу рилузола можно получить гидантоины 1
1a, б и соответствующих пропаргилсодержащих
(схема 1), активные в отношении процессов высво-
гидантоинов 2a-г в хлористом метилене в присут-
бождения и обратного захвата глутамата и сопо-
ствии каталитических количеств водных раство-
ставимые по этой активности с базовой структу-
ров сульфата меди и аскорбата натрия (схема 2).
рой [10].
Реакция протекала 3 ч при 40°С; целевые триазо-
В продолжение поиска новых мультитаргетных
лы 3a-з выделяли и очищали колоночной хрома-
тографией.
препаратов для лечения нейродегенеративных
заболеваний [11] и изучения синтетических воз-
Исходные пропаргилсодержащие 5-трифторме-
можностей декорирования
1-аминоадамантанов
тилгидантоины 2a-г получали циклоконденсаци-
различными гетероциклами [12-15] в данном ис-
ей пропаргилмочевины 4 с иминами метилтриф-
следовании представлено конъюгирование 1-ами-
торпирувата 5а-г по ранее описанной методике
ноадамантанов и
5-трифторметилгидантоинов
(схема 3) [16].
посредством реакции медь-катализируемого алки-
Соединения 3ж, з были получены также встреч-
назидного 1,3-диполярного циклоприсоединения.
ным синтезом из адамантансодержащих мочевин
Получение целевых продуктов - 1,4-замещен-
6a, б и сульфонилимина метилтрифторпирувата 5г
ных 1,2,3-триазолов 3a-з, включающих фарма-
по описанным выше реакциям медь-катализируе-
кофорные фрагменты адамантана и гидантоина,
мого алкин-азидного 1,3-диполярного циклопри-
осуществляли взаимодействием эквимолярных
соединения и последующей циклоконденсации
количеств N-(адамантан-1-ил)-2-азидоацетамидов
(схема 4).
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 10 2020
КОНЪЮГИРОВАНИЕ 1-АМИНОАДАМАНТАНОВ И 5-ТРИФТОРМЕТИЛГИДАНТОИНОВ
1497
Соединения 2, 3 и 6 - твердые вещества, состав
Спектр ЯМР 19F (ДМСО-d6): δF -1.98. Найдено, %:
и строение которых подтверждены данными эле-
С 43.21; Н 3.78; N 15.23. C10H10F3N3O3. Вычисле-
ментного анализа и спектроскопии ЯМР. В спек-
но, %: C 43.33; H 3.64; N 15.16.
трах ЯМР 1Н триазолов 3 и 6 наблюдаются харак-
N-[2,5-Диоксо-1-(проп-2-ин-1-ил)-4-(триф-
терные синглетные сигналы метиленовых групп,
торметил)имидазолидин-4-ил]циклогесан-
связанных с триазольным циклом, при 4.6-4.9
карбоксамид (2б) получали аналогично. Выход
и 4.9-5.5 м. д., а также СН-протона триазольно-
1.5 г (45%), т. пл. 185-186°С. Спектр ЯМР 1Н
го цикла в области 7.8-7.9 м. д. В спектрах ЯМР
(ДМСО-d6), δ, м. д. (J, Гц): 0.94-1.40 м (6H, CH2),
19F характерными являются синглетные сигналы
1.47-1.84 м (4H, CH2), 2.18-2.44 м (1H, CcyclH), 3.24
CF3-группы гидантоинового цикла в области -3÷
т (1H, CH, 4JHH = 2.6), 4.20 д (2H, CH2, 4JHH = 2.6),
-1 м. д.
9.51 c (1H, NH), 9.54 c (1H, NH). Спектр ЯМР 19F
Таким образом, предложен синтез конъюгатов
(ДМСО-d6): δF -1.72. Найдено, %: С 50.55; Н 4.73;
1-аминоадамантанового и 5-трифторметилгидан-
N 12.47. C14H16F3N3O3. Вычислено, %: C 50.76; H
тоиного фрагментов на основе реакции медь-ка-
4.87; N 12.68.
тализируемого алкин-азидного
1,3-диполярного
N-[2,5-Диоксо-1-(проп-2-ин-1-ил)-4-(триф-
циклоприсоединения. Полученные соединения
торметил)имидазолидин-4-ил]бензамид (2в) по-
представляют интерес в качестве потенциальных
лучали аналогично. Выход 1.7 г (55%), т. пл. 154-
препаратов для лечения нейродегенеративных за-
155°С. Спектр ЯМР 1Н (ДМСО-d6), δ, м. д. (J, Гц):
болеваний.
3.24 т (1H, CH, 4JHH = 2.6), 4.29 д. д (1H, CH2, 2JHH
= 17.5, 4JHH = 2.6), 7.40-7.68 м (3H, CHAr), 7.86 д
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
(2H, CHAr, 3JHH
= 7.1), 9.69 c (1H, NH), 10.08 c (1H,
Спектры ЯМР 1H и 19F записывали на спек-
NH). Спектр ЯМР 19F (ДМСО-d6): δF -0.98. Най-
трометре Bruker DPX 200 относительно тетра-
дено, %: С 51.45; Н 3.02; N 12.74. C14H10F3N3O3.
метилсилана (внутренний стандарт) и CF3COOH
Вычислено, %: C 51.70; H 3.10; N 12.92.
(внешний эталон) соответственно. Температуры
N-[2,5-Диоксо-1-(проп-2-ин-1-ил)-4-(триф-
плавления определяли в стеклянном капилляре.
торметил)имидазолидин-4-ил]-4-хлорбензамид
Колоночную хроматографию проводили на сили-
(2г) получали аналогично. Выход 2.7 г (69%),
кагеле Silica gel 60 (0.032-0.063 мм, 230-450 меш,
т. пл. 163-165°С. Спектр ЯМР 1Н (ДМСО-d6), δ,
Alfa-Aesar).
м. д. (J, Гц): 2.35 т (1H, ≡CH, 4JHH = 2.2), 4.18 д. д (1H,
N-(Адамантан-1-ил)-2-азидоацетамиды
1a, б
CH2, 2JHH = 17.5, 4JHH = 2.2), 4.29 д. д (1H, CH2, 2JHH =
[13], пропионил- (5а) [17], циклогексил- (5б) [18],
17.5, 4JHH = 2.2), 7.47 д (2H, CArH, 3JHH = 8.5), 7.84 д
бензоил- (5в) [16] и 4-хлорсульфонилимин (5г)
(2H, CArH, 3JHH = 8.5), 9.53 c (1H, NH), 9.70 c (1H,
метилтрифторпирувата [19] получали по соответ-
NH). Спектр ЯМР 19F (ДМСО-d6): δF -2.37. Найде-
ствующим методикам.
но, %: С 39.74; Н 2.12; N 10.76. C13H9ClF3N3O4S.
N-[2,5-Диоксо-1-(проп-2-ин-1-ил)-4-(триф-
Вычислено, %: C 39.45; H 2.29; N 10.62.
торметил)имидазолидин-4-ил]пропионамид
N-[1-{[1-(2-Адамантан-1-иламино)-2-оксо-
(2а). К раствору 10 ммоль пропаргилмочевины 4
этил]-1Н-1,2,3-триазол-1-ил}метил]-2,5-ди-
в 10 мл ДМФА при перемешивании при 20°С до-
оксо-4-(трифторметил)имидазолидин-4-ил]
бавляли 10 ммоль имина 5а. Реакционную смесь
пропионамид (3а). К раствору 1 ммоль азидоаце-
перемешивали 1 ч, затем добавляли 0.2 г Et3N. По-
тамида 1a в 20 мл хлористого метилена прибавля-
лученную смесь нагревали 2 ч при 90°С, затем ох-
ли 1 ммоль N-пропаргилгидантоина 2а, 0.05 ммоль
лаждали и выливали в 50 мл насыщенного водного
CuSO4 в 0.5 мл Н2О и 0.05 ммоль аскорбата натрия
раствора NaCl. Осадок кристаллизовали из 50%-
в 0.5 мл Н2О. Реакционную смесь перемешива-
ного EtOH. Выход 1.4 г (51%), т. пл. 189-190°С.
ли 3 ч при 40°С, затем промывали 10 мл 1%-ного
Спектр ЯМР 1Н (ДМСО-d6), δ, м. д. (J, Гц): 0.96
раствора водного аммиака. Органический слой
т (3H, CH3CH2, 3JHH = 7.7), 2.23 к (2H, CH3CH2,
отделяли и сушили Na2SO4. Хлористый метилен
3JHH = 7.7), 3.25 т (1H, CH, 4JHH = 2.6), 4.22 д (2H,
упаривали, остаток хроматографировали на сили-
CH2, 4JHH = 2.6), 9.52 c (1H, NH), 9.65 c (1H, NH).
кагеле (элюент - метанол-хлороформ, 1:10). Вы-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 10 2020
1498
СОКОЛОВ и др.
ход 0.31. г (61%), т. пл. 115-118°С. Спектр ЯМР 1Н
7.93 c (1H, NH), 9.49 c (1H, NH), 9.57 c (1H, NH).
(CDCl3), δ, м. д. (J, Гц): 0.96 т (3H, CH3CH2, 3JHH =
Спектр ЯМР 19F (CDCl3): δF -2.70. Найдено, %: С
7.6), 1.60 с (6H, CAdH2), 1.90 с (6H, CAdH2), 1.99 уш.
56.78; Н 6.22; N 16.26. C28H38F3N7O4. Вычислено,
c (3H, CAdH), 2.24 к (2H, CH3CH2, 3JHH = 7.6), 4.66 c
%: C 56.65; H 6.45; N 16.52.
(2H, NCH2), 4.97 c (2H, NCH2), 7.86 c (2H, =CHN +
N-[1-{[1-(2-Адамантан-1-иламино)-2-оксо-
NH), 9.34 c (1H, NH), 9.63 c (1H, NH). Спектр ЯМР
этил]-1Н-1,2,3-триазол-1-ил}метил]-2,5-диок-
19F (CDCl3): δF -2.82. Найдено, %: С 51.73; Н 5.27;
со-4-(трифторметил)имидазолидин-4-ил]бен-
N 14.23. C22H28F3N7O4. Вычислено, %: C 51.66; H
замид (3д) получали аналогично. Выход 0.36 г
5.52; N 19.17.
(64%), т. пл. 130-131°С. Спектр ЯМР 1Н (CDCl3), δ,
N-(1-[{1-[2-(3,5-Диметиладамантан-1-ил)
м. д. (J, Гц): 1.58 с (6H, CAdH2), 1.88 с (6H, CAdH2),
амино]-2-оксоэтил}-1Н-1,2,3-триазол-1-ил]ме-
1.97 уш. c (3H, CAdH), 4.80 уш. c (2H, NCH2), 4.84
тил)-2,5-диоксо-4-(трифторметил)имидазоли-
уш. c (2H, NCH2), 6.08 c (1H, NH), 7.24-7.56 м (3H,
дин-4-ил)пропионамид (3б) получали аналогич-
CHAr), 7.62-7.88 м (2H, CHAr), 7.89 c (1H, =CHN),
но. Выход 0.28 г (53%), т. пл. 197-199°С. Спектр
7.96 c (1H, NH), 8.21 c (1H, NH). Спектр ЯМР 19F
ЯМР 1Н (CDCl3), δ, м. д. (J, Гц): 0.81 c (6H, CH3),
(CDCl3): δF -2.36. Найдено, %: С 55.97; Н 5.22; N
0.98 т (3H, CH3CH2, 3JHH = 7.6), 1.10 c (2H, CAdH2),
17.34. C26H28F3N7O4. Вычислено, %: C 55.81; H
1.17-1.40 м (4H, CAdH2), 1.57 c (4H, CAdH2), 1.75 c
5.04; N 17.52.
(2H, CAdH2), 2.07 м (1H, CAdH), 2.25 к (2H, CH3CH2,
N-(1-[{1-[2-(3,5-Диметиладамантан-1-ил)
3JHH = 7.6), 4.69 c (2H, NCH2), 4.99 c (2H, NCH2),
амино]-2-оксоэтил}-1Н-1,2,3-триазол-1-ил]ме-
7.89 c (1H, =CHN), 7.94 c (1H, NH), 9.44 c (1H,
тил)-2,5-диоксо-4-(трифторметил)имидазоли-
NH), 9.68 c (1H, NH). Спектр ЯМР 19F (CDCl3):
дин-4-ил)бензамид
(3е) получали аналогично.
δF -1.80. Найдено, %: С 53.62; Н 5.75; N 18.28.
Выход 0.33 г (56%), т. пл. 154-155°С. Спектр ЯМР
C24H32F3N7O4. Вычислено, %: C 53.43; H 5.98; N
1Н (ДМСО-d6), δ, м. д. (J, Гц): 0.80 c (6H, CH3),
18.17.
1.09 c (2H, CAdH2), 1.17-1.40 м (4H, CAdH2), 1.57 c
N-[1-{[1-(2-Адамантан-1-иламино)-2-оксо-
(4H, CAdH2), 1.75 c (2H, CAdH2), 2.07 м (1H, CAdH),
этил]-1Н-1,2,3-триазол-1-ил}метил]-2,5-ди-
4.76 c (2H, NCH2), 5.01 c (2H, NCH2), 6.08 c (1H,
оксо-4-(трифторметил)имидазолидин-4-ил]
NH), 7.39-7.70 м (3H, CHAr), 7.91 c (1H, =CHN),
циклогексанкарбоксамид
(3в) получали ана-
7.92-8.04 м (3H, CHAr + NH), 9.67 c (1H, NH), 10.10
логично. Выход 0.34 г (60%), т. пл. 158-159°С.
c (1H, NH). Спектр ЯМР 19F (ДМСО-d6): δF -2.31.
Спектр ЯМР 1Н (CDCl3), δ, м. д. (J, Гц): 1.03-1.35
Найдено, %: С 57.83; Н 5.29; N 16.42. C28H32F3N7O4.
м (6H, CH2), 1.57 с (6H, CAdH2), 1.53-1.74 м (4H,
Вычислено, %: C 57.65; H 5.49; N 16.69.
CH2), 1.88 с (6H, CAdH2), 1.96 уш. c (3H, CAdH),
N-(Адамантан-1-ил)-2-[4-{[4-(4-хлорфенил-
2.25-2.42 м (1H, NCH), 4.63 c (2H, NCH2), 4.95 c
сульфамидо)-2,5-диоксо-4-(трифторметил)ими-
(2H, NCH2), 7.84 c (1H, =CHN), 7.86 c (1H, NH),
9.45 c (1H, NH), 9.53 c (1H, NH). Спектр ЯМР 19F
дазолидин-1-ил]метил}-1Н-1,2,3-триазол-1-ил]
ацетамид (3ж) получали аналогично методу а.
(CDCl3): δF -2.70. Найдено, %: С 55.29; Н 6.25; N
Выход 0.47 г (74%).
17.22. C26H34F3N7O4. Вычислено, %: C 55.21; H
6.06; N 17.34.
б. К раствору 2 ммоль мочевины 6а в 10 мл
N-(1-[{1-[2-(3,5-Диметиладамантан-1-ил)
ДМФА при перемешивании при 20°С добавляли
амино]-2-оксоэтил}-1Н-1,2,3-триазол-1-ил]ме-
2 ммоль имина 5г. Реакционную смесь перемеши-
тил)-2,5-диоксо-4-(трифторметил)имидазоли-
вали 1 ч, затем добавляли 0.2 г Et3N и нагревали
дин-4-ил)циклогексанкарбоксамид (3г) получа-
2 ч при 90°С. После охлаждения смесь выливали
ли аналогично. Выход 0.4 г (67%), т. пл. 146-147°С.
в 50 мл насыщенного водного раствора NaCl. Оса-
Спектр ЯМР 1Н (CDCl3), δ, м. д. (J, Гц): 0.80 c (6H,
док хроматографировали на силикагеле (элюент -
CH3), 1.09 c (2H, CAdH2), 1.10-1.42 м (14H, CAdH2 +
метанол-хлороформ, 1:10). Выход 0.61 г (48%),
CH2), 1.57 c (4H, CAdH2), 1.75 c (2H, CAdH2), 2.07
т. пл. 174-175°С. Спектр ЯМР 1Н (CDCl3), δ, м. д.
м (1H, CAdH), 2.25-2.42 м (1H, CH), 4.67 c (2H,
(J, Гц): 1.59 с (6H, CAdH2), 1.91 с (6H, CAdH2), 1.98
NCH2), 4.98 c (2H, NCH2), 7.87 c (1H, =CHN),
уш. c (3H, CAdH), 4.19 c (2H, NH2), 4.96 c (2H,
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 10 2020
КОНЪЮГИРОВАНИЕ 1-АМИНОАДАМАНТАНОВ И 5-ТРИФТОРМЕТИЛГИДАНТОИНОВ
1499
NCH2), 5.55 c (2H, NCH2), 6.38 c (1H, NH), 7.79
интересов.
c (1H, NH), 7.87 c (1H, =CHN). Спектр ЯМР 19F
СПИСОК ЛИТЕРАТУРЫ
(CDCl3): δF -1.75. Найдено, %: С 47.58; Н 4.22; N
15.41. C25H27ClF3N7O5S. Вычислено, %: C 47.66; H
1. Liu J., Obando D., Liao V., Lifa T., Codd R. // Eur. J.
Med. Chem. 2011. Vol. 46. N 6. P. 1949. doi 10.1016/j.
4.32; N 15.56.
ejmech.2011.01.047
N - ( 3 , 5 - Д и м е т и л а д а м а н -
2. Wanka L., Iqbal K., Schreiner P.R. // Chem. Rev. 2013.
тан-1-ил)2-[4-{[4-(4-хлорфенилсульфами-
Vol. 113. N 5. P. 3516. doi 10.1021/cr100264t
до)-2,5-диоксо-4-(трифторметил)имидазо-
3. Maugh T. // Science. 1979. Vol. 206. N 4422. P. 1058.
лидин-1-ил]метил}-1Н-1,2,3-триазол-1-ил]
doi 10.1126/science.386515
ацетамид (3з) получали аналогично. Выход 0.48 г
4. De Clercq E. // Nat. Rev. Drug Discov. 2006. Vol. 5.
(73%) (метод а), 0.74 г (37%) (метод б), т. пл. 176-
N 12. P. 1015. doi 10.1038/nrd2175
178°С. Спектр ЯМР 1Н (CDCl3), δ, м. д. (J, Гц):
5. Zoidis G., Kolocouris N., Kelly J.M., Prathalingam S.R.,
0.77 c (6H, CH3), 1.07 c (2H, CAdH2), 1.14-1.38 м
Naesens L., De Clercq E. // Eur. J. Med. Chem.
(4H, CAdH2), 1.54 c (4H, CAdH2), 1.75 c (2H, CAdH2),
2010. Vol. 45. N 11. P. 5022. doi 10.1016/j.
2.04 м (1H, CAdH), 4.59 уш. c (2H, NCH2), 4.99 c
ejmech.2010.08.009
(2H, NCH2), 7.31-7.82 м (5H, CHAr + NH), 7.89 c
6. Havale S.H., Pal M. // Bioorg. Med. Chem. 2009. Vol. 17.
(2H, =CHN + NH), 9.22 c (1H, NH). Спектр ЯМР
N 5. P. 1783. doi 10.1016/j.bmc.2009.01.061
19F (CDCl3): δF -2.00. Найдено, %: С 49.51; Н 4.52;
7. Zettl H., Schubert-Zsilavecz M., Steinhilber D. //
N 14.78. C27H31ClF3N7O5S. Вычислено, %: C 49.28;
ChemMedChem. 2010. Vol. 5. N 2. P. 179. doi 10.1002/
cmdc.200900448
H 4.75; N 14.90.
8. Reisberg B., Doody R., Stöffler A., Schmitt F., Ferris S.,
N-(Адамантан-1-ил)-2-(4-уреидоме-
Möbius H.J. // N. Engl. J. Med. 2003. Vol. 348. N 14.
тил)1Н-1,2,3-триазол-1-илацетамид (6а) получа-
P. 1333. doi 10.1056/NEJMoa013128
ли аналогично соединению 3а. Выход 0.28 г (84%),
9. Konnert L., Lamaty F., Martinez J., Colacino E. //
т. пл. 209-211°С. Спектр ЯМР 1Н (CDCl3), δ, м. д.
Chem. Rev. 2017. Vol. 117. N 23. P. 13757. doi 10.1021/
(J, Гц): 1.62 с (6H, CAdH2), 1.93 с (6H, CAdH2), 2.01
acs.chemrev.7b00067
уш. c (3H, CAdH), 4.22 уш. c (2H, NH2), 4.99 уш. c
10. Соколов В.Б., Аксиненко А.Ю., Соколов А.В., Габре-
(2H, NCH2), 5.59 уш. c (2H, NCH2), 6.45 c (1H, NH),
льян А.В., Ефимова А.Д., Григорьев В. В. // Изв. АН.
7.81 c (1H, =CHN), 7.91 c (1H, NH). Найдено, %: С
Сер. хим. 2017. № 1. С. 99; Sokolov V.B., Aksinenko
57.59; Н 7.42; N 25.39. C16H24N6O2. Вычислено, %:
A.Yu., Sokolov A.V., Gabrel’yan A.V., Efimova A.D.,
C 57.81; H 7.28; N 25.28.
Grigor’ev V.V. // Russ. Chem. Bull. 2017. Vol. 66. N 1.
P. 99. doi doi 10.1007/s11172-017-1706-y
N-(3,5-Диметиладамантан-1-ил)-2-(4-уреидо-
11. Соколов В.Б., Махаева Г.Ф., Аксиненко А.Ю., Гри-
метил)-1Н-1,2,3-триазол-1-илацетамид (6б) по-
горьев В.В., Шевцова Е.Ф., Бачурин С.О. // Изв.
лучали аналогично соединению 3а. Выход 0.30 г
АН. Сер. хим. 2017. № 10. C. 1821; Sokolov V.B.,
(83%), т. пл. 200-202°С. Спектр ЯМР 1Н (CDCl3),
Makhaeva G.F., Aksinenko A.Yu., Grigoriev V.V.,
δ, м. д. (J, Гц): 0.79 c (6H, CH3), 1.08 c (2H, CAdH2),
Shevtsova E.F., Bachurin S.O. // Russ. Chem. Bull.
1.14-1.41 м (4H, CAdH2), 1.44-1.86 м (6H, CAdH2),
2017. Vol. 66. N 10. P. 99. doi 10.1007/s11172-017-
2.05 м (1H, CAdH), 4.17 уш. с (2H, NH2), 4.95 c (2H,
1953-y
NCH2), 5.53 уш. с (2H, NCH2), 6.34 c (1H, NH),
12. Соколов В.Б., Аксиненко А.Ю., Епишина Т.А., Го-
7.77 c (1H, =CHN), 7.89 c (1H, NH). Найдено, %: С
рева Т.В., Бачурин С.О. // Изв. АН, Сер. хим. 2017.
60.09; Н 7.64; N 23.23. C18H28N6O2. Вычислено, %:
№ 11. С. 2110.; Sokolov V.B., Aksinenko A.Yu., Epishina
C 59.98; H 7.83; N 23.32.
T.A., Goreva T.V., Bachurin S.O. // Russ. Chem. Bull.
2017. Vol. 66. N 11. P. 2110. doi 10.1007/s11172-017-
ФОНДОВАЯ ПОДДЕРЖКА
1988-0
Работа выполнена в рамках государственного
13. Соколов В.Б., Аксиненко А.Ю., Епишина Т.А., Го-
задания на 2019 год (тема № 0090-2019-0001).
рева Т.В. // Изв. АН, Сер. хим. 2018. № 8. С. 1401;
Sokolov V.B., Aksinenko A.Yu., Epishina T.A., Goreva
КОНФЛИКТ ИНТЕРЕСОВ
T.V. // Russ. Chem. Bull. 2017. Vol. 67. N 8. P. 1401.
Авторы заявляют об отсутствии конфликта
doi 10.1007/s11172-018-2231-3
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 10 2020
1500
СОКОЛОВ и др.
14. Махаева Г.Ф., Шевцова Е.Ф., Ковалева Н.В., Руда-
№ 6. С. 1014; Aksinenko A.Yu., Epishina T.A., Goreva T.V.,
кова Е.В., Неганова М.Е., Дубова Л.Г., Шевцов П.Н.,
Pushin A.N., Sokolov V.B. // Russ. Chem. Bull. 2006.
Аксиненко А.Ю., Соколов В.Б., Бачурин С.О. //
Vol. 55. N 6. P. 1052. doi 10.1007/s11172-006-0375-z
Изв. АН. Сер. хим. 2018. № 11. С. 2121; Makhaeva
17. Соколов В.Б., Аксиненко А.Ю., Епишина Т.А., Горе-
G.F., Shevtsova E.F., Kovaleva N.V., Rudakova E.V.,
ва Т.В., Мартынов И.В. // Изв. АН. Сер. хим. 2005.
Neganova M.E., Dubova L.G., Shevtsov P.N., Aksinenko
№ 2. С. 472; Sokolov V.B., Aksinenko A.Yu., Epishina T.A.,
A.Yu., Sokolov V.B., Bachurin S.O. // Russ. Chem. Bull.
Goreva T.V., Martynov I.V. // Russ. Chem. Bull. 2005.
2018. Vol. 68. N 11. P. 2121. doi 10.1007/s11172-018-
Vol. 54. N 2. P. 472. doi 10.1007/s11172-005-0281-9
2338-6
18. Wellmar U., Liberg D., Ekblad M., Bainbridge M., East S.,
15. Соколов В.Б., Аксиненко А.Ю. // ЖОХ. 2019. T. 89.
Hargrave J., Prevost N. Pat. WO2015177367A1 (2015).
№ 8. C. 1300; Sokolov V.B., Aksinenko A.Yu. // Russ. J.
19. Соколов В.Б., Аксиненко А.Ю., Мартынов И.В. //
Gen. Chem. 2019. Vol. 69. N 8. P. 1724. doi 10.1134/
Изв. АН. Сер. хим. 2007. № 11. С. 2247; Sokolov V.B.,
S1070363219080280
Aksinenko A.Yu., Martynov I.V. // Russ. Chem. Bull.
16. Аксиненко А.Ю., Епишина Т.А., Горева Т.В., Пу-
2007. Vol. 56. N 11. P. 2247. doi 10.1007/s11172-007-
шин А.Н., Соколов В.Б. // Изв. АН, Сер. хим. 206.
0352-1
Conjugation of 1-Aminoadamantanes and
5-Trifluoromethylhydantoins by 1,3-Dipolar Cycloaddition
V. B. Sokolov,
A. Yu. Aksinenko*, T. V. Goreva, T. A. Epishina, and V. I. Shestov
Institute of Physiologically Active Compounds of the Russian Academy of Sciences, Moscow, 142432 Russia
*e-mail: alaks@ipac.ac.ru
Received May 25, 2020; revised May 25, 2020; accepted June 9, 2020
A synthetic approach was proposed for combining pharmacophore ligands, namely, 1-aminoadamantanes and
5-trifluoromethylhydantoins by the copper-catalyzed 1,3-dipolar alkyne-azide cycloaddition reaction.
Keywords: 1-aminoadamantanes, 5-trifluoromethylhydantoins, methyl trifluoropyruvate imines, 1,4-substituted
1,2,3-triazoles, 1,3-dipolar cycloaddition
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 10 2020