ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2020, том 90, № 10, с. 1501-1505
УДК 547.748:785.5.07
СИНТЕЗ И РЕАКЦИОННАЯ СПОСОБНОСТЬ
2-(ТИЕН-2-ИЛ)НАФТО[1,2-d]ТИАЗОЛА
© 2020 г. А. А. Александров*, М. М. Ельчанинов, Д. А. Тишина,
Ю. Е. Тараканова, М. Л. Шмановский
Южно-Российский государственный политехнический университет (НПИ) имени М. И. Платова,
пр. Просвещения 132, Новочеркасск, 346428 Россия
*е-mail: aaanet1@yandex.ru
Поступило в Редакцию 10 мая 2020 г.
После доработки 10 мая 2020 г.
Принято к печати 21 мая 2020 г.
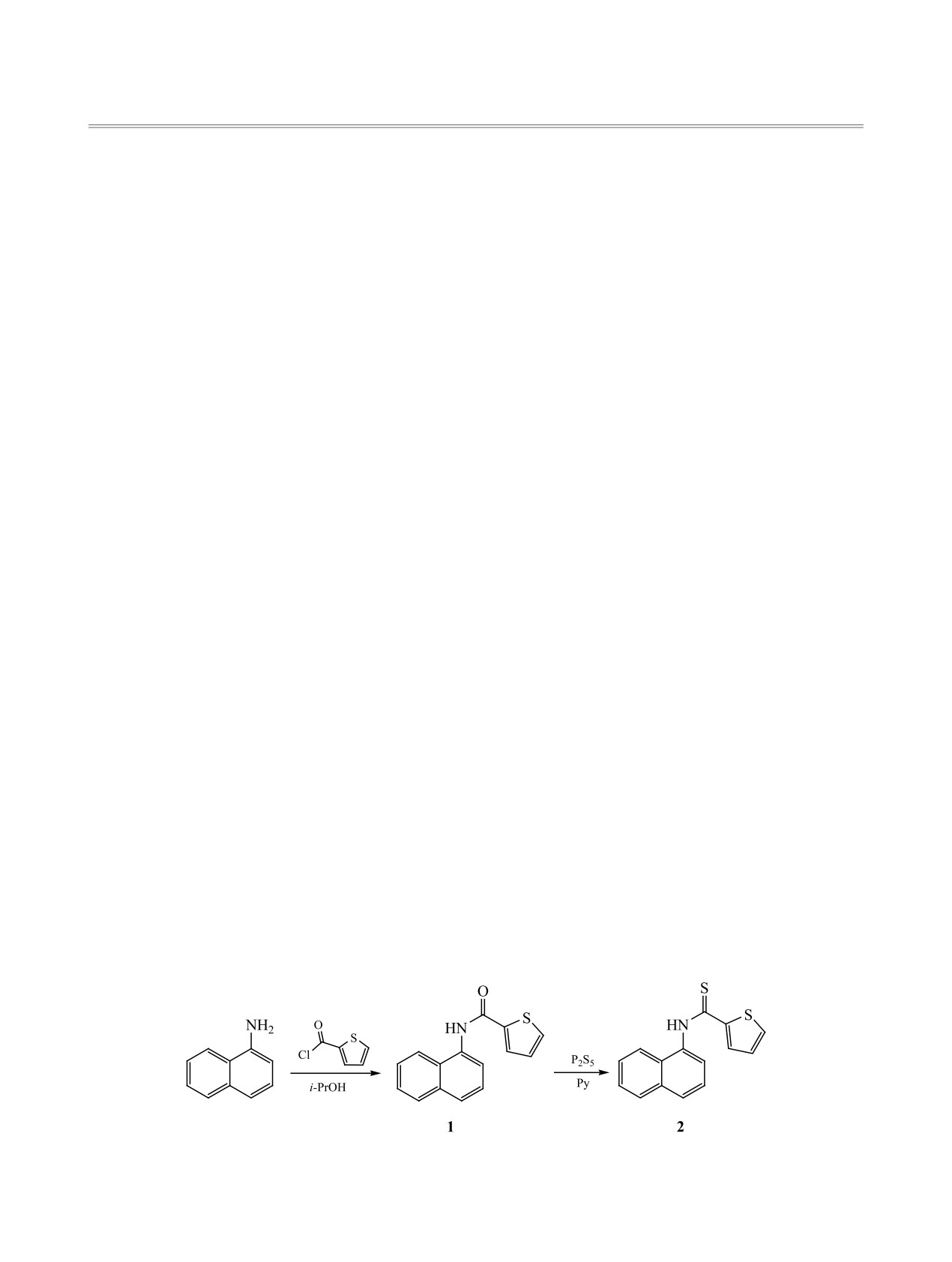
Конденсацией 1-аминонафталина с тиофен-2-карбонилхлоридом синтезирован N-(1-нафтил)тио-
фен-2-карбоксамид, обработка которого избытком P2S5 в безводном пиридине приводит к соответству-
ющему тиоамиду. Окислением последнего феррицианидом калия в щелочной среде по методу Якоб-
сона синтезирован 2-(тиен-2-ил)нафто[1,2-d]тиазол и введен в реакции электрофильного замещения
(нитрование, бромирование, формилирование, ацилирование). Показано, что новый заместитель вступает
исключительно в положение 5 тиофенового ядра.
Ключевые слова: 1-аминонафталин, тиофен-2-карбонилхлорид, N-(1-нафтил)тиофен-2-карбоксамид,
окисление, феррицианид калия, реакции электрофильного замещения
DOI: 10.31857/S0044460X20100042
Среди областей гетероциклической химии, ко-
мя бисгетероциклические соединения такого типа
торым уделяется повышенное внимание, следует
представляют интерес как потенциальные биоло-
выделить химию бигетарилов, содержащих два ге-
гически активные вещества [1-3] и органические
тероароматических фрагметна, соединенных про-
люминофоры [4, 5]. С этой целью мы попытались
стой связью. Они находят применение в качестве
применить метод получения бензотиазолов по
фармацевтических препаратов и пестицидов. Вза-
Якобсону [6, 7], заключающийся в циклизации
имное влияние гетероциклических фрагментов в
N-арилтиоамидов в водных растворах щелочей в
бигетарилах как с точки зрения их структуры, так
присутствии феррицианида калия.
и реакционной способности - интересная и недо-
Исходный N-(1-нафтил)тиофен-2-карбоксамид
статочно изученная проблема.
1 получен с выходом 75% при кипячении 1-амино-
В литературе практически отсутствуют сведе-
нафталина с тиофен-2-карбонилхлоридом в 2-про-
ния о получении и свойствах нафто[1,2-d]тиазола,
паноле. Нагревание соединения 1 с избытком пя-
содержащего тиофеновый фрагмент. В то же вре-
тисернистого фосфора в безводном пиридине по-
Схема 1.
1501
1502
АЛЕКСАНДРОВ и др.
Температуры плавления, данные элементного анализа и выходы соединений 1-8а
Найдено, %
Вычислено, %
№
Выход, %
Т. пл.,°С
Формула
С
Н
N
C
H
N
1
75
203-204
70.94
4.55
5.41
С15Н11NOS
71.12
4.38
5.53
2
63
68-69
67.05
3.96
5.37
С15Н11NS2
66.88
4.12
5.20
3
39
104-105
67.23
3.55
4.98
С15Н9NS2
67.38
3.39
5.24
4
57
195-196
57.82
2.44
9.21
С15Н8N2O2S2
57.68
2.58
8.97
5
72
156-157
51.77
2.48
3.81
С15Н8BrNS2
52.03
2.33
4.04
6
64
174-175
64.79
2.85
4.56
С16Н9NOS2
65.06
3.07
4.74
7
27
169-170
65.81
3.34
4.69
С17Н11NOS2
65.99
3.58
4.53
8
51
163-164
70.88
3.67
3.92
С22Н13NOS2
71.13
3.53
3.77
а Результаты элементного анализа соответствуют вычисленным в пределах ±0.34%.
зволяет обменять кислород карбонильной группы
1,2-аннелировании
2-(тиен-2-ил)тиазольного
на серу с выходом соединения 2 63% (схема 1, см.
фрагмента к нафталину.
таблицу).
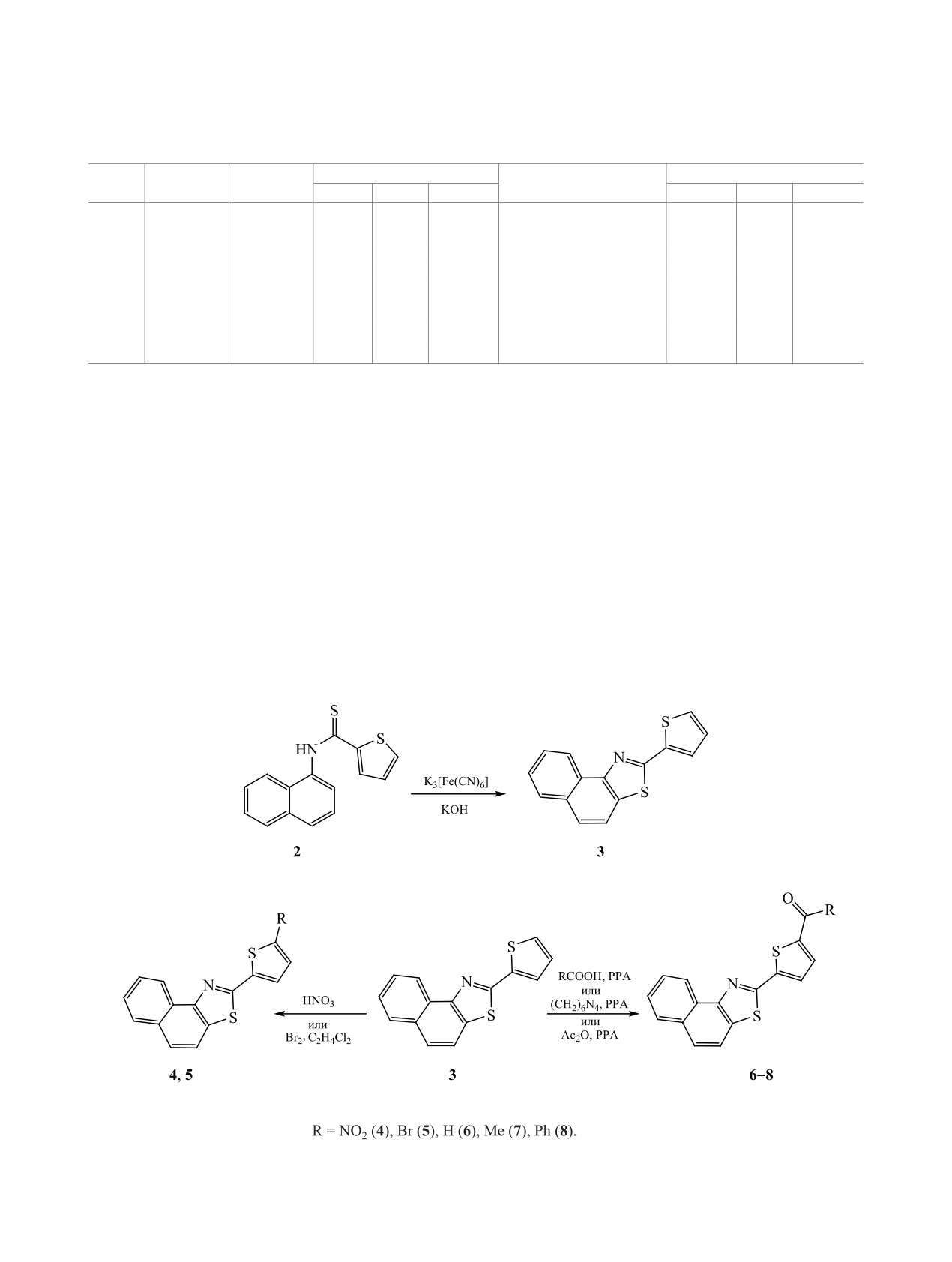
Феррицианид калия в щелочном растворе дей-
Далее соединение 2 растворяли в водном 2-про-
ствует как комплексный ион, отщепляющий элек-
паноле, подщелачивали 5%-ным раствором KОН и
трон; в результате такого окисления карботиоамид
окисляли реакционную массу 20%-ным водным
2 дает катион-радикал, который элиминирует про-
раствором K3[Fe(CN)6]. В результате с выходом
тон и превращается в S-радикал [8], после чего
39% был получен 2-(тиен-2-ил)нафто[1,2-d]тиа-
следует замыкание тиазольного кольца (схема 2).
зол 3 в виде кристаллов кремового цвета. В спек-
2-(Тиен-2-ил)нафто[1,2-d]тиазол 3 вступает в
тре ЯМP 1H соединения 3 присутствуют сигналы
реакции электрофильного замещения: нитрова-
протонов Н4 и Н5 нафталинового кольца при 7.79
ния, бромирования и ацилирования под действи-
и 7.70 м. д. с КССВ 9.0 и 8.9 Гц, что говорит об
ем ацетилнитрата или азотной кислоты, брома в
Схема 2.
Схема 3.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 10 2020
СИНТЕЗ И РЕАКЦИОННАЯ СПОСОБНОСТЬ
1503
дихлорэтане, серной кислоты, уротропина, уксус-
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
ного ангидрида и бензойной кислоты в полифос-
ИК спектры регистрировали на спектроме-
форной кислоте (PPA, cхема 3).
тре Specord 75IR в вазелиновом масле. Спектры
При проведении нитрования под действием
ЯМР 1Н записывали на приборе Varian Unity 300
комплекса Cu(NO3)2 и уксусного ангидрида в ос-
(300 МГц, CDCl3), внутренний стандарт - ТМС.
новном возвращается исходное соединение
3.
Ход реакции контролировали при помощи ТСХ на
Продукт нитрования удалось получить при на-
пластинах с Al2O3 II степени активности по Брок-
гревании
2-(тиен-2-ил)нафто[1,2-d]тиазола
3 в
ману, проявление парами иода, элюент - CH2Cl2,
разбавленной азотной кислоте (d = 1.32 г/см3). По
CHCl3. Элементный анализ проводили на анали-
данным ЯМР 1Н, образуется 5-нитрозамещенный
заторе PerkinElmer 2400. Температуры плавления
по тиофеновому кольцу продукт 4 с выходом 57%.
определяли капиллярным методом.
Аналогичный результат получен при бромирова-
N-(1-Нафтил)тиофен-2-карбоксамид
(1). К
нии нафтотиазола 3 при кипячении в дихлорэтане
раствору 7.15 г (0.05 моль) 1-аминонафталина в
(схема 3); выход 2-(5-бромтиен-2-ил)нафто[1,2-d]-
50 мл 2-пропанола прибавляли 7.33 г (0.05 моль)
тиазола 5 составил 72%.
тиофен-2-карбонилхлорида. Смесь кипятили 2 ч,
Для формилирования пятичленных π-избы-
затем выливали в 50 мл воды, нейтрализовали
точных гетероциклов и их производных успешно
до слабощелочной реакции раствором аммиака и
используют реакцию Вильсмайера [9]. Однако
оставляли в холодильнике на 24 ч. Выделившийся
данный метод не всегда применим для многих ге-
осадок соединения 1 отфильтровывали и перекри-
тарилимидазолов. Соединение 3 также оказалось
сталлизовывали из 2-пропанола. Выход 9.50 г. ИК
инертным к комплексу ДМФА-POCl3, поэтому мы
спектр, ν, см-1: 1685 с (С=О), 3313 ш (NH). Спектр
применили метод формилирования гексаметилен-
ЯМР 1Н (CDCl3), δ, м. д.: 7.22 т (1Н, Н4тиофен, J =
тетрамином в полифосфорной кислоте при 90-
3.8 Гц), 7.51 т (2Н, Н6,7Ar , J = 7.8 Гц), 7.53 т (1Н,
100°С [10] (схема 3). Выход альдегида 6 составил
Н3Ar , J = 7.8 Гц), 7.55 д (1Н, Н5тиофен, J = 5.1 Гц),
64%; другие продукты реакции выделить и иден-
7.72 д (1Н, Н5Ar , J = 8.4 Гц), 7.88 д (1Н, Н2Ar, J =
тифицировать не удалось.
8.4 Гц), 7.94 д (1Н, Н4Ar, J = 8.1 Гц), 7.98 д (1Н,
Ацетилирование соединения 3, вследствие де-
Н3тиофен, J = 3.9 Гц), 8.13 д (1Н, Н8Ar, J = 7.5 Гц),
зактивирующего влияния нафтотиазольного фраг-
8.54 с (1Н, NH).
мента на реакционную способность тиофенового
N-(1-Нафтил)тиофен-2-карботиоамид
(2).
кольца, удалось осуществить лишь действием
К раствору 9.37 г (0.037 моль) соединения 1 в
уксусного ангидрида в среде PPA при 120-130°С
20 мл безводного пиридина прибавляли 4.44 г
(схема 3). Реакция протекает неселективно и со-
(0.020 моль) пентасульфида фосфора. Получен-
провождается образованием побочного продукта,
ную смесь кипятили 3 ч, затем пиридин отгоняли
количество которого увеличивается с ростом тем-
в вакууме. Желтый осадок соединения 2 перекри-
пературы, в связи с чем метилкетон 7 был получен
сталлизовывали из водного 2-пропанола. Выход
с выходом, не превышающим 27%.
6.28 г. ИК спектр, ν, см-1: 1235 с (С=S), 3341 ш
Бензоилирование 2-(тиен-2-ил)нафто[1,2-d]ти-
(NН). Спектр ЯМР 1Н (CDCl3), δ, м. д.: 7.20 т (1Н,
азола 3 проводили действием бензойной кислоты
Н4тиофен, J = 3.9 Гц), 7.48 т (2Н, Н6,7Ar, J = 7.6 Гц),
в полифосфорной кислоте, но при более высокой
7.52 т (1Н, Н3Ar , J = 7.8 Гц), 7.54 д (1Н, Н5тиофен,
температуре (140-150°С). Как и при ацетилирова-
J = 5.0 Гц), 7.71 д (1Н, Н5Ar, J = 8.2 Гц), 7.86 д (1Н,
нии, образуется 5-бензоилкетон 8 с выходом 51%
Н2Ar, J = 8.4 Гц), 7.93 д (1Н, Н4Ar, J = 8.2 Гц), 7.96
(схема 3).
д (1Н, Н3тиофен, J = 3.8 Гц), 8.15 д (1Н, Н8Ar, J =
7.5 Гц), 11.28 с (1Н, NH).
Таким образом, впервые успешно осуществле-
но
1,2-аннелирование
2-(тиен-2-ил)тиазольного
2-(Тиен-2-ил)нафто[1,2-d]тиазол (3). К рас-
фрагмента к нафталину. Изучена относительная
твору 6.19 г (0.023 моль) соединения 2 в 10 мл
реакционная способность полученного 2-(тиен-2-
2-пропанола добавляли 15 мл 5%-ного раствора
ил)нафто[1,2-d]тиазола по отношению к электро-
KOH. К полученной смеси приливали раствор
фильным реагентам.
19.74 г (0.060 моль) K3[Fe(CN)6] в 50 мл теплой
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 10 2020
1504
АЛЕКСАНДРОВ и др.
воды. Смесь нагревали до кипения 1 ч и оставля-
ИК спектр, ν, см-1: 1658 с (С=О). Спектр ЯМР 1Н
ли на ночь. Осадок отделяли и кристаллизовали
(CDCl3), δ, м. д.: 7.61 т (1Н, Н7Ar, J = 7.5 Гц), 7.70 т
из водного спирта, получая целевой продукт 3 в
(1Н, Н8Ar, J = 7.8 Гц), 7.85 д (1Н, Н5Ar, J = 9.0 Гц),
виде бесцветных кристаллов. Выход 2.40 г. Спектр
7.90 д (1Н, Н3тиофен, J = 3.9 Гц), 7.93 д (1Н, Н4Ar,
ЯМР 1Н (CDCl3), δ, м. д.: 7.24 т (1Н, Н4тиофен, J =
J = 9.0 Гц), 7.96 д (1Н, Н6Ar, J = 8.4 Гц), 7.99 д (1Н,
3.9 Гц), 7.52 д (1Н, Н5тиофен, J = 5.2 Гц), 7.57 т (1Н,
Н4тиофен, J = 3.9 Гц), 8.85 д (1Н, Н9Ar, J = 8.1 Гц),
Н7Ar, J = 8.4 Гц), 7.67 т (1Н, Н8Ar, J = 7.2 Гц), 7.79 д
9.77 с (1Н, СНО).
(1Н, Н5Ar, J = 8.7 Гц), 7.89 д (1Н, Н4 Ar, J = 8.9 Гц),
1-[5-Нафто[1,2-d]тиазол-2-ил)тиен-2-ил]-
7.94 д (1Н, Н6Ar, J = 8.1 Гц), 8.02 д (1Н, Н3тиофен,
этан-1-он (7). Смесь 0.534 г (2 ммоль) соединения
J = 3.8 Гц), 8.86 д (1Н, Н9Ar, J = 8.1 Гц).
3 и 0.62 г (6 ммоль) уксусного ангидрида в 10 г
2-(5-Нитротиен-2-ил)нафто[1,2-d]тиазол
(4).
полифосфорной кислоты перемешивали при 120-
Смесь 0.267 г (1 ммоль) соединения 3 и 5 мл азот-
130°C в течение 18 ч, затем разбавляли 10 мл воды
ной кислоты (d = 1.32 г/см3) перемешивали при
и нейтрализовали раствором аммиака. Далее вы-
80°С 3 ч. После окончания реакции смесь выли-
деление продукта реакции проводили аналогично
вали в 100 мл холодной воды, осадок отделяли и
соединению 6. Соединение 7 кристаллизовали из
промывали 2-3 раза небольшим количеством хо-
метанола. Выход 0.167 г, бесцветные кристаллы.
лодной воды. Выход 0.178 г, желтые кристаллы (из
ИК спектр, ν, см-1: 1678 с (С=О). Спектр ЯМР 1Н
2-пропанола). ИК спектр, ν, см-1: 1543 [νas(NO2)],
(CDCl3), δ, м. д.: 2.65 с (3Н, СН3), 7.59 т (1Н, Н7Ar,
1385 [νs(NO2)]. Спектр ЯМР 1Н (CDCl3), δ, м. д.:
J = 8.0 Гц), 7.68 т (1Н, Н8Ar, J = 8.1 Гц), 7.71 д (1Н,
7.62 т (1Н, Н7Ar, J = 7.8 Гц), 7.75 т (1Н, Н8Ar, J =
Н5Ar, J = 9.0 Гц), 7.85 д (1Н, Н4Ar, J = 9.0 Гц), 7.96
7.8 Гц), 7.87 д (1Н, Н5Ar, J = 9.0 Гц), 7.90 д (1Н,
д (1Н, Н6Ar, J = 8.2 Гц), 7.98 д (1Н, Н3тиофен, J =
Н4тиофен, J = 4.5 Гц), 7.92 д (1Н, Н4Ar, J = 9.0 Гц),
7.98 д (1Н, Н6Ar, J = 8.2 Гц), 8.00 д (1Н, Н3тиофен,
4.0 Гц), 8.00 д (1Н, Н4тиофен, J = 4.0 Гц), 8.55 д (1Н,
J = 4.5 Гц), 8.82 д (1Н, Н9Ar, J = 8.1 Гц).
Н9Ar, J = 8.2 Гц).
2-(5-Бромтиен-2-ил)нафто[1,2-d]тиазол (5). К
[5-(Нафто[1,2-d]тиазол-2-ил)тиен-2-ил](фе-
раствору 0.267 г (1 ммоль) соединения 3 в 10 мл
нил)метанон (8). Смесь 0.534 г (2 ммоль) соеди-
дихлорэтана прибавляли 0.32 г (2 ммоль) брома.
нения 3 и 0.74 г (6 ммоль) бензойной кислоты в
Смесь кипятили 4 ч, затем растворитель упарива-
10 г полифосфорной кислоты перемешивали 10 ч
ли, остаток нейтрализовали раствором аммиака.
при 140-150°С. Продукт реакции выделяли ана-
Кремовые кристаллы отделяли и кристаллизовали
логично соединению 6. Соединение 8 кристалли-
из водного 2-пропанола. Выход 0.25 г. Спектр ЯМР
зовали из 1-пропанола. Выход 0.38 г, желтые кри-
1Н (CDCl3), δ, м. д.: 7.18 д (1Н, Н4тиофен, J = 4.5 Гц),
сталлы. ИК спектр, ν, см-1: 1665 с (С=О). Спектр
7.57 т (1Н, Н7Ar, J = 8.1 Гц), 7.67 т (1Н, Н8Ar, J =
ЯМР 1Н (CDCl3), δ, м. д.: 7.53 т (1Н, Н3,4,5Ar, J =
8.1 Гц), 7.79 д (1Н, Н5Ar, J = 8.2 Гц), 7.82 д (1Н,
7.7 Гц), 7.57 т (1Н, Н7Ar, J = 7.5 Гц), 7.63 т (1Н,
Н3тиофен, J = 4.5 Гц), 7.90 д (1Н, Н4тиофен, J = 4.5 Гц),
Н8Ar, J = 7.5 Гц), 7.84 д (1Н, Н5Ar, J = 8.7 Гц), 7.91
7.89 с (1Н, Н4Ar, J = 9.0 Гц), 7.93 д (1Н, Н6Ar, J =
д (1Н, Н4Ar, J = 8.7 Гц), 7.94 д (1Н, Н3тиофен, J =
7.8 Гц), 8.86 д (1Н, Н9Ar, J = 8.4 Гц).
4.0 Гц), 7.96 д (1Н, Н4тиофен, J = 4.0 Гц), 7.98 д (1Н,
5-(Нафто[1,2-d]тиазол-2-ил)тиофен-2-кар-
Н6Ar, J = 8.7 Гц), 8.07 д (1Н, Н2,6Ar, J = 8.1 Гц), 8.86
бальдегид (6). Смесь 0.267 г (1 ммоль) соедине-
д (1Н, Н9Ar, J = 8.4 Гц).
ния 3 и 0.42 г (3 ммоль) уротропина в 5 г поли-
КОНФЛИКТ ИНТЕРЕСОВ
фосфорной кислоты перемешивали при 90-110°С
в течение 6 ч, затем разбавляли 10 мл воды и
Авторы заявляют об отсутствии конфликта
осторожно нейтрализовали раствором аммиака.
интересов.
Выделившийся продукт реакции экстрагирова-
СПИСОК ЛИТЕРАТУРЫ
ли 15 мл хлороформа и хроматографировали на
колонке (10×2.5 cм) с оксидом алюминия, элюи-
1. Mabkhot Y.N., Barakat A., Al-Majid A.M., Alshahrani S.,
руя хлороформом. Соединение 6 кристаллизова-
Yousuf M.I., Choudhary S. // Chem. Cent. J. 2013.
ли из этанола. Выход 0.19 г, желтые кристаллы.
Vol. 7. P. 112. doi 10.1186/1752-153X-7-112
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 10 2020
СИНТЕЗ И РЕАКЦИОННАЯ СПОСОБНОСТЬ
1505
2. Olender D., Zwawiak J., Lukianchuk V., Lesyk R.,
6. Jacobson P. // Ber. 1886. Vol. 19. P. 1067. doi 10.1002/
Kropacz A., Fojutowski A., Zaprutko L. // Eur. J.
cber.188601901239
Med. Chem. 2009. Vol. 44. P. 645. doi 10.1016/j.
7. Fărcăsan V., Makkay C. // Acad. Rep. Populare Române,
ejmech.2008.05.016
Filiala Cluj, St. Cerc. Chim. 1959. Vol. 10. Р. 145.
3. Гребенников В.А., Ельчанинов М.М., Нахрацкий И.И.,
8. Александров А.А., Ельчанинов М.М., Степанов В.Ф. //
Симонов А.М., Боканева С.А. А. с. 1203861 (1985) //
ЖОрХ. 2018. Т. 54. Вып. 7. С. 1011; Alersandrov A.A.,
Б. И. 1986. № 28.
El’chaninov M.M., Stepanov V.F. // Russ. J. Org.
4. Рошаль А.Д., Лукьянов Б.С., Ельчанинов М.М. //
Chem. 2018. Vol. 54. N 7. P. 1014. doi 10.1134/
ЖФХ. 2003. Т. 77. № 10. С. 1899; Roshal A.D.,
S1070428018070072
Lukianov B.S., Elchaninov M.M. // Russ. J. Phys. Chem.
9. Vilsmeier A., Haack A. // Ber. 1927. Vol. 60B. P. 119. doi
(А). 2003. Vol. 77. N 10. P. 1709.
10.1002/cber.19270600118
5. Красовицкий Б.М., Болотин Б.М. Органические лю-
10. Denton D.A., Suschitzky H.J. // J. Chem. Soc. 1963.
минофоры. М.: Мир, 1984. С. 334.
Vol. 115. P. 4741. doi 10.1039/JR9630004741
Synthesis and Some Reactions
of 2-(Thien-2-yl)naphtho[1,2-d]tiazole
A. A. Aleksandrov*, M. M. Elchaninov, D. A. Tishina, Yu. E. Tarakanova, and M. L. Shmanovsky
M.I. Platov South Russian State Polytechnic University (NPI), Novocherkassk, 346428 Russia
*e-mail: aaanet1@yandex.ru
Received May 10, 2020; revised May 10, 2020; accepted May 21, 2020
Condensation of 1-aminonaphthalene with thiophene-2-carbonyl chloride in 2-propanol furnished N-(1-naphthyl)-
thiophene-2-carboxamide, the treatment of which with an excess of P2S5 in anhydrous pyridine led to the corre-
sponding thioamide. Oxidation of the latter with potassium ferricyanide in an alkaline medium according to the
Jacobson method yielded 2-(thien-2-yl)naphtho[1,2-d]thiazole. The later was introduced into the electrophilic
substitution reactions: nitration, bromination, formylation, and acylation. The reactions occurs exclusively at
the position 5 of the thiophene ring.
Keywords: 1-aminonaphthalene, thiophene-2-carbonyl chloride, N-(1-naphthyl)thiophene-2-carboxamide,
oxidation, potassium ferricyanide, electrophilic substitution
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 10 2020