ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2020, том 90, № 10, с. 1506-1511
УДК 547.1’181.54
СИНТЕЗ, МОЛЕКУЛЯРНАЯ И КРИСТАЛЛИЧЕСКАЯ
СТРУКТУРА
ТРИС[2-(КАРБАМОИЛМЕТОКСИ)ФЕНИЛ]-
ФОСФИНОКСИДА
© 2020 г. Т. В. Баулинаа, И. Ю. Кудрявцева,*, А. В. Артемьевb,
И. Ю. Багрянскаяc, М. П. Пасечника, В. К. Брельа
а Институт элементоорганических соединений имени А. Н. Несмеянова Российской академии наук,
ул. Вавилова 28, Москва, 119991 Россия
b Институт неорганической химии имени А. В. Николаева Сибирского отделения Российской академии наук,
Новосибирск, 630090 Россия
c Новосибирский институт органической химии имени Н. Н. Ворожцова Сибирского отделения
Российской академии наук, Новосибирск, 630090 Россия
*e-mail: zaq@ineos.ac.ru
Поступило в Редакцию 17 июня 2020 г.
После доработки 17 июня 2020 г.
Принято к печати 30 июня 2020 г.
Синтезирован новый триподальный лиганд - трис[2-(карбамоилметокси)фенил]фосфиноксид алкили-
рованием триc(2-гидроксифенил)фосфиноксида хлорацетамидом. Изучено его строение методами ИК,
ЯМР 1H, 31P спектроскопии и рентгеноструктурного анализа.
Ключевые слова: триподальный лиганд, трис[2-(карбамоилметокси)фенил]фосфиноксид, кристалли-
ческая структура
DOI: 10.31857/S0044460X20100054
Триподальные лиганды - перспективная груп-
новые кислоты [13] и углеводы [14] и выступать
па органических комплексообразователей, гибкая
в качестве сенсоров, рецепторов и искусственных
структура которых позволяет создавать соедине-
ферментов.
ния, способные связывать субстраты различных
В ряду триподальных ионофоров отличаются
классов. Лиганды с карбамоильными группами
своеобразием так называемые пропеллерные ли-
в боковых цепях образуют прочные комплексы с
ганды на основе органических соединений пира-
солями d- и f-элементов и могут быть использо-
мидальной структуры с тремя арильными замести-
ваны в качестве экстрагентов для извлечения и
телями с функциональными группами в боковой
разделения редких и ценных металлов, а также
цепи. К ним относятся соединения на основе три-
при переработке отработанного ядерного топлива
арилметанов, триариламинов, триарилфосфинов и
[1-5]. Триподальные лиганды с функциональными
триарилфосфиноксидов. В наиболее устойчивой
протонодонорными группами могут образовывать
конформации молекулы этих соединений имеют
комплексы с анионами [6-9]. Варьирование струк-
геометрию несимметричного пропеллера, в кото-
туры триподальных лигандов открывает возмож-
рой заместители в орто-положениях бензольных
ность получения ионофоров для ион-селективных
колец ориентированы в одну сторону (схема 1). Та-
электродов и оптических сенсоров ионов метал-
кая геометрия позволяет синтезировать ионофоры,
лов [10-12]. Триподальные лиганды могут связы-
в которых координирующие атомы функциональ-
вать нейтральные органические молекулы - карбо-
ных групп в боковых цепях сближены в простран-
1506
СИНТЕЗ, МОЛЕКУ
ЛЯРНАЯ И КРИСТАЛЛИЧЕСКАЯ СТРУКТУРА
1507
Схема 1.
фосфиноксид 1 потенциально может образовывать
комплексы как с катионами, связываясь с ними
группами P=O и C=O, так и с анионами и органи-
ческими молекулами за счет водородных связей с
группами NH2.
Соединение
1
получено из трис(2-
гидроксифенил)фосфиноксида 2 и 2-хлорацетами-
да (схема 2).
Соединение 2 легко получается при действии
стве и способны образовывать множество связей с
металлирующего агента
- диизопропиламида
гостевыми ионами и молекулами без существен-
лития (LDA) на трифенилфосфат 3 [18]. Алки-
ной перестройки конформации лиганда [15-17].
лирование фосфиноксида
2
2-хлорацетамидом
В отличие от экстрагентов для гидрометаллур-
приводит к триподальному лиганду 1 с амидной
гии, которые должны обладать значительной ли-
функциональной группой в боковой цепи. В каче-
пофильностью и низкой растворимостью в воде,
стве промотора в реакции алкилирования исполь-
в ряде случаев желательно, чтобы лиганды и их
зовали KBr. После обработки соединение 1 было
комплексы растворялись в воде. Такое требова-
выделено из реакционной смеси в виде кристал-
ние предъявляется в технологических процессах,
логидрата с тремя молекулами воды (по данным
в которых вода используется как самый доступ-
элементного анализа). Соединение 1 заметно рас-
ный и дешевый растворитель. Растворимость в
творяется в воде, хорошо растворяется в поляр-
воде - обязательное условие для лигандов и их
ных органических растворителях (EtOH, MeOH,
комплексов, предназначенных для использования
ДМФА, ДМСО) и нерастворимо в неполярных
в физиологических жидкостях: лекарствах, сред-
растворителях (гексане, эфире, CH2Cl2, CHCl3).
ствах диагностики, контрастных реагентах и т.п.
Состав и строение соединения 1 подтвержде-
Водорастворимые лиганды и комплексы такого
но данными элементного анализа, ИК, ЯМР 1H и
типа могут быть использованы для диагностики и
31P{1H} спектроскопии. Молекулярная структура
терапии различных заболеваний. Кроме того, для
была окончательно установлена рентгенострук-
биомедицинского применения желательно, чтобы
турным анализом.
лиганды и комплексы имели нейтральный харак-
Структура трис[2-(карбамоилметокси)фенил]-
тер и не влияли существенно на рН растворов.
фосфиноксида определена для тригидрата
Нами синтезирован трис[2-(карбамоилметок-
(NH2COCH2OC6H4)3PO·3H2O, который был полу-
си)фенил]фосфиноксид (NH2COCH2OC6H4)3PO
чен кристаллизацией из водного раствора. Сольват
1 - перспективный водорастворимый триподаль-
кристаллизуется в пространственной группе R-3
ный лиганд для связывания катионов, анионов и
с 1/3 молекулы соединения 1 в асимметрической
органических молекул в водных растворах и био-
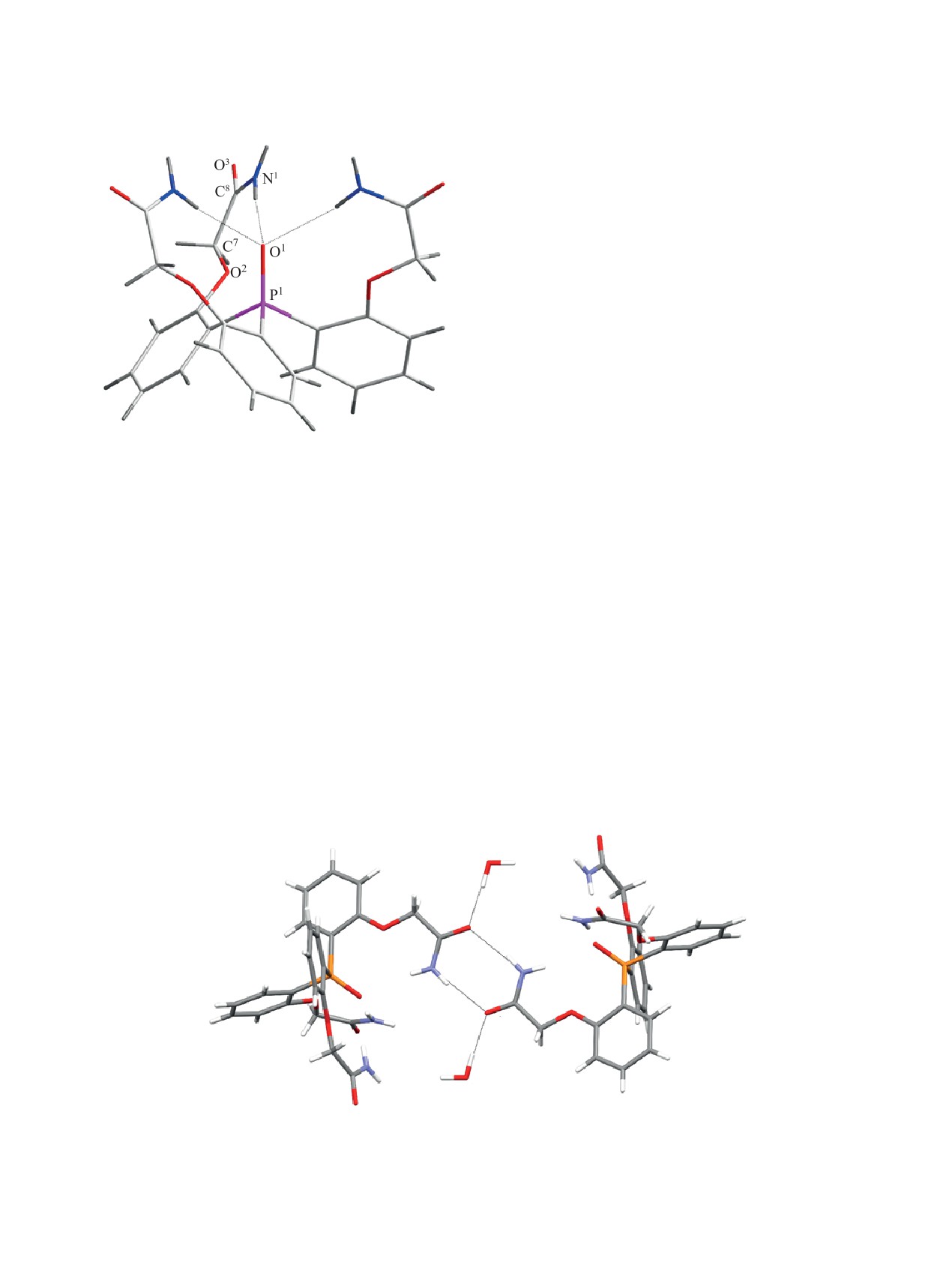
единице. Молекулы фосфиноксида 1 имеют струк-
логических жидкостях, изучены его строение и
туру пропеллера (торсионные углы OPCC τ =
свойства. Благодаря триподальной структуре с со-
51.90°), группы OCH2C(O)NH2 повернуты в сторо-
гласованной ориентацией функциональных групп,
ну атомов кислорода O1 группы P=O (рис. 1).
Схема 2.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 10 2020
1508
БАУЛИНА и др.
сильными межмолекулярными водородными свя-
зями N-H∙∙∙O и O-H∙∙∙O, так что каждая группа
C(O)NH2 образует пару межмолекулярных водо-
родных связей N1-H∙∙∙O3 с амидной группой со-
седней молекулы, в 8-членном цикле c расстояния-
ми H∙∙∙O3 и N1∙∙∙O3 2.071 и 2.923 Å соответственно.
В каждой группе NH2 один протон образует водо-
родную связь N1-H∙∙∙O1(P), а другой протон - бо-
лее короткую связь N1-H∙∙∙O3(С). Карбонильный
кислород ассоциирован с молекулами воды силь-
ными межмолекулярными водородными связями
O1(W)-H∙∙∙O3 с расстояниями O1(W)∙∙∙O3 2.780 Å.
В результате образуется трехмерная супрамолеку-
лярная сеть. На рис. 2 показаны межмолекулярные
водородные связи между молекулами соединения
Рис. 1. Общий вид молекулы трис[2-(карбамоилметок-
си)фенил]фосфиноксида 1 в кристалле.
1 и H2O.
В ИК спектре твердого фосфиноксида 1 поло-
Три амидных водорода образуют внутримоле-
са ν(РО) наблюдается при 1117 см-1, т. е. волновое
кулярную трифуркатную (четырехцентровую) во-
число колебания связи Р=О заметно ниже, чем в
дородную связь N1-H∙∙∙O1, в которой расстояния
триарилфосфиноксидах без водородных связей
H∙∙∙O1 и N1∙∙∙O1 d = 2.398 и 3.251 Å соответственно,
а угол N1-H∙∙∙O1 равен 171.54°. Торсионные углы
(1180 см-1 в спектре [2-Bu2NC(O)CH2OC6H4]3PO
O2-C7-C8-N1 равны -10.768(623)°. Связь P=O
[1]), но несколько выше, чем в спектре трис[2-
(1.502 Å) длиннее, чем в аналогичных триарил-
(тетразол-5-илметокси)фенил]фосфиноксида
фосфиноксидах без водородных связей (1.486 Å в
(1098 см-1), в котором образуется бифуркатная во-
молекуле соединения [2-Bu2NC(O)CH2OC6H4]3PO
дородная связь с двумя протонами групп NH [5].
[1]), но примерно такая же, как в фосфиноксидах,
Широкие полосы ν(NH) имеют максимумы при
в которых группа P=O образует водородную связь
3343 и 3172 см-1, которые можно отнести к ко-
{1.502 Å в соединении Ph2P(O)CH2CH2CH(OH)Me
лебаниям связей групп NH, ассоциированных с
[20], 1.503 [2-HO(CH2)2OC6H4]3PO [21], 1.513 Å
фосфорильной и карбонильной группами соответ-
(HOCH2CH2CH2)3PO [22]}.
ственно. Полоса ν(СО) проявляется при 1685 см-1.
В кристалле молекулы соединения 1 ассоции-
Таким образом, ИК спектр соединения согласует-
рованы друг с другом, а также с молекулами воды
ся с его установленной структурой.
1w
O
O3
N1
N1
O3
O1w
Рис. 2. Межмолекулярные водородные связи между молекулами соединения 1 и H2O.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 10 2020
СИНТЕЗ, МОЛЕКУ
ЛЯРНАЯ И КРИСТАЛЛИЧЕСКАЯ СТРУКТУРА
1509
При растворении в ДМСО, как правило, раз-
группы. Полученные структурные данные будут
рушаются межмолекулярные водородные связи
полезны при моделировании молекулярного до-
и сохраняются внутримолекулярные. Однако в
кинга соединений на этой платформе.
структуре соединения 1 разрыв межмолекулярных
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
ассоциаций С=О∙∙∙HN может повлечь за собой их
Органические растворители марки ХЧ обезво-
участие во внутримолекулярных взаимодействи-
живали и очищали по стандартным методикам
ях, т. е. перестройку системы водородных связей.
[23]. Дейтерированный растворитель ДМСО-d6
Сравнение ИК спектра раствора фосфиноксида 1 в
(Aldrich) использовали без дополнительной очист-
ДМСО-d6 со спектром твердого образца показало
ки.
отсутствие полосы ν(РО) при 1117 см-1, отсутству-
ет также поглощение в области свободной группы
ИК спектры получали на спектрометре FTIR
Р=О. Нам не удалось надежно идентифицировать
Tensor 37 Bruker. Спектр кристаллического образ-
ца (таблетки с KBr) регистрировали в диапазоне
положение полосы ν(РО), возможно, она маскиру-
4000-400 см-1, спектр раствора образца в ДМ-
ется поглощением растворителя, то есть сдвигает-
СО-d6 в диапазоне 4000-1090 см-1. Спектры ЯМР
ся в более низкочастотную сторону {например, в
1H и 31P{1H} соединения 1 регистрировали на при-
ИК спектре (2-HOC6H4)3PO ν(РО) 1090 см-1 [18]}.
боре Bruker AV-300, рабочие частоты - 300.13 (1H)
Положение полосы ν(СО) практически не измени-
и 121.49 МГц (31P{1H}). Внутренний эталон для
лось, так же, как и полос ν(NH). Можно предполо-
спектров ЯМР 1H - сигналы остаточных протонов
жить, что в растворе имеют место конкурирующие
дейтерированного растворителя, внешний эталон
взаимодействия между обеими протоноакцептор-
для спектров ЯМР 31Р{1H} - 85%-ная H3PO4. Эле-
ными группами и группами NH2, причем возмож-
ментный анализ выполнен в лаборатории микроа-
но равновесие разных форм.
нализа Института элементоорганических соедине-
В спектре ЯМР 1H раствора фосфиноксида 1 в
ний РАН.
ДМСО-d6 проявляется синглетный сигнал метиле-
Трис(2-гидроксифенил)фосфиноксид 2 был по-
новых протонов при 4.45 м. д. В области арома-
лучен по методике [18].
тических протонов наблюдается триплет дубле-
Трис[2-(карбамоилметокси)фенил]фосфин-
тов при 7.12 м. д. от протона H4 и триплет при
оксид (1). Смесь 0.98 г (0.003 моль) трис(2-
7.66 м. д. протона H6. Сигналы протонов H3, H5
гидроксифенил)фосфиноксида 2, 20 мл диметил-
перекрываются и проявляются в виде сложного
формамида и 2.50 г (0.18 моль) карбоната калия,
мультиплета при 7.16-7.29 м. д. Сигналы протонов
1.68 г (0.18 моль) амида хлоруксусной кислоты и
группы NH2 проявляются в виде двух значительно
0.25 г (0.002 моль) KBr перемешивали 26 ч при
раздвинутых синглетов при 7.31 и 7.85 м. д., веро-
90°C. После удаления растворителя в вакууме к
ятно, вследствие затрудненного вращения группы
остатку добавляли 50 мл воды и 50 мл хлорофор-
NH2 вокруг связи C-N [19]. Такое различие в сиг-
ма. образовавшийся творожистый осадок отфиль-
налах протонов группы NH2 может быть обуслов-
тровывали, промывали водой, эфиром и растирали
лено образованием различных водородных связей
в смеси эфира с метанолом, 20:1. Образовавшийся
с группами РО и СО. В спектре ЯМР 31P{1H} на-
порошок сушили на воздухе. Выход трис[2-(кар-
блюдается синглет при 30.5 м. д., что соответству-
бамоилметокси)фенил]фосфиноксида в виде три-
ет химическому сдвигу триарилфосфиноксидов
гидрата 1.51 г (91.2%), т. пл. 191-193°С (метанол-
с фосфорильной группой, вовлеченной в силь-
эфир). ИК спектр, ν, см-1: 3343 c. ш (NH), 3172 c. ш
ные водородные связи, например, в спектре ЯМР
(NH), 1685 с (С=О), 1117 c (Р=О). Спектр ЯМР 1H
31P{1H} (2-HOC6H4)3PO δP 35.9 м. д. (ДМСО) [18].
(ДМСО-d6), δ, м. д. (J, Гц): 4.45 с (6H, CH2O), 7.12
Синтезированный нами новый триподаль-
т. д (3H, H4, 4JHH = 2.0, 3JHH = 7.0), 7.16-7.29 м (6H,
ный лиганд - трис[2-(карбамоилметокси)фенил]-
H3, H5), 7.31 с (3H, NH), 7.66 т (3H, H6, 3JHH = 3JHР =
фосфиноксид - может служить основой для по-
7.8),
7.85 с
(3H, NH). Спектр ЯМР
31P{1H}
лучения разнообразных комплексных соединений
(ДМСО-d6): δР 30.5 м. д. Найдено, %: C 52.16; H
с d- и f-элементами, а также с различными орга-
5.41; N 7.58. C24H24N3O7P∙3H2O. Вычислено, %: C
ническими молекулами, содержащими полярные
52.27; H 5.48; N 7.62.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 10 2020
1510
БАУЛИНА и др.
Рентгеноструктурный анализ проводили на
na T.V., Karandashev V.K., Brel V.K. // Polyhedron.
дифрактометре Bruker APEX-II CCD, оснащенном
2019. Vol. 161. P. 276. doi 10.1016/j.poly.2019.01.036
CCD-детектором, с использованием излучения мо-
3. Кудрявцев И.Ю., Баулина Т.В., Пасечник М.П.,
либденового анода (λ = 0.71073 Å) и графитового
Айсин Р.Р., Матвеев С.В., Петровский П.В., Ни-
монохроматора. Поглощение учтено эмпирически
фантьев Э.Е. // Изв. АН. Сер. хим. 2013. № 4. С.
по программе SADABS [24]. Структура решена с
1085; Kudryavtsev I.Yu., Baulina T.V., Pasechnik M.P.,
помощью программы SHELXS97 [25], все не водо-
Matveev S.V., Petrovskii P.V., Nifant’ev E.E. // Russ.
родные атомы локализованы в разностных синте-
Chem. Bull. 2013. Vol. 62. N 4. P. 1086. doi 10.1007/
зах электронной плотности и уточнены с помощью
s11172-013-0146-6
программы SHELXL-2014/7 [26] в анизотропном
4. Kudryavtsev I.Yu., Baulina T.V., Pasechnik M.P.,
приближении. Атомы водорода в молекуле соеди-
Matveev S.V., Matveeva A.G. // Phosphorus, Sulfur,
нения 1 найдены геометрически и уточнены в мо-
Silicon, Relat. Elem. 2014. Vol. 189. N 7-8. P. 946. doi
дели наездника, атомы водорода в молекуле Н2О
локализованы из разностного синтеза и уточнены
10.1080/10426507.2014.904865
изотропно с ограничением на длину связей О-Н.
5. Быховская О.В., Матвеева А.Г., Пасечник М.П., Во-
Кристаллы соединения
1 тригональные,
логжанина А.В., Матвеев С.В., Кудрявцев И.Ю.,
C24H24N3O7P∙3H2O (М
551.48), пространствен-
Баулина Т.В., Брель В.К. // ЖОХ. 2019. Т. 89. Вып. 12.
ная группа R-3; параметры элементарной ячейки
С. 1885. doi 10.1134/S0044460X19120126; Bykhov-
при 296(2) K: a = 13.9869(17), b = 13.9869(17),
skaya O.V., Matveeva A.G., Pasechnik M.P.,
c = 23.896(3) Å, α = 90.00, β = 90.00, γ = 120.00°,
Vologzhanina A.V., Matveev S.V., Kudryavtsev I.Yu.,
V = 4048.6(11) Å3, Z = 6, dвыч. = 1.357 г/см3,
Baulina T.V., Brel V.K. // Russ. J. Gen. Chem. 2019.
μ(MoKα) = 0.161 мм-1, измерено 21932 отраже-
Vol. 89. N 12. P. 2400. doi 10.1134/S1070363219120120
ний до 2θ = 50.8°, из них 1654 независимых (Rint =
6. Singh A. S., Sun S.-S. // Chem. Commun. 2011. Vol. 47.
0.097) и 1034 наблюдаемых; R1(obs) = 0.062,
N 3. P. 8563. doi 10.1039/c1cc12757h
wR2(all) = 0.177, GOF = 1.058. Кристаллографиче-
7. Kuswandi B., Nuriman, Verboom W., Reinhoudt D.N. //
ские данные депонированы в Кембриджской базе
Sensors. 2006. Vol. 6. N 8. P. 978. doi 10.3390/s6080978
структурных данных (CCDC 1937005).
8. Santacroce P.V., Okunola O.A., Zavalija P.Y., Davis J.T. //
ФОНДОВАЯ ПОДДЕРЖКА
Chem. Commun. 2006. N 30. P. 3246. doi 10.1039/
Исследование выполнено при поддержке Рос-
b607221f
сийского научного фонда (проект № 20-13-00329).
9. Gale P.A. // Acc. Chem. Res. 2011. Vol. 44. N 3. P. 216.
Спектральные исследования проведены с исполь-
doi 10.1021/ar100134p
зованием научного оборудования Центра исследо-
10. Reinoso-García M.M., Dijkman A., Verboom W.,
вания строения молекул Института элементоорга-
Reinhoudt D.N., Malinowska E., Wojciechowska D.,
нических соединений РАН.
Pietrzak M., Selucky P. // Eur. J. Org. Chem. 2005.
КОНФЛИКТ ИНТЕРЕСОВ
N 10. P. 2131. doi 10.1002/ejoc.200500002
11. Kuswandi B., Nuriman, Dam H.H., Reinhoudt D.N.,
Авторы заявляют об отсутствии конфликта
Verboom W. // Analyt. Chim. Acta. 2007. Vol. 591. N 2.
интересов.
P. 208. doi 10.1016/j.aca.2007.03.064
СПИСОК ЛИТЕРАТУРЫ
12. Nuriman, Kuswandi B., Verboom W. // Analyt. Chim.
1. Matveeva A.G., Kudryavtsev I.Yu., Pasechnik M.P.,
Acta. 2009. Vol. 655. N 1-2. P. 75. doi 10.1016/j.
Vologzhanina A.V., Baulina T.V., Vavina A.V., Su-
aca.2009.09.045
kat G.Ya, Matveev S.V., Godovikov I.A., Turanov A.N.,
13. Le Gac S., Luhmer M., Reinaud O., Jabin I. //
Karandashev V.K., Brel V.K. // Polyhedron. 2018.
Tetrahedron. 2007. Vol. 63. N 44. P. 10721. doi
Vol. 142. P. 71. doi 10.1016/j.poly.2017.12.025
10.1016/j.tet.2007.06.122
2. Turanov A.N., Matveeva A.G., Kudryavtsev I.Yu.,
14. Welti R., Diederich F. // Helv. Chim. Acta. 2003. Vol. 86.
Pasechnik M.P., Matveev S.V., Godovikova M.I., Bauli-
N 2. P. 494. doi 10.1002/hlca.200390049
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 10 2020
СИНТЕЗ, МОЛЕКУ
ЛЯРНАЯ И КРИСТАЛЛИЧЕСКАЯ СТРУКТУРА
1511
15. Кудрявцев И.Ю., Быховская О.В., Аладжева И.М.,
19. Stewart W. E., Siddall T. H. // Chem. Rev. 1970. Vol. 70.
Баулина Т.В., Брель В.К. // ЖОХ. 2017. Т. 87. Вып. 11.
N 5. P. 517. doi 10.1021/cr60267a001
С. 1922; Kudryavtsev I.Y., Bykhovskaya O.V., Aladzhe-
20. Pasechnik M.P., Matveeva A.G., Lyssenko K.A.,
va I.M., Baulina T.V., Brel V.K. // Russ. J. Gen.
Aysin R.R., Smol’yakov A.F., Zubavichusc Y.V.,
Godovikov I.A., Goryunov E.I. // J. Mol. Struct. 2019.
Chem. 2017. Vol. 87. N 11. P. 2744. doi 10.1134/
Vol. 1175. P. 874. doi 10.1016/j.molstruc.2018.08.009
S1070363217110366
21. Baulina T.V., Pasechnik M.P., Kudryavtsev I.Yu.,
16. Баулина Т.В., Кудрявцев И.Ю., Сукат Г.Я.,
Bykhovskaya O.V., Sukat G.Ya., Smol’yakov A.F.,
Брель В.К. // ЖОХ. 2018. Т. 88. Вып. 9. С. 1559.
Anikina L.V., Brel V.K. // J. Mol. Struct. 2020. Vol. 1217.
doi 10.1134/S0044460X1809024X; Baulina Т.V.,
P. 128324. doi 10.1016/j.molstruc.2020.128324
Kudryavtsev I.Yu., Sykat G.Ya., Brel V.K. // Rus. J.
22. Durrell A.C., Gray H.B., Hazari N., Incarvito C.D., Liu J.,
Gen. Chem. 2018. Vol. 88. N 9. P. 1927. doi 10.1134/
Yan E.C.-Y. // Cryst. Growth Des. 2010. Vol. 10. N 4.
S1070363218090281
P. 1482. doi 10.1021/cg1001286
17. Baulina T.V., Kudryavtsev I.Y., Smolyakov A.F.,
23. Armarego W.L.F. Purification of Laboratory Chemicals.
Pasechnik M.P., Brel V.K. // Heteroatom Chem. 2018.
Amsterdam: Elsevier, 2017. doi 10.1016/B978-0-12-
P. e21454. doi 10.1002/hc.21454
805457-4.50008-2
18. Кудрявцев И.Ю., Баулина Т.В., Хрусталев В.Н., Пе-
24. SADABS program, vers. 2008/1, Bruker AXS, Madison,
тровский П.В., Пасечник М.П., Нифантьев Э.Е. //
WI, USA, 2008.
Докл. АН. 2013. Vol. 448. № 6. P. 657. doi 10.7868/
25. Sheldrick G.M. SHELX-97. Programs for Crystal
S0869565213060121; Kudryavtsev I.Yu., Baulina T.V.,
Structure Analysis (Release 97-2). University of
Khrustalev V.N., Petrovskii P.V., Pasechnik M.P.,
Göttingen, Germany, 1997.
Nifant’ev E.E. // Doklady Chem. 2013. Vol. 448. N 2.
26. Sheldrick G.M. // Acta Crystallogr. (C). 2015. Vol. 71.
P. 55. doi 10.1134/S0012500813020092
N 1. P. 3. doi 10.1107/S2053229614024218
Synthesis, Molecular, and Crystal Structure
of Tris(2-carbamoylmethoxyphenyl)phosphine Oxide
T. V. Baulinaa, I. Yu. Kudryavtseva,*, A. V. Artem’evb, I. Yu. Bagryanskayac,
M. P. Pasechnika, and V. K. Brela
a Nesmeyanov Institute of Organoelement Compounds, Russian Academy of Sciences, Moscow, 119991 Russia
b Nikolaev Institute of Inorganic Chemistry, Siberian Branch of the Russian Academy of Sciences,
Novosibirsk, 630090 Russia
c Vorozhtsov Institute of Organic Chemistry, Siberian Branch of the Russian Academy of Sciences,
Novosibirsk, 630090 Russia
*e-mail: zaq@ineos.ac.ru
Received June 17, 2020; revised June 17, 2020; accepted June 30, 2020
New tripodal ligand, tris(2-carbamoylmethoxyphenyl)phosphine oxide was synthesized by the alkylation of
triphenol with chloroacetamide. The structure of the ligand has been studied by IR, NMR (1H, 31P) spectroscopy
and X-ray diffraction.
Keywords: tripodal ligand, tris(2-carbamoylmethoxyphenyl)phosphine oxide, crystal and molecular structure
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 10 2020