ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2020, том 90, № 10, с. 1522-1532
ОБЗОРНАЯ
СТАТЬЯ
УДК 615.3;577.1
БИОЛОГИЧЕСКИ АКТИВНЫЕ СОЕДИНЕНИЯ
ФУЛЛЕРЕНОВ
© 2020 г. З. М. Саркисян*
Санкт-Петербургский государственный педиатрический медицинский университет,
ул. Литовская 2, Санкт-Петербург, 194100 Россия
*e-mail: zara-sark@inbox.ru
Поступило в Редакцию 6 мая 2020 г.
После доработки 14 мая 2020 г.
Принято к печати 18 мая 2020 г.
В настоящем обзоре рассмотрены опубликованные данные по синтезу производных фуллеренов С60 и
С70 с подтвержденными результатами их различной биологической активности.
Ключевые слова: фуллерен, производные фуллерена, анти-ВИЧ-активность, антивирусная активность,
антиамилоидные свойства
DOI: 10.31857/S0044460X20100078
Во всех странах в ведущих лабораториях ор-
В работах по анти-ВИЧ-активности произво-
ганического синтеза получение соединений на
дных фуллеренов [4, 5] показана активность ио-
основе фуллеренов (С60 и С70) приобретает на-
дида N,N-диметил[70]фуллеропирролидиния
1
растающий характер. Одно из перспективных на-
(схема 1), ингибирующего образование и созре-
правлений - синтез новых хорошо растворимых не
вание ключевых полипротеинов ретровирусного
только в химических растворителях, но и в воде
ВИЧ-1 Gag и Gag-Pol.
производных фуллеренов, обладающих разноо-
В 2018 г. получены аддукты куркумина и его
бразной биологической активностью.
аналогов с фуллереном С60 с использованием
Проявляя множественную реакционную спо-
реакции присоединения-отщепления Бингеля в
собность (вступать в реакции циклоприсоедине-
присутствии четырехбромистого углерода, 1,8-ди-
ния [2+1], [2+3], электрофильного и радикального
азабицикло[5.4.0]ундец-7-ена (DBU), о-дихлор-
присоединения), фуллерены дают возможность
бензола при комнатной температуре (схема 2) [6].
смоделировать и впоследствии синтезировать по-
Соединения 2a-л получены с выходами 23-
лифункциональные биологически активные сое-
55%. Как оказалось, производное самого куркуми-
динения [1, 2].
Схема 1.
Происходящие с вирусом иммунодефицита че-
ловека ВИЧ-1 мутации служат важным поводом
для продолжающегося поиска лекарственного
средства против самого ВИЧ. Существуют лицен-
зированные препараты, блокирующие действие
ключевого компонента вируса - обратной транс-
криптазы, которая обеспечивает фрагментацию,
разрезание белков, в последующем являющихся
составной частью капсидов новых вирионов [3].
1522
БИОЛОГИЧЕСКИ АКТИВНЫЕ СОЕДИНЕНИЯ ФУ
ЛЛЕРЕНОВ
1523
Схема 2.
на 2a обладает не только анти-ВИЧ-активностью,
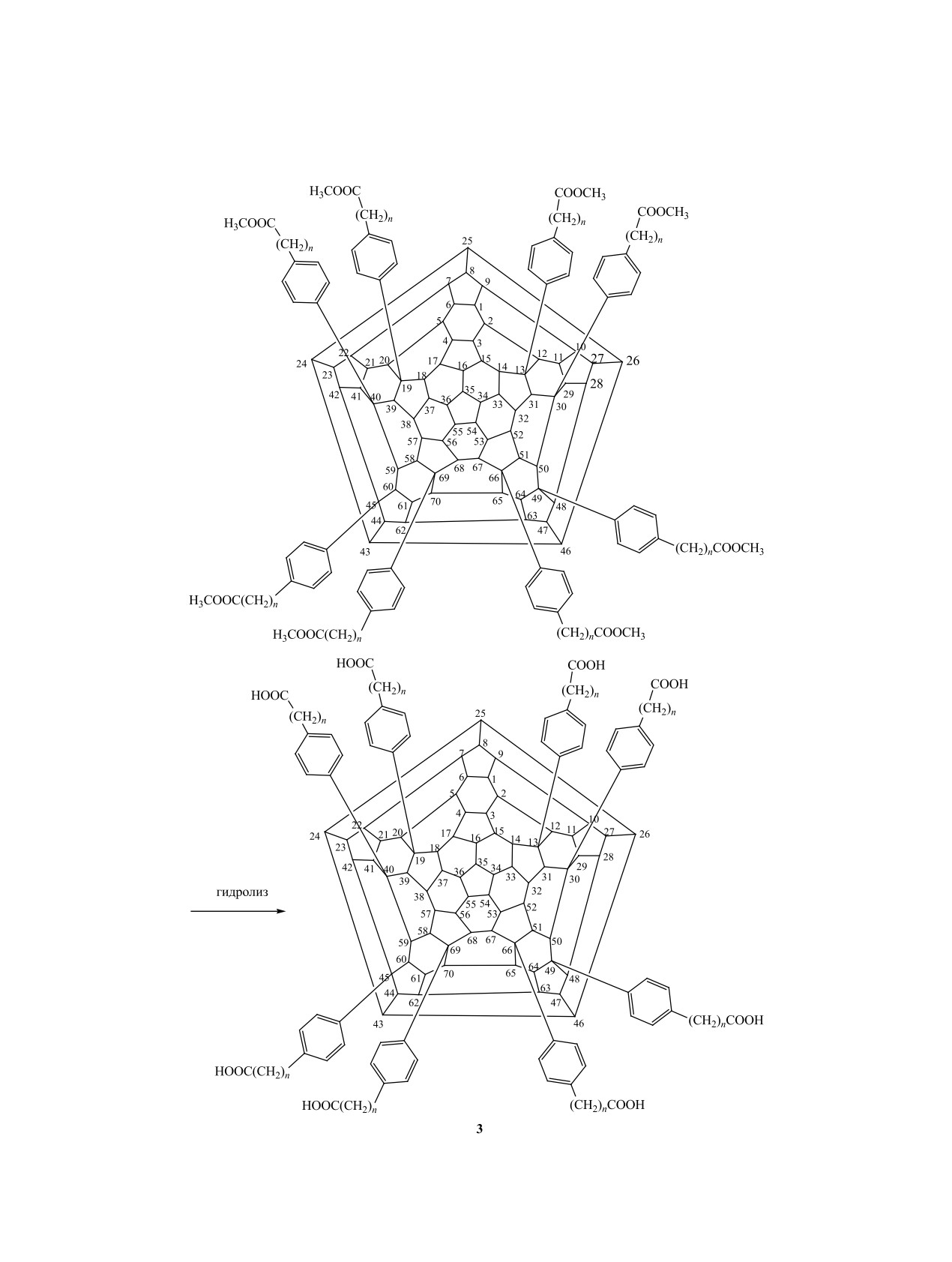
Синтез поликарбоксипроизводных фуллерена
но и антиканцерогенным, антиоксидантным и ней-
проводили также с различными соотношениями
ропротекторным действием.
гидрофобных (дихлорфенил) и гидрофильных
С целью синтеза водорастворимых поли(кар-
(остаток замещенной малоновой кислоты) адден-
боксиалкилфенил)производных фуллерена С70 3
дов с дальнейшим арилированием диметиловым
сначала были получены полихлорпроизводные,
эфиром 2-(3-фенилпропил)малоновой кислоты в
затем проведено арилирование полученных С70Сl8
нитробензоле с использованием FeCl3 (схема 4)
и C70Cl10 с последующим кислотным гидролизом
[8].
[7] (схема 3).
Наблюдалось усиление активности соединений
Одно из поликарбоксипроизводных фуллерена
против ВИЧ-1 при уменьшении количества высо-
обладало действием на ключевой гликопротеид
кополярных (ионных) фенилпропилмалонатных
ВИЧ GP120, который, в свою очередь, является
групп в структуре производного фуллерена с пяти
одним из пусковых факторов нераспознаваемого
(4а) до трех (4в) (R = H, CH3, K). Относительная
антителами связывания вируса с клеткой хозяина.
активность соединений 4а-в против ВИЧ-2 была
Низкая цитотоксичность поликарбоксифуллере-
практически одинаковой с небольшой тенденцией
нов была исследована на мышах.
к снижению при переходе от производного 4а к
фуллерену 4в при R = K (схема 3).
Параллельно удалось выявить активность
предложенных производных (карбоксилат калия,
В реакциях полихлорпроизводного фуллерена
n = 3) по отношению к штаммам гриппа А (H1N1,
С60 с N-метилпиперазином в толуоле при комнат-
H3N2).
ной температуре в течение 3-5 мин получали со-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 10 2020
1524
САРКИСЯН
Схема 3.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 10 2020
БИОЛОГИЧЕСКИ АКТИВНЫЕ СОЕДИНЕНИЯ ФУ
ЛЛЕРЕНОВ
1525
Схема 4.
Схема 5.
единение 5, обладающее ингибирующим действи-
хлорфуллеренов по Фриделю-Крафтсу с исполь-
ем к цитомегаловирусу, сопутствующему ВИЧ
зованием катализатора SnCl4 [10]. Согласно опу-
(схема 5) [9].
бликованным данным, полученные соединения
Стабильные водорастворимые производные
обладают выраженной активностью против штам-
фуллеренов 3-5 удалось получить арилированием
мов R5 и Х4 ВИЧ-1, в том числе действуют силь-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 10 2020
1526
САРКИСЯН
Схема 6.
нее (EC50 близко к 1 мкмоль/л), чем известный
куриного эмбриона, вызывая повреждение вирус-
препарат тенофовир.
ной оболочки, что может быть связано с перехо-
дом электронов через двойную липидную мембра-
Фуллереновые соединения с бис[4,4′-(2-ами-
ну. При воздействии света фуллерен действовал
ноэтил)]дифенильным фрагментом, который был
еще сильнее, что связано с его фотофизическими
получен в три этапа (замещенный бензофенонги-
дразон окисляли пероксидом никеля, полученный
свойствами: на свету фуллерен продуцирует цито-
бисацетамид гидролизовали водным раствором
токсичный атомарный кислород, который и пора-
соляной кислоты с последующей обработкой ан-
жает вирус.
гидридом янтарной кислоты), проявляли актив-
Онкологические заболевания занимают первое
ность in vitro в отношении 3′-азидо-3′-дезоксити-
место в мире, наравне с сердечно-сосудистыми.
мидинрезистентного ВИЧ-1 при концентрации
Производные фуллерена обладают антиканцеро-
~3 мкмоль/л [11]. Биологически активные водо-
генным спектром действия, будучи фотоактивны-
растворимые фуллероиды действовали в большей
ми молекулами [13]. В эксперименте были ото-
степени именно на остроинфицированные клетки
браны фибробластические нормальные клетки и
и в меньшей - на хронически инфицированные.
клетки, пораженные фибросаркомой. Обе куль-
На разных этапах синтеза фуллероида использова-
туры клеток были взяты из соединительной тка-
лись различные заместители Х: (1) Х = CH3C(O)·
ни и обработаны полиэтиленгликольфуллереном
NH(CH2)2- (6а); (2) X = Cl-H3N+(CH2)2- (6б);
(PEG-C60). При облучении клеток обоих типов
(3) X = HOC(O)(CH2)2C(O)NH(CH2)2- (6в) (схема 6).
наблюдалось исчезновение ворсинок фибросар-
Для усиления активности против штаммов
комы (данные электронной микроскопии), а также
РНК-содержащего вируса гриппа А (Н1N1) про-
гибель обработанных полиэтиленгликольфуллере-
веден синтез искусственной мембраны, включа-
ном больных клеток, т.е. PEG-C60 показал высокую
ющей фуллерен. Сначала фуллерен растворяли в
цитотоксичность при облучении галогеновыми
толуоле, а лецитин и холестерин - в смеси хлоро-
лампами, вызвавшими интенсивно голубую флуо-
форма и метанола (3:1), из смеси удаляли раство-
ресценцию ядерного ДНК, в частности, на участке
рители, остаток гомогенизировали 30 мин с помо-
аденин-тимин. Таким образом, получены данные,
щью ультразвука [12].
подтверждающие, что полиэтиленгликольфулле-
рен - важный фотосенсибилизатор, перспектив-
По известной и широко применяющейся мето-
ный для использования при лечении онкологиче-
дике выделения вируса из эмбрионной аллонтоис-
ских заболеваний.
ной жидкости вируса гриппа сравнивали противо-
вирусную активность римантадина гидрохлорида
Возможно, фуллерен и его производные пре-
и фуллереновой мембраны. По результатам прове-
пятствуют аутокринной и паракринной передаче
денного эксперимента выяснилось, что мембрана
сигналов [14, 15]. Фотосенсибилизирующее свой-
обладает значительным инактивирующим дей-
ство, антиканцерогенный эффект на лейкозные
ствием на вирус гриппа в аллонтоисной жидкости
клетки были изучены на примере аддукта 7 ро-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 10 2020
БИОЛОГИЧЕСКИ АКТИВНЫЕ СОЕДИНЕНИЯ ФУ
ЛЛЕРЕНОВ
1527
Схема 7.
дамин-B-5-изотиоцианата с N-метилпирролиди-
Множественная лекарственная устойчивость
новым производным фуллерена-C60 [15]. Синтез
[20], сильные побочные эффекты (особенно при
аддукта 7 проводили по раннее описанным мето-
химиотерапии) [21] стимулируют поиск более
дикам (схема 7) [16, 17]. Смесь метилглицина и па-
эффективных молекул в лечении заболеваний
раформальдегида кипятили 2 ч в толуоле в присут-
различного генеза. Ежегодное увеличение онко-
ствии С60. В результате 1,3-циклоприсоединения
логических больных во всех странах (в США ожи-
илида азометина было выделено N-метилпирроли-
дается прирост с 1.8 млн в 2019 г. до 22.2 млн в
диновое производное фуллерена 8 с выходом 82%.
2030 г. [22]) обусловило поиск путей синтеза но-
Лейкозные клетки обрабатывали соединением
вых препаратов с использованием наночастиц,
7 в течение 2 и 18 ч. Через 2 ч клетки выглядели
направленно доставляющих фармакофор к опухо-
окрашенными. Следовательно, лейкозные клетки
левому участку. Использование в качестве лиган-
хорошо поглощают С60. Так как ультрафиолетовый
дов полиэтиленгликоля или пептида Arg-Gly-Asp
спектр плохо влияет на организм, и в частности,
способствует накоплению фармакофора в целевом
на онкологического больного, облучение проводи-
участке [23]. Гадолиний, применяемый в качестве
ли видимым светом в области 410-700 нм. В ис-
контрастного вещества для МРТ, образует новое
следуемые клетки был также введен цисплатин в
фуллереновое производное GdC82(OH)22 с анти-
концентрации 5 мкг/мл и, согласно предположени-
канцерогенным эффектом [24].
ям [15], введенное фототоксическое производное
Противоопухолевым действием обладают пи-
С60 7 уменьшает резистентность раковых клеток
ридиновые производные фуллерена 9. Для полу-
к цис-диамминдихлороплатине(II), в том числе,
чения исходных соединений проводили окисление
за счет уменьшения мембранного потенциала ми-
соответствующих спиртов [25] методом Десс-
тохондрий в 1.6-2 раза, вызывая АФК-зависимый
Мартина с помощью пятикоординированного со-
митоптоз, где АФК — активные формы кислоро-
да [18], который продуцируется наночастицами,
единения иода (так называемого периодионана
направленно доставляющими фармакофор к опу-
Десс-Мартина) [26, 27]. Полученное карбониль-
холевому участку. Такими молекулами могут слу-
ное соединение 10 вводили в реакцию с произво-
жить также неорганические носители (оксид гра-
дным фуллерена 8 по классическому механизму
фена, наночастицы золота и др.) [19].
биполярного 1,3-циклоприсоединения в присут-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 10 2020
1528
САРКИСЯН
Схема 8.
Схема 9.
ствии саркозина в толуоле при кипячении c после-
го каскада [28]; цис-аддукт пиридин-3-карбальде-
дующим метилированием иодметаном (схема 8).
гида также вызывает образование активных форм
Другие дипиридин-3-илпроизводные фуллере-
кислорода, способных к флуоресценции и иници-
на 11 получены по аналогичному механизму при
ирующих апоптоз пораженной опухолью клетки
кипячении в толуоле с последующим метилиро-
[29, 30]. Все полученные соединения [25] облада-
ванием (схема 9). Кроме того, по такой же схеме
ют наряду с антиканцерогенным эффектом также
был синтезирован аддукт N-метилпиперидин-4-
антипролиферативным и антибактериальным дей-
она [25].
ствием.
Впервые синтезированные пиридин-3-илпро-
В работе [31] изучено строение соединений
изводные 11 фуллерена С60 показали противоопу-
эндоэдральных металлофулеренов С72@Sc2C2,
холевую активность как in vivo (на мышах), так и
C76@Sc2 и С80@Sc2 с целью прекращения ини-
in vitro, вызывая апоптоз клеток в этапах каспазно-
циирования рака молочной железы эпоксидом
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 10 2020
БИОЛОГИЧЕСКИ АКТИВНЫЕ СОЕДИНЕНИЯ ФУ
ЛЛЕРЕНОВ
1529
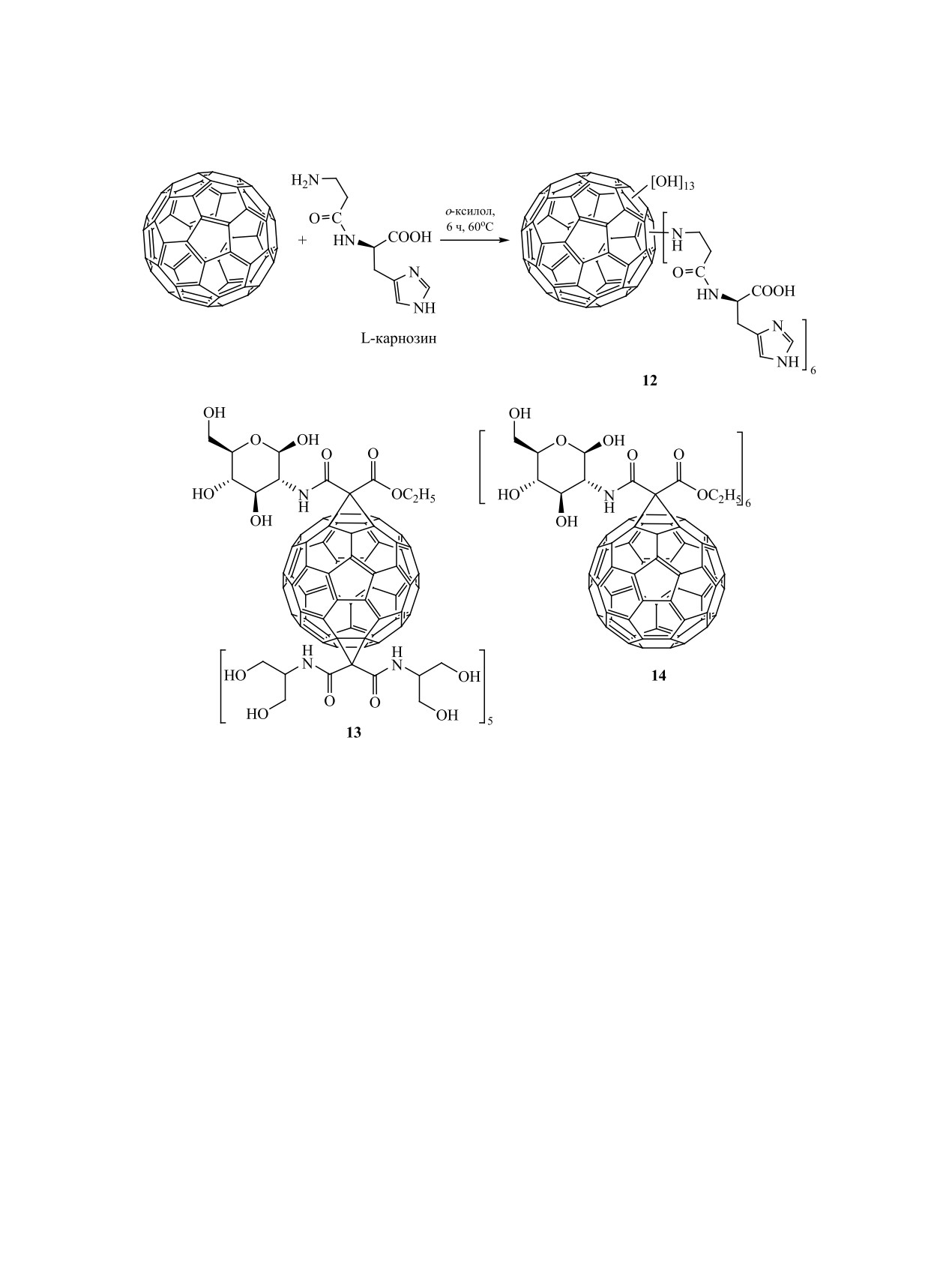
Схема 10.
эстрадиола [32, 33]. В результате математических
киназу (фермент, способствущий разрастанию
расчетов предполагается эндоэдральное располо-
опухоли), точнее, наблюдалось снижение экспрес-
жение скандия и [2+2]-циклоприсоединение эпок-
сии фермента, что свидетельствовало о деграда-
сида эстрадиола к фуллерену [31]. Таким образом,
ции белка [37-40]. Гликофуллерены исследованы
вновь синтезированные соединения, предположи-
на предмет способности инициирования аутофа-
тельно, могут оказаться перспективными синто-
гии в результате вызванного киназами образова-
нами при получении лекарственных веществ для
ния высокого уровня внутриклеточной активной
лечения опухоли именно молочной железы.
формы кислорода [41].
Гидроксилированный аддукт 12 L-карнозина
В 2015 г. вирус Зика широко и быстро затронул
с С60-фуллереном обладает хорошими цитопро-
жителей Африки, Южной (в основном в Бразилии)
текторными свойствами и осуществляет защиту
и Северной Америки [42, 43]. Функционализацией
клетки от окислительного стресса [34] (схема 10).
фуллерена С60 360 (максимальное значение) диса-
Опухоль поджелудочной железы - быстропро-
харидными остатками (в частности, маннозы) по-
грессирующий и возрастающий в количественном
лучены соединения, проявляющие антивирусную
отношении вид онкологических заболеваний [35].
(против вируса Зика и Денге) активность.
Полученные гликозоаминофуллерены 13, 14 были
Поиск вакцины и лекарственных препаратов
протестированы in vitro и in vivo.
против вируса Эбола, вызывающего геморрагиче-
Проведенные эксперименты показали высокое
скую лихорадку [45], распространенного на Аф-
селективное ингибирующее действие на тирозин-
риканском материке и приводящего к 42%-ному
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 10 2020
1530
САРКИСЯН
Схема 11.
летальному исходу в расчете на общее число за-
КОНФЛИКТ ИНТЕРЕСОВ
болевших, актуален по сегодняшний день. Соглас-
Автор заявляет об отсутствии конфликта
но литературным данным [46], азидопроизводные
интересов.
гликофуллерены использовались для синтеза так
называемых супершариков, образованных 13-ю
СПИСОК ЛИТЕРАТУРЫ
фуллереновыми фрагментами. Новые гликоден-
1. Трошин П.А., Любовская Р.Н. // Усп. хим. 2008.
дрофуллерены проявляли активность по отноше-
Т. 77. № 4. С. 323; Troshin P.A., Lyubovskaya R.N. //
нию к псевдотипичной инфекции Эбола.
Russ. Chem. Rev. 2008. Vol. 77. N 4. P. 323. doi
В борьбе против разного рода бактериоло-
10.1070/RC2008v077n04ABE
гических поражений перспективно соедине-
2. Illescas B. M., Rojo J., Delgado R., Martín N. // J.
ние С70(EDA)8 15, где EDA - этилендиамин [47]
Am. Chem. Soc. 2017. Vol. 139. P. 6018. doi 10.1021/
(схема 11), который эффективно уничтожает, бо-
jacs.7b01683
рется с супербактериями и дает положительные
3. Yang H., Nkeze J., Zhao R.Y. // Cell Biosci. 2012.
результаты при клиническом лечении инфекцион-
Vol. 2. N 1. P. 32. doi 10.1186/2045-3701-2-32
ных ран.
4. Castro Е., Martinez Z.S., Seong Ch.S., Cabrera-
Espinoza A., Ruiz M., Hernandez A., Valdez F., Liano L.,
Нейродегенеративная болезнь Альцгеймера,
Echegoyen L.A. // J. Med. Chem. 2016. Vol. 59. N 24.
связанная с накоплением бета-амилоидов в голов-
P. 10963. doi 10.1021/acs.jmedchem.6b00994
ном мозге [48], прогрессирует во всем мире, по
5. Marchesan S., Da Ros T., Spalluto G., Balzarini J.,
прогнозам, к 2050 г. число заболевших достигнет
Prato M. // Bioorganic & Medicinal Chem. Lett. 2005.
108 млн [49]. На основе фуллеренов синтезиро-
Vol. 15. N 15. 3615. doi 10.1016/j.bmcl.2005.05.069
ваны антиамилоидные средства - водораствори-
6. Castro E., Ceron M.R., Garcia A.H., Kim Q.,
мые производные фуллерена С60 с фрагментами
Etcheverry-Berrios A., Morrel M. J., Echegoyen L. //
фенилбутирата калия, аминокапроновой кислоты,
RSC Adv. 2018. Vol. 8. N 73. P. 41692. doi 10.1039/
каптоприлом, которые проявляют низкую цито-
c8ra08334g
токсичность, эффективно подавляют образование
7. Kornev A.B., Peregudov A.S., Martynenko V.M.,
зрелых амилоидных фибрилл и уничтожают эти
Balzarini J., Hoorelbeke B., Troshin P.A. // Chem.
фибриллы [50].
Commun. 2011. N 47. P. 8298. doi 10.1039/c1cc12209f
Из рассмотренной информации следует, что
8. Voronov I.I., Martynenko V.M., Chernyak A.V., Balzari-
необходимо продолжать синтез водорастворимых
ni J., Schols D., Troshin P. A. // Chem. Biodivers. 2018.
производных фуллерена для расширения круга со-
doi 10.1002/cbdv.201800293
единений, эффективных в лечении широкого спек-
9. Kornev A.B., Khakina E.A., Troyanov S.I., Kushch A.A.,
тра заболеваний человека.
Peregudov A., Vasilchenko A., Deryabin D.G.,
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 10 2020
БИОЛОГИЧЕСКИ АКТИВНЫЕ СОЕДИНЕНИЯ ФУ
ЛЛЕРЕНОВ
1531
Martynenko V.M., Troshin P.A. // Chem. Commun. 2012.
N 22. P. 4155. doi 10.1021/jo00170a070
N 44. P. 5461. doi 10.1039/c2cc00071g
27. Barrett A.G.M., Hamprecht D., Ohkubo M. // J. Org.
10. Kraevaya O.A., Peregudov A.S., Godovikov I.A.,
Chem. 1997. Vol. 62. N 26. P. 9376. doi 10.1021/
Shchurik E.V., Martynenko V.M., Shestakov A.F.,
jo971569u
Balzarini J., Schols D., Troshin P.A. // Chem. Commun.
28. Shalini S., Dorstyn L., Dawar S., Kumar S. // Cell
2020. Vol. 56. N 8. P. 1179. doi 11.1039/c9cc08400b
Death & Differentiation. 2014. Vol. 22. N 4. P. 526. doi
11. Schinazi R.F., Sijbesma R., Srdanov G., Hill C.L.,
10.1038/cdd.2014.216
Wudl F. // Antimicrob. Agents Chemother. 1993. Vol. 37.
29. Liu Q., Guan M., Xu L., Shu C., Jin C., Zheng J.,
N 8. P. 1707. doi 10.1128/aac.37.8.1707
Fang X., Yang Y., Wang C. // Cancer Cells. Small. 2012.
12. Ji H., Yang Z., Jiang W., Geng C., Gong M., Xiao H.,
Vol. 8. N 13. P 2070. doi 10.1002/smll.201200158
Wang Zh., Cheng L. // J. Huazhong Univ. Sci. Technol.
30. Liu Q., Zhang X., Zhang X., Zhang G., Zheng J., Guan M.,
2008. Vol. 28. N 3. P. 243. doi 10.1007/s11596-008-
Fang X., Wang C., Shu C. // ACS Appl. Mater.
0303-6
Interfaces. 2013. Vol. 5. N 21. P. 11101. doi 10.1021/
13. Asada R., Liao F., Saitoh Y., Miwa N. // Mol. Cell.
am4033372
Biochem. 2014. Vol. 390. N 1-2. P. 175. doi 10.1007/
31. Gutiérrez-Flores J., Moreno A., Vázquez F. J., Rios C.,
s11010-014-1968-8
Minutti B., Morales G., Suarez A., Ramos E., Salcedo R. //
14. Fiorito S., Serafino A., Andreola F., Togna A., Togna G. //
J. Mol. Model. 2018. Vol. 24. N 9. doi 10.1007/s00894-
J. Nanosci. Nanotechnol. 2006. Vol. 6. N 3. P. 591. doi
018-3778-5
10.1166/jnn.2006.125
32. Pérez-Manríquez L., Ramos E., Rangel E., Salcedo R. //
15. Franskevych D., Palyvoda K., Petukhov D., Prylutska S.,
Mol. Simulation. 2013. Vol. 39. N 8. P. 612. doi
Grynyuk I., Schuetze C., Drobot L., Matyshevska O.,
10.1080/08927022.2012.758845
Ritter U. // Nanoscale Res. Lett. 2007. Vol. 12. P. 1. doi
33. Rios C., Ramos E., Pérez-Manriquez L., Salcedo R. //
10.1186/s11671-016-1819-5
Mol. Simulation. 2014. Vol. 41. N 15. P. 1292. doi
16. Maggini M., Scorrano G., Prato M. // J. Am. Chem. Soc.
10.1080/08927022.2014.983100
1993. Vol. 115. N 21. P. 9798. doi 10.1021/ja00074a056.
34. Ma H., Zhao J., Meng H., Hu D., Zhou Y., Zhang X.,
17. Schuetze C., Ritter U., Scharff P., Fernekorn U.,
Yuan J., Wei Y. // ACS Appl. Mater. Interfaces. 2020. doi
Prylutska S., Bychko A., Ribalchenko V., Prylutskyy Y. //
10.1021/acsami.0c01669
Mater. Sci. Eng. (C). 2011. Vol. 31. N 5. P. 1148. doi
35. Kamisawa T., Wood L. D., Itoi T., Takaori K. // Lancet.
10.1016/j.msec.2011.02.026
2016. Vol. 388. N 10039. P. 73. doi 10.1016/s0140-
18. Jangamreddy J. R., Los, M. J. // Hepatitis Monthly.
6736(16)00141-0
2012. Vol. 12. P. 8. doi 10.5812/hepatmon.6159.
36. Serda M., Malarz K., Mrozek-Wilczkiewicz A., Wojtyni-
19. Naz S., Shamoon M., Wang R., Zhang L., Zhou J., Chen J. //
ak M., Musioł R., Curley S.A. // Sci. Rep. 2020. Vol. 10.
Int. J. Mol. Sci. 2019. Vol. 20. N 4. P. 965. doi 10.3390/
N 1. doi 10.1038/s41598-019-57155-7
ijms20040965
37. Parsons S.J., Parsons J.T. // Oncogene. 2004. Vol. 23.
20. Ren F., Shen J., Shi, H., Hornicek F. J., Kan Q.,
N 48. P. 7906. doi 10.1038/sj.onc.1208160
Duan Z. // Biochim. Biophys. Acta. Rev. Cancer. 2016.
38. Chen Z.-Y., Cai L., Bie P., Wang S.-G., Jiang Y.,
Vol. 1866. N 2. P. 266. doi 10.1016/j.bbcan.2016.10.001
Dong J.-H., Li X.-W. // J. Gastroenterol. Hepatol.
21. Winer A., Adams S., Mignatti P. // Mol. Cancer Ther.
2020. Vol. 25. N 2. P. 293. doi 10.1111/j.1440-
2018. Vol. 7. N 6. P. 1147. doi 10.1158/1535-7163.
1746.2009.06021.x
mct-17-0646
39. Yadav V., Denning M.F. // Mol. Carcinogenesis. 2010.
22. Bray F., Jemal A., Grey N., Ferlay J., Forman D. //
Vol. 50. N 5. P. 346. doi 10.1002/mc.20716
Lancet Oncol. 2012. Vol. 13. N 8. P. 790. doi 10.1016/
40. Je D. W., O Y. M., Ji Y. G., Cho Y., Lee D. H. // Cell
s1470-2045(12)70211-5
Proliferation, Migration, Invasion. Pancreas. 2014. Vol. 43.
23. Moreira, A. F., Dias, D. R., Correia, I. J. // Micropor.
N 5. P. 768. doi 10.1097/mpa.0000000000000103
Mesopor. Mater. 2016. Vol. 236. P. 141. doi 10.1016/j.
41. Luo Y., Zou P., Zou J., Wang J., Zhou D., Liu L. // Exp.
micromeso.2016.08.038
Gerontol. 2011. Vol. 46. N 11. 860. doi 10.1016/j.
24. Li J., Chen L., Yan, L., Gu Z., Chen Z., Zhang A., Zhao F. //
exger.2011.07.005
Molecules. 2019. Vol. 24. N 13. P. 2387. doi 10.3390/
42. Enserink M. // Science. 2015. Vol. 350. N 6264. P. 1012.
molecules24132387
doi 10.1126/science.350.6264.1012
25. Yasuno T., Ohe T., Ikeda H., Takahashi K., Nakamu-
43. Vogel G. // Science. 2016. Vol. 351. N 6269. P. 110. doi
ra Sh., Mashino T. // Int J. Nanomedicine. 2019. Vol. 14.
10.1126/science.351.6269.110
P. 6325. doi 10.2147/IJN.S212045
44. Ramos-Soriano J., Reina J.J., Illescas B.M., Cruz N.,
26. Dess D.B., Martin J.C. // J. Org. Chem. 1983. Vol. 48.
Rodríguez-Perez N., Lasala F., Rojo J., Delgado R.,
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 10 2020
1532
САРКИСЯН
Martín N. // J. Am. Chem. Soc. 2019. Vol. 141. P. 15403.
48. Ballard C., Gauthier S., Corbett A., Brayne C., Aars-
doi 10.1021/jacs.9b08003
land D., Jones E. // Lancet. 2011. Vol. 377. N 9770.
45. Goldstein T., Anthony S.J., Gbakima A., Bird B.H.,
P. 1019. doi 10.1016/s0140-6736(10)61349-9
Bangura J. // Nature Microbiology. 2018. Vol. 3. P.
49. Brookmeyer R., Johnson E., Ziegler-Graham K., Ar-
1084. doi 10.1038/s41564-018-0227-2
righi H.M. // Alzheimer’s Dementia. 2007. Vol. 3. N 3.
46. Illescas B. M., Rojo J., Delgado R., Martín, N. // J. Am.
P. 186. doi 10.1016/j.jalz.2007.04.381
Chem. Soc. 2017. Vol. 139. N 17. P. 6018. doi 10.1021/
50. Bobylev A.G., Kraevaya O.A., Bobyleva L.G., Khaki-
jacs.7b01683
na E.A., Fadeev R.S., Zhilenkov A.V., Mishchenko D.V.,
47. Zhang J., Xu J., Ma H., Bai H., Liu L., Shu C., Li H.,
Penkov N.V., Teplov I.Y., Yakupova E.I., Vikhlyan-
Wang C. // ACS Appl. Mater. Interfaces. 2019. Vol. 11.
tsev I.M., Troshin P. A. // Colloids and Surfaces (B).
P. 14597. doi 10.1021/acsami.9b01483
2019. P. 110426. doi 10.1016/j.colsurfb.2019.11042
Biologically Active Fullerene Derivatives
Z. M. Sarkisyan*
St. Petersburg State Pediatric Medical University, St. Petersburg, 194100 Russia
*e-mail: zara-sark@inbox.ru
Received May 6, 2020; revised May 14, 2020; accepted May 18, 2020
The review summarizes the data on the synthesis of fullerene C60 and C70 derivatives with various biological
activity.
Keywords: fullerene, fullerene derivatives, anti-HIV activity, antiviral activity, antiamyloid properties
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 10 2020