ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2020, том 90, № 10, с. 1533-1540
УДК 547.455.522:546.59
СИНТЕЗ 6-МЕРКАПТОГЕКСАНОИЛГИДРАЗОНОВ
МОНО- И ДИСАХАРИДОВ КАК ПОТЕНЦИАЛЬНЫХ
ЛИГАНДОВ ГЛИКОНАНОЧАСТИЦ БЛАГОРОДНЫХ
МЕТАЛЛОВ
© 2020 г. А. Ю. Ершовa,*, А. А. Мартыненковa, И. В. Лагодаb, А. В. Якиманскийa,c
a Институт высокомолекулярных соединений Российской академии наук,
Большой пр. 31, Санкт-Петербург, 199004 Россия
b Научно-исследовательский испытательный центр (медико-биологической защиты)
Государственного научно-исследовательского испытательного института военной медицины
Министерства обороны РФ, Санкт-Петербург, 195043 Россия
c Санкт-Петербургский государственный университет, Санкт-Петербург, 199034 Россия
*е-mail: ershov305@mail.ru
Поступило в Редакцию 22 июня 2020 г.
После доработки 22 июня 2020 г.
Принято к печати 9 июля 2020 г.
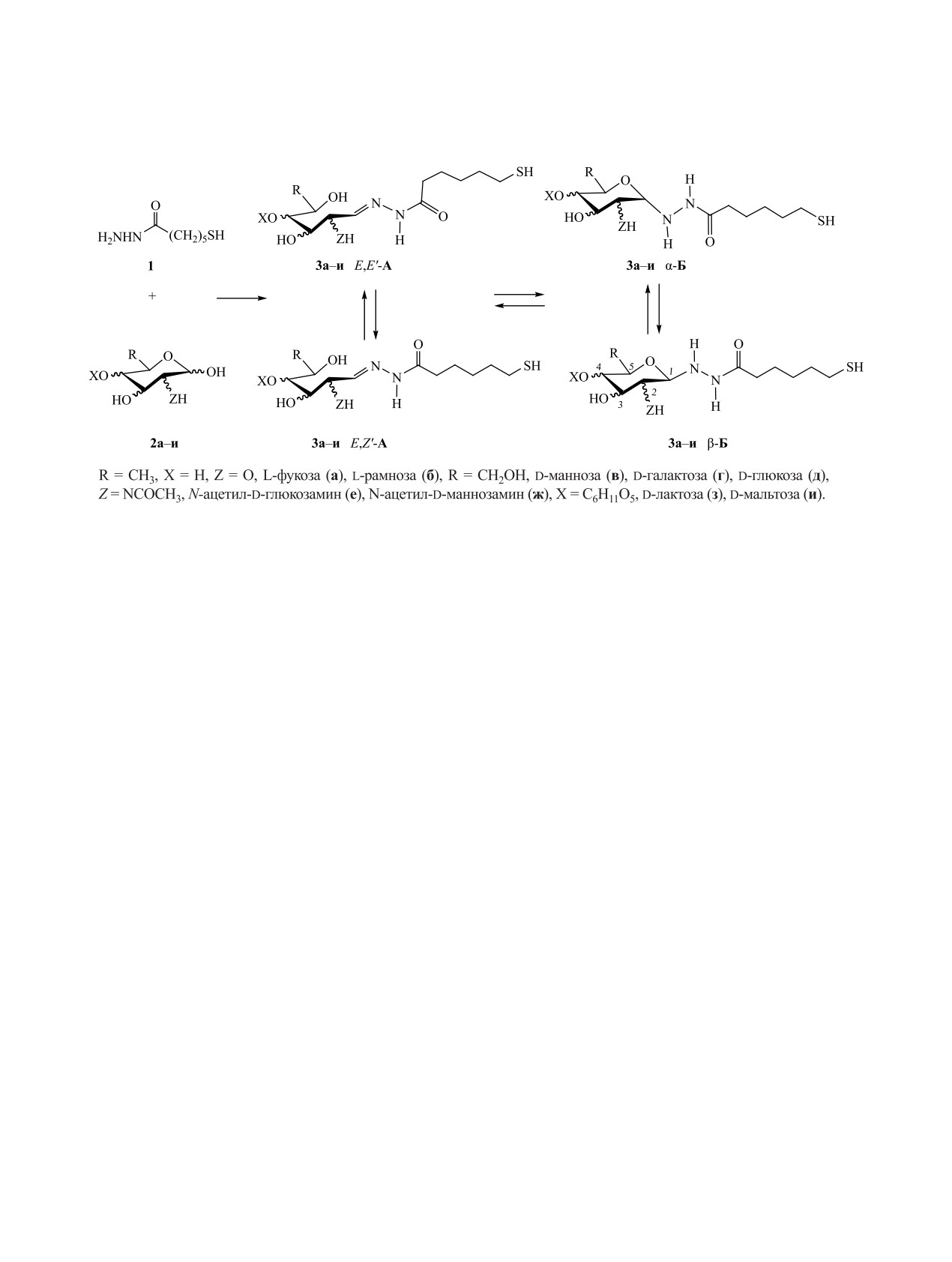
Методами спектроскопии ЯМР 1Н и 13С изучено строение неизвестных ранее продуктов конденсации
серии альдоз (L-фукозы, L-рамнозы, D-маннозы, D-галактозы, D-глюкозы, N-ацетил-D-глюкозамина,
N-ацетил-D-маннозамина, D-лактозы и D-мальтозы) с гидразидом 6-меркаптогексановой кислоты - пер-
спективных гликолигандов наночастиц благородных металлов. Показано, что производные L-фукозы,
L-рамнозы, D-маннозы, D-галактозы и N-ацетил-D-маннозамина находятся в растворе в ДМСО-d6 в виде
таутомерной смеси открытой гидразонной и циклической пиранозной форм. Линейная гидразонная
форма представлена набором Z′,E′-конформационных изомеров, отличающихся расположением за-
местителей относительно амидной связи C-N, в сопоставимых количествах. Продукты конденсации,
полученные на основе D-глюкозы, N-ацетил-D-глюкозамина, D-лактозы и D-мальтозы в кристаллическом
состоянии и в растворах в ДМСО-d6 имеют исключительно циклическое пиранозное строение, представ-
ленное α,β-конфигурационными изомерами. Аналогичный переход в пиранозную форму наблюдается в
растворах всех исследуемых соединений в D2O.
Ключевые слова: тиолсодержащие моно- и дисахариды, кольчато-цепная таутомерия
DOI: 10.31857/S0044460X2010008X
Тиолированные сахара - интенсивно развива-
маркеров и биосенсоров [3-5], активно применя-
ющийся класс углеводов, нашедший в последнее
ются при диагностике и лечении онкологических
время применение в качестве лигандов в синтезе
заболеваний [1, 6-13], обладают бактерицидными
гликонаночастиц благородных металлов. Благо-
и противовирусными свойствами [14].
даря разветвленной сети углеводных фрагментов,
Ранее нами был предложен простой метод син-
гликонаночастицы моделируют естественную кле-
теза гликонаночастиц Ag и Au на основе продуктов
точную поверхность и обладают высоким срод-
конденсации гидразидов тиогликолевой, 3-мер-
ством к природным гликопротеиновым молекулам
каптопропионовой и 2-меркаптобензойной кислот
(лектинам), а наличие в их составе металлического
с серией моно- и дисахаридов, а также показана
ядра, придает им уникальные оптические свойства
высокая антивирусная и антимикробная актив-
[1-14]. Действительно, гликонаночастицы Ag и
ность полученных конъюгатов [15-20]. Развивая
Au используются в качестве иммунохимиических
разработанную «гидразидную технологию» син-
1533
1534
ЕРШОВ и др.
Схема 1.
теза тиолированных сахаров и гликонаночастиц
Б, а в растворе они частично превращаются в ли-
благородных металлов на их основе, мы изучили
нейную форму A.
возможности получения тиолированных гликоли-
Для большинства 6-меркаптогексаноилгидра-
гандов на примере продуктов конденсации гидра-
зонов альдоз в спектрах ЯМР 1Н и 13С в ДМСО-d6
зида 6-меркаптогексановой кислоты с серией при-
наблюдаются два набора резонансных сигналов,
родных моно- и дисахаридов (схема 1).
отвечающих двум стереоизомерам линейной фор-
Исходный гидразид 1 был получен с выходом
мы А (см. таблицу). Наблюдаемое удвоение сигна-
85% по известной методике [19]; его физико-хими-
лов в спектрах ЯМР 1Н и 13С исследуемых соедине-
ческие и спектральные характеристики полностью
ний следует связать с наличием конформационных
соответствовали литературным данным. 6-Мер-
Z′,E′-изомеров линейной формы А, отличающихся
каптогексаноилгидразоны альдоз 3а-и образуются
расположением заместителей относительно амид-
с выходом 60-85% при кипячении эквимолярных
ной связи C-N. Существование E,Z-конфигураци-
количеств исходных реагентов 1 и 2а-и в метаноле
онной изомерии относительно связи C=N нами не
или водно-метанольном растворе в течение 5 ч.
рассматривалось, поскольку альдоацилгидразоны
имеют преимущественное или полное E-конфи-
6-Меркаптогексаноилгидразоны
3а-и пред-
ставляют собой потенциальные таутомерные си-
гурационное построение относительно этой связи
[18, 20]. Отнесение сигналов E,E′- и E,Z′-конфор-
стемы, способные существовать в виде линейной
меров линейной формы А основано на известном
гидразонной формы А и/или циклической пира-
различии в положении химических сдвигов ато-
нозной формы Б. Относительная интенсивность
сигналов, приписываемых формам A и Б в спек-
мов углерода связей C=N и C=O в спектрах ЯМР
13С; сигналы E′-изомера этих групп располагаются
трах ЯМР 1H и 13C, изменялась со временем; че-
в области 145 и 170 м. д., тогда как для Z′-изоме-
рез 48 ч эти изменения прекращались, указывая на
ра эти сигналы лежат при 150 и 160 м. д. соответ-
достижение равновесного состояния. В спектрах
ственно [20].
ЯМР 1H и 13C соединений 3а-и, снятых сразу по-
сле растворения в ДМСО-d6, интенсивность сиг-
Аналогичное удвоение сигналов в спектрах
налов, приписываемых пиранозной форме Б, была
ЯМР 1Н и 13С для большинства 6-меркаптогекса-
значительно выше, чем в спектрах, зарегистри-
ноилгидразонов альдоз фиксируется и для цикли-
рованных после установления равновесия А↔Б.
ческой формы Б (см. таблицу). Наблюдаемое
Это указывает, что в кристаллическом состоянии
удвоение сигналов обусловлено наличием α,β-кон-
соединения 3а-и существуют в пиранозной форме
фигурационной изомерии при аномерном атоме
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 10 2020
СИНТЕЗ 6-МЕРКАПТОГЕКСАНОИЛГИДР
АЗОНОВ МОНО- И ДИСАХАРИДОВ
1535
Таутомерный состав соединений 3а-и в различных растворителях (72 ч после растворения)
№
Растворитель
Форма E,E′-А
Форма E,Z′-А
Форма α-Б
Форма β-Б
3а
ДMСO-d6
15
15
20
50
3б
ДMСO-d6
25
25
30
20
D2O
-
-
80
20
3в
ДMСO-d6
35
30
15
20
D2O
-
-
10
90
3г
ДMСO-d6
25
25
10
40
D2O
-
-
-
100
3д
ДMСO-d6
-
-
25
75
3е
ДMСO-d6
-
-
60
40
3ж
ДMСO-d6
20
20
15
45
D2O
-
-
-
100
3з
ДMСO-d6
-
-
30
70
3и
ДMСO-d6
-
-
20
80
углерода С1 пиранозной формы. При этом ду-
динений 1 и 2а-и в нейтральной и слабощелочной
блетному сигналу Н1, находящемуся в более силь-
среде, что контролировалось съемкой их спектров
ных полях и имеющему бóльшую величину КССВ
ЯМР 1Н и 13С в растворе в D2O в течение 4 недель.
(J = 8.0-9.0 Гц), следует приписать β-конфигура-
Однако при добавлении каталитических количеств
цию. Сигнал атома Н1 α-конфигурационного изо-
минеральных кислот такой процесс ускоряется,
мера обнаруживается в более слабом поле и имеет
приводя к смеси исходных компонентов уже через
меньшую величину КССВ (J = 4.0-4.5 Гц). Обрат-
несколько часов. Данное обстоятельство, безус-
ное расположение сигналов обычно наблюдает-
ловно, необходимо учитывать при последующем
ся для атома С1 в спектрах ЯМР 13С: 85-88 м. д.
использовании соединений 3а-и в качестве ли-
(α-изомер) и 90-95 м. д. (β-изомер).
гандов во взаимодействии с водными растворами
Продукты конденсации гидразида
6-мер-
коллоидного серебра и золота [21].
каптогексановой кислоты с D-глюкозой 3д и N-
Поскольку для продуктов конденсации гидра-
ацетил-D-глюкозамином 3е, а также продукты на
зида 6-меркаптогексановой кислоты с моно- и ди-
основе D-лактозы 3з и D-мальтозы 3и проявляют
сахаридами частичный переход в линейную форму
склонность к нахождению в единственной цикли-
А наблюдается лишь в растворах в ДМСО-d6, тер-
ческой пиранозной форме А, представленной в
мин «6-меркаптогексаноилгидразон» для подоб-
растворе в ДМСО-d6 двумя α,β-конфигурацион-
ных систем носит условный характер.
ными изомерами. Аналогичная тенденция к ста-
Таким образом, предложен малостадийный
билизации пиранозной формы для тиолированных
метод синтеза тиолированных моно- и дисаха-
ацилгидразонов дисахаридов была отмечена нами
ридов - перспективных лигандов для получения
ранее при изучении строения продуктов конден-
гликонаночастиц серебра и золота. Важно подчер-
сации D-лактозы и D-мальтозы с гидразидами ти-
кнуть, что разработанный метод не предполагает
огликолевой, 3-меркаптопропионовой и 11-мер-
предварительной защиты гидроксильных групп
каптоундекановой кислот [17, 18].
исходного углевода, что в значительной степени
Стабилизировать пиранозную форму Б удает-
упрощает синтез тиолсодержащих сахаров и гли-
ся и варьированием природы используемого рас-
конаночастиц благородных металлов на их основе.
творителя. Так, судя по данным спектроскопии
Это будет являться предметом наших дальнейших
ЯМР 1Н и 13С, переход от апротонного полярного
исследований.
ДМСО-d6 к раствору в D2О полностью смещает
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
равновесие А↔Б в сторону циклического тауто-
мера (см. таблицу).
Элементный анализ полученных соединений
6-Меркаптогексаноилгидразоны
3а-и оказа-
проводили на анализаторе Hewlett-Packard 185B.
лись стабильными к гидролизу до исходных сое-
Спектры ЯМР 1Н и 13С снимали на спектроме-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 10 2020
1536
ЕРШОВ и др.
тре Bruker AV-400 при рабочих частотах 400 и
м. д.: форма E,E′-А, 16.70 (СН3), 23.79 (СН2), 24.78
100 МГц соответственно. Контроль за протеканием
(СН2), 27.67 (2СН2), 34.01 (СН2), 65.52 (C5), 70.35
реакций осуществляли методом ТСХ на пластин-
(С4), 71.80 (С2), 72.89 (С3), 148.85 (С=N), 174.04
ках марки Silufol UV-254 в системе бензол-ацетон,
(C=O); форма E,Z′-А, 17.01 (СН3), 23.79 (СН2),
4:1. Таутомерный состав исследуемых соединений
24.78 (СН2), 27.67 (2СН2), 34.01 (СН2), 65.24 (C5),
определяли интегрированием соответствующих
70.35 (С4), 71.34 (С2), 72.52 (С3), 151.80 (С=N),
сигналов в спектрах ЯМР 1Н. Погрешность изме-
168.44 (C=O); форма α-Б, 19.85 (СН3), 24.75 (СН2),
рений составляла ±5%.
27.54 (СН2), 28.58 (2СН2), 33.34 (СН2), 67.37 (C5),
Гидразид 6-меркаптогексановой кислоты 1
70.04 (С4), 71.84 (С2), 72.52 (С3), 88.41 (С1), 170.53
получен по методике [19]. Выход 85%, т. пл. 44-
(C=O); форма β-Б, 19.88 (СН3), 24.94 (СН2), 27.44
46°С. Спектр ЯМР 1Н (ДMСO-d6), δC, м. д.: 1.30
(СН2), 28.42 (2СН2), 33.13 (СН2), 67.89 (C5), 71.38
м (2Н, СН2), 1.49 м (4Н, 2СН2), 1.99 т (2Н, J =
(С4), 73.58 (С3), 74.58 (С2), 91.56 (С1), 172.41 (C=O).
7.0 Гц, СН2), 2.19 т (1Н, J = 7.5 Гц, SН), 2.44 к (2Н,
Найдено, %: С 46.68, H 7.90, N 9.13. C12H24N2O5S.
J = 7.0 Гц, СН2S), 4.14 уш. с (2Н, NH2), 8.92 уш. с
Вычислено, %: С 46.74, H 7.84, N 9.08.
(1Н, NHCO). Спектр ЯМР 13С (ДMСO-d6), δ, м. д.:
6-Меркаптогексаноилгидразон L-рамнозы
23.79 (CH2), 24.79 (CH2), 27.50 (CH2), 33.21 (CH2),
(3б). Выход 70%, т. пл. 103-105°С. Спектр ЯМР
33.42 (CH2), 171.67 (C=O). Найдено, %: С 44.37, H
1Н (ДMСO-d6), δ, м. д.: форма E,E′-А (25%), 1.09
8.63, N 17.34. C6H14N2OS. Вычислено, %: С 44.41,
д (0.75Н, J = 7.0 Гц, СН3), 1.33 м (0.5Н, СН2), 1.52
H 8.70, N 17.27.
м (1Н, 2СН2), 2.01 м (0.5Н, СН2), 2.46 к (0.5Н, J =
Синтез
6-меркаптогексаноилгидразонов
7.0 Гц, СН2S), 7.26 д (0.25Н, J = 6.5 Гц, HC=N),
альдоз 3а-и. Раствор 1.62 г (10 ммоль) гидрази-
10.83 уш. с (0.25Н, NHCO); форма E,Z′-А (25%),
да 6-меркаптогексановой кислоты и 10 ммоль
1.09 д (0.75Н, J = 7.0 Гц, СН3), 1.33 м (0.5Н, СН2),
соответствующего моно- или дисахарида в 30 мл
1.52 м (1Н, 2СН2), 2.01 м (0.5Н, СН2), 2.46 к (0.5Н,
МеOH (для соединений 3з, и в смеси 25 мл МеOH
J = 7.0 Гц, СН2S), 7.39 д (0.25Н, J = 6.5 Гц, HC=N),
и 5 мл Н2О) кипятили в течение 3 ч. После охлаж-
11.00 уш. с (0.25Н, NHCO); форма α-Б (30%), 1.13
дения белую кристаллическую массу отфильтро-
д (0.9Н, J = 7.0 Гц, СН3), 1.33 м (0.6Н, СН2), 1.52
вывали, сушили в вакууме и хранили в эксикаторе
м (1.2Н, 2СН2), 2.01 м (0.6Н, СН2), 2.46 к (0.6Н,
над Р2О5.
J = 7.0 Гц, СН2S), 5.11 д (0.3Н, J = 5.0 Гц, Н1),
6-Меркаптогексаноилгидразон
L-фукозы
9.23 уш. с (0.3Н, NHCO); форма β-Б (20%), 1.13 д
(3а). Выход 85%, т. пл. 183-185°С. Спектр ЯМР
(0.6Н, J = 7.0 Гц, СН3), 1.33 м (0.4Н, СН2), 1.52 м
1Н (ДMСO-d6), δ, м. д.: форма E,E′-А (15%), 1.08 д
(0.8Н, 2СН2), 2.01 м (0.4Н, СН2), 2.46 к (0.4Н, J =
(0.45Н, J = 7.0 Гц, СН3), 1.32 м (0.3Н, СН2), 1.50 м
7.0 Гц, СН2S), 3.98 д (0.2Н, J = 8.5 Гц, Н1), 9.14
(0.3Н, СН2), 1.59 м (0.3Н, СН2), 2.05 м (0.3Н, СН2),
уш. с (0.2Н, NHCO). Спектр ЯМР 13С (ДMСO-d6),
2.67 т (0.3Н, J = 6.0 Гц, СН2S), 7.35 д (0.15Н, J =
δС, м. д.: форма E,E′-А, 18.16 (СН3), 23.81 (СН2),
5.5 Гц, HC=N), 10.82 уш. с (0.15Н, NHCO); форма
24.57 (СН2), 27.25 (СН2), 27.50 (СН2), 34.02 (СН2),
E,Z′-А (15%), 1.08 д (0.45Н, J = 7.0 Гц, СН3), 1.32 м
68.25 (C5), 70.68 (С3), 71.82 (С2), 73.38 (С4), 148.52
(0.3Н, СН2), 1.50 м (0.3Н, СН2), 1.59 м (0.3Н, СН2),
(С=N), 174.06 (C=O); форма E,Z′-А, 18.16 (СН3),
2.05 м (0.3Н, СН2), 2.67 т (0.3Н, J = 6.0 Гц, СН2S),
23.81 (СН2), 24.57 (СН2), 27.25 (СН2), 27.50 (СН2),
7.48 д (0.15Н, J = 5.5 Гц, HC=N), 10.98 уш. с (0.15Н,
34.02 (СН2), 68.25 (C5), 70.64 (С3), 72.70 (С2), 73.42
NHCO); форма α-Б (20%), 1.12 д (0.6Н, J = 7.0 Гц,
(С4), 151.19 (С=N), 168.43 (C=O); форма α-Б, 20.91
СН3), 1.32 м (0.4Н, СН2), 1.50 м (0.4Н, СН2), 1.59
(СН3), 23.70 (СН2), 24.81 (СН2), 27.34 (СН2), 27.65
м (0.4Н, СН2), 2.05 м (0.4Н, СН2), 2.67 т (0.4Н, J =
(СН2), 33.21 (СН2), 66.28 (C5), 69.39 (C3), 70.73
6.0 Гц, СН2S), 4.92 д (0.2Н, J = 4.0 Гц, Н1), 9.25 уш.
(C2), 71.15 (С4), 89.03 (С1), 169.80 (C=O); форма
с (0.2Н, NHCO); форма β-Б (50%), 1.12 д (1.5Н, J =
β-Б, 20.91 (СН3), 23.70 (СН2), 24.81 (СН2), 27.34
7.0 Гц, СН3), 1.32 м (1Н, СН2), 1.50 м (1Н, СН2),
(СН2), 27.65 (СН2), 33.21 (СН2), 66.32 (C5), 72.19
1.59 м (1Н, СН2), 2.05 м (1Н, СН2), 2.67 т (1Н, J =
(С4), 73.17 (С2), 74.10 (С3), 87.95 (С1), 171.47 (C=O).
6.0 Гц, СН2S), 3.66 д (0.5Н, J = 8.5 Гц, Н1), 9.41 уш.
Найдено, %: С 46.79, H 7.79, N 9.02. C12H24N2O5S.
с (0.5Н, NHCO). Спектр ЯМР 13С (ДMСO-d6), δС,
Вычислено, %: С 46.74, H 7.84, N 9.08.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 10 2020
СИНТЕЗ 6-МЕРКАПТОГЕКСАНОИЛГИДР
АЗОНОВ МОНО- И ДИСАХАРИДОВ
1537
6-Меркаптогексаноилгидразон D-маннозы
ЯМР 13С (ДMСO-d6), δС, м. д.: форма E,E′-А, 23.82
(3в). Выход 75%, т. пл. 125-127°С. Спектр ЯМР
(СН2), 27.49 (СН2), 27.65 (СН2), 31.77 (СН2), 34.05
1Н (ДМСО-d6), δ, м. д.: форма E,E-А (35%), 1.33
(СН2), 60.57 (C6), 68.34 (С4), 69.18 (С2), 69.87 (С3),
м (0.7Н, СН2), 1.51 м (1.4Н, 2СН2), 2.14 м (0.7Н,
70.70 (С5), 148.94 (С=N), 174.14 (C=O); форма
СН2), 2.46 т (0.7Н, J = 7.0 Гц, СН2S), 7.26 д (0.35Н,
E,Z′-А, 23.82 (СН2), 27.49 (СН2), 27.65 (СН2), 31.77
J = 5.0 Гц, HC=N), 10.83 уш. с (0.35Н, NHCO); фор-
(СН2), 34.05 (СН2), 60.57 (C6), 68.23 (С4), 69.12
ма E,Z′-А (30%), 1.33 м (0.6Н, СН2), 1.51 м (1.2Н,
(С2), 69.90 (С3), 70.70 (С5), 151.87 (С=N), 168.52
2СН2), 2.14 м (0.6Н, СН2), 2.46 т (0.6Н, J = 7.0 Гц,
(C=O); форма α-Б, 23.72 (СН2), 24.61 (СН2), 25.10
СН2S), 7.39 д (0.3Н, J = 4.5 Гц, HC=N), 11.00 уш.
(СН2), 28.60 (СН2), 33.34 (СН2), 63.03 (C6), 69.59
с (0.3Н, NHCO); форма α-Б (15%), 1.33 м (0.3Н,
(С2), 70.43 (С3), 70.71 (С4), 72.26 (С5), 88.64 (С1),
СН2), 1.51 м (0.6Н, 2СН2), 2.14 м (0.3Н, СН2), 2.46
171.14 (C=O); форма β-Б, 23.81 (СН2), 24.82 (СН2),
т (0.3Н, J = 7.0 Гц, СН2S), 4.92 д (0.35Н, J = 4.0 Гц,
27.45 (СН2), 28.45 (СН2), 33.23 (СН2), 63.19 (C6),
Н1), 9.15 уш. с (0.15Н, NHCO); форма β-Б (20%),
70.24 (С4), 72.41 (С2), 73.51 (С3), 76.74 (С5), 91.75
1.33 м (0.4Н, СН2), 1.51 м (0.8Н, 2СН2), 2.14 м
(С1), 172.40 (C=O). Найдено, %: С 44.40, Н 7.53, N
(0.4Н, СН2), 2.46 т (0.4Н, J = 7.0 Гц, СН2S), 3.94
8.60. C12H24N2O6S. Вычислено, %: C 44.43, H 7.46,
д (0.2Н, J = 8.5 Гц, Н1), 9.07 уш. с (0.2Н, NHCO).
N 8.64.
Спектр ЯМР 13С (ДМСО-d6), δС, м. д.: форма E,E-А,
6-Меркаптогексаноилгидразон D-глюкозы
23.82 (СН2), 24.85 (СН2), 27.53 (СН2), 27.69 (СН2),
(3д). Выход 75%, т. пл. 88-92°С. Спектр ЯМР 1Н
32.24 (СН2), 63.93 (C6), 69.46 (С4), 70.42 (С2), 70.80
(ДМСО-d6), δ, м. д.: форма α-Б (25%), 1.31 м (0.5Н,
(С3), 71.25 (С5), 148.59 (С=N), 174.12 (C=O); форма
СН2), 1.50 м (0.5Н, СН2), 2.06 м (0.5Н, СН2), 2.44 к
E,Z′-А, 23.81 (СН2), 24.60 (СН2), 27.53 (СН2), 27.69
(0.5Н, J = 7.5 Гц, СН2S), 4.28 д (0.25Н, J = 4.5 Гц,
(СН2), 33.55 (СН2), 63.93 (C6), 69.50 (С4), 70.47
H1), 9.29 уш. с (0.25Н, NHCO); форма β-Б (75%),
(С2), 70.87 (С3), 71.30 (С5), 151.26 (С=N), 168.50
1.31 м (1.5Н, СН2), 1.50 м (1.5Н, СН2), 2.06 м (1.5Н,
(C=O); форма α-Б, 23.72 (СН2), 24.97 (СН2), 27.49
СН2), 2.44 к (1.5Н, J = 7.5 Гц, СН2S), 3.71 д (0.75Н,
(СН2), 28.47 (СН2), 33.62 (СН2), 61.42 (C6), 67.99
J = 8.5 Гц, Н1), 9.35 уш. с (0.75Н, NHCO). Спектр
(С4), 69.12 (С3), 70.04 (С2), 73.65 (С5), 88.07 (С1),
ЯМР 13С (ДMСO-d6), δС, м. д.: форма α-Б, 23.86
170.33 (C=O), форма β-Б, 23.72 (СН2), 24.82 (СН2),
(CH2), 24.94 (CH2), 27.47 (CH2), 28.46 (CH2), 33.39
27.58 (СН2), 28.47 (СН2), 33.42 (СН2), 62.12 (C6),
(CH2), 60.95 (C6), 70.17 (C4), 71.93 (C2), 73.64 (C3),
67.70 (С4), 71.40 (С2), 74.29 (С3), 78.26 (С5), 89.00
77.59 (C5), 88.25 (C1), 170.60 (C=O); форма β-Б,
(С1), 170.33 (C=O). Найдено, %: С 44.36, Н 7.51, N
23.82 (CH2), 24.78 (CH2), 27.41 (CH2), 28.41 (CH2),
8.58. C12H24N2O6S. Вычислено, %: C 44.43, H 7.46,
33.19 (CH2), 61.52 (C6), 70.49 (C4), 71.02 (C2), 76.66
N 8.64.
(C3), 78.22 (C5), 90.91 (C1), 172.29 (C=O). Найдено,
6-Меркаптогексаноилгидразон D-галактозы
%: С 44.49, Н 7.40, N 8.69. C12H24N2O6S. Вычисле-
(3г). Выход 70%, т. пл. 149-151°С. Спектр ЯМР
но, %: C 44.43, H 7.46, N 8.64.
1Н (ДМСО-d6), δ, м. д.: форма E,E-А (25%), 1.32 м
6-Меркаптогексаноилгидразон N-ацетил-
(0.5Н, СН2), 1.51 м (1Н, 2СН2), 2.06 м (0.5Н, СН2),
D-глюкозамина (3е). Выход 65%, т. пл. 211-213°С
2.45 к (0.5Н, J = 7.0 Гц, СН2S), 7.35 д (0.25Н, J =
(разл.). Спектр ЯМР 1Н (ДМСО-d6), δ, м. д.: форма
6.0 Гц, HC=N), 10.83 уш. с (0.25Н, NHCO); форма
α-Б (60%), 1.31 м (1.2Н, СН2), 1.50 м (2.4Н, 2СН2),
E,Z′-А (25%), 1.32 м (0.5Н, СН2), 1.51 м (1Н, 2СН2),
1.81 с (1.8H, CH3), 2.04 м (1.2Н, СН2), 2.47 к (1.2Н,
2.06 м (0.5Н, СН2), 2.45 к (0.5Н, J = 7.0 Гц, СН2S),
J = 6.5 Гц, СН2S), 4.29 д (0.6Н, J = 4.5 Гц, Н1), 9.33
7.49 д (0.25Н, J = 5.5 Гц, HC=N), 10.99 уш. с (0.25Н,
уш. с (0.6Н, NHCO); форма β-Б (40%): 1.31 м (0.8Н,
NHCO); форма α-Б (10%), 1.32 м (0.2Н, СН2), 1.51
СН2), 1.50 м (1.6Н, 2СН2), 1.86 с (1.2H, CH3), 2.04
м (0.4Н, 2СН2), 2.06 м (0.2Н, СН2), 2.45 к (0.1Н,
м (0.8Н, СН2), 2.47 к (0.8Н, J = 6.5 Гц, СН2S), 3.71
J = 7.0 Гц, СН2S), 4.42 д (0.1Н, J = 4.5 Гц, Н1),
д (0.4Н, J = 8.5 Гц, Н1), 9.27 уш. с (0.4Н, NHCO).
9.29 уш. с (0.1Н, NHCO); форма β-Б (40%), 1.32
Спектр ЯМР 13С (ДMСO-d6), δС, м. д.: форма α-Б,
м (0.8Н, СН2), 1.51 м (1.6Н, 2СН2), 2.06 м (0.8Н,
22.84 (CH3), 23.14 (CH2), 24.87 (CH2), 27.50 (CH2),
СН2), 2.45 к (0.8Н, J = 7.0 Гц, СН2S), 3.71 д (0.4Н,
28.45 (CH2), 33.22 (CH2), 54.45 (C2), 61.30 (C6),
J = 8.5 Гц, Н1), 9.39 уш. с (0.4Н, NHCO). Спектр
70.62 (C4), 71.31 (C5), 72.20 (C3), 90.75 (C1), 169.61
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 10 2020
1538
ЕРШОВ и др.
(C=O), 171.05 (C=O); форма β-Б, 23.01 (CH3), 23.22
м (1.4Н, СН2), 2.67 т (1.4Н, J = 7.0 Гц, СН2S), 3.78
(CH2), 24.92 (CH2), 27.43 (CH2), 28.62 (CH2), 33.37
д (0.7Н, J = 8.5 Гц, Н1), 5.11 уш. с (0.7Н, Н1′), 9.37
(CH2), 53.65 (C2), 61.49 (C6), 70.97 (C4), 74.51 (C5),
уш. с (0.7Н, NHCO). Спектр ЯМР 13С (ДMСO-d6),
77.62 (C3), 92.24 (C1), 169.90 (C=O), 170.62 (C=O).
δС, м. д.: форма α-Б, 23.91 (CH2), 24.78 (CH2), 27.42
Найдено, %: С 45.96, H 7.51, N 11.57. C14H27N3O6S.
(CH2), 28.47 (CH2), 33.41 (CH2), 60.97 (C6), 69.88
Вычислено, %: С 46.01, H 7.45, N 11.50.
(С6′), 69,94 (C4′), 70.73 (C2′), 71.51 (C3′), 72.02 (C5,
C5′), 74.66 (C2), 75.14 (C3), 80.84 (C4), 87.89 (C1),
6-Меркаптогексаноилгидразон N-ацетил-
D-маннозамина (3ж). Выход 60%, т. пл. 108-110°С
103.91 (C1′), 170.79 (C=O); форма β-Б, 23.84 (CH2),
(разл.). Спектр ЯМР 1Н (ДМСО-d6), δ, м. д.: форма
24.94 (CH2), 27.49 (CH2), 28.42 (CH2), 33.19 (CH2),
E,E′-А (20%), 1.32 м (0.4Н, СН2), 1.51 м (0.8Н,
60.54 (C6), 68.30 (C6′), 70.68 (C4′), 73.39 (C2′, C3′),
2СН2), 1.89 с (0.6H, CH3), 2.01 м (0.4Н, СН2), 2.45
74.89 (C5, C5′), 75.67 (C2), 76.17 (C3), 81.09 (C4),
т (0.4Н, J = 6.5 Гц, СН2S), 7.36 д (0.2Н, J = 4.5 Гц,
90.80 (C1), 103.97 (C1′), 172.19 (C=O). Найдено, %:
HC=N), 10.87 уш. с (0.2Н, NHCO); форма E,Z′-А
С 44.39, Н 6.97, N 5.82. C18H34N2O11S. Вычислено,
(20%), 1.32 м (0.4Н, СН2), 1.51 м (0.8Н, 2СН2), 1.89
%: С 44.44, H 7.04, N 5.76.
с (0.6H, CH3), 2.01 м (0.4Н, СН2), 2.45 т (0.4Н, J =
6-Меркаптогексаноилгидразон мальтозы
6.5 Гц, СН2S), 7.55 д (0.2Н, J = 4.5 Гц, HC=N), 11.05
(3и). Выход 75%, т. пл. 123-125°С. Спектр ЯМР 1Н
уш. с (0.2Н, NHCO); форма α-Б (15%), 1.32 м (0.3Н,
(ДМСО-d6), δ, м. д.: форма α-Б (20%), 1.32 м (0.4H,
СН2), 1.51 м (0.6Н, 2СН2), 1.84 с (0.45H, CH3), 2.01
СН2), 1.50 м (0.4Н, СН2), 1.60 м (0.4Н, СН2), 2.06 м
м (0.3Н, СН2), 2.45 т (0.3Н, J = 6.5 Гц, СН2S), 4.65
(0.4Н, СН2), 2.67 т (0.4Н, J = 7.0 Гц, СН2S), 4.29 д
д (0.15Н, J = 4.0 Гц, Н1), 9.21 уш. с (0.15Н, NHCO);
(0.2Н, J = 4.5 Гц, Н1), 4.99 (0.2Н, J = 3.5 Гц, Н1′), 9.29
форма β-Б (45%), 1.32 м (0.9Н, СН2), 1.51 м (1.8Н,
уш. с (0.2Н, NHCO); форма β-B (80%), 1.32 м (1.6H,
2СН2), 1.84 с (1.35H, CH3), 2.01 м (0.9Н, СН2), 2.45
СН2), 1.50 м (1.6Н, СН2), 1.60 м (1.6Н, СН2), 2.06
т (0.9Н, J = 6.5 Гц, СН2S), 3.78 д (0.45Н, J = 8.5 Гц,
м (1.6Н, СН2), 2.67 т (1.6Н, J = 7.0 Гц, СН2S), 3.76
Н1), 9.14 уш. с (0.45Н, NHCO). Спектр ЯМР 13С
д (0.8Н, J = 8.5 Гц, Н1), 4.90 уш. с (0.8Н, Н1′), 9.38
(ДMСO-d6), δC, м. д.: форма E,E′-А, 22.86 (СН3),
уш. с (0.8Н, NHCO). Спектр ЯМР 13С (ДMСO-d6),
23.18 (СН2), 24.92 (CH2), 27.63 (СН2), 28.61 (СН2),
δС, м. д.: форма α-Б, 23.91 (CH2), 25.10 (CH2), 27.64
34.02 (СН2), 51.72 (C2), 63.68 (С6), 71.20 (С4), 72.26
(CH2), 28.47 (CH2), 33.42 (CH2), 60.29 (C6), 70.11
(С3), 72.89 (С5), 145.61 (С=N), 168.38 (C=O), 174.17
(С6′), 70.74 (C4′), 72.57 (C2′), 72.75 (C3′), 73.39 (C5,
(C=O); форма E,Z′-А, 22.86 (СН3), 23.18 (СН2),
C5′), 73.54 (C2), 73.54 (C3), 79.96 (C4), 87.91 (C1),
24.92 (CH2), 27.63 (СН2), 28.61 (СН2), 34.02 (СН2),
101.01 (C1′), 172.29 (C=O); форма β-Б, 23.84 (CH2),
51.72 (C2), 63.68 (С6), 69.59 (С4), 72.26 (С3), 72.89
24.78 (CH2), 27.46 (CH2), 28.42 (CH2), 33.19 (CH2),
(С5), 149.06 (С=N), 168.60 (C=O), 170.61 (C=O);
61.04 (C6), 70.05 (C6′), 70.65 (C4′), 72.61 (C2′, C3′),
форма α-Б, 22.84 (СН3), 23.79 (СН2), 24.93 (СН2),
73.45 (C5, C5′), 73.63 (C2), 76.48 (C3), 81.25 (C4),
27.73 (СН2), 28.57 (СН2), 33.31 (СН2), 51.56 (C2),
90.88 (C1), 101.13 (C1′), 172.34 (C=O). Найдено, %:
61.42 (С6), 67.48 (С3), 71.21 (С4), 72.90 (С5), 87.82
С 44.50, Н 7.09, N 5.69. C18H34N2O11S. Вычислено,
(С1), 169.44 (C=O), 170.60 (C=O); форма β-Б, 22.84
%: С 44.44, H 7.04, N 5.76.
(СН3), 23.79 (СН2), 24.57 (СН2), 27.39 (2СН2), 33.46
КОНФЛИКТ ИНТЕРЕСОВ
(СН2), 52.54 (C2), 61.89 (С6), 69.60 (С3), 73.26 (С5),
78.78 (С4), 88.77 (С1), 169.46 (C=O), 170.85 (C=O).
Авторы заявляют об отсутствии конфликта
Найдено, %: С 46.08, H 7.39, N 11.47. C14H27N3O6S.
интересов.
Вычислено, %: С 46.01, H 7.45, N 11.50.
СПИСОК ЛИТЕРАТУРЫ
6-Меркаптогексаноилгидразон лактозы (3з).
1. Kang B., Opatz T., Landfester K., Wurm F.R. //
Выход 70%, т. пл. 139-141°С. Спектр ЯМР 1Н
Chem. Soc. Rev. 2015. Vol. 44. P. 8301. doi 10.1039/
(ДМСО-d6), δ, м. д.: форма α-Б (30%), 1.33 м (0.6H,
C5CS00092K
СН2), 1.50 м (0.6Н, СН2), 1.60 м (0.6Н, СН2), 2.06 м
2. Carbohydrate nanotechnology / Ed. K.J. Stine.
(0.6Н, СН2), 2.67 т (0.6Н, J = 7.0 Гц, СН2S), 4.28 д
New Jersey: John Wiley & Sons, 2016. 470 p. doi
(0.3Н, J = 4.5 Гц, Н1), 5.55 (0.3Н, J = 4.5 Гц, Н1′), 9.32
10.1002/9781118860 212.ch3
уш. с (0.3Н, NHCO); форма β-B (70%), 1.33 м (1.4H,
3. Glycochemical synthesis: strategies and applications /
СН2), 1.50 м (1.4Н, СН2), 1.60 м (1.4Н, СН2), 2.06
Eds S.-C. Hung, M.M.L. Zulueta. New Jersey: John
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 10 2020
СИНТЕЗ 6-МЕРКАПТОГЕКСАНОИЛГИДР
АЗОНОВ МОНО- И ДИСАХАРИДОВ
1539
Wiley & Sons, Inc., 2016, 576 p. doi 10.1002/978111
13. Jazayeri M.H., Amani H., Pourfatollah A.A., Avan A.,
9006435.ch16
Ferns G.A., Pazoki-Toroudi H. // Cancer Gene Therapy.
4. Engineered carbohydrate-based materials for biomedical
2016. Vol. 23. P. 365. doi 10.1038/cgt.2016.42
applications: polymers, surfaces, dendrimers,
14. Veerapandian M., Lim S.K., Nam H.M., Kuppannan G.,
Yun K.S. // Analyt. Bioanalyt. Chem. 2010. Vol. 398.
nanoparticles, and Hydrogels / Ed. R. Narain.
P. 867. doi 10.1007/ s00216-010-3964-5.virus
New Jersey: John Wiley & Sons, 2011. 424p. doi
15. Ершов А.Ю., Васильева М.Ю., Лагода И.В., Яки-
10.1002/9780470944349.ch6
манский А.В. // ЖОХ. 2018. Т. 88. Вып. 6. С. 1020;
5. Self-Assembled Monolayers of carbohydrate derivatives
Ershov A.Yu., Vasileva M.Yu., Lagoda I.V., Yakiman-
on gold surfaces. In: Carbohydrate / Eds M. Caliskan,
sky A.V. // Russ. J. Gen. Chem. 2018. Vol. 88. N 6.
I.H. Kavakli, G.C. Oz. Istanbul. InTech Publisher, 2017.
P. 1199. doi 10.1134/ S107036321 8060245
164p. doi 10.5772/66194
16. Ершов А.Ю., Васильева М.Ю., Левит М.Л., Лаго-
6. Nanobiomaterials in cancer therapy: applications of
да И.В., Байгильдин В.А., Шабсельс Б.М., Мар-
nanobiomaterials / Ed. A. Grumezescu. Oxford: Elsevier
тыненков А.А., Якиманский А.В. // ЖОХ. 2019.
Science Publishing Co Inc., 2016. 588 p. doi 10.1016 /
Т. 89. Вып. 2. С. 309; Ershov A.Y., Vasileva M.Y.,
B978-0-323-42863-7.00002-5
Levit M.L., Lagoda I.V., Baygildin V.A., Shabsels B.M.,
7. Федотчева Т.А., Оленин А.Ю., Старостин К.М.,
Martynenkov A.A., Yakimansky A.V. // Russ. J. Gen.
Лисичкин Г.В., Банин В.В., Шимановский Н.Л. //
Chem. 2019. Vol. 89. N 2. P. 300. doi 10.1134/S00444
Хим.-фарм. ж. 2015. Т. 49. № 4. С. 11; Fedotche-
60X19020215
va T.A., Olenin A.Yu., Starostin K.M., Lisichkin G.V.,
17. Васильева М.Ю., Ершов А.Ю., Байгильдин В.А., Ла-
Banin V.V., Shimanovskii N.L. // Pharm. Chem. J. 2015.
года И.В., Кулешова Л.Ю., Штро А.А., Зарубаев В.В.,
Vol.49. N 4. P. 220. doi 10.1007/ s110 94-015-1260-6
Якиманский А.В. // ЖОХ. 2018. Т. 88. Вып. 1.
8. Marin M.J., Schofield C.L., Field R.A., Russell D.A. //
С. 115; Vasileva M.Yu., Ershov A.Yu., Baygildin V.A.,
Analyst. 2015. Vol. 140. P. 59. doi 10.1039/
Lagoda I.V., Kuleshova L.Yu., Shtro A.A., Zarubaev V.V.,
Yakimansky A.V. // Russ. J. Gen. Chem. 2018. Vol. 88.
C4AN01466A
N 1. P. 109. doi 10.1134/S1070363218 010176
9. de la Fuente J.M., Penades S. // Biochim. Biophys.
18. Ershov A.Y., Martynenkov A.A., Lagoda I.V., Kopa-
Acta. 2006. Vol. 1760. N 4. P. 636. doi 10.1016/j.
nitsa M.A., Yakimansky A.V. // Chem. Select. 2019.
bbagen.2005. 12.001
Vol. 44. P. 12938. doi 10.1002/slct.201902942
10. Barrientos A.G., de la Fuente J.M., Rojas T.C.,
19. von Delius M., Geertsema E.M., Leigh D.A. // Nat.
Fernandez A., Penades S. // Chem. Eur. J. 2003. Vol. 9.
Chem. 2010. Vol. 2. N 2. P. 96. doi 10.1038/nchem.481
N 9. P. 1909. doi: 10. 1002/CHEM.200204544
20. Ершов А.Ю., Лагода И.В., Якимович С.И., Зеро-
11. Vetro M., Safari D., Fallarini S., Salsabila K., Lah-
ва И.В., Пакальнис В.В., Шаманин В.В. // ЖОрХ.
mann M., Penades S., Lay L., Marradi M., Compostel-
2009. Т. 45. Вып. 10. С. 1503; Ershov A.Yu., Lago-
la F. // Nanomedicine. 2017. Vol. 12. N 1. P. 13. doi
da I.V., Yakimovich S.I., Zerova I.V. Pakal’nis V.V.,
10.2217/nnm-2016-0306
Shamanin V.V. // Russ. J. Org. Chem. 2009. Vol. 45.
12. Bogart L.K., Pourroy G., Murphy C.J., Puntes V.,
N 10. P. 1488. doi 10.1134/S1070 42800910011X
Pellegrino T., Rosenblum D., Peer D., Lévy R. //
21. Sonawane S.J., Kalhapure R.S., Govender T. // Eur. J.
ACS Nano. 2014. Vol. 8. N 4. P. 3107. doi 10.1021/
Pharm. Sci. 2017. Vol. 99. N 1. P. 45. doi 10.1016/j.
nn500962q
ejps.2016.12.011
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 10 2020
1540
ЕРШОВ и др.
Synthesis of 6-Mercaptohexanoylhydrazones of Mono-
and Disaccharides as a Potential Glycoligands
of Noble Metal Glyconanoparticles
A. Yu. Еrshova,*, А. А. Маrtynenkova, I. V. Lagodab, and А. V. Yakimanskya,c
a Institute of Macromolecular Compounds of the Russian Academy of Sciences, St. Petersburg, 199004 Russia
b State Research Testing Institute of Military Medicine, Ministry of Defense of the Russian Federation,
St. Petersburg, 195043 Russia
c St. Petersburg State University, St. Petersburg, 199034 Russia
*e-mail: ershov305@mail.ru
Received June 22, 2020; revised June 22, 2020; accepted July 9, 2020
The 1H and 13C NMR spectroscopy was used to study the structure of previously unknown aldose series
condensation products (L-fucose, L-rhamnose, D-mannose, D-galactose, D-glucose, N-acetyl-D-glucosamine,
N-acetyl-D-mannosamine, D-lactose and D-maltose) with 6-mercaptohexanoic acid hydrazide - promising gly-
coligands of noble metal nanoparticles. It was shown that L-fucose, L-rhamnose, D-mannose, D-galactose and
N-acetyl-D-mannosamine derivatives exist in solution in DMSO-d6 as a tautomeric mixture of open hydrazone
and cyclic pyranose forms. The linear hydrazone form is represented by a set of Z′,E′-conformational isomers,
which differ in the arrangement of substituents relative to the C-N amide bond in comparable amounts. The
condensation products obtained on the basis of D-glucose, N-acetyl-D-glucosamine, D-lactose and D-maltose in
the crystalline state and in solutions in DMSO-d6 have an exclusively cyclic pyranose structure represented by
α,β-configurational isomers. A similar transition to the pyranose form is observed in solutions of all the studied
compounds in D2O.
Keywords: thiol-containing mono- and disaccharides, ring-chain tautomerism
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 10 2020