ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2020, том 90, № 10, с. 1541-1550
УДК 547.677.6:547.677.2:548.737
КВАНТОВО-ХИМИЧЕСКОЕ МОДЕЛИРОВАНИЕ
СТРОЕНИЯ КОМПЛЕКСОВ С ПЕРЕНОСОМ ЗАРЯДА
НИТРОПРОИЗВОДНЫХ 9,10-ФЕНАНТРЕНХИНОНА
С ФЕНАНТРЕНОМ. КРИСТАЛЛИЧЕСКАЯ И
МОЛЕКУЛЯРНАЯ СТРУКТУРА КОМПЛЕКСА
2,4,7-ТРИНИТРО-9,10-ФЕНАНТРЕНХИНОНА С
ФЕНАНТРЕНОМ (1:1)
© 2020 г. Р. В. Линкоa,*, М. А. Рябовa, П. В. Страшновa, Н. А. Полянскаяa, В. В. Давыдовa,
П. В. Дороватовскийb, В. Н. Хрусталевa,c
a Российский университет дружбы народов, ул. Миклухо-Маклая 6, Москва, 117198 Россия
b Национальный исследовательский центр «Курчатовский институт», Москва, 123182 Россия
c Институт органический химии имени Н. Д. Зелинского Российской академии наук, Москва, 119991 Россия
*e-mail: linko-rv@rudn.ru
Поступило в Редакцию 14 мая 2020 г.
После доработки 14 мая 2020 г.
Принято к печати 22 мая 2020 г.
На основании квантово-химических расчетов получены данные о строении и свойствах комплексов с
переносом заряда нитропроизводных 9,10-фенантренхинона (акцептор) с фенантреном (донор). Рас-
считаны энергии образования комплексов, средние расстояния между плоскостями донора и акцептора,
величины переноса заряда с донора на акцептор. Установлено, что 1,3,6-тринитро-9,10-фенантренхинон
является наиболее сильным акцептором в изученном ряду. Методом РСА определена кристалличе-
ская и молекулярная структура комплекса 1:1 2,4,7-тринитро-9,10-фенантренхинона с фенантреном
[C14H5N3O8·C14H10].
Ключевые слова: нитропроизводные 9,10-фенантренхинона, фенантрен, комплексы с переносом заряда,
квантово-химическое моделирование, рентгеноструктурный анализ
DOI: 10.31857/S0044460X20100091
Комплексы с переносом заряда (КПЗ) облада-
лярной орбитали (ВЗМО) донора [13, 14]. Кроме
ют широким спектром уникальных физических
того, на свойства КПЗ влияет стехиометрический
свойств. Они демонстрируют свойства изолятора
состав комплексов [15] и их полиморфная моди-
[1] и металла [2, 3], сверхпроводимость [4, 5] и фо-
фикация [16, 17].
топроводимость [6], ферромагнетизм [3, 7], анти-
Поиски новых эффективных акцепторов, по-
ферромагнетизм [8, 9] и сегнетоэлектричество [10,
лучение на их основе КПЗ с различными донора-
11], а также другие свойства [12].
ми и изучение их свойств по-прежнему остаются
Основным фактором, определяющим свойства
актуальными и перспективными. Достаточно ши-
КПЗ, является природа донора (Д) и акцептора
рокий ряд акцепторов π-электронов, содержащих
(А) π-электронов, и, в частности, разность энер-
разное число нитрогрупп, сформирован на основе
гий низшей свободной молекулярной орбитали
9,10-фенантренхинона, однако изучению КПЗ на
(НСМО) акцептора и высшей занятой молеку-
их основе посвящена только одна работа [18].
1541
1542
ЛИНКО и др.
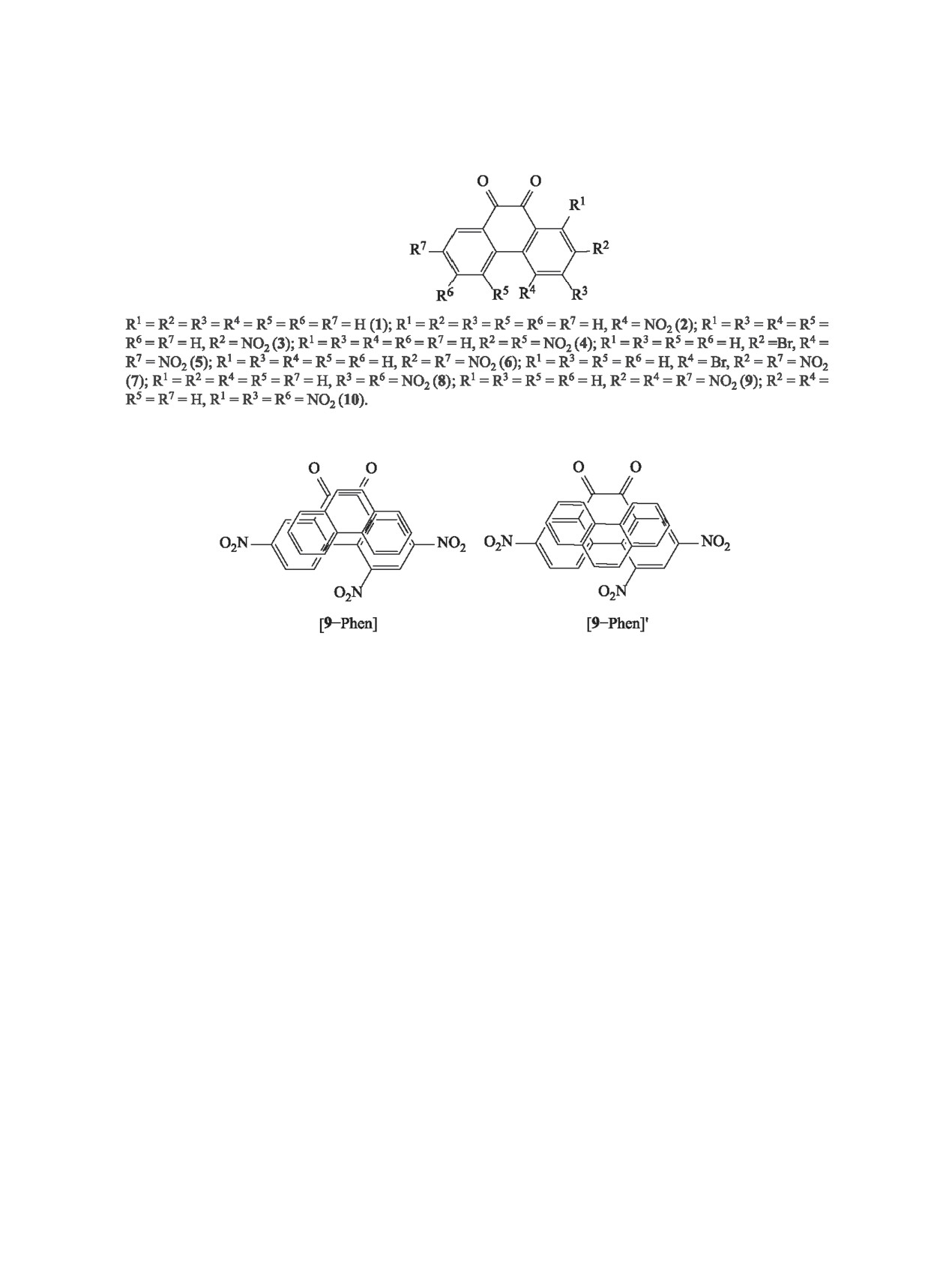
Схема 1.
Схема 2.
Целью настоящего исследования являлось
растают от -55.0 и -58.5 кДж/моль для комплек-
получение и изучение строения и свойств КПЗ
сов [1-Phen] и [1-Phen]′ до -92.9 и -89.9 кДж/моль
нитропроизводных 9,10-фенантренхинона с фе-
для комплексов [10-Phen] и [10-Phen]′ соответ-
нантреном (Phen). Для достижения поставленной
ственно (табл. 1). Следует обратить внимание на
цели в качестве акцепторов изучены 9,10-фенан-
тот факт, что значения ΔЕf отличаются также и
тренхинон 1 и его производные 2-10, содержащие
для комплексов различных типов [А-Phen] и [А-
от одной до трех нитрогрупп, а также атом брома
Phen]′, что подтверждает обоснованность рассмо-
(схема 1).
трения таких моделей. Одновременно с ростом ΔЕf
При образовании КПЗ с участием нитропроиз-
в рассматриваемом ряду наблюдается уменьшение
водных 9,10-фенантренхинона и фенантрена воз-
средних расстояний (R) между плоскостями А и Д
можны разные варианты взаимного расположения
в КПЗ от 3.33 и 3.29 Å для комплексов [1-Phen]
молекул Phen над молекулами акцепторов 1-10, а
и [1-Phen]′ до 3.15 и 3.14 Å для комплексов [10-
именно конгруэнтное (тип «кольцо над кольцом»,
Phen] и [10-Phen]′ (табл. 1).
[А-Phen]) и инконгруэнтное (тип «кольцо над свя-
Свойства КПЗ в значительной степени зави-
зью», [А-Phen]′), показанные на схеме 2. Поэтому
сят от энергий ВЗМО доноров (ЕДВЗМО) и энергий
квантово-химический расчет выполняли для ка-
НСМО акцепторов (ЕАНСМО). Рассчитанное значе-
ждой из двадцати возможных моделей КПЗ (табл. 1).
ние ЕДВЗМО равно -5.98 эВ, а значения ЕAНСМО ак-
Выполненные в рамках приближения теории
цепторов 1-10 понижаются от -3.16 до -4.57 эВ
функционала плотности квантово-химические
(табл. 1). Такое изменение ЕAНСМО свидетельствует
расчеты позволили получить данные, содержащие
о росте акцепторных свойств в ряду соединений
электронные и энергетические характеристики для
1-10 и, как следствие, разность энергий ЕAНСМО
молекул донора, акцепторов 1-10 и КПЗ (табл. 1).
и ЕДВЗМО изолированных акцепторов и доноров
Энергии образования КПЗ (ΔЕf) существенно воз-
(ΔЕМО) уменьшается от 2.82 до 1.41 эВ.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 10 2020
КВАНТОВО-ХИМИЧЕСКОЕ МОДЕЛИРОВАНИЕ
1543
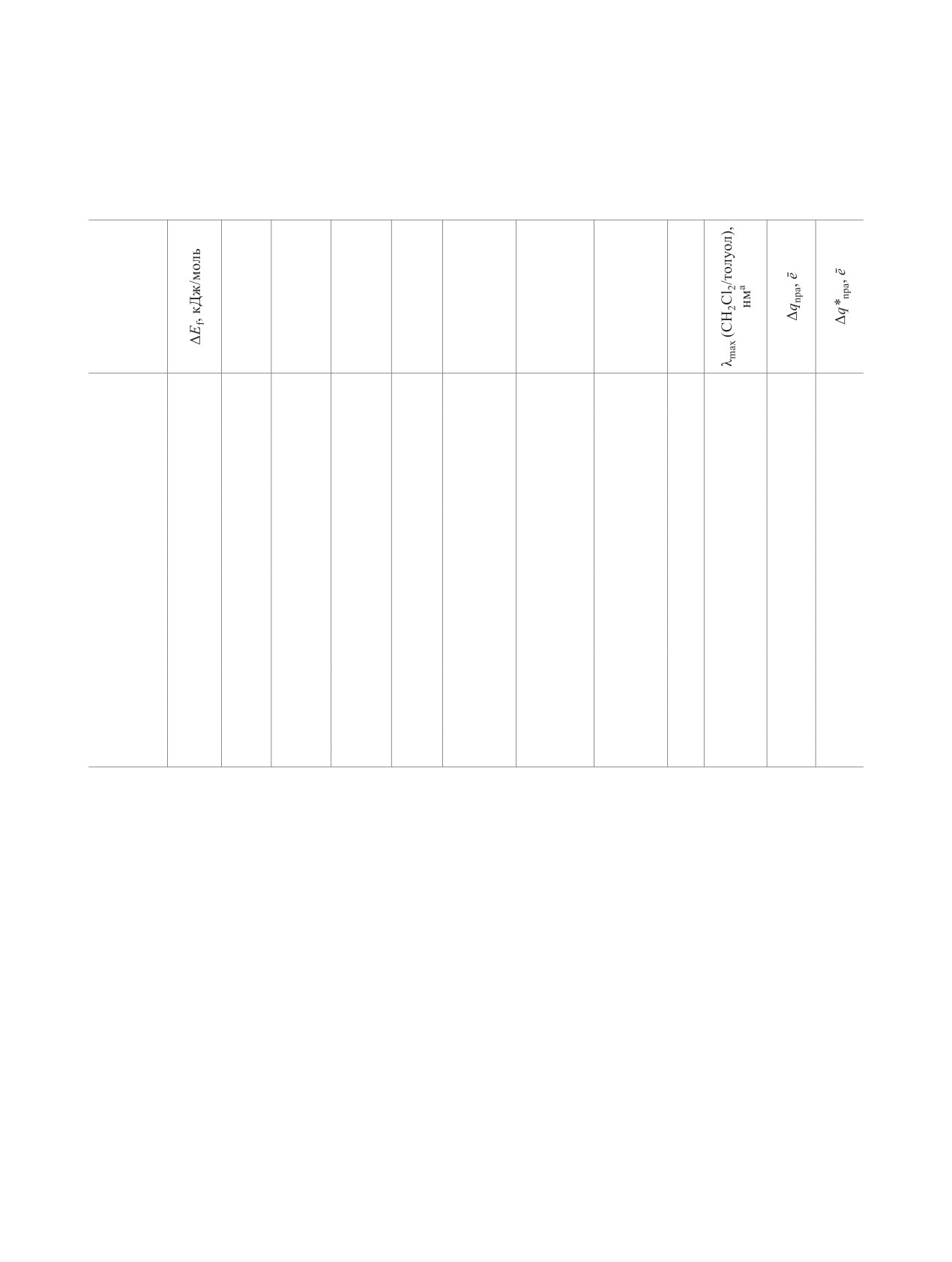
Таблица 1. Результаты расчетов методом DFT энергий образования КПЗ, средних межплоскостных расстояний,
энергий НСМО и ВЗМО акцептора, разностей энергий НСМО акцептора и ВЗМО донора, энергий НСМО и ВЗМО
в комплексе и их разностей, длин волн поглощения, величин переноса заряда в основном (Δqnра) и в первом возбуж-
денном состоянии (Δq*nрa)
ЕАВЗМО,
ЕАНСМО,
ΔЕМО,
ЕКПЗВЗМО,
ЕКПЗНСМО,
ΔЕКПЗМО,
λ,
КПЗ
R, Å
эВ
эВ
эВ
эВ
эВ
эВ
нм
[1-Phen]
-55.0
3.33
-6.79
-3.16
2.82
-5.98
-2.97
3.01
412
-
0.016
0.003
[1-Phen]′
-58.5
3.29
-6.00
-2.97
3.03
408
0.017
0.048
[2-Phen]
-65.9
3.32
-7.13
-3.51
2.47
-6.25
-3.28
2.96
418
-
0.039
0.031
[2-Phen]′
-65.6
3.27
-6.14
-3.29
2.85
434
0.035
0.173
[3-Phen]
-68.9
3.28
-7.23
-3.67
2.31
-6.20
-3.43
2.77
447
427/-
0.022
0.929
[3-Phen]′
-72.1
3.24
-6.24
-3.44
2.80
442
0.028
0.830
[4-Phen]
-78.6
3.22
-7.59
-4.04
1.94
-6.43
-3.71
2.72
456
446/-
0.046
0.925
[4-Phen]′
-79.3
3.25
-6.37
-3.77
2.60
476
0.036
0.948
[5-Phen]
-83.4
3.22
-7.65
-4.11
1.87
-6.50
-3.83
2.67
464
446/469
0.048
0.930
[5-Phen]′
-83.6
3.22
-6.44
-3.90
2.54
488
0.036
0.954
[6-Phen]
-79.2
3.18
-7.64
-4.15
1.83
-6.55
-3.84
2.71
457
-/448
0.050
0.923
[6-Phen]′
-80.2
3.19
-6.47
-3.89
2.57
481
0.033
0.954
[7-Phen]
-83.7
3.22
-7.68
-4.20
1.78
-6.54
-3.93
2.60
476
442/463
0.050
0.923
[7-Phen]′
-81.8
3.21
-6.50
-4.00
2.50
495
0.040
0.960
[8-Phen]
-82.5
3.15
-7.66
-4.25
1.73
-6.53
-3.93
2.60
477
-/470
0.051
0.931
[8-Phen]′
-78.7
3.18
-6.46
-3.98
2.48
500
0.038
0.955
[9-Phen]
-88.0
3.23
-7.92
-4.47
1.51
-6.70
-4.14
2.56
485
470/472
0.063
0.939
[9-Phen]′
-86.9
3.21
-6.62
-4.22
2.39
517
0.045
0.962
[10-Phen]
-92.6
3.15
-7.94
-4.57
1.41
-6.65
-4.22
2.43
509
490/495
0.054
0.940
[10-Phen]′
-89.9
3.14
-6.47
-3.89
2.57
481
0.028
0.964
а В системе.
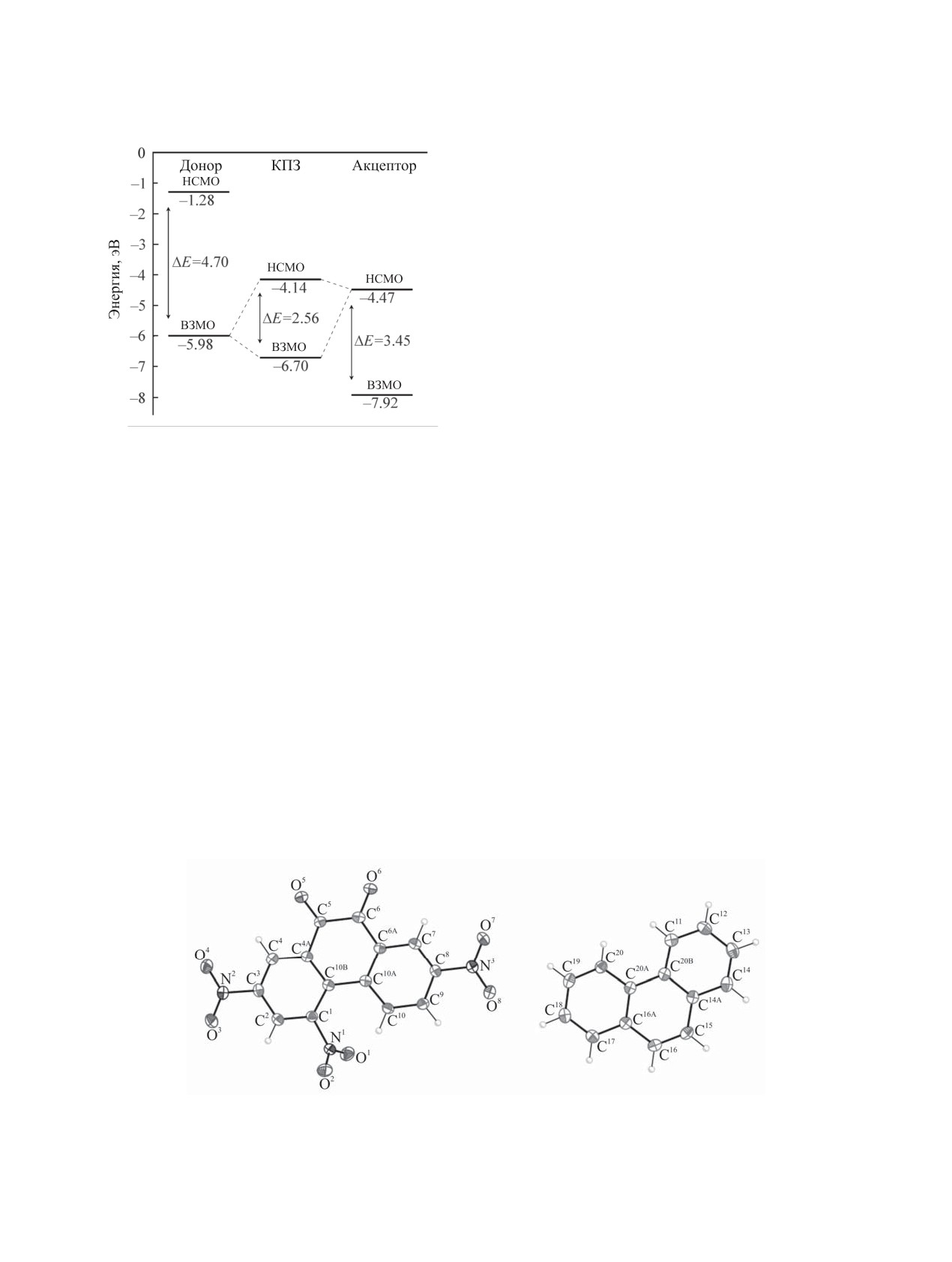
В составе КПЗ ВЗМО и НСМО остаются обра-
В электронном спектре КПЗ при его образо-
зованными преимущественно молекулярными ор-
вании появляется новая полоса поглощения, об-
биталями фрагментов донора и акцептора соответ-
условленная переносом электронной плотности
ственно. Однако их энергии (ЕКПЗВЗМО и ЕКПЗНСМО)
с ВЗМО донора на НСМО акцептора при погло-
претерпевают изменения: значения ЕКПЗВЗМО ле-
щении кванта света [13]. Эту полосу называют
жат ниже значений ЕДВЗМО (-5.98 эВ), а значения
полосой переноса заряда, а ее появление считает-
ЕКПЗНСМО лежат выше соответствующих энергий
ся надежным подтверждением образования КПЗ.
ЕАНСМО в молекулах 1-10 (табл. 1, рис. 1). В ре-
Исходя из значений ΔЕКПЗМО для изучаемых КПЗ
зультате, разности значений ЕКПЗНСМО и ЕКПЗВЗМО
были рассчитаны длины волн (λ) электронных пе-
в комплексах (ΔЕКПЗМО) заметно больше (от 2.39
реходов, которые удовлетворительно согласуются
до 3.03 эВ), чем соответствующие ΔЕМО (от 1.41
с полученными экспериментально в электронных
до 2.82 эВ), однако они существенно меньше раз-
спектрах поглощения (ЭСП) значениями длин
ности энергий НСМО и ВЗМО в доноре (4.70 эВ)
волн (λmax) полос переноса заряда КПЗ в растворах
и в акцепторах 1-10 (от 3.37 до 3.61 эВ) (табл. 1,
в области 427-495 нм (табл. 1). Поскольку фенан-
рис. 1).
трен не имеет в видимой области полос поглоще-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 10 2020
1544
ЛИНКО и др.
орто-положениях к карбонильным группам, явля-
ются наиболее сильными акцепторами среди ди- и
три-замещенных нитропроизводных 9,10-фенан-
тренхинона. Следует отметить, что наличие атома
Br в молекулах 5 и 7 не изменяет существенным
образом их акцепторные свойства в сравнении с
молекулами 4 и 6 соответственно.
Величины переноса заряда с донора на акцеп-
тор в КПЗ в основном состоянии, вычисленные
как разность сумм зарядов на атомах акцептора
в составе КПЗ и в свободном состоянии (Δqnра),
весьма невелики и лежат в пределах от 0.016 до
0.054 ē (табл. 1).
При переходе КПЗ от основного состояния к
Рис. 1. Энергетические диаграммы донора Phen, ак-
первому возбужденному состоянию происходит
цептора 9 и образуемого ими комплекса [9-Phen] по
перенос электронной плотности с атомов донора
данным DFT.
на атомы акцептора (Δq*nра), и эта величина долж-
на быть близкой к одному электрону. Действитель-
ния, то вычитание из ЭСП КПЗ полос поглощения
но, для комплексов с акцепторами 3-10 значения
акцепторов 3-10 позволило получить собственно
Δq*nра лежат в пределах от 0.830 до 0.964 ē. Крайне
полосы переноса заряда комплексов.
малые значения Δq*nра и отсутствие полосы пере-
Смещение λmax полосы переноса заряда в длин-
носа заряда в ЭСП для комплексов с акцепторами
новолновую область свидетельствует о сближении
1 и 2 (табл. 1) не позволяют отнести эти комплексы
ЕКПЗНСМО и ЕКПЗВЗМО, а при постоянном доноре -
к комплексам с переносом заряда. Причина - ма-
об увеличении акцепторной способности в изучае-
лые акцепторные свойства молекул 1 и 2: в первой
мом ряду нитропроизводных 9,10-фенантренхино-
из них нитрогрупп вообще нет, а во второй нитро-
на. Полученные данные (ЕАНСМО, ΔЕКПЗМО и λmax,
группа в положении 4 выключена из сопряжения,
табл. 1) свидетельствуют о зависимости акцептор-
поскольку вследствие стерических препятствий
ной способности нитропроизводных 9,10-фенан-
она развернута относительно плоскости
9,10-
тренхинона 1-10 не только от числа нитрогрупп, но
фенантренхинона.
и их положения. Молекулы 8 (λmax = 470 нм в толу-
Из раствора, содержащего эквимолярные коли-
оле) и 10 (λmax = 495 нм в толуоле), содержащие со-
чества 2,4,7-тринитро-9,10-фенантренхинона 9 и
ответственно две или три группы NO2 в пара- или
фенантрена, получены монокристаллы соединения
ɚ
ɛ
Рис. 2. Строение молекул 9 и Phen в структуре комплекса 11 по данным РСА.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 10 2020
КВАНТОВО-ХИМИЧЕСКОЕ МОДЕЛИРОВАНИЕ
1545
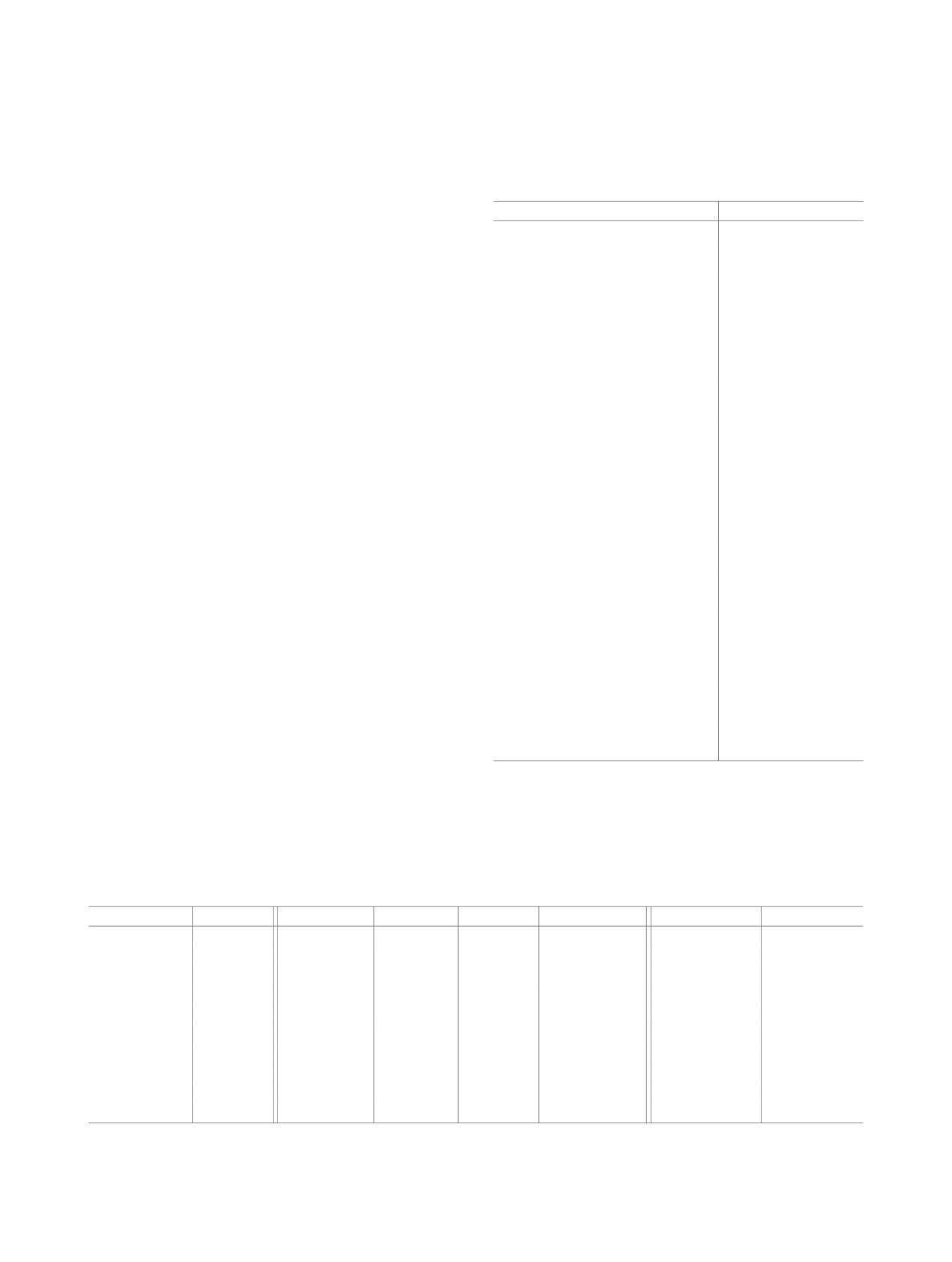
11 темно-красного цвета в форме призм. Кристал-
Таблица
2. Кристаллографические характеристики,
лическая и молекулярная структура соединения 11
данные эксперимента и уточнения структуры комплекса
11
определена методом рентгеноструктурного анали-
за. Кристаллы относятся к моноклинной сингонии
Параметр
Значение
с пространственной группой C2/c (табл. 2). Дан-
Брутто-формула
C28H15N3O8
ные РСА подтверждают образование комплекса с
Сингония
Моноклинная
участием молекул 9 и фенантрена в соотношении
Пространственная группа
C2/c
Z 8
8
1:1 [C14H5N3O8·C14H10].
a, Å
38.761(8)
В структуре комплекса 11 основные геоме-
b, Å
8.5374(17)
трические характеристики молекулы 9 (табл. 3,
c, Å
13.874(3)
рис. 2) не отличаются существенным образом от
β, град
107.61(3)
аналогичных параметров в сольвате 9 с бензо-
V, Å3
4376.0(17)
лом 12 [19]. Длины связей С=О в комплексе 11
dвыч, г/см3
1.583
[1.211(2) и 1.216(2) Å] незначительно увеличены,
λ, Å
0.80246
хотя и остаются в рамках погрешности, относи-
μ, мм-1
0.156
тельно аналогичных величин в сольвате 12 [1.208(6) и
Т, K
100(2)
1.213(6) Å] [19]. В комплексе 11 связь С5-С6 1.526(2)
Tmin/Tmax
0.960/0.970
Å существенно длиннее стандартной одинарной
θmax, град
30.88
связи типа С(sp2)-С(sp2) 1.479 Å [20], что обуслов-
Пределы h, k, l
-49 ≤h ≤ 49,
лено несвязанными взаимодействиями атомов O в
-10 ≤ k ≤10,
o-хинонах и было обнаружено ранее в соединении
-17 ≤ l ≤ 17
12 (1.523(7) Å) [19]. Валентные углы при атомах С5
Число отражений
29432/4782
и С6 в молекуле комплекса 11 находятся в пределах
измеренных/независимых (N1)
наблюдаемых с I > 2σ(I) (N2)
4215
от 117.53(14) до 123.28(16)° и практически совпа-
дают с аналогичными величинами в соединении
Rint
0.067
12 [от 117.6(4) до 123.4(4)°] [19]. В комплексе 11
Число параметров
353
атомы O5 и O6 лежат практически в одной пло-
R1/wR2 по N1
0.0603/0.1448
скости - торсионный угол O5С5С6O6 составляет
R1/wR2 по N2
0.0539/0.1396
0.8(2)°, а в соединении 12 он равен 5.26° [19].
S
1.040
Параметры групп NO2 в комплексах 11 (табл. 3)
Δρmin/ Δρmax, е/Å3
-0.294/0.504
и 12 [19] отличаются незначительно и близки к
куле 11 равны от 123.93(15) до 125.10(16)° {в ком-
среднестатистическим величинам [21]: длины свя-
плексе 12 - от 122.9(5) до 125.0(4)° [19]}. В струк-
зей N-O в соединении 11 находятся в пределах от
1.217(2) до 1.230(2) Å {в комплексе 12 - от 1.201(7)
туре 11 углы поворота групп NO2 относительно
до 1.223(6) Å [19]}, валентные углы ONO в моле-
связанной с ней плоскости ароматического цикла
Таблица 3. Основные длины связей и валентные углы в молекуле комплекса 11 по данным РСА
Связь
d, Å
Связь
d, Å
Угол
ω, град
Угол
ω, град
O5-C5
1.211(2)
N3-C8
1.468(2)
O2N1O1
125.10(16)
N1C1C10B
123.41(15)
O6-C6
1.216(2)
C5-C6
1.526(2)
O2N1C1
117.29(15)
O5C5C4A
122.39(16)
O1-N1
1.221(2)
C10A-C10B
1.485(2)
O1N1C1
117.56(14))
O5C5C6
119.76(15)
O2-N1
1.219(2)
C11-C12
1.376(3))
O4N2O3
124.45(15)
C4AC5C6
117.84(14)
O3-N2
1.229(2)
C11-C20B
1.410(2)
O4N2C3
117.83(15)
C4C4AC5
115.12(15)
O4-N2
1.219(2)
C12-C13
1.402(3)
O3N2C3
117.71(15)
C1C10BC4A
114.41(15)
O7-N3
1.230(2)
C13-C14
1.371(3)
O7N3O8
123.93(15)
C1C10BC10A
125.22(15)
O8-N3
1.217(2)
C14A-C15
1.436(2)
O7N3C8
118.31(15)
C11C12C13
120.57(17)
N1-C1
1.483(2)
C15-C16
1.345(3)
O8N3C8
117.76(14)
C11C20ВC14А
117.94(16)
N2-C3
1.468(2)
C20A-C20B
1.452(2)
N1C1C2
112.65(14)
C11C20ВC20А
123.20(16)
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 10 2020
1546
ЛИНКО и др.
ɚ
ɛ
Ⱥ
Ⱦ
Ⱥ'
Ⱦ'
Ⱥ
Ⱦ
Рис. 3. Кристаллическая структура комплекса 11. (а) фрагмент стопки {···[А-Д]···[А-Д]···}∞ ≡ {···[Д-А]ʹ···[Д-А]ʹ···}∞;
(б) проекция на плоскость ab, демонстрирующая строение слоев.
при атомах С1, С3 и С8 равны 73.8(2), 1.35(15) и
щими величинами в свободной молекуле Phen [22]
0.95(15)° соответственно, что существенным об-
и в его КПЗ с 2,3,5,6-тетрахлор-1,4-дицианобензо-
разом отличает их от аналогичных значений в со-
лом [23].
единении 12 (59.7, 8.9, 15.7° [19]). Как и в струк-
Согласно данным РСА, в кристалле комплекса
туре 12, в комплексе 11 наибольший угол поворота
11 молекулы акцептора 9 и донора Phen распола-
имеет группа NO2 при атоме C1, испытывающая
гаются параллельно друг другу и образуют стопки
значительное стерическое отталкивание от атомов
вдоль кристаллографической оси c. Молекулы ак-
C10 и H10. Следует обратить внимание на удлине-
цептора и донора в стопках чередуются с попар-
ние связи C1-N1 1.483(2) Å относительно других
ным поворотом на 180° в собственных плоскостях.
связей C-N, равных 1.468(2) Å в молекуле 11, чего
В результате такого чередования молекул акцепто-
не наблюдалось в случае комплекса 12 [19].
ра и донора образуются тесные пары [А-Д] и [Д-
Молекула фенантрена в комплексе 11 имеет
А]′, которые и формируют в кристалле комплекса
длины связей С-С от 1.345(3) до 1.452(2) Å и ва-
11 стопки смешанного типа {···[А-Д]···[А-Д]···}∞
лентные углы в пределах 117.94(16)-123.20(16)°,
≡ {···[Д-А]′···[Д-А]′···}∞ (рис. 3а). Соседние стоп-
которые практически совпадают с соответствую-
ки в кристалле комплекса 11 располагаются таким
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 10 2020
КВАНТОВО-ХИМИЧЕСКОЕ МОДЕЛИРОВАНИЕ
1547
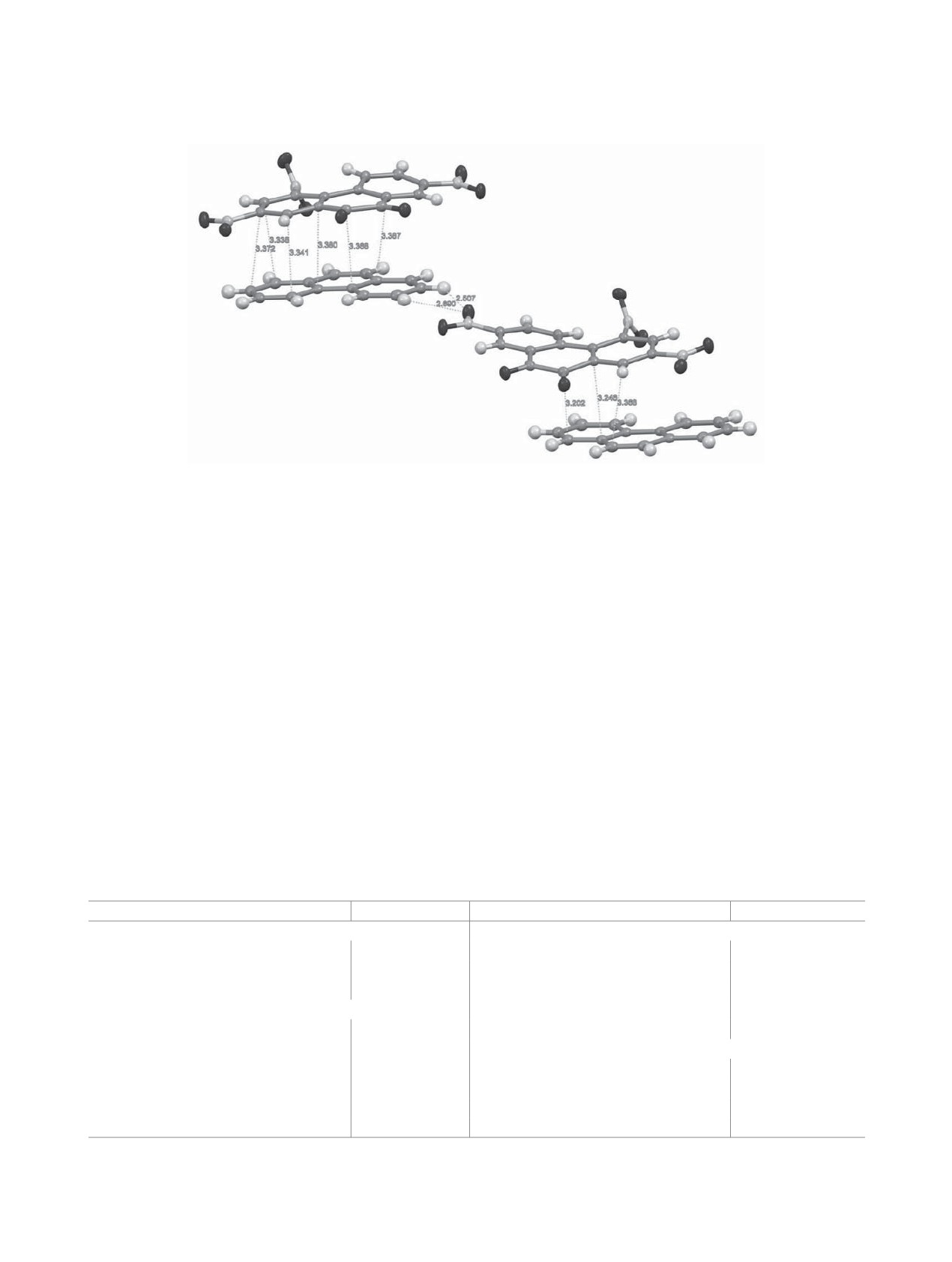
Рис. 4. Фрагмент кристаллической структуры комплекса 11 с указанием укороченных контактов (Å) по данным РСА.
образом, что молекулы акцептора и донора из со-
11, в отличие от соединения 12, можно объяснить
седних стопок формируют слои, которые могут
наблюдаемые изменения геометрических характе-
быть представлены либо чередующимися одно-
ристик молекулы 9 в комплексе 11 относительно
родными рядами -А-А-А- и -Д-Д-Д-, либо по-
комплекса 12 [19]. В комплексе 11 присутствуют
следовательными смешанными рядами А-Д-А-Д
укороченные контакты и между молекулами Phen,
(рис. 3б).
что наблюдалось и в КПЗ фенантрена с 1,4-дии-
од-2,3,5,6-тетрафторбензолом [24].
В комплексе 11 между молекулами соедине-
ния 9 и фенантрена в собственной стопке и между
Изучение КПЗ нитропроизводных
9,10-фе-
соседними стопками имеются укороченные кон-
нантренхинона с фенантреном с использованием
такты, которые меньше суммы ван-дер-ваальсо-
квантово-химических расчетов, электронной спек-
вых радиусов, типа [А-Д], [Д-А]′, А···Д и А···А
троскопии и рентгеноструктурного анализа позво-
(табл. 4, рис. 4). Наличие указанных укороченных
лило оценить акцепторную способность и степень
контактов предполагает значительное π-π-взаимо-
переноса заряда в КПЗ в зависимости от числа
действие между молекулами донора и акцептора.
и положения нитрогрупп в нитропроизводных
Общее число таких контактов для каждой моле-
9,10-фенантренхинона, а также получить данные
кулы 9 составляет 26. Наличием столь значитель-
о строении КПЗ в кристаллическом состоянии.
ного числа укороченных контактов в комплексе
Полученные данные свидетельствуют об увеличе-
Таблица 4. Некоторые укороченные контакты между молекулами соединения 9 и фенантрена в структуре комплекса
11 по данным РСА
Контакты (в одной стопке)
d, Å
Контакты (между стопками)
d, Å
[А-Д]
А···Д
С4···С16
3.368
О1···Н11-С11
2.653
С4А···С16А
3.246
О3···Н12-С12
2.538
С5···С17
3.202
О7···Н17-С17
2.457
[А-Д]′
О8···Н18-С18
2.507
С2···С14
3.338
О8···Н19-С19
2.690
С3···С13
3.372
А···А
С4···С11
3.341
О5···Н9-С9
2.515
С4А···С20В
3.380
О5···Н10-С10
2.468
С5···С20А
3.368
О6···Н9-С9
2.692
С6А···С16А
3.387
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 10 2020
1548
ЛИНКО и др.
нии акцепторной способности в ряду исследуемых
на прямым методом и уточнена полноматричным
производных 9,10-фенантренхинона.
методом наименьших квадратов в анизотропном
приближении для неводородных атомов с исполь-
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
зованием программ iMOSFLM [28], CCP4, SCALA
Нитропроизводные 9,10-фенантренхинона по-
[29], SHELXL [30]. Атомы водорода включены
лучены нитрованием 9,10-фенантренхинона (1, т.
в уточнение с фиксированными позиционными
пл. 208-209°С) или бромированием соответствую-
параметрами (модель наездника) и изотропны-
щих его динитропроизводных по описанным ме-
ми параметрами смещения Uизо(H) = 1.5Uэкв(О),
тодикам: 4-нитро-9,10-фенантренхинон 2 (т. пл.
1.2Uэкв(N) и
1.2Uэкв(C). Кристаллографические
177-179°С)
[25],
2-нитро-9,10-фенантренхинон
данные, параметры эксперимента и уточнения
3 (т. пл. 256-258°С) [25], 2,5-динитро-9,10-фе-
структуры соединения 11 приведены в табл. 2.
нантренхинон
4 (т. пл.
228-230°С)
[18,
25],
Полные данные РСА для комплекса 11 депониро-
2-бром-4,7-динитро-9,10-фенантренхинон 5 (т. пл.
ваны в Кембриджском банке структурных данных
253.5-254.5°С) [26], 2,7-динитро-9,10-фенантрен-
(CCDC 2001021).
хинон 6 (т. пл. 302-303°С) [18, 25], 4-бром-2,7-ди-
Квантово-химическое моделирование элек-
нитро-9,10-фенантренхинон
7
[т.
пл.
>
тронной структуры молекул донора, акцепторов
300°С (разл.)] [26], 3,6-динитро-9,10-фенантрен-
и КПЗ проводили в рамках приближения теории
хинон 8 (т. пл. 290-292°С) [18, 27], 2,4,7-трини-
функционала плотности с использованием ги-
тро-9,10-фенантренхинон 9 (т. пл. 213-214°С) [18,
бридного функционала B3LYP и базисного набора
25], 1,3,6-тринитро-9,10-фенантренхинон 10 (т. пл.
def2-SV(P). Коррекцию суперпозиции базисного
261-263°С) [27].
набора проводили методом Бойса-Бернарди [31].
Фенантрен квалификации Ч использовали без
Все расчеты выполняли с учетом дисперсионной
дополнительной очистки. Растворители (CH2Cl2 и
поправки Гримме D4 [32]. Величина переноса
толуол квалификации ХЧ) очищали по стандарт-
заряда с донора на акцептор была рассчитана с
ным методикам.
использованием анализа естественных заселен-
Для получения КПЗ в кристаллическом состо-
ностей (NPA) [33], как разность сумм зарядов на
янии смешивали растворы эквимолярных коли-
атомах акцептора в свободном состоянии и в со-
честв акцептора 9 (0.4 ммоль в 12 мл CH2Cl2) и
ставе комплекса в основном (Δqnра, ē) и первом
донора Phen (0.4 ммоль в 5 мл CH2Cl2). В результа-
возбужденном (Δq*nра, ē) состояниях. Рассчитаны
те медленного испарения растворителя получены
энергии образования КПЗ ΔЕf = ЕКПЗtot - ЕAtot -
монокристаллы комплекса 11, которые использо-
ЕДtot (кДж/моль), где ЕКПЗtot, ЕAtot и ЕДtot - соответ-
ваны для РСА.
ственно полные энергии КПЗ, акцептора и донора;
Электронные спектры поглощения растворов
средние расстояния (R, Å) между плоскостями ак-
КПЗ, приготовленных добавлением фенантрена
цептора и донора в КПЗ; энергии НСМО и ВЗМО
(10 мг/мл) к растворам акцепторов 1-10 в CH2Cl2
(ЕНСМО, ЕВЗМО, эВ) для донора, акцепторов и КПЗ;
и/или толуоле (с = 10-3 моль/л), регистрировали на
разности энергий НСМО акцептора и ВЗМО доно-
спектрометрах Specord M-40 или Varian Cary 50
ра (ΔЕМО, эВ) и разности энергий НСМО и ВЗМО
Scan в кварцевых кюветах толщиной 1.0 см в ин-
в комплексе (ΔЕКПЗМО, эВ); длины волн λ (нм),
тервале 400-900 нм с помещением в кювету срав-
соответствующие ΔЕКПЗМО. Все вычисления про-
нения раствора акцептора той же концентрации
водили с использованием средств программного
или вычитанием полос поглощения акцептора.
комплекса Firefly 8.20. [34].
Рентгеноструктурное исследование комплекса
ФОНДОВАЯ ПОДДЕРЖКА
11 выполнено в Национальном исследовательском
центре «Курчатовский институт». Параметры эле-
Работа выполнена при поддержке программы
ментарной ячейки и интенсивности отражений
Программы РУДН 5-100.
измерены на синхротронной станции БЕЛОК,
КОНФЛИКТ ИНТЕРЕСОВ
используя двухкоординатный детектор Rayonix
SX165 CCD (λ = 0.80246 Å, φ-сканирование с
Авторы заявляют об отсутствии конфликта
шагом 1.0°). Структура комплекса 11 определе-
интересов.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 10 2020
КВАНТОВО-ХИМИЧЕСКОЕ МОДЕЛИРОВАНИЕ
1549
СПИСОК ЛИТЕРАТУРЫ
19. Гридунова Г.В., Шкловер В.Е., Стручков Ю.Т.,
Сидоренко Е.Н., Андриевский А.М., Ежкова З.И.,
1. Dobrowolski M.A., Garbarino G., Mezouar M.,
Дюмаев К.М. // Изв. АН СССР. Сер. хим. 1986.
Ciesielski A., Cyrański M.K. // CrystEngComm. 2014.
№ 6. С. 1284; Gridunova G.V., Shklover V.E., Struch-
Vol. 16. P. 415. doi 10.1039/C3CE41703D
kov Yu.T., Sidorenko E.N., Andrievskii A.M., Ezhko-
2. Ferraris J., Cowan D.O., Walatka V., Perlstein J.H. // J.
va Z.I., Dyumaev K. M. // Bull. Acad. Sci. USSR. Div.
Am. Chem. Soc. 1973. Vol. 95. N 3. P. 948. doi 10.1021/
Chem. Sci. 1986. Vol. 35. N 6. P. 1163. doi 10.1007/
ja00784a066
BF00956588
3. Alves H., Molinari A.S., Xie H.X., Morpurgo A.F. // Nat.
20. Allen F.M., Kennard O., Watson D.G., Brammer L.,
Mater. 2008. Vol. 7. P. 574. doi 10.1038/nmat2205
Orpen A.G., Taylor R. // J. Chem. Soc., Perkin Trans. 2.
4. Coleman L.B., Cohen M.J., Sandman D.J., Yama-
1987. N 12. P. S1. doi 10.1039/P298700000S1
gishi F.G., Garito A.F., Heege A.J. // Solid State
21. Садова Н.И., Вилков Л.В. // Усп. хим. 1982. Т. 51.
Commun. 1973. Vol. 12. N 11. P. 1125. doi
№ 1. С.153; Sadova N.I., Vilkov L.V. // Russ.
10.1016/0038-1098(73)90127-0
5. Wosnitza J. // J. Low Temp. Phys. 2007. Vol. 146.
Chem. Rev. 1982. Vol. 51. N 1. P. 87. doi 10.1070/
P. 641. doi 10.1007/s10909-006-9282-9
RC1982v051n01ABEH002800
6. Yu W., Wang X.-Y., Li J., Li Z.-T., Yan Y.-K., Wang W.,
22. Fabbiani F.P.A., Allan D.R., David W.I.F., Mog-
Pei J. // Chem. Commun. 2013. Vol. 49. N 1. P. 54. doi
gach S.A., Parsons S., Pulham C.R. // CrystEngComm.
10.1039/c2cc37655e
2004. Vol. 6. N 82. P. 505. doi 10.1039/b406631f
7. Korshak Yu.V., Medvedeva T.V., Ovchinnikov A.A.,
23. Britton D. // Acta Crystallogr. (C). 2005. Vol. 61.
Spector V.N. // Nature. 1987. Vol. 326. P. 370. doi
P. o662. doi 10.1107/S0108270105032002
10.1038/326370a0
24. Shen Q.J., Pang X., Zhao X.R., Gao H.Y., Sun H.-L.,
8. Singleton J. // J. Solid State Chem. 2002. Vol. 168. N 2.
Jin W.J. // CrystEngComm. 2012. Vol. 14. N 15. P. 5027.
P. 675. doi 10.1006/jssc.2002.9766
doi 10.1039/c2ce25338k
9. Radvakova A., Kazheva O.N., Chekhlov A.N.,
25. Kato S., Maezawa M., Hirano S., Ishigaku S. //
Dyachenko O.A., Kucmin M., Kajnakova M., Feher A.,
Yuki Gosei Kagaku Kyokai Shi. 1957. Vol. 15.
Starodub V.A. // J. Phys. Chem. Solids. 2010. Vol. 71.
N 1. P. 29; C. A. 1958. Vol. 51. P. 10462. doi 10.5059/
N 5. P. 752. doi 10.1016/j.jpcs.2010.01.012
yukigoseikyokaishi.15.29
10. Horiuchi S., Tokura Y. // Nat. Mater. 2008. Vol. 7. P. 357.
26. Андриевский А.М., Горелик М.В., Линко Р.В., Гра-
doi 10.1038/nmat2137
чев М.К. // ЖОрХ. 2013. Т. 49. № 10. С. 1496;
11. Narayanan A., Cao D., Frazer L., Tayi A.S., Black-
Andrievskii A.M., Gorelik M.V., Linko R.V., Gra-
burn A.K., Sue A.C.H., Ketterson J.B., Stoddart J.F.,
chev M.K. // Russ. J. Org. Chem. 2013. Vol. 49. N 10.
Stupp S.I. // J. Am. Chem. Soc. 2017. Vol. 139. N 27.
P. 1474. doi 10.1134/S1070428013100126
P. 9186. doi 10.1021/jacs.7b02279
27. Андриевский А.М., Линко Р.В., Грачев М.К. // ЖОрХ.
12. Стародуб В.А., Стародуб Т.Н. // Усп. хим. 2014.
2013. Т. 49. № 7. С. 1041; Andrievskii A.M., Linko R.V.,
Т. 83. Вып. 5. С. 391; Starodub V.A., Starodub T.N. //
Grachev M.K. // Russ. J. Org. Chem. 2013. Vol. 49. N 7.
Russ. Chem. Rev. 2014. Vol. 83. N 5. P. 391. doi
P. 1025. doi 10.1134/S1070428013070117
10.1070/RC2014v083n05ABEH004299
28. Battye T.G.G., Kontogiannis L., Johnson O., Po-
13. Mulliken R.S., Person W.B. Molecular Complexes.
well H.R., Leslie A.G.W. // Acta Crystallogr. (D). 2011.
New York: Wiley-Interscience, 1969. 498 p. doi
Vol. 67. P. 271. doi 10.1107/S0907444910048675
10.1016/0022-2860(71)87071-0
29. Evans P. // Acta Crystallogr. (D). 2006. Vol. 62. P. 72.
14. Hu P., Du K., Wei F., Jiang H., Kloc C. // Cryst. Growth
doi 10.1107/S0907444905036693
Des. 2016. Vol. 16. N 5. P. 3019. doi 10.1021/acs.
30. Sheldrick G.M. // Acta Crystallogr. (C). 2015. Vol. 71.
cgd.5b01675
P. 3. doi 10.1107/S2053229614024218
15. Singh M., Chopra D. // Cryst. Growth Des. 2018.
31. Boys S.F., Bernardi F. // Mol. Phys. 1970. Vol. 19. N 4.
Vol. 18. N 11. P. 6670. doi 10.1021/acs.cgd.8b00918
P. 553. doi 10.1080/00268977000101561
16. Averkiev B., Isaac R., Jucov E.V., Khrustalev V.N.,
Kloc C., McNeil L.E., Timofeeva T.V. // Cryst. Growth
32. Caldeweyher E., Bannwarth C., Grimme S. // J.
Chem. Phys. 2017. Vol. 147. N 3. P. 034112. doi
Des. 2018. Vol. 18. N 7. P. 4095. doi 10.1021/acs.
cgd.8b00501
10.1063/1.4993215
17. Henderson J., Masino M., Hatcher L.E., Kociok-
33. Glendening E.D., Badenhoop J.K., Reed A.E., Car-
Köhn G., Salzillo T., Brillante A., Raithby P.R., Girlan-
penter J.E., Bohmann J.A., Morales C.M., Weinhold F.
do A., Da Como E. // Cryst. Growth Des. 2018. Vol. 18.
NBO 5.G. Theoretical Chemistry Institute, University
N 4. P. 2003. doi 10.1021/acs.cgd.7b01391
of Wisconsin: Madison, WI, 2004.
18. Mukherjee T.K. // J. Phys. Chem. 1967. Vol. 71. N 7.
P. 2277. doi 10.1021/j100866a048
msu.su/gran/firefly/index.html
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 10 2020
1550
ЛИНКО и др.
Quantum-Chemical Modeling of The Structure
of Charge-Transfer Complexes of Nitro-Derivatives
of 9,10-Phenanthrenequinone with Phenanthrene.
Crystal and Molecular Structure of 1:1 Complex of
2,4,7-Trinitro-9,10-Phenanthrenequinone with Phenanthrene
R. V. Linkoa,*, M. A. Ryabova, P. V. Strashnova, N. A. Polyanskayaa, V. V. Davydova,
P. V. Dorovatovskiib, and V.N. Khrustaleva,c
a Peoples’ Friendship University of Russia (RUDN University), Moscow, 117198 Russia
b National Research Center “Kurchatov Institute“, Moscow, 123182 Russia
c N.D. Zelinsky Institute of Organic Chemistry of the Russian Academy of Sciences, Moscow, 119991 Russia
*e-mail: linko-rv@rudn.ru
Received May 14, 2020; revised May 14, 2020; accepted May 22, 2020
The electronic structures and properties for charge-transfer complexes (CTCs) of 9,10-phenanthrenequinone
nitroderivatives (acceptor) and phenanthrene (donor) were characterized using density functional theory cal-
culations. The energy of complex formation, the average distance between the donor and acceptor planes, and
the total charge transfer values are calculated. 1,3,6-Trinitro-9,10-phenanthrenequinone was shown to be the
strongest acceptor in the studied series. The crystal and molecular structure of the 1:1 complex of 2,4,7-trini-
tro-9,10-phenanthrenequinone with phenanthrene [C14H5N3O8·C14H10] was elucidated by X-ray diffraction
analysis.
Keywords: 9,10-phenanthrenequinone nitro-derivatives, phenanthrene, charge-transfer complexes, quantum
chemical calculations, X-ray diffraction
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 10 2020