ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2020, том 90, № 10, с. 1551-1557
УДК 547.947.733
СИНТЕЗ И СПЕКТРАЛЬНЫЕ СВОЙСТВА
мезо-НИТРОЗАМЕЩЕННЫХ ОКТАЭТИЛПОРФИРИНОВ
И ИХ КОМПЛЕКСОВ С Со(II)
Н. В. Чижова*, А. И. Русанов, Н. Ж. Мамардашвили
Институт химии растворов имени Г. А. Крестова Российской академии наук, ул. Академическая 1, Иваново,
153040 Россия
*e-mail: nvc@isc-ras.ru
Поступило в Редакцию 28 апреля 2020 г.
После доработки 28 апреля 2020 г.
Принято к печати 12 мая 2020 г.
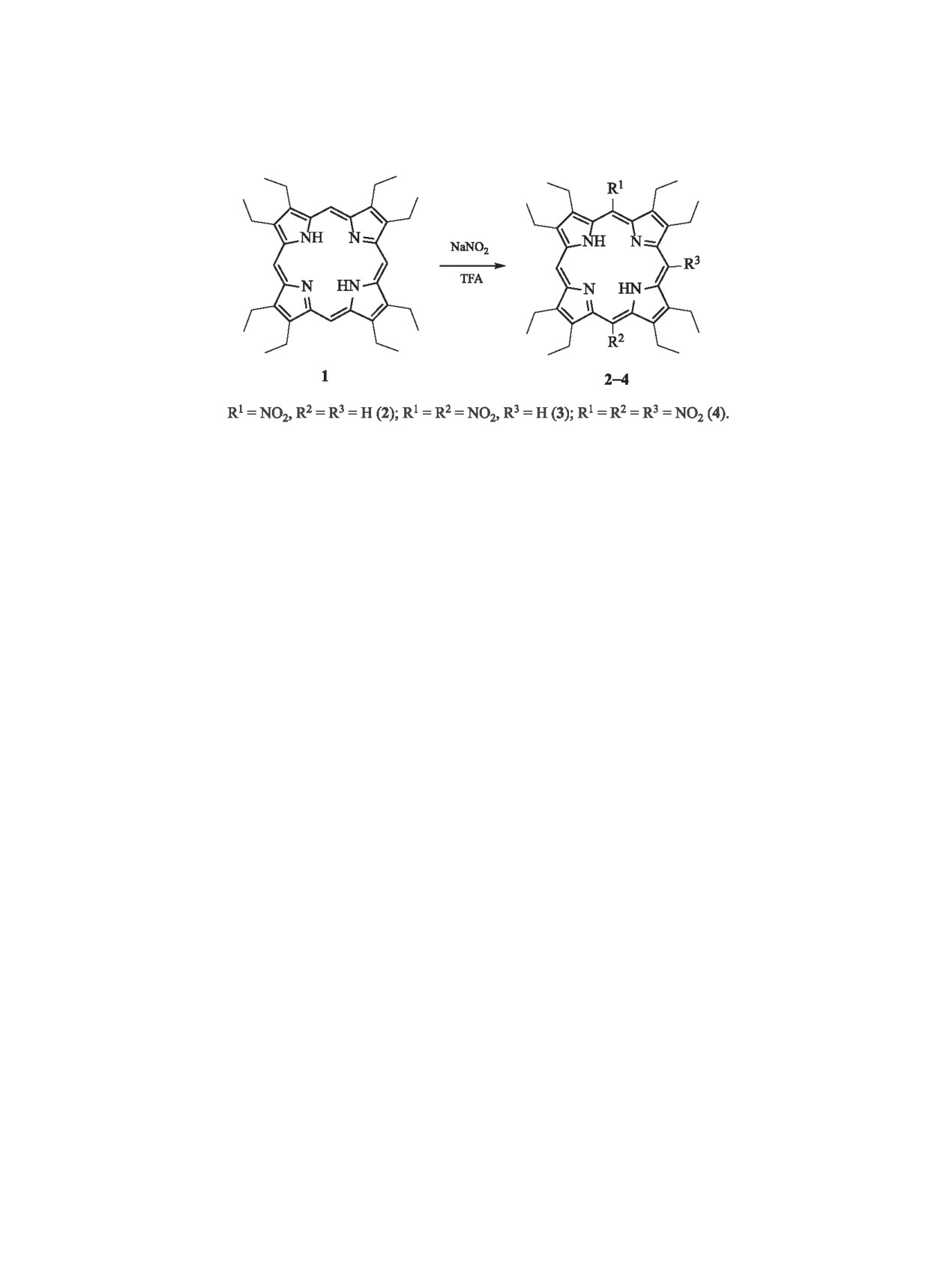
При взаимодействии 2,3,7,8,12,13,17,18-октаэтилпорфирина с нитритом натрия в трифторуксусной кис-
лоте получены 5-нитро-2,3,7,8,12,13,17,18-октаэтилпорфирин, 5,15-динитро-2,3,7,8,12,13,17,18-октаэтил-
порфирин и 5,10,15-тринитро-2,3,7,8,12,13,17,18-октаэтилпорфирин. Исследованы реакции координации
октаэтилпорфирина, моно-, ди-, три- и тетранитрозамещенных порфиринов с ацетатом кобальта(II) в
смеси хлороформ-метанол. Получены и идентифицированы соответствующие порфиринаты Co(II).
Показано, что при растворении октаэтилпорфиринатов Co(II) в диметилформамиде в присутствии NaOH
в координационном центре макроцикла происходит окисление Co(II)→Со(III).
Ключевые слова: октаэтилпорфирин, мезо-нитрозамещенные порфирины, комплексы кобальта, реакции
нитрования, комплексообразование
DOI: 10.31857/S0044460X20100108
Порфирины и их металлокомплексы находят
Ранее было описано нитрование октаэтилпор-
применение в качестве компонентов солнечных
фирината Zn(II) с помощью N2O4 в дихлормета-
батарей, агентов для фотодинамической терапии
не [6]. При обработке цинковых комплексов ни-
раковых заболеваний, сенсоров для детектирова-
трозамещенных порфиринов ледяной уксусной
ния ионов и газообразных субстратов различной
кислотой получены соответствующие порфири-
природы [1]. Селективным введением в молекулу
ны-лиганды. В работе [5] синтезированы пара-
порфирина электронодонорных и электроноакцеп-
нитрозамещенные тетрафенилпорфирины под
торных заместителей можно создавать системы
действием NaNO2 в трифторуксусной кислоте.
с неравномерным распределением электронной
В настоящей работе исследованы реакции ни-
плотности в пределах тетрапиррольного макро-
трования 2,3,7,8,12,13,17,18-октаэтилпорфирина 1
цикла, что представляет интерес при создании ма-
по мезо-положениям действием NaNO2 в трифтор-
териалов, обладающих нелинейно-оптическими
уксусной кислоте (TFA, схема 1).
свойствами или увеличенной n-проводимостью [2,
Показано, что при обработке порфирина
1
3]. Введение нитрогрупп в молекулы порфиринов
нитритом натрия в трифторуксусной кислоте
позволяет получать соединения c новыми, полез-
ными с практической точки зрения свойствами
при комнатной температуре в зависимости от
(например, хорошей растворимостью в органи-
соотношения реагентов и времени реакции об-
ческих растворителях и высокой устойчивостью
разуются
5-нитро-2,3,7,8,12,13,17,18-октаэтил-
комплексов металлов в агрессивных средах). Ни-
порфирин 2 и смесь 5,10- и 5,15-динитроокта-
трозамещенные порфирины могут представлять
этилпорфиринов. Так, при мольном соотношении
интерес в качестве объектов для дальнейших хи-
1:NaNO2 = 1:5 в течение 5 мин образуется 5-ни-
мических превращений [4-5].
тро-2,3,7,8,12,13,17,18-октаэтилпорфирин
2.
В
1551
1552
ЧИЖОВА и др.
Схема 1.
масс-спектре мононитрозамещенного порфирина
анодного окисления SO2 и различных углеводо-
присутствует пик с m/z 579.1, соответствующий
родов [12]. Комплексы кобальта на основе пор-
молекулярному иону соединения 2 (вычислено
фиринов характеризуются низким окислитель-
для С36Н45N5O2: 579.8). При увеличении избыт-
но-восстановительным потенциалом E(Co2+/Co3+)
ка NaNO2 до 12-кратного и времени реакции до
центрального иона [12, 13]. Величина этого по-
30 мин образуется смесь 5,15- и 5,10-динитроза-
тенциала в значительной степени определяется
мещенных октаэтилполрфиринов. В масс-спек-
донорно-акцепторными свойствами тетрапир-
тре продуктов присутствует пик с m/z 624.1,
рольных лигандов и может изменяться в широких
соответствующий молекулярному иону динитро-
пределах. Кобальтовые комплексы порфиринов
замещенных октаэтилпорфиринов (вычислено для
проявляют высокую биологическую активность.
С36Н44N6O4: 624.8). Разделение изомеров проводи-
В работе [14] изучены спектральные свойства
ли на пластинах Polygram SIL. Соотношение 5,15-
Со(II)-октаэтилпорфирина. Авторы [15] cинтези-
и 5,10-изомеров составило ~ 5:1.
ровали хлоридный и иодидный комплексы кобаль-
При увеличении избытка нитрующего реагента
та Со(III)(Cl)Porph и Co(III)IPorph. C целью изуче-
до 50-кратного и времени реакции до 3 сут полу-
ния влияния мезо-нитрозамещения на образование
чен 5,10,15-тринитро-2,3,7,8,12,13,17,18-октаэтил-
комплексов кобальта с производными октаэтил-
порфирин 4 с выходом 68%. Увеличение избытка
порфирина в настоящей работе исследованы ре-
NaNO2 до 60-кратного и времени реакции до 5 сут
акции координации порфиринов 1-5 с ацетатом
не приводит к исчерпывающему нитрованию ме-
кобальта(II) в смеси хлороформ-метанол.
зо-положений порфирина 1.
Исследования показали, что реакция комплек-
5,10,15,20-Тетранитро-2,3,7,8,12,13,17,18-ок-
сообразования порфирина 1 c Со(ОАс)2 (моль-
таэтилпорфирин 5 синтезировали по методике
ное соотношение 1:10) в кипящей смеси хлоро-
[7]. При взаимодействии октаэтилпорфирина
форм-метанол (1:1) в течение 30 мин приводит
с избытком нитрата цинка в уксусном анги-
к смеси Со(II)- и Со(III)-порфиринов (схема 2).
дриде сначала образуется
5,10,15,20-тетрани-
В ходе хроматографирования Co-порфиринов на
тро-2,3,7,8,12,13,17,18-октаэтилпорфиринат
основном оксиде алюминия наблюдается вос-
Zn(II). При обработке тетранитрозамещенного
становление Со(III)→Co(II) с образованием
комплекса цинка соляной или трифторуксусной
2,3,7,8,12,13,17,18-октаэтилпорфирината Co(II) 6
кислотами получен порфирин 5.
(см. таблицу).
Порфирины обычно проявляют свои биологи-
При взаимодействии порфирина 2 c Co(OAc)2
ческие и каталитические свойства в составе ком-
(мольное соотношение
1:20) в кипящей сме-
плексов с металлами. Особый интерес представ-
си хлороформ-метанол в течение 4 ч получена
ляют кобальтовые комплексы порфиринов [8-11].
смесь порфиринатов Со(II) и Co(III). Хромато-
Порфиринаты кобальта применяются в катализе
графирование полученных соединений на окси-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 10 2020
СИНТЕЗ И СПЕКТР
АЛЬНЫЕ СВОЙСТВА
1553
Схема 2.
де алюминия приводит к образованию 5-нитро-
Таким образом, при переходе от октаэтилпор-
2,3,7,8,12,13,17,18-октаэтилпорфирината
фирина к его моно- и динитрозамещенным на-
Со(II) 7. В аналогичных условиях при взаимо-
блюдается увеличение времени образования со-
действии
5,15-динитропорфирина
3 с ацета-
ответствующих порфиринатов кобальта в среде
том кобальта в течение 4 ч получен 5,15-дини-
хлороформ-метанол, a для три- и тетранитроза-
тро-2,3,7,8,12,13,17,18-октаэтилпорфиринат Со(II)
мещенных - уменьшение времени комплексообра-
8 (схема 2).
зования. Причем тетранитропорфирин вступает в
реакцию координации с Со(ОАс)2 в ~15 раз бы-
В условиях, аналогичных реакции с 5,15-ди-
стрее, чем незамещенный порфирин. Вероятно,
нитропорфирином 3, при взаимодействии три-
на координационные свойства нитрозамещенных
нитрозамещенного порфирина
4 c Co(OAc)2
октаэтилпорфиринов с Со(ОАс)2, помимо элек-
в течение
40 мин образуется
5,10,15-три-
нитро-2,3,7.8,12,13,17,18-октаэтилпофиринат
тронного влияния заместителей, существенное
влияние оказывает геометрический фактор (раз-
Co(II) 9. Комплексообразование порфирина 5 с
мер координационной полости N4H2 [16]).
Со(ОАс)2 (мольное соотношение 1:10) в кипящей
смеси хлороформ-метанол протекает в течение
В работах [17, 18] показано, что Mn(III)-порфи-
2 мин и приводит к образованию 5,10,15,20-тетра-
рины восстанавливаются до порфиринатов Mn(II)
нитро-2,3,7.8,12,13,17,18-октаэтилпорфирината
в диметилформамиде и в растворе ДМФА в при-
Co(II) 10.
сутствии твердой щелочи. Для Co-порфиринов,
Параметры ЭСП октаэтилпорфиринатов Co(II) и Со(III)
λ, нм (lgε)
Cоединение
Растворитель
полоса I
полоса II
полоса Соре
1-Co(II)а
СH2Cl2
551
516
391
1-Co(II)
СH2Cl2
550 (4.31)
516 (4.11)
391 (5.21)
2-Co(II)
СH2Cl2
554 (4.21)
520 (4.09)
393 (5.08)
3-Co(II)
СH2Cl2
559 (4.18)
526 (4.08)
396 (5.01)
4-Co(II)
СH2Cl2
569 (4.15)
540 (4.12)
404 (4.87)
5-Co(II)
СH2Cl2
579 (4.06)
543 (3.97)
416 (4.75)
1-Co(III)б
ДМФА+NaОН
566 (0.211)
537 (0.228)
421 (1.17)
2-Co(III)б
ДМФА+NaОН
-
552 (0.417)
423 (1.70)
3-Co(III)б
ДМФА+NaОН
-
555 (0.362)
426 (1.37)
а Данные работы [14].
б Относительная интенсивность.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 10 2020
1554
ЧИЖОВА и др.
в аналогичных условиях, отмечен обратный про-
4.20 м. д. по сравнению с исходным порфирином
цесс - окисление Со(II)→Со(III) [19, 20].
1. Сигналы мезо-протонов моно-, ди- и тризаме-
щенных порфиринатов Со(II) проявляются в сла-
Показано, что октаэтилпорфиринаты Со(II) 6-7
бом поле в области ~ 24-30 м. д.
окисляются до смеси Со(II) и Со(III)-порфиринов
в диметилформамиде. В то же время комплек-
Таким образом, синтезированы и идентифици-
сы 6-8 в растворе ДМФА в присутствии твердой
рованы 5-мононитро-2,3,7,8,12,13,17,18-октаэтил-
щелочи образуют Со(III)-порфирины (см. табли-
порфирин,
5,15-динитро-2,3,7,8,12,13,17,18-окта-
цу). Так, при выдерживании раствора октаэтил-
этилпорфирин и
5,10,15-тринитро-2,3,7,8,12,-
порфирината Со(II) 6 в ДМФА течение 24 ч при
13,17,18-октаэтилпорфирин. Исследованы реак-
комнатной температуре образуется смесь Со(II) и
ции координации октаэтилпорфирина, его моно-
Со(III)-порфиринов. В электронном спектре по-
, ди-, три- и тетранитрозамещенных с ацетатом
глощения Со-порфиринов в ДМФА полоса Соре
Со(II) в смеси хлороформ-метанол. Получены и
расщеплена на две с максимумами 394 и 413 нм
идентифицированы соответствующие порфири-
наты кобальта(II). Показано, что при растворении
примерно одинаковой интенсивности, в длинно-
октаэтилпорфиринатов Co(II) в ДМФА в присут-
волновой области присутствуют полосы при 524 и
ствии твердого NaOH наблюдается окисление
554 нм. В сравнимых условиях степень превраще-
Co(II)→Со(III).
ния мононитрозамещенного комплекса 7 в окис-
ленную форму составила ~ 10%.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
При встряхивании раствора комплекса 6 в
В работе использовали коммерческие
ДМФА в присутствии твердого NaОН в течение
2,3,7,8,12,13,17,18-октаэтилпорфирин
1
~45 мин образуется октаэтилпорфиринат Со(III).
(Porphychem), трифторуксусную кислоту (Acros),
Для моно- и динитрозамещенных октаэтилпорфи-
оксид алюминия (Merck), ДМФА, CH2Cl2, СНCl3
ринатов кобальта время образования окисленных
марки ХЧ, нитрит натрия марки Ч. Ледяную ук-
форм в растворе ДМФА в присутствии твердого
сусную кислоту получали вымораживанием
NaОН сокращается до 35 и 20 мин соответствен-
уксусной кислоты марки Ч. Co(OAc)2 (ХЧ) пе-
но. При растворении тринитрозамещенного пор-
рекристаллизовывали из ледяной уксусной кис-
фирината Со(II) 9 в ДМФА в присутствии твердого
лоты, сушили при 80°С в течение 1 ч. 5,10,15,20-
NaОН в течение ~ 5 мин образуется соединение с
Тетранитро-2,3,7,8,12,13,17,18-октаэтилпорфирин
максимумами в электронном спектре поглощения
5 синтезировали по известной методике [7].
664, 627 и 474 нм. При выделении образующихся
Контроль за ходом реакций комплексообра-
соединений из реакционной смеси наблюдается
зования октаэтилпорфиринов с Со(ОАс)2 осу-
частичная или полная деструкция комплексов.
ществляли спектрофотометрическим методом.
Синтезированные порфирины и их комплексы с
Электронные спектры поглощения записывали на
Со(II) идентифицированы методами электронной
спектрофотометре Cary-100 (Varian) при комнат-
абсорбционной и ЯМР 1Н спектроскопии, а также
ной температуре. Спектры ЯМР 1Н записывали
масс-спектрометрии. Последовательное увеличе-
на приборе Bruker AV III-500 в CDCl3 (внутрен-
ние числа нитрогрупп в мезо-положениях окта-
ний стандарт - ТМС). Масс-спектры получали на
этилпорфиринатов Со(II) приводит к смещению
масс-спектрометре MALDI TOF Shimadzu Biotech
полос в электронном спектре поглощения в длин-
Axima Confidence (матрица - дигидроксибензой-
новолновую область. При окислении порфирина-
ная кислота).
тов Со(II)→Со(III) также наблюдается батохром-
5-Нитро-2,3,7,8,12,13,17,18-октаэтилпорфи-
ное смещение полос (см. таблицу).
рин (2). К 0.04 г (0.0748 ммоль) порфирина 1 в 3
Октаэтилпорфиринат Со(II) проявляет парамаг-
мл трифторуксусной кислоты прибавляли 0.026 г
нитные свойства (конфигурация 3d7) [9]. Это при-
(0.374 ммоль) NaNO2, перемешивали при комнат-
водит к тому, что в спектре ЯМР 1Н соединения
ной температуре в течение 5 мин. К реакционной
6 cигналы мезо- и β-протонов уширены и смеще-
смеси прибавляли хлороформ и воду. Органиче-
ны в слабое поле соответственно на 19.65, 4.77 и
ский слой отделяли, промывали водой, раствором
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 10 2020
СИНТЕЗ И СПЕКТР
АЛЬНЫЕ СВОЙСТВА
1555
NaHCO3, снова водой, затем сушили Na2SO4 и
3.59-3.57 м (4Н), 3.56-3.53 м (8Н, СН2), 1.81-1.77
упаривали до минимального количества. Остаток
м (6Н), 1.55-1.50 м (6Н), 1.49-1.45 м (6Н), 1.43-
хроматографировали на оксиде алюминия смесью
1.40 м (6Н, СН3), -3.86 с (2Н, NH). Масс-спектр,
гексан-дихлорметан (1:1), затем дихлорметаном.
m/z (Iотн, %): 671.6 (97) [M + 2Н]+ (вычислено для
Выход 0.034 г (0.0586 ммоль, 78%). ЭСП (СH2Cl2),
С36Н43N7O6: 669.9).
λ, нм (lgε): 624 (3.67), 571 (3.74), 537 (3.88), 502
2,3,7,8,12,13,17,18-Октаэтилпорфиринат
(4.05), 396 (5.08). Спектр ЯМР 1H, δ, м. д.: 10.25
Со(II) (6). Смесь 0.025 г (0.0467 ммоль) порфири-
с (2Н) и 10.10 с (1Н, мезо-Н), 4.11-4.02 м (12Н)
на 1 и 0.083 г (0.467 ммоль) Со(ОАс)2 растворяли
и 3.75 с (4Н, СН2), 1.93-1.85 м (18Н) и 1.69-1.60
в 30 мл смеси хлороформ-метанол (1:1). Реакци-
м (6Н, СН3), -3.85 с и -3.95 с (2Н, NH). Масс-
онную смесь кипятили в течение 30 мин, затем ох-
спектр, m/z (Iотн, %): 579.1 (98) [M]+ (вычислено
лаждали, промывали водой, сушили Na2SO4 и упа-
для С36Н45N5O2: 579.8).
ривали. Остаток хроматографировали на оксиде
5,15-Динитро-2,3,7,8,12,13,17,18-октаэтил-
алюминия дихлорметаном. Выход 0.024 г (0.0408
ммоль, 87%). Спектр ЯМР 1Н, δ, м. д.: 29. 60 уш.
порфирин (3). К 0.04 г (0.0748 ммоль) порфири-
с (4Н, мезо-Н), 8.82 уш. с (16Н, β-СН2), 6.15 уш. с
на 1 в 3 мл трифторуксусной кислоты прибавляли
(24Н, β-СН3). Масc-спектр, m/z (Iотн, %): 591.3 (98)
0.062 г (0.898 ммоль) NaNO2, перемешивали при
комнатной температуре в течение 30 мин. К ре-
[M]+ (вычислено для С36Н44N4Co: 591.7).
акционной смеси прибавляли хлороформ и воду.
5-Нитро-2,3,7,8,12,13,17,18-октаэтилпорфи-
Органический слой отделяли, промывали водой,
ринат Со(II) (7) получали аналогично из 0.025 г
раствором NaHCO3, снова водой, затем сушили
(0.0431 ммоль) порфирина 2 и 0.15 г (0.862 ммоль)
Na2SO4 и упаривали до минимального объема.
Co(OAc)2; время реакции - 4 ч. Выход 0.022 г
Остаток хроматографировали на оксиде алюминия
(0.0346 ммоль, 80%). Спектр ЯМР 1Н, δ, м. д.: 30.8
дихлорметаном, затем хлороформом. Выход смеси
уш. c (2H, мезо-Н), 24.3 уш. с (1Н, мезо-Н), 9.50
5,15- и 5,10-динитрозамещенных изомеров 0.03 г
уш. с и 8.42 уш. с (16Н, β-СН2); 8.10 уш. с, 6.25 уш.
(0.048 ммоль, 65%). Разделение изомеров прово-
с, 6.16 уш. с (24Н, β-СН3). Масс-спектр, m/z (Iотн,
дили на пластинах Polygram SIL (элюент - дихлор-
%): 636.1 (88) [M]+ (вычислено для С36Н43N5О2Co:
метан-гексан 1:3, затем 1:1). Выход соединения 3
636.7).
0.023 г (0.0368 ммоль, 50%). ЭСП (СH2Cl2), λ, нм
5,15-Динитро-2,3,7,8,12,13,17,18-октаэтил-
(lgε): 629 (3.96), 578 (4.04), 538 (4.10), 507 (4.24),
порфиринат Со(II) (8) получали аналогично из
381 (4.99). Спектр ЯМР 1H, δ, м. д.: 10.34 с (2Н,
0.02 г (0.032 ммоль) порфирина 3 и 0.114 г (0.64
мезо-Н), 4.71-4.64 м (8Н) и 4.10-4.03 м (8Н, СН2),
ммоль) Co(OAc)2; время реакции - 4 ч. Выход 0.018
1.94-1.88 м (12Н) и 1.70-1.64 м (12Н, СН3), -3.36
г (0.0264 ммоль, 80%). Спектр ЯМР 1Н, δ, м. д.:
с (2Н, NH). Масс-спектр, m/z (Iотн, %): 624.1 (96)
28. 75 уш. с (2Н, мезо-Н), 8.80 уш. с (16Н, β-СН2),
[M]+ (вычислено для С36Н44N6O4: 624.8).
6.05 уш. с (24Н, β-СН3). Масс-спектр, m/z (Iотн, %):
681.2
(74)
[M]+ (вычислено для C36Н42N6О4Со:
5,10,15-Тринитро-2,3,7,8,12,13,17,18-окта-
681.7).
этилпорфирин (4). К 0.04 г (0.0748 ммоль) порфи-
рина 1 в 3 мл трифторуксусной кислоты прибав-
5,10,15-Тринитро-2,3,7,8,12,13,17,18-окта-
ляли 0.257 г (3.73 ммоль) NaNO2, перемешивали
этилпорфиринат Со(II) (9) получали аналогично
при комнатной температуре в течение 3 сут. По-
из 0.025 г (0.0373 ммоль) порфирина 4 и 0.132 г
сле завершения реакции прибавляли хлороформ
(0.746 ммоль) Co(OAc)2; время реакции - 40 мин.
и воду. Органический слой отделяли, промывали
Выход 0.025 г (0.0316 ммоль, 85%). Спектр ЯМР
водой, раствором NaHCO3, снова водой и сушили
1Н, δ, м. д.: 28.30 уш. c (1H, мезо-Н), 5.90 уш. с (4Н,
Na2SO4. Растворитель упаривали до минимального
β-CH2), 5.32 уш. с (12Н, β-CH2), 3.70-3.35 м (24Н,
объема, хроматографировали на оксиде алюминия
β-CH3). Масс-спектр, m/z (Iотн, %): 726.3 (82) [M]+
хлороформом. Выход 0.031 г (0.0463 ммоль, 61%).
(вычислено для C36Н41N7О6Со: 726.7).
ЭСП (СH2Cl2), λ, нм (lgε): 637 (3.33), 589 (3.64),
5,10,15,20-Тетранитро-2,3,7,8,12,13,17,18-ок-
540 (3.79), 513 (4.01), 385 (4.99). Cпектр ЯМР 1Н,
таэтилпорфиринат Со(II) (10) получали ана-
δ, м. д.: 10.08 с (1Н, мезо-H), 3.96-3.92 м (4Н),
логично из 0.025 г (0.035 ммоль) порфирина 5 и
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 10 2020
1556
ЧИЖОВА и др.
0.062 г (0.35 ммоль) Co(OAc)2; время реакции -
Zvezdina S.V., Mamardashvili N.Z. // Russ. J. Gen.
2 мин. Выход 0.025 г (0.0311 ммоль, 89%). Спектр
Chem. 2016. Vol. 86. N 5. P. 1091. doi 10.1134/
ЯМР 1H, δ, м. д.: 5.68 уш. с (16Н, β-СН2), 2.36 уш. с
S1070363216050182
10. Мамардашвили Г.М., Симонова О.Р., Чижова Н.В.,
(24Н, β-СН3). Масс-спектр, m/z (Iотн, %): 770.9 (76)
Мамардашвили Н.Ж. // ЖОХ. 2018. Т. 88. Вып. 6.
[M]+ (вычислено для C36Н40N8О8Со: 771.7).
С. 974; Mamardashvili G.M., Simonova O.R., Chizho-
ФОНДОВАЯ ПОДДЕРЖКА
va N.V., Mamardashvili N.Z. // Russ. J. Gen. Chem.
2018. Vol. 88. N 6. P. 1154. doi 10.1134/
Работа выполнена при поддержке Российско-
S107036321806018X
го научного фонда (проект № 19-73-20079) с ис-
11. Чижова Н.В., Хелевина О.Г., Кумеев Р.С., Бере-
пользованием оборудования центра коллективно-
зин Б.Д., Мамардашвили Н.Ж. // ЖОХ. 2010. Т. 80.
го пользования Института органической химии
Вып. 11. С. 1924; Chizhova N.V., Khelevina O.G., Ku-
им. Н.Д. Зелинского РАН.
meev R.S., Berezin B.D., Mamardashvili N.Z. // Russ. J.
КОНФЛИКТ ИНТЕРЕСОВ
Gen. Chem. 2010. Vol. 80. N 11. P. 2387. doi 10.1134/
S1070363210110253
Авторы заявляют об отсутствии конфликта
12. Порфирины: Спектроскопия, электрохимия, при-
интересов.
менение / Под ред. Н.С. Ениколопяна. М.: Наука,
СПИСОК ЛИТЕРАТУРЫ
1987. 384 с.
13. Манн Ч., Барнес К. Электрохимические реакции в
1. Lu-Lin Li, Eric Wei-Guang Diau. // Chem. Soc. Rev.
неводных системах. М.: Химия, 1970. 489 с.
2013. Vol. 42. N 1. P. 291. doi 10.1039/C2CS35257E
14. Ali B.B., Belkhiria M.S., Giorgi M., Nasri H. // Open J.
2. Зданович С.А., Мамардашвили Н.Ж., Голубчиков О.А. //
Inorg. Chem. 2011. P. 39. doi 10.4236/ojic.2011.13006
ЖОрХ. 1996. Т. 32. Вып. 5. С. 788; Zdanovich S.A.,
15. Cao Y, Peterson J.L., Stolzenberg A.M. // Inorg. Chem.
Mamardashvili N.Z., Golubchikov O.A. // Russ. J. Org.
1998. Vol. 37. P. 5173. doi 10.1021/ic980538u
Chem. 1996. Vol. 32. N 5. P. 756.
16. Координационные соединения порфиринов и фта-
3. Stuzhin P.A., Goryachev M.Yu., Ivanova S.S., Nazaro-
лоцианина. М.: Наука, 1978. 280 с.
va A., Pimkov I., Koifman O.I. // J. Porph. Phthal. 2013.
17. Шейнин В.Б., Чижова Н.В., Романова А.О. // ЖОХ.
Vol. 17. P. 905. doi 10.1142/S1088424613500892
2010. Т. 80. Вып. 2. С. 326; Sheinin V.B., Chizhova N.V.,
4. Любимцев А., Семейкин А., Жеглова Н., Шейнин В.,
Romanova A.O. // Russ. J. Gen. Chem. 2010. Vol. 80.
Куликова О., Сырбу С. // Макрогетероциклы. 2018.
N 2. P. 351. doi 10.1134/S107036321002026X
Т. 11. № 1. С. 103. doi 10.6060/mhc171151l
18. Chizhova N.V., Maltceva O.V., Zvezdina S.V., Mamar-
5. Luguya R., Jaquinod L., Fronczek F.R., Graca M., Vi-
dashvili N.Z., Koifman O.I. // J. Coord. Chem. 2018.
cente H., Smith K.M. // Tetrahedron. 2004. Vol. 60.
Vol.
71.
N
19.
P.
3222.
doi
P. 2757. doi 10.1016/j.tet.2004.01.080
10.1080/00958972.2018.1519186
6. Gong L.Ch., Dolphin D. // Can. J. Chem. 1985. Vol. 63.
19. Мамардашвили Г.М., Чижова Н.В., Кайгородова Е.Ю,
N 2. P. 401. doi 10.1139/v85-066
Мамардашвили Н.Ж. // ЖНХ. 2017. Т. 62. № 3.
7. Watanabe E., Nichimura S., Ogoshi H., Yoshida Z. //
Tetrahedron. 1975. Vol. 31. N 11-12. P. 1385. doi
С. 296; Mamardashvili G.M., Chizhova N.V., Kaig-
10.1016/0040-4020(75)87068-2
orodova E.Y., Mamardashvili N.Zh. // Russ. J. Inorg.
8. Чижова Н.В., Кумеев Р.С., Мамардашвили Н.Ж. //
Chem. 2017. Vol. 62. N 3. P. 301. doi 10.1134/
ЖНХ. 2013. Т. 58. № 6. С. 836; Chizhova N.V., Kume-
S0036023617030123
ev R.S., Mamardashvili N.Z. // Russ. J. Inorg.
20. Чижова Н.В., Мальцева О.В., Завьялов А.В., Ма-
Chem. 2013. Vol. 58. N 6. P. 740. doi 10.1134/
мардашвили Н.Ж. // ЖНХ. 2017. Т. 62. № 5.
S0036023613060089
С. 689; Chizhova N.V., Mal’tseva O.V., Zav’yalov A.V.,
9. Чижова Н.В., Звездина С.В., Мамардашвили Н.Ж. //
Mamardashvili N.Z. // Russ. J. Inorg. Chem. 2017.
ЖОХ. 2016. Т. 86. Вып. 5. С. 829; Chizhova N.V.,
Vol. 62. N 5. P. 683. doi 10.1134/S0036023617050072
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 10 2020
СИНТЕЗ И СПЕКТР
АЛЬНЫЕ СВОЙСТВА
1557
Synthesis and Spectral Properties of meso-Nitro-Substituted
Octaethylporphyrins and Their Co(II) Complexes
N. V. Chizhova*, A. I. Rusanov, N. Zh. Mamardashvili
G.A. Krestov Institute of Chemistry of Solutions of the Russian Academy of Sciences, Ivanovo, 153040 Russia
*e-mail: nvc@isc-ras.ru
Received April 28, 2020; revised April 28, 2020; accepted May 12, 2020
The reaction of 2,3,7,8,12,13,17,18-octaethylporphyrin with sodium nitrite in trifluoroacetic acid yielded
5-nitro-2,3,7,8,12,13,17,18-octaethylporphyrin, 5, 15-dinitro-2,3,7,8,12,13,17,18-octaethylporphyrin and
5,10,15-trinitro-2,3,7,8,12,13,17,18-octaethylporphyrin. Coordination reactions of octaethylporphyrin, mo-
no-, di-, tri-, and tetranitro-substituted porphyrins with cobalt(II) acetate in a chloroform-methanol mixture
were studied. The corresponding Co(II) porphyrinates were obtained and identified. It was shown that, upon
dissolution of Co(II) octaethylporphyrinates in dimethylformamide in the presence of NaOH, the oxidation of
Co(II)→Co(III) occurs in the coordination site of the macrocycle.
Keywords: octaethylporphyrin, meso-nitro-substituted porphyrins, cobalt complexes, nitration reactions,
complexation
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 10 2020