ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2020, том 90, № 10, с. 1567-1576
УДК 546.98:547-304.7: 547.793.3
СИНТЕЗ И ИЗУЧЕНИЕ СТРОЕНИЯ
АЦИКЛИЧЕСКИХ ДИАМИНОКАРБЕНОВЫХ
КОМПЛЕКСОВ ПАЛЛАДИЯ(II), СОДЕРЖАЩИХ
1,2,4-ОКСАДИАЗОЛЬНЫЙ ФРАГМЕНТ
© 2020 г. С. В. Байковa,*, Ю. А. Трухановаb, М. В. Тарасенкоc, М. А. Кинжаловa
a Санкт-Петербургский государственный университет,
Университетская наб. 7-9, Санкт-Петербург, 199034 Россия
b Санкт-Петербургский государственный химико-фармацевтический университет,
Санкт-Петербург, 197376 Россия
c Центр трансфера фармацевтических технологий имени М. В. Дорогова,
Ярославский государственный педагогический университет имени К.Д. Ушинского, Ярославль, 150000 Россия
*e-mail: sergei.v.baikov@yandex.ru
Поступило в Редакцию 19 августа 2020 г.
После доработки 19 августа 2020 г.
Принято к печати 24 августа 2020 г.
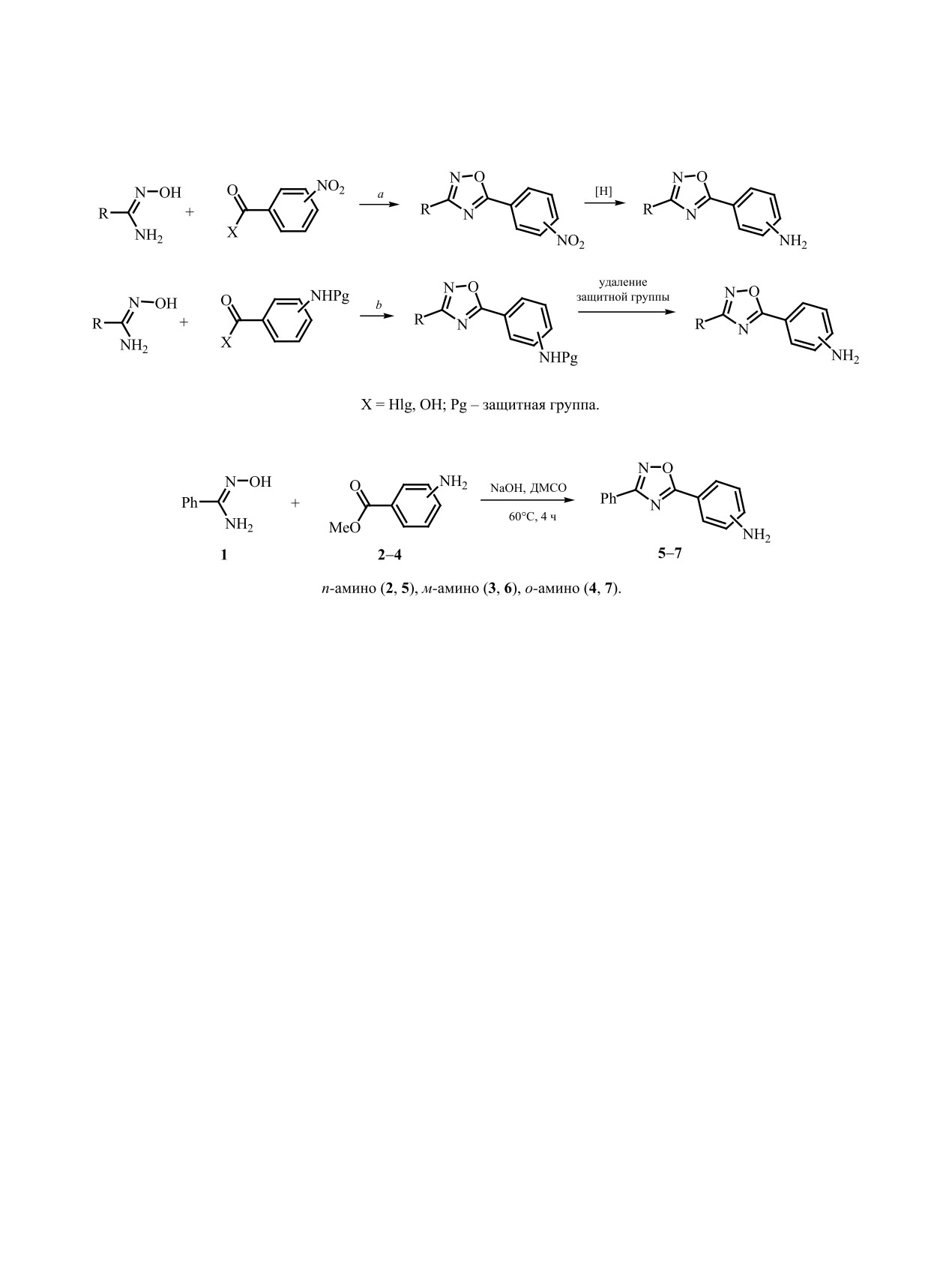
Реакция анилинов, содержащих 1,2,4-оксадиазольный фрагмент, с бис(ксилилизоцианидным) комплексом
Pd(II) приводит к образованию ациклических диаминокарбеновых комплексов. Оксадиазольный цикл
при этом во взаимодействии не участвует. Состав и строение полученных комплексов подтверждены
данными масс-спектрометрии, спектроскопии ЯМР и данными рентгеноструктурного анализа.
Ключевые слова: ациклические диаминокарбеновые комплексы палладия, оксадиазолы, изоцианидные
лиганды, π-π-стекинг
DOI: 10.31857/S0044460X20100121
Изучение взаимодействия N-нуклеофилов с
также строительных блоков для создания супра-
изоцианидами, координированными к переход-
молекулярных ансамблей методами инженерии
ным металлам (Pd, Pt, Au), является приоритет-
кристаллов [31, 32].
ным направлением исследований в области неор-
Реакция N-нуклеофилов с изоцианидными ком-
ганической и координационной химии [1-6]. Его
плексами описана как для соединений с одним
актуальность обусловлена большой практической
нуклеофильным центром (например, амины) [33,
значимостью образующихся в результате данной
34], так и для полинуклеофилов (фенилендиами-
реакции ациклических диаминокарбеновых ком-
ны, аминопиридин, аминотиазолы, иминоиндали-
плексов. Например, ациклические диаминокарбе-
ноны) [35-40]. В первом случае присоединение
новые комплексы Pd(II) являются эффективными
нуклеофила, как правило, происходит исключи-
катализаторами реакций кросс-сочетания (Суз-
тельно к одному изоцианидному лиганду, кото-
уки [7-15], Соногаширы [9, 16-22], Хиямы [23,
рый превращается в диаминокарбен, а остальные
24], Хека [25]) и не уступают по своим характе-
лиганды и металлоцентр не затрагиваются. В слу-
ристикам самым популярным катализаторам на
чае же ди- и полинуклеофилов во взаимодействии
основе N-гетероциклических карбенов (NHC) [2,
могут участвовать и остальные лиганды, что при-
26]. В дополнение к синтетическому применению
водит к образованию различных типов хелатных
карбеновых комплексов [5, 6, 27].
относительно недавно подобные комплексы ста-
ли активно изучаться в роли антибактериальных
Одними из потенциальных полинуклеофилов
средств [27], противораковых агентов [28-30], а
являются анилины, содержащие 1,2,4-оксадиазо-
1567
1568
БАЙКОВ и др.
Схема 1.
Схема 2.
льный заместитель. Интерес к данным соедине-
[PdCl2(CNXyl)2]. Работа состояла из трех этапов:
ниям обусловлен широкой востребованностью
синтеза изомерных анилинов с оксадиазольным
производных
1,2,4-оксадиазола в медицинской
заместителем в орто-, мета- и пара-положениях,
химии [41-50]. Более того, 1,2,4-оксадиазолы ис-
изучения их взаимодействия с cis-[PdCl2(CNXyl)2]
пользуются в качестве органических лигандов для
и исследования строения образующихся ацикли-
дизайна металлокомплексных препаратов [51-53].
ческих диаминокарбеновых комплексов методами
В частности, описана серия обладающих противо-
спектроскопии ЯМР, масс-спектрометрии высоко-
опухолевыми свойствами комплексов Au(I) и Ag(I)
го разрешения и РСА.
с карбеновыми лигандами, в периферию которых
Традиционно анилины, содержащие 1,2,4-ок-
включен 1,2,4-оксадиазольный цикл [54]. Поэтому
садиазольный цикл, получают восстановлением
исследование их реакционной способности в от-
соответствующих нитросоединений (схема 1, а)
ношении координированных с переходными ме-
[62-66], либо с привлечением защитных групп
таллами изоцианидов и получение соответствую-
(схема 1, б) [67].
щих диаминокарбеновых комплексов - актуальная
задача.
Недавно в серии работ [68-70] было показано,
что система NaOH-ДМСО является перспектив-
1,2,4-Оксадиазольный цикл, как изоэлектрон-
ной средой для синтеза разнообразных 3,5-диза-
ный аналог амидной и алкоксикарбонильной
мещенных 1,2,4-оксадиазолов. Например, реакция
групп [55], является электроноакцепторным за-
амидоксимов со сложными эфирами, протекаю-
местителем и должен понижать нуклеофильность
щая при температуре окружающей среды, позво-
аминогруппы. Кроме того, атомы азота гетеро-
цикла способны координироваться с различны-
ляет получать соединения, содержащие в качестве
ми переходными металлами [53, 56-59], включая
периферийных заместителей ароматические и
палладий [60, 61]. Целью настоящей работы явля-
алифатические амины, а также лабильные гетеро-
лось определение реакционной способности как
циклы [71-73]. Однако сложные эфиры аромати-
самого 1,2,4-оксадиазольного цикла, так и ами-
ческих аминокислот, в том числе метил-4-амино-
ногруппы ароматического кольца в реакции с cis-
бензоат, оказались малоактивны в данной реакции.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 10 2020
СИНТЕЗ И ИЗУЧЕНИЕ СТРОЕНИЯ
1569
Схема 3.
Поскольку данный метод удобнее многоста-
хлорид-аниона [М - Cl]+. Во всех случаях сигналы
дийных подходов, изложенных выше, мы попро-
имеют характерное изотопное распределение для
бовали его модифицировать для малоактивных
соответствующего предполагаемым структурам
эфиров аминобензойных кислот 2-4. В результате
количества атомов палладия и хлора.
было обнаружено, что для инициирования целевой
С позиции спектроскопии ЯМР 1Н об обра-
реакции достаточно умеренного нагревания реак-
зовании диаминокарбеновой системы говорит
ционной массы (60°С). Таким образом, была син-
присутствие двух синглетных сигналов равной
тезирована серия анилинов, содержащих 1,2,4-ок-
интенсивности NH-протонов фрагмента NCN
садиазольный фрагмент 5-7 (схема 2).
[36] в области ароматических атомов водорода и
в области 10.3-10.6 м. д., а также исчезновение
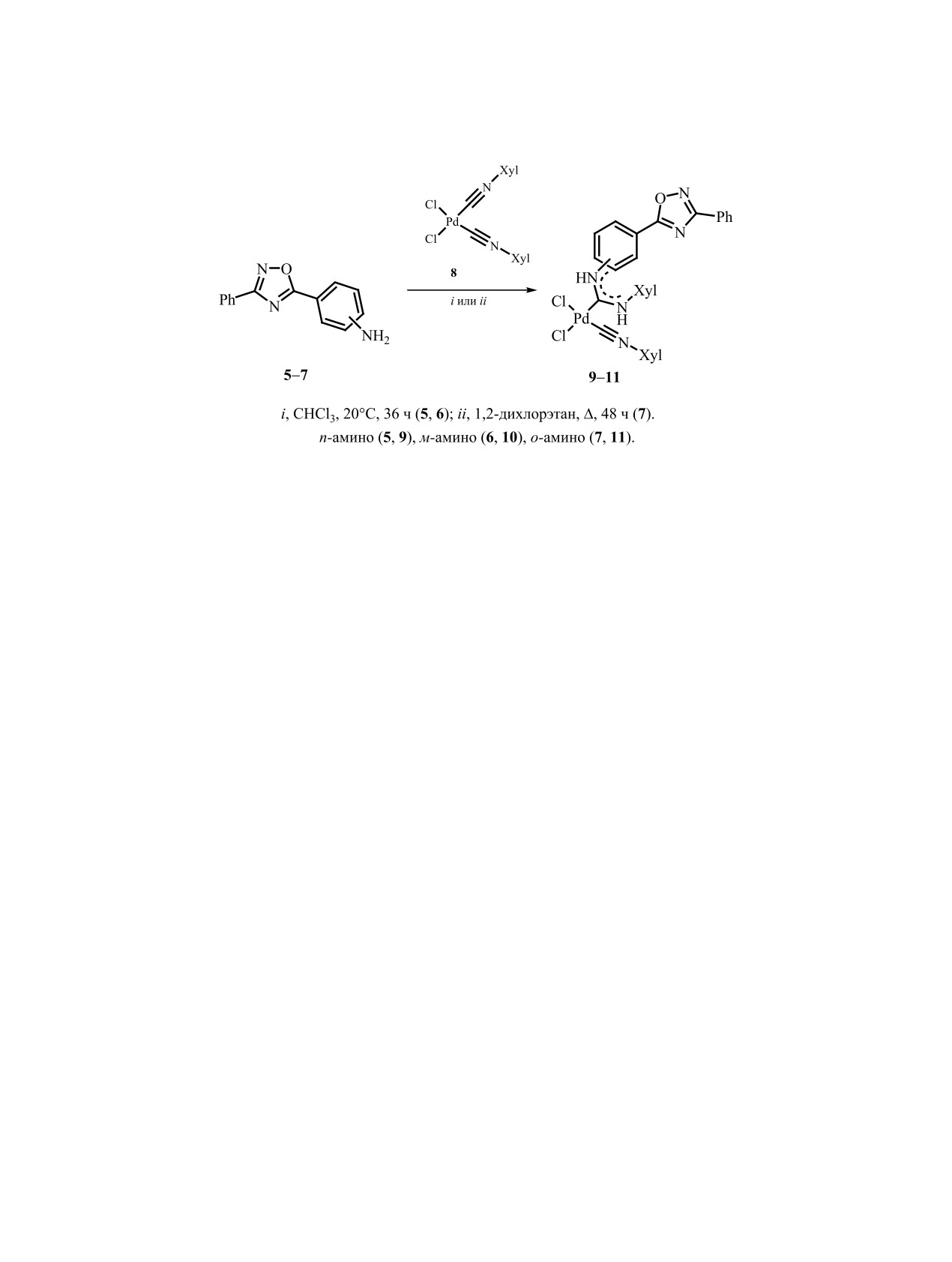
Далее была изучена реакционная способ-
сигнала аминогруппы, присутствующего в спек-
ность соединений
5-7 по отношению к cis-
трах исходных соединений 5-7 в области 5.5-
[PdCl2(CNXyl)2]
8 (схема
3). Взаимодействие
7.1 м. д. Высокочастотное расположение (10.3-
соединений 5-7 и комплекса 8 протекает при
10.6 м. д.) сигнала одного из NH-протонов в спек-
комнатной температуре и приводит к образова-
трах комплексов 9-11 обусловлено, скорее всего,
нию диаминокарбеновых комплексов 9-11. Амин
нековалентным взаимодействием между ними и
7 оказался малоактивным и в указанных услови-
хлоридным лигандом в растворе, что также наблю-
ях за 72 ч аналитический выход комплекса 11, по
далось в случае других комплексов с ациклически-
данным спектроскопии ЯМР 1H, составил всего
ми диаминокарбеновыми лигандами [6, 74, 75].
21%, поэтому синтез комплекса 11 проводили при
В случае комплекса 11 другой NH-протон также
кипячении в 1,2-дихлорэтане (DCE) в течение 48 ч
расположен в высокочастотной области (9.9 м. д.),
(выход 49% после перекристаллизации из CHCl3).
что связано с образованием внутримолекулярной
Во всех случаях в реакцию вступает только один
водородной связи с атомом азота оксадиазольного
изоцианидный лиганд. Это связано с тем, что об-
кольца. В спектрах ЯМР 13С присутствует сигнал в
разующийся карбеновый лиганд является более
области 182-195 м. д., характерный для четвертич-
сильным донором, чем изоцианидный, и дезакти-
ного атома углерода диаминокарбеновой системы
вирует второй изоцианидный лиганд в реакциях
в комплексах палладия(II) [24, 39, 76, 77]. Кроме
нуклеофильного присоединения [5].
того, в спектрах ЯМР 1H и 13С наблюдается разде-
Синтезированные комплексы 9-11 были охарак-
ление сигналов протонов и углеродов метильных
теризованы с помощью масс-спектрометрии высо-
групп ксилильного заместителя в изоцианидном
кого разрешения с ионизацией электрораспылени-
и карбеновом лигандах. Также в спектрах ЯМР
ем, спектроскопии ЯМР 1H и 13С. В масс-спектрах
13С всех полученных комплексов присутствуют
комплексов присутствуют сигналы, соответству-
сигналы углеродов оксадиазольного цикла (168 и
ющие продуктам фрагментации с отщеплением
176 м. д.) [46, 63, 70, 78].
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 10 2020
1570
БАЙКОВ и др.
Общий вид молекул комплексов (а) 9, (б) 10, (в) 11 в кристалле.
Медленным упариванием растворов в
Таким образом, установлено, что анилины,
1,2-дихлорэтане (комплексы 9 и 10) либо в аце-
содержащие
1,2,4-оксадиазольный заместитель,
тонитриле (комплекс 11) получены монокристал-
вступают в реакцию с координированным к Pd(II)
лы, структуру которых изучили методом РСА (см.
изоцианидом, давая диаминокарбеновый про-
рисунок). Кристалл комплекса 9 является моно-
дукт, аналогично другим N-нуклеофилам. При
гидратом (9·H2O), тогда как для комплексов 10 и
этом 1,2,4-оксадиазольный цикл не участвует во
11 образовались сольваты состава 10·1/2DCE и
взаимодействии в качестве хелатного лиганда, а
11·1/2MeCN. Все три кристаллических образца
его влияние на реакционную способность амино-
имеют триклинную сингонию и пространствен-
группы существенно только в случае орто-заме-
ную группу P1 (табл. 1). Из данных РСА следует,
щенного анилина. Получены и охарактеризованы
что все три комплекса 9-11 имеют практически не-
физико-химическими методами три новых диа-
искаженное плоскоквадратное координационное
минокарбеновых комплекса Pd(II), содержащих в
окружение металлоцентра с цис-расположенными
своей периферии 1,2,4-оксадиазольный фрагмент.
хлоридными лигандами, одним изоцианидным
Структура всех комплексов изучена с помощью
и одним карбеновым лигандами. Значения длин
рентгеноструктурного анализа.
обеих CN связей в карбеновом фрагменте близки
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
по величине и находятся в диапазоне между дли-
ной простой связи C-N и двойной связи C=N. Это
Органические и неорганические реагенты и рас-
творители, если это не оговорено отдельно, были
указывает на эффективное n-π-сопряжение, харак-
терное для диаминокарбеновых комплексов [8, 14,
получены из коммерческих источников (Merck) и
15, 34, 36, 79]. Молекулы растворителя в сольватах
использовались без дополнительной очистки. Бен-
замидоксим 1 и комплекс cis-[PdCl2(CNXyl)2] 8 син-
10·1/2DCE и 11·1/2MeCN, а также воды в гидра-
те 9·H2O удерживаются за счет водородных свя-
тезированы по литературным методикам [81] и [38]
соответственно.
зей c молекулами комплекса. Во всех структурах
присутствует π-π-стекинг между ароматическими
Масс-спектры получены на спектрометре
кольцами изоцианидного лиганда. Кроме того, в
Bruker micrOTOF с ионизацией электрораспыле-
структуре соединения 10 π-π-стекинговое взаи-
нием. Растворитель - MeOH, область регистрации
модействие наблюдается и между 3,5-диарилокса-
m/z = 50-3000. Значения m/z приведены для сиг-
диазольными фрагментами. Детальные геометри-
налов изотопологов c наибольшим содержанием.
ческие параметры данных структур в сравнении с
Спектры ЯМР 1H и 13C зарегистрированы на спек-
литературными данными представлены в табл. 2.
трометре Bruker 400 MHz Avance. Измерения про-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 10 2020
СИНТЕЗ И ИЗУЧЕНИЕ СТРОЕНИЯ
1571
Таблица 1. Основные кристаллографические данные, параметры рентгеноструктурных экспериментов и уточнения
для соединений 9-11
Параметр
9
10
11
M
694.92
726.38
1394.85
Т, K
100.00(10)
100.00(10)
100.00(10)
Размер кристалла, мм
0.16 × 0.15 × 0.12
0.13 × 0.12 × 0.12
0.2 × 0.14 × 0.11
Сингония
Триклинная
Триклинная
Триклинная
Группа симметрии
P1
P1
P1
a, Å
12.6894(2)
11.1620(2)
10.7521(3)
b, Å
15.7269(3)
12.7179(2)
14.3542(5)
c, Å
16.0157(3)
13.3786(1)
22.9481(5)
α, град
90.766(2)
71.717(1)
99.618(2)
β, град
92.5180(10)
81.543(1)
90.845(2)
γ, град
90.671(2)
81.716(1)
109.773(3)
V, Å3
3192.56(10)
1773.98(5)
3276.38(17)
Z
4
2
2
dвыч, г/см3
1.446
1.360
1.414
μ, мм-1
6.521
6.548
6.339
F(000)
1416.0
738.0
1420.0
Область сканирования по
6.974-155.018
7-154.382
6.656-152.336
2θ, град
-16 ≤ h ≤ 16; -19 ≤ k ≤ 19;
-14 ≤ h ≤ 14; -16 ≤ k ≤ 15;
-13 ≤ h ≤ 12; -17 ≤ k ≤ 17;
Интервалы индексов
-20 ≤ l ≤ 20
-16 ≤ l ≤ 16
-28 ≤ l ≤ 27
Общее число отражений
62286
58254
19078
Число независимых
12992 [Rint = 0.0441,
7324 [Rint = 0.0738,
13436 [Rint = 0.0363,
отражений (Rint)
Rσ = 0.0339]
Rσ = 0.0325]
Rσ = 0.0430]
GOOF
1.092
1.081
1.040
R = 0.0353,
R1 = 0.0433,
R = 0.0336,
R [I > 2σ(I)]
wR= 0.0919
wR2 = 0.0974
wR = 0.0848
R = 0.0385,
R = 0.0453,
R = 0.0393,
R (все данные)
wR= 0.0935
wR = 0.0990
wR = 0.0898
Δρmax/Δρmin, e/Å3
1.41/-0.92
0.77/-1.22
1.05/-0.90
Таблица 2. Геометрические параметры кристаллических структур комплексов 9-11
Литературные
Литературные
d, Å
ω, град
Связь
данные
Угол
данные
9
10
11
[75, 80]
9
10
11
[75, 80]
C10-N2
1.318(4)
1.315(4)
1.318(4)
1.319-1.329
Cl2Pd1C1
88.55(8)
93.00(9)
93.20(2)
86-88
C10- N3
1.330(4)
1.333(4)
1.337(3)
1.320-1.339
Cl1Pd1C10
89.89(8)
88.45(8)
89.10(7)
88-90
Pd1-C10
1.983(2)
1.985(3)
1.982(3)
1.977-1.989
Cl1Pd1Cl2
92.54(2)
92.02(3)
90.53(9)
92-94
Pd1-C1
1.923(3)
1.940(3)
1.922(3)
1.928-1.935
C1Pd1C10
89.00(11)
86.55(12)
87.21(11)
89-92
N1-C1
1.144(4)
1.148(4)
1.153(3)
1.147-1.155
N3C10N2
119.5(2)
118.5(3)
118.7(2)
116-118
водили в ДМСО-d6 (для аминов 5-7) и CDCl3 (для
граммы SHELXT (Intrinsic Phasing) [82] и уточня-
комплексов 9-11) при комнатной температуре.
ли SHELXL (метод наименьших квадратов) [83],
интегрированными в пакет OLEX2 [84]. Кристал-
Рентгеноструктурный анализ выполнен на диф-
лографические данные были депонированы в Кем-
рактометре Rigaku SuperNova с использованием
бриджском центре структурных данных (CCDC
рентгеновского излучения CuKα (λ = 0.154184 нм).
2023515-2023517) и доступны по адресу www.
Решение структур проводили с помощью про-
ccdc.cam.ac.uk/retrieving.html.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 10 2020
1572
БАЙКОВ и др.
Получение аминооксадиазолов 5-7. К раство-
cis-[PdCl2(CNXyl)2] 8 (22 мг, 0.05 ммоль). Реак-
ру бензамидоксима 1 (200 мг, 1.5 ммоль) и соот-
ционную смесь перемешивали при комнатной
ветствующего эфира аминокислоты 2-4 (150 мг,
температуре в течение 36 ч, затем фильтровали и
1 ммоль) в ДМСО (2 мл) быстро добавляли растер-
упаривали при комнатной температуре и нормаль-
тый NaOH (60 мг, 1.5 ммоль). Реакционную смесь
ном давлении. Полученный осадок промывали
перемешивали при 60°С в течение 4 ч, затем раз-
Et2O (3 × 1 мл) и оставляли сушиться на воздухе
бавляли холодной водой (20 мл). Полученный оса-
при комнатной температуре.
док отфильтровывали, промывали водой (10 мл) и
Комплекс
11 из-за меньшей реакционной
сушили при комнатной температуре.
способности исходного анилина 7 синтезирова-
4-(3-Фенил-1,2,4-оксадиазол-5-ил)анилин (5)
ли по другой методике: раствор амина 7 (12 мг,
[78]. Выход 145 мг (61%), светло-желтый поро-
0.05 ммоль) в 1,2-дихлорэтане (5 мл) добавляли
шок, т. пл. 157-158°C. Спектр ЯМР 1H, δ, м. д.:
к cis-[PdCl2(CNXyl)2] 8 (22 мг, 0.05 ммоль). Реак-
6.19 уш. с (2H, NH2), 6.72 д (2H, Ar, 3JHH = 8.4 Гц),
ционную смесь кипятили при перемешивании в
7.54-7.63 м (3Н, Ar), 7.85 д (2H, Ar, 3JHH = 8.4 Гц),
течение 48 ч, затем упаривали при комнатной тем-
8.02-8.11 м (2Н, Ar). Спектр ЯМР 13С, δС, м. д:
пературе и пониженном давлении. К остатку до-
110.0 (Ar), 114.0 (2CH, Ar), 127.2 (Ar), 127.5 (2CH,
бавляли CHCl3 (0.5 мл) и смесь кипятили 5 мин,
Ar), 129.6 (2CH, Ar), 130.2 (2CH, Ar), 131.8 (CH,
после чего фильтровали. Фильтрат упаривали при
Ar), 154.1 (Ar), 168.3 (оксадиазол), 176.5 (оксадиа-
пониженном давлении.
зол). Масс-спектр, m/z: 260.0780 [M + Na]+ (вычис-
Комплекс 9. Выход 29 мг (86%). Спектр ЯМР
лено для C14H11N3NaO+: 260.0794).
1H, δ, м. д.: 2.20 с (6H, CH3), 2.53 с (6H, CH3), 6.97
3-(3-Фенил-1,2,4-оксадиазол-5-ил)анилин
д (2H, Ar, 3JHH = 7.6 Гц), 7.14-7.25 м (4Н, Ar), 7.48-
(6). Выход 171 мг (72%), светло-желтый порошок,
7.58 м (4Н, Ar + NH), 8.13-8.21 м (4Н, Ar), 8.26 д
т. пл. 150-151°C. Спектр ЯМР 1H, δ, м. д.: 5.59 уш. с
(2H, Ar, 3JHH = 8.3 Гц), 10.62 с (1H, NH). Спектр
(2H, NH2), 6.89 д. т (1H, Ar, 3JHH = 7.2, 4JHH = 2.1 Гц),
ЯМР 13С, δС, м. д: 18.6 (2CH3), 18.7 (2CH3), 122.6
7.25-7.36 м (2Н, Ar), 7.40-7.42 м (1H, Ar), 7.57-
(Ar), 124.0 (2CH, Ar), 126.8 (2С, Ar), 127.5 (2CH,
7.65 м (3Н, Ar), 8.06-8.11 м (2H, Ar). Спектр ЯМР
Ar), 127.9 (2CH, Ar), 128.9 (2CH, Ar), 129.3 (2CH,
13С, δС, м. д: 112.7 (CH, Ar), 115.4 (CH, Ar), 119.0
Ar), 129.4 (2CH, Ar), 129.7 (Ar), 129.9 (Ar), 131.1
(CH, Ar), 124.3 (Ar), 126.8 (Ar), 127.5 (2CH, Ar),
(Ar), 131.3 (CH, Ar), 132.5 (2С, Ar), 136.0 (Ar), 136.7
129.7 (2CH, Ar), 130.5 (CH, Ar), 132.0 (СH, Ar),
(Ar), 142.9 (Ar), 169.0 (оксадиазол), 174.7 (оксади-
150.1 (Ar), 168.6 (оксадиазол), 176.6 (оксадиазол).
азол), 181.8 (карбен). Масс-спектр, m/z: 640.1091
Масс-спектр, m/z: 260.0791 [M + Na]+ (вычислено
[M
- Cl]+ (вычислено для C32H29ClN5OPd+:
для C14H11N3NaO+: 260.0794).
640.1090).
2-(3-Фенил-1,2,4-оксадиазол-5-ил)анилин (7)
Комплекс 10. Выход 31 мг (91%). Спектр ЯМР
[85]. Выход 187 мг (79%), белый порошок, т. пл.
1H, δ, м. д.: 2.21 с (6H, CH3), 2.56 с (6H, CH3), 6.89 д
131-132°С. Спектр ЯМР 1H, δ, м. д.: 6.68-6.72 м
(2H, Ar, 3JHH = 7.6 Гц), 7.05 т (1H, Ar, 3JHH = 7.6 Гц),
(1Н, Ar), 6.95-7.05 м (3H, Ar + NH2), 7.33-7.37 м
7.19-7.28 м (3Н, Ar), 7.46-7.58 м (4Н, Ar + NH), 7.75
(1H, Ar), 7.56-7.65 м (3H, Ar), 7.85 д. д (1H, Ar, 3JHH =
т (1H, Ar, 3JHH = 8.0 Гц), 7.82 с (1Н, Ar), 8.04-8.17 м
8.1, 4JHH = 1.6 Гц), 8.14-8.16 м (2Н, Ar). Спектр
(3Н, Ar), 9.01 д (1H, Ar, 3JHH = 8.0 Гц), 10.61 с (1H,
ЯМР 13С, δС, м. д: 104.0 (Ar), 116.1 (CH, Ar), 117.1
NH). Спектр ЯМР 13C, δС, м. д.: 18.6 (2CH3), 18.8
(CH, Ar), 126.7 (Ar), 127.7 (2CH, Ar), 128.9 (CH,
(2CH3), 123.0 (CH, Ar), 124.9 (Ar), 125.7 (2C, Ar),
Ar), 129.6 (2CH, Ar), 132.0 (CH, Ar), 134.5 (CH, Ar),
126.6 (Ar), 126.7 (CH, Ar), 127.5 (2CH, Ar), 127.8
149.3 (Ar), 167.8 (оксадиазол), 175.2 (оксадиазол).
(2CH, Ar), 128.9 (2CH, Ar), 129.3 (2CH, Ar), 129.7
Масс-спектр, m/z: 260.0785 [M + Na]+ (вычислено
(CH, Ar), 129.8 (CH, Ar), 130.1 (CH, Ar), 131.0 (CH,
для C14H11N3NaO+: 260.0794).
Ar), 131.4 (CH, Ar), 132.5 (2C, Ar), 136.0 (Ar), 136.7
Синтез карбеновых комплексов 9-11. Ком-
(Ar), 140.2 (Ar), 168.9 (оксадиазол), 174.4 (оксади-
плексы 9 и 10 получали по следующей мето-
азол), 182.2 (карбен). Масс-спектр, m/z: 640.1070
дике: раствор соответствующего амина 5 или 6
[M
- Cl]+ (вычислено для C32H29ClN5OPd +:
(12 мг, 0.05 ммоль) в CHCl3 (3 мл) добавляли к
640.1090).
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 10 2020
СИНТЕЗ И ИЗУЧЕНИЕ СТРОЕНИЯ
1573
Комплекс 11. Выход 17 мг (49%). Спектр ЯМР
Organometallics. 2009. Vol. 28. N 22. P. 6559. doi
10.1021/om900682v
1H, δ, м. д. 2.41 с (6H, CH3), 2.62 с (6H, CH3), 6.96
8. Kinzhalov M.A., Luzyanin K.V., Boyarskiy V.P., Haukka M.,
т (1H, Ar, 3JHH = 7.6 Гц), 7.21 д (2Н, Ar 3JHH =
Kukushkin V.Y. // Organometallics. 2013. Vol. 32. N 18.
7.6 Гц), 7.27-7.35 м (3H, Ar), 7.41-7.49 м (3Н, Ar),
P. 5212. doi 10.1021/om4007592
7.51-7.58 м (4H, Ar), 7.76 д (1Н, Ar, 3JHH = 7.3 Гц),
9. Хайбулова Т.С., Боярская И.А., Боярский В.П. //
7.80 д (1Н, Ar, 3JHH = 7.3 Гц), 9.89 с (1H, NH),
ЖОрХ. 2013. Т. 49. Вып. 3. С. 373; Khaibulova T.S.,
Boyarskaya I.A., Boyarskii V.P. // Russ. J. Org.
10.35 с (1H, NH). Спектр ЯМР 13С, δС, м. д: 18.4
Chem. 2013. Vol. 49. N 3. P. 360. doi 10.1134/
(2CH3), 19.0 (2CH3), 106.8 (Ar), 122.7 (Ar), 124.0
S1070428013030081
(CH, Ar), 126.0 (2C, Ar), 127.4 (2CH Ar), 127.5 (CH,
10. Боярская Д.В., Боярский В.П. // ЖОХ. 2016. Т. 86.
Ar), 128.2 (2CH, Ar), 128.7 (2CH, Ar), 128.8 (CH,
Вып. 9. С. 1466; Boyarskaya D.V., Boyarskii V.P. //
Russ. J. Gen. Chem. 2016. Vol. 86. N 9. P. 2033. doi
Ar), 128.9 (CH, Ar), 129.2 (2CH, Ar), 130.1 (CH,
10.1134/S1070363216090085
Ar), 131.3 (CH, Ar), 133.0 (2C, Ar), 135.4 (Ar), 136.0
11. Михайлов В.Н., Савичева Е.А., Сорокоумов В.Н.,
(Ar), 142.9 (Ar), 143.0 (CH, Ar), 152.8 (Аr), 167.6
Боярский В.П. // ЖОрХ. 2013. Т. 49. Вып. 4. С. 567;
(оксадиазол), 174.1 (оксадиазол), 194.3 (карбен).
Mikhailov V.N., Savicheva E.A., Sorokoumov V.N.,
Масс-спектр, m/z: 640.1072 [M - Cl]+ (вычислено
Boyarskii V.P. // Russ. J. Org. Chem. 2013. Vol. 49.
N 4. P. 551. doi 10.1134/S107042801304009X
для C32H29ClN5OPd+: 640.1090).
12. Miltsov S., Karavan V., Boyarsky V., Gómez-de Pedro S.,
ФОНДОВАЯ ПОДДЕРЖКА
Alonso-Chamarro J., Puyol M. // Tetrahedron Lett. 2013.
Vol. 54. N 10. P. 1202. doi 10.1016/j.tetlet.2012.12.060
Работа выполнена при финансовой поддерж-
13. Mikhaylov V.N., Sorokoumov V.N., Korvinson K.A.,
ке Совета по грантам Президента Российской
Novikov A.S., Balova I.A. // Organometallics. 2016. Vol. 35.
N 11. P. 1684. doi 10.1021/acs.organomet.6b00144
Федерации (грант МК-1074.2020.3) с использо-
14. Chay R.S., Luzyanin K.V., Kukushkin V.Y., Guedes da
ванием оборудования ресурсных центров Санкт-
Silva M.F.C., Pombeiro A.J.L. // Organometallics. 2012.
Петербургского государственного университета
Vol. 31. N 6. P. 2379. doi 10.1021/om300020j
«Магнитнорезонансные методы исследования»,
15. Chay R.S., Luzyanin K.V. // Inorg. Chim. Acta. 2012.
«Методы анализа состава вещества» и «Рентгено-
Vol. 380. P. 322. doi 10.1016/j.ica.2011.09.047
16. Valishina E.A., Guedes da Silva M.F.C., Kinzhalov M.A.,
дифракционные методы исследования».
Timofeeva S.A., Buslaeva T.M., Haukka M., Pom-
КОНФЛИКТ ИНТЕРЕСОВ
beiro A.J.L., Boyarskiy V.P., Kukushkin V.Y., Luzya-
nin K.V. // J. Mol. Catal. (A). 2014. Vol. 395. P. 162. doi
Авторы заявляют об отсутствии конфликта
10.1016/j.molcata.2014.08.018
интересов.
17. Timofeeva S.A., Kinzhalov M.A., Valishina E.A., Luzya-
nin K.V., Boyarskiy V.P., Buslaeva T.M., Haukka M.,
СПИСОК ЛИТЕРАТУРЫ
Kukushkin V.Y. // J. Catal. 2015. Vol. 329. P. 449. doi
10.1016/j.jcat.2015.06.001
1. Vignolle J., Cattoën X., Bourissou D. // Chem. Rev.
18. Savicheva E.A., Kurandina D.V., Nikiforov V.A.,
2009. Vol. 109. N 8. P. 3333. doi 10.1021/cr800549j
Boyarskiy V.P. // Tetrahedron Lett. 2014. Vol. 55. N 13.
2. Slaughter L.M. // ACS Catal. 2012. Vol. 2. N 8. P. 1802.
P. 2101. doi 10.1016/j.tetlet.2014.02.044
doi 10.1021/cs300300y
19. Боярский В.П. // ЖОХ. 2017. Т. 87. Вып. 8. С. 1247;
3. Boyarskiy V.P., Bokach N.A., Luzyanin K.V., Kukush-
Boyarskii V.P. // Russ. J. Gen. Chem. 2017. Vol. 87.
kin V.Y. // Chem. Rev. 2015. Vol. 115. N 7. P. 2698. doi
N 8. P. 1663. doi 10.1134/S1070363217080035
10.1021/cr500380d
20. Ryabukhin D.S., Sorokoumov V.N., Savicheva E.A.,
4. Tšupova S., Rudolph M., Rominger F., Hashmi A.S.K. //
Boyarskiy V.P., Balova I.A., Vasilyev A.V. // Tetrahedron
Adv. Synth. Catal. 2016. Vol. 358. N 24. P. 3999. doi
Lett. 2013. Vol. 54. N 19. P. 2369. doi 10.1016/j.
10.1002/adsc.201600615
tetlet.2013.02.086
5. Кинжалов М.А., Боярский В.П. // ЖОХ. 2015. Т. 85.
21. Mikhaylov V.N., Sorokoumov V.N., Liakhov D.M.,
Вып. 10. С. 1681; Kinzhalov M.A., Boyarskii V.P. //
Tskhovrebov A.G., Balova I.A. // Catalysts. 2018.
Russ. J. Gen. Chem. 2015. Vol. 85. N 10. P. 2313. doi
Vol. 8. N 4. P. 141. doi 10.3390/catal8040141
10.1134/S1070363215100175
22. Валишина Е.А., Буслаева Т.М., Лузянин К.В. // Изв.
6. Kinzhalov M.A., Luzyanin K.V. // Coord. Chem.
АН. Сер. хим. 2013. Т. 62. № 6. С. 1361; Valishi-
Rev. 2019. Vol. 399. P. 213014. doi 10.1016/j.
na E.A., Buslaeva T.M., Luzyanin K.V. // Russ. Chem.
ccr.2019.213014
Bull. 2013. Vol. 62. N 6. P. 1361. doi 10.1007/s11172-
7. Luzyanin K.V., Tskhovrebov A.G., Carias M.C., Guedes
013-0193-z
da Silva M.F.C., Pombeiro A.J.L., Kukushkin V.Y. //
23. Singh C., Prakasham A.P., Ghosh P. // ChemistrySelect.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 10 2020
1574
БАЙКОВ и др.
2019. Vol. 4. N 1. P. 329. doi 10.1002/slct.201803292
Mikherdov A.S., Tiuftiakov N.Y., Polukeev V.A.,
24. Singh C., Prakasham A.P., Gangwar M.K., Butcher R.J.,
Boyarskii V.P. // Russ. J. Gen. Chem. 2018. Vol. 88. N
Ghosh P. // ACS Omega. 2018. Vol. 3. N 2. P. 1740. doi
4. P. 713. doi 10.1134/S1070363218040151
10.1021/acsomega.7b01974
40. Gee J.C., Fuller B.A., Lockett H-M, Sedghi G.,
25. Dhudshia B., Thadani A.N. // Chem. Commun. 2006.
Robertson C.M., Luzyanin K.V. // Chem. Commun.
N 6. P. 668. doi 10.1039/b516398f
2018. Vol. 54. N 68. P. 9450. doi 10.1039/C8CC04287J
26. Boyarskiy V.P., Luzyanin K.V., Kukushkin V.Y. // Coord.
41. Biernacki K., Daśko M., Ciupak O., Kubiński K.,
Chem. Rev. 2012. Vol. 256. N 17. P. 2029. doi 10.1016/j.
Rachon J., Demkowicz S. // Pharmaceuticals. 2020.
ccr.2012.04.022
Vol. 13. N 6. P. 111. doi 10.3390/ph13060111
27. Михердов А.С., Байков С.В., Проскурина И.К., Шет-
42. Pace A., Buscemi S., Palumbo Piccionello A., Pibiri I. //
нев А.А., Котов А.Д. // ЖОХ. 2019. Т. 89. Вып. 10.
Adv. Heterocycl. Chem. 2015. Vol. 116. P. 85. doi
С. 1572; Mikherdov A.S., Baikov S.V., Proskurina I.K.,
10.1016/bs.aihch.2015.05.001
Shetnev A.A., Kotov A.D. // Russ. J. Gen. Chem. 2019.
43. Welch E.M., Barton E.R., Zhuo J., Tomizawa Y., Frie-
Vol. 89. N 10. P. 2062. doi 10.1134/S1070363219100128
sen W.J., Trifillis P., Paushkin S., Patel M., Trotta C.R.,
28. Serebryanskaya T.V., Kinzhalov M.A., Bakulev V.,
Hwang S., Wilde R.G., Karp G., Takasugi J., Chen G.,
Alekseev G., Andreeva A., Gushchin P.V., Protas A.V.,
Jones S., Ren H., Moon Y.-C., Corson D. // Nature.
Smirnov A.S., Panikorovskii T.L., Lippmann P, Ott I.
2007. Vol. 447. N 7140. P. 87. doi 10.1038/nature05756
Verbilo C.M., Zuraev A.V., Bunev A.S., Boyarskiy V.P.,
44. Lanier G., Sankholkar K., Aronow W.S. // Am.
Kasyanenko N.A. // New. J. Chem. 2020. Vol. 44. N 15.
J. Ther. 2014. Vol. 21. N 5. P. 419. doi 10.1097/
P. 5762. doi 10.1039/D0NJ00060D
MJT.0b013e31824a0ed7
29. Bertrand B., Romanov A.S., Brooks M., Davis J.,
45. Hale M., Wild J., Reddy J., Yamada T., Arjona Fer-
Schmidt C., Ott I., O’Connell M., Bochmann M. //
reira J.C. // Lancet Gastroenterol Hepatol. 2017. Vol. 2.
Dalton Trans. 2017. Vol. 46. N 45. P. 15875. doi
N 8. P. 555. doi 10.1016/S2468-1253(17)30105-X
10.1039/C7DT03189K
46. Krasavin M., Shetnev A., Sharonova T., Baykov S.,
30. Williams, M., Green A.I., Fernandez-Cestau J.,
Kalinin S., Nocentini A., Sharoyko V., Poli G.,
Hughes D.L., O’Connell M.A., Searcey M., Bertrand B.,
Tuccinardi T., Presnukhina S., Tennikova T.B., Supu-
Bochmann M. // Dalton Trans. 2017. Vol. 46. N 39.
ran C.T. // Eur. J. Med. Chem. 2019. Vol. 164. P. 92. doi
P. 13408. doi 10.1039/C7DT02804K
10.1016/j.ejmech.2018.12.049
31. Ivanov D.M., Kinzhalov M.A., Novikov A.S., Ana-
47. Krasavin M., Lukin A., Vedekhina T., Manicheva O.,
nyev I.V., Romanova A.A., Boyarskiy V.P., Haukka M.,
Dogonadze M., Vinogradova T., Zabolotnykh N.,
Kukushkin V.Y. // Cryst. Growth. Des. 2017. Vol. 17.
Rogacheva E., Kraeva L., Sharoyko V., Tennikova T., B.
N 3. P. 1353. doi 10.1021/acs.cgd.6b01754
Dar’in D., Sokolovich E. // Eur. J. Med. Chem. 2019.
32. Kinzhalov M.A., Baykov S.V., Novikov A.S., Haukka M.,
Vol. 166. P. 125. doi 10.1016/j.ejmech.2019.01.050
Boyarskiy V.P. // Z. Kristallogr. Cryst. Mater. 2019.
48. Atmaram Upare A., Gadekar P.K., Sivaramakrishnan H.,
Vol. 234. N 3. P. 155. doi 10.1515/zkri-2018-2100
Naik N., Khedkar V.M., Sarkar D., Choudhari A.,
33. Rassadin V.A., Yakimanskiy A.A., Eliseenkov E.V.,
Mohana Roopan S. // Bioorg. Chem. 2019. Vol. 86.
Boyarskiy V.P. // Inorg. Chem. Commun. 2015. Vol. 61.
P. 507. doi 10.1016/j.bioorg.2019.01.054
P. 21. doi 10.1016/j.inoche.2015.08.008
49. Abdel hameid M.K., Mohammed M.R. // Bioorg. Chem.
34. Anisimova T.B., Guedes da Silva M.F.C., Kukushkin V.Y.,
2019. Vol. 86. P. 609. doi 10.1016/j.bioorg.2019.01.067
Pombeiro A.J.L., Luzyanin K.V. // Dalton Trans. 2014.
50. Caneschi W., Enes K.B., Carvalho de Mendonça C., de
Vol. 43. N 42. P. 15861. doi 10.1039/C4DT01917B
Souza Fernandes F., Miguel, F.B., da Silva Martins J.,
35. Tskhovrebov A.G., Luzyanin K.V., Dolgushin F.M.,
Costa Couri M.R. // Eur. J. Med. Chem. 2019. Vol. 165.
Guedes da Silva M.F.C., Pombeiro A.J.L., Kukush-
P. 18. doi 10.1016/j.ejmech.2019.01.001
kin V.Y. // Organometallics. 2011. Vol. 30. N 12. P. 3362.
51. Salassa G., Terenzi A. // Int. J. Mol. Sci. 2019. Vol. 20.
doi 10.1021/om2002574
N. 14. P. 3483. doi 10.3390/ijms20143483
36. Kinzhalov M.A., Timofeeva S.A., Luzyanin K.V.,
52. Mayer J.C.P., Sauer A.C., Iglesias B.A., Acunha T.V.,
Boyarskiy V.P., Yakimanskiy A.A., Haukka M.,
Back D.F., Rodrigues O.E.D., Dornelles L. // J.
Kukushkin V.Y. // Organometallics. 2016. Vol. 35. N 2.
Organomet. Chem. 2017. Vol. 841. P. 1. doi 10.1016/j.
P. 218. doi 10.1021/acs.organomet.5b00936
jorganchem.2017.04.014.
37. Luzyanin K.V., Pombeiro A.J.L., Haukka M., Kukush-
53. Terenzi A., Barone G., Palumbo Piccionello A., Giorgi G.,
kin V.Y. // Organometallics. 2008. Vol. 27. N 20. P. 5379.
Guarcello A., Portanova P., Calvaruso G., Buscemi S.,
doi 10.1021/om800517c
Vivona N., Pace A. // Dalton Trans. 2010. Vol. 39. N 38.
38. Михердов А.С., Орехова Ю.А., Боярский В.П. // ЖОХ.
P. 9140. doi 10.1039/c0dt00266f
2018 Т. 88. Вып. 10. С. 1677; Mikherdov A.S., Orekho-
54. Maftei C.V., Fodor E., Jones P.G., Freytag M.,
va Y.A., Boyarskii V.P. // Russ. J. Gen. Chem. 2018.
Franz M.H., Kelter G., Fiebig H.H., Tamm M., Neda I. //
Vol. 88. N 10. P. 2119. doi 10.1134/S1070363218100158
Eur. J. Med. Chem. 2015. Vol. 101 N 1. P. 431. doi
39. Михердов А.С.,Тюфяков Н.Ю., Полукеев В.А., Бо-
10.1016/j.ejmech.2015.06.053
ярский В.П. // ЖОХ. 2018 Т. 88. Вып. 4. С. 631;
55. Kumari S., Carmona A.V., Tiwari A.K., Trippier P.C. // J.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 10 2020
СИНТЕЗ И ИЗУЧЕНИЕ СТРОЕНИЯ
1575
Med. Chem. 2020. doi 10.1021/acs.jmedchem.0c00530
va Z., Korsakov M., Petzer A., Engelbrecht I., Petzer J.P. //
56. Bokach N.A., Khripoun A.V., Kukushkin V.Y., Hauk-
Bioorg. Med. Chem. Lett. 2019.Vol. 29. N 1. P. 40. doi
ka M., Pombeiro A.J.L. // Inorg. Chem. 2003. Vol. 42.
10.1016/j.bmcl.2018.11.018
N 3. P. 896. doi 10.1021/ic026103v
57. Klapötke T.M., Mayr N., Stierstorfer J., Weyrauther M. //
73. Shetnev A., Baykov S., Kalinin S., Belova A., Sharoyko V.,
Chem. Eur. J. 2014. Vol. 20. N 5. P. 1410. doi 10.1002/
Rozhkov A., Zelenkov L., Tarasenko M., Sadykov E.,
chem.201303825
Korsakov M., Krasavin M. // Int. J. Mol. Sci. 2019.
58. Klingele J., Kaase D., Schmucker M., Meier L. // Eur.
Vol. 20. N 7. P. 1699. doi 10.3390/ijms20071699
J. Inorg. Chem. 2013. Vol. N 28 P. 4931. doi 10.1002/
ejic.201300511
74. Mikhaylov V.N., Sorokoumov V.N., Novikov A.S., Mel-
59. Terenzi A., Barone G., Palumbo Piccionello A., Giorgi G.,
nik M.V., Tskhovrebov A.G., Balova I.A. // J. Organomet.
Guarcello A., Pace A. // Inorganica Chim. Acta. 2011.
Chem. 2020. Vol. 912. P. 121174. doi 10.1016/j.
Vol. 373. N 1. P. 62. doi 10.1016/j.ica.2011.03.057
jorganchem.2020.121174
60. Bokach N.A., Kukushkin V.Y., Haukka M., Pom-
beiro A.J.L. // Eur. J. Inorg. Chem. 2005. Vol. 2. N 5.
75. Kinzhalov M.A., Boyarskiy V.P., Luzyanin K.V.,
P. 845. doi 10.1002/ejic.200400580
Dolgushin F.M., Kukushkin V.Y. // Dalton Trans. 2013.
61. Richardson C., Steel P.J. // Inorg. Chem. Commun. 2007.
Vol. 42. N 29. P. 10394. doi 10.1039/c3dt51335a
Vol. 10. N 8. P. 884. doi 10.1016/j.inoche.2007.04.020
76. Кинжалов М.А., Лузянин К.В., Боярский В.П., Хаук-
62. Тарасенко М.В., Кофанов Е.Р., Байков С.В., Кра-
совская Г.Г., Данилова А.С. // ЖОрХ. 2017. Т. 53.
ка М., Кукушкин В.Ю. // Изв. АН. Сер. Хим. 2013.
Вып. 7. С. 1072; Tarasenko M.V., Kofanov E.R.,
Т. 3. С. 757; Kinzhalov M.A., Luzyanin K.V., Boyarskiy
Baikov S.V., Krasovskaya G.G, Danilova A.S. // Russ.
V.P., Haukka M., Kukushkin V.Y. // Russ. Chem. Bull.
J. Org. Chem. 2017. Vol. 53. N 7. P. 1085. doi 10.1134/
S1070428017070211
2013. Vol. 62. N 3. P. 758. doi 10.1007/s11172-013-
63. Dokla E.M.E., Fang C-S., Abouzid K.A.M., Chen C.S. //
0103-4
Eur. J. Med. Chem. 2019. Vol. 182. P. 111607. doi
77. Conole D., Beck T.M., Jay-Smith M., Tingle M.D.,
10.1016/j.ejmech.2019.111607
Eason C.T., Brimble M.A., Rennison D. // Bioorg.
64. Maftei C.V., Fodor E., Jones P.G., Franz M.H., Kelter G.,
Fiebig H., Neda I. // Beilstein J. Org. Chem. 2013. Vol. 9.
Med. Chem. 2014. Vol. 22. N 7. P. 2220. doi 10.1016/j.
P. 2202. doi 10.3762/bjoc.9.259
bmc.2014.02.013
65. Pathak S.K., Nath S., De J, Pal S.K., Achalkumar A.S. //
78. Luzyanin K.V., Guedes da Silva M.F.C., Kukushkin V.Y.,
New J. Chem. 2017. Vol. 41. N 18. P. 9908. doi 10.1039/
Pombeiro A.J.L. // Inorg. Chim. Acta. 2009. Vol. 362.
C7NJ01766A
66. O’Daniel P.I., Peng Z., Pi H., Testero S.A, Ding D.,
N 3. P. 833. doi 10.1016/j.ica.2008.02.026
Spink E., Leemans E., Boudreau M.A., Yamaguchi T.,
79. Kinzhalov M.A., Kashina M.V., Mikherdov A.S.,
Schroeder V.A., Wolter W.R., Llarrull L.I., Song W.,
Mozheeva E.A., Novikov A.S., Smirnov A.S., Ivanov D.M.,
Lastochkin E., Kumarasiri M., Antunes N.T., Espahbodi M.,
Kryukova M.A., Ivanov A.Y., Smirnov S.N., Kukush-
Lichtenwalter K. // J. Am. Chem. Soc. 2014. Vol. 136.
N 9. P. 3664. doi 10.1021/ja500053x
kin V.Y., Luzyanin K.V. // Angew. Chem. Int. Ed. 2018.
67. Liu J., Li H., Chen K-X., Zuo J.-P., Guo Y.-W., Tang W.,
Vol. 57. N 39. P. 12785. doi 10.1002/anie.201807642
Li X.-W. // J. Med. Chem. 2018. Vol. 61. N 24. P. 11298.
80. Srivastava R.M., Pereira M.C., Faustino W.W.M.,
doi 10.1021/acs.jmedchem.8b01430
68. Sharonova T., Pankrat’eva V., Savko P., Baykov S.,
Coutinho K., Dos Anjos J.V., De Melo S.J. // Monatsh.
Shetnev A. // Tetrahedron Lett. 2018. Vol. 59. N 29.
Chem. 2009. Vol. 140. N 11. P. 1319. doi 10.1007/
P. 2824. doi 10.1016/j.tetlet.2018.06.019
s00706-009-0186-7.
69. Tarasenko M., Duderin N., Sharonova T., Baykov S.,
81. Sheldrick G.M. // Acta Crystallogr. (A). 2015. Vol. 71.
Shetnev A., Smirnov A.V. // Tetrahedron Lett. 2017.
Vol. 58. N 37. P. 3672. doi 10.1016/j.tetlet.2017.08.020
N 1. P. 3. doi 10.1107/S2053273314026370
70. Панкратьева В.Е., Шаронова Т.В., Тарасенко М.В.,
82. Sheldrick G.M. // Acta Crystallogr. (C). 2015. Vol. 71.
Байков С.В., Кофанов Е.Р. / ЖОрХ. 2018. Т. 54.
N 1. P. 3. doi 10.1107/S2053229614024218
Вып. 8. С. 1236; Pankrat’eva V.E., Sharonova T.V.,
83. Dolomanov O.V., Bourhis L.J., Gildea R.J., Ho-
Tarasenko M.V., Baikov S.V., Kofanov E.R. // Russ. J.
Org. Chem. 2018. Vol. 54. N 8. P. 1250. doi 10.1134/
ward J.A.K., Puschmann H. // J. Appl. Crystallogr. 2009.
S1070428018080213
Vol. 42. N 2. P. 339. doi 10.1107/S0021889808042726
71. Baykov S., Sharonova T., Shetnev A., Rozhkov S.,
84. Draghici B., El-Gendy B., Katritzky A. // Synthesis.
Kalinin S., Smirnov A.V. // Tetrahedron. 2017. Vol. 73.
2012. Vol. 2012. N 4. P. 547. doi 10.1055/s-0031-
N. 7. P. 945. doi 10.1016/j.tet.2017.01.007
72. Shetnev A., Osipyan A., Baykov S., Sapegin A., Chirko-
1289673
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 10 2020
1576
БАЙКОВ и др.
Synthesis and Study of the Structure
of Palladium(II) Acyclic Diaminocarbene Complexes
Containing a 1,2,4-Oxadiazole Moiety
S. V. Baikova,*, Yu. A. Trukhanovb, M. V. Tarasenkoc, and M. A. Kinzhalova
a St. Petersburg State University, St. Petersburg, 199034 Russia
b St. Petersburg State University of Chemistry and Pharmacy, St. Petersburg, 197376 Russia
c M.V. Dorogov Center for Transfer of Pharmaceutical Technologies, K.D. Ushinskii Yaroslavl State Pedagogical
University, Yaroslavl, 150000 Russia
* e-mail: sergei.v.baikov@yandex.ru
Received August 19, 2020; revised August 19, 2020; accepted August 24, 2020
The reaction of anilines containing a 1,2,4-oxadiazole moiety with the bis(xylylisocyanide) Pd(II) complex
leads to the formation of acyclic diaminocarbene complexes. The oxadiazole ring is not involved in the reaction.
Composition and structure of the obtained complexes were confirmed by means of mass spectrometry, NMR
spectroscopy methods and single crystal X-ray diffraction data.
Keywords: acyclic diaminocarbene palladium complexes, oxadiazoles, isocyanide ligands, π-π-stacking
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 10 2020