ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2020, том 90, № 10, с. 1577-1582
УДК 546.865;547.53.024;548.312.5
ТРИС(2-МЕТОКСИ-5-ХЛОРФЕНИЛ)СУРЬМА: СИНТЕЗ
И РЕАКЦИИ ОКИСЛИТЕЛЬНОГО ПРИСОЕДИНЕНИЯ
© 2020 г. В. В. Шарутин*, О. К. Шарутина
Национальный исследовательский Южно-Уральский государственный университет,
пр. Ленина 76, Челябинск, 454080 Россия
*e-mail: vvsharutin@rambler.ru
Поступило в Редакцию 1 июня 2020 г.
После доработки 1 июня 2020 г.
Принято к печати 15 июня 2020 г.
Взаимодействием 2-метокси-5-хлорфениллития с SbCl3 (3:1) в диэтиловом эфире синтезирована трис-
(2-метокси-5-хлорфенил)сурьма, кристаллизующаяся из бензола в виде сольвата. Обработка сольва-
та бромом в хлороформе приводит к образованию дибромида трис(2-метокси-5-хлорфенил)сурьмы,
выделенного из бензола также в форме сольвата. Продукт аналогичной реакции с хлором - дихлорид
трис(2-метокси-5-хлорфенил)сурьмы - получен также окислением трис(2-метокси-5-хлорфенил)сурь-
мы дихлоридом меди в ацетоне. Особенности строения полученных соединений установлены методом
рентгеноструктурного анализа.
Ключевые слова: трис(2-метокси-5-хлорфенил)сурьма, дибромид и дихлорид трис(2-метокси-5-хлор-
фенил)сурьмы, рентгеноструктурный анализ
DOI: 10.31857/S0044460X20100133
Наиболее изучены арилпроизводные сурьмы с
получали литированием п-хлоранизола фенилли-
фенильным и, в меньшей степени, с 4-метилфе-
тием в эфире по описанной методике [13, 14].
нильным лигандами [1]. Вакантные d-орбитали
Взаимодействие соединения 1 с раствором бро-
у атома сурьмы способны образовывать допол-
ма в хлороформе приводит к образованию дибро-
нительные координационные связи с лигандами,
мида трис(2-метокси-5-хлорфенил)сурьмы, выде-
имеющими потенциальные координирующие цен-
ленного после перекристаллизации из бензола в
тры, что приводит к увеличению координационно-
виде сольвата (2-MeO-5-ClC6H3)3SbBr2·0.5PhH 2.
го числа центрального атома и влияет на свойства
Дихлорид трис(2-метокси-5-хлорфенил)сурьмы 3
соединения, в том числе на реакционную способ-
получали пропусканием хлора через раствор три-
ность. Известные арилпроизводные сурьмы с та-
с(2-метокси-5-хлорфенил)сурьмы 1 в хлороформе
кими потенциальными координирующими центра-
или обработкой соединения 1 дихлоридом меди в
ми, как атомы азота [2-9] или кислорода [10-19] в
ацетоне.
фенильных заместителях, немногочисленны.
Триорганилсурьма и ее дигалогениды исполь-
С целью исследования арилпроизводных вы-
зуются как прекурсоры для синтеза других клас-
сококоординированной сурьмы(III) нами впервые
сов органических соединений сурьмы(V) [20-22].
получена трис(2-метокси-5-хлорфенил)сурьма,
Соединения 1-3 - высокоплавкие бесцветные
изучены ее реакции с галогенами и установлены
кристаллические вещества, устойчивые к дей-
особенности строения синтезированных соедине-
ний.
Схема 1.
Трис(2-метокси-5-хлорфенил)сурьма
1 по-
лучена из 2-метокси-5-хлорфениллития и SbCl3
(схема 1). Исходное арильное соединение лития
1577
1578
ШАРУТИН, ШАРУТИНА
Таблица 1. Кристаллографические данные, параметры эксперимента и уточнения структуры соединений 1-3
Параметр
1
2
3
Брутто-формула
C24H21Cl3O3Sb
C24H21Br2Cl3O3Sb
C21H18Cl5O3Sb
М
585.51
745.33
617.35
Сингония
Моноклинная
Триклинная
Моноклинная
Пространственная группа
P21/n
P-1
P21/n
a, Å
8.899(3)
8.847(15)
8.452(2)
b, Å
21.324(12)
12.59(3)
22.087(8)
c, Å
13.703(5)
14.13(3)
13.133(3)
α, град
90.00
64.40(9)
90.00
β, град
107.413(13)
87.29(6)
90.568(11)
γ, град
90.00
88.93(8)
90.00
V, Å3
2481.1(19)
1417(5)
2451.5(13)
Z
4
2
4
dвыч, г/см3
1.567
1.746
1.673
μMo, мм-1
1.458
4.098
1.690
F(000)
1164.0
722.0
1216.0
Размер кристалла, мм
0.6 × 0.35 × 0.16
0.32 × 0.31 × 0.25
0.46 × 0.4 × 0.22
2θ, град
6.14 - 78.98
5.98 - 60.42
6.08 - 86.72
Интервалы индексов
-15 ≤ h ≤ 15,
-12 ≤ h ≤ 12,
-16 ≤ h ≤ 16,
-38 ≤ k ≤ 37,
-17 ≤ k ≤ 17,
-42 ≤ k ≤ 42,
-24 ≤ l ≤ 22
-19 ≤ l ≤ 19
-20 ≤ l ≤ 25
Всего отражений
93900
76049
114884
Независимых отражений
14793
8198
18438
Rint
0.0510
0.0424
0.0487
Число уточняемых параметров
283
301
274
GOOF
1.083
1.060
1.057
R-Факторы по F2 > 2σ
R1 = 0.0513,
R1 = 0.0345,
R1 = 0.0561,
wR2 = 0.0964
wR2 = 0.0813
wR2 = 0.1151
R-Факторы по всем отражениям
R1 = 0.0968,
R1 = 0.0571,
R1 = 0.1091,
wR2 = 0.1105
wR2 = 0.0896
wR2 = 0.1365
Остаточная электронная плотность
0.44/-1.35
0.76/-1.03
0.93/-1.99
(max/min), e/Å3
ствию влаги и кислорода воздуха, хорошо рас-
да метоксигрупп к атому металла [внутримолеку-
творимые в ароматических углеводородах, че-
лярные расстояния Sb∙∙∙OМе 3.053(1), 3.054(1) и
тыреххлористом углероде, тетрагидрофуране,
3.011(1) Å] его координационное число возрастает
хлороформе. В ИК спектрах соединений 1-3 на-
до 6. Внутримолекулярные контакты приводят к
блюдаются интенсивные полосы валентных ко-
уменьшению валентных углов в соединении 1 по
лебаний около 450 (Sb-C), 1250 (О-C), 1460 (Ar),
сравнению с молекулами трифенил- и три(4-ме-
2835 (H-CAlk), 3050 см-1 (H-CAr).
тилфенил)сурьмы (95.52-97.36 [23] и 97.31° [24]
соответственно), в которых такие контакты отсут-
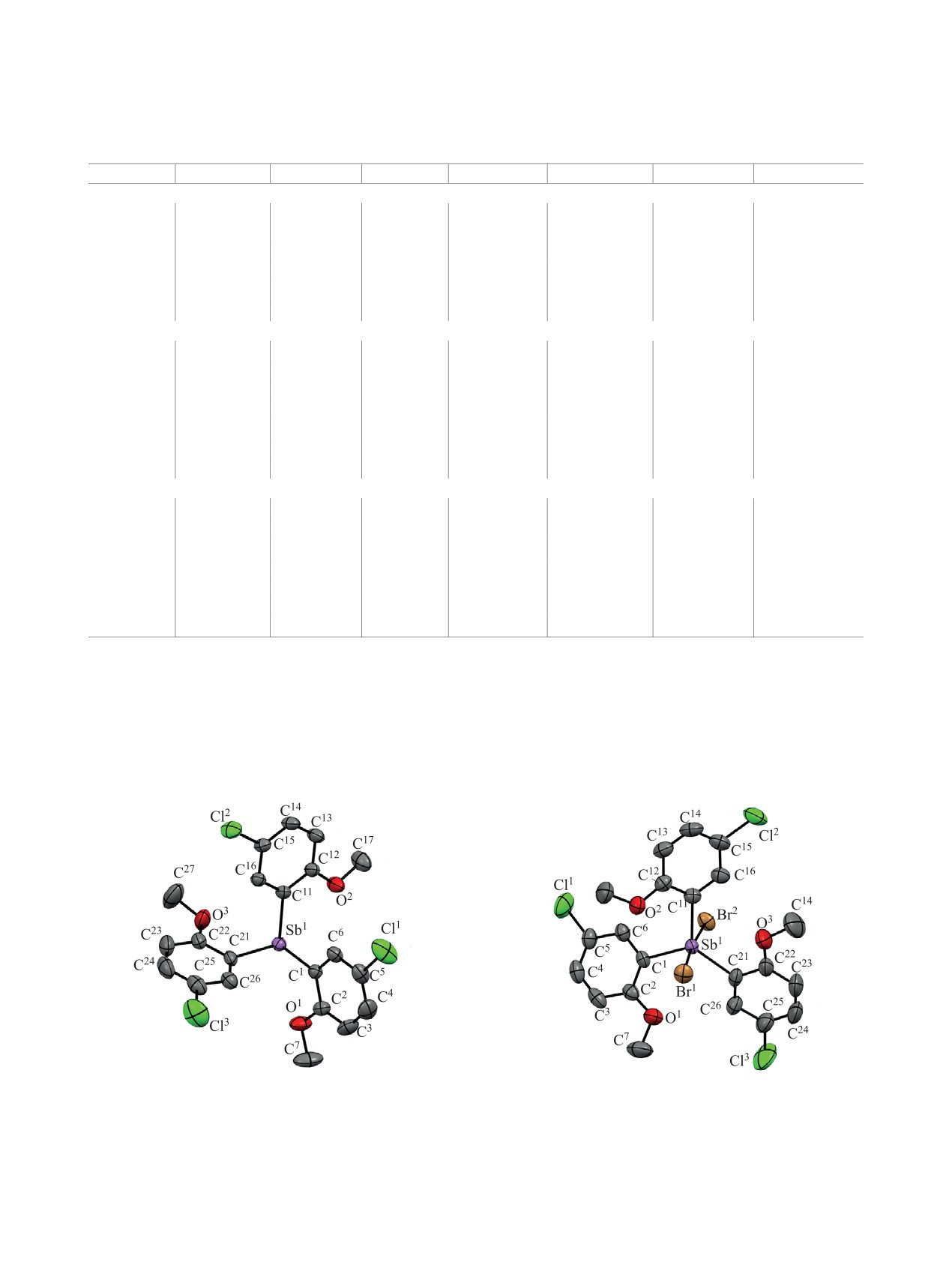
По данным РСА (табл. 1, 2), в кристалле сое-
ствуют. В молекуле трис(2-метокси-5-бромфенил)-
динения 1 атомы сурьмы в первом приближении
сурьмы валентные углы и расстояния Sb∙∙∙O {ω =
имеют тригональное окружение лигандов и непо-
92.19(6), 94.23(6), 94.52(6)°, d = 2.985(1), 3.051(1),
деленную электронную пару (рис. 1). Соединение
3.052(1) Å [13]} близки к найденным для соедине-
1 изоструктурно трис(2-метокси-5-бромфенил)-
ния 1.
сурьме (сольват с бензолом) [13]. Длины связей
Sb-C равны 2.167(2), 2.174(2) и 2.166(2) Å, а ва-
Атомы сурьмы в молекулах соединений 2, 3
лентные углы CSbC составляют 92.30(7), 94.70(8),
имеют мало искаженную тригонально-бипирами-
94.63(8)°. С учетом координации атомов кислоро-
дальную координацию с аксиально расположен-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 10 2020
ТРИС(2-МЕТОКСИ-5-ХЛОРФЕНИЛ)СУРЬМА
1579
Таблица 2. Основные длины связей и валентных углов в молекулах соединений 1-3
Связь
d, Å
Связь
d, Å
Угол
ω, град
Угол
ω, град
1a
Sb1-C1
2.167(2)
O1-C2
1.372(3)
C1Sb1C11
94.70(8)
C2C1Sb1
117.46(15)
Sb1-C11
2.174(2)
O1-C7
1.426(3)
C21Sb1C1
94.63(8)
C6C1Sb1
123.96(15)
Sb1-C21
2.166(2)
O2-C12
1.374(3)
C21Sb1C11
92.30(7)
C12C11Sb1
117.23(14)
Сl1-C5
1.751(3)
O2-C17
1.423(3)
C2O1C7
118.3(2)
C16C11Sb1
124.24(14)
Сl2-C15
1.750(2)
O3-C22
1.379(3)
C12O2C17
117.68(18)
C22C21Sb1
115.58(17)
Сl3-C25
1.757(3)
O3-C27
1.434(4)
C22O3C27
118.8(2)
C26C21Sb1
125.16(16)
2б
Sb1-Br1
2.594(4)
Сl3-C25
1.738(6)
Br1Sb1Br2
174.26(2)
C11Sb1C21
125.01(18)
Sb1-Br2
2.681(5)
O1-C2
1.373(5)
C1Sb1Br1
96.46(13)
C21Sb1Br1
89.84(13)
Sb1-C1
2.143(5)
O1-C7
1.434(5)
C1Sb1Br2
87.50(13)
C21Sb1Br2
84.51(13)
Sb1-C11
2.135(5)
O2-C12
1.364(5)
C1Sb1C21
123.05(17)
C2O1C7
117.4(4)
Sb1-C21
2.145(6)
O2-C17
1.437(6)
C11Sb1Br1
94.70(11)
C12O2C17
119.7(3)
Сl1-C5
1.753(5)
O3-C22
1.365(6)
C11Sb1Br2
87.74(11)
C22O3C27
119.2(4)
Сl2-C15
1.756(5)
O3-C27
1.456(6)
C11Sb1C1
110.8(2)
C6C1Sb1
117.1(3)
3
Sb1-Cl4
2.4080(10)
Cl3-C35
1.735(5)
Cl4Sb1Cl5
178.11(2)
C11Sb1Cl5
87.38(7)
Sb1-Cl5
2.5133(9)
O1-C2
1.357(4)
C31Sb1Cl4
94.63(8)
C11Sb1C31
116.54(10)
Sb1-C31
2.107(2)
O1-C7
1.395(4)
C31Sb1Cl5
86.32(8)
C11Sb1C1
120.82(10)
Sb1-C1
2.114(2)
O2-C12
1.356(4)
C31Sb1C1
121.37(10)
C2O1C7
119.6(3)
Sb1-C11
2.105(2)
O2-C17
1.416(4)
C1Sb1Cl4
93.01(7)
C12O2C17
119.9(3)
Cl1-C5
1.740(4)
O3-C32
1.351(4)
C1Sb1Cl5
85.11(7)
C36C31Sb1
120.7(2)
Cl2-C15
1.737(4)
O3-C37
1.404(5)
C11Sb1Cl4
93.64(7)
C2C1Sb1
118.85(19)
Преобразования симметрии: a 1-x, 1-y, 2-z; б -x, -y, -z.
ными атомами галогена (рис. 2, 3). Аксиальные
чем в молекуле соединения 1. Среднее значение
углы HlgSbHlg 174.26(2) и 178.06(3)°, экватори-
связей Sb-C [2.141(6) Å (2)] больше аналогичного
альные углы изменяются в интервалах 116.67(13)-
значения в молекуле дибромида трифенилсурьмы
121.27(13) и 110.8(2)-125.05(18)° соответствен-
(2.112 Å [25]), a средние значения связей Sb-Br в
но. Связи Sb-C в молекулах соединений 2,
3
этих молекулах совпадают [2.637(4) Å и 2.638(6) Å
[2.135(5)-2.146(6) Å и 2.105(3)-2.116(3) Å] короче,
соответственно]. В молекулах соединения 3 и
Рис. 1. Общий вид молекулы трис(2-метокси-5-хлор-
Рис. 2. Общий вид молекулы дибромида трис(2-меток-
фенил)сурьмы 1 (разупорядоченная молекула бензола
си-5-хлорфенил)сурьмы 2 (разупорядоченная молекула
и атомы водорода не показаны).
бензола и атомы водорода не показаны).
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 10 2020
1580
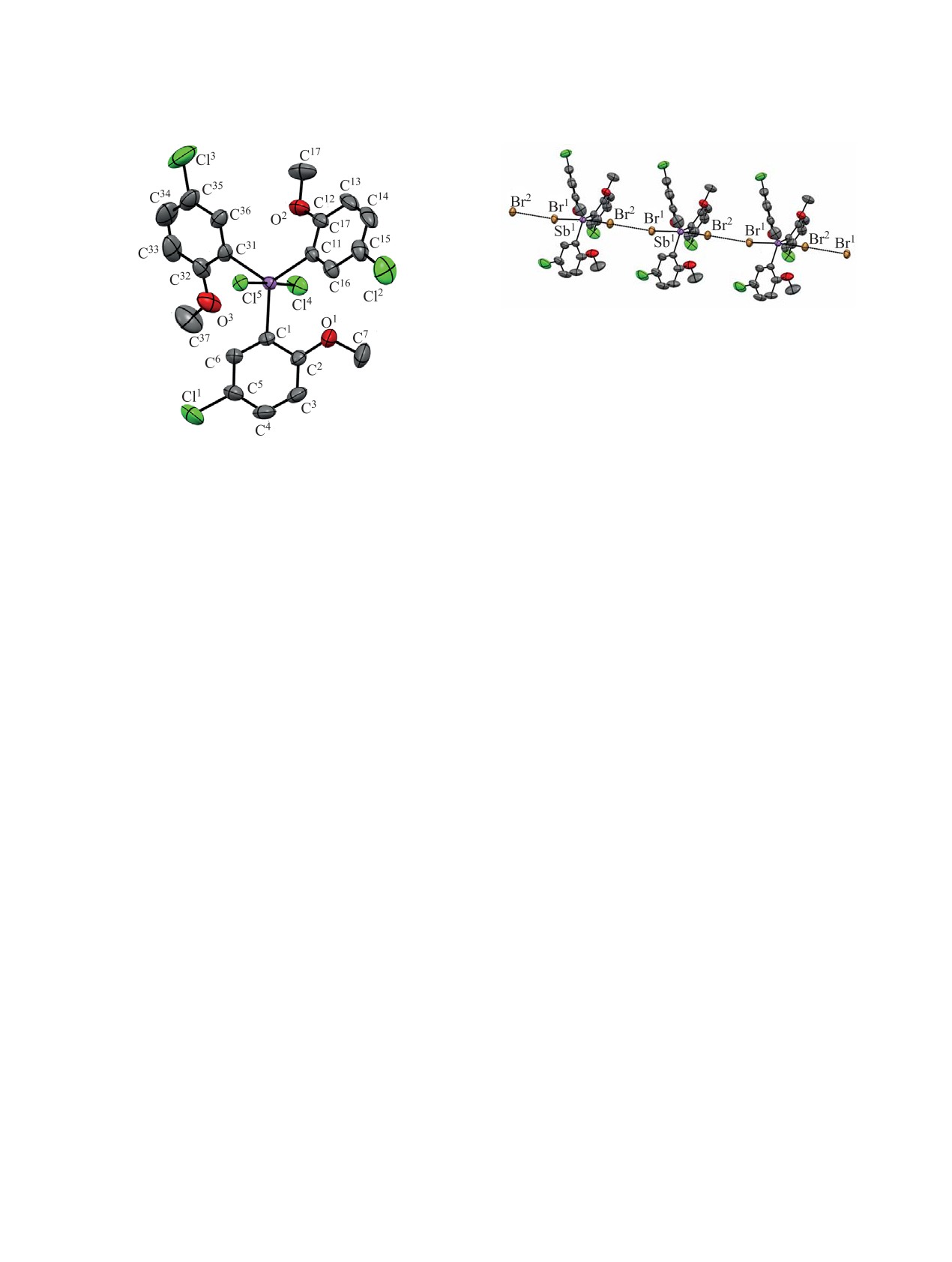
ШАРУТИН, ШАРУТИНА
Рис. 4. Межмолекулярные взаимодействия Br···Br в
кристалле соединения 2.
Таким образом, во впервые синтезированных
трех новых арилпроизводных высококоординиро-
ванной сурьмы координационное число металла
повышается за счет внутримолекулярных взаимо-
Рис. 3. Общий вид молекулы дихлорида трис(2-ме-
действий Sb∙∙∙O.
токси-5-хлорфенил)сурьмы 3 (атомы водорода не по-
казаны).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
дихлорида трифенилсурьмы [25] средние значе-
ИК спектры записывали на ИК-Фурье спектро-
ния экваториальных связей [2.109(3) и 2.097(6) Å]
метре Shimadzu IRAffinity-1S; образцы готови-
и связей Sb-Cl [2.460(1) и 2.463(3) Å] практиче-
ли таблетированием с KBr (область поглощения
4000-400 см-1). Рентгеноструктурный анализ кри-
ски одинаковы. Внутримолекулярные расстояния
сталлов соединений 1-3 проводили на автоматиче-
Sb∙∙∙OМе в молекулах соединений 2 и 3, как и в
ском четырехкружном дифрактометре D8 QUEST
соединении 1, сохраняются [3.065(7)-3.195(7) и
фирмы Bruker (MoKα-излучение, λ = 0.71073 Å,
3.037(3)-3.088(3) Å соответственно].
графитовый монохроматор). Сбор, редактирова-
Имеются существенные различия в особенно-
ние данных и уточнение параметров элементар-
стях формирования структур 2 и 3. В структуре
ной ячейки, а также учет поглощения проведены
2 молекулы посредством взаимодействий Br···Br
по программам SMART и SAINT-Plus [27]. Все
[d = 3.647(6) Å при сумме ван-дер-ваальсовых
расчеты по определению и уточнению структуры
радиусов брома 3.90 Å] объединены в цепи, ори-
выполнены по программам SHELXL/PC [28] и
ентированные вдоль кристаллографической оси
OLEX2 [29]. Структуры соединений 1-3 опреде-
a (рис. 4). Углы Sb1Br1Br2 и Sb1Br2Br1 имеют зна-
лены прямым методом и уточнены методом наи-
чения 165.77(2) и 164.89(2)° соответственно. На-
меньших квадратов в анизотропном приближении
блюдаемые взаимодействия Br···Br можно клас-
для не водородных атомов. Основные кристал-
сифицировать как галогенную связь, поскольку
лографические данные и результаты уточнения
существующие требования для идентификации
структур 1-3 приведены в табл. 1, основные дли-
такой связи (межатомное расстояние Br···Br долж-
ны связей и валентные углы - в табл. 2. Полные
но быть меньше, чем сумма ван-дер-ваальсовых
таблицы координат атомов, длин связей и валент-
радиусов; угол Sb-Br···Br должен быть близким к
ных углов депонированы в Кембриджском банке
180° [26]), в кристалле соединения 2 выполняют-
структурных данных [ССDC 1977662 (1), 1979209
ся.
(2), 1984429 (3)].
Структурная организация соединения 3 значи-
Трис(2-метокси-5-хлорфенил)сурьма(III),
тельно сложнее, поскольку один из аксиальных
сольват (1:0.5) с бензолом (1). К раствору 7.66 г
атомов хлора Cl5 каждой молекулы образует водо-
(51.6 ммоль)
5-хлор-2-метоксифениллития, по-
родные связи Cl···Н с тремя соседними молекула-
лученного металлированием 7.35 г (51.6 ммоль)
ми, в результате чего мотив структуры - каркас-
п-хлоранизола фениллитием (60.0 ммоль) в эфи-
ный.
ре, прибавляли 3.69 г (16.2 ммоль) SbCl3 в 100 мл
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 10 2020
ТРИС(2-МЕТОКСИ-5-ХЛОРФЕНИЛ)СУРЬМА
1581
диэтилового эфира, перемешивали и оставляли на
3. Copolovici D., Isaia F., Breunig H.J., Rat C.I., Silvest-
ночь. Смесь осторожно разлагали при охлажде-
ru C. // RSC Adv. 2014. Vol. 4. P. 26569. doi 10.1039/
нии водой (2 мл), удаляли растворитель и остаток
C4RA03482A
4. Chirca I., Soran A., Silvestru A., Silvestru C. // Rev.
перекристаллизовывали из бензола. Выход 7.22 г
Roum. сhim. 2015. Vol. 60. P. 643.
(85%), бесцветные кристаллы, т. пл. 178°С. ИК
5. Copolovici D., Bojan V.R., Rat C.I., Silvestru A.,
спектр, ν, см-1: 3088, 3045, 2997, 2960, 2937, 2837,
Breunig H.J., Silvestru C. // Dalton Trans. 2010. Vol. 39.
2517, 2036, 1863, 1570, 1463, 1431, 1377, 1286,
P. 6410. doi 10.1039/C003318A
1261, 1234, 1178, 1141, 1101, 1045, 1020, 887, 812,
6. Okajima S., Yasuike S., Kakusawa N., Osada A.,
802, 732, 715, 692, 673, 638, 545, 528, 441. Найдено,
Yamaguchi K., Seki H., Kurita J. // J. Organomet.
%: С 49.10; Н 3.63. C24H21Cl3O3Sb. Вычислено, %:
Chem. 2002. Vol. 656. P. 234. doi 10.1016/S0022-
С 49.19; Н 3.59.
328X(02)01622-4
Дибромид трис(2-метокси-5-хлорфенил)-
7. Yamamichi H., Matsukawa S., Kojima S., Ando K.,
сурьмы(V), сольват (1:0.5) с бензолом (2). В
Yamamoto Y. // Heteroatom Chem. 2011. Vol. 22.
P. 553. doi 10.1002/hc.20721
30 мл хлороформа растворяли 0.58 г (1.0 ммоль)
8. Reznicek T., Dostal L., Ruzicka A., Vinklarek J.,
сольвата трис(2-метокси-5-хлорфенил)сурьмы с
Rezacova M., Jambor R. // Appl. Organomet. Chem.
бензолом 1, затем при перемешивании по каплям
2012. Vol. 26. P. 237. doi 10.1002/aoc.2845
прибавляли раствор 0.16 г (1.0 ммоль) брома в
9. Obata T., Matsumura M., Kawahata M., Hoshino S.,
20 мл хлороформа. Растворитель удаляли. Выход
Yamada M., Murata Y., Kakusawa N., Yamaguchi K.,
0.55 г (83%). Mелкиe бесцветные кристаллы пе-
Tanaka M., Yasuike S. // J. Organomet. Chem. 2016.
рекристаллизовывали из бензола, т. пл. 202°С. ИК
Vol. 807. P. 17. doi 10.1016/j.jorganchem.2016.02.008
спектр, ν, см-1: 3091, 3072, 3005, 2962, 2931, 2839,
10. Matano Y., Nomura H., Hisanaga T., Nakano H., Shiro M.,
1872, 1579, 1571, 1475, 1435, 1381, 1328, 1282,
Imahori H. // Organometallics. 2004. Vol. 23. P. 5471.
1267, 1249, 1180, 1143, 1105, 1047, 1016, 995, 862,
doi 10.1021/om0494115
812, 729, 702, 680, 640, 530, 455, 447, 435. Найдено,
11. Шарутин В.В., Шарутина О.К. // ЖНХ. 2015. Т. 60.
%: С 38.54; Н 2.94. C24H21Br2Cl3O3Sb. Bычислено,
№ 12. С. 1631. doi 10.7868/S0044457X15120211;
%: С 38.64; Н 2.82.
Sharutin V.V., Sharutina O.K. // Russ. J. Inorg.
Chem. 2015. Vol. 60. N 12. P. 1491. doi 10.1134/
Дихлорид
трис(2-метокси-5-хлорфенил)-
S0036023615120219
сурьмы(V) (3) получали из триарилсурьмы 1 и
12. Шарутин В.В., Сенчурин В.С., Шарутина О.К.,
хлора (а) или хлорида меди (б) по описанным ме-
Чагарова О.В., Зелевец Л.Е. // Коорд. хим. 2011.
тодикам [14]. Выход 78 (а), 82% (б), т. пл. 250°С.
№ 10. С. 782; Sharutin V.V., Senchurin V.S., Sharuti-
ИК спектр, ν, см-1: 3084, 3001, 2964, 2933, 2891,
na O.K., Chagarova O.V., Zelevets L.E. // Russ. Coord.
2839, 1874, 1747, 1625, 1579, 1477, 1436, 1382,
Chem. 2011. Vol. 37. N 10. C. 781. doi 10.1134/
1282, 1267, 1251, 1180, 1149, 1107, 1049, 1018, 941,
S1070328411090089
877, 862, 813, 705, 680, 640, 572, 543, 441. Найдено,
13. Шарутин В.В., Сенчурин В.С., Шарутина О.К.,
%: С 40.34; Н 2.99. C21H18Cl5O3Sb. Вычислено, %:
Чагарова О.В. // ЖОХ. 2011. Т. 81. Вып. 10.
С 40.84; Н 2.92.
С. 1649; Sharutin V.V., Senchurin V.S., Sharutina O.K.,
Chagarova O.V. // Russ. J. Gen. Chem. 2011. Vol. 81.
КОНФЛИКТ ИНТЕРЕСОВ
N 10. P. 2102. doi 10.1134/S1070363211100100
Авторы заявляют об отсутствии конфликта
14. Шарутин В.В., Сенчурин В.С., Шарутина О.К.,
интересов.
Чагарова О.В. // ЖНХ. 2011. Т. 56. Вып. 10.
С. 1640; Sharutin V.V., Senchurin V.S., Sharutina O.K.,
СПИСОК ЛИТЕРАТУРЫ
Chagarova O.V. // Russ. J. Inorg. Chem. 2011. Vol. 56.
1. Кочешков К.А., Сколдинов А.П., Землянский Н.Н. Ме-
N 10. P. 1561. doi 10.1134/S0036023611100196
тоды элементоорганической химии. Сурьма, висмут.
15. Hirai M., Gabbai F.P. // Angew. Chem. Int. Ed. 2015.
М.: Наука, 1976. 483 с.
Vol. 54. P. 1205. doi 10.1002/anie.201410085
2. Onishi K., Douke M., Nakamura T., Ochiai Y., Kakusa-
16. Matano Y., Nomura H., Suzuki H. // Inorg. Chem. 2000.
wa N., Yasuike S., Kurita J., Yamamoto C., Kawahata M.,
Vol. 39. P. 1340. doi 10.1021/ic991120e
Yamaguchi K., Yagura T. // J. Inorg. Biochem. 2012.
17. Matano Y., Nomura H., Suzuki H. // Inorg. Chem. 2002.
Vol. 117. P. 77. doi 10.1016/j.jinorgbio.2012.09.009
Vol. 41. P. 1940. doi 10.1021/ic0110575
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 10 2020
1582
ШАРУТИН, ШАРУТИНА
18. Шарутин В.В., Шарутина О.К., Сенчурин В.С.,
24. Sobolev A.N., Romm I.P., Belskii V.K., Gur’yano-
Чагарова О.В. // ЖОХ. 2012. Т. 82. Вып. 10.
va E.N. // J. Organomet. Chem. 1979. Vol. 179. P. 153.
С. 1646; Sharutin V.V., Sharutina O.K., Senchurin V.S.,
doi 10.1016/S0022-328X(00)95217-3
Chagarova O.V. // Russ. J. Gen. Chem. 2012. Vol. 82.
25. Begley M.J., Sowerby D.B. // Acta Crystallogr. (C). 1993.
N 10. P. 1665. doi 10.1134/S1070363212100064
Vol. 49. P. 1044. doi 10.1107/S0108270192012836
26. Desiraju G.R., Ho P.S., Kloo L., Legon A.C., Marquardt R.,
19. Шарутин В.В., Шарутина О.К., Сенчурин В.С. //
Metrangolo P., Politzer P., Resnati G., Rissanen K. //
ЖНХ. 2014. Т. 59. № 4. С. 481. doi 10.7868/
Pure Appl. Chem. 2013. Vol. 85. Р. 1711. doi 10.1351/
S0044457X14040217; Sharutin V.V., Sharutina O.K.,
PAC-REC-12-05-10
Senchurin V.S. // Russ. J. Inorg. Chem. 2014. Vol. 59.
27. Bruker (1998). SMART and SAINT-Plus. Versions
N 4. P. 326. doi 10.1134/S0036023614040202
5.0. Data Collection and Processing Software for the
20. Yin H., Quan L., Li L. // Inorg. Chem. Commun. 2008.
SMART System. Bruker AXS Inc., Madison, Wisconsin,
Vol. 11. P. 1121. doi 10.1016/j.inoche.2008.06.017
USA.
21. Shu W., Liu D., Huang K., Wang K., Li Y. // Trans.
28. Bruker (1998). SHELXTL/PC. Versions 5.10. An
Nonferrous Met. Soc. China. 1992. Vol. 2. N 2. P. 32
Integrated System for Solving, Refining and Displaying
22. Domagala M., Huber F., Preut H. // Z. anorg.
Crystal Structures from Diffraction Data. Bruker AXS
allg. Chem. 1989. Bd 574. S. 130. doi 10.1002/
Inc., Madison, Wisconsin, USA.
zaac.655740114
29. Dolomanov O.V., Bourhis L.J., Gildea R.J., Ho-
23. Grigsby E.W.J., Hart R.D., Raston C.L., Skelton B.W.,
ward J.A.K., Puschmann H. // J. Appl. Cryst. 2009.
White A.H. // Aust. J. Chem. 1997. Vol. 50. P. 675.
Vol. 42. P. 339. doi 10.1107/S0021889808042726
Tris(2-metoxy-5-chlorophenyl)antimony:
Synthesis and Oxidative Addition Reactions
V. V. Sharutin* and O. K. Sharutina
National Research South Ural State University, Chelyabinsk, 454080 Russia
*e-mail: vvsharutin@rambler.ru
Received June 1, 2020; revised June 1, 2020; accepted June 15, 2020
The reaction of 2-methoxy-5-chlorophenyllithium with SbCl3 (3:1) in diethyl ether afforded tris(2-
methoxy-5-chlorophenyl)antimony, which crystallizes from benzene as a solvate. Treatment of the solvate with
bromine in chloroform led to the formation of tris2-methoxy-5-chlorophenyl)antimony dibromide, which was
also isolated from benzene as a solvate. The product of a similar reaction with chlorine, tris(2-methoxy-5-chlo-
rophenyl)antimony dichloride, was also obtained by oxidation of tris(2-methoxy-5-chlorophenyl)antimony with
copper dichloride in acetone. The structural features of the obtained compounds were established by the single
crystal of X-ray diffraction analysis method.
Keywords: tris(2-methoxy-5-chlorophenyl)antimony, tris(2-methoxy-5-chlorophenyl)antimony dibromide and
dichloride, X-ray diffraction analysis
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 10 2020