ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2020, том 90, № 11, с. 1647-1653
УДК 542.913-977:[547.569.1:546.16]:[547.313.2:546.16]
ТЕРМИЧЕСКИЕ ПРЕВРАЩЕНИЯ
2,5-ДИФТОР-3,4,6-ТРИХЛОРБЕНЗОЛТИОЛА
С ТЕТРАФТОРЭТИЛЕНОМ
© 2020 г. П. В. Никульшин, А. М. Максимов, В. Е. Платонов*
Новосибирский институт органической химии имени Н. Н. Ворожцова Сибирского отделения
Российской академии наук, пр. Академика Лаврентьева 9, Новосибирск, 630090 Россия
*е-mail: platonov@nioch.nsc.ru
Поступило в Редакцию 17 июля 2020 г.
После доработки 17 июля 2020 г.
Принято к печати 29 июля 2020 г.
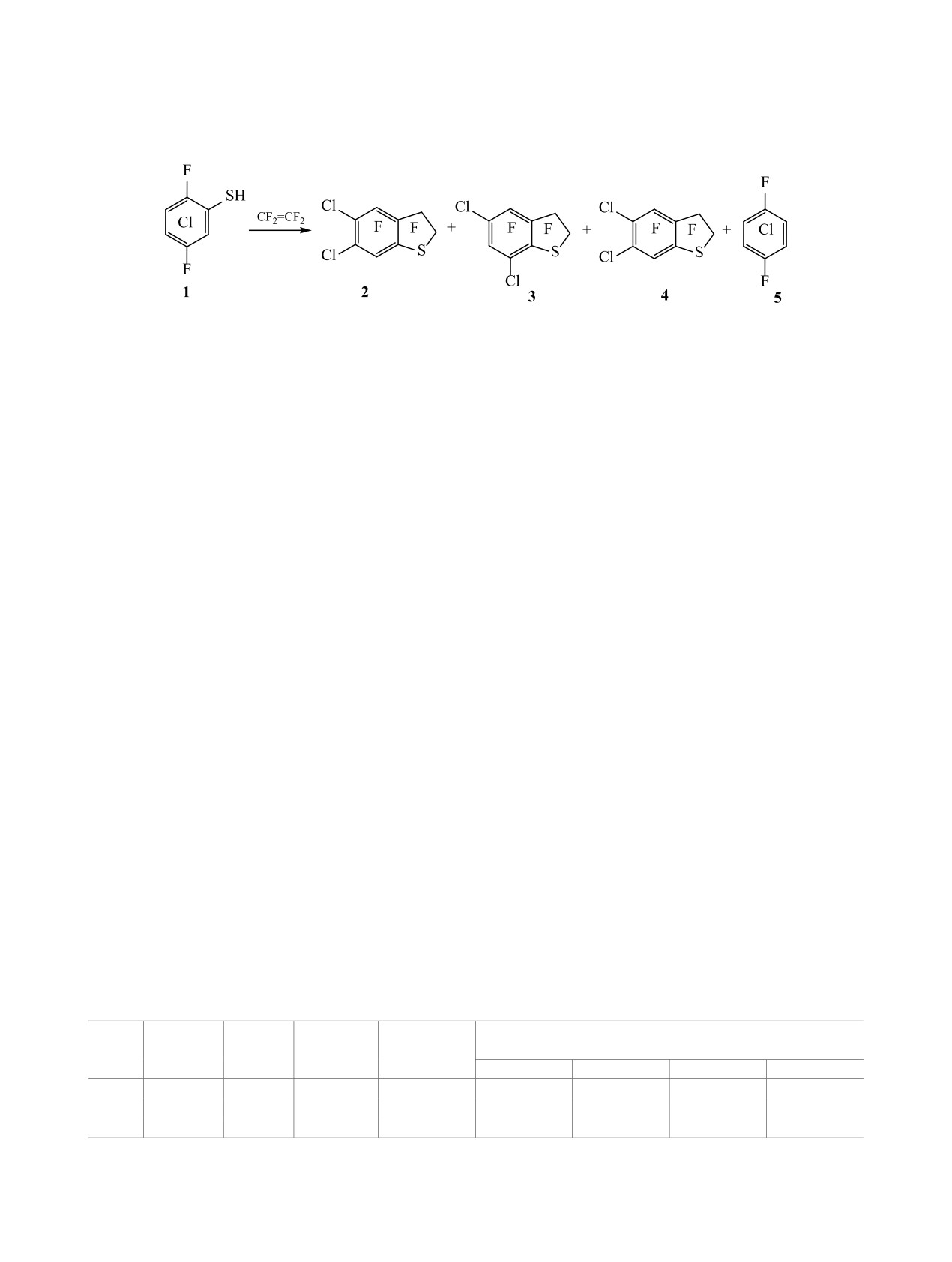
Пиролиз смеси 2,5-дифтор-3,4,6-трихлорбензолтиола с тетрафторэтиленом приводит к 2,2,3,3,4,7-гекса-
фтор-5,6-дихлор-2,3-дигидробензо[b]тиофену (основному продукту реакции) наряду с 2,2,3,3,4,6-гекса-
фтор-5,7-дихлор-2,3-дигидробензо[b]тиофеном. Предложены схемы их образования с участием про-
межуточных радикалов. Окислением смеси синтезированных соединений получены 2,2,3,3,4,7-гекса-
фтор-5,6-дихлор-2,3-дигидробензо[b]сульфан-1,1-диоксид и 2,2,3,3,4,6-гексафтор-5,7-дихлор-2,3-диги-
дробензо[b]сульфан-1,1-диоксид.
Ключевые слова: 2,5-дифтор-3,4,6-трихлорбензолтиол, тетрафторэтилен, пиролиз, 2,2,3,3,4,7-гекса-
фтор-5,6-дихлор-2,3-дигидробензо[b]тиофен, 2,2,3,3,4,7-гексафтор-5,6-дихлор-2,3-дигидробензо[b]-
сульфан-1,1-диоксид
DOI: 10.31857/S0044460X20110025
Среди реакций совместного пиролиза полифто-
серы. Индивидуальные полифтор-2,3-дигидро-
рароматических соединений и тетрафторэтилена
бензо[b]тиофены - труднодоступные соединения.
в проточной системе описаны превращения по-
Описано получение перфтор-2,3-дигидробензо[b]-
лифторхлорарентиолов с атомами хлора в орто- и
тиофена и изучены его некоторые превращения
пара-положениях к тиольной группе [1]. Основное
[2]. Пиролизом смеси 6-(метилсульфанил)октаф-
направление пиролиза смеси полифтор-о-хлор-
ториндан-5-тиола с тетрафторэтиленом при 420°С
арентиолов с тетрафторэтиленом - неожиданное
получен индивидуальный додекафтор-3,5,6,7-те-
образование производных полифтор-2,3-диги-
трагидрo-2H-инденo[5,6-b]тиофен [3].
дробензо[b]тиофена с миграцией атома серы. В
С учетом возможности перегруппировки при
небольших количествах получались также изоме-
образовании полифторированного тиенового цик-
ры, в которых атом серы находился в исходном
ла в синтезе полифтордигидробензо[b]тиофенов
положении, а также полифторинданы. Реакции
целесообразно проводить пиролиз смеси тетра-
2,3,6-трифтор-5-хлорпиридин-4-тиола с тетра-
фторэтилена и 2,5-дифторпроизводных бензолти-
фторэтиленом при 410-620°C в проточной системе
ола с атомом хлора в орто-положении к тиольной
протекали аналогично с образованием азотсодер-
группе, а также с двумя одинаковыми замести-
жащих аналогов. Продукты пиролиза образуются,
телями в положениях 3 и 4 с целью исключения
по-видимому, с участием промежуточных радика-
влияния перегруппировки на строение конечного
лов, включая радикальные σ-комплексы, а также
полифтордигидробензо[b]тиофена. Этим требо-
радикальные σ-спирокомплексы [1]. Образование
ваниям отвечает 2,5-дифтор-3,4,6-трихлорбензол-
двух изомерных соединений усложняет выделе-
тиол 1, и с целью получения 2,2,3,3,4,7-гекса-
ние основного изомера с мигрировавшим атомом
фтор-5,6-дихлор-2,3-дигидробензо[b]тиофена
2
1647
1648
НИКУЛЬШИН и др.
Схема 1.
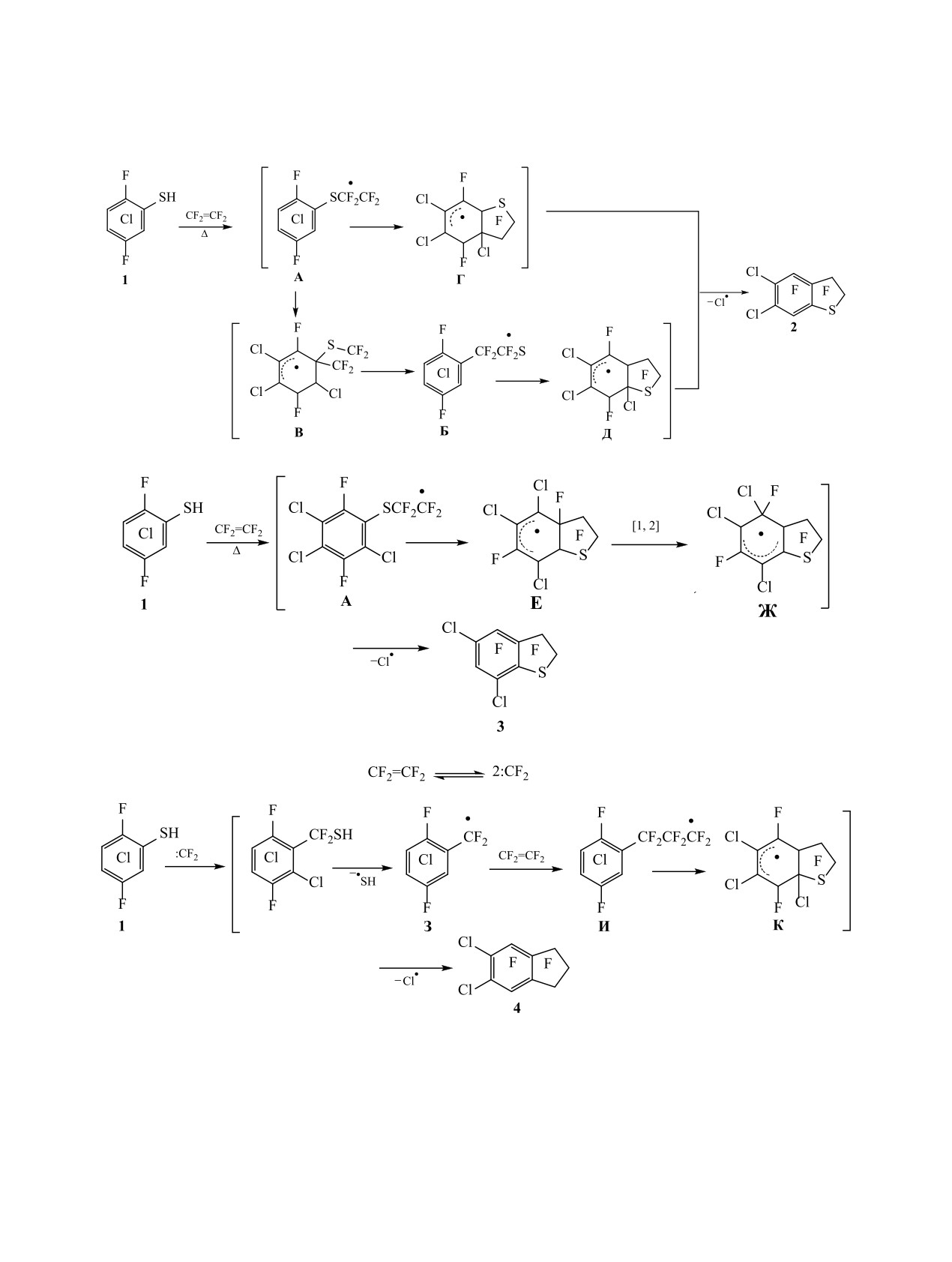
нами проведены реакции совместного пиролиза
Можно полагать (ср.
[1]), что образова-
тиола 1 с тетрафторэтиленом при различных тем-
ние соединения 2 происходит через 2-(2,5-ди-
пературах.
фтор-3,4,6-трихлорфенилcульфанил)тетрафтор-
Исходное соединение 1 было получено с вы-
этильный радикал А (схема 2), который получа-
соким выходом при взаимодействии доступного
ется из 2,5-дифтор-3,4,6-трихлорбензолтиильного
1,2,4-трифтортрихлорбензола [4] с KSH [5]. При
радикала и тетрафторэтилена. Тиильный радикал
пиролизе смеси тиола 1 с тетрафторэтиленом при
может генерироваться при термолизе связи S-H,
600-620°C в проточной системе образуется соеди-
а также при действии атома хлора, элиминирую-
нение 2. Однако неожиданно было зафиксировано
щегося из радикальных σ-комплексов. В образо-
образование другого изомера - 2,2,3,3,4,6-гекса-
вании арена 2, возможно, принимает участие и
фтор-5,7-дихлор-2,3-дигидробензо[b]тиофена
[2-(2,5-дифтор-3,4,6-трихлорфенил)тетрафторэ-
3. Кроме того, в небольших количествах в реак-
тан]тиильный радикал Б, генерирующийся из
ционной смеси обнаружен
1,1,2,2,3,3,4,7-окта-
σ-спирокомплекса В. Последний может образо-
фтор-5,6-дихлориндан 4 наряду с заметным количе-
ваться в результате превращения радикала А. Ра-
ством 1,4-дифтортетрахлорбензола 5 (21% в смеси,
см. таблицу, оп. 1). Среди этих соединений преоб-
дикалы А и Б подвергаются внутримолекулярной
ладает 2,2,3,3,4,7-гексафтор-5,6-дихлор-2,3-диги-
циклизации в радикальные σ-комплексы Г, Д, и с
дробензо[b]тиофен 2 (выход 10%, 46% в смеси).
последующим элиминированием атома хлора об-
Снижение температуры реакции до 510-530 и до
разуется соединение 2 (схема 2).
400-420°C приводит к увеличению выхода соеди-
Соединение 3, по-видимому, получается вслед-
нения 2 (32 и 18%) (см. таблицу, оп. 2, 3) (схема 1).
ствие замыкания радикала А по положению 2
Пиролиз смеси соединения 1 с тетрафторэти-
ароматического кольца и генерации радикально-
леном при 600-620°C сопровождался сильным
го σ-комплекса Е. Последующая миграция ато-
осмолением, что, по-видимому, объясняет низкий
ма фтора приводит к образованию радикального
выход соединения 2 и других продуктов реакции.
σ-комплекса Ж (схема 3). Подобный механизм с
Сильное осмоление, возможно, обусловлено сни-
миграцией атома фтора был предложен ранее при
жением термостабильности тиола 1 из-за присут-
изучении реакции перекиси пентафторбензоила
ствия трех атомов хлора. В пользу такого предпо-
с гексафторбензолом [6]. Замыканию радикала А
ложения свидетельствует сравнение с результатом
реакции
2,4,5-трифтор-3,6-дихлорбензолтиола с
по положению 2 и миграции атома фтора способ-
тетрафторэтиленом в аналогичных условиях, при-
ствует участие атомов хлора и атома серы своими
водящей к изомерным полифторхлордигидробен-
вакантными d-орбиталями в стабилизации ради-
зо[b]тиофенам с более высокими выходами [1].
кальных σ-комплексов Е и Ж. Элиминирование
Пиролиз смеси 2,5-дифтор-3,4,6-трихлорбензолтиола с тетрафторэтиленом
Состав реакционной смеси по данным ГЖХ, %
№
1, г
τ, мин
Т, °C
Выход, г
(выделено, %)
опыта
2
3
4
5
1
2.60
3.7
600-620
0.68
46.1 (10)
15.7
(3.5)
2.6
(0.5)
21.3 (4)
2
40.30
33.7
510-530
28.52
56.7 (32)
20.5
(11.5)
4.7
(2.5)
5.1 (2)
3
2.59
4.5
400-420
1.15
50 (18)
16.1 (6)
2.2 (1)
0.3 (~0.1)
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 11 2020
ТЕРМИЧЕСКИЕ ПРЕВР
АЩЕНИЯ 2,5-ДИФТОР-3,4,6-ТРИХЛОРБЕНЗОЛТИОЛА
1649
Схема 2.
Схема 3.
Схема 4.
атома хлора из σ-комплекса Ж ведет к соединению
C-S тиола 1 с генерацией тетрафтортрихлорбен-
3 (схема 3).
зильного радикала З, который реагирует затем с
тетрафторэтиленом с последующей циклизацией
Образование соединения
4, по-видимому,
полифтортрихлорфенилпропильного радикала И
включает внедрение дифторкарбена, образующе-
и элиминированием атома хлора из радикального
гося при термолизе тетрафторэтилена [7], по связи
σ-комплекса К (схема 4).
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 11 2020
1650
НИКУЛЬШИН и др.
заместителями [2]. Константы JF4F7 в арене 2 и
Схема 5.
JF4F6 в соединении 3 совпадают с таковыми в пер-
фтор-2,3-дигидробензо[b]тиофене
[2]. Сигналы
при 46.8 м. д. в спектре соединения 2 имеют толь-
ко дублетную константу (JF7F4) при отсутствии
триплетной константы, что позволяет отнести их
к атому фтора в положении 7.
Отнесение сигналов атомов фтора в положени-
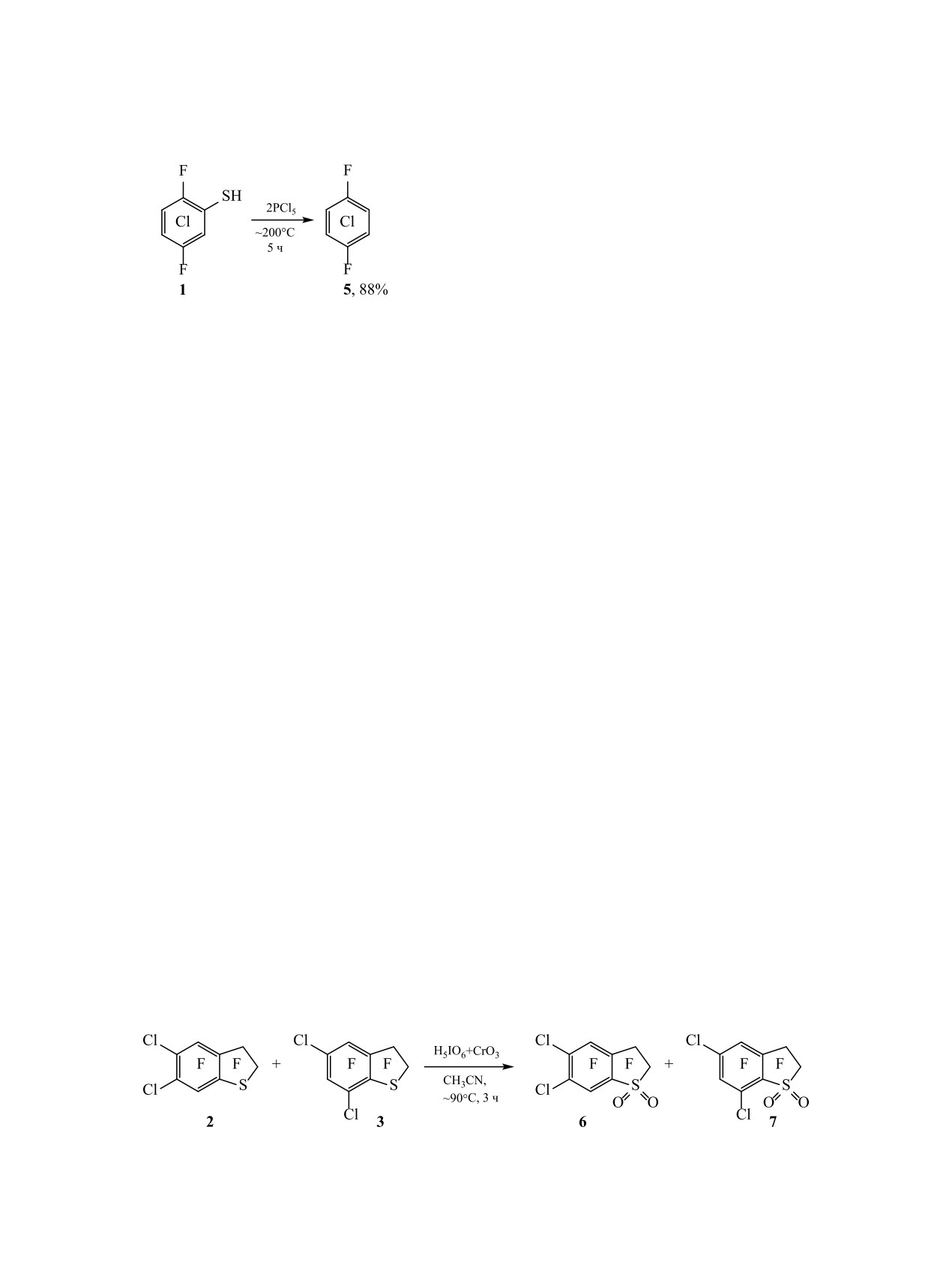
Принимая во внимание элиминирование атома
ях 4, 7 и 4, 6 в спектрах соединений 2 и 3 согла-
хлора при ароматизации σ-комплексов Г-Ж, К,
суется с расчетами по аддитивной схеме с учетом
можно предположить, что соединение 5 образует-
соответствующих сдвигов атомов фтора в пер-
ся в результате взаимодействия тиола 1 с атомов
фтор-2,3-дигидробензо[b]тиофене [2] и влияния
хлора. Ранее нами было показано, что в реакциях
атомов хлора в пентафторхлорбензоле [10].
полифторарентиолов с PCl5 при ~200°C происхо-
Химические сдвиги атомов фтора F2 и F3 и их
дит гладкое замещение тиольной группы на атом
КССВ в спектрах соединений 6 и 7 близки к со-
хлора, при этом предполагалось, что это происхо-
ответствующим величинам в спектрах 2,2,3,3-те-
дит при участии хлора [8] (схема 5).
трафтор-2,3-дигидробензо[b]тиофен-1,1-диоксида
С целью изучения химических свойств и полу-
и его 5-бромпроизводного [11]. Константы JF4F7 и
чения дополнительных данных для подтверждения
J
в спектрах соединений 2 и 6 сопоставимы; ве-
F3F4
строения соединений 2 и 3 смесь этих соединений
личины JF4F6 в спектрах соединений 3 и 7 близки.
в соотношении ~77:23, окисляли кислотой H5IO6 в
Химические сдвиги атомов F4 в спектрах соедине-
присутствии CrO3 в ацетонитриле и получили смесь
ний 2, 3, 6, 7 близки друг к другу.
2,2,3,3,4,7-гексафтор-5,6-дихлор-2,3-дигидробен-
Таким образом, изучены термические превраще-
зо[b]тиофен-1,1-диоксида
6 и
2,2,3,3,4,6-гекса-
ния2,5-дифтор-3,4,6-трихлорбензолтиола вприсут-
фтор-5,7-дихлор-2,3-дигидробензо[b]тиофен-
ствии тетрафторэтилена. Получены 2,2,3,3,4,7-гек-
1,1-диоксида 7 примерно в том же соотношении
сафтор-5,6-дихлор-2,3-дигидробензо[b]тиофен и
(схема 6). Подобным образом ранее окисляли де-
2,2,3,3,4,6-гексафтор-5,7-дихлор-2,3-дигидробен-
кафтордифенилсульфид и получали с высоким вы-
зо[b]тиофен, окисление которых приводит к об-
ходом декафтордифенилсульфон [9].
разованию соответствующих 2,3-дигидробензо[b]
Состав и строение соединений 2, 3, 6, 7 установ-
сульфан-1,1-диоксидов.
лены на основании данных элементного анализа,
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
масс-спектрометрии высокого разрешения, спек-
троскопии ЯМР. Закономерности, наблюдаемые
Спектры ЯМР 19F записаны на приборе Bruker
в спектрах ЯМР 19F соединений 2, 3, 6, 7, анало-
AV-300 (282.4 МГц) в CCl4 c добавкой CDCl3. Вну-
гичны таковым в полифтор-2,3-дигидробензо[b]-
тренний стандарт - C6F6. Положительные значе-
тиофенах и их сульфоксидах [2].
ния химических сдвигов соответствуют смещению
Химические сдвиги сигналов F2 и F3, а также
сигнала в слабое поле от С6F6. Спектры ЯМР 13С
константы J(C2F
,C3F
), JF3F4 в спектрах соедине-
записаны на приборах Bruker AV-300 (75.5 МГц)
2
2
ний 2 и 3 близки соответствующим величинам в
и Bruker AV-400 (100.6 МГц) в CDCl3. Внутренний
спектрах
перфтор-2,3-дигидробензо[b]тиофена
стандарт - CDCl3. ИК и УФ спектры записаны на
и его 5- и 6-производных с O- и S-содержащими
приборах Bruker Vector 22 IR и Hewlett Packard
Схема 6.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 11 2020
ТЕРМИЧЕСКИЕ ПРЕВР
АЩЕНИЯ 2,5-ДИФТОР-3,4,6-ТРИХЛОРБЕНЗОЛТИОЛА
1651
8453 UV соответственно. Молекулярные массы и
114.3 т. д (C3a, 2JCF = 25.0, 2JCF = 20.0 Гц), 117.7 т. т.
элементный состав определены из масс-спектров,
д (C3F2, 1JCF = 265.0, 2JCF = 25.0, JCF ~3.0 Гц), 121.2
полученных на приборе DFS с энергией иониза-
д (C5 либо C6, 2JCF = 20.0 Гц), 121.8 д. м (C7a, 2JCF
ции 70 эВ. Для хромато-масс-спектрометрии (ГХ-
~22.0 Гц), 127.9 д (C5 либо C6, 2JCF = 20.0 Гц), 128.8
МС) использовали хроматограф Hewlett Packard
т. т (C2F2, 1JCF = 295.0, 2JCF = 28.0 Гц), 149.3 д. м (C4
HP 5890 с масс-селективным детектором HP 5971
либо C7, 1JCF = 249.0 Гц), 152.2 д. м (C4 либо C7,
и хроматограф Agilent 6890N с хромато-масс-спек-
1JCF = 262.0 Гц). Спектр ЯМР 19F, δF, м. д.: 45.6 д.
трометрической системой Agilent
5973N.
т (F4, JF4F7 = 15.5, JF4F = 10.5 Гц), 46.8 д (F7, JF7F4 =
Энергия ионизирующих электронов
-
70 эВ.
15.5 Гц), 51.2 д. т (С3F2, J FF4 = 10.5, JFF = 2.5 Гц),
Газохроматографический анализ проводили на
68.2 т (С2F2, JFF = 2.5 Гц).
приборе Hewlett Packard HP 5980, снабженном
2,2,3,3,4,6-Гексафтор-5,7-дихлор-2,3-дигид-
кварцевой капиллярной колонкой HP-5 (непод-
робензо[b]тиофен (3). Спектр ЯМР 19F, δF, м. д.:
вижная фаза
- диметилдифенилполисилоксан),
47.4 т. д (F4, JF4F = 10.0, JF4F6 = 8.0 Гц), 52.7 д. к
30 м × 0.52 мм/2.6 мкм, и детектором по теплопро-
(С3F2, JFF4 = 10.0, JFF2 ~ JFF6 ~2.0 Гц), 59.8 д. т (F6,
водности. Температуру плавления определяли на
J
F6F4 = 8.0, JF6F ~2.0 Гц), 67.7 т (С2F2, JFF ~2.0 Гц).
приборе Mettler Toledo FP900.
1,1,2,2,3,3,4,7-Октафтор-5,6-дихлориндан
Пиролитические реакции
2,5-дифтор-
(4). Спектр ЯМР 19F, δF, м. д.: 31.8 квинтет (С2F2,
3,4,6-трихлорбензолтиола 1 с тетрафторэтиле-
JFF ~4.0 Гц), 47.6 уш. с (F4, F7), 54.1 уш. с [C1(3)F2]
ном проводили в реакторе, состоящем из кварце-
[12]. Масс-спектр, m/z: 330 [M]+ (вычислено для
вой трубки (400×20 мм), нагреваемой в электри-
C9Cl2F8: 330).
ческой трубчатой печи. Исходное соединение 1
1,4-Дифтор-2,3,5,6-тетрахлорбензол
(5).
В
помещали в капельную воронку, присоединенную
ампулу помещали 3.33 г (13.35 ммоль) тиола 1,
к кварцевой трубке реактора, и расплавляли. До
добавляли 5.68 г PCl5 (27.60 ммоль) и медленно
начала реакции систему продували аргоном, за-
подогревали до вскипания. По окончании выделе-
тем тиол подавали одновременно с током тетра-
ния газа ампулу запаивали, помещали в металли-
фторэтилена (~15 л/ч). По окончании прибавления
ческий кожух и нагревали 5 ч при 200-202°C. По
соединения 1 в реактор подачу тетрафторэтилена
окончании реакции ампулу охлаждали, вскрывали,
прекращали. Продукты реакции собирали в кол-
содержимое переносили в колбу под слой воды со
бу, охлаждаемую ледяной водой, затем перегоня-
льдом (80-100 г). Смесь перемешивали 2 ч с це-
ли с паром. Органический слой отделяли, сушили
лью гидролиза соединений фосфора, затем добав-
CaCl2 и анализировали методами ГХ-МС, ГХ и
ляли 12.31 г Na2CO3 (116.83 ммоль) и перемеши-
ЯМР 19F. В таблице приведены условия реакций,
вали еще 2 ч, перегоняли с паром. Органический
составы реакционных смесей и выходы. Спектры
слой отделяли, сушили CaCl2, анализировали ме-
ЯМР 19F смесей использовали для идентификации
тодами ГХ и ЯМР 19F. Доля соединения 5 в смеси,
соединений 2, 3, 4. Для идентификации в смеси
по данным ГХ, ~98.9%, выход 2.98 г (88%), т. пл.
арена 5 проведен встречный синтез этого соедине-
74.9-75.3°C (т. пл. 76.5°C [13]). ИК спектр (KBr),
ния.
ν, см-1: 1632, 1487, 1444, 1394, 1346, 1296, 1252,
Перегонкой в вакууме (18-20 мм рт. ст.) 26.14 г
1180, 1130, 1117, 912, 879, 729, 633. УФ спектр
смеси, полученной в оп. 2 (см. таблицу), отобрали
(гексан), λmax, нм (ε, л·моль-1·см-1): 207 (2.032),
фракцию 20.32 г соединений 2 и 3 с температурой
227 (1.250), 282 (0.162), 290 (0.185). Спектр ЯМР
кипения ~105°C и чистотой 91.9 % (ГХ), соотно-
13C, δC, м. д.: 119.5 м (C2,3,5,6), 151.9 д. д (C1,4, 1JCF =
шение соединений 2 и 3 ~77:23 (по данным ЯМР
251.0, 4JCF = 5.0 Гц). Спектр ЯМР 19F: δF 51.2 м.
19F). Для смеси соединений 2 и 3 найдено, m/z:
д. [14, 15]. Найдено, %: С 28.64; Cl 56.15; F 15.51.
[M]+ 311.8995 (вычислено для C8Cl2F6S: 311.8997).
С6Cl2F4. Вычислено, %: С 28.61; Cl 56.30; F 15.09.
Ниже приведены данные спектров ЯМР, запи-
Синтез соединений 6 и 7. Окисление смеси
санных для смеси соединений 2 и 3.
соединений 2 и 3 (оп. 2, перегонка, см. выше) про-
2,2,3,3,4,7-Гексафтор-5,6-дихлор-2,3-дигид-
водили согласно известной методике [9]. К 9.76 г
робензо[b]тиофен (2). Спектр ЯМР 13C, δС, м. д.:
H5IO6 (42.82 ммоль) в 35 мл безводного CH3CN
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 11 2020
1652
НИКУЛЬШИН и др.
добавляли 0.37 г CrO3 (1.05 ммоль) и перемеши-
СПИСОК ЛИТЕРАТУРЫ
вали 30 мин при комнатной температуре, затем
1. Никульшин П.В., Максимов А.М., Гатилов Ю.В.,
добавляли 1.40 г смеси соединений 2 и 3 в 15 мл
Платонов В.Е. // ЖОХ. 2018. Т. 88. С. 1967;
безводного CH3CN. Перемешивали 3 ч при кипя-
Nikul’shin P.V., Maksimov A.M., Gatilov Yu.V., Plato-
чении. После удаления ацетонитрила добавляли
nov V.E. // Russ. J. Gen. 2018. Vol. 88. P. 2486. doi
~5 мл воды и 0.57 г Na2CO3 (5.38 ммоль), экстра-
10.1134/S107036321812006X
гировали CH2Cl2 (3×5 мл). Экстракт очищали,
2. Platonov V.E., Maksimov A.M., Maslovsky P.I. // J. Fluor.
пропуская его через силикагель, отгоняли CH2Cl2.
Chem. 1995. Vol. 75. N 1. P. 41. doi 10.1016/0022-
Получили 1.18 г смеси соединений 6 и 7 (93.1%,
1139(95)03294-N
ГХ) в соотношении ~75:25 (ЯМР 19F). 1.01 г сме-
3. Никульшин П.В., Максимов А.М., Гатилов Ю.В.,
си возгоняли в статическом вакууме (~2 мм рт. ст.)
Платонов В.Е. // ЖОХ. 2019. Т. 89. С. 1859;
при 150-160°C и выделяли 0.89 г смеси соедине-
Nikul’shin P.V., Maksimov A.M., Gatilov Yu.V., Plato-
ний 6 и 7 98.0%-ной чистоты (ГХ). 0.68 г смеси пе-
nov V.E. // Russ. J. Gen. 2019. Vol. 89. P. 2378. doi
рекристаллизовали из ~1.5 мл гексана при -30°C,
10.1134/S1070363219120090
промывали ~1.5 мл холодного гексана. Получили
4. Никульшин П.В., Максимов А.М., Платонов В.Е. //
0.58 г смеси соединений 6 и 7 (98.4%-ной чистоты,
ЖОрХ. 2012. Т. 48. Вып. 4. С. 538; Nikul’shin P.V.,
Maksimov A.M., Platonov V.E. // Russ. J. Org.
ГХ). Масс-спектр, m/z: [M]+ 343.8896 (вычислено
Chem. 2012. Vol. 48. N 4. P. 536. doi 10.1134/
для C8Cl2F6O2S: 343.8895). Найдено, %: С 27.75; Cl
S1070428012040124
20.46; F 33.30; S 9.35. C8Cl2F6O2S. Вычислено, %:
5. Никульшин П.В., Максимов А.М., Платонов В.Е. //
С 27.85; Cl 20.55; F 33.04; S 9.29. Ниже приведены
ЖОрХ. 2016. Т. 52. Вып. 1. С. 33; Nikul’shin P.V.,
данные спектров ЯМР, записанных для смеси сое-
Maksimov A.M., Platonov V.E. // Russ. J. Org.
динений 6 и 7.
Chem. 2016. Vol. 52. N 1. P. 25. doi 10.1134/
2,2,3,3,4,7-Гексафтор-5,6-дихлор-2,3-дигид-
S107042801601005X
робензо[b]тиофен-1,1-диоксид (6). Спектр ЯМР
6. Власова Л.В., Кобрина Л.С., Якобсон Г.Г. // ЖОрХ.
13C, δС, м. д.: 108.9 т. т. д (C3F2, 1JCF = 266.0, 2JCF =
1974. Т. 10. Вып. 4. С. 787.
23.0, JCF ~2.0 Гц), 113.1 т. т (C2F2, 1JCF = 305.0, 2JCF =
7. Kirmse W. Carbene Chemistry. New York: Academic
25.0 Гц), 113.9 т. д (C3a, 2JCF = 27.0, 2JCF = 18.0 Гц),
Press, 1971.
123.5 д. м (C7a, 2JCF ~22.0 Гц), 130.4 д. т (C5 либо C6,
8. Никульшин П.В., Максимов А.М., Платонов В.Е. //
2JCF = 19.0, JCF = 1.5 Гц), 131.5 д. т (C5 либо C6, 2JCF =
ЖОрХ. 2016. Т. 52. Вып. 2. С. 217; Nikul’shin P.V.,
19.0, JCF = 1.5 Гц), 149.6 д. д (C4 либо C7, 1JCF =
Maksimov A.M., Platonov V.E. // Russ. J. Org.
263.0, JCF = 4.0 Гц), 151.9 д. д (C4 либо C7, 1JCF =
Chem. 2016. Vol. 52. N 2. P. 200. doi 10.1134/
267.0, JCF = 4.0 Гц). Спектр ЯМР 19F, δF, м. д.: 42.4
S1070428016020068.
т (С2F2, JFF = 5.0 Гц), 49.9 д (F7, JF7F4 = 17.5 Гц),
9. Xu L., Cheng J., Trudell M.L. // J. Org. Chem. 2003.
Vol. 68. N. 13. P. 5388. doi 10.1021/jo030031n
51.3 д. т (F4, JF4F7 = 17.5, JF4F = 12.5 Гц), 55.8 д. т. д
10. Пушкина Л.Н., Степанов А.П., Жуков В.С. // ЖОрХ.
(С3F2, JFF4 = 12.5, JFF2 = 5.0, JFF7 = 1.0 Гц).
1972. Т. 8. Вып. 3. С. 586.
2,2,3,3,4,6-Гексафтор-5,7-дихлор-2,3-дигид-
11. Platonov V.E., Maksimov A.M. // Heteroatom Chem.
робензо[b]тиофен-1,1-диоксид (7). Спектр ЯМР
1992. Vol. 3. N. 4. P. 373. doi 10.1002/hc.520030411
19F, δF, м. д.: 42.6 т (С2F2, JFF = 5.0 Гц), 53.3 т. д (F4,
12. Никульшин П.В., Максимов А.М., Платонов В.Е. //
JF4F = 12.0, JF4F6 = 10.0 Гц), 56.0 д. т. д (С3F2, JFF4 =
ЖПХ. 2010. Т. 83. Вып. 7. С. 1148; Nikul’shin P.V.,
12.0, JFF2 = 5.0, JFF6 = 2.0 Гц), 64.1 д. т (F6, JF6F4 =
Maksimov A.M., Platonov V.E. // Russ. J. Appl.
10.0, JF6F = 2.0 Гц).
Chem. 2010. Vol. 83. N 7. P. 1254. doi 10.1134/
S1070427210070165
БЛАГОДАРНОСТЬ
13. Parshall G.W. // J. Org. Chem. 1962. Vol 27. N 12.
Авторы выражают благодарность Химическо-
P. 4649. doi 10.1021/jo01059a509
му исследовательскому центру коллективного
14. Молин Ю.Н., Кулакова Г.И., Платонов В.Е., Якоб-
пользования СО РАН за проведение спектральных
сон Г.Г. // ЖСХ. 1964. Т. 5. Вып. 5. С. 781; Mo-
и аналитических измерений.
lin Yu.N., Kulakova G.I., Platonov V.E., Yakobson G.G. //
J. Struct. Chem. 1965. Vol. 5. N 5. P.718. doi 10.1007/
КОНФЛИКТ ИНТЕРЕСОВ
BF00744062
Авторы заявляют об отсутствии конфликта
15. Bolton R., Sandall J.P.B. // J. Chem. Soc. Perkin Trans.
интересов.
2. 1976. P. 1541. doi 10.1039/P29760001541
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 11 2020
ТЕРМИЧЕСКИЕ ПРЕВР
АЩЕНИЯ 2,5-ДИФТОР-3,4,6-ТРИХЛОРБЕНЗОЛТИОЛА
1653
Thermal Transformations
of 2,5-Difluoro-3,4,6-trichlorobenzenethiol
with Tetrafluoroethylene
P. V. Nikul’shin, A. M. Maksimov, and V. E. Platonov*
Vorozhtsov Novosibirsk Institute of Organic Chemistry, Siberian Branch of the Russian Academy of Sciences,
Novosibirsk, 630090 Russia
*e-mail: platonov@nioch.nsc.ru
Received July 17, 2020; revised July 17, 2020; accepted July 29, 2020
Pyrolysis of a mixture of 2,5-difluoro-3,4,6-trichlorobenzenethiol with tetrafluoroethylene leads to
2,2,3,3,4,7-hexafluoro-5,6-dichloro-2,3-dihydrobenzo[b]thiophene (the major reaction product) along with
2,2,3,3,4,6-hexafluoro-5,7-dichloro-2,3-dihydrobenzo[b]thiophene. Schemes of their formation with the par-
ticipation of intermediate radicals are proposed. Oxidation of a mixture of the synthesized compounds gave
2,2,3,3,4,7-hexafluoro-5,6-dichloro-2,3-dihydrobenzo[b]sulfane-1,1-dioxide and 2,2,3,3,4,6-hexafluoro-5,7-di-
chloro-2,3-dihydrobenzo[b]sulfane-1,1-dioxide.
Keywords: 2,5-difluoro-3,4,6-trichlorobenzenethiol, tetrafluoroethylene, pyrolysis, 2,2,3,3,4,7-hexafluoro-
5,6-dichloro-2,3-dihydrobenzo[b]thiophene, 2,2,3,3,4,7-hexafluoro-5,6 dichloro-2,3-dihydrobenzo[b]sul-
fane-1,1-dioxide
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 11 2020