ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2020, том 90, № 11, с. 1661-1666
УДК [547.496.3:547.281.1:547.466]:66.095.253.095.832
АМИНОМЕТИЛИРОВАНИЕ СИММЕТРИЧНЫХ
ДИАЛКИЛТИОМОЧЕВИН ФОРМАЛЬДЕГИДОМ И
АМИНОКИСЛОТАМИ
© 2020 г. У. А. Маммериa, Ф. Хамудa, А. А. Собинаa, С. М. Рамшa,*, В. С. Фундаменскийa,
В. В. Гуржийb, Е. С. Храброваa
a Санкт-Петербургский государственный технологический институт (технический университет),
Московский пр. 26, Санкт-Петербург, 190013 Россия
b Санкт-Петербургский государственный университет, Санкт-Петербург, 199034 Россия
*е-mail: sramsh@technolog.edu.ru
Поступило в Редакцию 16 июля 2020 г.
После доработки 16 июля 2020 г.
Принято к печати 29 июля 2020 г.
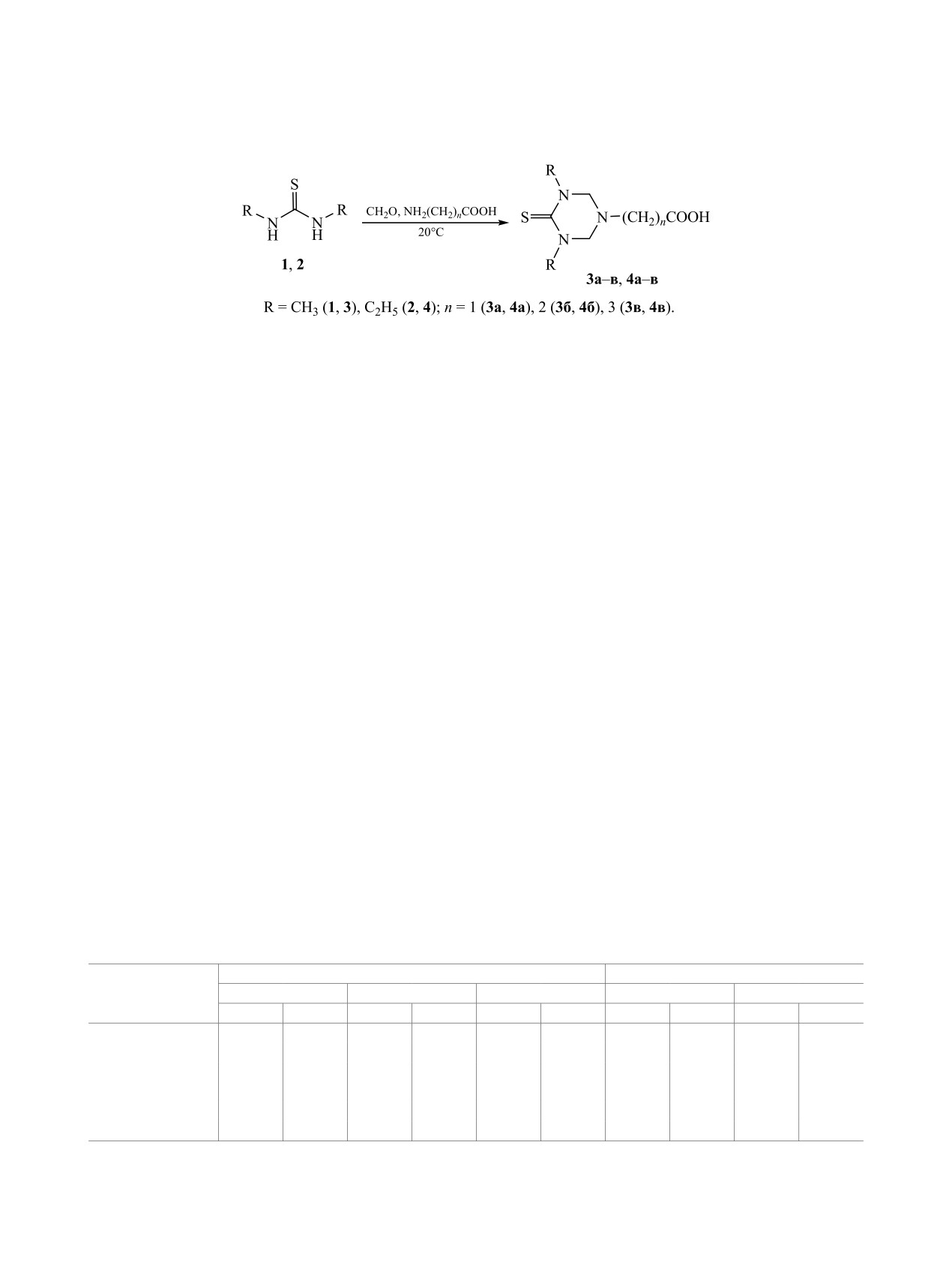
При конденсации 1,3-диалкилтиомочевины, формальдегида и терминальной аминокислоты С2, С3 или
С4, взятых в мольном соотношении 1:2:1, образуются терминально замещенные (3,5-диалкил-4-тиок-
со-1,3,5-триазинан-1-ил)карбоновые кислоты.
Ключевые слова: аминометилирование, 1,3-диалкилтиомочевины, формальдегид, ω-аминокислоты,
терминально замещенные (3,5-диалкил-4-тиоксо-1,3,5-триазинан-1-ил)карбоновые кислоты
DOI: 10.31857/S0044460X20110049
Аминометилирование незамещенной тио-
карственных форм [4] активных фармацевтиче-
мочевины формальдегидом и терминальными
ских ингредиентов с тиоуреидным фрагментом
аминокислотами С2-С4 хорошо изучено, в ре-
-HNC(=S)NH-.
зультате этой реакции получаются циклические
Оказалось, что, как и в случае незамещенной
тиомочевины - терминально замещенные (4-ти-
тиомочевины, 1,3-диметилтиомочевина 1 и 1,3-ди-
оксо-1,3,5-триазинан-1-ил)карбоновые кислоты
этилтиомочевина 2 в водном формальдегиде легко
[1, 2]. Из незамещенной мочевины и тех же ами-
вступают в реакцию с простейшими аминокисло-
нометилирующих агентов подобные соединения
тами - глицином, β-аланином и γ-аминомасляной
не образуются, возможно, из-за более быстрой
кислотой, образуя хорошо кристаллизующиеся
поликонденсации мочевины с формальдегидом,
терминально замещенные
(3,5-диалкил-4-тиок-
катализируемой аминокислотами, в то время как
со-1,3,5-триазинан-1-ил)карбоновые кислоты 3a-в
симметричные диалкилмочевины легко вступа-
и 4a-в с выходом 76-93% (схема 1).
ют в указанную реакцию аминометилирования с
Структура полученных соединений под-
образованием соответствующих терминально за-
тверждена методами ИК и ЯМР спектроскопии
мещенных
(3,5-диалкил-4-оксо-1,3,5-триазинан-
и масс-спектрометрии. В спектрах ЯМР 1Н со-
1-ил)карбоновых кислот [3].
единений 3 и 4 присутствует синглет цикличе-
Цель данной работы - получение тио-анало-
ских СH2-протонов в области 4.24-4.31 м. д., и
гов этих соединений, а именно (3,5-диалкил-4-ти-
сигналы протонов аминокислотных фрагментов
оксо-1,3,5-триазинан-1-ил)карбоновых
кислот,
и N-алкильных групп соответствующей интен-
путем конденсации симметричных диалкилти-
сивности (табл. 1). Сигналы карбоксильных про-
омочевин с формальдегидом и терминальными
тонов не проявляются, вероятно, из-за быстрого
аминокислотами С2-С4. Эта реакция представляет
обмена с протонами остаточной воды раствори-
практический интерес в плане получения проле-
теля. В спектрах ЯМР 13С присутствуют сигналы
1661
1662
МАММЕРИ и др.
Схема 1.
всех углеродных атомов: циклических при 66.2-
тиокарбамидного фрагмента O13A-H13A···S1A и
68.8 м. д., карбоксильных при 171.5-174.8 м. д., а
O13-H13···S1 (рис. 1). Каждая из цепей уложена
также аминокислотных фрагментов и N-алкиль-
в спиральную колонку. Таким образом, кристал-
ных групп (табл. 1). В ИК спектрах присутствуют
лическая структура состоит из двух типов спи-
характерные сигналы тиоуреидного фрагмента в
ральных колонок. Обе спирали закручены в одну
диапазоне 1512-1530 см-1 и карбоксильной груп-
сторону, причем их оси направлены вдоль оси
пы в диапазоне 1691-1738 см-1. Определенные
b. Между спиральными колонками реализуются
масс-спектрометрическим методом молекулярные
ван-дер-ваальсовы контакты S1A···H5A, S1A···H11A
массы соединений 3 и 4 соответствуют вычислен-
и S1···H3A, S1···H5B.
ным значениям.
В аналогичные бесконечные цепи связаны и
Строение соединений 3a и 4a-в подтверж-
молекулы оксо-аналога этого соединения, а также
дено методом рентгеноструктурного анализа
оксо-аналога метильного производного 3a за счет
(табл. 2). В триазинановом цикле соединений 3a,
межмолекулярных водородных связей карбок-
4a-в, как и в случае их оксо-аналогов [1], пять из
сильной группы и кислорода карбамидного фраг-
шести атомов цикла лежат в одной плоскости, и
мента [1].
лишь атом азота аминокислотного фрагмента вы-
В молекулах соединений 4б и 4в карбоксиль-
ходит из этой плоскости. У всех этильных произ-
ный водород разупорядочен 50:50 между двумя
водных 4a-в этильные фрагменты и аминокислот-
карбоксильными кислородами (рис. 2). Другой
ная ветвь обращены в одну сторону относительно
особенностью строения соединений 4б и 4в яв-
триазинанового цикла. В отличие от этого, у ок-
ляется образование в кристалле димеров за счет
со-аналога соединения 4a этильные ветви и ами-
межмолекулярных водородных связей (рис.
2,
нокислотная ветвь отклоняются в разные стороны
табл. 3). Димерные структуры реализуются и в
[1].
кристалле соединения 3а. Стоит также отметить,
В независимой части ячейки соединения 4а
что в структуре соединения 3а плоскости кар-
находятся две не связанные элементами симме-
боксильных групп в димерах ориентированы па-
трии молекулы. Молекулы каждого типа связаны
раллельно друг другу и примерно параллельно
в бесконечные цепи за счет межмолекулярных во-
плоскости (131), тогда как в структуре оединения
дородных связей карбоксильной группы и серы
4в плоскости имеют две системы ориентировки,
Таблица 1. Химические сдвиги (м. д.) сигналов аминокислотного фрагмента и алкильных групп в спектрах ЯМР
1H и 13C соединений 3a-в и 4a-в в ДМСО-d6
Аминокислотный фрагмент
N-Алкильные группы
Соединение
α-CH2
β-CH2
γ-CH2
CH2
CH3
1Н
13С
1Н
13С
1Н
13С
1Н
13С
1Н
13С
3a
3.44
52.31
-
-
-
-
-
-
3.14
39.66
3б
2.47
33.53
2.84
47.19
-
-
-
-
3.15
39.64
3в
2.26
31.70
1.70
23.25
2.60
50.38
-
-
3.14
39.66
4a
3.35
51.71
-
-
-
-
3.68
45.55
1.05
12.54
4б
2.47
33.49
2.75
46.82
-
-
3.70
45.62
1.07
12.71
4в
2.27
31.69
1.71
23.21
2.53
49.98
3.68
45.59
1.06
12.70
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 11 2020
АМИНОМЕТИЛИРОВАНИЕ СИММЕТРИЧНЫХ ДИАЛКИЛТИОМОЧЕВИН
1663
Таблица 2. Основные кристаллографические параметры соединений 3a, 4a-в
Параметр
3a
4a
4б
4в
CCDC
1992488
1966734
1966741
1966744
Брутто-формула
C7H13N3O2S
C9H17N3O2S
C10H19N3O2S
C11H21N3O2S
Сингония
Триклинная
Моноклинная
Моноклинная
Моноклинная
Пространственная группа
P-1
P21/n
P21/c
P21/c
Температура, K
100
130
130
130
a, Å
7.14196(11)
16.65752(16)
12.8937(3)
11.55799(17)
b, Å
8.36169(14)
8.38419(8)
8.29026(17)
8.40325(12)
c, Å
8.41726(14)
17.30894 (16)
11.7536 (2)
14.1073 (2)
α, град
96.0650(14)
β, град
105.2343(14)
107.6224(11)
104.077(2)
91.9265(13)
γ, град
104.1754 (14)
V, Å3
462.41(1)
2303.92(4)
1218.63(4)
1369.39(3)
Z
2
8
4
4
Излучение
CuKα
μ, мм-1
2.91
2.40
2.30
2.07
Размер кристалла, мм
0.24 × 0.18 × 0.14
0.22 × 0.18 × 0.13
0.25 × 0.17 × 0.02
0.17 × 0.12 × 0.09
Tmin, Tmax
0.825, 1.000
0.823, 1.000
0.497, 1.000
0.956, 1.000
Измеренные, независимые и
6194, 1708, 1696
11431, 4292, 3874
5374, 2236, 1985
6329, 2548, 2286
наблюдаемые [I > 2σ(I)] рефлексы
Rint
0.018
0.029
0.030
0.025
θmin, θmax, град)
5.5, 70.0
3.2, 70.0
6.4, 70.0
3.8, 69.9
Количество рефлексов
1708
4292
2236
2548
Уточняемые параметры
122
277
155
164
Δρmax/Δρmin, e/Å3
0.30/-0.24
0.53/-0.32
0.26/-0.23
0.19/-0.22
приблизительно параллельно плоскостям (212) и
пользованы сигналы остаточных протонов и ядер
(2-12), расположенные под углом ~51.8(1)° друг к
13С ДМСО-d6. Масс-спектры получены в Ресурс-
другу, что, вероятно, может быть связано с боль-
ном центре Санкт-Петербургского государствен-
шей длиной аминокислотной ветви.
ного университета «Методы анализа состава ве-
щества» на хромато-масс-спектрометре MaXis 62
Таким образом, симметричные диалкилтиомо-
(Bruker Daltonik GmbH), оснащенном источни-
чевины, подобно их оксо-аналогам и самой ти-
ком электроспрей-ионизации (4.5 эВ) и квадру-
омочевине, легко вступают в реакцию аминоме-
поль-времяпролетным масс-анализатором (ESI-
тилирования формальдегидом и терминальными
аминокислотами С2-4 с образованием терминаль-
нозамещенных
(3,5-диалкил-4-тиоксо-1,3,5-три-
азинан-1-ил)карбоновых кислот. Изученная реак-
ция может рассматриваться в качестве модельной
при разработке пролекарственных форм лекар-
ственных молекул с тиоуреидным фрагментом
-HNC(=S)NH-.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
ИК спектры зарегистрированы на спектроме-
тре Shimadzu FTIR-8400S в таблетках KBr. Спек-
тры ЯМР 1Н и 13С зарегистрированы на спектро-
метре Bruker Avance III-400 (400 и 100 МГц) в
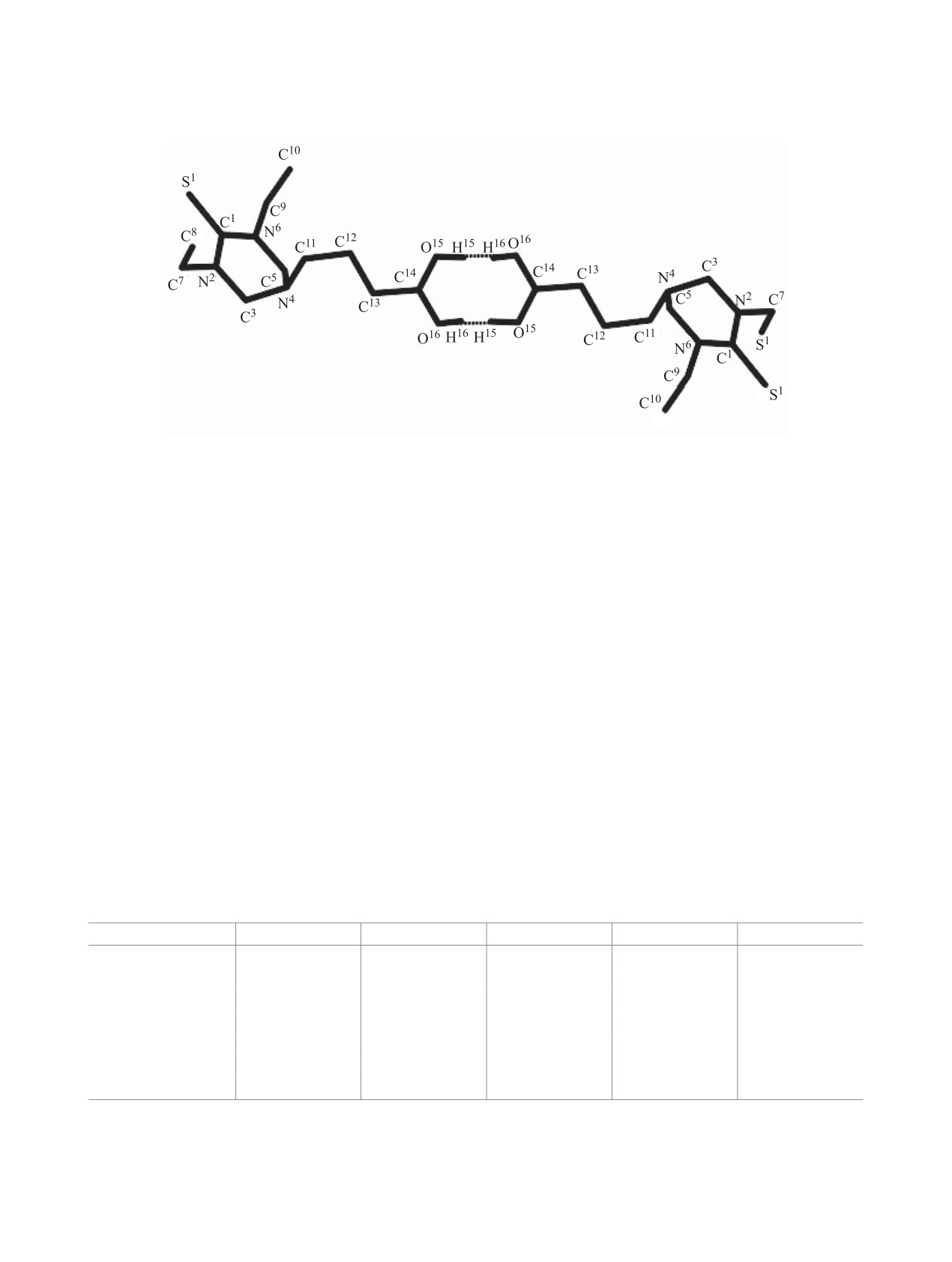
Рис. 1. Межмолекулярные водородные связи в беско-
нечных цепях структуры 4a.
ДМСО-d6, в качестве внутреннего стандарта ис-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 11 2020
1664
МАММЕРИ и др.
Рис. 2. Межмолекулярные водородные связи в димерной структуре 4в.
QTOF) в режиме детектирования положительных
смесь оставляли на ночь, затем отфильтровывали
ионов, растворитель - метанол.
и сушили образовавшиеся прозрачные ромбиче-
ские кристаллы. Выход 3.27 г (80.5 %), т. пл. 170°С
Основные кристаллографические параметры
структур 3a, 4a-в, а также условия съемки приве-
(C2H5OH). ИК спектр, ν, см-1: 1525 с (C=S + C-N),
дены в табл. 2. Структуры решены прямым мето-
1711 c (C=O), 2880, 2932 сл (CH2), 2400-3200 ш
дом и уточнены в анизотропном приближении для
(ОН). Спектр ЯМР 1H, δ, м. д.: 3.14 с (6H, NCH3),
неводородных атомов полноматричным методом
3.44 (2H, NCH2СOOH), 4.31 (4H, CH2цикл), 12.57
наименьших квадратов с помощью программного
с (1H, OH). Спектр ЯМР 13С{1Н}, δС, м. д.: 39.66
комплекса SHELXL 2018 [5]. Рентгеноструктур-
(CH3), 52.31 (NCH2COO), 68.76 (NCH2N), 178.85
ные исследования выполнены в Ресурсном центре
(C=S), 171.58 (COOH). Масс-спектр, m/z: 204.0801
Санкт-Петербургского государственного универ-
[M + H]+ (вычислено для C7H13N3O2S: 204.0801),
ситета «Рентгенодифракционные методы исследо-
226.0624 [M + Na]+ (вычислено для C7H13N3NaO2S:
вания».
226.0621).
2-(3,5-Диметил-4-тиоксо-1,3,5-триазинан-
3-(3,5-Диметил-4-тиоксо-1,3,5-триазинан-
1-ил)уксусная кислота (3a). К раствору
2.08
1-ил)пропановая кислота (3б). К раствору 2.08 г
г (0.02 моль) диметилтиомочевины (1) в 3.36 г
(0.02 моль) диметилтиомочевины (1) в 3.36 г
(0.04 моль) 36%-ного формалина одномоментно
(0.04 моль) 36%-ного формалина одномомент-
добавляли 1.50 г (0.02 моль) глицина и перемеши-
но добавляли 1.78 г (0.02 моль) β-аланина и пе-
вали до его полного растворения. Реакционную
ремешивали до его полного растворения. Через
Таблица 3. Параметры водородных связей в кристаллической ячейке соединений 3a, 4a-ва
Соединение
D-H···A
d(D···A), Å
d(D-H), Å
d(H···A), Å
D—H···A, град
3a
O10···O11 (i)
2.651
0.82
1.83
178
4a
O13···S1 (ii)
3.137
0.82
2.33
171
O13A···S1A (iii)
3.168
0.82
2.35
173
4б
O15···O14 (iv)
2.633
0.91
1.74
164
O14···O15 (iv)
2.633
0.75
1.89
172
4в
O15···O16 (v)
2.648
0.91
1.74
176
O16···O15 (v)
2.648
0.74
1.91
173
а Операторы симметрии: (i) -x+2, -y, -z+1; (ii) -x+3/2, y+1/2, -z+3/2; (iii) -x+3/2, y-1/2, -z+1/2; (iv) -x+1, -y, -z+2; (v) -x+1, -y+1,
-z-1.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 11 2020
АМИНОМЕТИЛИРОВАНИЕ СИММЕТРИЧНЫХ ДИАЛКИЛТИОМОЧЕВИН
1665
20 мин наблюдалось образование белого кристал-
(CH2), 2480-3360 ш (ОН). Спектр ЯМР 1H, δ,
лического осадка. Смесь оставляли на 2 сут, оса-
м. д.: 1.05 т (6H, NCH2CH3, J = 7.0 Гц), 3.35 с (2H,
док отфильтровывали, промывали этанолом и су-
NCH2СOOH), 3.68 к (4H, NCH2CH3, J = 7.0 Гц),
шили в вакуум-эксикаторе. Выход 3.78 г (87.1%),
4.30 с (4H, CH2цикл). Спектр ЯМР 13С{1H}, δС,
т. пл. 169°С (C2H5OH). ИК спектр, ν, см-1: 1519 с
м. д.:
171.51 (СOOH),
176.44 (С=S),
66.45
(C=S + C-N), 1711 c (C=O), 2868, 2932 сл (CH2),
(NCH2N), 51.71 (NCH2COOH), 45.55 (NCH2CH3),
2560-3360 ш (ОН). Спектр ЯМР 1H, δ, м. д.: 2.47
12.54 (NCH2CH3). Масс-спектр, m/z:
232.1102
т (2H, NCH2CH2СOOH, J = 7.0 Гц), 2.84 т (2H,
[M + H]+ (вычислено для C9H17N3O2S: 232.1114),
NCH2CH2СOOH, J = 7.0 Гц), 3.15 с (6H, NCH3),
254.0922 [M + Na]+ (вычислено для C9H17N3NaO2S:
4.27 с (4H, СH2цикл). Спектр ЯМР 13С{1Н}, δС,
254.0934).
м. д.: 39.64 (CH3), 33.53 (NCH2CH2COOH), 47.19
3-(3,5-Диэтил-4-тиоксо-1,3,5-триазинан-
(NCH2CH2COOH), 68.49 (NCH2N), 178.68 (C=S),
1-ил)пропановая кислота (4б) получена анало-
173.73 (COOH). Масс-спектр, m/z:
218.0956
гично из 1.32 г (0.01 моль) диэтилтиомочевины 2,
[M + H]+ (вычислено для C8H15N3O2S: 218.0957),
1.68 г (0.02 моль) 36%-ного формалина и 0.89 г
240.0773 [M + Na]+ (вычислено для C8H15N3NaO2S:
(0.01 моль) β-аланина. Выход 2.23 г (90.9%),
240.0777).
т. пл. 117-119°С (ацетона). ИК спектр, ν, см-1:
4-(3,5-Диметил-4-тиоксо-1,3,5-триазинан-
1512 с (C=S + C-N), 1691, 1714 c (C=O), 2929,
1-ил)бутановая кислота (3в). К раствору 3.43 г
2958, 2985 сл (CH2), 2480-3360 ш (ОН). Спектр
(0.033 моль) диметилтиомочевины 1 в 5.55 г
ЯМР 1H, δ, м. д.: 1.07 т (6H, NCH2CH3, J = 7.0 Гц),
(0.066 моль) 36%-ного формалина одномоментно
2.47 т (2H, NCH2CH2СOOH, J = 7.1 Гц), 2.75 т
добавляли 3.40 г (0.033 моль) γ-аминомасляной
(2H, NCH2CH2СOOH, J = 7.1 Гц), 3.70 к (4H,
кислоты и перемешивали до ее полного растворе-
NCH2CH3, J = 7.0 Гц), 4.25 с (4H, CH2цикл). Спектр
ния. Реакционную смесь оставляли на ночь, затем
ЯМР 13С{1H}, δС, м. д.: 173.65 (СOOH), 176.48
переносили в чашку Петри и упаривали под током
(С=S), 66.35 (NCH2N), 46.82 (NCH2CH2COOH),
теплого воздуха. Через 2 ч наблюдалось образова-
45.62 (NCH2CH3), 33.49 (NCH2CH2COOH), 12.71
ние кристаллического осадка, который оставляли
(NCH2CH3). Масс-спектр, m/z: 246.1272 [M + H]+
на ночь. Прозрачные ромбические кристаллы от-
(вычислено для C10H19N3O2S: 246.1270), 268.1090
фильтровывали и сушили в вакууме. Выход 5.82 г
[M
+ Na]+ (вычислено для C10H19N3NaO2S:
(76.2%), т. пл. 137-139°С (C2H5OH). ИК спектр,
268.1090).
ν, см-1: 1530 с (C=S + C-N), 1705 c (C=O), 2904,
4-(3,5-Диэтил-4-тиоксо-1,3,5-триазинан-
2935 сл (CH2), 2500-3280 ш (ОН). Спектр ЯМР
1-ил)бутановая кислота (4в) получена анало-
1H, δ, м. д.: 1.70 м (2H, CH2CH2CH2), 2.26 т (2H,
гично из 1.32 г (0.01 моль) диэтилтиомочевины
CH2COOH, J = 7.2 Гц), 2.60 т (2H, NCH2, J = 7.2 Гц),
2, 1.68 г (0.02 моль) 36%-ного формалина и 1.03 г
3.14 с (6H, CH3), 4.26 с (4H, CH2цикл). Спектр ЯМР
(0.01 моль) γ-аминомасляной кислоты. Вы-
13С{1Н}, δС, м. д.: 23.25 (NCH2CH2CH2COOH),
ход 2.22 г (85.6%), т. пл. 81-83°С. ИК спектр, ν,
31.70 (NCH2CH2CH2COOH), 39.66 (CH3), 50.38
см-1: 1517 с (C=S + C-N), 1695, 1710 c (C=O),
(NCH2CH2CH2COOH),
68.42 (NCH2N),
178.64
2895, 2920, 2980 сл (CH2), 2590-3370 ш (ОН).
(C=S), 174.80 (COO). Масс-спектр, m/z: 232.1114
Спектр ЯМР 1H, δ, м. д.: 1.06 т (6H, NCH2CH3,
[M + H]+ (вычислено для C9H17N3O2S: 232.1114),
J = 7.0 Гц), 1.71 м (2H, NCH2CH2CH2СOOH), 2.27
254.0934 [M + Na]+ (вычислено для C9H17N3NaO2S:
т (2H, NCH2CH2CH2СOOH, J = 7.2 Гц), 2.53 т
254.0934).
(2H, NCH2CH2CH2СOOH, J = 7.1 Гц), 3.68 к (4H,
2-(3,5-Диэтил-4-тиоксо-1,3,5-триазинан-
NCH2CH3, J = 7.0 Гц), 4.24 с (4H, CH2цикл). Спектр
1-ил)уксусная кислота (4a) получена аналогично
ЯМР 13С{1H}, δС, м. Д.: 174.77 (СOOH), 176.41
из 1.32 г (0.01 моль) диэтилтиомочевины 2, 1.68 г
(С=S), 66.21 (NCH2N), 49.98 (NCH2CH2CH2COOH),
(0.02 моль) 36%-ного формалина и 0.75 г (0.01
45.59 (NCH2CH3),
23.21 (NCH2CH2CH2COOH),
моль) глицина. Выход 2.15 г (93.0%), т. пл. 129-
31.69 (NCH2CH2CH2COOH),
12.70 (NCH2CH3).
131°С (ацетон). ИК спектр, ν, см-1: 1528 с (C=S +
Масс-спектр, m/z: 282.1237 [M + Na]+ (вычислено
C-N), 1706, 1738 c (C=O), 2937, 2967, 2985 сл
для C11H21N3NaO2S: 282.1247).
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 11 2020
1666
МАММЕРИ и др.
ФОНДОВАЯ ПОДДЕРЖКА
sky V.S., Solov’eva S.Yu., Zakharov V.I. // Russ. J.
Gen. Chem. 2012. Vol. 82. N 2. P. 236. doi 10.1134/
Работа выполнена в рамках программы Ми-
S1070363212020132
нистерства науки и высшего образования РФ
2. Рамш С.М., Хамуд, Ф., Храброва Е.С. // Изв. СПбГТИ
785.00Х60.19.
(ТУ). 2019. № 50 (76). С. 72.
3. Хамуд Ф., Маммери У., Чуйко А.В., Рамш С.М.,
КОНФЛИКТ ИНТЕРЕСОВ
Фундаменский В.С., Гуржий В.В., Храброва Е.С. //
Авторы заявляют об отсутствии конфликта
Изв. СПбГТИ (ТУ). 2019. № 51 (77). С. 56. doi
интересов.
10.36807/1998-9849-2019-51-77-56-60
4. Кузнецов С.Г., Чигарева С.М., Рамш С.М. // Итоги
СПИСОК ЛИТЕРАТУРЫ
науки и техники. Сер. Органическая химия. Т. 19.
1. Сун Миньянь, Рамш С.М., Фундаменский В.С., Со-
M.: ВИНИТИ, 1991. 176 с.
ловьева С.Ю., Захаров В.И. // ЖОХ. 2012. Т. 82.
5. Sheldrick G.M. // Acta Crystallogr. (C). 2015. Vol. 71.
Вып. 2. С. 240; Minyan S., Ramsh S.M., Fundamen-
N 1. P. 3. doi 10.1107/S2053229614024218
Aminomethylation of Symmetric Dialkylthioureas
with Formaldehyde and Amino Acids
O. A. Mammeria, F. Hamouda, A. A. Sobinaa, S. M. Ramsha,*,
V. S. Fundamenskya, V. V. Gurzhiyb, and E. S. Khrabrovaa
a St. Petersburg State Institute of Technology (Technical University), St. Petersburg, 190013 Russia
b St. Petersburg State University, St. Petersburg, 199034 Russia
*e-mail: sramsh@technolog.edu.ru
Received July 16, 2020; revised July 16, 2020; accepted July 29, 2020
Condensation of 1,3-dialkylthiourea, formaldehyde and terminal amino acids C2, C3 or C4 taken in a molar
ratio of 1:2:1 gives rise to terminally substituted (3,5-dialkyl-4-thioxo-1,3,5-triazinan-1-yl)carboxylic acids.
Keywords: aminomethylation, 1,3-dialkylthioureas, formaldehyde, ω-amino acids, terminally substituted
(3,5-dialkyl-4-thioxo-1,3,5-triazinan-1-yl)carboxylic acids
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 11 2020