ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2020, том 90, № 11, с. 1667-1672
УДК 541.49:546.98:547.874
ПАЛЛАДИЙ-ПРОМОТИРУЕМОЕ РАСЩЕПЛЕНИЕ
СВЯЗИ УГЛЕРОД-АЗОТ В ПРОИЗВОДНЫХ
1,3,5-ТРИАЗИНАНА
© 2020 г. Ю. И. Муринов, Л. Г. Голубятникова*, Р. А. Хисамутдинов
А. Г. Бадамшин, В. А. Докичев
Уфимский Институт химии Уфимского федерального исследовательского центра Российской академии наук,
пр. Октября 69, Уфа, 450054 Россия
*e-mail: hisam@anrb.ru
Поступило в Редакцию 18 июня 2020 г.
После доработки 6 июля 2020 г.
Принято к печати 9 июля 2020 г.
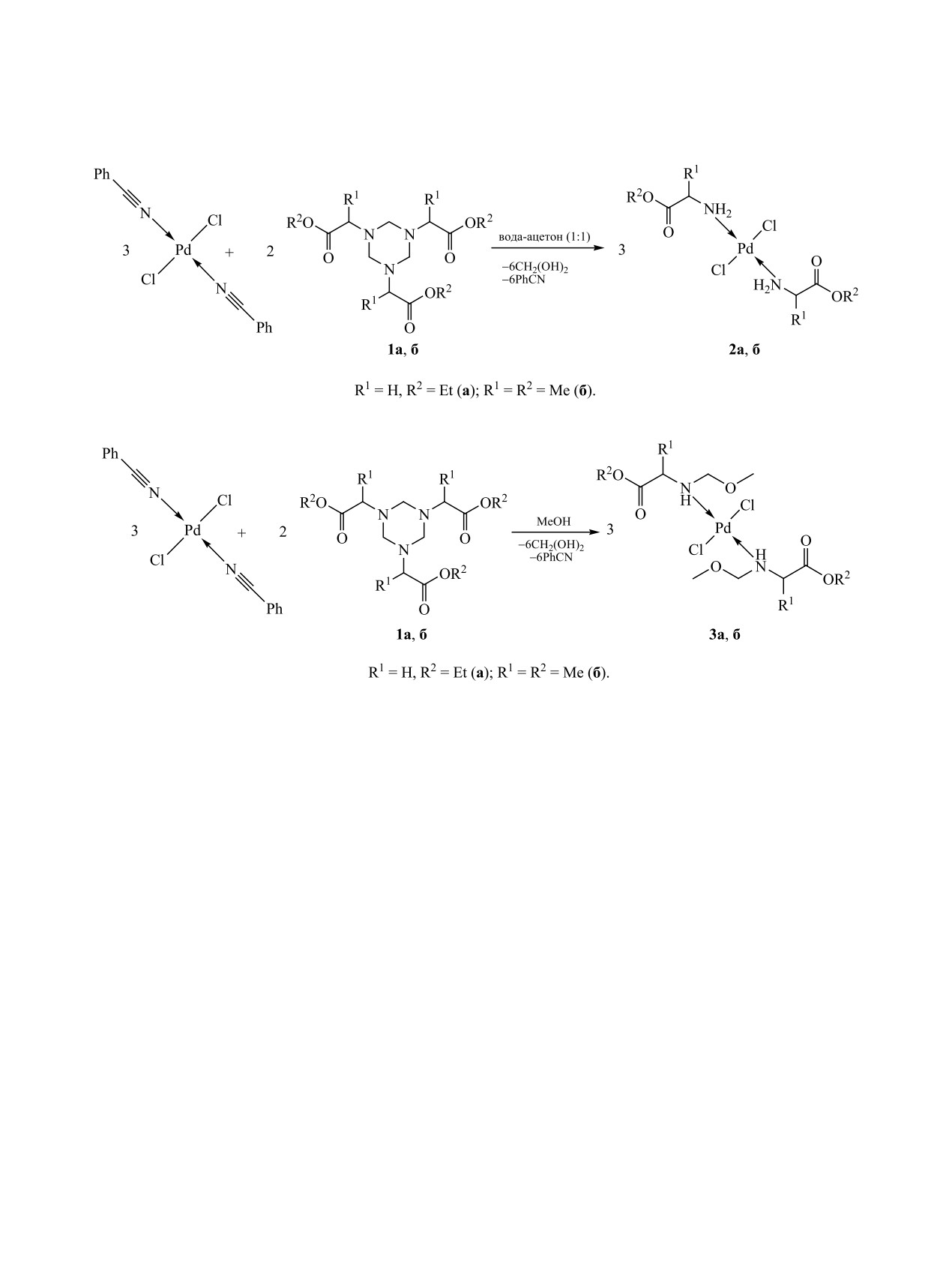
Синтезированы транс-дихлорокомплексы палладия(II) с эфирами аминокислот состава PdCl2L2 путем
селективного гидролитического расщепления связи азот-углерод в 1,3,5-трис(этоксикарбонилметил)- и
1,3,5-трис[(S)-1′-(метоксикарбонил)этил]-1,3,5-триазинанах под действием палладия(II) в метаноле и
водно-ацетоновом растворе. В результате нуклеофильной атаки воды или метанола в комплексах пал-
ладия(II) с исходными триазинанами происходит селективное расщепление 1,3,5-триазинанового цикла
с образованием дихлорокомплексов палладия(II) с эфирами аминокислот.
Ключевые слова: 1,3,5-триазинаны, эфиры аминокислот, комплексы палладия
DOI: 10.31857/S0044460X20110050
В последнее время особое внимание исследо-
исходит мягкое расщепление связи C-N под дей-
вателей направлено на синтез комплексов пал-
ствием катализаторов на основе Pd(II) [9-12].
ладия(II), обладающих схожей или лучшей про-
Взаимодействием соединений палладия(II) с
тивоопухолевой активностью по сравнению с
1,3,5-триазинанами 1a, б при мольном соотноше-
комплексами платины(II) [1]. В частности, деталь-
нии Pd(II):1 = 3:2 в смеси вода-ацетон (1:1) или
но исследовано взаимодействие солей и комплек-
метаноле получены комплексы 2а, б или 3a, б со-
сов переходных металлов с аминокислотами раз-
ответственно (схема 1).
личного строения [2-6]. В то же время данные по
В спектре ЯМР 1Н комплекса 2a присутству-
синтезу координационных соединений металлов
ет уширенный синглет протонов NH2-групп при
платиновой группы с эфирами аминокислот не-
3.19 м. д., а в спектре комплекса 2б - сигналы ди-
многочисленны [7, 8]. Учитывая перспективность
астереотопных протонов групп NH2 при 3.30 и
комплексов палладия(II) как потенциальных про-
3.94 м. д. с константой спин-спинового взаимодей-
тивоопухолевых препаратов, разработка нового
ствия 10.5 Гц. Отсутствие в спектрах сигнала прото-
удобного метода синтеза хлорокомплексов Pd(II)
нов триазинанового цикла при 3.66 м. д. указывает
с эфирами аминокислот является весьма актуаль-
на расщепление связей С-N цикла вследствие ну-
ной.
клеофильной атаки воды. Отметим, что соедине-
Целью настоящей работы является изучение
ния 1a, б не образуют комплексы с Pd(II) [13, 14].
Pd-промотируемого гидролитического селектив-
В ИК спектрах комплексов 2a, б полоса ν(С-N),
ного расщепления связи C-N в 1,3,5-трис(этокси-
присутствующая в спектрах исходных триазина-
карбонилметил)- (1a) и 1,3,5-трис[(S)-1′-(меток-
нов 1a, б при 1238 см-1, отсутствует, но имеют-
сикарбонил)этил]-1,3,5-триазинанах (1б) в смеси
ся сильные полосы поглощения при 3285, 3146
вода-ацетон или метаноле. В этих условиях про-
и 1580 см-1, относящиеся к νas(NH2), νs(NH2) и
1667
1668
МУРИНОВ и др.
Схема 1.
Схема 2.
δ(NH2) соответственно [15-17]. В дальней обла-
исходных триазинанов, относится к NH-протону.
сти появляются полосы поглощения при 559 и
В ИК спектрах комплексов 3а, б появляется ин-
350 см-1, которые можно отнести к валентным
тенсивная полоса поглощения валентных колеба-
колебаниям связей Pd-N и Pd-Cl соответственно
ний NH-группы (3233 см-1). Интенсивная полоса
[18-20]. Наличие одной сильной полосы ν(Pd-Cl)
поглощения при 339 см-1 относится к валентным
свидетельствует о транс-конфигурации комплек-
колебаниям связи Pd-Cl в комплексах типа trans-
сов. Таким образом, при взаимодействии соеди-
PdCl2L2. Слабую полосу поглощения при 474 см-1,
нений Pd(II) с реагентами 1a, б в водно-ацетоно-
отсутствующую в спектрах соединений 1а, б, мож-
вой среде происходит селективное расщепление
но отнести к валентным колебаниям связи Pd-N.
связей С-N триазинанового цикла с образованием
Таким образом, в среде метанола взаимодей-
транс-комплексов 2a, б.
ствие триазинанов 1а, б с соединениями Pd(II)
Внутренняя координационная сфера транс-
протекает с образованием транс-дихлоробис-
комплексов палладия(II) состоит из двух атомов
(этил-N-метоксиметил)глицината
3a и транс-
азота молекул этилглицината (метилаланината) и
дихлоробис(метил-N-метоксиметил)аланината
двух хлорид-ионов, атомы кислорода в координа-
Pd(II) 3б. Pd-Промотируемая реакция селектив-
ции участия не принимают.
ного гидролитического расщепления связи C-N
При взаимодействии соединений Pd(II) с триа-
1,3,5-триазинанового цикла в метаноле и вод-
зинанами 1а, б в метаноле образуются комплексы
ном ацетоне может служить методом синтеза
3а, б (схема 2), спектры которых существенно от-
транс-дихлорокомплексов Pd(II) с эфирами ами-
личаются от спектров исходных соединений.
нокислот состава PdCl2L2.
Уширенный сигнал в спектрах ЯМР 1Н соедине-
Мы предположили, что процесс гидролиза и
ний 3а, б при 4.63 м. д., отсутствующий в спектрах
алкоголиза триазинанового цикла протекает в две
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 11 2020
ПАЛЛАДИЙ-ПРОМОТИРУЕМОЕ Р
АСЩЕПЛЕНИЕ СВЯЗИ УГЛЕРОД-АЗОТ
1669
стадии с первоначальным образованием хлоро-
Методами ЯМР 1H и масс-спектрометрии изуче-
комплекса Pd(II) с соединениями 1a, б и после-
но воздействие нуклеофильных агентов (метанол,
дующим селективным расщеплением связи C-N
вода) на комплекс 4б. В данных средах вследствие
под действием нуклеофильных реагентов, при-
реакций алкоголиза и гидролиза триазинановых
водя к транс-дихлорокомплексам Pd(II) с эфи-
циклов в комплексе 4б образуются комплексы 3б
рами аминокислот. Для подтверждения предло-
и 2б соответственно. Так, при растворении ком-
женного механизма был синтезирован комплекс
плекса 4б в CD3OD в спектре ЯМР 1H появляются
бис{1,3,5-трис[(метоксикарбонил)этил]-1,3,5-три-
новые сигналы при 4.63 и 3.31 м. д., соответству-
азинан}дихлоропалладий(II) 4б в дихлорметане
ющие группам NH и CH3OCH2 в комплексе 3б. В
при мольном соотношении исходных реагентов
спектре комплекса 4б в ацетоне-d6 при добавлении
Pd:1б = 1:2. По данным элементного анализа, по-
D2O появляются сигналы протонов NH2-группы
лученный комплекс имеет состав PdCl2(1б)2. В
комплекса 2б при 3.30 и 3.90 м. д. В масс-спектре
спектре ЯМР 1Н комплекса 4б по сравнению со
реакционной массы в метаноле наблюдается пик c
спектром триазинана 1б нет смещения сигналов
m/z 470.3, соответствующий продукту реакции 3б.
групп протонов 1, 2 и 4 в двух метилаланинатных
В масс-спектре реакционной массы в среде вода-
заместителях и протонов метиленовой группы ча-
ацетон присутствует пик c m/z 378.3 с характерным
сти гетероцикла -NCH2N-. В то же время сигналы
изотопным распределением по палладию и хлору,
протонов метиленовых групп -CH2NCH2- смеща-
относящийся к основному продукту реакции 2б.
ются в слабое поле на 0.07-0.17 м. д. Наибольшее
Таким образом, синтез транс-дихлорокомплек-
слабопольное смещение при комплексообразова-
сов палладия(II) с эфирами аминокислот происхо-
нии, на 0.4 и 0.21 м. д. соответственно, наблюдает-
дит с первоначальным образованием комплексов
ся для сигналов протонов метильной и метиновой
1,3,5-триазинана с палладием(II) и последующим
групп третьего метилаланинатного фрагмента, в
селективным расщеплением связи азот-углерод
то время как сигнал протонов при сложноэфирной
триазинанового цикла под действием нуклеофиль-
группе положения практически не меняет. Это по-
ных реагентов.
зволяет утверждать, что комплексообразование со-
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
единений Pd(II) с двумя молекулами триазинана 1б
обусловлено координацией одного из атомов азота
ИК спектры регистрировали на спектрометре
реагента. В ИК спектре комплекса 4б по сравне-
Specord M80 в области 4000-250 см-1 (вазелино-
нию со спектром исходного триазинана появляет-
вое масло, KRS-5). Спектры ЯМР записывали на
ся одна сильная полоса поглощения ν(Pd-Cl) при
спектрометре Bruker Avance III (500 МГц). Темпе-
358 см-1, характерная для комплексов типа trans-
ратуры плавления определяли на нагревательном
PdCl2L2. Полосу поглощения средней интенсивно-
столике Boеtius. Масс-спектры регистрировали на
сти при 520 см-1, отсутствующую в спектре соеди-
жидкостном квадрупольном масс-спектрометре
нения 1б, можно отнести к валентным колебаниям
Shimadzu LCMS-2010EV химической ионизацией
связи Pd-N. Полоса поглощения ν(C-N) триазина-
при атмосферном давлении (APCI) в режиме де-
нового цикла при 1238 см-1 в спектре комплекса
тектирования положительных и отрицательных
расщепляется на две, одна из которых сдвигается в
ионов.
дальнюю область на 18 см-1, а другая положения не
В работе использовали тетрахлоропалладат(II)
меняет [15]. Можно утверждать, что в результате
калия K2PdCl4 и лития Li2PdCl4, бис(ацетонитрил)-
комплексообразования в среде дихлорметана раз-
дихлоропалладий(II) и бис(бензонитрил)дихлоро-
рыва связи C-N в 1,3,5-триазинановом кольце со-
палладий(II), синтезированные по известным ме-
единения 1б не происходит. В масс-спектре соеди-
тодикам [21-23]. В качестве растворителей исполь-
нения 4б имеется пик, соответствующий продукту
зовали ацетон (ЧДА), метанол (ХЧ), хлористый
фрагментации с отщеплением метильной группы
метилен (ХЧ), бензонитрил (ЧДА), ацетонитрил
[M - CH3]+ с характерным изотопным распределе-
(ОСЧ). Для синтеза комплексов использовали
нием по палладию и хлору. Комплексообразование
производные 1,3,5-триазинанов 1a, б, полученные
иона металла сопровождается координацией двух
взаимодействием гидрохлоридов этилового эфира
молекул соединения 1б только по одному из трех
глицина или метилового эфира L-аланина с фор-
атомов азота гетероцикла.
мальдегидом.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 11 2020
1670
МУРИНОВ и др.
1,3,5-Трис(этоксикарбонилметил)-1,3,5-три-
52.58 (OCH3), 52.33 (CH), 19.08 (CH3). Спектр
азинан (1a). Соединение получено из 8.0 мг
ЯМР 15N (CD2Cl2): δN -1.71 м. д. Спектр ЯМР 35Cl
(57 ммоль) гидрохлорида этилового эфира глици-
(CD2Cl2): δCl 238.54 м. д. Найдено, %: С 25.16; H
на. Выход 87%, бесцветное масло. Физико-хими-
4.75; N 7.27; Cl 18.66; Pd 27.80. PdCl2С8Н18N2O4.
ческие характеристики соединения аналогичны
Вычислено, %: С 25.05; H 4.73; N 7.30; Cl 18.49;
представленным в работе [24].
Pd 27.74.
1,3,5-Трис[(S)-1′-(метоксикарбонил)этил]-
транс-Дихлоробис(этил-N-метоксиме-
1,3,5-триазинан (1б) получен из гидрохлорида
тилглицинато)палладий(II)
(3а). К раствору
метилового эфира L-аланина (8.0 мг, 57 ммоль).
Pd(PhCN)2Cl2 (279 мг, 0.73 ммоль) в 10 мл абсо-
Выход 70%, бесцветное масло. ИК спектр, ν, см-1:
лютного метанола при перемешивании добав-
2968, 2952, 2842, 1734, 1454, 1435, 1196, 1171,
ляли раствор триазинана 1a (170 мг, 0.49 ммоль)
1141, 1055, 998, 904, 861. Спектр ЯМР 1H (CD2Cl2),
в 5 мл метанола. Полученный прозрачный рас-
δ, м. д.: 3.66 с (9H, OCH3), 3.63 с (6H, NCH2N), 3.55
твор выдерживали при
0°С в течение
12 ч.
к (3H, СН, 3J = 7.1 Гц), 1.26 д (9H, СН3, 3J = 7.1 Гц).
Желтые кристаллы отфильтровывали на филь-
Спектр ЯМР 13C (CD2Cl2), δС, м. д.: 174.04 (CO2),
тре Шотта, промывали ледяной водой и суши-
68.55 (NCH2N), 58.12 (CH), 51.70 (OCH3), 15.44
ли. Выход 54%, т. пл. 101°C. ИК спектр, ν, см-1:
(CH3). Масс-спектр (ESI), m/z: 368.17 [M + Na]+,
3250, 1750, 1461, 1381, 1350, 1327, 1285, 1200, 1190,
384.15 [M + K]+.
1081, 1031, 967, 913, 877, 841, 825, 772, 720, 480,
425, 340, 297. Спектр ЯМР 1H (CD2Cl2), δ, м. д.:
транс-Дихлоробис(этилглицинато)палла-
4.90 с (2H, NH), 4.40 к (4Н, СН2ОСН3, J = 7.9 Гц),
дий(II) (2a). К раствору соединения 1a (149 мг,
4.17 т (4H, CH2СН3, J = 7.2 Гц), 3.90 т (4H,
0.44 ммоль) в ацетоне (3 мл) добавляли раствор
CH2СОО, J = 7.4 Гц), 3.14 с (6H, CH2OCH3), 1.22
Pd(PhCN)2Cl2 (253 мг, 0.65 ммоль) в воде (3 мл).
д (6H, CH3, J = 7.3 Гц). Найдено, %: С 31.18; H
Из полученного прозрачного раствора постепенно
5.57; Cl 15.03; N 5.24; Pd 22.71. PdCl2C12H26N2O6.
выпадали ярко-желтые игольчатые кристаллы. Че-
Вычислено, %: С 30.53; H 5.56; Cl 14.90; N 5.94;
рез 24 ч кристаллы отфильтровывали, промывали
Pd 22.56.
ледяной водой и сушили при комнатной темпера-
туре. Выход 63%, т. пл. 161°C. ИК спектр, ν, см-1:
транс-Дихлоробис(метил-N-метоксимети-
3280, 3153, 1733, 1583, 1377, 1223, 1178, 1072, 953,
лаланинато)палладий(II) (3б) получали анало-
859, 553, 343. Спектр ЯМР 1H (CD2Cl2), δ, м. д.:
гично из Pd(PhCN)2Cl2 (318 мг, 0.83 ммоль) и сое-
6.64 т (4H, CH2, 3J = 7.4 гц), 4.24 к (4H, CH2, 3J =
динения 1б (190 мг, 0.55 ммоль). Выход 54%, т. пл.
7.0 Гц), 3.19 уш. с (4Н, NH2), 1.30 т (6Н, СН3, 3J =
91°C. ИК спектр, ν, см-1: 3233, 2962, 2941, 1750,
7.0 Гц). Спектр ЯМР 13C (CD2Cl2), δС, м. д.: 169.36
1461, 1381, 1350, 1327, 1285, 1210, 1187, 1170, 1109,
(CO2), 61.95 (OCH2), 45.79 (CH2), 13.84 (CH3).
1100, 1081, 1031, 967, 913, 877, 841, 825, 772, 720,
Спектр ЯМР 15N (CD2Cl2): δN 20.91 м. д. Найде-
474, 425, 339, 297. Спектр ЯМР 1H (CD2Cl2), δ, м. д.:
но, %: С 25.16; H 4.75; Cl 18.66; N 7.37; Pd 27.93.
4.63 с (2H, NH), 4.50 д. д (2H, CH2, J = 6.8 Гц),
PdCl2С8Н18N2O4. Вычислено, %: С 25.05; H 4.74;
4.29 т (2H, CH2, J = 6.8 Гц), 3.70 с (6H, CO2CH3),
Cl 18.48; N 7.30; Pd 27.74.
3.31 с (6H, CH2OCH3), 1.97 д (6H, CH3, J = 7.2 Гц).
транс-Дихлоробис(метилаланинато)палла-
Спектр ЯМР 13C (CD2Cl2), δС, м. д.: 172.46 (CO2),
дий(II) (2б) получали аналогично из соединения
84.67 (CH2), 57.70 (OCH3), 57.32 (CO2CH3), 52.48
(CH), 20.96 (CH3). Найдено, %: С 31.18; H 5.57; Cl
1б (130 мг, 0.38 ммоль) и Pd(PhCN)2Cl2 (218 мг,
15.01; N 5.24; Pd 22.64. PdCl2C12H26N2O6. Вычис-
0.57 ммоль). Выход 86%, т. пл. 123°C. ИК спектр,
лено, %: С 30.53; H 5.56; Cl 14.90; N 5.94; Pd 22.56.
ν, см-1: 3237, 3146, 1733, 1683, 1588, 1428, 1329,
1270, 1249, 1220, 1177, 1115, 1052, 1030, 976, 900,
Бис{1,3,5-трис[(метоксикарбонил)этил]-
841, 771, 600, 559, 464, 439, 350, 294, 276. Спектр
1,3,5-триазинан}-транс-дихлоропалладий(II)
ЯМР 1H (CD2Cl2), δ, м. д.: 3.94 д (2H, NH2, J =
(4б). К раствору соединения 1б (1.83 г, 0.53 ммоль)
7.9 Гц), 3.87-3.78 м (2H, CH), 3.77 с (6H, OCH3),
в 10 мл дихлорметана добавляли Pd(PhCN)2Cl2
3.30 т (2H, NH2, J = 7.9 Гц), 1.76 д (6H, CH3).
(0.88 г, 0.26 ммоль). После испарения раствори-
Спектр ЯМР 13C (CD2Cl2), δС, м. д.: 172.72 (CO2),
теля в течение 3 ч образовывался желтый оса-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 11 2020
ПАЛЛАДИЙ-ПРОМОТИРУЕМОЕ Р
АСЩЕПЛЕНИЕ СВЯЗИ УГЛЕРОД-АЗОТ
1671
док, который промывали гексаном (3×10 мл) и
2014. P. 8. doi 10.1155/2014/382646
сушили. Выход 96%, т. пл. > 250°C. ИК спектр,
9. Ouyang K., Hao W., Zhang W.X., Xi Z. // Chem.
ν, см-1: 2986, 2953, 2843, 1753, 1733, 1455, 1435,
Rev. 2015. Vol. 115. P. 12045. doi 10.1021/acs.
1374, 1275, 1197, 1172, 1142, 1100, 1058, 999, 952,
chemrev.5b00386
10. Qalaf F.A., Bassam A.A., Shoukry M.M. // J. Chil. Chem.
904, 861, 843, 816, 761, 520. 358. Спектр ЯМР 1H
Soc. 2013. Vol. 58. P. 1706
(CDCl3) δ, м. д.: 3.66 с и 3.72 м (9H, OCH3), 3.63 с
11. Surasani R., Kalita D., Rao V.D., Chandrasekhar K.B. //
и 3.7-3.8 м (6H, NCH2N), 3.55 к и 3.76 м (3H, CH,
Beilstein J. Org. Chem. 2012. Vol. 8. P. 2004. doi
J = 6.5 Гц), 1.26 д и 1.66 уш. с (9H, CH3, J = 7.1 Гц).
10.3762/bjoc.8.227
Найдено, %: С 40.73; H 6.32; N 8.37; Cl 8.19; Pd
12. Zhao X., Liu D., Guo H., Liu Y., Zhang W. // J. Am.
11.98. PdCl2С30Н54N6O12. Вычислено, %: С 41.51;
Chem. Soc. 2011. Vol. 133. P. 19354. doi 10.1021/
H 6.28; N 9.68; Cl 8.17; Pd 12.26. Масс-спектр, m/z:
ja209373k
853.1 [М - CH3]+.
13. Hitchcock P.B., Lee T.H., Leigh G.J. // Inorg. Chim.
ФОНДОВАЯ ПОДДЕРЖКА
Acta. 2003. Vol. 355. P. 168. doi 10.1016/S0020-
1693(03)00329-3
Работа выполнена в рамках научно-исследова-
14. Молодкин A.К., Есина Н.Я., Тачаев М.В., Курасо-
тельских работ Уфимского института химии РАН
ва М.Н. // ЖНХ. 2007. Т. 10. С. 1669; Molodkin A.K.,
(№ госрегистрации АААА-А20-120012090027-6).
Esina N.Ya., Tachaev M.V., Kurasova M.N. // Russ.
БЛАГОДАРНОСТЬ
J. Inorg. Chem. 2007. Vol. 10. P. 1567. doi 10.1134/
S0036023607100166
Авторы выражают благодарность центру кол-
15. Infante-Castillo R., Pacheco-Londono L., Hernandez-
лективного пользования «Химия» Уфимского ин-
Rivera S.P. // Spectrochim. Acta (A). 2010. Vol. 76.
ститута химии РАН за предоставленную возмож-
P. 137. doi 10.1016/j.saa.2010.02.051
ность проведения элементного анализа и ЯМР
16. Mostafa S.I., El-Morsy F.A., Butler I.S. // Inorg. Chem.
спектроскопических исследований.
Ind. J. 2014. Vol. 9. P. 15
17. Ajibade P.A., Idemudia O.G. // Bioinorg. Chem. Appl.
КОНФЛИКТ ИНТЕРЕСОВ
2013. P. 1. doi 10.1155/2013/549549
Авторы заявляют об отсутствии конфликта
18. Шакирова О.Г., Лавренова Л.Г., Шведенков Ю.Г.,
интересов.
Березовский Г.A., Наумов Д.Ю., Шелудякова Л.A.,
Долгушин Г.В., Ларионов С.В. // Коорд. хим. 2004.
СПИСОК ЛИТЕРАТУРЫ
Т. 7. С. 507; Shakirova O.G., Lavrenova L.G.,
1. Jahromi E.Z., Divsalar A., Saboury A.A., Khaleghizadeh S.,
Shvedenkov Yu.G., Berezovskii G.A., Naumov D.Yu.,
Mansouri-Torshizi H., Kostova I. // J. Iran. Chem. Soc.
Sheludyakova L.A., Dolgushin G.V., Larionov S.V. //
2016. Vol. 13. P. 967. doi 10.1007/s13738-015-0804-8
Russ. J. Coord. Chem. 2004. Vol. 7. P. 473. doi
2. Zaghal M.H., Saeed M.S., Hamid A.G., Ali B.F. //
10.1023/B:RUCO.0000034787.91168.3c
Arabian J. Chem. 2017. Vol. 10. P. 3920. doi 10.1016/j.
19. Hazarika T.N., Bora T. // Trans. Met. Chem. 1982.
arabjc.2014.05.032
Vol. 4. P. 210
3. Zaghal M.H., Saeed M.S., Hamid A.G., Ali B.F. // Synth.
20. Накамото К. ИК спектры и спектры КР неоргани-
React. Inorg., Metal-Org., Nano-Metal Chem. 2015.
ческих и координационных соединений. Москва.
Vol. 45. P. 164. doi 10.1080/15533174.2013.819895
1991. 536 с
4. Krylova L.F., Kovtunova L.M., Romanenko G.V. //
21. Matesanz A.I., Perez J.M., Navarro P., Moreno J.M.,
Bioinorg. Chem. Appl.
2008. P.
1. doi
Colacio E., Souza P. // J. Inorg. Biochem. 1999. Vol. 76.
10.1155/2008/983725
P. 29. doi 10.1016/S0162-0134(99)00105-1
5. Appleton T.G. // Coord. Chem. Rev. 1997. Vol. 166.
22. Rao K., Tyagi R., Kaur N., Kishore D. // J. Chem. 2013.
P. 313. doi 10.1016/S0010-8545(97)00047-7
P. 1. doi: 10.1155/2013/548025
6. Pettit L.D., Bezer M. // Coord. Chem. Rev. 1985.
Vol. 61. P. 97. doi 10.1016/0010-8545(85)80003-5
23. Szłyk E., Barwiołek M. // Thermochim. Acta. 2009.
7. Yan Q.Q., Yuan Z., Liu G.J., Lv Z.H., Fu B., Du J.L.,
Vol. 495. P. 85. doi 10.1016/j.tca.2009.06.002
Li L.J. // Appl. Organomet. Chem. 2017. Vol. 31. P.
24. Tsuge O., Kanemasa S., M. Ohe M., Takenaka S. // Bull.
3689. doi 10.1002/aoc.3689
Chem. Soc. Japan. 1987. Vol. 60. P. 4079. doi 10.1246/
8. Shoukry M.M., Ezzat M.T. // Bioinorg. Chem. Appl.
bcsj.60.4079
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 11 2020
1672
МУРИНОВ и др.
Palladium-Promoted Carbon-Nitrogen Bond Cleavage
in 1,3,5-Triazinane Derivatives
Yu. I. Murinov, L. G. Golubyatnikova*, R. A. Khisamutdinov,
A. G. Badamshin, and V. A. Dokichev
Ufa Institute of Chemistry, Ufa Federal Research Center of the Russian Academy of Sciences, Ufa, 450054 Russia
*e-mail: hisam@anrb.ru
Received June 18, 2020; revised July 6, 2020; accepted July 9, 2020
trans-Dichloropalladium(II) complexes with amino acid esters PdCl2L2 were synthesized by selective hy-
drolytic cleavage of the nitrogen-carbon bond in 1,3,5-tris(ethoxycarbonylmethyl)- and 1,3,5-tris[(S)-1′-
(methoxycarbonyl)ethyl]-1,3,5-triazinane under the action of palladium(II) in methanol and water-acetone
solution. As a result of the nucleophilic attack of water or methanol in the complexes of palladium(II) with the
starting triazinanes, the 1,3,5-triazinane ring is selectively cleaved with the formation of dichloropalladium(II)
complexes with amino acids esters.
Keywords: 1,3,5-triazinane, amino acid esters, palladium complexes
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 11 2020