ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2020, том 90, № 11, с. 1673-1679
УДК 547.854
СИНТЕЗ, СТРОЕНИЕ И АНТИБАКТЕРИАЛЬНАЯ
АКТИВНОСТЬ АЛКИЛ-7-АРИЛ-6-АРОИЛ-4,7-
ДИГИДРОТЕТРАЗОЛО[1,5-а]ПИРИМИДИН-5-
КАРБОКСИЛАТОВ
© 2020 г. В. Л. Гейнa, Т. М. Замараеваa, А. А. Бобылеваa, М. В. Дмитриевb
aПермская государственная фармацевтическая академия, ул. Полевая 2, Пермь, 614990 Россия
b Пермский государственный национальный исследовательский университет, Пермь, 614990 Россия
*е-mail: geinvl48@mail.ru
Поступило в Редакцию 18 июня 2020 г.
После доработки 18 июня 2020 г.
Принято к печати 29 июня 2020 г.
Трехкомпонентной реакцией алкиловых эфиров ароилпировиноградных кислот со смесью ароматиче-
ского альдегида и моногидрата 5-аминотетразола синтезированы новые алкил-7-арил-6-ароил-4,7-ди-
гидротетразоло[1,5-а]пиримидин-5-карбоксилаты. Изучена антибактериальная активность полученных
соединений.
Ключевые слова: производные тетразоло[1,5-а]пиримидина, алкиловые эфиры ароилпировиноградных
кислот, антибактериальная активность
DOI: 10.31857/S0044460X20110062
В медицинской практике широко применяются
ароматического альдегида и моногидрата 5-ами-
тетразолсодержащие β-лактамные антибиотики
нотетразола и получены ранее неописанные ал-
ряда цефалоспорина, такие как цефобид, цефмета-
кил-7-арил-6-ароил-4,7-дигидротетразоло[1,5-а]-
зол, цефоперазон, цефазолин, ингибирующие био-
пиримидин-5-карбоксилаты 1-20 (схема 1). Реак-
синтез клеточной стенки бактерий. Соединения,
цию проводили при выдерживании эквимолярной
содержащие пиримидиновый цикл, используются
смеси соответствующего алкилпирувата, заме-
как противопротозойные средства (хлоридин, пи-
щенного бензальдегида и моногидрата 5-аминоте-
риметамин) и антибактериальные препараты (три-
тразола при 120-150°С. Выход целевых соедине-
метоприм), механизм действия которых связан с
ний 1-20 составил 59-94%.
угнетением дигидрофолатредуктазы в процессе
Соединения 1-20 представляют собой бесцвет-
синтеза тетрагидрофолиевой кислоты (предше-
ные кристаллические вещества, легко раствори-
ственника пуринов и пиримидинов) [1-4]. С этой
мые в ДМФА, ДМСО, при нагревании - в уксусной
точки зрения целесообразен поиск новых веществ
кислоте, этиловом спирте, диоксане, нераство-
с антибактериальной активностью среди конден-
римые в воде. Строение полученных соединений
сированных гетероциклических систем, содержа-
доказано с помощью методов ИК и ЯМР спетро-
щих тетразольный цикл, аннелированный с пири-
скопии, а также данными рентгеноструктурного
мидиновым кольцом.
анализа на примере метил-6-(4-метоксибензо-
С целью получения новых производных тетраз-
ил)-7-(2-фторфенил)-4,7-дигидротетразоло[1,5-а]-
олопиримидина, установления их пространствен-
пиримидин-5-карбоксилата 6.
ного строения и изучения их антибактериальной
В ИК спектрах соединений 1-20 наблюдаются
активности нами по известной методике [5-8]
полосы, обусловленные валентными колебания-
было осуществлено взаимодействие алкиловых
ми кетонной (1630-1670 см-1) и сложноэфирной
эфиров ароилпировиноградных кислот со смесью
(1720-1760 см-1) групп, а также связи N-H (3100-
1673
1674
ГЕЙН и др.
Схема 1.
3300 см-1). В спектрах ЯМР 1Н алкил-7-арил-6-аро-
[М]+ соответственно, что подтверждает предпола-
ил-4,7-дигидротетразоло[1,5-а]пиримидин-5-кар-
гаемую структуру.
боксилатов, кроме сигналов ароматических
Для установления пространственной структу-
протонов и связанных с ними групп, наблюдаются
ры соединений 1-20 в кристаллическом состоянии
сигналы протонов CH3OCO (3.18-3.35 м. д., 1-18),
медленной кристаллизацией из этанола были по-
CH3CH2O (0.90-0.93 м. д.), CH3CHАНВO (3.73-
лучены монокристаллы соединения 6, пригодные
3.78 м. д.) и CH3CHАНВO (3.84-3.86 м. д., 19-20),
для проведения рентгеноструктурного анализа.
H7 (6.33-7.12 м. д.) и H4 (10.95-11.50 м. д.).
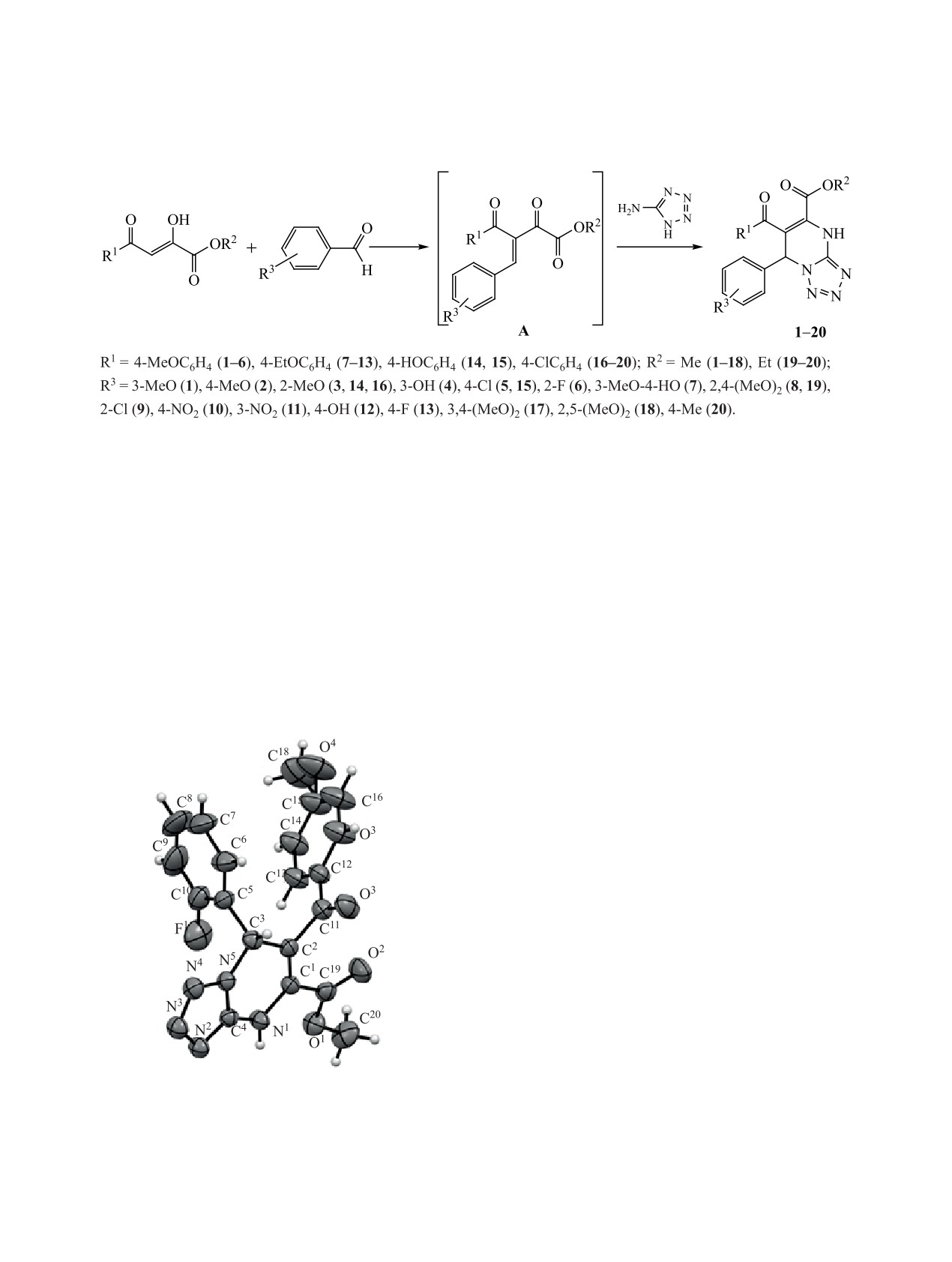
Полученные результаты РСА находятся в полном
В масс-спектре соединения 3 присутствует пик
согласии с предложенной структурой соединения
молекулярного иона с m/z 421 [М]+ , а также пики
6 (см. рисунок).
фрагментных ионов с m/z 362 [М - COOCH3]+,
Соединение 6 кристаллизуется в центросимме-
314 [М - CH3OC6H4]+, 135 [CH3OC6H4CO]+. В
тричной пространственной группе P-1 триклинной
масс-спектрах соединений 5 и 6 регистрируются
сингонии в виде сольвата с этанолом. Ввиду слож-
пики молекулярных ионов с m/z 425 [М]+ и m/z 409
ности локализации разупорядоченных молекул
растворителя при уточнении структуры использо-
вана процедура SQUEEZE в программе PLATON
[9]. Элементарная ячейка содержит три кристал-
лографически независимых молекулы соединения
6 с близкой геометрией, на рисунке изображена
одна из них. Одна из трех независимых молекул
представлена в виде двух ротамеров: атом фтора
разупорядочен по двум позициям с заселенностью
минорной компоненты 0.164(4), для которой о-ф-
торфенильный заместитель оказывается развернут
на 180°. Тетразольные циклы плоские, пиримиди-
новые в незначительной степени отклоняются от
плоской конформации в сторону конформации ис-
каженная ванна. В кристалле молекулы связаны в
димерные ассоциаты за счет внутримолекулярных
водородных связей N-H∙∙∙N.
Антибактериальную активность полученных
соединений 1-20 определяли по отношению к
Общий вид молекулы соединения 6 в кристалле в пред-
ставлении тепловыми эллипсоидами 50%-ной вероят-
типовым штаммам Staphylococcus aureus ATCC
ности.
6538-P и Escherichia coli ATCC 25922. Согласно
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 11 2020
СИНТЕЗ, СТРОЕНИЕ И АНТИБАКТЕРИАЛЬНАЯ АКТИВНОСТЬ
1675
Антибактериальная активность соединений 1-20
Минимальная подавляющая концентрация, мкг/мл
Соединение
Staphylocoсcus aureus ATCC 6538-P
Escherichia coli ATCC 25922
1
1000
1000
2
1000
1000
3
1000
1000
4
250
250
5
500
500
6
500
500
7
500
500
8
500
500
9
1000
1000
10
500
500
11
1000
1000
12
1000
1000
13
1000
1000
14
500
500
15
500
500
16
1000
1000
17
1000
1000
18
1000
1000
19
1000
1000
20
1000
1000
Диоксидин [14]
62.5-1000
3.9-62.5
Диоксидинa (1% раствор)
62.5
31.2
a Данные МПК диоксидина (1%-ный раствор) получены экспериментально.
полученным данным, наиболее выраженную про-
приборе PerkinElmer 2400 и элементном анализа-
тивомикробную активность к указанным штам-
торе Euro EA 3028-НТ. Температуры плавления
мам проявило соединение 4 (МПК 250 мкг/мл, см.
определены на приборе BUCHI М-565.
таблицу). Активность остальных полученных ал-
Для рентгеноструктурного анализа использо-
кил-7-арил-6-ароил-4,7-дигидротетразоло[1,5-а]-
ван бесцветный кристалл соединения 6 размером
пиримидин-5-карбоксилатов оказалась достаточно
0.55×0.10×0.06 мм. Кристалл триклинный, про-
низкой (МПК 500-5000 мкг/мл).
странственная группа P-1, a = 12.3418(18), b =
Таким образом, получен ряд новых алкил-7-
14.1020(18), c = 19.9910(17) Å, α = 106.280(9), β =
арил-6-ароил-4,7-дигидротетразоло[1,5-а]пири-
99.004(10), γ = 106.999(12)°, V = 3084.3(7) Å3, Z =
мидин-5-карбоксилатов, среди которых обнаруже-
6. Набор экспериментальных отражений получен
но соединение, обладающее выраженной противо-
на дифрактометре Xcalibur Ruby с ССD-детекто-
микробной активностью.
ром по стандартной методике (MoKα-излучение,
295(2) K, ω-сканирование, шаг сканирования 1°)
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
[10]. Поглощение учтено эмпирически с использо-
ИК спектры соединений записаны на спектро-
ванием алгоритма SCALE3 ABSPACK [10]. Всего
метре Specord М-80 в таблетках KBr. Спектры
измерено 30427 отражений, из них независимых
ЯМР 1Н зарегистрированы на спектрометре Bruker
14441, 8219 отражений с I > 2σ(I). Структура опре-
500 (500.13 МГц) в ДМСО-d6, внутренний стан-
делена прямым методом по программе SHELXS-97
дарт - ТМС. Масс-спектры получены на приборе
[11] и уточнена полноматричным МНК по F2 в
Ультра-ВЭЖХ-МС (колонка Waters Acquity UPLC
анизотропном приближении для всех неводород-
BEN C18 1.7 мкм, подвижная фаза - ацетонитрил-
ных атомов с использованием программ SHELXL
вода, скорость потока - 0.6 мл/мин, детектор ESI
[12] и OLEX2 [13]. Атомы водорода групп NH ло-
MS Xevo TQD). Элементный анализ проведен на
кализованы из разностных синтезов электронной
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 11 2020
1676
ГЕЙН и др.
плотности и уточнены независимо в изотропном
CH3OC6H4CO, CH3OC6H4), 6.68 c (1Н, C7H), 7.15
приближении, остальные включены в уточнение
м (8Н, CH3OC6H4CO, CH3OC6H4), 11.04 уш. с (1Н,
в модели наездника в изотропном приближении
NH). Найдено, %: C 59.63, 60.13; H 4.42, 4.62; N
с зависимыми тепловыми параметрами. Оконча-
16.31, 16.90. С21H19N5O5. Вычислено, %: C 59.85;
тельные параметры уточнения: R1 = 0.0596, wR2 =
H 4.54; N 16.62.
0.1415 [для отражений с I > 2σ(I)], R1 0.1102, wR2
Метил-7-(3-гидроксифенил)-6-(4-метокси-
0.1719 (для всех отражений), S 0.996. Результаты
бензоил)-4,7-дигидротетразоло[1,5-а]пирими-
РСА зарегистрированы в Кембриджском центре
дин-5-карбоксилат (4). Выход 3.83 г (94%), т. пл.
кристаллографических данных (CCDC 1504859) и
189-191°С (AcOH). ИК спектр, ν, см-1: 1648 (CO),
1752 (CH3OCO), 3150 (NH), 3470 (ОН). Спектр
ac.uk/data_request/cif.
ЯМР 1Н, δ, м. д.: 3.30 c (3Н, CH3OCO), 3.75 c
Метил-6-(4-метоксибензоил)-7-(3-метокси-
(3Н, CH3OC6H4CO), 6.33 c (1Н, C7H), 6.79 м (8Н,
фенил)-4,7-дигидротетразоло[1,5-а]пирими-
CH3OC6H4CO, HOC6H4), 9.34 с (1Н, ОН), 11.04
дин-5-карбоксилат
(1). Смесь
0.01 моль ме-
уш. с (1Н, NH). Найдено, %: C 58.78, 59.19; H 4.12,
тил-4-(4-метоксифенил)-2,4-диоксобутаноата,
4.31; N 16.99, 17.45. С20H17N5O5. Вычислено, %: C
0.01 моль 3-метоксибензальдегида и 0.01 моль
58.97; H 4.21; N 17.19.
5-аминотетразола моногидрата выдерживали при
Метил-6-(4-метоксибензоил)-7-(4-хлор-
120-150°С до прекращения газовыделения и за-
фенил)-4,7-дигидротетразоло[1,5-а]пирими-
твердения реакционной смеси. После охлаждения
дин-5-карбоксилат (5). Выход 3.45 г (81%), т. пл.
остаток обрабатывали этанолом, отфильтровыва-
186-188°С (AcOH). ИК спектр, ν, см-1: 1650 (CO),
ли и перекристаллизовывали из уксусной кислоты.
1750 (CH3OCO), 3158 (NH). Спектр ЯМР 1Н, δ,
Выход 3.53 г (84%), т. пл. 190-192°С (АсOH). ИК
м. д.:
3.32 c
(3Н, CH3OCO),
3.76 c
(3Н,
спектр, ν, см-1: 1644 (CO), 1744 (CH3OCO), 3150
CH3OC6H4CO), 6.74 c (1Н, C7H), 7.26 м (8Н,
(NH). Спектр ЯМР 1Н, δ, м. д.: 3.31 c (3Н, CH3OCO),
CH3OC6H4CO, ClC6H4), 11.30 уш. с (1Н, NH). Най-
3.62 с и 3.76 с (6Н, CH3OC6H4CO, CH3OC6H4), 7.12
дено, %: C 56.14, 56.66; H 3.70, 3.91; N 16.18, 16.74.
c (1Н, C7H), 7.56 м (8Н, CH3OC6H4CO, CH3OC6H4),
С20H16ClN5O4. Вычислено, %: C 56.41; H 3.79; N
11.20 уш. с (1Н, NH). Найдено, %: C 59.64, 60.15; H
16.45.
4.45, 4.54; N 16.42, 16.93. С21H19N5O5. Вычислено,
Метил-6-(4-метоксибензоил)-7-(2-фтор-
%: C 59.85; H 4.54; N 16.62.
фенил)-4,7-дигидротетразоло[1,5-а]пирими-
Соединения 2-20 получали аналогично.
дин-5-карбоксилат (6). Выход 3.60 (88%), т. пл.
Метил-6-(4-метоксибензоил)-7-(4-метокси-
171-173°С (AcOH). ИК спектр, ν, см-1: 1652 (CO),
фенил)-4,7-дигидротетразоло[1,5-а]пирими-
1748 (CH3OCO), 3160 (NH). Спектр ЯМР 1Н, δ, м. д.:
дин-5-карбоксилат (2). Выход 3.83 г (91%), т. пл.
3.32 c (3Н, CH3OCO), 3.76 c (3Н, CH3OC6H4CO),
163-165°С (AcOH). ИК спектр, ν, см-1: 1632 (CO),
6.82 c (1Н, C7H), 7.18 м (8Н, CH3OC6H4CO, FC6H4),
1756 (CH3OCO), 3100 (NH). Спектр ЯМР 1Н, δ,
11.32 уш. с (1Н, NH). Найдено, %: C 58.42, 58.92; H
м. д.: 3.32 c (3Н, CH3OCO), 3.64 с и 3.76 с (6Н,
3.84, 4.03; N 16.87, 17.40. С20H16FN5O4. Вычисле-
CH3OC6H4CO, CH3OC6H4), 6.71 c (1Н, C7H), 7.53
но, %: C 58.68; H 3.94; N 17.11.
м (8Н, CH3OC6H4CO, CH3OC6H4), 11.20 уш. с (1Н,
Метил-7-(4-гидрокси-3-метоксифенил)-
NH). Найдено, %: C 59.58, 60.09; H 4.44, 4.66; N
6-(4-этоксибензоил)-4,7-дигидротетразоло-
16.45, 16.91. С21H19N5O5. Вычислено, %: C 59.85;
[1,5-а]пиримидин-5-карбоксилат
(7).
Выход
H 4.54; N 16.62.
3.38 г (75%), т. пл. 200-202°С (AcOH). ИК спектр,
Метил-6-(4-метоксибензоил)-7-(2-метокси-
ν, см-1: 1648 (CO), 1752 (CH3OCO), 3180 (NH),
фенил)-4,7-дигидротетразоло[1,5-а]пирими-
3450 (ОН). Спектр ЯМР 1Н, δ, м. д.: 1.35 т (3H,
дин-5-карбоксилат (3). Выход 3.92 г (93%), т. пл.
СH3CH2O, J = 6.5 Гц), 3.30 c (3Н, CH3OCO), 3.56
215-217°С (AcOH). ИК спектр, ν, см-1: 1660 (CO),
c [3Н, (CH3O)HOC6H3], 4.05 к (2H, СH3CH2O, J =
1749 (CH3OCO), 3180 (NH). Спектр ЯМР 1Н, δ,
6.5 Гц), 6.57 c (1Н, C7H), 6.86 м [7H, C2H5OC6H4CO,
м. д.: 3.18 c (3Н, CH3OCO), 3.60 с и 3.74 с (6Н,
(CH3O)HOC6H3], 9.03 c (1Н, OH), 11.13 уш. с (1Н,
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 11 2020
СИНТЕЗ, СТРОЕНИЕ И АНТИБАКТЕРИАЛЬНАЯ АКТИВНОСТЬ
1677
NH). Найдено, %: C 58.29, 58.67; H 4.60, 4.77; N
Метил-7-(4-гидроксифенил)-6-(4-этокси-
15.30, 15.69. С22H21N5O6. Вычислено, %: C 58.53;
бензоил)-4,7-дигидротетразоло[1,5-а]пирими-
H 4.69; N 15.51.
дин-5-карбоксилат (12). Выход 2.48 г (59%), т. пл.
208-210°С (AcOH). ИК спектр, ν, см-1: 1655 (CO),
Метил-6-(4-этоксибензоил)-7-(2,4-диметок-
1735 (CH3OCO), 3240 (NH), 3480 (OH). Спектр
сифенил)-4,7-дигидротетразоло[1,5-а]пирими-
ЯМР 1Н, δ, м. д.: 1.36 т (3H, СH3CH2O, J = 6.7 Гц),
дин-5-карбоксилат (8). Выход 2.93 г (63%), т. пл.
3.31 c (3Н, CH3OCO), 4.05 к (2H, СH3CH2O, J =
200-202°С (AcOH). ИК спектр, ν, см-1: 1670 (CO),
6.7 Гц), 6.61 c (1Н, C7H), 6.87 м (8H, C2H5OC6H4CO,
1745 (CH3OCO), 3180 (NH). Спектр ЯМР 1Н, δ, м. д.:
HOC6H4), 9.31 с (1Н, OH), 11.15 уш. с (1Н, NH).
1.29 т (3H, СH3CH2O, J = 6.5 Гц), 3.28 c (3Н,
Найдено, %: C 59.55, 60.03; H 4.48, 4.64; N 16.38,
CH3OCO), 3.59 с и 3.63 с [6Н, (CH3O)2C6H3], 4.04
16.89. С21H19N5O5. Вычислено, %: C 59.85; H 4.54;
к (2H, СH3CH2O, J = 6.5 Гц), 6.36 c (1Н, C7H), 6.73
N 16.62.
м [7Н, C2H5OC6H4CO, (CH3O)2C6H3], 10.95 уш.
с (1Н, NH). Найдено, %: C 59.23, 59.54; H 4.88,
Метил-7-(4-фторфенил)-6-(4-этоксибен-
5.09; N 14.84, 15.32. С23H23N5O6. Вычислено, %: C
зоил)-4,7-дигидротетразоло[1,5-а]пирими-
59.35; H 4.98; N 15.05.
дин-5-карбоксилат (13). Выход 2.79 г (66%), т. пл.
200-202°С (AcOH). ИК спектр, ν, см-1: 1630 (CO),
Метил-7-(2-хлорфенил)-6-(4-этоксибен-
1745 (CH3OCO), 3180 (NH). Спектр ЯМР 1Н, δ, м. д.:
зоил)-4,7-дигидротетразоло[1,5-а]пирими-
дин-5-карбоксилат (9). Выход 2.72 г (62%), т. пл.
1.31 т (3H, СH3CH2O, J = 6.5 Гц), 3.33 c (3Н,
CH3OCO), 4.06 к (2H, СH3CH2O, J = 6.5 Гц), 6.79
203-205°С (AcOH). ИК спектр, ν, см-1: 1650 (CO),
c (1Н, C7H), 7.25 м (8H, C2H5OC6H4CO, FC6H4),
1740 (CH3OCO), 3200 (NH). Спектр ЯМР 1Н, δ, м. д.:
11.40 уш. с (1Н, NH). Найдено, %: C 59.36, 59.86;
1.30 т (3H, СH3CH2O, J = 6.5 Гц), 3.32 c (3Н,
H 4.21, 4.39; N 16.28, 16.83. С21H18FN5O4. Вычис-
CH3OCO), 4.06 к (2H, СH3CH2O, J = 6.5 Гц), 6.88
лено, %: C 59.57; H 4.29; N 16.54.
c (1Н, C7H), 7.25 м (8H, C2H5OC6H4CO, ClC6H4),
11.50 уш. с (1Н, NH). Найдено, %: C 57.17, 57.48;
Метил-6-(4-гидроксибензоил)-7-(2-меток-
H 4.02, 4.21; N 15.73, 16.09. С21H18ClN5O4. Вычис-
сифенил)-4,7-дигидротетразоло[1,5-а]пирими-
лено, %: C 57.34; H 4.12; N 15.92.
дин-5-карбоксилат (14). Выход 2.56 г (63%), т. пл.
228-230°С (AcOH). ИК спектр, ν, см-1: 1650 (CO),
Метил-7-(4-нитрофенил)-6-(4-этоксибен-
1730 (CH3OCO), 3280 (NH), 3460 (ОН). Спектр
зоил)-4,7-дигидротетразоло[1,5-а]пирими-
ЯМР 1Н, δ, м. д.: 3.31 c (3Н, CH3OCO), 3.56 c
дин-5-карбоксилат (10). Выход 2.75 г (61%), т. пл.
(3Н, CH3OC6H4), 6.69 c (1Н, C7H), 7.52 м (8H,
154-156°С (AcOH). ИК спектр, ν, см-1: 1660 (CO),
HOС6Н4CO, CH3OC6H4), 9.34 с (1Н, ОH), 11.30
1745 (CH3OCO), 3180 (NH). Спектр ЯМР 1Н, δ, м. д.:
1.30 т (3H, СH3CH2O, J = 6.7 Гц), 3.32 c (3Н,
уш. с (1Н, NH). Найдено, %: C 58.70, 59.25; H 4.13,
4.32; N 16.89, 17.48. С20H17N5O5. Вычислено, %: C
CH3OCO), 4.06 к (2H, СH3CH2O, J = 6.7 Гц), 6.87
58.97; H 4.21; N 17.19.
c (1Н, C7H), 7.58 м (8H, C2H5OC6H4CO, O2NC6H4),
11.50 уш. с (1Н, NH). Найдено, %: C 55.81, 56.29; H
Метил-6-(4-гидроксибензоил)-7-(4-хлор-
3.95, 4.14; N 18.42, 18.95. С21H18N6O6. Вычислено,
фенил)-4,7-дигидротетразоло[1,5-а]пирими-
%: C 56.00; H 4.03; N 18.66.
дин-5-карбоксилат (15). Выход 2.68 г (65%), т. пл.
229-231°С (AcOH). ИК спектр, ν, см-1: 1640 (CO),
Метил-7-(3-нитрофенил)-6-(4-этоксибен-
1720 (CH3OCO), 3180 (NH), 3440 (ОН). Спектр
зоил)-4,7-дигидротетразоло[1,5-а]пирими-
дин-5-карбоксилат (11). Выход 3.02 г (67%), т. пл.
ЯМР 1Н, δ, м. д.: 3.32 c (3Н, CH3OCO), 6.77 c (1Н,
C7H), 7.42 м (8H, HOС6Н4CO, ClC6H4), 8.94 с (1Н,
206-208°С (AcOH). ИК спектр, ν, см-1: 1650 (CO),
ОH), 11.20 уш. с (1Н, NH). Найдено, %: C 55.26,
1750 (CH3OCO), 3180 (NH). Спектр ЯМР 1Н, δ, м. д.:
55.62; H 3.36, 3.52; N 16.75, 17.28. С19H14ClN5O4.
1.30 т (3H, СH3CH2O, J = 6.5 Гц), 3.32 c (3Н,
Вычислено, %: C 55.42; H 3.43; N 17.01.
CH3OCO), 4.05 к (2H, СH3CH2O, J = 6.5 Гц), 6.85
c (1Н, C7H), 7.53 м (8H, C2H5OC6H4CO, O2NC6H4),
Метил-7-(2-метоксифенил)-6-(4-хлорбен-
11.40 уш. с (1Н, NH). Найдено, %: C 55.77, 56.21; H
зоил)-4,7-дигидротетразоло[1,5-а]пирими-
3.94, 4.12; N 18.38, 18.91. С21H18N6O6. Вычислено,
дин-5-карбоксилат (16). Выход 4.04 г (92%), т. пл.
%: C 56.00; H 4.03; N 18.66.
220-222°С (AcOH). ИК спектр, ν, см-1: 1670 (CO),
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 11 2020
1678
ГЕЙН и др.
1750 (CH3OCO), 3180 (NH). Спектр ЯМР 1Н, δ, м. д.:
С21H18ClN5O3. Вычислено, %: С 59.51; Н 4.28; N
3.33 c (3Н, CH3OCO), 3.64 с (3H, СН3OС6H4), 6.72
16.52.
c (1Н, C7H), 7.44 м (8H, ArН), 11.32 (с, 1Н, NH).
Антибактериальную активность получен-
Найдено, %: С 56.11, 56.56; Н 3.71, 3.89; N 16.24,
ных соединений 1-20 определяли пробирочным
16.70. C20H16ClN5O4. Вычислено, %: С 56.41; Н
методом двукратных серийных разведений в жид-
3.79; N 16.45.
кой питательной среде [15] по отношению к типо-
Метил-7-(3,4-диметоксифенил)-6-(4-хлор-
вым штаммам Staphylococcus aureus ATCC 6538-P,
бензоил)-4,7-дигидротетразоло[1,5-а]пирими-
Escherichia coli ATCC 25922.
дин-5-карбоксилат (17). Выход 3.14 г
(69%).
Исследуемое соединение массой 0.05 г рас-
т. пл. 195-197°С (AcOH). ИК спектр, ν, см-1: 1650
творяли в 5 мл диметилсульфоксида, получая
(CO), 1745 (CH3OCO), 3300 (NH). Спектр ЯМР 1Н,
основной раствор вещества в концентрации
δ, м. д.: 3.35 c (3Н, CH3OCO), 3.60 с и 3.63с [6H,
104 мкг/мл. Данный раствор служил основой для
(СН3O)2С6H3], 6.75 c (1Н, C7H), 7.43 м (7H, ArН),
рабочего раствора, имеющего концентрацию
11.30 с (1Н, NH). C21H18ClN5O5. Найдено, %: С
2×103 мкг/мл, который последовательно разводи-
56.15, 56.36; Н 4.20, 4.37; N 14.78, 15.01. Вычисле-
ли двукратно в жидкой питательной среде в ряду
но, %: С 55.33; Н 3.98; N 15.36.
из 10 пробирок. Концентрация исследуемых со-
Метил-7-(2,5-диметоксифенил)-6-(4-хлор-
единений в первой пробирке ряда разведений в
бензоил)-4,7-дигидротетразоло[1,5-а]пирими-
питательной среде составляла 1000.0 мкг/мл. Для
дин-5-карбоксилат (18). Выход 3.41 г (75%),
определения антибактериальной активности ис-
т. пл. 234-236°С (AcOH). ИК спектр, ν, см-1: 1648
пользовали бульон Хоттингера (Государственный
(CO), 1746 (CH3OCO), 3150 (NH). Спектр ЯМР 1Н,
научный центр прикладной микробиологии и био-
технологии, Оболенск), типовые суточные культу-
δ, м. д.: 3.31 c (3Н, CH3OCO), 3.65 с и 3.68 с [6H,
(СН3O)2С6H3], 6.81 c (1Н, C7H), 7.50 м (7H, Ar Н),
ры, выращенные на питательном агаре (ГРМ-агар,
11.39 с (1Н, NH). C21H18ClN5O5. Найдено, %: С
Государственный научный центр прикладной ми-
56.13, 56.39; Н 4.22, 4.39; N 14.74, 15.03. Вычисле-
кробиологии и биотехнологии, Оболенск). Кон-
но, %: С 55.33; Н 3.98; N 15.36.
центрация микробных клеток в опыте составля-
ла 2.5×105 КОЕ/мл. В качестве положительного
Этил-7-(2,4-диметоксифенил)-6-(4-хлор-
контроля использовали питательную среду с вне-
бензоил)-4,7-дигидротетразоло[1,5-а]пирими-
сенной исследуемой культурой. В качестве отри-
дин-5-карбоксилат (19). Выход 3.24 г (69%),
цательного контроля использовали интактную
т. пл. 209-211°С (AcOH). ИК спектр, ν, см-1: 1656
питательную среду. Посевы инкубировали в тер-
(CO), 1740 (C2H5OCO), 3120 (NH). Спектр ЯМР
мостате при температуре 37±2°С. Оценку роста
1Н, δ, м. д.: 0.90 м (3Н, OCH2СН3), 3.58 с и 3.64 с
бактерий проводили визуально через 20-24 ч ин-
[6Н, (CH3O)2C6H3], 3.78 м (1Н, CH3CHAHBO, J =
кубирования. В качестве значения МПК (мини-
6.5 Гц), 3.86 м (1Н, CH3CHAHBO, J = 6.5 Гц), 6.76
мальной подавляющей концентрации) принимали
c (1Н, C7H), 7.45 м [7H, (CH3O)2C6H3, ClC6H4CO],
концентрацию соединения в последней прозрач-
11.10 с (1Н, NH). Найдено, %: С 56.01, 56.61; Н
ной пробирке серии разведения. Антибактериаль-
4.20, 4.36; N 14.72, 15.04. С22H20ClN5O5. Вычисле-
ный эффект соединений сравнивали с действием
но, %: С 56.24; Н 4.29; N 14.90.
диоксидина (1%-ный раствор, ОАО «Новосибхим-
Этил-7-(4-метилфенил)-6-(4-хлорбен-
фарм»).
зоил)-4,7-дигидротетразоло[1,5-а]пирими-
КОНФЛИКТ ИНТЕРЕСОВ
дин-5-карбоксилат (20). Выход 3.05 г (72%), т. пл.
235-237°С (AcOH). ИК спектр, ν, см-1: 1656 (CO),
Авторы заявляют об отсутствии конфликта
1740 (C2H5OCO), 3120 (NH). Спектр ЯМР 1Н, δ,
интересов.
м. д.: 0.93 м (3Н, OCH2СН3), 2.16 с (3Н, CH3C6H4),
СПИСОК ЛИТЕРАТУРЫ
3.73 м (1Н, CH3CHAHBO, J = 6.5 Гц), 3.84 м (1Н,
CH3CHAHBO, J = 6.5 Гц), 6.72 c (1Н, C7H), 7.42 м
1. Машковский М.Д. // Лекарственные средства. М.:
(8H, CH3C6H4, ClC6H4CO), 11.26 с (1Н, NH). Най-
Новая волна. Издатель Умеренков, 2010. С. 785, 780,
дено, %: С 59.25, 59.65; Н 4.20, 4.39; N 16.23, 16.79.
788.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 11 2020
СИНТЕЗ, СТРОЕНИЕ И АНТИБАКТЕРИАЛЬНАЯ АКТИВНОСТЬ
1679
2. Фармакология / Под ред. Р.Н. Аляутдина. М.: ГЭО-
Russ. J. Gen. Chem. 2015. Vol. 85. N 10. P. 2299. doi
ТАР-Медиа, 2016. 1104 с.
10.1134/S107036321510014X
3. Фармакология / Под ред. Д.А. Харкевича. М.: ГЭО-
9. Spek A.L. // J. Appl. Cryst. 2003. Vol. 36. P. 7. doi
ТАР-Медиа, 2017. 760 с.
10.1107/S0021889802022112
4. Клиническая фармакология / Под ред. В.Г. Кукеса,
10. CrysAlisPro, Agilent Technologies, Version 1.171.37.33
Д.А. Сычева. М.: ГЭОТАР-Медиа, 2017. 1024 с.
(release 27-03-2014 CrysAlis171 .NET).
5. Гейн В.Л., Гейн Л.Ф., Цыплякова Е.П., Розова Е.А. //
11. Sheldrick G.M. // Acta Crystallogr. (A). 2008. Vol. 64.
ЖОрХ. 2003. Т. 39. Вып. 5. С. 797; Gein V.L., Gein L.F.,
P. 112. doi 10.1107/S0108767307043930
Tsyplyakova E.P., Rozova E.A. // Russ. Org. Chem. 2003.
12. Sheldrick G.M. // Acta Crystallogr. (C). 2015. Vol. 71.
Vol. 39. N 5. P. 753. doi 10.1023/A:1026002522354
P. 3. doi 10.1107/S205322961402421
6. Гейн В.Л., Гейн Л.Ф., Цыплякова Е.П., Панова О.С. //
13. Dolomanov O.V., Bourhis L.J., Gildea R.J., Ho-
ЖОрХ. 2007. Т. 43. Вып. 9. С. 1386; Gein V.L.,
ward J.A.K., Puschmann H. // J. Appl. Cryst. 2009. Vol.
Gein L.F., Tsyplyakova E.P., Panova O.S. // Russ.
42. P. 339. doi 10.1107/S0021889808042726
Org. Chem. 2007. Vol. 43. N 9. P. 1382. doi 10.1134/
S1070428007090205
14. Падейская Е.Н. // Инфекции и антимикробная тера-
пия. 2001. Т. 3. № 5.
7. Гейн В.Л., Мишунин В.В., Цыплякова Е.П., Вах-
рин М.И., Слепухин П.А. // ЖОрХ. 2011. Т. 47. Вып. 7.
15. Руководство по проведению доклинических ис-
С. 1060; Gein V.L., Mishunin V.V., Tsyplyakova E.P.,
следований лекарственных средств / Под ред. А.Н.
Vakhrin M.I., Slepukhin P.A. // Russ. J. Org. Chem. 2011.
Миронова, Н.Д. Бунятян, А.Н. Васильева, О.Л. Вер-
Vol. 47. N 7. P. 1077. doi 10.1134/S1070428011070189
стаковой, М.В. Журавлевой, В.К. Лепахина, Н.В.
8. Гейн В.Л., Замараева Т.М., Панова О.С., Белоного-
Коробова, В.А. Меркулова, С.Н. Орехова, И.В. Са-
ва В.Д. // ЖОХ. 2015. Т. 85. Вып. 10. С. 1667; Gein
каевой, Д.Б. Утешева, А.Н. Яворского. М.: Гриф и
V.L., Zamaraeva T.M., Panova O.S., Belonogova V.D. //
К. 2012, Ч. 1. 944 с.
Synthesis, Structure and Antibacterial Activity of Alkyl 6-Aroyl-
7-aryl-4,7-dihydrotetrazolo[1,5-a]pyrimidine-6-carboxylates
V. L. Geina,*, T. M. Zamaraevaa, A. A. Bobylevaa, and M. V. Dmitrievb
a Perm Pharmaceutical Academy, Perm, 614990 Russia
b Perm State National Research University, Perm, 614990 Russia
*е-mail: geinvl48@mail.ru
Received June 18, 2020; revised June 18, 2020; accepted June 29, 2020
A series of new alkyl 6-aroyl-7-aryl-4,7-dihydrotetrazolo[1,5-a]pyrimidine-5-carboxylates was obtained through
the three-component reaction of alkyl esters aroylpyruvic acids with a mixture of aromatic aldehyde and
5-aminotetrazole. All the synthesized compounds were tested for antibacterial activity.
Keywords: dihydrotetrazolo[1,5-a]pyrimidine derivatives, aroylpyruvic acids alkyl esters, antibacterial activity
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 11 2020