ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2020, том 90, № 11, с. 1686-1690
УДК 547.856.1
ВЗАИМОДЕЙСТВИЕ
4-ПРОПАРГИЛСУЛЬФАНИЛХИНАЗОЛИНА С
БРОМОМ И ИОДОМ
© 2020 г. Д. Г. Ким, Е. И. Бахтеева*, В. В. Шарутин
Южно-Уральский государственный университет, пр. Ленина 76, Челябинск, 454080 Россия
*e-mail: evgesheck1990@gmail.com
Поступило в Редакцию 3 июля 2020 г.
После доработки 3 июля 2020 г.
Принято к печати 19 июля 2020 г.
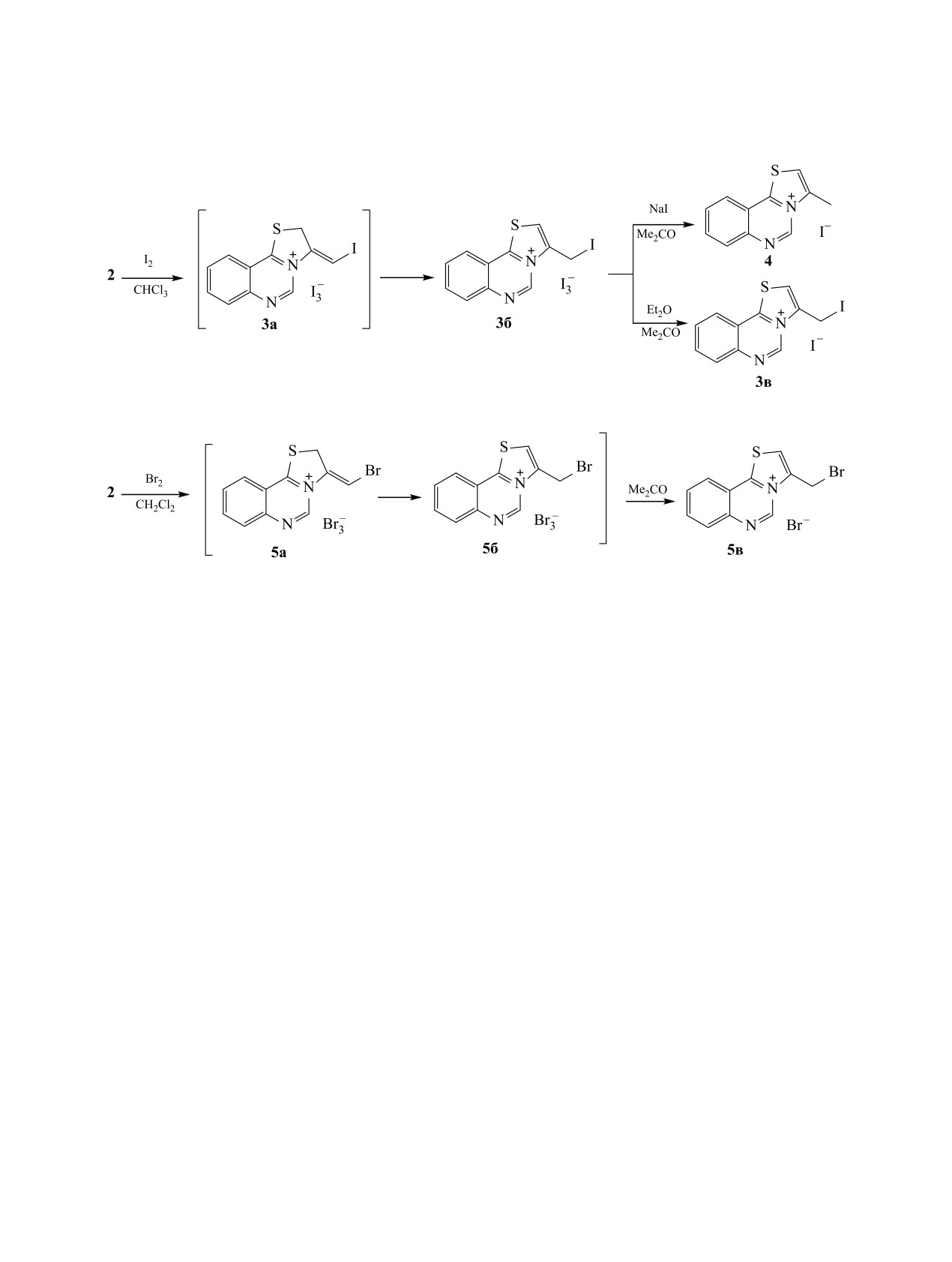
Циклизацией 4-пропаргилсульфанилхиназолина под действием иода получен трииодид 3-иодметил[1,3]-
тиазоло[3,2-c]хиназолиния, который восстанавливается иодидом натрия с образованием иодида 3-ме-
тил[1,3]тиазоло[3,2-c]хиназолиния. Взаимодействие с бромом в дихлорметане приводит к образованию
бромида 3-бромметил[1,3]тиазоло[3,2-c]хиназолиния, а в уксусной кислоте - гидробромида 2-(2-ами-
нофенил)-4-дибромметил-1,3-тиазола.
Ключевые слова: хиназолин-4(3Н)-тион, 4-пропаргилсульфанилхиназолин, тиазоло[3,2-c]-
хиназолин, галогенциклизация, 2-(2-аминофенил)-4-дибромметил-1,3-тиазол, домино-реакция
DOI: 10.31857/S0044460X20110086
Структуры, содержащие ядро хиназолина, об-
В работе [7] описано взаимодействие 2-пропар-
ладают противоаллергической, антигипертониче-
гилсульфанилхиназолин-4-она с иодом в уксус-
ской, антимикробной, противогрибковой, противо-
ной кислоте с образованием иодида 1-иодметили-
туберкулезной и противосудорожной активностью
ден-1,2-дигидро-5Н-тиазоло[3,2-а]хиназолиния с
[1-4]. В то же время в литературе практически от-
экзоциклической двойной связью. Нами обнаруже-
но, что реакция 4-пропаргилсульфанилхиназолина
сутствуют данные о синтезах тиазоло[3,2-c]хина-
золиниевых системах, что является целью настоя-
с иодом в хлороформе не останавливается на ста-
дии образования трииодида 3-иодметилен-2,3-ди-
щего исследования.
гидротиазоло[3,2-c]хиназолиния 3а, а идет даль-
Известно, что алкилирование
2-меркапто-
нейшая изомеризация с образованием трииодида
(3Н)-хиназолин-4-она пропаргилбромидом осу-
3-иодметил[1,3]тиазоло[3,2-c]хиназолиния
3б с
ществляют в этаноле или диоксане в присутствии
эндоциклической двойной связью (схема 2). При
гидроксида калия [5, 6]. В настоящей работе нами
добавлении к раствору трииодида 3б в ацетоне
взаимодействием хиназолин-4(3Н)-тиона 1 с про-
10-кратного объема диэтилового эфира был вы-
паргилбромидом в водно-спиртовой среде (4:1)
делен иодид 3-иодметил[1,3]тиазоло[3,2-c]хина-
в присутствии гидроксида калия синтезирован
золиния 3в. Интересно, что при обработке трии-
4-пропаргилсульфанилхиназолин 2 (схема 1) и из-
одида 3б иодидом натрия в ацетоне не образуется
учено его взаимодействие с галогенами.
Схема 1.
Состав и строение сульфида 2 подтверждает-
ся данными масс-спектрометрии и ЯМР. Так, в
масс-спектре соединения 2 присутствуют харак-
терные пики [М - H]+, [M - SAlk]+, [M - Alk]+. Зна-
чительную интенсивность в спектре имеют пики
ионов [М - SC3H3]+, [М - C3H3]+.
1686
ВЗАИМОДЕЙСТВИЕ 4-ПРОПАРГИЛСУ
ЛЬФАНИЛХИНАЗОЛИНА
1687
Схема 2.
Схема 3.
моноиодид, как в работе [8], а происходит восста-
В спектре ЯМР 1Н бромида 5в сигнал протона
новление иодметильной группы в метильную с
5-Н смещен в слабое поле на 0.68 м. д. по срав-
образованием иодида 3-метил[1,3]тиазоло[3,2-c]-
нению с сигналом протона 2-Н соединения 2, что
хиназолиния 4. По-видимому, происходит реакция
обусловлено появлением положительного заряда
иода с ацетоном с образованием иодоводорода,
на атоме азота. Протоны групп SCH и CH2Br ре-
который восстанавливает иодметильную группу в
зонируют при 8.05 и 4.72 м. д. соответственно, а
сигналы протонов группы SCH2 отсутствуют.
метильную.
Иначе протекает взаимодействие сульфи-
В спектре ЯМР 1Н соединения 4 присутствуют
да 2 с бромом в уксусной кислоте, содержащей
сигналы протонов метильной группы при 2.90 м.
следы воды. Вместо ожидаемого бромида
5в
д., а сигнал ароматического протона 5-Н смещен
получен гидробромид
2-(2-аминофенил)-4-ди-
в область слабого поля на 0.84 м. д. по сравнению
бромметил-1,3-тиазола 6 (схема 4). По-видимо-
с сигналом протона 2-Н исходного сульфанила 2.
му, происходит домино-реакция: вначале, как и
По литературным данным, 2-арил-4-пропар-
в дихлорметане, происходит бромциклизация с
гилсульфанилхиназолины реагируют с бромом в
образованием трибромида 5а, затем протекают
CCl4 с образованием бромидов 3-бромметил-5-а-
присоединение брома по двойной связи (6а), эли-
рил[1,3]тиазоло[3,2-c]хиназолиния [9]. Мы изучи-
минирование бромоводорода (6б), раскрытие цик-
ли взаимодействие 4-пропаргилсульфанилхиназо-
ла (6в), затем гидролиз (6г-е) и взаимодействие
лина с бромом в дихлорметане и обнаружили, что
с HBr c образованием тиазола 6 (схема 4). Ранее
происходит бромциклизация с образованием три-
2-(2-аминофенил)-4-фенилтиазол, близкий по
бромида 3-бромметил[1,3]тиазоло[3,2-c]хиназоли-
структуре к соединению 6, был получен нагрева-
ния 5б, который при обработке ацетоном превра-
нием 2-(4-хиназолинсульфанил)ацетофенона с ок-
щается в бромид 3-бромметил[1,3]тиазоло[3,2-c]
сихлоридом фосфора [10].
хиназолиния 5в (схема 3). По-видимому, образова-
Структура гидробромида 6 была установлена
ние бромида 5в c эндоциклической двойной свя-
методом РСА (см. рисунок). Комплекс 6 содержит
зью протекает в результате изомеризации трибро-
гетероциклический катион [C10H9N2SBr2]+, анион
мида 5a с экзоциклической двойной связью.
Br- и молекулу уксусной кислоты.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 11 2020
1688
КИМ и др.
Схема 4.
Br
Соединение 6 кристаллизуется в центросим-
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
метричной пространственной группе P21/n моно-
Спектры ЯМР 1Н (400 МГц) записаны на прибо-
клинной сингонии в виде сольвата с уксусной кис-
рах Bruker DRX-400, внутренний стандарт - ТМС,
лотой. Тиазольный фрагмент в катионе плоский.
растворитель - ДМСО-d6. Масс-спектры сняты
Атомы Br1 и Br2 выходят из плоскости остальных
на газовом хромато-масс-спектрометре GCMS-
атомов на 1.69 и 1.51 Å соответственно.
QP2010 UltraShimadzu (ЭУ, 70 эВ). Элементный
Таким образом,
4-пропаргилсульфанилхина-
анализ выполнен на анализаторе Carlo Erba 1108.
золин реагирует с иодом с образованием триио-
Соединение 1 синтезировано взаимодействием
дида
3-иодметил[1,3]тиазоло[3,2-c]хиназолиния,
хиназолин-4(3Н)-она с пентасульфидом фосфора
который при обработке ацетоном и диэтиловым
в безводном пиридине по известному методу [11].
эфиром превращается в иодид 3-иодметил[1,3]-
Пропаргилбромид - коммерческий продукт (Acros
тиазоло[3,2-c]хиназолиния, а с иодидом натрия в
Оrganics).
ацетоне - в иодид 3-метил[1,3]тиазоло[3,2-c]хи-
4-Пропаргилсульфанилхиназолин (2). К рас-
назолиния. При взаимодействии пропаргилсуль-
твору 0.81 г (5 ммоль) хиназолин-4-тиона и 0.28 г
фида с бромом в дихлорметане образуется бромид
(5 ммоль) KОН в 30 мл воды добавляли 0.89 мл
3-бромметил[1,3]тиазоло[3,2-c]хиназолиния, а в
(10 ммоль) пропаргилбромида в 1 мл этанола. По-
уксусной кислоте протекает домино-реакция с об-
лученную смесь перемешивали 2 ч при комнатной
разованием гидробромида 2-(2-аминофенил)-4-ди-
температуре. Образовавшийся осадок песочного
бромметил-1,3-тиазола.
цвета отфильтровывали и сушили. Выход 0.952 г
(95%), т. пл. 82°С (хлороформ). Спектр ЯМР 1H,
δ, м. д.: 2.25 т (1Н, ≡СН, J = 2.7 Гц), 4.19 д (2Н,
SCH2, J = 2.7 Гц), 7.65-7.57 м (1Н, 6-Н), 7.88 д. д. д
(1Н, 5-Н, J1 = 8.3, J2 = 7.1, J3 = 1.2 Гц), 8.07-7.98 м
(2Н, 8-Н, 7-Н), 9.03 с ( 1Н, 2-Н). Масс-спектр, m/z
(Iотн, %): 200 (100) [M]+∙, 199 (28) [M - H]+, 172 (10)
[M - С2H4]+, 168 (18) [M - S]+, 167 (25) [M - SH]+,
168 (16), 161 (5) [M - C3H3]+, 160 (9) [M - C3H4]+,
155 (18), 130 (8), 129 (22) [M - SC3H3]+,103 (36),
102 (35), 76 (16), 75 (16), 71 (9), 51(7), 39 (15). Най-
дено, %: С 65.73; H 4.25; N 14.17. C11H8N2S. Вы-
числено, %: С 65.98; H 4.03; N 13.99.
Трииодид
3-иодметил[1,3]тиазоло[3,2-c]хи-
назолиния (3б). К раствору 0.06 г (0,3 ммоль)
4-пропаргилсульфанилхиназолина в
3 мл хло-
Общий вид молекулы соединения 6 в кристалле.
роформа прибавляли 0.156 г (0,6 ммоль) иода в
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 11 2020
ВЗАИМОДЕЙСТВИЕ 4-ПРОПАРГИЛСУ
ЛЬФАНИЛХИНАЗОЛИНА
1689
2 мл хлороформа. Полученную смесь оставляли на
J = 7.8 Гц), 8.52 д (1Н, 10-Н, J = 8.2 Гц), 9.72 с
сутки при комнатной температуре. Образовавший-
(1H, 5-Н). Найдено, %: С 36.84; H 2.85; N 7.67.
ся коричневый осадок отфильтровывали и суши-
C11H8Br2N2S. Вычислено, %: С 36.69; H 2.24; N
ли. Выход 0.175 г (82%), т. пл. 136-138°С (разл.).
7.78.
Спектр ЯМР 1H, δ, м. д.: 4.71 д (2Н, CH2I, J =
Гидробромид 2-(2-аминофенил)-4-дибромме-
3.0 Гц), 8.05 м (1Н, SCH), 8.23 д (1H, 7-Н, J =
тил-1,3-тиазола (6). К раствору 0.5 г (2.5 ммоль)
8.3 Гц), 8.29 т (1Н, 8-Н, J = 3.0 Гц), 8.40 м (1Н,
4-пропаргилсульфанилхиназолина в 3 мл уксусной
9-Н), 8.52 д (1Н, 10-Н, J = 8.2 Гц), 9.70 с (1H, 5-Н).
кислоты прибавляли раствор 0.21 мл (4 ммоль) Br2
Найдено, %: С 18.83; H 1.29; N 3.77. C11H8I4N2S.
в 3 мл уксусной кислоты при охлаждении льдом.
Вычислено, %: С 18.66; H 1.14; N 3.96.
Смесь оставляли на сутки при комнатной темпе-
Иодид
3-иодметил[1,3]тиазоло[3,2-c]хиназо-
ратуре. Образовавшийся кристаллический осадок
линия (3в). К раствору 0.106 г (0.15 ммоль) три-
коричневого цвета отфильтровывали и обраба-
иодида 3б в 0.5 мл ацетона добавляли 10 мл ди-
тывали 5 мл ацетона. Выход 0.707 г (58%), т. пл.
этилового эфира. Полученную смесь оставляли
210-212°С (разл.). Найдено, %: С 28.24; H 2.32; N
на сутки при 0°С. Желтый осадок отфильтровы-
6.69. C10H9Br3N2S. Вычислено, %: С 28.00; H 2.11;
вали и сушили на воздухе. Выход 0.061 г (89%),
N 6.53.
т. пл. 161-163°С (разл.). Спектр ЯМР 1H, δ, м. д.:
Рентгеноструктурный анализ. Набор экспе-
4.71 д (2Н, CH2I, J = 2.9 Гц), 8.04 т (1Н, SCH, J =
риментальных отражений образца получен на ав-
7.7 Гц), 8.23 д (1H, 7-Н, J = 8.4 Гц), 8.29 т (1Н, 8-Н,
томатическом четырехкружном дифрактометре D8
J = 3.0 Гц), 8.40 м (1Н, 9-Н), 8.51 д (1Н, 10-Н, J =
QUEST Bruker (MoKα-излучение, λ = 0.71073 Å,
8.2 Гц), 9.70 с (1H, 5-Н). Найдено, %: С 29.33; H
графитовый монохроматор). Сбор, редактирова-
1.89; N 6.34. C11H8I2N2S. Вычислено, %: С 29.10;
ние данных и уточнение параметров элементар-
H 1.78; N 6.17.
ной ячейки, а также учет поглощения проведены
Иодид
3-метил[1,3]тиазоло[3,2-c]хиназоли-
с помощью программ SMART и SAINT-Plus [12].
ния (4). Смесь 0.071 г (0.1 ммоль) трииодида 3б,
Все расчеты по определению и уточнению струк-
0.223 г (1.2 ммоль) иодида натрия (дигидрат) и 6
тур выполнены с помощью программ SHELXL/PC
мл ацетона оставляли на 1 ч. Оранжевый осадок
[13], OLEX2 [14]. Структура определена прямым
отфильтровывали и сушили на воздухе. Выход
методом и уточнена методом наименьших квадра-
0.024 г (74%), т. пл. 180-182°С (разл.). Спектр
тов в анизотропном приближении для неводород-
ЯМР 1H, δ, м. д.: 2.90 д (3Н, СH3, J = 1.0 Гц), 8.09 д.
ных атомов.
д. д (1Н, SCH, J = 8.2, 7.0, 1.3 Гц), 8.30 м (2Н, Н-7,
Н-8), 8.35 д. д (1Н, Н-10, J = 8.5, 1.3 Гц), 8.81 д. д
Кристаллы соединения 6 моноклинные, про-
(1Н, Н-9, J = 8.3, 1.3 Гц), 9.88 с (1Н, Н-5). Найдено,
странственная группа P21/n, [C10H9N2SBr2]+∙[Br]-·
%: С 40.43; H 2.85; N 8.77. C11H9I1N2S. Вычислено,
CH3COOH, M 489.03, a = 11.606(5), b = 9.772(4),
%: С 40.26; H 2.76; N 8.54.
c = 15.181(9) Å, β = 104.05(3)°, V = 1670.4(14) Å3,
Бромид 3-бромметил[1,3]тиазоло[3,2-c]хина-
Z = 4, dвыч = 1.945 г/см3, μ = 7.371 см-1. Измерено
золиния (5в). К раствору 0.12 г (0.6 ммоль) 4-про-
40409 отражений, из них 7163 независимых (Rint =
паргилсульфанилхиназолина в 5 мл дихлормета-
0.0908) и 3107 наблюдаемых отражений [I ≥ =
на прибавляли раствор 0.09 мл (0.9 ммоль) Br2 в
2σ(I)], 184 параметр уточнения: R1 = 0.0674, wR2 =
5 мл дихлорметана при охлаждении льдом. Смесь
0.1178. Полные таблицы координат атомов, длин
оставляли на сутки при комнатной температуре,
связей и валентных углов депонированы в Кем-
затем удаляли растворитель. Остаток обрабатыва-
бриджском банке структурных данных (CCDC
ли 5 мл ацетона и оставляли на 1 ч. Полученный
1913587) и могут быть запрошены по адресу http://
белый осадок отфильтровывали и сушили на воз-
духе. Выход 0.18 г (83%), т. пл. 116-118°С (разл.).
КОНФЛИКТ ИНТЕРЕСОВ
Спектр ЯМР 1H, δ, м. д.: 4.72 д (2Н, CH2Br, J =
3.0 Гц), 8.05 т (1Н, SCH, J = 7.7 Гц), 8.23 м (1H,
Авторы заявляют об отсутствии конфликта
7-Н), 8.31 д (1Н, 8-Н, J = 3.0 Гц), 8.41 т (1Н, 9-Н,
интересов.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 11 2020
1690
КИМ и др.
СПИСОК ЛИТЕРАТУРЫ
8. Bakhteeva E.I., Kim D.G., Dmitriev M.V., Krylova Yu.E. //
Russ. J. Org. Chem. 2019. Vol. 55. N 6. P. 748. doi
1. LeMahieu R.A., Carson M., Nason W.C., Parrish D.R.,
10.1134/S1070428019060022
Welton A.F., Baruth H.W., Yaremko B. // J. Med. Chem.
1983. Vol. 26. N 3. P. 420. doi 10.1021/jm00357a018
9. Molina P., Arques A., Vinader M.V. // Eur. J. Org. Chem.
2. Liu K.C., Hsu L.Y. // Arch. Pharm. 1985. Vol. 318. N 6.
1987. Vol. 2. P. 103. doi 10.1002/jlac.198719870203
P. 502. doi 10.1002/ardp.19853180605
10. Singh H., Deep K. // Tetrahedron. 1984. Vol. 40. N 23.
3. Lamberth C., Hillesheim E., Bassand D., Schaub F. //
P. 4937. doi 10.1016/s0040-4020(01)91329-8
Pest Manag. Sci. 2000. Vol. 56. N 1. P. 94. doi 10.1002/
11. Kuneš J., Bažant J., Pour M., Waisser K., Šlosárek M.,
(sici)1526-4998(200001)56:1<94::aid-ps105>3.0.co;2-3
Janota J. // Il Farmaco. 2000. Vol. 55. N 11-12. P. 725.
4. Waisser K., Klimešová V., Odlerová Ž. Antituberculotics //
doi 10.1016/s0014-827x(00)00100-2
Folia Pharm. Univ. Carol. 1995. Vol. 18. P. 31.
12. SMART and SAINT-Plus. Versions 5.0. Data Collection
5. Bakherad M., Keivanloo A., Kalantar Z., Keley V. //
and Processing Software for the SMART System.
Phosphorus, Sulfur, Silicon, Relat. Elem. 211. Vol. 186.
Madison, WI, USA, Bruker AXS, 1998.
N 3. P. 464. doi 10.1080/10426507.2010.503211
13. SHELXTL/PC. Versions 5.10. An Integrated System
6. Song P., Cui F., Li N., Xin J., Ma Q., Meng X., Liu H. //
for Solving, Refining and Displaying Crystal Structures
Chinese J. Chem. 2017. Vol. 35. N 10. P. 1633. doi
from Diffraction Data. Madison, USA, Bruker AXS,
10.1002/cjoc.201700005
1998.
7. Zborovskii Y.L., Orysyk V.V., Dobosh A.A., Staninets V.I.,
Pirozhenko V.V., Chernega A.N. // Chem. Heterocycl.
14. Dolomanov O.V., Bourhis L.J., Gildea R.J, Ho-
Compd. 2003. Vol. 39. N 8. P. 1099. doi 10.1023/
ward J.A.K., Puschmann H. // J. Appl. Cryst. 2009.
b:cohc.0000003532.58469.cc
Vol. 42. P. 339. doi 10.1107/s0021889808042726
Reactions of 4-Propargylsulfanylqinazoline with Bromine
and Iodine
D. G. Kim, E. I. Bakhteeva*, and V. V. Sharutin
South Ural State University, Chelyabinsk, 454080 Russia
*e-mail: evgesheck1990@gmail.com
Received July 3, 2020; revised July 3, 2020; accepted July 19, 2020
Cyclization of 4-propargylsulfanylquinazoline under the action of iodine gave 3-iodomethyl[1,3]thiazolo[3,2-c]-
quinazolinium triiodide, which is reduced with sodium iodide to form 3-methyl[1,3]thiazolo[3,2-c]quinazolinium
odide. The reaction with bromine in dichloromethane leads to the formation of 3-bromomethyl[1,3]-
thiazolo[3,2-c]quinazolinium bromide, and in acetic acid - 2-(2-aminophenyl)-4-dibromomethyl-1,3-thiazole
hydrobromide.
Keywords: quinazoline-4(3H)-thione, 4-propargylsulfanylquinazoline, thiazolo[3,2-c]quinazoline, halocycliza-
tion, 2-(2-aminophenyl)-4-dibromomethyl-1,3-thiazole, domino reaction
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 11 2020