ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2020, том 90, № 11, с. 1691-1703
УДК 547.341
АЛКИЛИРОВАНИЕ СН-КИСЛОТ
3-ГАЛОГЕНМЕТИЛЬНЫМИ ПРОИЗВОДНЫМИ
ЭФИРОВ (ДИЭТОКСИФОСФОРИЛМЕТИЛ)-
ФУРАНКАРБОНОВЫХ КИСЛОТ
© 2020 г. Л. М. Певзнер*, В. С. Завгородний, А. И. Поняев
Санкт-Петербургский государственный технологический институт (технический университет),
Московский пр. 26, Санкт-Петербург, 190013 Россия
*e-mail: pevzner_lm@list.ru
Поступило в Редакцию 11 июня 2020 г.
После доработки 11 июня 2020 г.
Принято к печати 21 июня 2020 г.
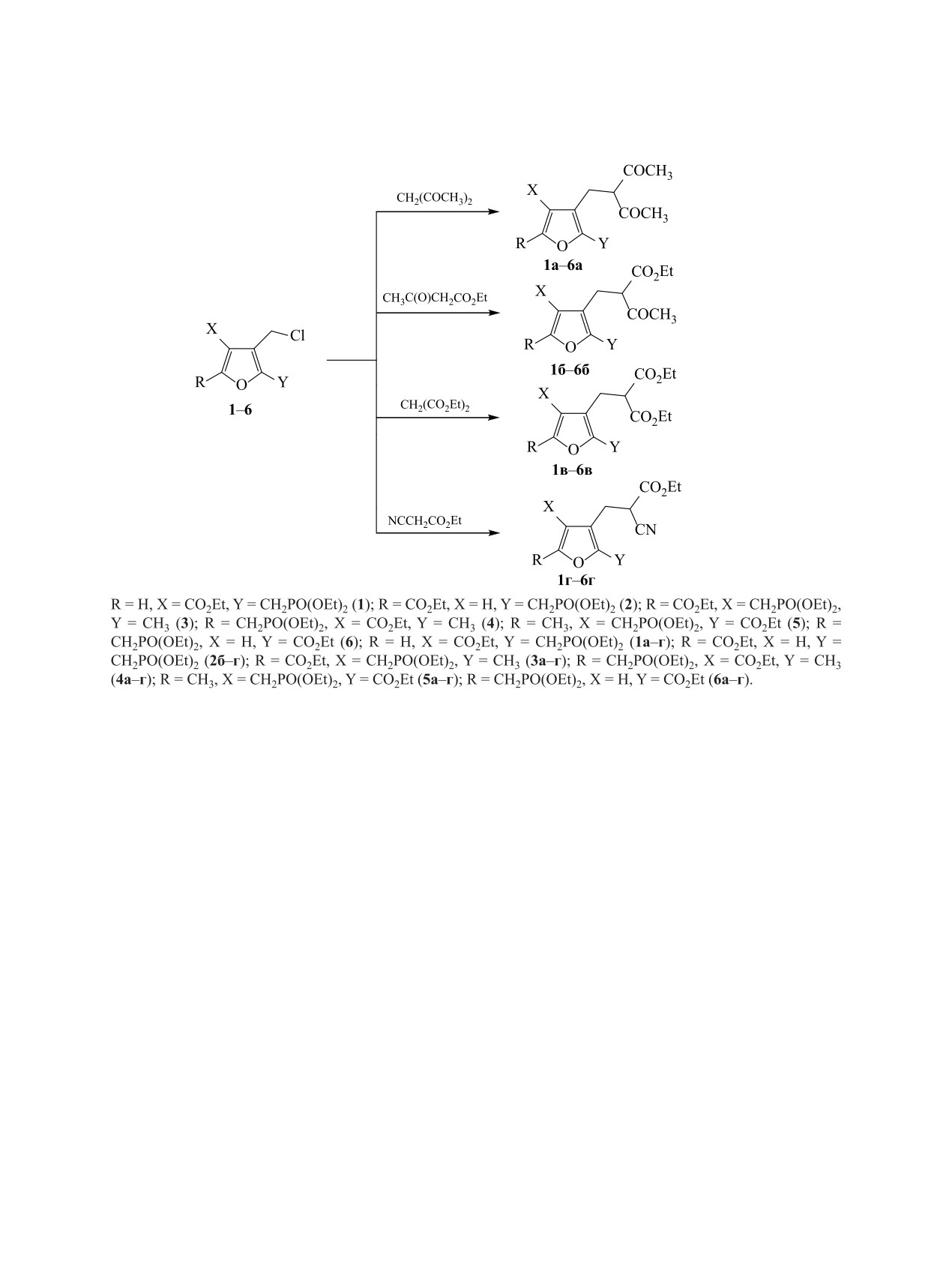
Алкилирование по углероду активной метиленовой группы 3-галогенметильных производных эфиров
фосфонкарбоновых кислот фуранового ряда ацетилацетоном, ацетоуксусным, малоновым и цианоук-
сусным эфирами в среде абсолютный этанол-диоксан (1:10) в присутствии этилата натрия приводит
к образованию соответствующих моноалкильных производных. Полученные фосфонметилированные
производные 3-(фурилметил)ацетилацетона и 2-(фурилметил)ацетоуксусного эфира реагируют с гидра-
зингидратом, образуя фосфорсодержащие производные (фурил)(пиразолил)метанов и (фурил)(пиразо-
лонил)метанов соответственно. Последние в хлороформе существуют исключительно в гидроксиформе.
Ключевые слова: алкилирование СН-кислот, 3-галогенметилфураны, пиразолы, пиразолоны, кето-е-
нольная таутомерия
DOI: 10.31857/S0044460X20110098
Ранее нами был разработан метод алкилиро-
в природе и обладают высокой биологической ак-
вания наиболее распространенных СН-кислот
тивностью [4].
2-галогенметильными производными эфиров
В качестве алкилирующих агентов были ис-
фосфонкарбоновых кислот фуранового ряда, что
пользованы соединения 1-6, структура которых ох-
позволило синтезировать исходные вещества для
ватывает все возможные варианты относительного
получения гибридных гетероциклических систем,
расположения фосфометильной и сложноэфирной
имеющих в своей структуре функционализирован-
групп в молекуле 3-галогенметилфуранов. В сое-
ный фурановый и азольный или азиновый цикл,
динения 3-5 пришлось вводить в α-положение фу-
разделенные метиленовым мостиком [1]. В ходе
ранового кольца балластную метильную группу,
работы из полученных продуктов алкилирования
поскольку синтезировать тризамещенное соедине-
были синтезированы 4-замещенные производные
ние требуемой структуры не удавалось. В качестве
3,5-диметилпиразола и 4-метил-5-гидроксипира-
СН-кислот были выбраны ацетилацетон, ацетоук-
зола. Продолжая работу в этом направлении, мы
сусный, малоновый и цианоуксусный эфиры. Во
обратились к изучению недавно синтезирован-
всех случаях реакцию проводили в смеси абсо-
ных [2, 3] 3-галогенметильных производных эфи-
лютного этанола и диоксана (1:10) при 90°С при
ров фосфонкарбоновых кислот фуранового ряда.
мольном соотношении фуран 1-6 :СН-кислота =
Необходимость изучения этого ряда соединений
1.0:1.1 в присутствии 1.05 моль этилата натрия и
обусловлена тем, что вещества, имеющие фу-
0.2 моль иодида калия на 1 моль фурана в тече-
ран-3-ильный фрагмент, широко распространены
ние 10 ч (схема 1). Продукты алкилирования 1а-6г
1691
1692
ПЕВЗНЕР и др.
Схема 1.
были выделены в виде желтых или светло-корич-
Предположение о преобладающем влиянии сте-
невых сиропообразных веществ, разлагающихся
рических факторов подтверждается примерами с
при перегонке в вакууме ниже температуры кипения.
участием соединений 2 и 4, где выходы продуктов
алкилирования колеблются в пределах 70-80 и 70-
Анализ зависимости выхода продуктов ал-
90% соответственно. В первом случае в положе-
килирования от строения
3-галогенметильного
нии 2 фуранового кольца находится диэтоксифос-
производного показывает, что для всех четырех
форилметильная группа, а положение 4 свободно.
использованных СН-кислот хуже всего идет реак-
Следовательно, экранирование хлорметильной
ция с участием соединения 1. Выходы продуктов
группы намного меньше, чем в случае соединения
алкилирования колеблются в пределах 45-60%.
1. В соединении 4 положение 2 фуранового кольца
В случае соединения 5 с обратным расположе-
занято метильной группой, а положение 4 - слож-
нием заместителей и дополнительной удаленной
метильной группой в кольце выходы целевых
ноэфирной. Экранирующее действие обеих групп
по отношению к хлорметильной заметно меньше,
продуктов увеличиваются до 70-90%. Поскольку
чем объемной диэтоксифосфорилметильной, что и
суммарное акцепторное воздействие заместителей
отражается на выходах продуктов алкилирования.
на реакционный центр в обоих случаях примерно
одинаково, остается предположить, что наиболь-
В случае соединений 3 и 6 выходы целевых
шее влияние на выход продуктов алкилирования
продуктов сильно колеблются в зависимости от
оказывают стерические факторы. Видимо, экрани-
природы СН-кислоты, что не очень понятно. Ал-
рование хлорметильной группы диэтоксифосфо-
килирование ацетилацетона и ацетоуксусного
рилметильной, находящейся в положении 2, боль-
эфира соединением 3 протекает с выходами 53 и
ше, чем группы в положении 4.
59%, а в случае малонового и цианоуксусного эфи-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 11 2020
АЛКИЛИРОВАНИЕ СН-КИСЛОТ 3-ГАЛОГЕНМЕТИЛЬНЫМИ ПРОИЗВОДНЫМИ
1693
Схема 2.
ра выходы продуктов реакции увеличиваются до
тересно, что в цианоацетатах 1г и 2г это взаимо-
86 и 96% соответственно. Алкилирование ацетил-
действие ядер фосфора и углерода спектрально не
ацетона соединением 6 протекает с выходом 89%,
проявляется. Дальние константы взаимодействия
а малонового эфира с выходом 75%, тогда как для
фосфора и углерода не отмечаются также в слу-
ацетоуксусного и цианоуксусного эфиров выходы
чае 4-фосфонметилированных производных 3а-г
продуктов алкилирования составляют 52 и 49%
и 5а-г.
соответственно. Поскольку прямой зависимости
Конформационная подвижность полученных
как от кислотности СН-кислоты, так и от объема
соединений подтверждается множественностью
ее аниона не прослеживается, наблюдаемый эф-
сигналов протонов и, особенно, ядер углерода раз-
фект может быть обусловлен действием несколь-
личных структурных фрагментов. Однако иногда
ких разнонаправленных факторов, индивидуаль-
закрепляется единственная конформация, в кото-
ных для каждого из алкилирующих агентов.
рой протоны метиленовой группы боковой цепи
Анализ спектральных данных соединений 1а-
становятся неэквивалентны и их сигналы образу-
6г показывает, что положение сигналов протонов
ют АВ-систему (соединения 3б, г, 4б, г, 5г, 6б, в).
и ядер углерода метиленовой группы алкильного
При этом соединения 6б, в не самые стерически
заместителя мало зависит от природы функцио-
загруженные. В случае соединения 3г AB-систему
нальных групп в боковой цепи. Они регистриру-
образуют также сигналы протонов метиленовой
ются в интервалах 2.9-3.3 и 21-23 м. д. соответ-
группы при атоме фосфора.
ственно. Напротив, положение сигнала углерода
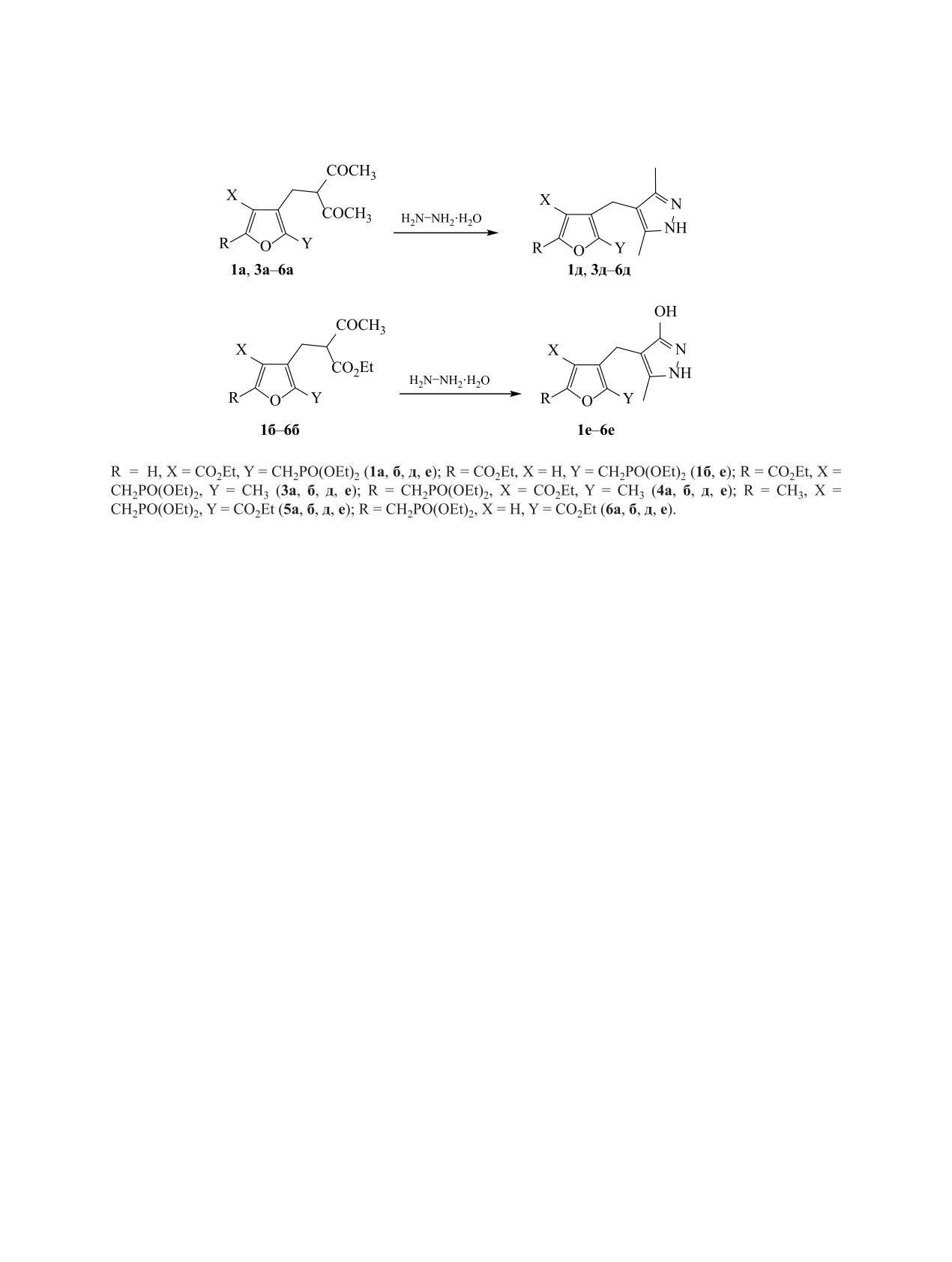
Как и раньше [1], на примере производных аце-
метиновой группы четко определяется природой
тилацетона и ацетоуксусного эфира была изучена
заместителей. Его химический сдвиг возрастает
возможность образования пиразольного кольца
в ряду малонат (50-53 м. д.) < ацетоацетат (58-
при взаимодействии этих соединений с гидразин-
59 м. д.) < цианоацетат (62-63 м. д.) < ацетилаце-
гидратом при комнатной температуре в этаноле.
тон (66-67 м. д.). В случае 4-замещенных 2-фос-
Оказалось, что в большинстве случаев эта реак-
фонметилированных соединений 1а-в этот сигнал
ция идет с высокими выходами (80-90%) с обра-
расщеплен от фосфора с константой 5JPC = 3.1-
зованием 4-замещенных производных 3,5-диме-
3.4 Гц. Если соседнее положение 4 фуранового
тилпиразола 1д-6д и 3-метилпиразол-5-она 1е-6е
кольца свободно (соединения 2а-в) константа 5JPC
соответственно (схема 2). Исключение составили
уменьшается до 2.5-2.7 Гц, видимо, за счет боль-
соединения 2а и 6б. В первом случае пиразоль-
шей подвижности алкильного заместителя. Ин-
ный цикл не образуется, а во втором выход пира-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 11 2020
1694
ПЕВЗНЕР и др.
золона 6е составил всего 32%. Целевые продукты
Общая методика алкилирования ацетилаце-
представляли собой стекловидные вещества, при
тона, ацетоуксусного, малонового и цианоуксус-
небольшом нагревании превращающиеся в очень
ного эфиров хлорметильными производными
вязкие сиропы, за исключением соединения 3е с
1-6. К раствору 5.25 мг-экв. свежеприготовленной
т. пл. 188°С.
натриевойфольгив смеси1мл абсолютного этанолаи
10 мл безводного диоксана прибавляли 5.50 ммоль
Образование пиразольного цикла подтвержда-
субстрата и перемешивали 20 мин. Затем прибав-
ется данными ЯМР 1Н и 13С. В спектрах ЯМР 1Н в
ляли в один прием 5.00 ммоль галогенметильного
слабом поле наблюдается сильно уширенный сиг-
производного 1-6, 1.00 ммоль иодида калия, и на-
нал, свидетельствующий о появлении в структуре
легко обменивающихся протонов фрагментов NH
гревали полученную смесь 10 ч при 90°С при ин-
тенсивном перемешивании. После завершения ре-
и ОН. Сигнал протонов метиленовой группы, на-
акции отгоняли растворители, остаток растворяли
ходящейся между двумя гетероциклами, во всех
в 30 мл четыреххлористого углерода, промывали
случаях представляет собой синглет. Следователь-
10 мл воды, 10 мл раствора NaCl и сушили сульфа-
но, в соединениях 1д, 3д-6д и 1е-6е пиразольное
кольцо является ароматическим. В углеродных
том натрия. Фильтрат упаривали, остаток выдер-
спектрах
3,5-диметилпиразолов наблюдаются
живали в вакууме (1 мм рт. ст.) 1 ч при комнатной
температуре.
уширенные обменные сигналы ядер углерода С4
в интервале 106-112 м. д. и С3,5 около 142 м. д.
3-[(2-Диэтоксифосфорилметил)-4-(этокси-
В спектрах 3-метил-5-гидроксипиразолов присут-
карбонил)фур-3-ил]метилпентан-2,4-дион (1а).
ствуют три уширенных сигнала при 99-109 (С4),
Выход 58%, светло-коричневое сиропообразное
138-147 (С3) и 161-163 м. д. (С5). Это также под-
вещество. Спектр ЯМР 1Н, δ, м. д.: 1.21-1.32 м (9Н,
тверждает, что во всех случаях NH-форма пира-
СН3-фосфонат, СН3-фуроат), 2.16 с (6Н, СН3-аце-
зольного цикла преобладает, а для пиразолонов
тил), 3.03 д (2Н, фуран-СН2, JНН = 6.8 Гц), 3.33 д
енольная форма является преобладающей. Уши-
(2Н, СН2Р, JРН = 20.4 Гц), 3.90-4.08 м (5Н, СН2ОР,
рение сигналов ядер углерода цикла доказывает
СН), 4.25 к (2Н, СН2О-фуроат, JНН = 7.2 Гц),
также, что в пиразольном кольце идет быстрый (в
7.90 с (1Н, Н5-фуран). Спектр ЯМР 13С, δС, м. д.:
шкале времени ЯМР) обменный процесс.
14.27 (СН3-фуроат),
16.36 д (СН3-фосфонат,
Таким образом, алкилирование наиболее рас-
3JPC = 5.8 Гц), 21.84 д (фуран-СН2, 4JPC = 0.9 Гц),
пространенных СН-кислот линейного строения
24.77 д (СН2Р, 1JPC = 142.2 Гц), 30.11 (СН3-ацетил),
3-хлорметильными производными фосфонкарбо-
60.33 (СН2О-фуроат), 62.25 д (СН2ОР, 2JPC = 6.5 Гц),
новых кислот фуранового ряда приводит к обра-
66.74 д (СН, 5JPC = 2.5 Гц), 118.32 д (С3-фуран, 3JPC =
зованию моноалкильных производных. Основное
8.9 Гц), 118.34 д (С4-фуран, 4JPC = 6.5 Гц), 145.72 д
влияние на выход продуктов оказывают стериче-
(С2-фуран, 2JPC = 12.6 Гц), 147.88 д (С5-фуран, 4JPC =
ские факторы. Реакция производных ацетилаце-
2.7 Гц), 163.29 (С=О-фуроат), 204.02 (С=О-аце-
тона и ацетоуксусного эфира с гидразингидратом
тил). Спектр ЯМР 31Р: δР 23.00 м. д.
приводит к гибридным гетероциклическим систе-
Этиловый эфир 2-[(2-диэтоксифосфорилме-
мам, в которых фурановый и пиразольный цикл
тил)-4-(этоксикарбонил)фур-3-ил]метил-3-ок-
соединены метиленовым мостиком. Во всех этих
собутановой кислоты (1б). Выход 63%, желтое
соединениях пиразольное кольцо присутствует в
сиропообразное вещество. Спектр ЯМР 1Н, δ, м. д.:
таутомерных формах, имеющих ароматическую
1.16-1.28 м (9Н, СН3-фосфонат, СН3-ацетоацетат),
структуру.
1.31 т (3Н, СН3-фуроат, JНН = 7.2 Гц), 2.24 с (3Н,
СН3-ацетил), 2.99-3.12 м (2Н, фуран-СН2), 3.28 д
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
=
(1Н, СН2Р, JРН = 20.8 Гц), 3.36 д (1Н, СН2Р, JРН
Спектры ЯМР 1Н, 13С, и 31Р получали на
20.4 Гц),
4.06 д. к
(4Н, СН2ОР, JНН
=
7.2,
приборе Bruker AVANCE-400 (400.13, 100.16 и
JРН = 14.8 Гц), 4.11 д. т (1Н, СН, JНН = 7.2,
161.97 МГц соответственно) в дейтерохлороформе.
J
=
2.8 Гц),
4.17 к
(2Н, СН2О-ацетоаце-
РН
Галогенметильные производные эфиров фос-
тат, JНН = 7.0 Гц), 4.26 к (2Н, СН2О-фуроат,
фонкарбоновых кислот фуранового ряда получали
J
= 7.2 Гц), 7.88 д (1Н, Н5-фуран, JРН = 2.0 Гц).
НН
по методикам [2, 3].
Спектр ЯМР 13С, δС, м. д.: 13.98 (СН3-ацетоа-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 11 2020
АЛКИЛИРОВАНИЕ СН-КИСЛОТ 3-ГАЛОГЕНМЕТИЛЬНЫМИ ПРОИЗВОДНЫМИ
1695
цетат), 14.05 (СН3-ацетоацетат), 14.21 (СН3-фу-
(СН), 113.09 (CN), 116.14 д (С3-фуран, 3JPC = 8.0 Гц),
роат),
16.33 д (СН3-фосфонат, 3JPC = 5.8 Гц),
118.72 д (С4-фуран, 4JPC = 3.4 Гц), 146.48 д (С2-фуран,
22.02 уш. с (фуран-СН2),
24.79 д (СН2Р,
2JPC = 11.9 Гц), 147.97 д (С5-фуран, 4JPC = 2.9 Гц),
1JРС=142.4Гц),30.10(СН3-ацетил),58.88д(СН, 5JPC=
162.93 (С=О-фуроат), 165.66 (С=О-цианоацетат).
2.7 Гц), 60.32 (СН2О-фуроат), 61.33 (СН2О-ацетоа-
Спектр ЯМР 31Р: δР 21.96 м. д.
цетат), 62.26 д (СН2ОР, 2JPC = 6.5 Гц), 62.33 д (СН2ОР,
3-[(2-Диэтоксифосфорилметил)-5-(этокси-
2JPC = 6.0 Гц), 118.09 д (С3-фуран, 3JPC = 8.6 Гц),
карбонил)фур-3-ил]метилпентан-2,4-дион (2а).
118.58 д (С4-фуран, 4JPC = 3.2 Гц), 145.75 д (С2-фу-
Выход 80%, светло-коричневое сиропообразное
ран, 2JPC = 12.6 Гц), 147.87 д (С2-фуран, 2JPC =
вещество. Спектр ЯМР 1Н, δ, м. д.: 1.24-1.39 м
12.4 Гц), 163.26 (С=О-фуроат), 167.09 (С=О-аце-
(9Н, СН3-фосфонат, СН3-фуроат),
2.17 с
(6Н,
тоацетат), 200.62 (С=О-ацетил), 202.97 (С=О-аце-
СН3-ацетил), 2.91 д. д (2Н, фуран-СН2, JНН = 7.6,
тил). Спектр ЯМР 31Р: δР 22.89 м. д.
J
= 1.8 Гц), 3.27 д (2Н, СН2Р, JРН = 21.2 Гц), 4.06
РН
Диэтиловый эфир [(2-диэтоксифосфорилме-
д. к (4Н, СН2ОР, JНН = 7.2, JРН = 14.8 Гц), 4.09 т (1Н,
тил)-4-(этоксикарбонил)фур-3-ил]метилмало-
СН, JНН = 7.6 Гц), 4.25-4.32 м (2Н, СН2О-фуроат),
новой кислоты (1в). Выход 45%, темно-желтое
6.93 с (1Н, Н4-фуран). Спектр ЯМР 13С, δС, м. д.:
сиропообразное вещество. Спектр ЯМР 1Н, δ, м. д.:
14.28 (СН3-фуроат), 16.31 д (СН3-фосфонат, 3JPC =
1.17-1.33 м (15Н, СН3-фосфонат, СН3-малонат,
5.9 Гц), 16.41 д (СН3-фосфонат, 3JPC = 6.0 Гц),
СН3-фуроат), 3.08-3.23 м (2Н, фуран-СН2), 3.29 д
22.90 (фуран-СН2), 25.53 д (СН2Р, 1JPC = 141.3 Гц),
(2Н, СН2Р, JРН = 20.4 Гц), 3.88 д. д (1Н, СН, JНН = 7.8,
29.89 (СН3-ацетил), 60.86 (СН2О-фуроат), 62.55
10.8 Гц), 4.00-4.13 м (4Н, СН2ОР), 4.18 к (4Н,
д (СН2ОР, 2JPC = 6.5 Гц), 62.58 д (СН2ОР, 2JPC =
СН2О-малонат, JНН = 7.2 Гц), 4.27 к (2Н, СН2О-фу-
6.6 Гц), 67.98 д (СН, 5JPC = 2.5 Гц), 119.61 д (С4-фу-
роат, JНН = 7.2 Гц), 7.80 д (1Н, Н5-фуран, JРН =
ран, 4JPC = 6.5 Гц), 121.05 д (С3-фуран, 3JPC = 8.4 Гц),
2.0 Гц). Спектр ЯМР 13С, δС, м. д.: 13.94 (СН3-ма-
143.55 д (С5-фуран, 4JPC = 3.6 Гц), 147.23 д (С2-фу-
лонат), 14.21 (СН3-фуроат), 16.35 д (СН3-фос-
ран, 2JPC = 12.4 Гц), 158.31 (С=О-фуроат), 191.64
фонат,
3JPC
=
6.7 Гц),
23.03 д (фуран-СН2,
(С=О-ацетил), 203.17 (С=О-ацетил). Спектр ЯМР
4JРС = 1.5 Гц), 24.83 д (СН2Р, 1JРС = 141.0 Гц),
31Р: δР 21.58 м. д.
51.57 д (СН, 5JРС = 3.4 Гц), 60.38 (СН2О-фуроат),
Этиловый эфир 2-[(2-диэтоксифосфорилме-
61.37 (СН2О-малонат),
61.63 (СН2О-малонат),
тил)-5-(этоксикарбонил)фур-3-ил]метил-3-ок-
62.28 д (СН2ОР, 2JPC = 6.7 Гц), 117.68 д (С3-фуран,
собутановой кислоты (2б). Выход 80%, свет-
3JPC = 9.1 Гц), 118.86 д (С4-фуран, 4JPC = 3.6 Гц),
ло-коричневое сиропообразное вещество. Спектр
145.77 д (С2-фуран, 2JPC = 12.5 Гц), 147.93 д (С5-фу-
ЯМР 1Н, δ, м. д.: 1.20-1.31 м (12Н, СН3-фосфо-
ран, 4JPC = 2.1 Гц), 163.24 (С=О-фуроат), 169.07
нат, СН3-ацетоацетат, СН3-фуроат), 2.20 с (1.5Н,
(С=О-малонат). Спектр ЯМР 31Р: δР 22.74 м. д.
СН3-ацетил), 2.22 с (1.5Н, СН3-ацетил), 2.89 д. д
Этиловый эфир
2-[(2-диэтоксифосфорил-
(1Н, фуран-СН2, JНН = 7.4, JРН = 2.0 Гц), 2.91 д.
метил)-4-(этоксикарбонил)фур-3-ил]метил-
д (1Н, фуран-СН2, JНН = 7.4, JРН = 2.0 Гц), 3.26 д
цианоуксусной кислоты (1г). Выход 50%, свет-
(2Н, СН2Р, JРН = 20.8 Гц), 3.78 т (1Н, СН, JНН =
ло-коричневое сиропообразное вещество. Спектр
7.4 Гц), 4.05 д. к (4Н, СН2ОР, JНН = 7.2, JРН = 14.4 Гц),
ЯМР 1Н, δ, м. д.: 1.26-1.37 м (12Н, СН3-фосфонат,
4.15 к (2Н, СН2О-ацетоацетат, JНН = 7.0 Гц), 4.26
СН3-цианоацетат, СН3-фуроат), 3.18-3.27 м (2Н,
к (2Н, СН2О-фуроат, JНН = 7.2 Гц), 6.95 с (1Н, Н4-
фуран-СН2), 3.32 д (2Н, СН2Р, JРН = 20.8 Гц), 4.03-
фуран). Спектр ЯМР 13С, δС, м. д.: 13.98 (СН3-
4.15 м (4Н, СН2ОР), 4.18 д. д (1Н, СН, JНН = 4.0,
ацетоацетат),
14.03 (СН3-ацетоацетат),
14.26
10.4 Гц), 4.27 к (2Н, СН2О-фуроат, JНН = 7.2 Гц),
(СН3-фуроат), 16.27 д (СН3-фосфонат, 3JPC = 6.0 Гц),
4.30 к (2Н, СН2О-цианоацетат, JНН = 7.0 Гц), 7.95
22.76 (фуран-СН2), 25.46 д (СН2Р, 1JРС = 141.3 Гц),
д (1Н, Н5-фуран, JРН = 2.0 Гц). Спектр ЯМР 13С,
29.73 (СН3-ацетил), 30.08 (СН3-ацетил), 59.43 д
δС, м. д.: 13.97 (СН3-цианоацетат), 14.24 (СН3-фу-
(СН, 5JPC = 2.7 Гц), 60.77 (СН2О-фуроат), 61.29
роат), 16.38 д (СН3-фосфонат, 3JPC = 5.8 Гц), 22.70
(СН2О-ацетоацетат),
61.63 (СН2О-ацетоацетат),
д (фуран-СН2, 4JPC = 2.8 Гц), 25.23 д (СН2Р, 1JРС =
62.18 д (СН2ОР, 2JPC = 6.7 Гц), 62.50 д (СН2ОР, 2JPC =
142.5 Гц), 60.67 (СН2О-фуроат), 62.36 д (СН2ОР,
6.6 Гц), 119.81 д (С4-фуран, 4JPC = 4.0 Гц), 120.99
2JPC = 6.7 Гц), 62.46 д (СН2ОР, 2JPC = 7.0 Гц), 62.89
д (С3-фуран, 3JPC = 8.4 Гц), 143.43 д (С5-фуран,
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 11 2020
1696
ПЕВЗНЕР и др.
4JPC = 3.7 Гц), 147.42 д (С2-фуран, 2JPC = 12.4 Гц),
3-[2-Метил-4-(диэтоксифосфорилме-
158.35 (С=О-фуроат), 167.07 (С=О-ацетоацетат),
тил)-5-(этоксикарбонил)фур-3-ил]метилпен-
168.80 (С=О-ацетоацетат), 200.60 (С=О-ацетил),
тан-2,4-дион (3а). Выход 53%, желтое сиропо-
202.04(С=О-ацетил). Спектр ЯМР 31Р: δР 21.65 м. д.
образное вещество. Спектр ЯМР 1Н, δ, м. д.: 1.26
т (6Н, СН3-фосфонат, JНН = 7.0 Гц), 1.37 т (3Н,
Диэтиловый эфир [(2-диэтоксифосфорилме-
СН3-фуроат, JНН = 7.2 Гц), 2.17 с (6Н, СН3-ацетил),
тил)-5-(этоксикарбонил)фур-3-ил]метилмало-
2.29 уш. с (3Н, СН3-фуран), 2.99 д (2Н, фуран-СН2,
новой кислоты (2в). Выход 74%, темно-желтое
JНН = 7.8 Гц), 3.54 д (1Н, СН2Р, JРН = 23.2 Гц),
сиропообразное вещество. Спектр ЯМР 1Н, δ,
3.56 д (1Н, СН2Р, JРН = 23.2 Гц), 4.02-4.10 м (4Н,
м. д.: 1.19-1.34 м (15Н, СН3-фосфонат, СН3-ма-
СН2ОР), 4.22 т (1Н, СН, JНН = 7.8 Гц), 4.42-4.38 м
лонат, СН3-фуроат), 2.99 уш. д (2Н, фуран-СН2,
(СН2О-фуроат). Спектр ЯМР 13С, δС, м. д.: 12.34
JНН = 7.6 Гц), 3.25 д (2Н, СН2Р, JРН = 19.2 Гц), 3.59 д.
(СН3-фуран), 12.40 (СН3-фуран), 14.39 (СН3-фу-
т (1Н, СН, JНН = 7.6, JРН = 1.6 Гц), 4.03-4.11 м (4Н,
роат), 16.32 д (СН3-фосфонат, 3JPC = 6.3 Гц), 16.34
СН2ОР), 4.12-4.21 м (4Н, СН2О-малонат), 4.29 уш.
д (СН3-фосфонат, 3JPC = 6.0 Гц), 22.92 д (СН2Р,
к (2Н, СН2О-фуроат, JНН = 7.2 Гц), 7.00 с (1Н, Н4-фу-
1JPC = 139.0 Гц), 23.11 д (СН2Р, 1JPC = 139.5 Гц), 23.34
ран). Спектр ЯМР 13С, δС, м. д.: 13.97 (СН3-мало-
(фуран-СН2), 29.68 (СН3-ацетил), 30.05 (СН3-а-
нат), 14.01 (СН3-малонат), 14.27 (СН3-фуроат),
цетил), 60.60 (СН2О-фуроат), 60.67 (СН2О-фу-
16.27 д (СН3-фосфонат, 3JPC = 6.1 Гц), 23.74 (фу-
роат),
60.71 (СН2О-фуроат),
62.08 д (СН2ОР,
ран-СН2), 25.49 д (СН2Р, 1JРС = 141.0 Гц), 52.17
2JPC = 6.7 Гц), 62.19 д (СН2ОР, 2JPC = 6.5 Гц),
д (СН, 5JPC = 2.5 Гц), 60.78 (СН2О-фуроат), 61.44
62.26 д (СН2ОР, 2JPC = 6.5 Гц), 65.73 (СН), 66.81
(СН2О-малонат),
61.66 (СН2О-малонат),
62.49
(СН), 118.43 д (С3-фуран, 3JPC = 3.0 Гц), 119.07
д (СН2ОР, 2JPC = 6.4 Гц),
119.76 д (С4-фуран,
д (С3-фуран, 3JPC = 3.1 Гц), 119.93 д (С3-фуран,
4JPC = 4.1 Гц), 120.64 д (С3-фуран, 3JPC = 8.3 Гц),
3JPC = 3.2 Гц), 125.65 д (С4-фуран, 2JPC = 10.3 Гц),
143.48 д (С5-фуран, 4JPC = 3.6 Гц), 147.62 д (С2-фу-
126.09 д (С4-фуран, 2JPC = 10.2 Гц), 126.19 д
ран, 2JPC = 12.5 Гц), 158.39 (С=О-фуроат), 166.59
(С4-фуран, 2JPC = 9.8 Гц),
139.18 д (С5-фуран,
(С=О-малонат),
168.59 (С=О-малонат). Спектр
3JPC = 10.1 Гц), 139.24 д (С5-фуран, 3JPC = 8.9 Гц),
ЯМР 31Р: δР 21.66 м. д.
139.28 д (С5-фуран, 3JPC = 8.8 Гц), 153.49 д
Этиловый эфир 2-[(2-диэтоксифосфорилме-
(С2-фуран, 4JPC = 2.4 Гц),
139.24 д (С2-фуран,
тил)-5-(этоксикарбонил)фур-3-ил]метил-ци-
4JPC = 2.2 Гц), 155.58 д (С2-фуран, 4JPC = 2.4 Гц),
аноуксусной кислоты (2г). Выход 78%, свет-
159.04 д (С=О-фуроат, 4JPC = 2.7 Гц), 159.16 д
ло-коричневое сиропообразное вещество. Спектр
(С=О-фуроат, 4JPC = 3.1 Гц), 191.19 (С=О-ацетил),
ЯМР 1Н, δ, м. д.: 1.26-1.36 м (12Н, СН3-фосфонат,
191.64 (С=О-ацетил), 203.55 (С=О-ацетил). Спектр
СН3-цианоацетат, СН3-фуроат), 3.04-3.13 м (2Н,
ЯМР 31Р, δР, м. д.: 24.77, 24.95. Соотношение ин-
фуран-СН2), 3.38 д (2Н, СН2Р, JРН = 20.8 Гц), 3.98
тенсивностей сигналов 1:1.
д. д (1Н, СН, JНН = 6.0, JНН = 8.0 Гц), 4.08 д. к (4Н,
Этиловый эфир 2-[2-метил-4-(диэтоксифос-
СН2ОР, JНН = 7.2, JРН = 14.4 Гц), 4.26 к (2Н, СН2О-фу-
форилметил)-5-(этоксикарбонил)фур-3-ил]ме-
роат, JНН = 7.2 Гц), 4.32 уш. к (2Н, СН2О-цианоа-
тил-3-оксобутановой кислоты (3б). Выход 59%,
цетат, JНН = 7.2 Гц), 7.14 с (1Н, Н4-фуран). Спектр
темно-желтое сиропообразное вещество. Спектр
ЯМР 13С, δС, м. д.: 13.80 (СН3-цианоацетат), 13.94
ЯМР 1Н, δ, м. д.: 1.20-1.29 м (9Н, СН3-фосфо-
(СН3-цианоацетат), 14.29 (СН3-фуроат), 16.33 д
нат, СН3-ацетоацетат), 1.36 т (3Н, СН3-фуроат,
(СН3-фосфонат, 3JPC = 6.1 Гц), 24.74 (фуран-СН2),
JНН = 7.2 Гц), 2.21 с (3Н, СН3-ацетил), 2.29 уш.
25.62 д (СН2Р, 1JРС = 140.4 Гц), 60.86 (СН2О-фу-
с (3Н, СН3-фуран), 2.96 д. д (1Н, фуран-СН2, НА,
роат), 61.00 (СН2О-цианоацетат), 62.23 д (СН2ОР,
J
= 15.0, JНАН = 8.0 Гц), 3.06 д. д (1Н, фуран-СН2,
АВ
2JPC = 6.9 Гц), 62.57 д (СН2ОР, 2JPC = 7.0 Гц), 62.97
НВ, JАВ = 15.0, JНВН = 7.0 Гц), 3.42 д. д (1Н, СН2Р,
(СН), 109.69 (CN), 115.31 (CN), 117.41 д (С3-фу-
НА, JАВ = 14.6, JРНА = 22.6 Гц), 3.50 д. д (1Н, СН2Р,
ран, 3JPC = 8.0 Гц), 119.71 (С4-фуран, 4JPC = 3.4 Гц),
НВ, JАВ = 14.6, JРНВ = 22.6 Гц), 3.89 д. д (1Н, СН,
143.88 д (С5-фуран, 4JPC = 3.6 Гц), 149.04 д (С2-фу-
J
НАН = 8.0, JНВН = 7.0 Гц), 4.01-4.14 м (4Н, СН2ОР),
ран, 2JPC = 12.3 Гц), 158.18 (С=О-фуроат), 162.15
4.19 к (2Н, СН2О-ацетоацетат, JНН = 7.2 Гц), 4.34
(С=О-цианоацетат),
162.92 (С=О-цианоацетат).
к (2Н, СН2О-фуроат, JНН = 7.2 Гц). Спектр ЯМР
Спектр ЯМР 31Р: δР 21.37 м. д.
13С, δС, м. д.: 12.40 (СН3-фуран), 13.99 (СН3-ацето-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 11 2020
АЛКИЛИРОВАНИЕ СН-КИСЛОТ 3-ГАЛОГЕНМЕТИЛЬНЫМИ ПРОИЗВОДНЫМИ
1697
ацетат), 14.37 (СН3-фуроат), 16.31 д (СН3-фос-
3JPC = 5.8 Гц), 62.08 д (СН2ОР, 2JPC = 6.7 Гц), 62.25 д
фонат, 3JPC = 6.3 Гц), 21.24 (фуран-СН2), 23.09 д
(СН2ОР, 2JPC = 6.9 Гц), 62.39 (СН2О-цианоацетат),
(СН2Р, 1JPC = 139.2 Гц), 29.70 (СН3-ацетил), 58.66
62.62 д (СН2ОР, 2JPC = 6.8 Гц); основной конфор-
(СН), 60.61 (СН2О-фуроат), 61.35 (СН2О-ацето-
мер, 12.74 (СН3-фуран), 14.34 (СН3-фуроат), 23.07
ацетат), 61.57 (СН2О-ацетоацетат), 62.18 д (СН2ОР,
д (СН2Р, 1JPC = 139.4 Гц), 24.72 (фуран-СН2), 60.75
2JPC = 6.5 Гц), 119.05 д (С3-фуран, 3JPC = 3.2 Гц),
(СН2О-фуроат), 62.94 (СН), 113.10 (СN), 117.15
125.93 д (С4-фуран, 2JPC = 10.6 Гц), 139.14 д
д (С3-фуран, 3JPC = 3.1 Гц), 125.41 д (С4-фуран,
(С5-фуран, 3JPC = 8.4 Гц),
153.60 д (С2-фуран,
2JPC = 10.3 Гц), 139.48 д (С5-фуран, 3JPC = 8.7 Гц),
4JPC = 2.4 Гц), 159.09 д (С=О-фуроат, 4JPC = 2.8 Гц),
154.86 д (С2-фуран, 4JPC = 2.4 Гц), 158.92 д (С=О-
169.10 (С=О-ацетоацетат), 202.28 (С=О-ацетил).
фуроат, 4JPC = 2.8 Гц), 162.94 (С=О-цианоацетат);
Спектр ЯМР 31Р: δР 24.86 м. д.
минорный конформер, 12.27 (СН3-фуран), 15.17
(СН3-фуроат), 22.90 д (СН2Р, 1JPC = 138.9 Гц), 23.54
Диэтиловый эфир [2-метил-4-(диэтоксифос-
(фуран-СН2), 60.58 (СН2О-фуроат), 62.97 (СН),
форилметил)-5-(этоксикарбонил)фур-3-ил]ме-
тилмалоновой кислоты (3в). Выход 86%, желтое
116.62 (СN), 119.22 д (С3-фуран, 3JPC = 3.1 Гц),
сиропообразное вещество. Спектр ЯМР 1Н, δ, м. д.:
126.15 д (С4-фуран, 2JPC = 10.4 Гц), 139.17 д
1.18-1.28 м (12Н, СН3-фосфонат, СН3-малонат),
(С5-фуран, 3JPC = 8.6 Гц),
154.23 д (С2-фуран,
1.35 т (3Н, СН3-фуроат, JНН = 7.2 Гц), 2.28 с (3Н,
4JPC = 2.7 Гц), 159.14 д (С=О-фуроат, 4JPC = 3.0 Гц),
СН3-фуран), 3.08 д (2Н, фуран-СН2, JНН = 7.8 Гц),
165.74 (С=О-цианоацетат). Спектр ЯМР 31Р, δР,
3.47 д (2Н, СН2Р, JРН = 22.8 Гц), 3.61 т (1Н, СН,
м. д.: 24.50, 25.27 (1:0.6).
JНН = 7.8 Гц), 4.01-4.14 м (4Н, СН2ОР), 4.18 к (4Н,
3-[2-Метил-4-(этоксикарбонил)-5-(диэтокси-
СН2О-малонат, JНН = 7.2 Гц), 4.33 к (2Н, СН2О-
фосфорилметил)фур-3-ил]метилпентан-2,4-ди-
фуроат, JНН = 7.2 Гц). Спектр ЯМР 13С, δС, м. д.:
он (4а). Выход 87%, коричневое сиропообразное
12.37 (СН3-фуран), 13.96 (СН3-малонат),
14.02
вещество. Спектр ЯМР 1Н, δ, м. д.: 1.26 т (6Н,
(СН3-малонат),
14.36 (СН3-фуроат),
16.28 д
СН3-фосфонат, JНН = 7.2 Гц), 1.37 т (3Н, СН3-фу-
(СН3-фосфонат, 3JPC = 6.2 Гц), 22.28 (фуран-СН2),
роат, JНН = 7.2 Гц), 2.14 с (3Н, СН3-фуран), 2.28
23.01 д (СН2Р, 1JPC = 139.3 Гц), 51.59 (СН), 60.58
с
(6Н, СН3-ацетил),
2.98 д
(2Н, фуран-СН2,
(СН2О-фуроат),
61.44 (СН2О-малонат),
61.55
JНН = 7.2 Гц), 3.62 д (2Н, СН2Р, JРН = 22.4 Гц), 4.07
(СН2О-малонат), 62.12 д (СН2ОР, 2JPC = 6.5 Гц),
д. к (4Н, СН2ОР, JНН = 7.2, JРН = 14.8 Гц), 4.16 т
118.86 д (С3-фуран, 3JPC = 3.1 Гц), 126.07 д
(1Н, СН, JНН = 7.2 Гц), 4.30 к (2Н, СН2О-фуроат,
(С4-фуран, 2JPC = 10.7 Гц), 139.08 д (С5-фуран,
JНН = 7.2 Гц). Спектр ЯМР 13С, δС, м. д.: 11.31
3JPC = 8.4 Гц), 153.62 д (С2-фуран, 4JPC = 2.4 Гц),
(СН3-фуран),
14.24 (СН3-фосфонат),
16.32 д
159.09 д (С=О-фуроат, 4JPC = 2.7 Гц),
166.58
(СН3-фосфонат, 3JPC = 6.2 Гц), 23.24 (фуран-СН2),
(С=О-малонат),
168.69 (С=О-малонат). Спектр
27.07 д (СН2Р, 1JPC = 139.0 Гц), 30.15 (СН3-а-
ЯМР 31Р: δР 24.89 м. д.
цетил), 60.38 (СН2О-фуроат),
62.26 д (СН2ОР,
2JPC = 6.4 Гц), 66.99 (СН), 114.52 д (С4-фуран,
Этиловый эфир
2-[2-метил-4-(диэтокси-
2JPC = 8.3 Гц), 115.96 д (С3-фуран, 3JPC = 2.3 Гц),
фосфорилметил)-5-(этоксикарбонил)фур-3-
149.53 д (С2-фуран, 4JPC = 2.7 Гц), 151.22 д
ил]метилцианоуксусной кислоты (3г). Выход
(С5-фуран, 3JPC = 13.6 Гц), 163.78 д (С=О-фуроат,
96%, светло-коричневое сиропообразное веще-
4JPC = 2.6 Гц), 204.00 (С=О-ацетил). Спектр ЯМР
ство. Спектр ЯМР 1Н, δ, м. д.: 1.18-1.39 м (12Н,
31Р: δР 21.67 м. д.
СН3-фосфонат, СН3-цианоацетат, СН3-фуроат),
2.39 с (3Н, СН3-фуран), 3.08 д. д (1Н, фуран-СН2,
Этиловый эфир 2-[2-метил-4-(этоксикарбо-
НА, JАВ = 14.8, JНАН = 9.6 Гц), 3.16 д. д (1Н, фу-
нил)-5-(диэтоксифосфорилметил)фур-3-ил]ме-
ран-СН2, НВ, JАВ = 14.8, JНВН = 6.0 Гц), 3.30 д. д
тил-3-оксобутановой кислоты (4б). Выход 94%,
(1Н, СН2Р, НА, JАВ = 14.6, JРНА = 22.2 Гц), 3.61 д. д
желтое сиропообразное вещество. Спектр ЯМР
(1Н, СН2Р, НВ, JАВ = 14.6, JРНВ = 22.2 Гц), 3.98-4.10
1Н, δ, м. д.: 1.18 т (3Н, СН3-ацетоацетат, J = 7.2 Гц),
м (5Н, СН2ОР, СН), 4.25 к (2Н, СН2О-цианоацетат,
1.25 т (6Н, СН3-фосфонат, JНН = 7.2 Гц), 1.32 т
JНН = 7.2 Гц), 4.35 к (2Н, СН2О-фуроат, JНН = 7.2 Гц).
(3Н, СН3-фуроат, J = 7.2 Гц), 2.18 с (3Н, СН3-фу-
Спектр ЯМР 13С, δС, м. д.: общие сигналы, 13.95
ран), 2.24 с (3Н, СН3-ацетил), 2.94 д. д (1Н, фу-
(СН3-цианоацетат), 16.31 уш. д (СН3-фосфонат,
ран-СН2, НА, JАВ = 14.0, JНAН = 8.4 Гц), 3.02 д. д
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 11 2020
1698
ПЕВЗНЕР и др.
(1Н, фуран-СН2, НВ, JАВ = 14.0, JНВН = 6.4 Гц),
д. д (1Н, фуран-СН2, НВ, JАВ = 14.0, JНВН = 6.0 Гц),
3.60 д (1Н, СН2Р, JРН = 22.0 Гц), 3.62 д (1Н, СН2Р,
3.66 д (2Н, СН2Р, JРН = 22.0 Гц), 3.99 д. д (1Н,
JРН = 22.0 Гц), 3.99 д. д (1Н, СН, JНAН = 8.4,
СН, JНАН = 9.8, JНВН = 6.0 Гц), 4.04-4.12 м (4Н,
JНВН = 6.4 Гц), 4.00-4.12 м (4Н, СН2ОР), 4.16 к
СН2ОР), 4.22-4.29 м (2Н, СН2О-цианоацетат), 4.31
(2Н, СН2О-ацетоацетат, JНН = 7.2 Гц), 4.27 к (2Н,
к (2Н, СН2О-фуроат, JНН = 7.2 Гц). Спектр ЯМР
СН2О-фуроат, JНН = 7.2 Гц). Спектр ЯМР 13С,
13С, δС, м. д.: 11.47 (СН3-фуран), 13.96 (СН3-циа-
δС, м. д.: 11.28 (СН3-фуран), 13.99 (СН3-ацето-
ноацетат), 14.18 (СН3-фуроат), 16.31 д (СН3-фос-
ацетат), 14.18 (СН3-фуроат), 16.28 д (СН3-фос-
фонат, 3JPC = 6.2 Гц), 25.41 (фуран-СН2), 26.97 д
фонат, 3JPC = 6.2 Гц), 23.09 (фуран-СН2), 26.93 д
(СН2Р, 1JPC = 139.1 Гц), 60.60 (СН2О-фуроат),
(СН2Р, 1JPC = 139.0 Гц), 29.74 (СН3-ацетил), 59.11
62.32 д (СН2ОР, 2JPC = 6.3 Гц), 62.38 д (СН2ОР,
(СН), 60.35 (СН2О-фуроат), 61.33 (СН2О-ацетоа-
2JPC = 6.2 Гц), 62.41 д (СН2ОР, 2JPC = 6.5 Гц),
цетат), 62.25 уш. д (СН2ОР, 2JPC = 6.5 Гц), 114.63
62.79 (СН2О-цианоацетат), 62.97 (СН2О-циано-
д (С4-фуран, 2JPC = 8.2 Гц), 115.73 д (С3-фуран,
ацетат), 63.70 (СН), 63.71 (СН), 113.97 д (С3-фуран,
3JPC = 2.5 Гц), 149.61 д (С2-фуран, 4JPC = 2.7 Гц),
3JPC = 2.6 Гц), 114.44 д (С4-фуран, 2JPC = 8.3 Гц),
151.16 д (С5-фуран, 3JPC = 13.5 Гц), 163.75 д
116.53 (CN), 150.71 д (С2-фуран, 4JPC = 2.6 Гц),
(С=О-фуроат, 4JPC = 2.7 Гц), 169.31 (С=О-ацето-
151.66 д (С5-фуран, 3JPC = 13.5 Гц), 163.61 д
ацетат), 202.94 (С=О-ацетил). Спектр ЯМР 31Р: δР
(С=О-фуроат, 4JPC = 2.7 Гц), 165.79 (С=О-цианоа-
21.78 м. д.
цетат). Спектр ЯМР 31Р: δР 21.44 м. д.
Диэтиловый эфир
[2-метил-4-(этоксикар-
3-[2-(Этоксикарбонил)-4-(диэтоксифос-
бонил)-5-(диэтоксифосфорилметил)фур-3-ил]-
форилметил)-5-метилфур-3-ил]метилпен-
метилмалоновой кислоты
(4в). Выход
70%,
тан-2,4-дион (5а). Выход 93%, коричневое сиро-
темно-желтое сиропообразное вещество. Спектр
пообразное вещество. Спектр ЯМР 1Н, δ, м. д.:
ЯМР 1Н, δ, м. д.: 1.24-1.30 м (12Н, СН3-фос-
1.23 т (6Н, СН3-фосфонат, JНН = 7.2 Гц), 1.33 т
фонат, СН3-малонат), 1.33 т (3Н, СН3-фуроат,
(3Н, СН3-фуроат, JНН = 7.2 Гц), 2.15 с (6Н, СН3-а-
JНН = 7.2 Гц), 2.19 д (3Н, СН3-фуран, JРН = 2.0 Гц),
цетил), 2.27 д (3Н, СН3-фуран, JРН = 3.6 Гц), 3.03
3.07 д (2Н, фуран-СН2, JНН = 7.6 Гц), 3.64 д (2Н,
д (2Н, СН2Р, JРН = 20.0 Гц), 3.11 д (2Н, фуран-СН2,
СН2Р, JРН = 22.0 Гц), 3.78 т (1Н, СН, JНН = 7.6 Гц),
J
= 6.8 Гц), 4.02 д. к (4Н, СН2ОР, JНН = 7.2,
НН
4.04-4.15 м (4Н, СН2ОР), 4.19 к (4Н, СН2О-ма-
J
= 14.8 Гц), 4.25 т (1Н, СН, JНН = 6.8 Гц), 4.33
РН
лонат, JНН = 7.2 Гц), 4.28 к (2Н, СН2О-фуроат,
к (2Н, СН2О-фуроат, JНН = 7.2 Гц). Спектр ЯМР
JНН = 7.2 Гц). Спектр ЯМР 13С, δС, м. д.: 11.29
13С, δС, м. д.: 12.47 д (СН3-фуран, 4JPC = 2.0 Гц),
(СН3-фуран), 13.99 (СН3-малонат), 14.02(СН3-ма-
14.39 (СН3-фуроат),
16.39 д (СН3-фосфонат,
лонат), 14.13 (СН3-фуроат), 16.28 д (СН3-фосфонат,
3JPC = 6.0 Гц), 21.38 д (СН2Р, 1JPC = 143.1 Гц), 22.39
3JPC = 6.2 Гц), 24.02 (фуран-СН2), 26.76 д (СН2Р,
(фуран-СН2), 29.96 (СН3-ацетил), 60.66 (СН2О-фу-
1JPC = 138.9 Гц), 51.89 (СН), 60.29 (СН2О-фуро-
роат), 61.97 д (СН2ОР, 2JPC = 6.7 Гц), 67.14 (СН),
ат), 61.54 (СН2О-малонат), 61.64 (СН2О-малонат),
113.77 д (С4-фуран, 2JPC = 9.7 Гц), 134.04 д (С3-фу-
62.27 д (СН2ОР, 2JPC = 6.5 Гц), 114.70 д (С4-фуран,
ран, 3JPC = 3.2 Гц), 138.44 уш. с (С2-фуран), 153.81
2JPC = 8.2 Гц), 115.31 д (С3-фуран, 3JPC = 2.5 Гц),
д (С5-фуран, 3JPC = 8.0 Гц), 158.92 (С=О-фуроат),
149.67 д (С2-фуран, 4JPC = 2.6 Гц), 151.36 д
204.03 (С=О-ацетил). Спектр ЯМР 31Р: δР 26.50 м. д.
(С5-фуран, 3JPC = 13.6 Гц), 163.74 д (С=О-фуро-
Этиловый эфир
2-[2-(этоксикарбонил)-4-
ат, 4JPC = 2.7 Гц), 168.56 (С=О-малонат), 169.11
(диэтоксифосфорилметил)-5-метилфур-3-ил]-
(С=О-малонат). Спектр ЯМР 31Р: δР 21.83 м. д.
метил-3-оксобутановой кислоты
(5б). Выход
Этиловый эфир
2-[2-метил-4-(этоксикар-
70%, желтое сиропообразное вещество. Спектр
бонил)-5-(диэтоксифосфорилметил)фур-3-ил]-
ЯМР 1Н, δ, м. д.: 1.18 т (3Н, СН3-ацетоаце-
метилцианоуксусной кислоты
(4г). Выход
тат, JНН = 7.2 Гц), 1.25 т (6Н, СН3-фосфонат,
74%, светло-коричневое сиропообразное веще-
JНН = 7.2 Гц), 1.35 т (3Н, СН3-фуроат, JНН = 7.2 Гц),
ство. Спектр ЯМР 1Н, δ, м. д.: 1.24-1.38 м (12Н,
2.24 с (3Н, СН3-ацетил), 2.30 д (3Н, СН3-фуран,
СН3-фосфонат, СН3-цианоацетат, СН3-фуроат),
JРН = 3.6 Гц), 2.97-3.11 м (2Н, фуран-СН2), 3.15 д
2.29 д (3Н, СН3-фуран, JРН = 2.0 Гц), 3.20 д. д (1Н,
(2Н, СН2Р, JРН = 20.0 Гц), 3.91-4.06 м (5Н, СН2ОР,
фуран-СН2, НА, JАВ = 14.0 Гц, JНАН = 9.8 Гц), 3.27
СН), 4.09 к (1Н, СН2О-ацетоацетат, JНН = 7.2 Гц),
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 11 2020
АЛКИЛИРОВАНИЕ СН-КИСЛОТ 3-ГАЛОГЕНМЕТИЛЬНЫМИ ПРОИЗВОДНЫМИ
1699
4.16 к (1Н, СН2О-ацетоацетат, JНН = 7.2 Гц),
НА, JАВ = 14.2, JНАН = 9.6 Гц), 3.39 д. д (1Н, фу-
4.31 к (1Н, СН2О-фуроат, JНН = 7.2 Гц), 4.33 к
ран-СН2, НВ, JАВ = 14.2, JНВН = 6.4 Гц), 4.00 д. к
(1Н, СН2О-фуроат, JНН = 7.2 Гц). Спектр ЯМР
(4Н, СН2ОР, JНН = 7.2, JРН = 14.8 Гц), 4.13 д. д (1Н,
13С, δС, м. д.: 12.51 д (СН3-фуран, 4JPC = 2.0 Гц),
СН, JНАН = 9.6, JНBН = 6.4 Гц), 4.21 к (2Н, СН2О-ци-
13.96 (СН3-ацетоацетат),
14.04 (СН3-ацетоаце-
аноацетат, JНН = 7.0 Гц), 4.32 к (2Н, СН2О-фуроат,
тат), 14.37 (СН3-фуроат), 16.40 д (СН3-фосфонат,
J
= 7.0 Гц). Спектр ЯМР 13С, δС, м. д.: 12.42 д
НН
3JPC = 6.1 Гц), 21.42 д (СН2Р, 1JPC = 143.1 Гц),
(СН3-фуран, 4JPC = 1.8 Гц), 13.91 (СН3-цианоаце-
22.48 (фуран-СН2),
29.67 (СН3-ацетил),
59.07
тат), 14.27 (СН3-фуроат), 16.39 д (СН3-фосфонат,
(СН),
60.66 (СН2О-фуроат),
61.31(СН2О-ацето-
3JPC = 6.0 Гц), 21.75 д (СН2Р, 1JPC = 143.8 Гц),
ацетат), 61.40 (СН2О-ацетоацетат), 61.98 д (СН2ОР,
24.37 (фуран-СН2), 60.98 (СН2О-фуроат),
61.98
2JPC = 6.6 Гц), 62.03 д (СН2ОР, 2JPC = 6.6 Гц), 113.84
(СН2О-цианоацетат), 62.07 (СН2О-цианоацетат),
д (С4-фуран, 2JPC = 9.8 Гц), 133.54 д (С3-фуран,
62.18 д (СН2ОР, 2JPC = 7.2 Гц), 62.25 д (СН2ОР,
3JPC = 3.2 Гц), 138.68 уш. с (С2-фуран), 153.82 д
2JPC = 6.7 Гц), 62.87 (СН), 113.31 д (С4-фуран,
(С5-фуран, 3JPC = 7.9 Гц), 158.31 (С=О-фуроат),
2JPC = 9.6 Гц), 116.37 (CN), 130.23 д (С3-фуран,
167.07 (С=О-ацетоацетат), 169.20 (С=О-ацетоаце-
3JPC = 2.7 Гц), 139.46 уш. с (С2-фуран), 154.19 д
тат), 200.58 (С=О-ацетил), 202.80 (С=О-ацетил).
(С5-фуран, 3JPC = 8.1 Гц), 158.76 (С=О-фуроат),
Спектр ЯМР 31Р: δР 26.41 м. д.
165.53 (С=О-цианоацетат). Спектр ЯМР 31Р: δР
25.61 м. д.
Диэтиловый эфир
[2-(этоксикарбонил)-4-
(диэтоксифосфорилметил)-5-метилфур-3-ил]-
3-[2-(Этоксикарбонил)-5-(диэтоксифосфо-
метилмалоновой кислоты (5в). Выход 80%, тем-
рилметил)фур-3-ил]метилпентан-2,4-дион
но-желтое сиропообразное вещество. Спектр ЯМР
(6а). Выход
89%, светло-желтое сиропообраз-
1Н, δ, м. д.: 1.18 т (6Н, СН3-малонат, JНН = 7.2 Гц),
ное вещество. Спектр ЯМР 1Н, δ, м. д.: 1.29-1.34
1.23 т (6Н, СН3-фосфонат, JНН = 7.2 Гц), 1.34 т (3Н,
м (6Н, СН3-фосфонат), 1.38 т (3Н, СН3-фуро-
СН3-фуроат, JНН = 7.2 Гц), 2.29 д (3Н, СН3-фу-
ат, JНН = 7.0 Гц), 2.20 с (6Н, СН3-ацетил), 3.26 д
ран, JРН = 3.6 Гц), 2.99 д (2Н, СН2Р, JРН = 20.0 Гц),
(2Н, фуран-СН2, JНН = 7.2 Гц), 3.29 д (1Н, СН2Р,
3.22 д (2Н, фуран-СН2, JНН = 7.6 Гц), 3.87 т (1Н,
J
= 22.0 Гц), 3.32 д (1Н, СН2Р, JРН = 20.8 Гц),
РН
СН, JНН = 7.6 Гц), 4.01 д.к (4Н, СН2ОР, JНН = 7.2,
4.02 т (СН, JНН = 7.2 Гц), 4.12 д. к (4Н, СН2ОР,
JРН = 14.4 Гц), 4.09-4.13 м (4Н, СН2О-мало-
J
= 7.2, JРН = 14.4 Гц), 4.36 к (2Н, СН2О-фуроат,
НН
нат), 4.32 к (2Н, СН2О-фуроат, JНН = 7.2 Гц).
J
= 7.0 Гц), 6.28 уш. с (1Н, Н4-фуран). Спектр ЯМР
НН
Спектр ЯМР 13С, δС, м. д.: 12.47 д (СН3-фуран,
13С, δС, м. д.: 14.36 (СН3-фуроат), 14.42 (СН3-фу-
4JPC = 2.0 Гц), 13.94 (СН3-малонат), 13.99 (СН3-ма-
роат),
16.34 д (СН3-фосфонат, 3JPC = 5.9 Гц),
лонат), 14.29 (СН3-фуроат), 16.39 д (СН3-фосфо-
22.69 (фуран-СН2),
23.12 (фуран-СН2),
25.55
нат, 3JPC = 6.0 Гц), 21.45 д (СН2Р, 1JPC = 143.1 Гц),
д (СН2Р, 1JPC = 141.3 Гц), 29.70 (СН3-ацетил),
23.37 (фуран-СН2), 51.66 (СН), 60.71 (СН2О-фуро-
60.72 (СН2О-фуроат),
60.80 (СН2О-фуроат),
ат), 61.41 (СН2О-малонат), 61.52 (СН2О-малонат),
62.60 д (СН2ОР, 2JPC = 6.5 Гц), 67.95 (СН), 111.44
62.00 д (СН2ОР, 2JPC = 6.6 Гц), 113.70 д (С4-фуран,
д (С4-фуран, 3JPC = 6.4 Гц), 113.29 д (С4-фуран,
2JPC = 10.0 Гц), 132.50 д (С3-фуран, 3JPC = 3.2 Гц),
3JPC = 6.4 Гц), 133.35 д (С3-фуран, 4JPC = 3.3 Гц),
139.02 уш. с (С2-фуран),
153.82 д (С5-фуран,
135.61 д (С3-фуран, 4JPC = 3.1 Гц), 138.88 д
3JPC
=
8.0 Гц),
158.84 (С=О-фуроат),
168.51
(С2-фуран, 4JPC = 2.9 Гц),
139.70 д (С2-фуран,
(С=О-малонат),
169.97 (С=О-малонат). Спектр
4JPC = 2.9 Гц), 148.81 д (С5-фуран, 2JPC = 8.7 Гц),
ЯМР 31Р: δР 26.28 м. д.
149.42 д (С5-фуран, 2JPC = 8.7 Гц), 158.87 (С=О-фу-
роат), 191.66 (С=О-ацетил), 203.31 (С=О-ацетил).
Этиловый эфир [2-(этоксикарбонил)-4-(ди-
Спектр ЯМР 31Р: δР 21.46 м. д.
этоксифосфорилметил)-5-метилфур-3-ил]-
метилцианоуксусной кислоты
(5г). Выход
Этиловый эфир 2-[2-(этоксикарбонил)-5-(ди-
91%, светло-коричневое сиропообразное веще-
этоксифосфорилметил)фур-3-ил]метил-3-ок-
ство. Спектр ЯМР 1Н, δ, м. д.: 1.21-1.36 д (12Н,
собутановой кислоты (6б). Выход 52%, желтое
СН3-фосфонат, СН3-цианоацетат, СН3-фуроат),
сиропообразное вещество. Спектр ЯМР 1Н, δ,
2.31 д (3Н, СН3-фуран, JРН = 3.2 Гц), 2.92 д (2Н,
м. д.: 1.26-1.31 м (9Н, СН3-фосфонат, СН3-аце-
СН2Р, JРН = 20.0 Гц), 3.30 д. д (1Н, фуран-СН2,
тоацетат), 1.37 т (3Н, СН3-фуроат, JНН = 7.2 Гц),
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 11 2020
1700
ПЕВЗНЕР и др.
2.27 с (3Н, СН3-ацетил), 3.20 д. д (1Н, фуран-СН2,
Н4-фуран, JРН = 2.4 Гц). Спектр ЯМР 13С, δС, м. д.:
НА, JАВ = 14.4, JНАН = 6.8 Гц), 3.23 д (2Н, СН2Р,
14.06 (СН3-цианоацетат), 14.18 (СН3-цианоацетат),
JРН = 21.2 Гц), 3.30 д. д (1Н, фуран-СН2, НВ,
14.29 (СН3-фуроат), 14.43 (СН3-фуроат), 16.35 д
JАВ = 14.4, JНВН = 6.8 Гц), 3.83 д. д (1Н, СН,
(СН3-фосфонат, 3JPC = 5.9 Гц), 22.71 (фуран-СН2),
JНАН = JНВН = 6.8 Гц), 4.09-4.15 м (4Н, СН2ОР),
25.52 д (СН2Р, 1JPC = 139.4 Гц), 60.63 (СН2О-фу-
4.20 к (2Н, СН2О-ацетоацетат, JНН = 7.2 Гц), 4.34
роат), 60.38 (СН2О-фуроат), 61.04 (СН2О-цианоа-
(2Н, СН2О-фуроат, JНН = 7.2 Гц), 6.28 д (1Н,
цетат), 61.46 (СН2О-цианоацетат), 62.68 д (СН2ОР,
Н4-фуран, JРН = 3.2 Гц). Спектр ЯМР 13С, δС, м. д.:
2JPC = 6.5 Гц), 63.02 (СН), 112.97 д (С4-фуран,
14.08 (СН3-ацетоацетат),
14.34 (СН3-фуроат),
3JPC = 5.9 Гц), 113.04 (CN), 130.26 д (С3-фуран,
16.33 д (СН3-фосфонат, 3JPC = 6.0 Гц), 24.24 (фу-
4JPC = 2.8 Гц), 140.45 д (С2-фуран, 4JPC = 3.1 Гц),
ран-СН2), 26.94 д (СН2Р, 1JPC = 141.5 Гц), 29.35
149.91 д (С5-фуран, 2JPC = 8.2 Гц), 158.96 (С=О-фу-
(СН3-ацетил),
29.68 (СН3-ацетил),
59.51 (СН),
роат), 165.27 (С=О-цианоацетат). Спектр ЯМР 31Р:
60.77 (СН2О-фуроат), 61.52 (СН2О-ацетоацетат),
δР 21.24 м. д.
62.57 д (СН2ОР, 2JPC = 6.5 Гц), 113.45 д (С4-фуран,
Общая методика синтеза пиразолов
1д,
3JPC = 6.4 Гц), 133.21 д (С3-фуран, 4JPC = 3.5 Гц),
3д-6д и пиразолонов 1е-6е. К раствору 5 ммоль
139.87 д (С2-фуран, 4JPC = 3.1 Гц), 148.92 д (С5-фу-
1,3-дикарбонильного соединения 1а-6а или 1б-6б
ран, 2JPC = 8.7 Гц), 158.88 (С=О-фуроат), 168.83
в 15 мл этанола прибавляли 5.5 ммоль гидразин-
(С=О-ацетоацетат), 202.12 (С=О-ацетил). Спектр
гидрата. Полученную смесь перемешивали 15 мин
ЯМР 31Р: δР 21.52 м. д.
и оставляли на 12 ч при комнатной температуре.
Диэтиловый эфир [2-(этоксикарбонил)-5-(ди-
После этого отгоняли этанол, остаток растворяли в
этоксифосфорилметил)фур-3-ил]метилмалоно-
30 мл хлористого метилена, промывали 10 мл рас-
вой кислоты (6в). Выход 75%, темно-желтое си-
твора NaCl и сушили сульфатом натрия. Высушен-
ропообразное вещество. Спектр ЯМР 1Н, δ, м. д.:
ный раствор фильтровали через тонкий слой сили-
1.19-1.29 м (12Н, СН3-фосфонат, СН3-малонат),
кагеля, упаривали досуха, остаток выдерживали в
1.33 т (3Н, СН3-фуроат, JНН = 7.2 Гц), 3.13-3.26 м
вакууме (1 мм рт. ст.) при комнатной температуре.
(2Н, фуран-СН2), 3.20 д (2Н, СН2Р, JРН = 21.2 Гц),
Этиловый эфир4-(3,5-диметилпиразол-4-ил)-
3.99 д. д (1Н, СН, JНАН = 7.2, JНВН = 9.2 Гц), 4.07
метил-5-(диэтоксифосфорилметил)фуран-
д. к (4Н, СН2ОР, JНН = 7.2, JРН = 15.2 Гц), 4.17 к
3-карбоновой кислоты (1д). Выход 93%, светло-
(4Н, СН2О-малонат, JНН = 7.2 Гц), 4.34 к (2Н,
желтое стекловидное вещество. Спектр ЯМР 1Н,
СН2О-фуроат, JНН = 7.2 Гц), 6.28 д (1Н, Н4-фу-
δ, м. д.: 1.23-1.35 м (9Н, СН3-фосфонат, СН3-фу-
ран, JРН = 2.8 Гц). Спектр ЯМР 13С, δС, м. д.:
роат), 2.11 с (6Н, СН3-пиразол), 2.92 д (2Н, СН2Р,
13.99 (СН3-малонат), 14.24 (СН3-фуроат), 16.28 д
J
= 20.8 Гц), 3.84 с (2Н, фуран-СН2), 4.01-
(СН3-фосфонат, 3JPC = 5.9 Гц), 25.10 (фуран-СН2),
РН
4.09 м (4Н, СН2ОР), 4.25 к (2Н, СН2О-фуроат,
26.89 д (СН2Р, 1JPC = 141.7 Гц), 50.42 (СН), 60.71
J
= 7.2 Гц), 7.93 д (1Н, Н2-фуран, JРН = 1.6 Гц),
(СН2О-фуроат),
61.46 (СН2О-малонат),
61.73
НН
8.51 уш. с (1Н, NH). Спектр ЯМР 13С, δС, м. д.:
(СН2О-малонат), 62.52 д (СН2ОР, 2JPC = 6.5 Гц),
10.97 (СН3-пиразол), 14.27 (СН3-фуроат), 16.38 д
113.23 д (С4-фуран, 3JPC = 6.5 Гц), 132.52 д (С3-фу-
(СН3-фосфонат, 3JPC = 5.8 Гц), 17.25 (фуран-СН2),
ран, 4JPC = 3.5 Гц), 140.04 д (С2-фуран, 4JPC = 3.1 Гц),
25.07 д (СН2Р, 1JPC = 142.8 Гц), 60.16 (СН2О-фу-
149.24 д (С5-фуран, 2JPC = 8.1 Гц), 158.76 (С=О-фу-
роат), 168.57 (С=О-малонат). Спектр ЯМР 31Р: δР
роат), 62.29 д (СН2ОР, 2JPC = 6.6 Гц), 112.40 уш.
21.50 м. д.
с (С4-пиразол), 119.41 д (С3-фуран, 4JPC = 3.1 Гц),
120.10 д (С4-фуран, 3JPC = 9.1 Гц), 142.41 уш. с
Этиловый эфир [2-(этоксикарбонил)-5-(ди-
(С3,5-пиразол), 144.41 д (С5-фуран, 2JPC = 13.1 Гц),
этоксифосфорилметил)фур-3-ил]метилциано-
147.34 д (С2-фуран, 4JPC = 2.8 Гц), 163.41 (С=О-фу-
уксусной кислоты (6г). Выход 49%, светло-желтое
роат). Спектр ЯМР 31Р: δР 23.04 м. д.
сиропообразное вещество. Спектр ЯМР 1Н, δ, м. д.:
1.28-1.36 м (12Н, СН3-фосфонат, СН3-цианоацетат,
Этиловый эфир 4-(3-метил-5-гидроксипира-
СН3-фуроат), 3.27-3.30 м (2Н, фуран-СН2), 3.29 д
зол-4-ил)метил-5-(диэтоксифосфорилметил)-
(2Н, СН2Р, JРН = 21.2 Гц), 4.10-4.18 м (5Н, СН2ОР,
фуран-3-карбоновой кислоты (1е). Выход 89%,
СН), 4.23 к (2Н, СН2О-цианоацетат, JНН = 7.2 Гц),
желтое стекловидное вещество. Спектр ЯМР 1Н,
4.38 к (2Н, СН2О-фуроат, JНН = 7.2 Гц), 6.29 д (1Н,
δ, м. д.: 1.23-1.35 м (9Н, СН3-фосфонат, СН3-фу-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 11 2020
АЛКИЛИРОВАНИЕ СН-КИСЛОТ 3-ГАЛОГЕНМЕТИЛЬНЫМИ ПРОИЗВОДНЫМИ
1701
роат), 2.11 с (3Н, СН3-пиразол), 3.37 д (2Н, СН2Р,
ран), 14.38 (СН3-фуроат), 16.34 д (СН3-фосфонат,
JРН = 20.4 Гц), 3.76 с (2Н, фуран-СН2), 4.03-4.10
3JPC = 6.3 Гц), 16.37 д (СН3-фосфонат, 3JPC = 6.1 Гц),
м (4Н, СН2ОР), 4.24-4.31 м (2Н, СН2О-фуро-
17.74 (фуран-СН2), 22.90 д (СН2Р, 1JPC = 138.9 Гц),
ат), 7.91 д (1Н, Н2-фуран, JРН = 2.0 Гц), 8.68 уш.
22.93 д (СН2Р, 1JPC = 138.6 Гц), 22.97 д (СН2Р,
с (2Н, NH, ОН). Спектр ЯМР 13С, δС, м. д.: 10.72
1JPC
= 139.4 Гц), 60.58 (СН2О-фуроат),
60.72
(СН3-пиразол),
14.29 (СН3-фуроат),
16.31 д
(СН2О-фуроат), 62.12 д (СН2ОР, 2JPC = 6.6 Гц),
(СН3-фосфонат, 3JPC = 5.8 Гц), 16.37 д (СН3-фос-
62.22 д (СН2ОР, 2JPC = 6.7 Гц), 111.93 уш. с (С4-пи-
фонат, 3JPC = 5.8 Гц), 19.91 (фуран-СН2), 24.96 д
разол), 118.42 д (С4-фуран, 3JPC = 3.0 Гц), 119.93
(СН2Р, 1JPC = 142.8 Гц), 60.19 (СН2О-фуроат),
д (С4-фуран, 3JPC = 3.3 Гц), 120.75 д (С4-фуран,
62.37 д (СН2ОР, 2JPC = 6.6 Гц), 62.52 д (СН2ОР,
3JPC = 3.3 Гц) 126.08 д (С3-фуран, 2JPC = 10.3 Гц),
2JPC = 6.4 Гц), 107.69 уш. с (С4-пиразол), 118.91
126.18 д (С3-фуран, 2JPC = 9.8 Гц), 126.22 д
д (С3-фуран, 4JPC = 3.2 Гц), 120.66 д (С4-фуран,
(С3-фуран, 2JPC = 10.6 Гц), 138.98 д (С2-фуран,
3JPC = 9.1 Гц), 147.09 уш. с (С3-пиразол), 144.83
3JPC = 8.6 Гц), 139.18 д (С2-фуран, 3JPC = 8.7 Гц),
д (С5- фуран, 2JPC = 14.1 Гц), 147.28 д (С2-фуран,
139.24 д (С2-фуран, 3JPC = 8.7 Гц), 142.42 уш. с
4JPC = 3.0 Гц), 161.31 уш. с (С5-пиразол), 163.70
(С3-пиразол), 152.21 д (С5-фуран, 4JPC = 2.7 Гц),
(С=О-фуроат). Спектр ЯМР 31Р: δР 24.04 м. д.
154.27 д (С5-фуран, 4JPC = 2.2 Гц), 155.60 д
(С5-фуран, 4JPC = 2.4 Гц), 159.05 д (С=О-фуроат,
Этиловый эфир 4-(3-метил-5-гидроксипира-
4JPC = 3.0 Гц), 159.17 д (С=О-фуроат, 4JPC = 3.0 Гц).
зол-4-ил)метил-5-(диэтоксифосфорилметил)-
Спектр ЯМР 31Р, δР, м.д.: 24.96, 25.32 (1:1).
фуран-2-карбоновой кислоты (2е). Выход 81%,
желтое стекловидное вещество. Спектр ЯМР 1Н,
Этиловый эфир
3-(диэтоксифосфорилме-
δ, м. д.: 1.20-1.28 м (9Н, СН3-фосфонат, СН3-фу-
тил)-4-(3-метил-5-гидроксипиразол-4-ил)ме-
роат), 2.03 уш. с (3Н, СН3-пиразол), 3.01 уш. д
тил-5-метилфуран-2-карбоновой кислоты (3е).
(2Н, СН2Р, JРН = 20.4 Гц), 3.62 уш. с (2Н, фу-
Выход 81%, желтые кристаллы, т. пл. 188°С.
ран-СН2), 4.00-4.03 м (4Н, СН2ОР), 4.22-4.26 м
Спектр ЯМР 1Н, δ, м. д.: 1.20-1.24 м (6Н, СН3-фос-
(2Н, СН2О-фуроат), 7.14 с (1Н, Н3-фуран), 8.68
фонат), 1.34 т (3Н, СН3-фуроат, JНН = 7.2 Гц), 2.00
уш. с (2Н, NH, ОН). Спектр ЯМР 13С, δС, м. д.:
с (3Н, СН3-пиразол), 2.27 с (3Н, СН3-фуран), 3.47 д
10.35 (СН3-пиразол), 14.25 (СН3-фуроат), 16.20 д
(2Н, СН2Р, JРН = 22.8 Гц), 3.50 с (2Н, фуран-СН2),
(СН3-фосфонат, 3JPC = 5.9 Гц), 16.25 д (СН3-фос-
4.04 д. к (4Н, СН2ОР, JНН = 7.2, JРН = 14.0 Гц),
фонат, 3JPC = 5.0 Гц), 16.96 (фуран-СН2), 25.31 д
4.31 к (2Н, СН2О-фуроат, JНН = 7.2 Гц), 10.04 уш.
(СН2Р, 1JPC = 141.1 Гц), 60.64 (СН2О-фуроат),
с (2Н, NH, ОН). Спектр ЯМР 13С, δС, м. д.: 10.70
62.59 д (СН2ОР, 2JPC = 6.5 Гц), 62.75 д (СН2ОР,
(СН3-пиразол), 12.34 (СН3-фуран), 14.37 (СН3-фу-
2JPC = 6.5 Гц), 99.72 уш. с (С4-пиразол), 120.39
роат), 16.27 д (СН3-фосфонат, 3JPC = 6.1 Гц), 22.67
д (С3-фуран, 4JPC = 3.2 Гц), 124.32 д (С3-фуран,
(фуран-СН2), 22.69 д (СН2Р, 1JPC = 138.2 Гц), 60.47
3JPC = 8.6 Гц), 139.88 уш. с (С3-пиразол), 142.91
(СН2О-фуроат), 62.57 д (СН2ОР, 2JPC = 6.6 Гц),
д (С2- фуран, 2JPC = 3.5 Гц), 145.59 д (С5-фуран,
99.45 уш. с (С4-пиразол),
121.32 (С4-фуран,
2JPC = 12.6 Гц), 161.33 уш. с (С5-пиразол), 158.54
3JPC = 2.7 Гц), 125.99 д (С3-фуран, 2JPC = 10.5 Гц),
(С=О-фуроат). Спектр ЯМР 31Р: δР 22.57 м. д.
138.73 д (С2-фуран, 3JPC = 8.8 Гц), 140.43 уш. с
(С3-пиразол), 152.27 д (С5-фуран, 4JPC = 1.7 Гц),
Этиловый эфир
3-(диэтоксифосфорилме-
159.22 д (С=О-фуроат, 4JPC = 3.0 Гц), 161.47 уш. с
тил)-4-(3,5-диметилпиразол-4-ил)метил-5-ме-
(С5-пиразол). Спектр ЯМР 31Р: δР 26.20 м. д.
тилфуран-2-карбоновой кислоты (3д). Выход
77%, светло-коричневое стекловидное вещество.
Этиловый эфир
2-(диэтоксифосфорилме-
Спектр ЯМР 1Н, δ, м. д.: 1.26 уш. т (6Н, СН3-фос-
тил)-4-(3,5-диметилпиразол-4-ил)метил-5-ме-
фонат, JНН = 7.0 Гц), 1.38 уш. т (3Н, СН3-фуроат,
тилфуран-3-карбоновой кислоты (4д). Выход
JНН = 7.2 Гц), 2.11 с (3Н, СН3-пиразол), 2.35 с (1.5Н,
85%, желтое стекловидное вещество. Спектр
СН3-фуран), 2.39 с (1.5Н, СН3-фуран), 3.25 д (2Н,
ЯМР 1Н, δ, м. д.: 1.22-1.29 м (9Н, СН3-фосфо-
СН2Р, JРН = 22.8 Гц), 3.63 уш. с (2Н, фуран-СН2),
нат, СН3-фуроат), 2.07 уш. с (9Н, СН3-пиразол,
4.01-4.11 м
(4Н, СН2ОР),
4.32-4.38 м
(2Н,
СН3-фуран), 3.64 д (2Н, СН2Р, JРН = 22.8 Гц),
СН2О-фуроат), 7.16 уш. с (1Н, NH). Спектр ЯМР
3.67 с (2Н, фуран-СН2), 4.07 д. к (4Н, СН2ОР,
13С, δС, м. д.: 10.98 (СН3-пиразол), 12.29 (СН3-фу-
JНН = 7.2, JРН = 14.4 Гц), 4.22 к (2Н, СН2О-фуроат,
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 11 2020
1702
ПЕВЗНЕР и др.
JНН = 7.2 Гц), 9.12 уш. с (1Н, NH). Спектр ЯМР
(СН2Р, 1JPC = 143.9 Гц), 60.53 (СН2О-фуроат), 62.08
13С, δС, м. д.: 9.12 (СН3-пиразол), 11.54 (СН3-фу-
уш. д (СН2ОР, 2JPC = 6.8 Гц), 111.44 уш. с (С4-пи-
ран), 14.18 (СН3-фуроат), 16.29 д (СН3-фосфонат,
разол), 113.04 д (С4-фуран, 2JPC = 9.7 Гц), 133.72 д
3JPC = 6.2 Гц), 18.50 (фуран-СН2), 26.78 д (СН2Р,
(С3-фуран, 3JPC = 2.8 Гц), 138.60 уш. с (С2-фуран),
1JPC
= 138.9 Гц), 60.06 (СН2О-фуроат), 62.32 д
142.56 уш. с (С3-пиразол), 154.10 д (С5-фуран,
(СН2ОР, 2JPC = 6.7 Гц), 106.59 уш. с (С4-пира-
2JPC = 8.1 Гц), 159.63 (С=О-фуроат). Спектр ЯМР
зол), 115.63 д (С3-фуран, 3JPC = 8.4 Гц), 117.63 д
31Р: δР 26.57 м. д.
(С4-фуран, 4JPC = 2.6 Гц), 142.09 уш. с (С3,5-пира-
Этиловый эфир 3-(3-метил-5-гидроксипира-
зол), 148.36 д (С5-фуран, 3JPC = 2.9 Гц), 150.14 д
зол-4-ил)метил-4-(диэтоксифосфорилметил)-
(С2-фуран, 2JPC = 13.8 Гц), 164.03 д (С=О-фуроат,
5-метилфуран-2-карбоновой кислоты (5е). Вы-
4JPC = 2.5 Гц). Спектр ЯМР 31Р: δР 22.17 м. д.
ход 83%, желтое стекловидное вещество. Спектр
Этиловый эфир
2-(диэтоксифосфорилме-
ЯМР 1Н, δ, м. д.:1.23 т (6Н, СН3-фосфонат,
тил)-4-(3-метил-5-гидроксипиразол-4-ил)ме-
J
= 7.2 Гц), 1.35 т (3Н, СН3-фуроат, JНН = 7.2 Гц),
НН
тил-5-метилфуран-3-карбоновой кислоты (4е).
2.00 с (3Н, СН3-пиразол), 2.31 д (3Н, СН3-фуран,
Выход 87%, темно-желтое стекловидное вещество.
JНН = 3.6 Гц), 3.16 д (2Н, СН2Р, JРН = 20.0 Гц),
Спектр ЯМР 1Н, δ, м. д.: 1.21-1.27 м (6Н, СН3-фос-
3.94 с (2Н, фуран-СН2), 3.99-4.09 м (4Н, СН2ОР),
фонат), 1.30 т (3Н, СН3-фуроат, JНН = 7.2 Гц), 1.96
4.32-4.38 м (2Н, СН2О-фуроат), 7.42 уш. с (2Н,
с (3Н, СН3-пиразол), 2.08 с (3Н, СН3-фуран), 3.56 с
NH, ОН). Спектр ЯМР 13С, δС, м. д.: 10.59 уш. с
(2Н, фуран-СН2), 3.60 д (2Н, СН2Р, JРН = 22.8 Гц),
(СН3-пиразол), 12.33 д (СН3-фуран, 4JPC = 1.8 Гц),
4.03 д. к (4Н, СН2ОР, JНН = 7.2, JРН = 14.4 Гц),
14.35 (СН3-фуроат), 14.45 (СН3-фуроат), 16.28 д
4.21 к (2Н, СН2О-фуроат, JНН = 7.2 Гц), 9.08 уш.
(СН3-фосфонат, 3JPC = 6.4 Гц), 16.39 д (СН3-фос-
с (2Н, NH, ОН). Спектр ЯМР 13С, δС, м. д.: 10.43
фонат, 3JPC = 5.7 Гц), 20.91 (фуран-СН2), 22.68 д
(СН3-пиразол), 11.53 (СН3-фуран), 14.11 (СН3-фу-
(СН2Р, 1JPC = 138.1 Гц), 60.53 (СН2О-фуроат), 60.63
роат), 16.24 д (СН3-фосфонат, 3JPC = 6.2 Гц), 16.69
(СН2О-фуроат), 62.13 д (СН2ОР, 2JPC = 6.8 Гц),
(фуран-СН2), 26.23 д (СН2Р, 1JPC = 139.3 Гц), 26.75
62.21 д (СН2ОР, 2JPC = 6.8 Гц), 105.35 уш. с (С4-пи-
д (СН2Р, 1JPC = 139.3 Гц), 60.22 (СН2О-фуроат),
разол), 113.15 д (С4-фуран, 2JPC = 10.3 Гц), 134.82 д
62.34 д (СН2ОР, 2JPC = 6.4 Гц), 100.45 уш. с (С4-пи-
(С3-фуран, 3JPC = 2.1 Гц), 137.95 уш. с (С2-фуран),
разол), 115.55 д (С3-фуран, 3JPC = 8.2 Гц), 116.01
141.47 уш. с (С3-пиразол), 153.93 д (С5-фуран,
д (С3-фуран, 3JPC = 8.4 Гц), 117.78 д (С4-фуран,
2JPC = 8.1 Гц), 159.71 (С=О-фуроат), 161.83 (С5-пи-
4JPC = 2.6 Гц), 139.11 уш. с (С3-пиразол), 149.73
разол). Спектр ЯМР 31Р: δР 25.61 м. д.
д (С2-фуран, 2JPC = 13.8 Гц),151.58 д (С2-фуран,
4JPC = 2.7 Гц), 161.37 уш. с (С5-пиразол), 164.48 д
Этиловый эфир3-(3,5-диметилпиразол-4-ил)-
(С=О-фуроат, 4JPC = 2.2 Гц). Спектр ЯМР 31Р: δР
метил-5-(диэтоксифосфорилметил)метилфу-
22.29 м. д.
ран-2-карбоновой кислоты (6д). Выход 87%,
светло-коричневое стекловидное вещество. Спектр
Этиловый эфир3-(3,5-диметилпиразол-4-ил)-
ЯМР 1Н, δ, м. д.: 1.26-1.42 м (9Н, СН3-фосфонат,
метил-4-(диэтоксифосфорилметил)-5-метил-
СН3-фуроат), 2.18 уш. с (6Н, СН3-пиразол), 3.21 д
фуран-2-карбоновой кислоты (5д). Выход 83%,
(2Н, СН2Р, JРН = 21.6 Гц), 3.89 с (2Н, фуран-СН2),
желтое стекловидное вещество. Спектр ЯМР 1Н,
4.09 д. к (4Н, СН2ОР, JНН = 7.2, JРН = 14.4 Гц), 4.40 к
δ, м. д.: 1.23 т (3Н, СН3-фосфонат, JНН = 7.0 Гц),
(2Н, СН2О-фуроат, JНН = 7.2 Гц), 6.02 д (1Н, Н4-фу-
1.25 т (3Н, СН3-фосфонат, JНН = 7.0 Гц), 1.35 т (3Н,
СН3-фуроат, JНН = 7.0 Гц), 2.11 с (6Н, СН3-пира-
ран, JРН = 2.4 Гц), 7.68 уш. с (1Н, NH). Спектр ЯМР
зол), 2.28 д (3Н, СН3-фуран, JНН = 3.2 Гц), 3.16 д
13С, δС, м. д.: 10.87 (СН3-пиразол), 14.44 (СН3-фу-
(2Н, СН2Р, JРН = 20.0 Гц), 3.86 с (2Н, фуран-СН2),
роат),
16.28 д (СН3-фосфонат, 3JPC = 5.9 Гц),
3.99-4.05 м (4Н, СН2ОР), 4.36 к (2Н, СН2О-фуроат,
19.52 (фуран-СН2), 22.69 (фуран-СН2), 26.99 д
JНН = 7.0 Гц), 7.42 уш. с (1Н, NH). Спектр ЯМР 13С,
(СН2Р, 1JPC = 141.6 Гц), 60.60 (СН2О-фуроат),
δС, м. д.: 10.86 (СН3-пиразол), 12.32 д (СН3-фу-
62.58 д (СН2ОР, 2JPC = 6.4 Гц), 112.58 д (С4-фуран,
ран, 4JPC = 1.8 Гц), 14.44 (СН3-фуроат), 16.34 д
3JPC = 6.7 Гц), 112.84 уш. с (С4-пиразол), 136.11
(СН3-фосфонат, 3JPC = 5.7 Гц), 16.45 д (СН3-фос-
д (С3-фуран, 4JPC = 2.9 Гц), 138.77 д (С2-фуран,
фонат, 3JPC = 5.2 Гц), 18.24 (фуран-СН2), 21.62 д
4JPC = 3.1 Гц), 142.49 уш. с (С3-пиразол), 149.19
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 11 2020
АЛКИЛИРОВАНИЕ СН-КИСЛОТ 3-ГАЛОГЕНМЕТИЛЬНЫМИ ПРОИЗВОДНЫМИ
1703
д (С5-фуран, 2JPC = 8.7 Гц), 159.40 (С=О-фуроат).
ний (грант № 19-08-01232) в рамках государствен-
Спектр ЯМР 31Р: δР 21.72 м. д.
ного задания Министерства науки и высшего обра-
Этиловый эфир 3-(3-метил-5-гидроксипира-
зования Российской Федерации (№ 785.00.X6019)
зол-4-ил)метил-5-(диэтоксифосфорилметил)-
с использованием оборудования Инжинирингово-
фуран-2-карбоновой кислоты (6е). Выход 87%,
го центра Санкт-Петербургского государственного
желтое стекловидное вещество. Спектр ЯМР 1Н, δ,
технологического института (технического уни-
м. д.: 1.26-1.30 м (6Н, СН3-фосфонат), 1.38 т (3Н,
верситета).
СН3-фуроат, JНН = 7.2 Гц), 2.17 с (3Н, СН3-пира-
зол), 3.21 д (2Н, СН2Р, JРН = 20.8 Гц), 3.79 уш. с
КОНФЛИКТ ИНТЕРЕСОВ
(2Н, фуран-СН2), 4.06-4.14 м (4Н, СН2ОР), 4.36 к
Авторы заявляют об отсутствии конфликта
(2Н, СН2О-фуроат, JНН = 7.2 Гц), 6.35 уш. с (1Н,
интересов.
Н4-фуран), 9.46 уш. с (2Н, NH, ОН). Спектр ЯМР
13С, δС, м. д.: 10.21(СН3-пиразол), 14.12 (СН3-фу-
СПИСОК ЛИТЕРАТУРЫ
роат),
14.42 (СН3-фуроат),
16.24 д (СН3-фос-
1. Певзнер Л.М., Поняев А.И. // ЖОХ. 2020. Т. 90. № 8.
фонат, 3JPC = 6.3 Гц), 22.69 (фуран-СН2), 26.69 д
С. 1247; Pevzner L. M., Ponyaev A.I. // Russ. J. Gen.
(СН2Р, 1JPC = 141.0 Гц), 60.60 (СН2О-фуроат),
Chem. 2020. Vol. 90. N 8. P. 1453. doi 10.1134/
62.63 д (СН2ОР, 2JPC = 6.3 Гц), 62.79 д (СН2ОР,
S1070363220080125
2JPC = 6.5 Гц), 108.96 уш. с (С4-пиразол), 113.60
2. Певзнер Л.М. // ЖОХ 2017. Т. 87. № 11. С. 1822;
д (С4-фуран, 3JPC = 6.8 Гц), 136.64 д (С3-фуран,
Pevzner L.M. // Russ. J. Gen. Chem. 2017. Vol. 87. N 11.
4JPC = 3.6 Гц), 138.47 д (С2-фуран, 4JPC = 3.0 Гц),
P. 2563. doi 10.1134/S1070363217110093
145.74 уш. с (С3-пиразол), 148.69 д (С5-фуран,
3. Певзнер Л.М., Завгородний В.С. // ЖОХ 2018. Т. 88.
2JPC = 8.6 Гц), 159.53 (С=О-фуроат), 161.80 уш. с
№ 3. С. 411; Pevzner L.M., Zavgorodnii V.S. // Russ.
(С5-пиразол). Спектр ЯМР 31Р: δР 22.13 м. д.
J. Gen. Chem. 2018. Vol. 88. N 3. P. 439. doi 10.1134/
ФОНДОВАЯ ПОДДЕРЖКА
S1070363218030106
Работа выполнена при финансовой поддержке
4. Еляков А.В., Стоник В.А. Терпеноиды морских ор-
Российского фонда фундаментальных исследова-
ганизмов. 1986. М: Наука, 272 с.
Alkylation of CH-Acids with 3-Halomethyl Derivatives
of (Dietoxyphosphorylmethyl)furancarboxylic Acids Esters
L. M. Pevzner*, V. S. Zavgorodnii, and A. I. Ponyaev
St. Petersburg State Institute of Technology (Technical University), St. Petersburg, 190013 Russia
*e-mail: pevzner_lm@list.ru
Received June 11, 2020; revised June 11, 2020; accepted June 21, 2020
Alkylation at the carbon of the active methylene group of 3-halomethyl derivatives of phosphonocarboxylic
acid esters of the furan series with acetylacetone, acetoacetic, malonic and cyanoacetic esters in an absolute
ethanol-dioxane medium (1:10) in the presence of sodium ethylate leads to the formation of the corresponding
monoalkyl derivatives. The obtained phosphonomethylated derivatives of 3-(furylmethyl)acetylacetone and
2-(furylmethyl)acetoacetic ester react with hydrazine hydrate to form phosphorus-containing derivatives of
(furyl)(pyrazolyl)methanes and (furyl)(pyrazolonyl)methanes, respectively. The latter in chloroform exist
exclusively in enol form.
Keywords: СН-acids alkylation, 3-halomethylfurans, pyrazoles, pyrazolones, keto-enol tautomerism
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 11 2020