ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2020, том 90, № 11, с. 1704-1717
УДК 547.26’118
ПАРАЛЛЕЛЬНОЕ ОБРАЗОВАНИЕ
ПЕНТААЛКОКСИФОСФОРАНОВ КАРКАСНОГО И
СПИРАНОВОГО ТИПА В РЕАКЦИИ 5,5-ДИМЕТИЛ-
2-(2-ОКСО-1,2-ДИФЕНИЛЭТИЛОКСИ)-1,3,2-
ДИОКСАФОСФОРИНАНА С ГЕКСАФТОРАЦЕТОНОМ
© 2020 г. В. Ф. Мироновa,b,*, М. Н. Димухаметовa, Я. С. Блиноваb, Ф. Х. Каратаеваb
a Институт органической и физической химии имени А. Е. Арбузова, Федеральный исследовательский центр
«Казанский научный центр Российской академии наук», ул. Академика Арбузова 8, Казань, 420088 Россия
b Казанский (Приволжский) федеральный университет, Казань, 420008 Россия
*e-mail: mironov@iopc.ru
Поступило в Редакцию 29 июня 2020 г.
После доработки 29 июня 2020 г.
Принято к печати 9 июля 2020 г.
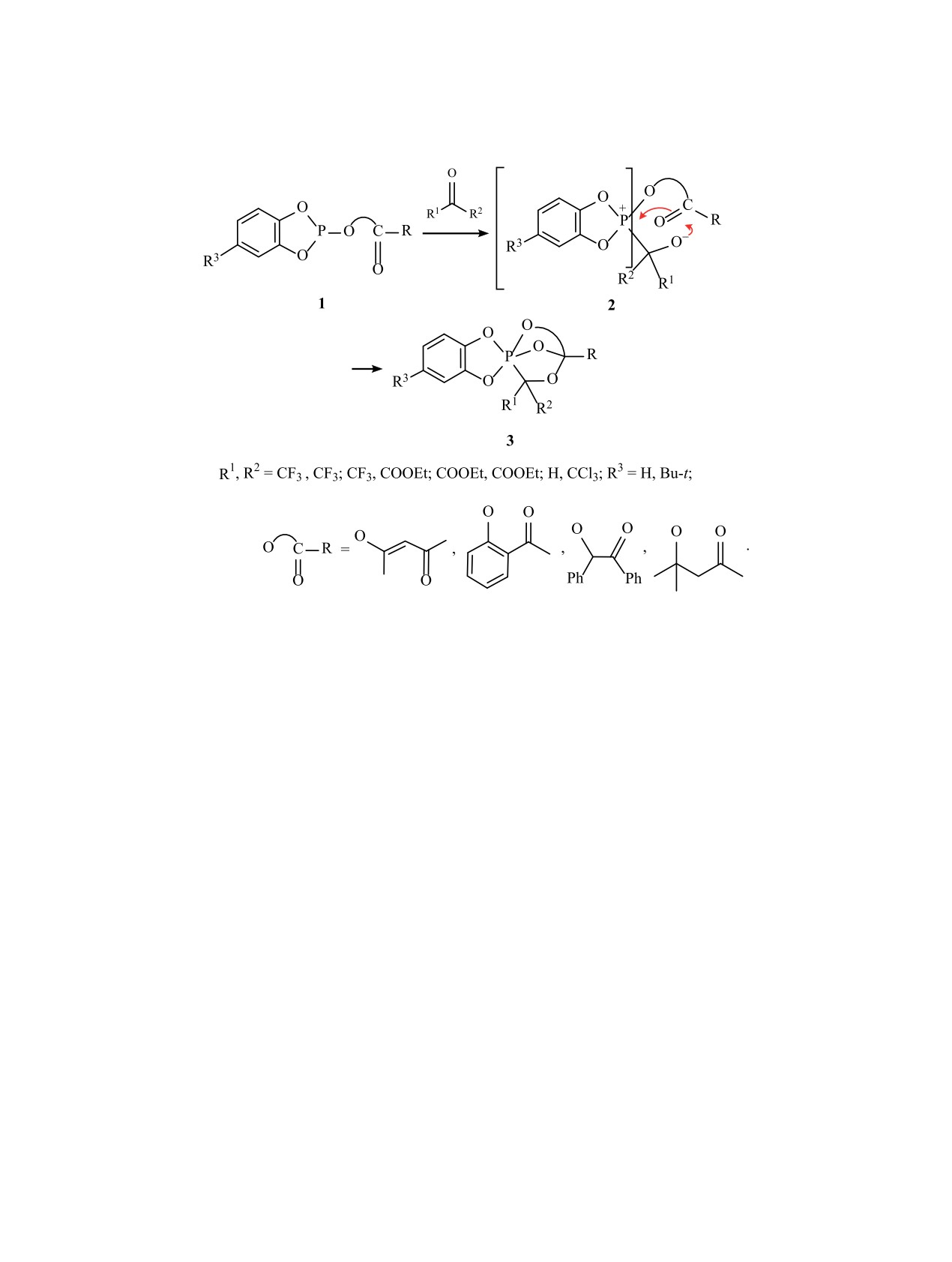
Реакция гексафторацетона с 5,5-диметил-2-(2-оксо-1,2-дифенилэтилокси)-1,3,2-диоксафосфорина-
ном осуществляется по двум параллельным направлениям: с образованием каркасного фосфорана
и спирофосфорана - 1,1-(2,2-диметилпропилендиокса)-4,5-дифенил-3,3-бис(трифторметил)-2,6,7-
триокса-1-фосфабицикло[2.2.11.4]гептана и 2-(2,2-диметилпропилендиокса)-2-гексафторизопропок-
си-4,5-дифенил-1,3,2-диоксафосфолена соответственно. Последний был получен встречным синтезом
из 5,5-диметил-2-гексафторизопропокси-1,3,2-диоксафосфоринана и дибензоила. Мягкий гидролиз
полученных соединений отличается высокой хемоселективностью и приводит к образованию цикличе-
ских фосфатов. Строение полученных соединений установлено методом ЯМР и масс-спектрометрии.
Ключевые слова: диоксафосфоринан, гексафторацетон, каркасный фосфоран, PCO/POC-перегруппи-
ровка, спирофосфоран, фосфат
DOI: 10.31857/S0044460X20110104
Производные пентакоординированного фосфо-
кислоты, применяющихся в сельском хозяйстве в
ра (фосфораны) являются высоко реакционноспо-
качестве пестицидов и гербицидов [11-14], а так-
собными интермедиатами большого числа реак-
же в технике в качестве огнестойких добавок [15].
ций с участием фосфорорганических соединений
Интермедиаты с пентакоординированным атомом
[1, 2], в том числе ключевых процессов, имеющих
фосфора обнаруживаются в различных каталити-
важное значение в органическом синтезе. Они
ческих процессах с использованием солей фос-
также являются интермедиатами или переходны-
фония и фосфиноксидов [16-21] и зачастую сами
ми состояниями важнейших для жизни биохи-
проявляют каталитическое действие [22, 23]. По
мических процессов фосфорилирования гидрок-
этим причинам не ослабевает внимание исследо-
сильных групп и гидролиза фосфор-эфирных и
вателей к разработке методов синтеза, строению
РОР-связей, которые катализируются различными
и реакционной способности фосфоранов [24-37],
типами ферментов [3-9], интермедиатами в про-
являющихся высокоэнергетическими соединени-
цессе превращения некоторых противовирусных
ями. Однако недавно была опубликована работа,
соединений-пролекарств в лекарства в процессе
в которой представлен синтез гидролитически
гидролиза связей P-O [10], а также интермедиата-
устойчивых пентаоксифосфоранов путем «спон-
ми реакций гидролиза других эфиров фосфорной
танного фосфорилирования сахаров и полиолов в
1704
ПАР
АЛЛЕЛЬНОЕ ОБРАЗОВАНИЕ ПЕНТААЛКОКСИФОСФОРАНОВ
1705
Схема 1.
отсутствие ферментов» неорганическими солями
касных фосфоранов на основе каскадных процес-
фосфорной кислоты в воде. Авторы не принима-
сов 2-R-бензо-1,3,2-диоксафосфола 1, имеющего в
ют во внимание тот факт, что фосфат-анионы не
ациклическом заместителе R γ- или δ-карбониль-
подвергаются атаке нуклеофилами в обычных
ную или имино-группу, которые инициируются
(некаталитических) условиях, а метод масс-спек-
активированными карбонильными соединениями,
трометрии высокого разрешения не может дать
такими как гексафторацетон и хлораль [39-42],
информацию о структуре образующихся аддуктов
этиловые эфиры трифторпировиноградной и ме-
[38]. Учитывая данные по химическим сдвигам в
зоксалевой кислот [43-45]. В ходе этих процес-
спектрах ЯМР 31Р, приведенные авторами этой ра-
сов первоначально возникают биполярные ионы
боты (δP 2-3 м. д., D2O), следует отметить, что речь
типа P+-C-O- (2), анионная часть которых легко
идет о комплексах c водородной связью неорга-
взаимодействует с экзоциклической карбониль-
нических фосфатов с изученными полиолами, но
ной или имино-группой, приводя в итоге через
никак не о фосфоранах, для которых характерно
двухстадийный каскадный процесс к каркасным
проявление резонанса в высокопольной области.
PCO-фосфоранам 3 (схема 1). По аналогичному
Введение в молекулу фосфорана электроноак-
пути происходит взаимодействие 3,4-диметил- и
3,3,4,4-тетраметил-1,3,2-диоксафосфоланов, со-
цепторных групп, пяти- и шестичленных фрагмен-
держащих те же ациклические заместители при
тов, а также включение атома фосфора в полици-
фосфоре, с хлоралем [46, 47].
клические (каркасные) остовы приводит не только
к увеличению устойчивости фосфоранов, но и к
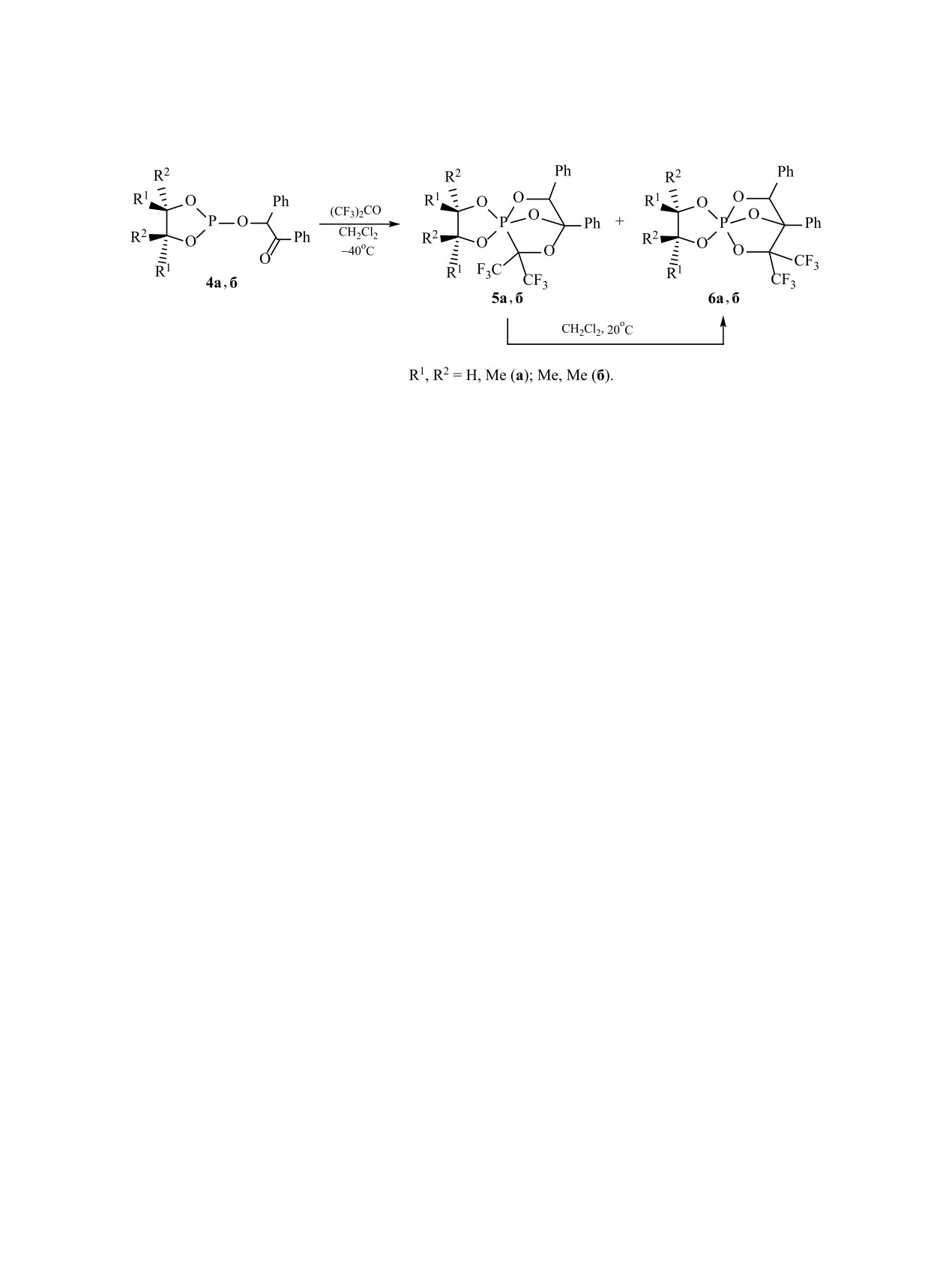
Недавно нами было показано на примере
ограничению внутримолекулярных процессов об-
реакции гексафторацетона с 4,5-диметил-2-(2-ок-
мена лигандами в тригональной бипирамиде (пер-
со-1,2-дифенилэтилокси)бензо-1,3,2-диоксафос-
мутационной изомеризации), а также появлению
фоланом 4a [48, 49] и 4,4,5,5-тетраметил-2-(2-ок-
из-за этого пространственной жесткости струк-
со-1,2-дифенилэтилокси)-1,3,2-диоксафосфола-
туры, что существенно облегчает исследование
ном 4б [50], что происходит не только параллельное
их реакционной способности. Так, недавно нами
образование PCO/POC-фосфоранов 5 и 6, но и
были предложены новые подходы к синтезу кар-
внутримолекулярная PCO/POC-перегруппировка,
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 11 2020
1706
МИРОНОВ и др.
Схема 2.
сопровождающаяся переходом PCO-изомера 5 в
нами показано далее методами ЯМР, является пен-
POC-изомер 6 (схема 2).
таалкоксиспирофосфораном (9) (схема 3, направ-
ления а и г).
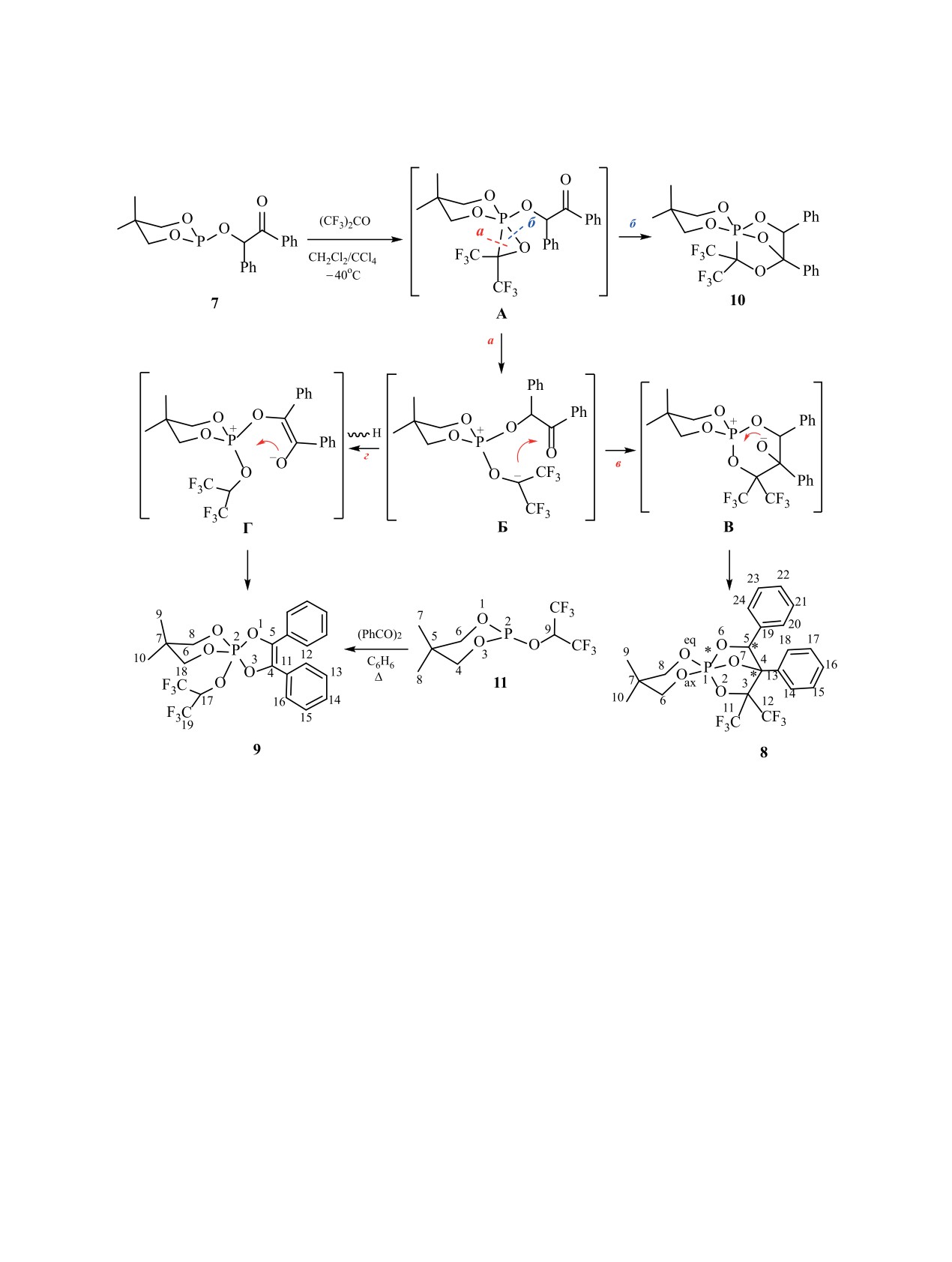
В данной работе во взаимодействие с гексаф-
торацетоном был вовлечен 5,5-диметил-2-(2-ок-
Строение соединения 8 было установлено ме-
со-1,2-дифенилэтилокси)-1,3,2-диоксафосфори-
тодами ЯМР 1H, 1H{31P}, 19F, 19F{1H}, 13C, 13C{1H}
нан 7, который содержит шестичленный цикл,
и 13C,1H-dept, а также методом ИК спектроско-
существенно менее стабилизирующий конфигу-
пии. Несмотря на то, что молекула фосфорана 8
рацию тригональной бипирамиды по сравнению с
содержит три хиральных центра (С4, С5 и Р1),
пятичленными циклами в структурах 5a, б и 6a, б.
получается только один диастереомер, т. е. про-
Кроме того ожидается, что, являясь более донор-
цесс образования соединения 8 является высоко
ным циклом по сравнению с пятичленным цикли-
стереоселективным. То, что он имеет структуру
ческим фрагментом, он будет сильнее способ-
РОС-пентаалкоксифосфорана, а не РСO-изоме-
ствовать протеканию PCO/POC-перегруппировки,
ра (10) (схема 3, направление б), четко следует из
поскольку известно, что донорные заместители
данных спектра ЯМР 13C, в котором отсутствует
при атоме фосфора заметно ускоряют аналогич-
характерный для фрагмента Р-С(СF3)2 дублет сеп-
ную фосфонат-фосфатную перегруппировку в
тетов с прямой константой 1JPC. Вместо этого в
ряду производных тетракоординированного фос-
спектре имеется уширенный септет (δC 83.49 м. д.,
фора [51-55].
2JFCC = 29.0-30.0 Гц, 2JPOC < 1 Гц), соответству-
Взаимодействие соединения 7 с гексафтора-
ющий углероду С3 фрагмента Р-O-С3(СF3)2. Резо-
цетоном происходит в мягких условиях (-40°С) в
нанс атома С4 фрагмента О-С4(С3)С13 проявляется
смеси дихлор- и тетрахлорметанов (1:1) с образо-
в характерной для третичного углерода, связан-
ванием двух соединений с соотношением ~1:1, ко-
ного с кислородом, области (δC 79.71 м. д.) в виде
торым в спектре ЯМР 31Р{1H} соответствуют два
дублета (2JPOC = 20.0 Гц). Углероды фенильных
высокопольных cинглета с δP -39.8 и -53.1 м. д. В
групп в положениях 5 и 4 проявляются в спектре
масс-спектре электронного удара (ЭУ) смеси этих
по-разному: если атомы С20,24, С21,23 попарно эк-
соединений присутствует только один пик молеку-
вивалентны, то орто- и мета-атомы С14,18 и C15,17
лярного иона [M]+· с m/z 510.10, соответствующий
фенильной группы в положении 4 неэквивалентны
образованию продукта реакции состава 1:1, т. е.
и заметно уширены. Это связано с заторможенным
оба соединения являются изомерами. Удалением
вращением вокруг связи C4-C13, обусловленным
дихлорметана из реакционной массы с последу-
влиянием соседнего гем-трифторметильного фраг-
ющей дробной кристаллизацией из тетрахлорме-
мента. Интересно отметить, что резонанс атомов
тана удалось выделить с выходом 35 % кристал-
С14,18 проявляется в виде квартетов с дальними
лический РОС-каркасный фосфоран (8) - продукт
константами 5JFC11C4C5C13C = 4.6 и 2.5 Гц, что воз-
PCO/POC-перегруппировки (схема 3, направления
можно в случае жесткой структурной организа-
а и в). Изомерное соединение с более высокополь-
ции каркасного остова молекулы и сближенности
ным химическим сдвигом (δP -53.1 м. д.), как было
фенилькой группы с одним из двух трифторме-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 11 2020
ПАР
АЛЛЕЛЬНОЕ ОБРАЗОВАНИЕ ПЕНТААЛКОКСИФОСФОРАНОВ
1707
Схема 3.
тильных заместителей. В спектре ЯМР 19F атомы
аксиальных и экваториальных протонов в в спек-
фтора этих трифторметильных групп также прояв-
трах ЯМР 1H. Так, в спектре 5,5-диметил-2-ок-
ляют сильную неэквивалентность (∆δF = 3.87 м. д.)
со-2-фенокси-1,3,2-диоксафосфоринана в конфор-
и резонируют в виде квартетов (4JFF = 10.0 Гц). В
мации кресло экваториально ориентированные
целом описанная спектральная картина согласует-
протоны при атомах углерода С4,6 резонируют в
ся с таковой для соединений 6a, б [49, 50]. Учиты-
более сильных полях с бόльшей по величине кон-
вая это обстоятельство, можно предположить, что
стантой 3JPOC4,6Heq = 21.5 Гц (взаимно-трансоидная
также как и для соединений 6a, б, атомы углерода
ориентация связей Р-О и C4,6-Heq) по сравнению с
C4 и С5 выделенного диастереомера соединения 8
аксиальными протонами, резонанс которых прояв-
имеют конфигурацию R,S/S,R.
ляется в более слабых полях с меньшей констан-
Особый интерес, с точки зрения определения
той 3JPOC4,6Hax = 2.8 Гц (гош-ориентация связей
конформации 1,3,2-диоксафосфоринанового фраг-
Р-О и C4,6-Hax) [56-59]. Спектральная картина
мента, представляют протонные и углеродные
попарно неэквивалентных аксиальных и эквато-
параметры в спектрах ЯМР 1H и 13C. Для про-
риальных протонов H6,8 в аналогичных положе-
изводных четырехкоординированного фосфора,
ниях диоксафосфоринанового цикла соединения 8
содержащих этот цикл, имеются надежные спек-
свидетельствует об образовании двух ABX-систем
тральные критерии для идентификации сигналов
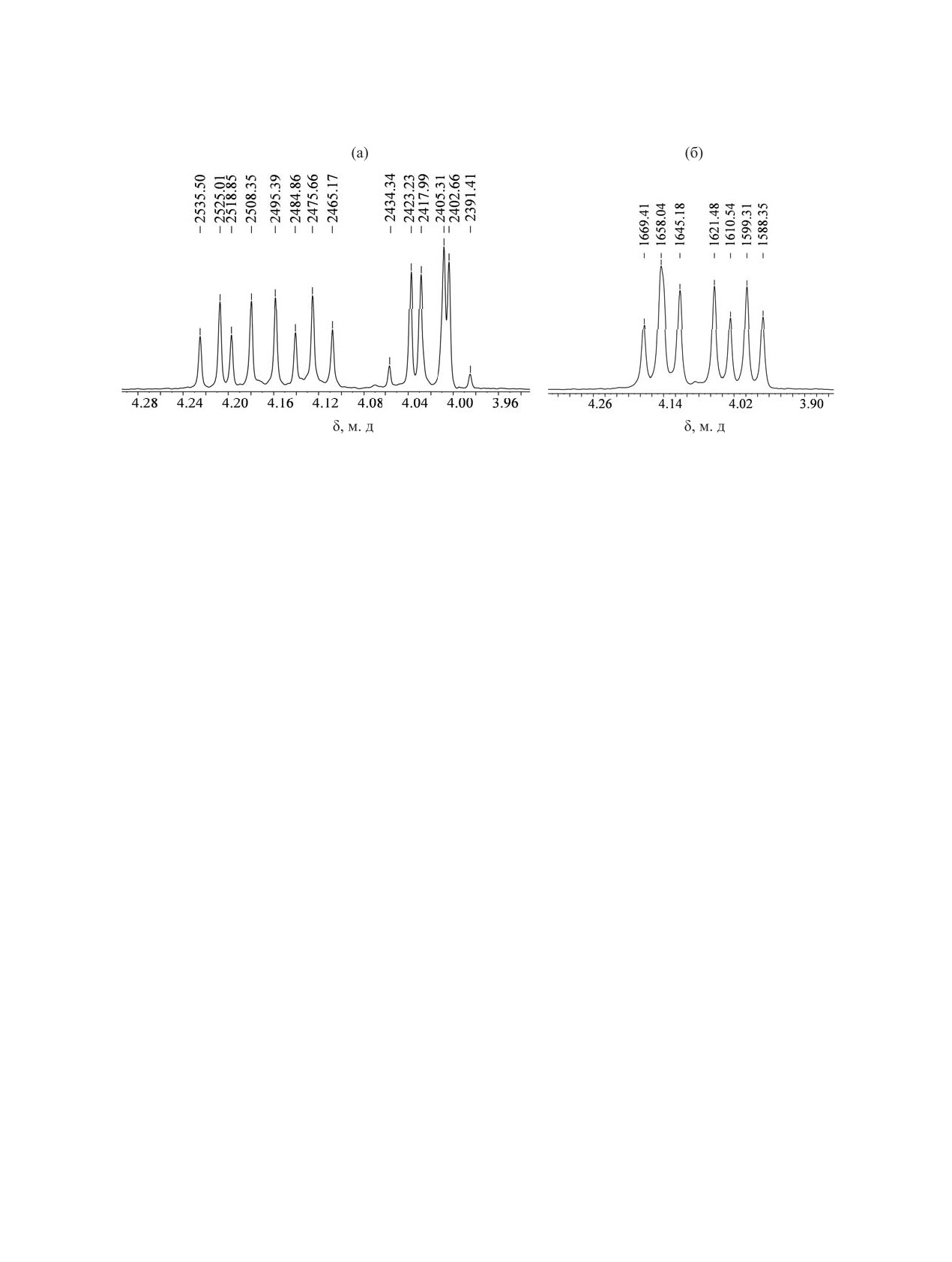
(рис. 1a), что является следствием аксиально-эква-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 11 2020
1708
МИРОНОВ и др.
Рис. 1. Фрагменты спектров ЯМР 1H (CDCl3) протонов С6HeqHax и С8HeqHax в молекулах фосфоранов 8 (600 МГц, a) и 9
(400 МГц, б).
ториальной ориентации диоксафосфоринанового
и псевдовращения при атоме P(V). Спектр ЯМР
цикла в тригонально-бипирамидальном остове мо-
31P cогласуется с данными ЯМР 1H и содержит
лекулы 8. При этом величины констант 3JPOC6,8Heq
мультиплет с пятью различными константами от
и 3JPOC6,8Hax для двух каналов спин-спиновой свя-
пяти разных протонов. В спектре ЯМР 13C атомы
зи Р-(O-С6HeqHax)ax и P-O-С8HeqHax)eq не име-
углерода С6 и С8 неэквивалентны и резонируют в
ют таких существенных отличий, отмеченных
области δC 77.75 и 75.59 м. д.
выше для протонов этого цикла в производных
Таким образом, в реакции диоксафосфоринана
Р(IV), что может быть связано с конформацион-
7, содержащего более донорный шестичленный
ным равновесием кресло-ванна (или твист-фор-
цикл, с гексафторацетоном не происходит одно-
ма). Причиной такого равновесия является неу-
временного образования каркасных фосфоранов 8
стойчивость конформации кресло, обусловленная
и 10 со связями P-O и P-C, как это имеет место
валентным углом Oax-P-Oeq 90° в производных
в приведенных выше реакциях соединений 4a, б
пентакоординированного фосфора [60, 61], а так-
(схема 2). Вместо этого происходит параллельное
же с процессом псевдовращения в тригональной
образование каркасного РОС-фосфорана 8 и спи-
бипирамиде. С учетом величин этих констант
рофосфорана 9.
мы приписали более низкопольные сигналы с δ
На схеме 3 представлена предполагаемый меха-
4.19 м. д. (3JPOC8Hax = 16.7 Гц) и 4.13 м. д. (3JPOC8Heq =
низм реакции, который включает первоначальное
19.5 Гц) экваториально ориентированному фраг-
хелетропное [1+2]-циклоприсоединение фосфита
менту (OС8HeqHax)eq, а высокопольные сигналы с δ
к карбонильной группе гексафторацетона с проме-
4.03 м. д. (3JPOC6Heq = 17.9 Гц) и 4.01 м. д. (3JPOC6Hax
жуточным образованием оксафосфирана с пента-
15.5 Гц) - аксиально ориентированному фрагмен-
координированным атомом фосфора (A). В пользу
ту (OС6HeqHax)ax в тригональной бипирамиде. Эти
возможного образования оксафосфиранов с пен-
значения констант близки к соответствующим ве-
такоординированным атомом фосфора в реакциях
личинам для 5,5-диметилдиоксафосфоринаново-
производных Р(III) с хлоралем и гексафторацето-
го цикла в производных гексакоординированного
ном свидетельствуют данные квантовохимических
фосфора, в которых конформация этого гетероцик-
расчетов [49, 63, 64]. Затем процесс мог бы про-
ла согласно данным РСА твист-форма или ванна
текать по двум направлениям: по пути а с разры-
[62]. Окончательное соотнесение возможно только
вом связи P-C и по пути б с разрывом связи P-O,
после проведения квантово-химических расчетов
последний, как нами установлено, не реализуется.
химических сдвигов и констант с учетом процес-
Итермедиат A далее переходит в POС-биполярный
сов конформационного равновесия кресло-ванна
ион Б, который, в свою очередь, также может далее
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 11 2020
ПАР
АЛЛЕЛЬНОЕ ОБРАЗОВАНИЕ ПЕНТААЛКОКСИФОСФОРАНОВ
1709
стабилизироваться по двум направлениям. Направ-
смеси соединений 8 и 9 (1:1) в растворе пентана в
ление в включает внутримолекулярную атаку кар-
мягких условиях под действием воздуха установ-
баниона на атом углерода экзоциклической карбо-
лено, что скорость гидролиза спирофосфорана 9
нильной группы с образованием бициклического
заметно выше, чем каркасного соединения 8. При
биполярного иона В, который трансформируется
этом за неделю выдерживания спирофосфоран
в конечный каркасный фосфоран 8 через внутри-
практически весь переходит в соединение фос-
молекулярное взаимодействие алкоксид-аниона
фатной природы, которому в спектре ЯМР 31Р{1H}
с атомом фосфора. Направление г предполагает
соответствует синглет с δP -8.6 м. д., тогда как кар-
перенос протона с 2-оксо-1,2-дифенилэтильного
касный фосфоран в этих условиях сохраняется.
заместителя к карбанионному центру с образова-
Проведение гидролиза фильтрата, растворенного
нием биполярного иона Г, в котором отрицатель-
в пентане, после отделения основной массы кар-
ный заряд находится на стабилизированном ено-
касного фосфорана 8 (и удаления тетрахлормета-
лят-анионе. Последующее внутримолекулярное
на с дихлорметаном) во влажном воздухе привело
взаимодействие кислорода с фосфором приводит
к образованию кристаллического фосфата с тем
к образованию спирофосфорана 9.
же химическим сдвигом в спектре ЯМР 31Р{1H}.
Поскольку выделить в чистом виде соединение
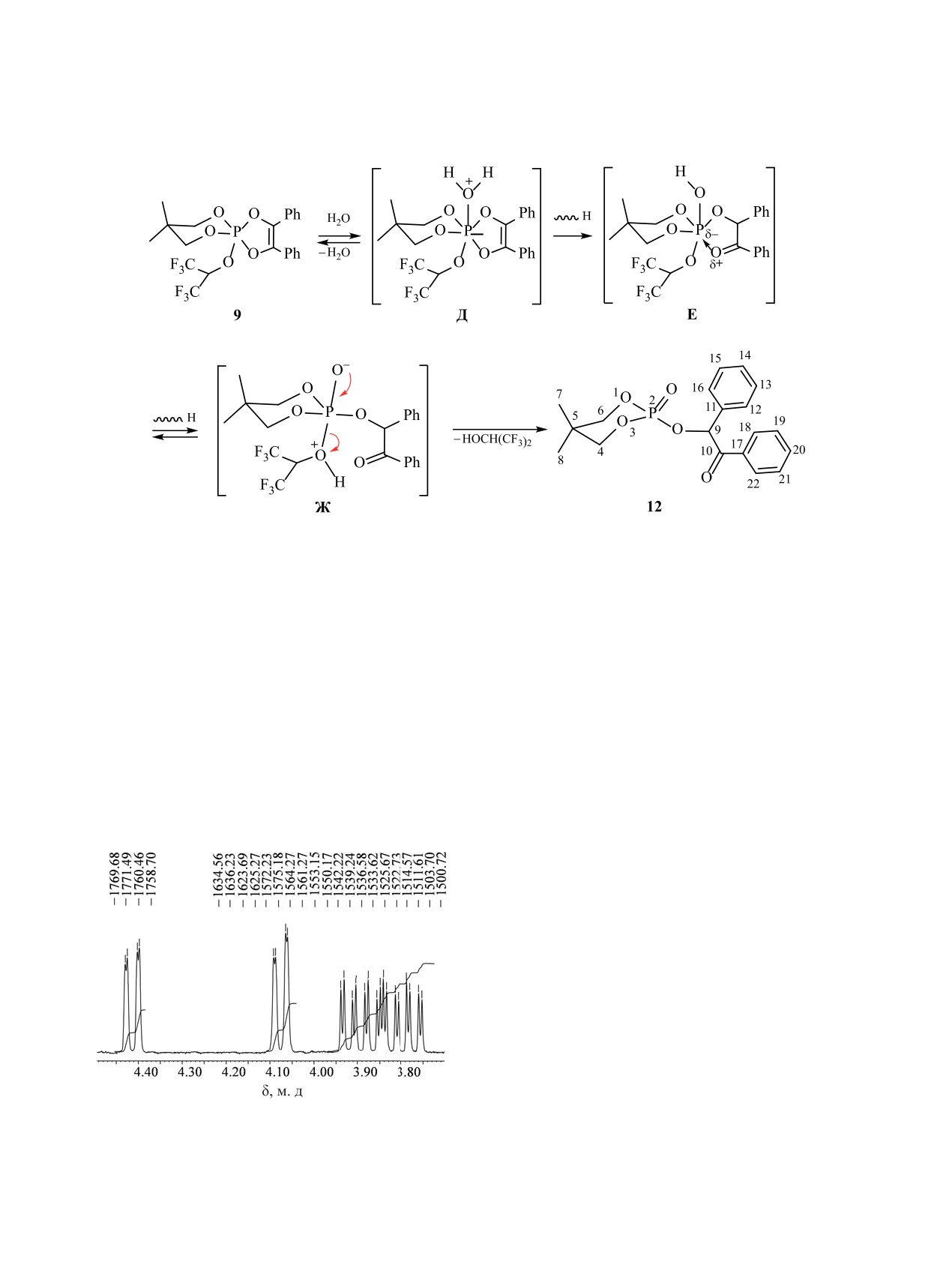
Принимая во внимание данные масс-спектроме-
9 не удалось, оно было получено независимым
трии ESI (пик молекулярного иона с m/z 360.11), а
синтезом из 5,5-диметил-2-гексафторизопропок-
также данные ЯМР и ИК спектроскопии, продук-
си-1,3,2-диоксафосфоринана 11 и дибензоила на-
ту гидролиза была приписана структура 5,5-ди-
греванием в бензоле в соответствии с методикой
метил-2-(2-оксо-1,2-дифенилэтилокси)-2-ок-
синтеза для близких по структуре фосфоранов из
со-1,3,2-диоксафосфоринана 12. В этих мягких
дибензоила [65, 66]. Его строение доказано мето-
кинетически контролируемых условиях гидролиз
дами ЯМР 1H, 1H{31P}, 19F, 19F{1H}, 13C, 13C{1H}
отличается высокой хемоселективностью - про-
и 13C,1H-dept, а также методом ИК спектроско-
исходит отщепление исключительно гексафто-
пии. В масс-спектре ЭУ ему соответствует пик
ризопропанола (схема 4). Процесс, по-видимому,
молекулярного иона [M]+· с m/z 510.10, в спектре
является ассоциативным, и включает нуклеофиль-
ЯМР 31P резонанс проявляется в виде триплета ду-
ное присоединение атома кислорода воды к атому
блетов триплетов (δP -53.1 м. д.) с тремя различ-
электронодефицитного пентакоординированного
ными константами (3JHeqC6,8OP = 22.5, 3JPOC17H =
фосфора с промежуточным образованием гекса-
14.4, 3JHaxC6,8OP = 13.5 Гц). Спектры ЯМР 1H и 13C
координированного биполярного интермедиата
являются более простыми по сравнению с анало-
Д. Далее в интермедиате Д осуществляется про-
гичными спектрами соединения 8. Несмотря на
тотропный сдвиг к одному из атомов кислорода
то, что диоксафосфоринановый и диоксафосфоль-
диоксафосфоленового цикла с промежуточным
ный циклы занимают аксиально-экваториальное
образованием гидроксифосфоранового интерме-
положение в тригональной бипирамиде, в спек-
диата Е, в котором возможна внутримолекулярная
трах наблюдается усреднение сигналов протонов
координация с атомом кислорода карбонильной
и углеродов диоксафосфоринанонового и диокса-
группы. Последующее перемещение протона к
фосфоленового цикла, связанное, по-видимому,
кислороду гексафторизопропоксильного замести-
с динамическим обменом (псевдовращением в
теля приводит к возникновению оксифосфорана
тригональной бипирамиде). Так, резонанс атомов
Ж, в котором легко осуществляется отщепление
C6,8, С3,4 проявляется в спектре ЯМР 13C{1H} в
наиболее легко уходящего гексафторизопропано-
виде дублетов с δC 76.76 (2JPOC = 8.1) и 133.95 м. д.
ла, приводящее к образованию конечного продук-
(2JPOC = 3.6 Гц), соответственно. В спектре ЯМР
та гидролиза - фосфата 12.
1H протоны C6HaxHeq и C8HaxHeq попарно эквива-
На рис. 2 приведен фрагмент спектра ЯМР 1Н
лентны (C6,8Hax, δ 4.08 м. д. и C6,8Heq, δ 3.96 м. д.) и
этого соединения в области резонанса протонов
образуют две ABX-системы (рис. 1б).
при атомах С4 и С6 диоксафосфоринанового цик-
Фосфораны 8 и 9, как высоко реакционноспо-
ла. Из-за присутствия в молекуле хирального ато-
собные соединения, легко подвергаются гидроли-
ма углерода С9 неэквивалентность в спектрах ЯМР
зу. Так, при проведении гидролиза реакционной
проявляют не только эти атомы углерода, но и на-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 11 2020
1710
МИРОНОВ и др.
Схема 4.
ходящиеся при них аксиальные и экваториальные
ма отрицательных ионов, им соответствуют пики
протоны, которые резонируют упрощенно (без
с m/z 441 [M - 1] (13) и m/z 459 [M - 1] (14). Ранее
учета дальнего спин-спинового взаимодействия)
нами было показано, что процесс перехода фос-
в виде двух AMX-систем, интерпретация которых
фолана 13 в моноэфир 14 обратим, и при нагре-
(эксп. часть) выполнена с учетом данных ЯМР
вании с отгонкой воды из производного 14 можно
1H{31Р}.
снова получить это соединение [49, 50]. На схеме
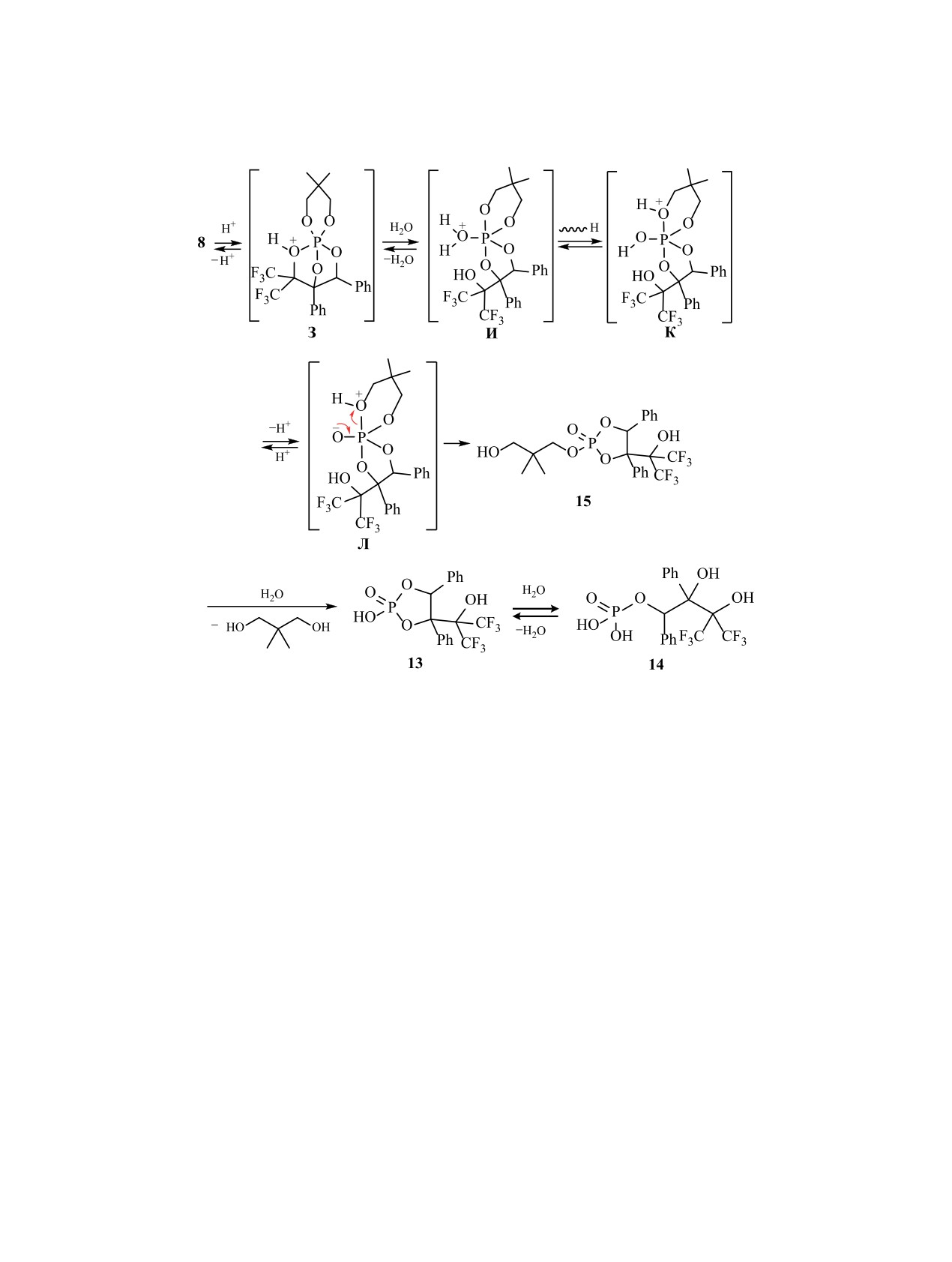
В результате гидролиза каркасного фосфо-
5 приведен предполагаемый путь гидролиза фос-
рана 8 в присутствии каталитического количе-
форана 8, который включает обратимое образова-
ства HCl (схема 5) неожиданно были получены
ние протонированного по кислороду фосфорана З.
2,3-диметилпропандиол и циклический фосфат
Дальнейшее обратимое раскрытие диоксафосфо-
13 (δР 13.8 м. д., 3JHP = 6.3 Гц, ацетон-d6), который
ланового цикла в интермедиате З с образованием
при дальнейшем гидролизе дает моноэфир фос-
хорошо уходящей группы С(CF3)2OH и присоеди-
форной кислоты 14 (δР -0.2 м. д., 3JHP = 9.0 Гц,
нение воды приводят к пентакоординированному
ацетон-d6). В спектре ESI, полученном для режи-
интермедиату И. Последующий перенос протона
к одному из атомов кислорода диоксафосфори-
нанового цикла приводит к возникновению про-
тонированного гидроксифосфорана К, обратимое
депротонирование которого через интермедиат Л
дает промежуточный циклический фосфат 15. Ги-
дролиз этого соединения приводит к отщеплению
2,3-диметилпропандиола и образованию цикли-
ческого диэфира фосфорной кислоты 13, который
при дальнейшем гидролизе дает моноэфир фос-
форной кислоты 14. Соединение 13 было выделено
кристаллизацией из воды и его структура доказана
методом ЯМР, а также сравнением спектральных
параметров с ранее полученным образцом [49, 50].
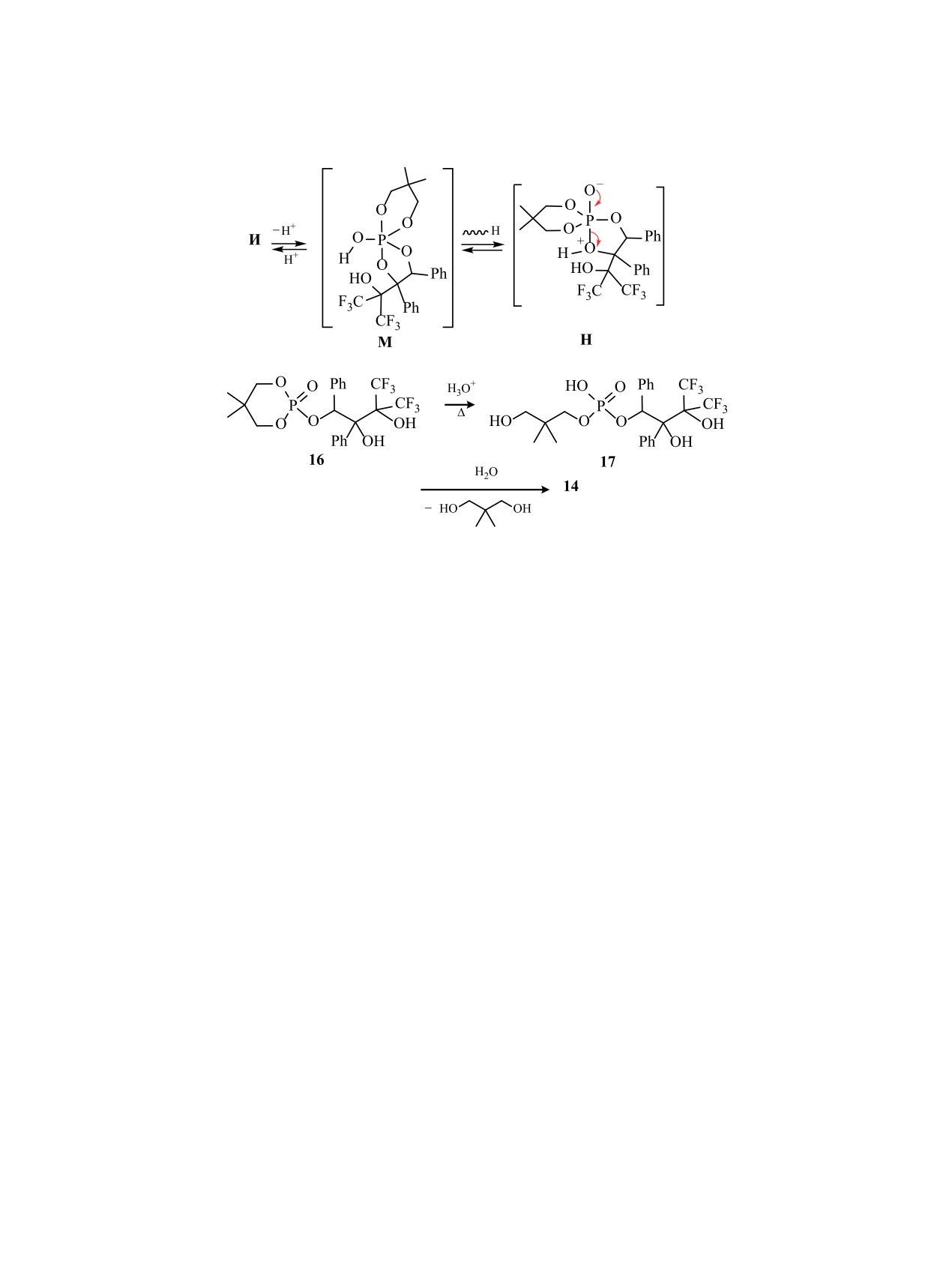
Известно, что спирофосфораны, молекулы ко-
Рис. 2. Фрагмент спектра ЯМР 1H (CDCl3, 400 МГц)
торых содержат 5,5-диметил-1,3,2-диоксафосфо-
протонов С6HeqHax и С8HeqHax в молекулe фосфата 12.
ринановый и 1,3,2-диосафосфолановый циклы,
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 11 2020
ПАР
АЛЛЕЛЬНОЕ ОБРАЗОВАНИЕ ПЕНТААЛКОКСИФОСФОРАНОВ
1711
Схема 5.
легко подвергаются гидролизу с раскрытием пя-
В спектре ЯМР 31Р (162.0 МГц, CCl4:CDCl3 = 1:2)
тичленного цикла и удалением ациклического
эти фосфаты заметно отличаются по своим спек-
заместителя от фосфора; при этом гидролиз ше-
тральным параметрам: резонанс фосфора в спек-
стичленного цикла не происходит [67]. В свя-
тре соединения 15 проявляется в виде двух сигна-
зи с этим, с целью обнаружения возможных ин-
лов в соотношении 41:59 (d1, δР 15.4 м. д., уш. т. д,
термедиатов гидролиза фосфорана
8, методом
3JHP = 9.9, 3JHP = 8.5-8.6 Гц; d2, δР 14.4 м. д., уш. т.
масс-спектрометрии и ЯМР были изучены состав
д, 3JHP = 9.9, 3JHP = 5.1 Гц), а резонанс фосфора в
и соотношение продуктов гидролиза как в мягких
спектре соединения 16 проявляется в виде одного
кинетически контролируемых условиях (путем
сигнала (δР -7.6 м. д., т. д. т, 3JHeqP = 21.5, 3JHP =
8.6 Гц, 3JHaxP = 2.7 Гц). При этом в спектре ЯМР
длительного выдерживания раствора фосфорана 8
в тетрахлорметане на воздухе), так и в более жест-
1Н (400 МГц) резонанс протона фрагмента ОСНPh
этих соединений проявляется в виде дублета при
ких (нагреванием в дистиллированной воде без
6.59 (15 d1, 3JHP = 8.5 Гц), 6.54 (15 d2, 3JHP = 5.2 Гц)
катализа HCl при 70-80°С). Мягкий гидролиз сое-
и 6.24 м. д. (16, 3JHP = 8.6 Гц).
динения 8 осуществляется по двум направлениям:
по пути образования фосфата 16 с сохранением
При проведении гидролиза при нагревании
диоксафосфоринанового цикла и двух диастерео-
кроме перечисленных соединений 13-16 образу-
меров диоксафосфолана 15 (схема 6); при этом со-
ется диэфир фосфорной кислоты 17, которому в
отношение фосфатов 15 и 16 составляет 0.98:1.02,
масс-спектре ESI, записанном в режиме регистра-
т. е. процесс не является селективным. Этим сое-
ции отрицательных ионов, соответствует пик мо-
динениям соответствует один пик молекулярного
лекулярного иона с m/z 545 [M - 1].
иона с m/z 527 [M - 1] в масс-спектре ESI, записан-
Таким образом, можно заключить, что взаимо-
ном в режиме регистрации отрицательных ионов.
действие диоксафосфоринана 7 с гексафтораце-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 11 2020
1712
МИРОНОВ и др.
Схема 6.
тоном приводит к одновременному образованию
таблетки вещества с КВr. Все операции по полу-
каркасного пентаалкоксифосфорана 8 и пентаал-
чению соединений трехкоординированного атома
коксиспирофосфорана 9. Гидролиз соединения 9
фосфора и реакции с гексафторацетоном с после-
осуществляется с высокой хемоселективностью и
дующим выделением фосфоранов проведены в
дает циклический фосфат 12, в котором 1,3,2-ди-
атмосфере сухого аргона с использованием осу-
оксафосфоринановый цикл сохраняется. Гидролиз
шенных растворителей (дихлорметан и тетрахлор-
каркасного фосфорана 8 не является хемоселек-
метан).
тивным и протекает как с образованием диокса-
5,5-Диметил-2-(2-оксо-1,2-дифенилэти-
фосфолана 15, так и диоксафосфоринана 16; по-
локси)-1,3,2-диоксафосфоринан
(7). К смеси
следующий гидролиз этих фосфатов приводит к
100 мл диэтилового эфира, 0.03 моль (5 г) 5,5-ди-
образованию моноэфира фосфорной кислоты 14.
метил-2-хлор-1,3,2-диоксафосфоринана
[68] и
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
0.03 моль (3.3 г) триэтиламина, охлажденной до
10°С, при перемешивании добавляли по каплям
Спектры ЯМР зарегистрированы на приборах
0.03 моль (6.31 г) бензоина в 100 мл эфира в тече-
Bruker Avance-600 (1Н, 600 МГц; 13C, 150.9 MГц;
ние 20 мин. После прибавления всего количества
31P, 242.94 МГц), Bruker Avance-400 (1Н, 400 МГц;
бензоина реакционной массе позволили нагреться
19F, 376.5 МГц; 13C, 100.6 MГц; 31Р, 162.0 МГц),
до комнатной температуры и дополнительно пе-
в качестве внутреннего стандарта использовали
ремешивали 2 ч. Выпавший осадок хлорида триэ-
сигналы остаточных протонов или ядер углеро-
тиламмония отфильтровывали на воронке Шотта,
да CDCl3 или другого растворителя (1Н и 13С),
растворитель удаляли в вакууме (25 мм рт. ст.). В
внешнего стандарта - Н3РО4. Спектры ЯМР 19F
остатке получили 10 г (70%) слегка желтоватого
записаны для растворов в СDCl3. Масс-спектроме-
густого маслообразного соединения 7, которое
трические исследования были проведены на при-
далее использовали без дополнительной очист-
боре TRACE MS (Finnigan-MAT-212) при энергии
ки. Спектр ЯМР 31Р{1Н} (242.94 МГц, CDCl3): δP
ионизирующих электронов 70 эВ и температуре
122.0 м. д. (δP 121.4 м. д. [69])
источника ионов 200°С. Обработка масс-спек-
тральных данных проводилась с использованием
Реакция фосфита
7 с гексафторацето-
программы Xcalibur. ИК спектры записаны на при-
ном. В охлажденный до -40°С раствор 10 г
боре Tensor-27 для пленки или суспензии вещества
(0.029 моля) соединения 7 в 100 мл смеси ССl4 и
в вазелиновом масле между пластинами KBr или
CH2Cl2 (1:1) при перемешивании конденсировали
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 11 2020
ПАР
АЛЛЕЛЬНОЕ ОБРАЗОВАНИЕ ПЕНТААЛКОКСИФОСФОРАНОВ
1713
4.8 г (0.029 моль) гексафторацетона (по привесу).
128.50 д. м (с) (С20,24, 1JНC
= 161.7, 3JHC22CC
=
Реакционную массу плотно закрывали и оставля-
7.0-8.0, 3JHC24,20CC = 6.0-7.0), 127.66 уш. д. д (с)
ли в холодильнике (5°С) на ночь. На следующий
(С21,23, 1JНC = 162.1, 3JHC23,21CC = 8.1), 128.52 д.
день после достижения комнатной температуры
т (с) (С22, 1JНC = 160.7, 3JHC20,24CC = 7.7). Спектр
реакционную массу упаривали наполовину (для
ЯМР 19F/19F{1Н} (376.3 МГц, CDCl3-CCl4), δF,
удаления дихлорметана), в полученном остатке
м. д. (J, Гц): -68.88 к (к) (3F, 4JFF = 10.0), -72.75
(~40 мл) образовался кристаллический осадок. К
к (к) (3F, 4JFF
= 10.0). Спектр ЯМР 31P/31P{Н}
остатку добавляли 20 мл тетрахлорметана и вы-
(242.94 МГц, CDCl3), δP, м. д. (J, Гц): -39.8 д. д. д.
держивали в холодильнике (5°С) 10 сут. После
д. д (c) (3JHeqC8OP = 19.7, 3JHC5OP = 19.5, 3JHeqC6OP =
этого кристаллический осадок отфильтровывали
17.9, 3JHaxC8OP
= 16.7, 3JHaxC6OP
= 15.9). Масс-
в атмосфере аргона и сушили в вакууме. Полу-
спектр (EI), m/z (Iотн, %): 511.11 (24.2), 512.11 (3.8),
чено 5.3 г (36 %) 1,1-(2,2-диметилпропилендиок-
510.10 [M]+· (C22H21F6O5P, 100). Найдено, %: C
са)-4,5-дифенил-3,3-бис(трифторметил)-2,6,7-три-
51.62; H 4.27; P 6.11. C22H21F6O5P. Вычислено, %:
окса-1λ5σ5-фосфабицикло[2.2.11,4]гептана 8, т. пл.
C 51.77; H 4.15; P 6.07.
71-73°С. ИК спектр (вазелиновое масло), ν, см-1:
Фильтрат после отделения соединения
8
3066, 3035, 1496, 1402, 1287, 1260, 1243, 1208, 1173,
упаривали и растворяли в пентане (60 мл). Из
1153, 1114, 1102, 1077, 1060, 1020, 988, 950, 937,
полученного раствора при выдерживании на
888, 869, 837, 798, 784, 759, 749, 735, 714, 694, 654,
открытом воздухе постепенно выпадает оса-
623, 612, 577, 565, 540, 509, 487, 453, 424. Спектр
док
5,5-диметил-2-(2-оксо-1,2-дифенилэтилок-
ЯМР 1Н (600 МГц, CDCl3), δ, м. д. (J, Гц): 7.39 уш.
си)-2-оксо-1,3,2-диоксафосфоринана
12. Выход
д (1H, H14, 3JHH = 7.1), 7.26 м (1H, H18), 7.18 м (2H,
1.67 г (32%), т. пл. 150-152°С (т. пл. 147-149°С
H15, H17), 7.10 т. д (1H, H16, 3JHH = 7.6, 4JHH = 2.1),
[71]). ИК спектр (KBr), ν, см-1: 3066, 2973, 2947,
7.03-7.05 м (5H, H20-24), 5.70 д (1H, H5, 3JPOC5H
2893, 1827, 1695, 1597, 1580, 1495, 1473, 1460,
19.5), 4.19 м
(1H, H8ax, A-часть спектра ABX,
1450, 1402, 1372, 1356, 1338, 1290, 1262, 1243,
3JPOC8Hax = 16.7, 2JHeqC8Hax = 10.5), 4.13 м (1H, H8eq,
1227, 1209, 1184, 1161, 1044, 1016, 1000, 970, 918,
B-часть спектра ABX, 3JPOC8Heq = 19.5, 2JHaxC8Heq =
892, 841, 785, 769, 749, 736, 697, 672, 623, 587, 541,
10.5), 4.03 м
(1H, H6eq, A-часть спектра ABX,
507, 492, 473, 457, 428. Спектр ЯМР 1Н/1Н{31P}
3JPOC6Heq = 17.9, 2JHaxC6Heq = 11.1), 4.01 м (1H, H6ax,
(400 МГц, CDCl3), δ м. д. (J, Гц): 7.93 м (м) (2H,
B-часть спектра ABX, 3JPOC6Hax = 15.5, 2JHeqC6Hax =
H18,22, 3JHH = 8.5), 7.53 м (м) (3H, H20, H12,16), 7.42 д
11.1), 1.12 с и 1.11 с (6H, H9,10). Спектр ЯМР 13C
(д) (2H, H18, H22), 7.37-7.38 м (м) (3H, H19-21), 6.77
(150.9 МГц, CDCl3), δC, м. д. (J, Гц) (здесь и да-
д (c) (1H, H9, 3JPOC9H = 8.2), 4.41 уш. д. д (уш. д)
лее в скобках указан вид сигнала в спектре ЯМР
(1H, H6ax, A-часть спектра AMX, 3JPOC6Hax = 1.7,
13C{1Н}): 83.49 уш. септ (уш. септ) (С3, 2JFCC =
2JHeqC6Hax = 10.9, 4JHC7C5C6Hax < 1), 4.07 уш. д. д (уш.
29.0–30.0), 79.71 уш. д (д) (С4, 2JPOC = 20.0), 82.86
д) (1H, H4ax, A-часть спектра AMX, 3JPOC4Hax = 1.7,
уш. д (уш. с) (С5, 1JНC = 155.1), 75.59 уш. т. м (д) (С8,
2JHeqC8Hax = 10.9, 4JHC7C5C8Hax < 1), 3.99 д. д. д (д. д)
1JНC = 147.9, 2JPOC = 7.4), 32.53 м (д) (С7, 3JPOCС =
(1H, H6eq, M-часть спектра AMX, 3JPOC6Heq = 22.0,
6.2), 77.75 уш. т. м (д) (С6, 1JНC = 149.8, 2JPOC = 8.3),
2JHaxC6Heq = 10.9, 4JHeqC4C5C6Heq = 3.0), 3.79 д. д. д
24.01 к. м (с) (С9, 1JНC = 126.6, 3JНCC10C = 3.8-4.0,
(д. д) (1H, H4eq, M-часть спектра AMX, 3JPOC4Heq =
3JНCC8C
= 3.8-4.0, 3JНCC6C
= 3.8-4.0), 23.84 к. м
22.0, 2JHaxC4Heq = 10.9, 4JHeqC6C5C4Heq = 3.0), 1.28 уш.
(с) (С10, 1JНC = 127.0, 3JНCC9C = 3.8-4.0, 3JНCC8C =
с (уш. с) (3H, H7ax), 0.88 с (c) (3H, H8eq). Спектр
3.8-4.0, 3JНCC6C
= 3.8-4.0), 122.34 к. д (к. д) (С11,
ЯМР 13C (100.6 МГц, CDCl3), δC, м. д. (J, Гц): 78.13
1JFC
= 287.0, 3JPOCC = 8.0), 121.01 уш. к (уш. к)
уш. т. м (д) (С4, 1JНC = 149.7, 2JPOC = 6.7), 32.07 м
(С12, 1JFC = 288.6), 131.17 д. т (д) (С13, 3JPOCC =
(д) (С5, 3JPOCС = 5.9), 78.17 уш. т. м (д) (С6, 1JНC =
18.8, 3JHC15,17CC
= 7.2), 126.84 д. м (к) (С14, 1JНC =
149.7, 2JPOC = 6.8), 20.22 к. к (уш. с) (С8, 1JНC =
159.0, 5JFC11C4C5C13C
= 4.6), 127.04 уш. д. д (уш. с)
127.0, 3JНCCC = 4.3-4.4), 21.83 к. м (с) (С7, 1JНC =
(С15, 1JНC = 159.9, 3JHC17CC 7.1), 128.28 д. т (с) (С16,
126.4, 3JНCCC = 4.2), 79.42 д. д. т (д) (С9, 1JНC = 148.2,
1JНC
= 160.7, 3JHC14,18CC = 7.7), 127.85 уш. д. д (с)
2JPOC = 4.8, 3JНCCC = 4.2), 193.37 д. д. т (д) (С10,
(С17, 1JНC = 161.0, 3JHC15CC = 8.4), 127.65 уш. д. м
3JPOCС = 4.3, 2JНC9C = 3.6-3.7, 3JHC18,22CC = 3.6-
(к) (С18, 5JFC11C4C5C13C = 2.5), 135.24 уш. м (с) (С19),
3.7), 134.71 м (д) (С11, 3JPOC9C = 7.2, 3JHC13,15CC =
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 11 2020
1714
МИРОНОВ и др.
7.2, 2JHC9C = 1.7),
128.41 д. д. д. д (с) (С12,16,
ЯМР 1Н/1Н{31P} (400 МГц, CDCl3), δ, м. д. (J, Гц):
1JHC = 160.1, 3JHC14CC = 7.2, 3JHC16,12CC = 6.8, 3JHC9CC =
7.49 м (м) (4H, H12,16), 7.33 м (м) (6H, H13-15), 5.52
5.0), 128.79 д. д (c) (С13,15, 1JHC = 162.5, 3JHC15,13CC =
д. септ (септ) (1Н, H17, 3JPOC17H = 14.4, 3JFC18,19CH =
7.5), 129.65 д. т (c) (С14, 1JНC = 161.3, 3JHC12,16CC =
6.0), 4.08 д. д (д) (2H, H6,8ax, совпадение двух A-ча-
7.3), 134.19 уш. т (с) (С17, 3JHC19,21CC = 7.3), 128.96 д.
стей двух независимых ABX-спектров, 3JPOC6,8Hax =
д. д (с) (С18,22, 1JНC = 160.9, 3JHC20CC = 7.5, 3JHC22,18CC =
22.5, 2JHeqC6,8Hax = 11.0), 1.21 c (c) (3H, C10eqH),
6.3),
129.28 уш. д. д (с) (С19,21, 1JНC
= 162.1,
3.96 д. д (д) (2H, H6,8eq, совпадение двух B-частей
3JHC21,19CC = 6.8-7.0), 133.84 д. т (с) (С20, 1JНC =
двух независимых ABX-спектров, 3JPOC4,6Heq =
161.7, 3JHC18,22CC = 7.5). Спектр ЯМР 31P/31P{1Н}
22.5, 2JHaxC4Heq = 11.0), 1.01 c (c) (3H, C9axH).
(162.0 МГц, CDCl3), δP, м. д. (J, Гц): -8.6 т. д. т (c)
Спектр ЯМР 13C (100.6 МГц, CDCl3), δC, м. д. (J,
(3JHeqCOP = 22.0, 3JHCOP = 8.2, 3JHaxCOP = 2.0). Масс-
Гц): 133.95 уш. д. т (д) (C3,4, 2JHC12,16C = 4.2, 2JPOC =
спектр (EI), m/z : 360.11 [M]+ · (C19H21O5P). Найде-
3.6), 76.76 уш. т. м (д) (C6,8, 1JHC = 146.8-147.0,
но, %: C 63.21; H 5.91; P 8.57. C19H21O5P. Вычисле-
2JPOC = 8.1), 32.24 м (д) (C7, 3JPOC6,8C = 4.5), 24.13
но, %: C 63.33; H 5.87; P 8.60.
к. м (с) (C9, 1JHC = 126.2, 3JHCCC = 4.3-4.4, 3JHCCC =
4.3-4.4), 23.43 уш. к. м (с) (C10, 1JHC = 126.0), 130.0
5,5-Диметил-2-гексафторизопропокси-
д. т (д) (C11, 3JPOC3,4C = 13.4, 3JHC13,15CC = 6.9),
1,3,2-диоксафосфоринан
(11) получен соглас-
126.79 д. м (с) (C12,16, 1JHC = 159.0, 3JHC14CC = 6.7-
но данным работы [70]. Спектр ЯМР 1Н/1Н{31P}
7.0, 3JHC16,12CC = 5.7-6.0, 2JHCC = 1.7), 128.52 д. м
(400 МГц, CDCl3), δ, м. д. (J, Гц): 4.65 д. септ (септ)
(с) (C13,15, 1JHC = 163.4, 3JHC15,13CC = 7.0, 3JHCC = 2.7,
(1H, H9, 3JPOCH = 8.0, 3JFCCH = 5.9), 4.19 уш. д (д) (2H,
2JHCC = 1.5), 128.38 уш. д. т (с) (C14, 1JHC = 161.0,
H4,6ax, совпадение двух A-частей двух независи-
3JHC12,16CC = 7.8), 72.48 д. септ. д (септ. д) (C17,
мых ABX-спектров, 2JHeqC4,6Hax = 11.0, 3JPOC4,6Hax =
1JHC = 152.0, 2JFC18,19C = 34.4, 2JPOC = 10.1), 121.08
1.0-1.2), 3.45 д. д (д) (2H, H4,6eq, совпадение
к. д. д. к (к. д. д) (С18,19, 1JFC = 282.8, 3JPOC17C =
двух B-частей двух независимых ABX-спектров,
6.3, 2JHC17C = 5.6-5.8, 3JFC19,18CC = 2.8-2.9). Спектр
2JHaxC4,6Heq = 11.0, 3JPOC4,6Heq = 11.0), 1.29 c (c) (3H,
ЯМР 19F/19F{1Н} (376.3 МГц, CDCl3-CCl4), δF, м. д.
H8eq), 0.80 c (c) (3H, H7ax). Спектр ЯМР 19F/19F{1Н}
(J, Гц): -74.79 д (с) (3JHCСF = 6.0). Спектр ЯМР 19F
(376.3 МГц, CDCl3-CCl4), δF, м. д. (J, Гц): -74.83
(376.3 МГц, CDCl3-CCl4): δF -74.79 м. д. Спектр
д. д (д) (4JPOCCF = 8.0, 3JHCCF = 5.9). Спектр ЯМР
ЯМР 31P/31P{1Н} (242.94 МГц, CDCl3-CCl4), δP, м. д.
31P/31P{1Н} (242.94 МГц, CDCl3), δP, м. д. (J, Гц):
(J, Гц): -53.1 т. д. т (c) (3JHeqC6,8OP = 22.5, 3JPOC17H =
125.3 септ (септ) (4JFCCOP = 8.0).
14.4, 3JHaxC6,8OP = 13.5). Масс-спектр (EI), m/z (Iотн,
2-Гексафторизопропокси-2,2-(2,2-диметил-
%): 510.10 [M]+ · (C22H21F6O5P). Найдено, %: C
пропилендиокса)-4,5-дифенил-1,3,2λ5σ5-диокса-
51.56; H 4.33; P 5.94. C22H21F6O5P. Вычислено, %:
фосфолен (9). К раствору 4.57 г (0.015 моль) со-
C 51.77; H 4.15; P 6.07.
единения 11 в 20 мл бензола по каплям добавля-
Гидролиз соединения 9 (2.0 г) проводили при
ли 3.20 г (0.015 моль) дибензоила в 15 мл бензола
течение 15 мин (20°С). После прибавления всего
выдерживании его раствора в тетрагидрофуране
количества реагента реакционную смесь кипятили
на воздухе с последующей кристаллизацией из
в течение 8 ч. На следующий день растворитель
пентана. Получено 1.26 г (89%) фосфата 12.
удаляли в вакууме. К остатку прибавляли 15 мл
Гидролиз соединения 8. Гидролиз проводи-
пентана. При выдерживании пентанового рас-
ли для образца соединения 8 (3.0 г) в 40 мл дис-
твора в холодильнике (5°С) в течение 10 сут об-
тиллированной воды и 3 капель концентрирован-
разовывался осадок, который быстро отфильтро-
ной соляной кислоты при нагревании (70-80°С)
вывали, промывали холодным пентаном (-10°С)
в течение 6 ч. При последующем выдерживании
и сушили в вакууме. При комнатной температуре
раствора
(20°С) образовывался кристалличе-
осадок растворяется в пентане. Получено 5.44 г
ский осадок
(1.4 г)
2,3-дигидрокси-3,4-дифе-
(70%) cоединения 9, т. пл. 58-60°С. ИК спектр
нил-1,1,1-трифтор-2-трифторметилбут-4-илфос-
(пленка), ν, см-1: 3059, 3036, 2964, 2898, 1673,
фата 14, содержащий, согласно данным ЯМР 31P,
1602, 1580, 1499, 1468, 1447, 1383, 1346, 1291,
10% 2-гидрокси-4-(2-гидрокси-1,1,1,3,3,3-гексаф-
1272, 1231, 1199, 1144, 1109, 1081, 1058, 1022, 966,
торпроп-2-ил)-2-оксо-4,5-дифенил-1,3,2-диокса-
885, 777, 758, 691, 678, 645, 612, 594, 576. Спектр
фосфолана 13.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 11 2020
ПАР
АЛЛЕЛЬНОЕ ОБРАЗОВАНИЕ ПЕНТААЛКОКСИФОСФОРАНОВ
1715
Соединение 14. Спектр ЯМР 1Н (400 МГц, аце-
5. Mattioli E.J., Bottoni A., Calvaresi M. // J. Chem. In-
form. Model. 2019. Vol. 59. N 4. P. 1547. doi 10.1021/
тон-d6), δ, м. д. (J, Гц) (в скобках здесь и далее при-
acs.jcim.8b00815
веден вид сигнала в спектре ЯМР 1Н{31Р}): 7.42 м
6. Aboelnga M.M., Wetmore S.D. // J. Am. Chem. Soc.
(м) (2H, Ph), 7.10 м (м) (2H, Ph), 7.01-7.02 м (м)
2019. Vol. 141. N 21. P. 8646. doi 10.1021/jacs.9b03986
(3H, Ph), 6.90-6.94 м (м) (3H, Ph), 6.10 д (с) (OCH,
7. Sharma G., Jayasinghe-Arachchige V.M., Hu Q.,
Schenk G., Prabhakar R. // ACS Catal. 2020. Vol. 10.
1H, 3JHСOP = 8.9), сигналы протонов групп ОН не
N 6. P. 3684. doi 10.1021/acscatal.9b04847
идентифицированы из-за очень сильного ушире-
8. Borišek J., Magistrato A. // ACS Catal. 2020. Vol. 10.
ния. Спектр ЯМР 19F (376.5 МГц, СD3CN), δF, м. д.
N 9. P. 5328. doi 10.1021/acscatal.0c00390
(J, Гц): -68.94 к и -68.14 к (4JFF = 11.6). Спектр
9. Bevilacqua P.C., Harris, M.E. Piccirilli J.A., Gaines C.,
ЯМР 31Р (31Р{1H}) (162.0 МГц), δP, м. д. (J, Гц): -0.2
Ganguly A., Kostenbader K., Ekesan S., York D.M. //
ACS Chem. Biol. 2019. Vol. 14. N 6. P. 1068. doi
д (с) (3JHСOP = 9.0, ацетон-d6), -1.3 д (с) (3JHСOP =
10.1021/acschembio.9b00202
6.3, СD3CN), -0.3 д (с) (3JHСOP = 7.4, Et2O), -1.5 с
10. Procházková E., Navrátil R., Janeba Z., Roithová J.,
(д) (3JHСOP = 6.5, Н2О). Масс-спектр (ESI), m/z: 459
Baszczyňski O. // Org. Biomol. Chem. 2019. Vol. 17. N 2.
[M - 1] (вычислено для C17H15F6O6P: 460).
P. 315. doi 10.1039/c8ob02870b
11. Chagas M.A., Pereira E.S., Da Silva J.C.S., Rocha W.R. //
Соединение 13. Спектр ЯМР 1Н (400 МГц, аце-
J. Mol. Model. 2018. Vol. 24. P. 259. doi 10.1007/
тон-d6), δ, м. д. (J, Гц): 6.43 д (с) (OCH, 3JHСOP =
s00894-018-3798-1
6.2). Спектр ЯМР 19F (376.5 МГц, СD3CN), δF, м. д.
12. Pereira E.S., Da Silva J.C.S., Brandao T.A.S.,
Rocha W.R. // Phys. Chem. Chem. Phys. 2016. Vol. 18.
(J, Гц): -70.79 к и -69.39 к (4JFF = 10.6). Спектр
N 27. P. 18255. doi 10.1039/c6cp01536k
ЯМР 31Р (31Р{1H}) (162.0 МГц), δP, м. д. (J, Гц): 13.4
13. Pereira M.S., Murta B., Oliveira T.C.F., Manfredi A.M.,
д (с) (3JHСOP = 6.3, ацетон-d6), 14.0 д (с) (3JHСOP =
Nome F., Hengge A.C., Brandao T.A.S. // J. Org.
6.5, СD3CN), 14.6 д (с) (3JHСOP = 6.0, Et2O). Масс-
Chem. 2016. Vol. 81. N 19. P. 8663. doi 10.1021/acs.
joc.6b01358
спектр (ESI), m/z: 441 [M - 1] (вычислено для
14. Bigley A.N., Narindoshvili T., Xiang D.F., Raushel F.M. //
C17H13F6O5P: 442).
Biochem. 2020. Vol. 59. N 12. P. 1273. doi 10.1021/acs.
biochem.0c00089
ФОНДОВАЯ ПОДДЕРЖКА
15. Bigley A.N., Xiang D.F., Narindoshvili T., Burgert C.W.,
Работа выполнена при финансовой поддержке
Hengge A.C., Raushel F.M. // Biochem. 2019. Vol. 58.
N 9. P. 1246. doi 10.1021/acs.biochem.9b00041
Российского фонда фундаментальных исследова-
16. Holthausen M.H., Hiranandani R.R., Stephan D.W. //
ний (грант № 19-03-00751).
Chem. Sci. 2015. Vol. 6. N 3. P. 2016. doi 10.1039/
c5sc00051c
ДОПОЛНИТЕЛЬНЫЕ МАТЕРИАЛЫ
17. Firth K.F., Mobus J., Stephan D.W. // Chem. Comm.
К данной статье приложены дополнительные
2016. Vol. 52. N 97. P. 13967. doi 10.1039/c6cc08561j
18. Mallov I., Johnstone T.C., Burns D.C., Stephan D.W. //
материалы.
Chem. Commun. 2017. Vol. 53. N 54. P. 7529. doi
КОНФЛИКТ ИНТЕРЕСОВ
10.1039/c7cc04057a
19. Kostenko A., Dobrovetsky R. // Eur. J. Org. Chem. 2019.
Авторы заявляют об отсутствии конфликта
N 2-3. P. 318. doi 10.1002/ejoc.201800823
интересов.
20. Süsse L., LaFortune J.H.W., Stephan D.W., Oestreich M. //
Organomet. 2019. Vol. 38. N 3. P. 712. doi 10.1021/acs.
СПИСОК ЛИТЕРАТУРЫ
organomet.8b00912
21. Li G., Nykaza T.V., Cooper J.C., Ramirez A., Luzung M.R.,
1. Liu L.-J., Wang W.-M., Yao, L. Meng F.-J., Sun Y.-M.,
Radosevich A.T. // J. Am. Chem. Soc. 2020. Vol. 142.
Xu H., Xu Z.-Y., Li Q., Zhao C.-Q., Han L.-B. // J. Org.
N 14. P. 6786. doi 10.1021/jacs.0c01666
Chem. 2017. Vol. 82. N 11. P. 11990. doi 10.1021/acs.
22. Bittner B., Koppe K., Frank W., Ignat’ev N. // J.
joc.7b01326
Fluor. Chem. 2016. Vol. 182. P. 22. doi 10.1016/j.
2. Kolodiazhnyi O.I. // Pure. Appl. Chem. 2018. Vol. 91.
jfluchem.2015.11.007
N 1. P. 43. doi 10.1515/pac-2018-0807
23. Bader J, Neumann B., Stammler H.-G., Ignat’ev N.,
3. Yonker N.J.De, Webster C.E. // Biochem. 2015. Vol. 54.
Hoge B. // Chem. Eur. J. 2018. Vol. 24. N 27. P. 6975.
N 27. P. 4236. doi 10.1021/acs.biochem.5b00396
doi 10.1002/chem.201800682
4. Harris M.E., Piccirilli J.A., York D.M. // Biochim.
24. Krasowska D., Pokora-Sobczak P., Jasiak A., Drabo-
Biophys. Acta. 2015. Vol. 1854. N 11. P. 1801. doi
wicz J. // Adv. Heterocycl. Chem. 2017. Vol. 124. P. 175.
10.1016/j.bbapap.2015.04.022
doi 10.1016/bs.aihch.2017.06.002
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 11 2020
1716
МИРОНОВ и др.
25. Hazin K., Gates D.P. // Canad. J. Chem. 2018. Vol. 96.
43. Димухаметов М.Н., Миронов В.Ф., Криволапов Д.Б.,
N 6. P. 526. doi 10.1139/cjc-2017-0648
Миронова Е.В., Мусин Р.З. // Изв. АН. Cер. хим.
26. Bader J., Neumann B., Stammler H.-G., Ignat’ev N.,
2013. № 4. С. 1090; Dimukhametov M.N., Mironov V.F.,
Hoge B. // J. Fluor. Chem. 2018. Vol. 207. P. 12. doi
Krivolapov D.B., Mironova E.V., Musin R.Z. // Russ.
10.1016/j.jfluchem.2017.12.015
Chem. Bull. 2013. Vol. 62. N 4. P. 1091. doi 10.1007/
27. Marczenko K.M., Johnson C.-L., Chitnis S.S. // Chem.
s11172-013-0147-5
Eur. J. 2019. Vol. 25. N 37. P. 8865. doi 10.1002/
44. Миронов В.Ф., Димухаметов М.Н., Миронова Е.В.,
chem.201901333
Криволапов Д.Б., Абдрахманова Л.М. // ЖОХ. 2015.
28. Sun C., Cao S., Zhao P., Ma W., Guo Y., Zhao Y. //
Т. 85. Вып. 2. С. 268; Mironov V.F., Dimukhame-
Tetrahedron Lett. 2018. Vol. 59. N 43. P. 3833. doi
tov M.N., Mironova E.V., Krivolapov D.B., Abdra-
10.1016/j.tetlet.2018.09.020
khmanova L.M. // Russ. J. Gen. Chem. 2015. Vol. 85.
29. Ma W., Dai W., Liu Q., Chen Y., Zhao Y., Cao S. //
N 2. P. 441. doi 10.1134/S1070363215020152
Tetrahedron. 2020. Vol. 76. N 6. P. 130886. doi
45. Dimukhametov M., Mironov V., Krivolapov D.,
10.1016/j.tet.2019.130886
Mironova E., Aksunov I. // Phosphorus, Sulfur, Sili-
30. Breidung J., Thiel W. // J. Phys. Chem. (A). 2019.
con, Relat. Elem. 2015. Vol. 190. N 5-6 P. 939. doi
Vol. 123. N 26. P. 5600. doi 10.1021/acs.jpca.9b04406
10.1080/10426507.2014.993757
31. Brand A., Uhl W. // Chem. Eur. J. 2019. Vol. 25. N 6.
46. Миронов В.Ф., Димухаметов М.Н., Миронова Е.В.,
P. 1391. doi 10.1002/chem.201803331
Криволапов Д.Б., Ивкова Г.А., Абдрахманова Л.М. //
32. Solyntjes S., Neumann B., Stammler H.-G., Ignat’ev N.,
ЖОХ. 2015. Т. 85. Вып. 2. С. 277; Mironov V.F.,
Hoge B. // Eur. J. Inorg. Chem. 2016. N 25. P. 3999. doi
Dimukhametov M.N., Mironova E.V., Krivolapov D.B.,
10.1002/ejic.201600539
Ivkova G.A., Abdrakhmanova L.M. // Russ. J. Gen.
33. Pistner A.J., Moon H.W., Silakov A., Yennawar H.P.,
Chem. 2015. Vol. 85. N 2. P. 450. doi 10.1134/
Radosevich A.T. // Inorg. Chem. 2017. Vol. 56. N 15.
S1070363215020164
P. 8661. doi 10.1021/acs.inorgchem.7b00657
47. Хасиятуллина Н.Р., Миронов В.Ф., Миронова Е.В.,
34. Hazin K., Patrick B.O., Gates D.P. // Inorg. Chem. 2019.
Криволапов Д.Б., Литвинов И.А. // ЖОХ. 2016.
Vol. 58. N 1 P. 188. doi 10.1021/acs.inorgchem.8b02174
Т. 86. Вып. 3. С. 408; Khasiyatullina N.R., Miro-
35. Morsdorf J.-M., Wadepohl H., Ballmann J. // Inorg.
nov V.F., Mironova E.V., Krivolapov D.B., Litvinov I.A. //
Chem. 2019. Vol. 58. N 5. P. 3502. doi 10.1021/acs.
Russ. J. Gen. Chem. 2016. Vol. 86. N 3. P. 551. doi
inorgchem.9b00076
10.1134/S1070363216030105
36. Fujimoto H., Kusano M., Kodama T., Tobisu M. //
48. Миронов В.Ф., Димухаметов М.Н., Ефимов С.В.,
Org. Lett. 2020. Vol. 22. N 6. P. 2293. doi 10.1021/acs.
Каратаева Ф.Х., Клочков В.В. // Изв. АН. Сер.
orglett.0c00489
хим. 2015. № 10. C. 2517; Mironov V.F., Dimukhame-
37. Li B., Hagenbach A., Abram U. // Inorg. Chem. 2019.
tov M.N., Efimov S.V., Karataeva F.Kh., Klochkov V.V. //
Vol.
58. N
12. P.
7925. doi
10.1021/acs.
Russ. Chem. Bull. 2015. Vol. 64. N 10. P. 2517. doi
inorgchem.9b00635
10.1007/s11172-015-1187-9
38. Perez-Ramirez M., Agyekum I., Otoo B. / /
49. Mironov V.F., Dimukhametov M.N., Efimov S.V., Ami-
ChemBioChem. 2020. Vol. 21. N 4. P. 473. doi 10.1002/
nova R.M., Karataeva, F.Kh. Krivolapov D.B., Mirono-
cbic.201900328
va E.V., Klochkov V.V. // J. Org. Chem. 2016. Vol. 81.
39. Abdrakhmanova L.M., Mironov V.F., Baronova T.A.,
N 14. P. 5837. doi 10.1021/acs.joc.6b00356
Dimukhametov M.N., Krivolapov D.B., Litvinov I.A.,
50. Khasiyatullina N.R., Mironov V.F., Krivolapov D.B.,
Balandina A.A., Latypov Sh.K., Konovalov A.I. //
Mironova E.V., Gnezdilov O.I. // RSC Adv. 2016.
Mendeleev Commun. 2006. Vol. 16. N 6. P. 320. doi
Vol. 6. N 89. P. 85745. doi 10.1039/c6ra17983e
10.1070/MC2006v016n06ABEH002414
51. Пудовик А.Н., Гурьянова И.В., Бандерова Л.В., Ро-
40. Abdrakhmanova L.M., Mironov V.F., Dimukhame-
манов Г.В. // ЖОХ. 1968. Т. 38. Вып. 1. С. 143; Pudo-
tov M.N., Krivolapov D.B., Litvinov I.A. // Mendeleev
vik A.N., Gur’yanova I.V., Banderova L.V., Roma-
Commun. 2010. Vol. 20. N 1. P. 41. doi 10.1016/j.
nov G.V. // J. Gen. Chem. USSR. 1968. Vol. 38. N 1.
mencom.2010.01.016
P. 142.
41. Abdrakhmanova L.M., Мironov V.F., Gryaznova T.P.,
52. Пудовик А.Н., Коновалова И.В., Романов Г.В., Фице-
Katsyuba S.A., Dimukhametov M.N. // Phosphorus, Sul-
ва Р.Г., Бурмистрова Н.П. // ЖОХ. 1973. Т. 43. № 1.
fur, Silicon, Relat. Elem. 2011. Vol. 186. N 4. P. 652. doi
С. 41; Pudovik A.N., Konovalova I.V., Romanov G.V.,
10.1080/10426507.2010.521434
Fitseva R.G., Burmistrova N.P. // J. Gen. Chem. USSR.
42. Миронов В.Ф., Баронова Т.А., Миронова Е.В., Ди-
1973. Vol. 43. N 1. P. 38.
мухаметов М.Н., Криволапов Д.Б., Абдрахмано-
53. Романов Г.В., Ягфаров М.Ш., Коновалов А.И., Пу-
ва Л.М. // ЖОрХ. 2015. Т. 51. Вып. 3. С. 415; Miro-
довик А.Н., Коновалова И.В., Юсупова Т.Н. // ЖОХ.
nov V.F., Baronova T.A., Mironova E.V., Dimukhame-
1973. Т. 43. Вып. 11. С. 2378; Romanov G.V., Yagfa-
tov M.N., Krivolapov D.B., Abdrakhmanova L.M. //
rov M.Sh., Konovalov A.I., Pudovik A.N., Konovalo-
Russ. J. Org. Chem. 2015. Vol. 51. No 3. P. 401. doi
va I.V., Yusupova T.N. // J. Gen. Chem. USSR. 1973.
10.1134/S1070428015030203.
Vol. 43. N 11. P. 2363.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 11 2020
ПАР
АЛЛЕЛЬНОЕ ОБРАЗОВАНИЕ ПЕНТААЛКОКСИФОСФОРАНОВ
1717
54. Romanov G.V., Fitseva R.G., Konovalova I.V., Pudo-
J. Gen. Chem. 2006. Vol. 76. N 6. P. 906. doi 10.1134/
vik A.N., Burmistrova N.P. // J. Therm. Anal. 1974.
S1070363206060107
Vol. 6. N 1. P. 119.
64. Ferao A.E. // Inorg. Chem. 2018. Vol. 57. N 14. P. 8058.
55. Офицеров Е.Н., Миронов В.Ф., Синяшина Т.Н.,
doi 10.1021/acs.inorgchem.7b02816
Чернов А.Н., Ильясов А.В., Коновалова И.В., Пудо-
65. Ramirez F., Nagabhushanam M., Smith C. // Tetrahe-
вик А.Н. // Докл. АН СССР. 1989. Т. 306. № 1. С. 122;
dron. 1968. Vol. 24. N 4. P. 1785. doi 10.1016/S0040-
Ofitserov E.N., Mironov V.F., Sinyashina T.N., Cher-
4020(01)82484-4
nov A.N., Konovalova I.V., Il’yasov A.V., Pudovik A.N. //
66. Овчинников В.В., Сафина Ю.Г., Черкасов Р.А. //
Doklady. Chem. 1989. Vol. 306. N 1-3. P. 146.
ЖOX. 1990. Т. 60. Вып. 5. С. 997; Ovchinnikov V.V.,
56. Bartle K.D., Edmundson R.S., Jones D.W. // Tetra-
Safina Yu.G., Cherkasov R.A. // J. Gen. Chem. USSR.
hedron. 1967. Vol. 23. N 4. P. 1701. doi 10.1016/S0040-
1990. Vol. 60. N 5. P. 878.
4020(01)82569-2
67. Kumara Swamy K.C., Said M.A., Kumaraswamy S.,
57. Edmundson R.S., Mitchell E.W. // J. Chem. Soc. (C).
Herbst-Irmer R., Pülm M. // Polyhedron. 1998. Vol. 17.
1968. N 16. P. 2091. doi 10.1039/J39680002091
N 20. P. 2532. doi 10.1016/S0277-5387(98)00160-0.
58. Majoral J.P., Navech J. // Compt. Rend. Acad. Sci. (C).
68. Edmundson R.S. // Chem. Ind. (London). 1965. N 27.
1969. Vol. 268. N 24. P. 2117.
P. 1220.
59. Hall L.D., Malcolm R.B. // Canad. J. Chem. 1972.
69. Konig T., Habicher W.D., Hahner U., Pionteck J.,
Vol. 50. N 13. P. 2092. doi 10.1139/v72-336
Ruger C., Schwetlick K. // J. Prakt. Chem.- Chem.-Zeit.
60. Yu J.H., Sopchik A.E., Arif A.M., Bentrude W.G. // J.
1992. Bd 334. H. 4. S. 333. doi 10.1002/
Org. Chem. 1990. Vol. 55. N 11. P. 3444. doi 10.1021/
prac.19923340407
jo00298a009
70. Yu J., Sopchik A.E., Arif A.M., Bentrude W.G., Röschen-
61. Yu J.H., Arif A.M., Bentrude W.G. // J. Am. Chem. Soc.
thaler G.V. // Heteroatom Chem. 1991. Vol. 2. N 1.
1990. Vol. 112. N 21. P. 7451. doi 10.1021/ja00177a002
62. Skowrońska A., Kowara J., Kamiński R., Bujacz G.,
P. 177. doi 10.1002/hc.520020120
Wieczorek M.W. // J. Org. Chem. 2000. Vol. 65. N 2.
71. Овчинников В.В., Сафина Ю.Г., Черкасов Р.А., Ка-
P. 304. doi 10.1021/jo990921w
ратаева Ф.Х., Пудовик А.Н. // ЖОХ. 1988. Т. 58.
63. Аминова Р.М., Шамов Г.А., Савостина Л.И., Миро-
Вып. 9. С. 2066; Ovchinnikov V.V., Safina Yu.G., Cher-
нов В.Ф. // ЖОХ. 2006. Т. 76. Вып. 6. C. 946; Aminova
kasov R.A., Karataeva F.Kh., Pudovik A.N. // J. Gen.
R.M., Shamov G.A., Savostina L.I., Mironov V.F. // Russ.
Chem. USSR. 1988. Vol. 58. N 9. P. 1841.
Simultaneous Formation of Cage and Spirane
Pentaalcoxyphosphoranes in Reaction of 5,5-Dimethyl-
2-(2-oxo-1,2-diphenylethyloxy)-1,3,2-dioxaphosphorinane
with Hexafluoroacetone
V. F. Mironova,b,*, M. N. Dimukhametova, Ya. S. Blinovab, and F. Kh. Karataevab
a Arbuzov Institute of Organic and Physical Chemistry, Federal Research Center “Kazan Scientific Center of the Russian
Academy of Sciences”, Kazan, 420088 Russia
bKazan (Volga Region) Federal University, Kazan, 420008 Russia
*e-mail: mironov@iopc.ru
Received June 29, 2020; revised June 29, 2020; accepted July 9, 2020
The reaction of hexafluoroacetone with 5,5-dimethyl-2-(2-oxo-1,2-diphenylethyloxy)-1,3,2-dioxaphosphorinane
occurs in two simultaneous directions: through the formation of cage phosphorane and spirophosphorane -
1,1-(2,2-dimethylpropylenedioxy)-4,5-diphenyl-3,3-bis(trifluoromethyl)-2,6,7-trioxa-1-phosphabicyclo-
[2.2.11.4]heptane and 2-(2,2-dimethylpropylenedioxy)-2-hexafluoroisopropoxy-4,5-diphenyl-1,3,2-dioxaphos-
pholene, respectively. The latter was obtained by authentic synthesis from 2-hexafluoroisopropoxy-5,5-di-
methyl-1,3,2-dioxaphosphorinane and benzil. The mild hydrolysis of the compounds obtained leads to the
formation of cyclic phosphates. The structure of the obtained compounds was determined by the NMR and
mass spectrometry methods.
Key words: dioxaphosphorinane, hexafluoroacetone, cage phosphorane, PCO/POC-rearrangement, spirophos-
phorane, hydrolysis, phosphate.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 11 2020