ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2020, том 90, № 11, с. 1718-1723
УДК 547.1:547.794.3
СИНТЕЗ И ФУНКЦИОНАЛИЗАЦИЯ
5-АЛКИЛ-6-МЕТИЛ-2-ТИОУРАЦИЛОВ
© 2020 г. А. А. Бабушкинаa,b, Д. М. Егоровb,*, К. И. Каскевичb
a Санкт-Петербургский государственный университет, Санкт-Петербург, 199034 Россия
b Санкт-Петербургский государственный технологический институт (технический университет),
Московский пр. 26, Санкт-Петербург, 190013 Россия
*e-mail: diavoly@mail.ru
Поступило в Редакцию 18 августа 2020 г.
После доработки 18 августа 2020 г.
Принято к печати 29 августа 2020 г.
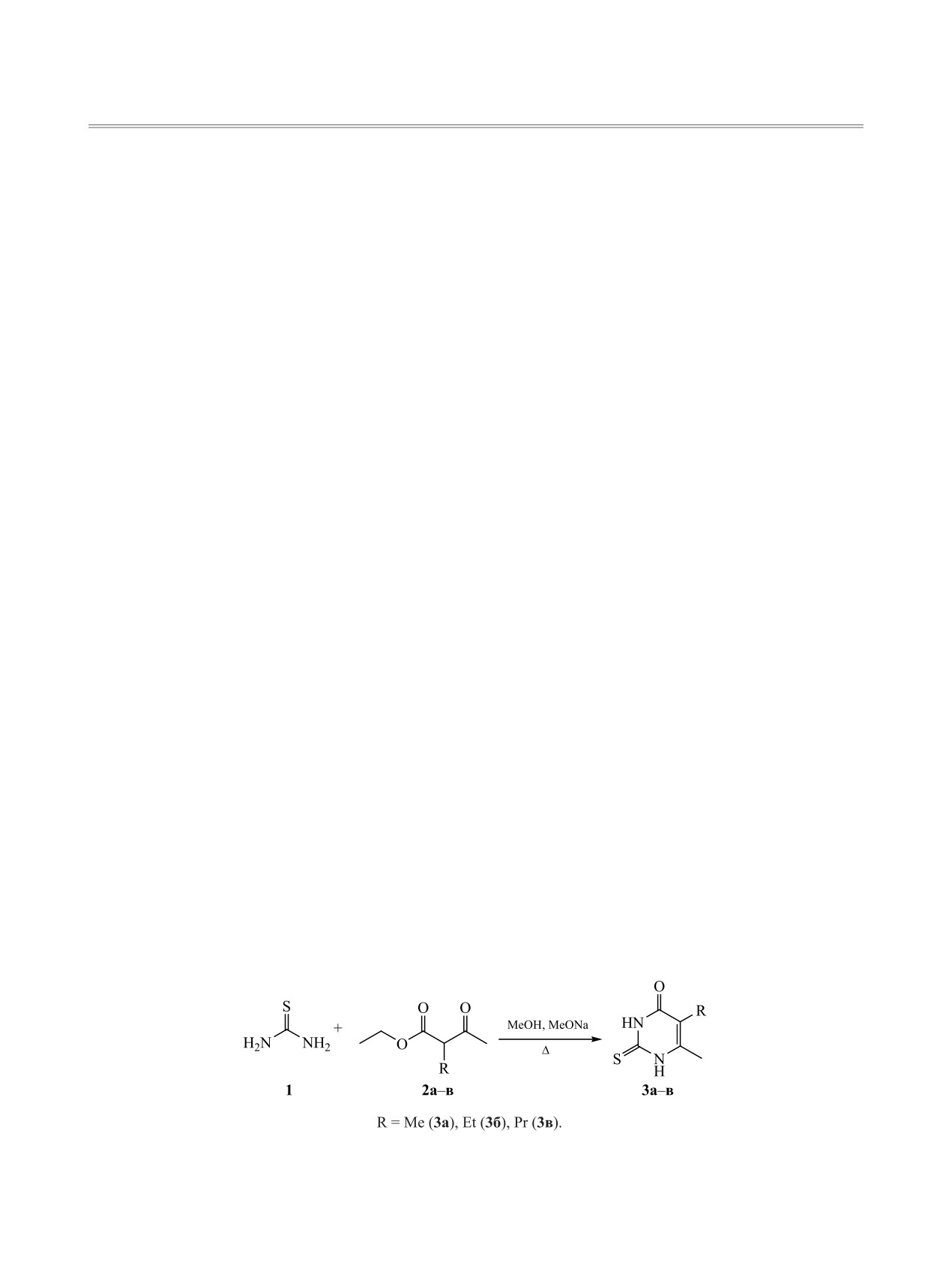
Получен ряд 5-алкил-6-метил-2-тиоурацилов, дальнейшим введением которых в реакцию с диал-
килхлорэтинфосфонатами синтезтрованы новые диалкиловые эфиры (6-алкил-5-оксо-7-метил-5Н-тиа-
золо[3,2-а]пиримидин-3-ил)фосфоновой кислоты.
Ключевые слова: хлорэтинфосфонат, 2-тиоурацил, фосфорилирование, тиазоло[3,2-a]пиримидины
DOI: 10.31857/S0044460X20110116
Пиримидиновое кольцо входит в состав многих
мидиновый фрагмент фосфонатной группировки
лекарственных препаратов: иммуностимуляторов
может расширить спектр проявляемых видов био-
(метилурацил), барбитуратов (фенобарбитал, гек-
логической активности.
сенал), противовирусных средств (лавимудин),
Основным методом получения производных
противоопухолевых препаратов (фторурацил, до-
тиазолопиримидинов является конденсация
пан). Широкий спектр биологической активно-
1,2,3,4-тетрагидропиримидин-2-тионов с 1,2-ди-
сти приводит к активному росту исследований,
электрофилами: галогенкетонами,
1,2-дигало-
направленных на модификацию пиримидинового
геналканами и α-галогенкарбоновыми кислота-
кольца. Одними из наиболее изучаемых произво-
ми [10-12]. Альтернативным подходом является
дных пиримидинов являются тиазоло[3,2-a]пи-
синтез с использованием галогеналкинов, за-
римидины. Данный класс соединений проявляет
ключительной стадией в этом методе является 5-
широкий спектр биологической активности: им-
эндо-диг-циклизация, приводящая к целевым
муномодулирующую
[1,2], противоопухолевую
структурам [13].
[3-5], антибактериальную [6, 7], психотропную
[8, 9]. К препаратам тиазолопиримидинового ряда,
Исходные 5-алкил-6-метил-2-тиоурацилы по-
которые используются в медицинской практике,
лучены по стандартной методике синтеза про-
относятся иммуномодулятор левамизол [2], пре-
изводных
6-метил-2-тиоурацила: конденсацией
параты антипсихотического действия ритансерин
тиомочевины с
2-алкилэтилацетоацетатом при
[8, 9] и сетопероном [9]. Введение в тиазолопири-
кипячении в течении 12-18 ч в метаноле в присут-
Схема 1.
1718
СИНТЕЗ И ФУНКЦИОНАЛИЗАЦИЯ 5-АЛКИЛ-6-МЕТИЛ-2-ТИОУР
АЦИЛОВ
1719
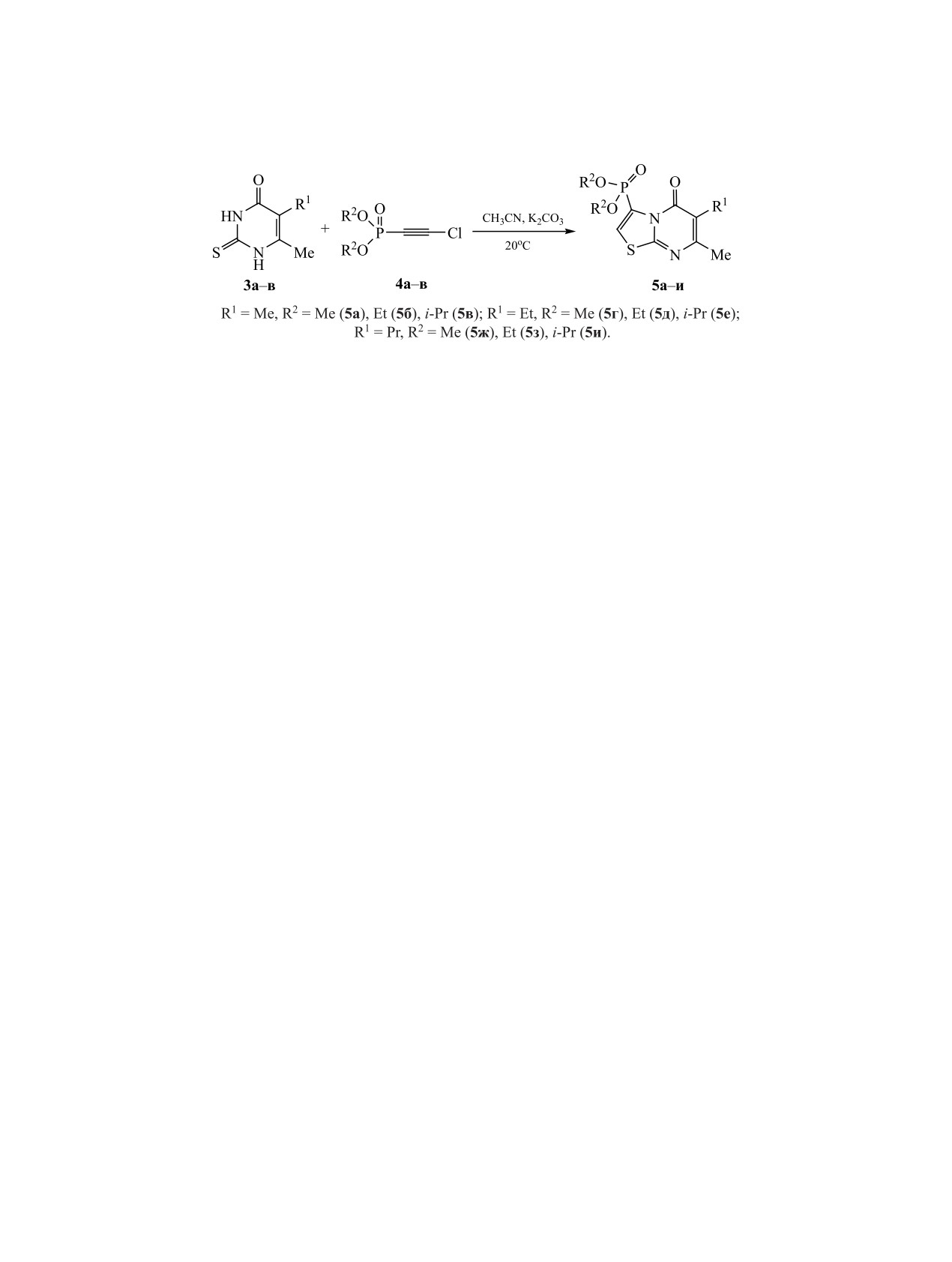
Схема 2.
ствии метилата натрия [14] (схема 1).
Известно, что 5-алкил-6-метил-2-тиоурацилы
3а-в имеют четыре нуклеофильных центра: два
Полученные нами 5-алкил-6-метил-2-тиоура-
атома азота N1 и N3, атом серы и атом кислорода.
цилы 3а-в могут существовать в виде нескольких
По литературным данным [15], наиболее нукле-
таутомерных форм, что обусловлено подвижно-
офильным является атом серы, меньшей нукле-
стью протонов у атомов азота в пиримидиновом
офильностью обладают атомы азота, кислород
кольце. Согласно литературными данным [15-18],
практически не проявляет основных свойств. Сле-
наиболее термодинамически стабильной являет-
довательно, можно предполагать на первом этапе
ся форма 2-тиоксо-2,3-дигидропиримидин-4(1H)-
атаку диалкилхлорэтинфосфоната по тионному
онов. Данные спектроскопии ЯМР соединений
атому серы и дальнейшее протекание циклиза-
3а-в подтверждают предположение о их суще-
ции с участием как атома азота N3 с образованием
ствовании в форме тионного таутомера. В част-
5-оксо-изомера, так и с участием атома азота N1 с
ности, в спектрах ЯМР 1H присутствуют слабо-
образованием 7-оксо-изомера. В случае образова-
польные синглетные сигналы двух NH-групп при
ния двух изомеров в реакционной массе в спектре
12.06-12.10 и 12.28-12.31 м. д. В спектре ЯМР
ЯМР 31Р должно бы было наблюдаться два харак-
13С имеются сигналы атомов углерода тионной и
терных сигнала, но этого не происходит. Только в
карбонильной групп при 174.11-177.44 и 161.59-
случае реакций диметилхлорэтинфосфоната 4а с
162.06 м. д. соответственно.
5-алкил-6-метил-2-тиоурацилами 3а-в в спектрах,
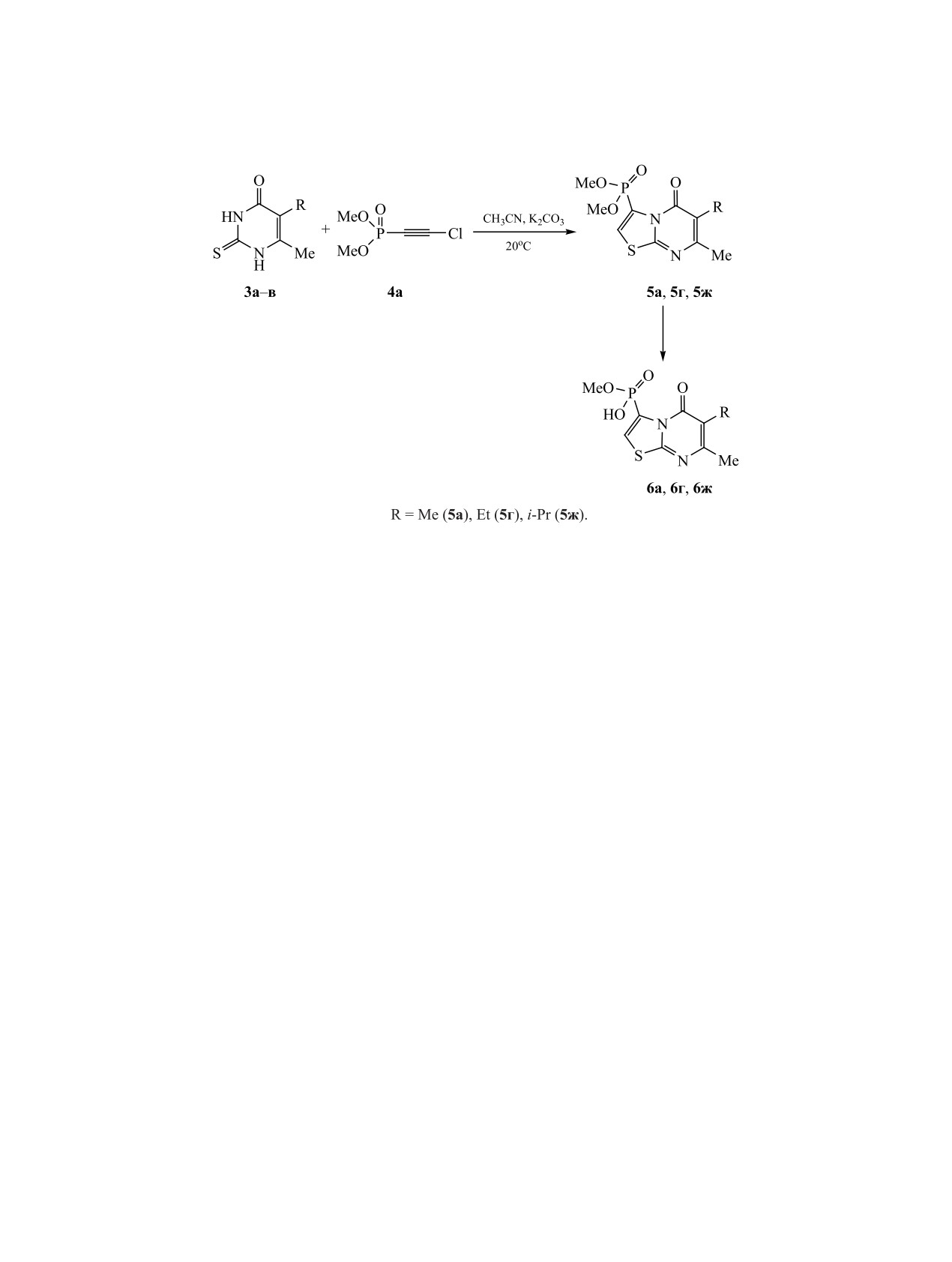
Ранее в работах [19, 20] была показана высо-
действительно, наблюдаются два сигнала при
кая эффективность использования диалкилхлор-
4.36-4.47 и 2.48-2.51 м. д., первый из которых со-
этинфосфонатов для получения конденсирован-
ответствует продуктами реакции 5а, 5г, 5ж, а вто-
ных структур в реакциях с гетероциклическими
рой, регистрирующийся в более сильном поле, -
N,S-бинуклеофилами. Новые неописанные в лите-
продуктам монодезалкилирования диметоксифос-
ратуре конденсированные тиазоло[3,2-a]пирими-
фонатной группы 6а, 6г, 6ж, которые образуют-
дины 5а-и были получены с высокими выходами
ся из соединений 5а, 5г, 5ж с течением времени
взаимодействием 5-алкил-6-метил-2-тиоурацилов
(схема 3).
3а-в с диалкилхлорэтинфосфонатами 4а-в с вы-
Согласно данным ЯМР 31Р, при взаимодействии
ходами 51-86% (схема 2).
диалкилхлорэтинфосфонатов 4б, в с 5-алкил-6-ме-
Реакцию проводили в условиях работ [19, 20]:
тил-2-тиоурацилами 3а-в образуется лишь один
при интенсивном перемешивании эквивалентных
продукт - 5-оксо изомера, химический сдвиг фос-
количеств исходных реагентов 3а-в и 4а-в в сре-
фора которого лежит в области -0.82-1.44 м. д. Де-
де безводного ацетонитрила в присутствии 1 экв.
залкилирование в этом случае не протекает.
карбоната калия при комнатной температуре. Вре-
Строение полученных соединений устанавле-
мя полного протекания реакции составляло 2-3 ч.
но по данным спектроскопии ЯМР 1Н, 13С, 31Р. В
Ход реакции контролировали методом спектро-
спектре ЯМР 31P соединений 5а-и присутству-
скопии ЯМР 31Р, окончание реакции определяли
ют сигналы в сильном поле δP -0.82-4.47 м. д. В
по полному исчезновению сигнала исходного ди-
спектре ЯМР 1Н в слабом поле 7.68-8.07 м. д. на-
алкилхлорэтинфосфоната 4а-в.
блюдается характерный сигнал протона у sp2-ги-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 11 2020
1720
БАБУШКИНА и др.
Схема 3.
бридизованного атома углерода с небольшой кон-
на частотах 400.17 (1H), 100.62 (13C), 161.98 МГц
стантой спин-спинового взаимодействия (КССВ) с
(31P). Температуры плавления измеряли на сто-
ядром фосфора, 3JHP = 6.0-7.8 Гц. В спектрах ЯМР
лике Кофлера (VEB Wägetechnik Rapido, PHMK
13С олефиновые углероды резонируют дублет-
81/2969).
ными сигналами при 126.75-129.41 м. д. с боль-
Общая методика получения соединений 3а-в.
шой КССВ 1JCP = 213.1-226.0 Гц и при 125.21-
К раствору 0.02 моль метилата натрия в 20 мл аб-
121.98 м. д. с меньшей КССВ с ядром фосфора
солютированного метанола добавляли 0.02 моль
2JCP = 13.6-16.4 Гц. Дополнительно подтвердить
тиомочевины и 0.02 моль соответствующего 2-ал-
образование 5-оксо-изомера можно на основании
килэтилацетоацетата. Смесь кипятили в течение
анализа спектров ЯМР 13C. Так в случае 7-оксо-и-
12-18 ч при постоянном перемешивании. После
зомера в пиримидиновом фрагменте сигналы ато-
охлаждения смесь выливали в ледяную воду и
мов углерода N-C=C-C=O сближены и регистри-
подкисляли концентрированной соляной кислотой
руются в области 120-135 м. д., в то время как в
до кислой реакции среды. Осадок отфильтровыва-
случае 5-оксо-изомера данные сигналы сильно
ли на фильтре Шотта, промывали этанолом и пере-
разнесены, и сигнал атома углерода, связанного с
кристаллизовывали из этилового спирта.
азотом, наблюдается в области 150-160 м. д. Сиг-
5,6-Диметил-2-тиоурацил (3а). Выход 56%,
нал другого атом углерода регистрируется в обла-
бесцветные кристаллы, т. пл. 278–280°С (этанол).
сти 110-120 м. д. На основании этого, мы относим
Спектр ЯМР 1H (ДМСО-d6), δ, м. д.: 1.75 с (3H,
полученные соединения именно к диалкил-(6-ал-
CH3), 2.10 с (3H, CH3), 12.10 с (1H, NH), 12.31 с
кил-7-метил-5-оксо-5H-тиазоло[3,2-a]пирими-
(1H, NH). Спектр ЯМР 13C (ДМСО-d6), δС, м. д.:
дин-3-ил)фосфонатам.
10.12 (CH3), 16.44 (CH3), 110.69 (C-C=O), 148.58
Таким образом, установлено, что реакция
(HN-C-CH3), 162.06 (C=O), 174.11 (C=S).
хлорэтинфосфонатов с 5-алкил-6-метил-2-тиоура-
цилами протекает хемо- и региоселективно с обра-
6-Метил-5-этил-2-тиоурацил
(3б). Выход
зованием диалкил-(6-алкил-7-метил-5-оксо-5H-ти-
59%, бесцветные кристаллы, т. пл. 215-216°С (эта-
азоло[3,2-a]пиримидин-3-ил)фосфонатов.
нол). Спектр ЯМР 1H (ДМСО-d6), δ, м. д.: 0.93 т
(3H, CH3СН2, 3JHH = 7.4 Гц), 2.12 с (3H, CH3), 2.25
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
к (2H, CH3СН2, 3JHH = 7.4 Гц), 12.06 с (1H, NH),
Спектры ЯМР на ядрах 1Н, 13С, 31Р сняты на
12.28 с (1H, NH). Спектр ЯМР 13C (ДМСО-d6), δС,
спектрометре Bruker Avance III HD 400 NanoBay
м. д.: 13.31 (CH3CH2), 15.87 (CH3), 17.85 (CH3CH2),
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 11 2020
СИНТЕЗ И ФУНКЦИОНАЛИЗАЦИЯ 5-АЛКИЛ-6-МЕТИЛ-2-ТИОУР
АЦИЛОВ
1721
116.57 (C-C=O),
148.36 (HN-C-CH3),
161.59
(N=CS, 3JСР = 10.2 Гц). Спектр ЯМР 31Р (CDCl3):
(C=O), 174.29 (C=S).
δР 1.44 м. д.
6-Метил-5-пропил-2-тиоурацил (3в). Выход
Диизопропил-(6,7-диметил-5-оксо-5H-тиазо-
51%, бесцветные кристаллы, т. пл. 211-212°С
ло[3,2-a]пиримидин-3-ил)фосфонат (5в). Выход
(этанол). Спектр ЯМР 1H (ДМСО-d6), δ, м. д.: 0.86
81%, бесцветные кристаллы, т. пл. 123°С. Спектр
т (3H, CH3СH2, 3JHH = 8.0 Гц), 1.30-1.40 м (2H,
ЯМР 1H (CDCl3), δ, м. д.: 1.27 д [6H, POСН(CH3)2,
CH3CH2, 3JHH = 8.0 Гц), 2.11 с (3H, CH3), 2.21 т
3JHH = 6.2 Гц], 1.32 д [6H, POСН(CH3)2, 3JHH =
(2H, СH3CH2CH2, 3JHH = 8.0 Гц), 12.07 с (1H, NH),
6.2 Гц], 2.03 с (3H, CH3), 2.31 с (3H, CH3), 4.79-
12.29 с (1H, NH). Спектр ЯМР 13C (ДМСО-d6), δС,
4.88 д. септ (2H, POСН, 3JHH = 6.2, 3JHP = 12.5 Гц),
м. д.: 13.86 (CH3СH2), 16.61 (CH3), 21.25 (CH3CH2),
8.02 д (1H, CH=CP, 3JHP = 7.6 Гц). Спектр ЯМР 13C
31.24 (CH3CH2CH2), 109.29 (C-C=O), 151.37 (HN-
(CDCl3), δС, м. д.: 11.51 (CH3), 22.22 (СН3), 23.91 д
C-CH3), 161.63 (C=O), 177.44 (C=S).
[POСН(CH3)2, 3JСР = 4.7 Гц], 24.41 д [POСН(CH3)2,
2JСР = 4.7 Гц], 72.34 д (POCH, 2JСР = 6.3 Гц), 112.03
Общая методика получения соединений
5а-и. Смесь 0.001 моль соответствующего диал-
(C-С=О), 127.80 д (CH=CP, 2JСР = 14.1 Гц), 128.12
д (CH=CP, 1JСР = 220.6 Гц), 158.58 (CH3СN), 159.03
килхлорэтинфосфоната 4a-в, 0.001 моль соот-
(C=O), 159.80 д (N=CS, 3JСР = 9.6 Гц). Спектр ЯМР
ветствующего 2-тиоурацила 3a-в и 0.0012 моль
31Р (CDCl3): δP -0.79 м. д.
карбоната калия в 10 мл безводного ацетонитрила
интенсивно перемешивали при комнатной тем-
Диметил-(6-этил-7-метил-5-оксо-5H-тиазоло-
пературе в течение 2-3 ч. Степень протекания
[3,2-a]пиримидин-3-ил)фосфонат
(5г). Выход
реакции контролировали методом ЯМР 31P. По
65%, бесцветные кристаллы, т. пл. 112°С. Спектр
окончании реакции смесь фильтровали. Фильтрат
ЯМР 1H (CDCl3), δ, м. д.: 1.05 т (3H, CH3СН2, 3JHH =
упаривали в вакууме, остаток перекристаллизовы-
7.5 Гц), 2.31 с (3H, CH3СN), 2.56 к (2H, CH3CH2,
вали из этилацетата.
3JHH = 7.5 Гц), 3.89 д (6H, POCH3, 3JHP = 11.6 Гц),
7.68 д (1H, CH=CP, 3JHP = 7.8 Гц). Спектр ЯМР 13C
Диметил-(6,7-диметил-5-оксо-5H-тиазоло-
(CDCl3), δС, м. д.: 12.66 (CH3СН2), 19.17 (СН3СN),
[3,2-a]пиримидин-3-ил)фосфонат
(5а). Выход
66%, бесцветные кристаллы, т. пл. 134°С. Спектр
21.38 (CH3CH2), 54.33 д (POCH3, 2JСР = 6.2 Гц),
118.89 (C-С=О), 126.12 д (CH=CP, 2JСР = 13.8 Гц),
ЯМР 1H (CDCl3), δ, м. д.: 2.13 с (3H, CH3С-N),
126.75 д (CH=CP, 1JСР = 225.8 Гц), 158.58 (CH3СN),
2.36 c (3H, CH3), 3.96 д (6H, POCH3, 3JHP =11.6 Гц),
158.77 д (N=CS, 3JСР = 10.3 Гц), 158.84 (C=O).
7.73 д (1H, CH=CP, 3JHP =7.8 Гц). Спектр ЯМР 13C
Спектр ЯМР 31Р (CDCl3): δР 4.36 м. д.
(CDCl3), δС, м. д.: 11.36 (CH3), 22.06 (СН3), 54.39
д (POCH3, 2JСР = 6.1 Гц), 113.16 (C-C=О), 126.19
Диэтил-(6-этил-7-метил-5-оксо-5H-тиазоло-
д (CH=CP, 2JСР = 13.8 Гц), 126.79 д (CH=CP, 1JСР =
[3,2-a]пиримидин-3-ил)фосфонат
(5д). Выход
226.0 Гц), 158.68 д (N=CS, 3JСР = 9.9 Гц), 159.06
79%, бледно-желтые кристаллы, т. пл.
78°С.
(CH3СN), 159.29 (C=O). Спектр ЯМР 31Р (CDCl3):
Спектр ЯМР 1H (CDCl3), δ, м. д.: 1.14 т (3H,
δР 4.45 м. д.
CH3СН2, 3JHH = 7.5 Гц), 1.40 т (6H, POСН2CH3,
3JHH = 7.1 Гц), 2.39 с (3H, CH3СN), 2.65 к (2H,
Диэтил-(6,7-диметил-5-оксо-6-пропил-
CH3CH2, 3JHH = 7.5 Гц), 4.38 д. к (4H, POСН2, 3JHH =
5H-тиазоло[3,2-a]пиримидин-3-ил)фосфонат
7.1, 3JHP = 14.1 Гц), 7.70 д (1H, CH=CP, 3JHP =
(5б). Выход 79%, желтые кристаллы, т. пл. 82°С.
7.7 Гц). Спектр ЯМР 13C (CDCl3), δС, м. д.: 12.74
Спектр ЯМР 1H (CDCl3), δ, м. д.: 1.42 т (6H,
(CH3СН2), 16.45 д (POСН2CH3, 3JСР = 6.6 Гц), 19.29
POСН2CH3, 3JHH = 6.8 Гц), 2.17 с (3H, CH3), 2.40 с
(СН3СN), 21.40 (CH3CH2), 63.93 д (POCH2, 2JСР =
(3H, CH3), 4.39 д. к (4H, POСН2, 3JHH = 6.8, 3JHP =
6.2 Гц), 119.05 (C-С=О), 125.41 д (CH=CP, 2JСР =
12.4 Гц), 7.72 д (1H, CH=CP, 3JHP = 6.0 Гц). Спектр
13.6 Гц), 128.15 д (CH=CP, 1JСР = 223.3 Гц), 158.61
ЯМР 13C (CDCl3), δС, м. д.: 11.37 (CH3), 16.46 д
(CH3СN), 158.61 (C=O), 159.02 д (N=CS, 3JСР =
(POСН2CH3, 3JСР = 5.9 Гц), 21.71 (СН3), 64.02 д
(POCH2, 2JСР = 5.3 Гц), 113.16 (C-С=О), 125.95 д
10.1 Гц). Спектр ЯМР 31Р (CDCl3): δР 1.51 м. д.
(CH=CP, 2JСР = 14.4 Гц), 128.04 д (CH=CP, 1JСР =
Диизопропил-(6-этил-7-метил-5-оксо-5H-тиа-
213.1 Гц), 158.291 (CH3СN), 158.65 (C=O), 158.98 д
золо[3,2-a]пиримидин-3-ил)фосфонат
(5е).
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 11 2020
1722
БАБУШКИНА и др.
Выход 83%, бесцветные кристаллы, т. пл. 117°С.
(5и). Выход 86%, бледно-желтые кристаллы, т. пл.
Спектр ЯМР 1H (CDCl3), δ, м. д.: 1.11 т (3H,
89°С. Спектр ЯМР 1H (CDCl3), δ, м. д.: 0.99 т (3H,
CH3СН2, 3JHH = 7.5 Гц), 1.33 д [6H, POСН(CH3)2,
CH3СН2, 3JHH = 7.5 Гц), 1.35 д [6H, POСН(CH3)2,
3JHH = 6.2 Гц], 1.41 д [6H, POСН(CH3)2, 3JHH =
3JHH = 6.2 Гц], 1.43 д [6H, POСН(CH3)2, 3JHH =
6.2 Гц], 2.37 с (3H, CH3СN), 2.52 к (2H, CH3CH2,
6.2 Гц], 1.56 гекс (2H, CH3CH2CH2, 3JHH = 7.5 Гц),
3JHH = 7.5 Гц), 5.03 д. септ (2H, POСН, 3JHH =
2.38 с (3H, CH3СN), 2.59 т (2H, CH3CH2СН2, 3JHH =
6.2, 3JHP = 12.6 Гц), 7.69 д (1H, CH=CP, 3JHP =
7.5 Гц), 5.05 д. септ (2H, POСН,3JHH = 6.2, 3JHP =
7.7 Гц). Спектр ЯМР 13C (CDCl3), δС, м. д.: 12.77
12.7 Гц), 7.71 д (1H, CH=CP, 3JHP = 7.7 Гц). Спектр
(CH3СН2), 19.33 (СН3СN), 21.35 (CH3CH2), 23.81 д
ЯМР 13C (CDCl3), δС, м. д.: 14.13 (CH3СН2), 21.62
[POСН(CH3)2, 3JСР = 4.7 Гц], 24.26 д [POСН(CH3)2,
(СН3СN),
21.64
(CH3CH2CH2),
23.80
д
3JСР = 4.7 Гц], 72.81 д (POCH, 2JСР = 6.3 Гц), 119.05
[POСН(CH3)2, 3JСР = 4.7 Гц], 24.26 д [POСН(CH3)2,
(C-С=О), 125.24 д (CH=CP, 2JСР = 13.7 Гц), 129.37
3JСР = 4.7 Гц], 27.93 (CH3CH2CH2), 72.79 д (POCH,
д (CH=CP, 1JСР = 221.6 Гц), 158.29 (CH3СN), 158.50
2JСР = 6.2 Гц), 117.68 (C-С=О), 125.21 д (CH=CP,
(C=O), 159.26 д (N=CS, 3JСР = 9.7 Гц). Спектр ЯМР
2JСР = 13.6 Гц), 129.41 д (CH=CP, 1JСР = 221.1 Гц),
31Р (CDCl3): δP -0.82 м. д.
158.65 (CH3СN), 158.66 (C=O), 159.28 д (N=CS,
Диметил-(7-метил-5-оксо-6-пропил-5H-тиа-
3JСР = 9.8 Гц). Спектр ЯМР 31Р (CDCl3): δP -0.77 м. д.
золо[3,2-a]пиримидин-3-ил)фосфонат (5ж). Вы-
ход 51%, бесцветные кристаллы, т. пл. 73°С. Спектр
ФОНДОВАЯ ПОДДЕРЖКА
ЯМР 1H (CDCl3), δ, м. д.: 0.98 т (3H, CH3СН2,
Работа выполнена в рамках базовой части го-
3JHH = 7.4 Гц), 1.52 гекс (2H, CH3CH2CH2, 3JHH =
сударственного задания Министерства науки и
7.4 Гц), 2.28 с (CH3СN), 2.57 т (2H, CH2CH2CH3,
высшего образования (№ 785.00.Х6019) с исполь-
3JHH = 7.4 Гц), 3.98 д (6H, POCH3, 3JHP = 11.6 Гц),
зованием оборудования Инжинирингового центра
7.72 д (1H, CH=CP, 3JHP = 7.6 Гц). Спектр ЯМР 13C
Санкт-Петербургского государственного техноло-
(CDCl3), δC, м. д.: 14.20 (CH3СН2), 21.46 (СН3СN),
21.61 (CH3CH2CH2), 27.96 (CH3CH2CH2), 54.37 д
гического института при финансовой поддержке
(POCH3, 2JСР = 6.2 Гц), 119.13 (C-С=О), 126.00 д
Российского фонда фундаментальных исследова-
(CH=CP, 2JСР = 13.8 Гц), 127.87 д (CH=CP, 1JСР =
ний (грант № 19-03-00365).
222.2 Гц), 157.66 (CH3СN), 159.21 (C=O), 159.45 д
КОНФЛИКТ ИНТЕРЕСОВ
(N=CS, 3JСР = 10.6 Гц). Спектр ЯМР 31Р (CDCl3): δP
4.47 м. д.
Авторы заявляют об отсутствии конфликта
интересов.
Диэтил-(7-метил-5-оксо-6-пропил-5H-тиазо-
ло[3,2-a]пиримидин-3-ил)фосфонат (5з). Выход
СПИСОК ЛИТЕРАТУРЫ
83%, бледно-желтые кристаллы, т. пл.
95°С.
1. Briel D., Holzer M., Leistner S., Droessler K., Dobner B. //
Спектр ЯМР 1H (CDCl3), δ, м. д.: 0.93 т (3H,
Pharmazie. 2003. Vol. 58. P. 759.
CH3СН2, 3JHH = 7.3 Гц), 1.47 т (6H, POСН2CH3,
2. Husz H., Berko D., Kenderessy S. // Dermatol.
3JHH = 7.1 Гц), 1.47 гекс (2H, CH3CH2CH2, 3JHH =
Monatschr. 1979. Vol. 165. P. 569 - 574.
7.3 Гц), 2.32 с (CH3СN), 2.48 т (2H, CH2CH2CH3,
3. Shin N., Li Y.-L., Mei S., Wang K.H., Hall L., Katiyar K.,
3JHH = 7.3 Гц), 4.20 д. к (4H, POСН2,3JHH = 7.1,
Wang Q., Yang G., Rumberger B., Leffet L., He X.,
3JHP = 14.2 Гц), 8.07 д (1H, CH=CP, 3JHP = 7.6 Гц).
Rupar M., Bowman K., Favata M., Li J., Liu M., Li Y.,
Спектр ЯМР 13C (CDCl3), δС, м. д.: 14.40 (CH3СН2),
Covington M., Koblish H., Soloviev M., Shuey D.,
16.65 д (POСН2CH3, 3JСР = 6.2 Гц), 21.61 (СН3СN),
Burn T., Diamond S., Fridman J., Combs A., Yao W.,
21.84 (CH3CH2CH2), 27.79 (CH3CH2CH2), 63.71 д
Yeleswaram S., Hollis G., Vaddi K., Huber R., Newton R.,
(POCH2, 2JСР = 6.1 Гц), 116.41 (C-С=О), 126.92 д
Scherle P.J. // Pharmacol. Exp. Ther. 2018. Vol. 364.
(CH=CP, 1JСР = 216.7 Гц), 126.94 д (CH=CP, 2JСР =
P. 120. doi 10.1124/jpet.117.244947
16.4 Гц), 158.45 (CH3СN), 159.18 (C=O), 159.83 д
4. Abdo N.Y.M. // Acta Chim. Slov. 2015. Vol. 62. P. 168.
(N=CS, 3JСР = 9.5 Гц). Спектр ЯМР 31Р (CDCl3): δР
doi 10.17344/acsi.2014.867
1.28 м. д.
5. Verma A., Sahu L., Chaudhary N., Dutta T., Dewangan D.,
Диизопропил-(7-метил-5-оксо-6-пропил-
Tripathi D.K. // Asian J. Biochem. Pharm. Res. 2012.
5H-тиазоло[3,2-a]пиримидин-3-ил)фосфонат
Vol. 2. P. 1.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 11 2020
СИНТЕЗ И ФУНКЦИОНАЛИЗАЦИЯ 5-АЛКИЛ-6-МЕТИЛ-2-ТИОУР
АЦИЛОВ
1723
6. Khobragade C.N., Bodade R.G., Konda S.G., Da-
15. Худина О.Г., Иванова А.Е., Бургарт Я.В., Первова М.Г.,
wane B.S., Manwar A. V. // Eur. J. Med. Chem. 2010.
Шатунова Т.В., Борисевич С.С., Хурсан С.Л., Салоу-
Vol. 45. P. 1635. doi 10.1016/j.ejmech.2009.12.040
тин В.И. // ЖОрХ, 2019. T. 55. № 6. С. 879; Khudina
7. Mohamed M.M., Khalil A.K., Abbass E.M., El-
O.G., Ivanova A.E., Burgart Y.V., Pervova M.G.,
Naggar A.M. // Synth. Commun. 2017. Vol. 47. P. 1441.
Shatunova T.V., Borisevich S.S., Saloutin V.I. // Russ.
doi 10.1080/00397911.2017.1332223
8. Velnati S., Massarotti A., Antona A., Talmon M.,
J. Org. Chem. 2019. Vol. 55. P. 782. doi 10.1134/
Fresu L.G., Galetto A.S., Baldanzi G. // J. Enzyme.
s1070428019060071
Inhib. Med. Chem. 2019. Vol. 35. P. 96. doi
16. Giuliano B.M., Feyer V., Prince K.C., Coreno M.,
10.1080/14756366.2019.1684911
Evangelisti L., Melandri S., Caminati W. // J. Phys.
9. Hazari P.P., Pandey A., Chaturvedi S., Mishra A.K. //
Chem. (A). 2010. Vol. 114. P. 12725. doi 10.1021/
Bioconjug. Chem. 2017. Vol. 28. P. 2647. doi 10.1021/
jp106883s
acs.bioconjchem.7b00243
10. Abdel Moty S.G., Hussein M.A., Abdel Aziz S.A., Abou-
17. Khvorostov A., Lapinski L., Rostkowska H., Nowak M.J. //
Salim M.A. // Saudi Pharm. J. 2016. Vol. 24. P. 119. doi
J. Phys. Chem. (A).
2005. Vol. 109. P. 7700. doi
10.1016/j.jsps.2013.12.016
10.1021/jp051940e
11. Nagarajaiah H., Khazi I.M., Begum N.S. // J. Chem. Sci.
18. Yekeler H. // J. Comput. Aid. Mol. Design. 2000.
2012. Vol. 124. P. 847. doi 10.1007/s12039-012-0271-z
Vol. 14. P. 243. doi 10.1023/a:1008132202838
12. Mobinikhaledi A., Foroughifar N., Ahmadi B. //
Phosphorus, Sulfur, Silicon, Relat. Elem. 2005.
19. Egorov D.M., Piterskaya Y.L., Dogadina A.V.,
Vol. 180. P. 339. doi 10.1080/104265090508406
Svintsitskaya N.I. // Tetrahedron Lett. 2015. Vol. 56. P.
13. Xiao D., Han L., Sun Q., Chen Q., Gong N., Lv Y.,
1552. doi 10.1016/j.tetlet.2015.02.027
Li R. // RSC Adv. 2012. Vol. 2. P. 5054. doi 10.1039/
20. Егоров Д.М., Бабушкина А.А., Леоненок В.Е., Чека-
c2ra20254a
лов А.П., Питерская Ю.Л. // ЖОХ. 2020. Т. 90. № 2.
14. Piechowicz K.A., Truong E.C., Javed K.M., Chaney R.R.,
С. 326; Egorov D.M., Babushkina A.A., Leonenok V.E.,
Wu J.Y., Phuan P.W., Anderson M.O. // J. Enzyme
Inhib. Med. Chem. 2016. Vol. 31. P. 1362. doi
Chekalov A.P., Piterskaya Y.L. // Russ. J. Gen. Chem.
10.3109/14756366.2015.1135912
2020. Vol. 90. P. 319. doi 10.1134/s1070363220020267
Synthesis and Functionalization
of 5-Alkyl-6-methyl-2-thiouracils
A. A. Babushkinaa,b, D. M. Egorovb,*, and K. I. Kaskevichb
a St. Petersburg State University, St. Petersburg, 199034 Russia
b St. Petersburg State Institute of Technology (Technical University), St. Petersburg, 190013 Russia
*e-mail: diavoly@mail.ru
Received August 18, 2020; revised August 18, 2020; accepted August 29, 2020
A number of 5-alkyl-6-methyl-2-thiouracils were obtained, the further introduction of which into the reaction
with dialkyl chloroethynylphosphonates afforded a series of new dialkyl (6-alkyl-5-oxo-7-methyl-5H-
thiazolo[3,2-a]pyrimidin- 3-yl)phosphonates.
Keywords: chlorethynylphosphonate, 2-thiouracil, phosphorylation, thiazolo[3,2-a]pyrimidines
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 11 2020