ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2020, том 90, № 11, с. 1724-1731
УДК 547.947.733
СИНТЕЗ, СПЕКТРАЛЬНЫЕ И КООРДИНАЦИОННЫЕ
СВОЙСТВА ПЕРГАЛОГЕНИРОВАННЫХ
ТЕТРАФЕНИЛПОРФИРИНОВ
© 2020 г. Ю. Б. Иванова*, Н. В. Чижова, Н. Ж. Мамардашвили
Институт химии растворов имени Г. А. Крестова Российской академии наук,
ул. Академическая 1, Иваново, 153040 Россия
*e-mail: jjiv@yandex.ru
Поступило в Редакцию 17 июня 2020 г.
После доработки 17 июня 2020 г.
Принято к печати 29 июня 2020 г.
Взаимодействием Zn(II) 5,10,15,20-тетра(2,6-дихлорфенил)порфирината c N-галогенсукцинимидами
в смеси хлороформ-метанол и хлороформ-бутанол или ДМФА синтезированы 2,3,7,8,12,13,17,18-
октахлор(бром)-5,10,15,20-тетра-(2,6-дихлорфенил)порфиринаты Zn(II). Их обработкой трифторуксус-
ной кислотой получены соответствующие порфириновые лиганды. Полученные соединения, а также
их дважды депротонированные формы изучены методами электронной и ЯМР 1Н спектроскопии и
масс-спектрометрии. Определены кинетические параметры образования цинковых комплексов изучен-
ных порфиринов в системах ацетонитрил-Zn(OAc)2 и ацетонитрил-Zn(OAc)2-1,8-диазабицикло[5.4.0]-
ундец-7-ен в интервале температур 298-318 K.
Ключевые слова: галогензамещенные тетрафенилпорфирины, комплексы с цинком, бромирование,
хлорирование, спектральные и координационные свойства
DOI: 10.31857/S0044460X20110128
Порфирины и их металлокомплексы нашли
5,10,15,20-тетра-(2,6-дихлорфенил)порфиринат
применение в качестве компонентов солнечных
3. Ранее были получены β-октабромзамещенные
батарей, полупроводников, сенсорных систем, а
несимметричные нитрофенилпорфирины
[5],
также фотосенсибилизаторов для фотодинамиче-
изомерные тетрахлороктабром- и тетрабромок-
ской терапии [1]. Металлопорфирины, содержа-
тахлортетрафенилпорфирины [6] и изучены их
щие в макроцикле нитрогруппы и атомы фтора
кислотно-основные свойства.
были синтезированы как потенциально эффектив-
В данной работе осуществлено бромирова-
ные средства борьбы со злокачественными ново-
ние β-положений дихлорзамещенного комплекса
образованиями [2]. Галогензамещенные порфири-
цинка 1 с помощью NBS в ДМФА в смеси хлоро-
ны также используются при производстве новых
форм-метанол и хлорирование с помощью NCS
материалов, обладающих каталитическими и не-
в бинарных растворителях: хлороформ-метанол,
линейно-оптическими свойствами [3].
хлороформ-бутанол. При обработке соответству-
Известно, что бромирование Zn(II) 5,10,15,20-
ющих порфиринатов цинка трифторуксусной
тетра(2,6-дихлорфенил)порфирината 1 действием
кислотой получены 2,3,7,8,12,13,17,18-октабром-
N-бромсукцинимида (NBS) в кипящем метаноле
5,10,15,20-тетра-(2,6-дихлорфенил)порфирин
4
приводит к образованию Zn(II)-2,3,7,8,12,13,17,18-
и
2,3,7,8,12,13,17,18-октахлор-5,10,15,20-тетра-
октабром-5,10,15,20-тетра-(2,6-дихлорфенил)пор-
(2,6-дихлорфенил)порфирин 5 (схема 1).
фирината 2 с выходом 45% [4]. При кипячении
Исходный порфиринат цинка 1 получен по реак-
комплекса 1 с N-хлорсукцинимидом (NCS) в мета-
ции комплексообразования 5,10,15,20-тетра-(2,6-
ноле получен Zn(II)-2,3,7,8,12,13,17,18-октахлор-
дихлорфенил)порфирина 6 с ацетатом цинка(II)
1724
СИНТЕЗ, СПЕКТР
АЛЬНЫЕ И КООРДИНАЦИОННЫЕ СВОЙСТВА
1725
Схема 1.
и металлообмена
5,10,15,20-тетра-(2,6-дихлор-
метанол (1:1) в течение 30 мин образуется β-окта-
фенил)порфирината Cd(II) 7 c ZnCl2 в кипящем
бромзамещенный порфиринат цинка 2 (схема 1).
ДМФА [7]. Показано, что использование реакции
В электронном спектре поглощения (ЭСП) пробы,
переметаллирования [8] в синтезе соединения 1 и
взятой из реакционной смеси и растворенной в
замена ацетата цинка на хлорид цинка позволяет
хлороформе, присутствуют полосы с максиму-
сократить время образования конечного продукта
мами 470, 606 и 658 нм. Спектр образующегося
более чем на порядок, по сравнению с комплексо-
продукта не изменяется при увеличении времени
образованием.
реакции до 50 мин. После хроматографии полу-
В масс-спектре комплекса 1 зафиксирован пик
ченного соединения на оснóвной окиси алюминия
молекулярного иона с m/z 952.9 (вычислено для
выход продукта составил 73%.
С44H20Cl8N4Zn: 953.7). В спектре ЯМР 1Н сое-
динения 1 присутствует синглет β-протонов при
При взаимодействии орто-дихлорзамещен-
8.75 м. д., дублет мета-фенильных протонов при
ного комплекса 1 с избытком NBS в ДМФА при
7.80 м. д. и триплет пара-протонов при 7.70 м. д.
комнатной температуре в течение 30 ч также об-
Установлено, что при кипячении комплекса 1
разуется соединение 2 с выходом около 80% (схе-
с 20-кратным избытком NBS в смеси хлороформ-
ма 1). В ЭСП пробы в ДМФА после завершения
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 11 2020
1726
ИВАНОВА и др.
Таблица 1. Данные ЭСП для галогензамещенных тетрафенилпорфиринатов Zn(II) и Cd(II)
λ, нм (lgε)
Соединение
Растворитель
полоса Соре
Q-полоса
1
ДМФА
405 (4.66), 426 (5.50)
559 (4.35), 594 пл
1
CHCl3
405 (4.64), 425 (5.53)
557 (4.32), 592 пл
2
ДМФА
368 (4.52), 474 (5.31)
612 (4.16), 660 (4.06)
2
CHCl3
368 (4.64), 469 (5.45)
604 (4.35), 656 (4.16)
3
ДМФА
364 (4.66), 455 (5.40)
592 (4.34), 643 пл
3
CHCl3
362 (4.63), 451 (5.45)
584 (4.38), 635 пл
7а
ДМФА
418 (4.77), 438 (5.53)
578 (4.34), 620 (3.98)
а Данные работы [7].
реакции присутствуют полосы с максимумами
NH-протонов при -1.26 м. д. В масс-спектре за-
474, 612 и 663 нм. В его спектре ЯМР 1Н наблю-
фиксирован пик молекулярного иона с m/z 1523.7
дается мультиплет ароматических протонов при
(вычислено для С44H14Br8Cl8N4: 1521.6).
7.71-7.62 м. д. В масс-спектре присутствует пик
При обработке комплекса
3 трифторуксус-
молекулярного иона с m/z 1584.7 (вычислено для
ной кислотой получен
2,3,7,8,12,13,17,18-ок-
С44H12Br8Cl8N4Zn: 1584.9).
тахлор-5,10,15,20-тетра-(2,6-дихлорфенил)порфи-
При взаимодействии 2,6-дихлорзамещенного
рин 5 (схема 1). В его масс-спектре присутствует
порфирината цинка 1 с 20-кратным избытком NCS
пик молекулярного иона с m/z 1168.3 (вычислено
в кипящей смеси хлороформ-метанол в течение 5 ч
для С44H14Cl16N4: 1165.9).
образуется
Zn(II)-2,3,7,8,12,13,17,18-октахлор-
Методом спектрофотометрического титрова-
5,10,15,20-тетра-(2,6-дихлорфенил)порфиринат
ния [9, 10] изучены спектральные и комплексо-
(схема 1). По сравнению с данными, приведен-
образующие свойства порфиринов 4 и 5 в срав-
ными в работе [4], время реакции уменьшилось в
нении с тетра-(2,6-дихлорфенил)порфирином 6 в
~2 раза. В смеси хлороформ-бутанол время реак-
системах ацетонитрил-Zn(OAc)2 и ацетонитрил-
ции сокращается до 1 ч. В ЭСП пробы, взятой из
Zn(OAc)2-1,8-диазабицикло[5.4.0]ундец-7-ен
реакционной смеси, присутствуют полосы с мак-
(DBU) в интервале температур 298-318 K.
симумами 451, 584 и 635 нм. В спектре ЯМР 1Н
Природа заместителя и его положение в макро-
β-хлорзамещенного порфирината цинка 3 наблю-
цикле оказывают значительное влияние на кислот-
дается мультиплет ароматических протонов при
ные свойства порфиринов. Процессы депротони-
7.73-7.65 м. д. В масс-спектре присутствует пик
рования порфиринов 4 и 5 [уравнения (1), (2)] в
молекулярного иона с m/z 1231.04 (вычислено для
системе ацетонитрил-DBU показали, что моди-
С44H12Cl16N4Zn: 1229.3). В табл. 1 приведены ха-
фикация порфиринового макроцикла повышает
рактеристики ЭСП галогензамещенных порфири-
общую кислотность соединения 5 по сравнению с
натов цинка 1-3 и порфирината кадмия 7.
соединением 4 на порядок, при этом наблюдалась
При обработке раствора порфирината цинка 2
визуализация ступеней депротонирования
[11].
в хлороформе трифторуксусной кислотой (TFA)
Соединение 6 в этой системе не образует депро-
в течение 30 мин образуется дважды протониро-
тонированных форм. Однако в системе ацетони-
ванная форма (Н4ОВР2+) свободного основания
трил-HClO4 наблюдалось образование протони-
(схема 1). В ее ЭСП в хлороформе присутствуют
рованных форм для всех изученных порфиринов
полосы с максимумами 494, 636 и 696 нм. После
4-6, основность которых уменьшается в ряду 6 >
обработки протонированной формы Н4ОВР2+ рас-
4 > 5 [11].
твором NaHCO3 получен 2,3,7,8,12,13,17,18-ок-
(1)
табром-5,10,15,20-тетра-(2,6-дихлорфенил)пор-
(2)
фирин 4. В ЭСП соединения 4 в хлороформе
присутствуют полосы с λmax 463, 559 и 644 нм. В
Здесь Н2Р, HР-, Р2- - молекулярная, моно- и дваж-
спектре ЯМР 1Н присутствуют сигналы арома-
ды депротонированные формы порфиринового ли-
тических протонов при 7.71-7.67 м. д. и сигнал
ганда.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 11 2020
СИНТЕЗ, СПЕКТР
АЛЬНЫЕ И КООРДИНАЦИОННЫЕ СВОЙСТВА
1727
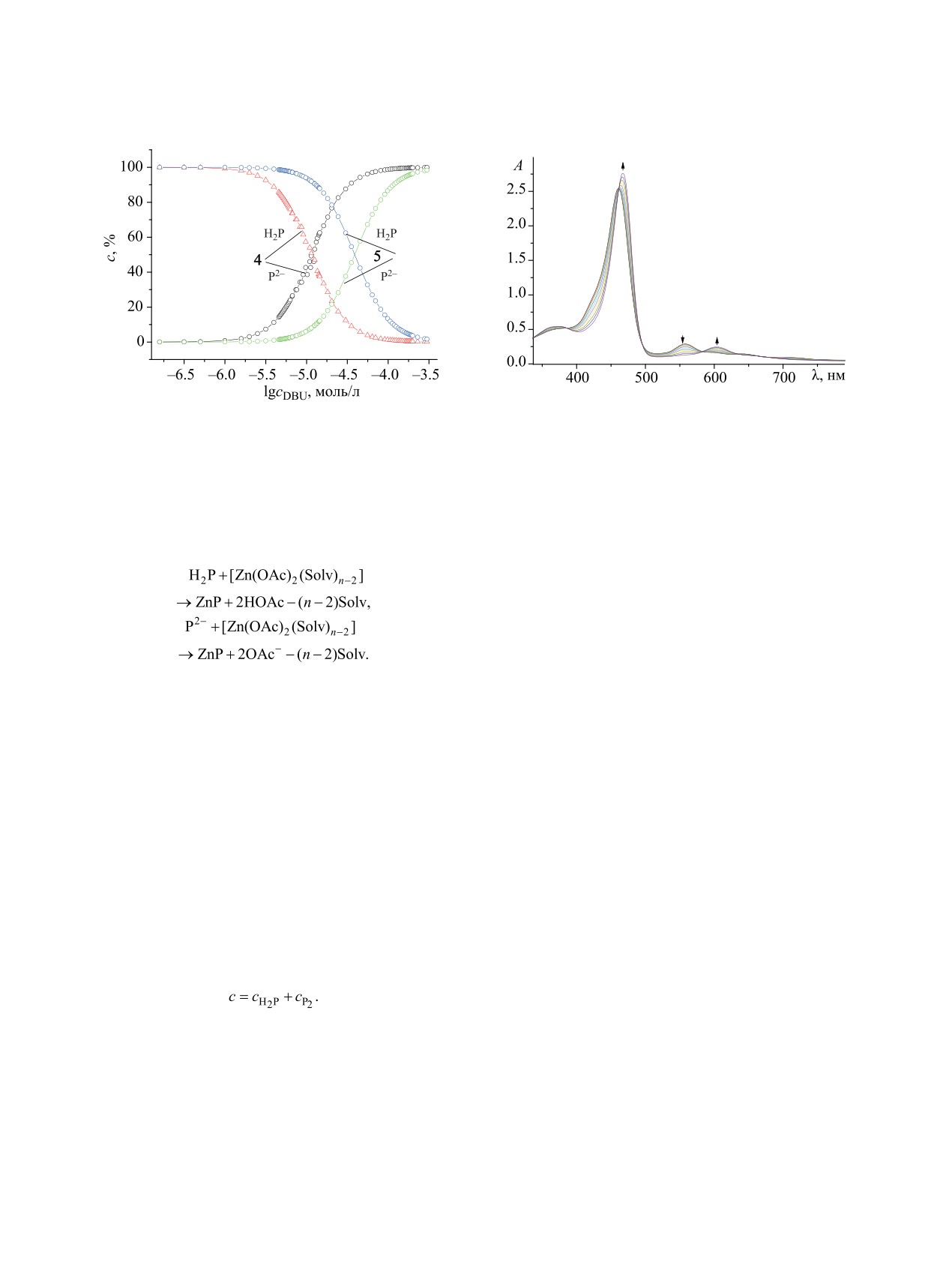
Рис. 2. Электронные спектры поглощения соедине-
Рис. 1. Распределение концентраций молекулярных
ния 4 в системе Zn(OAc)2-ацетонитрил в интервале
(H2P) и дважды депротонированных форм (P2-) для со-
298-318 K. [4] = 1.88×10-5 моль/л, [Zn(OAc)2] = 1.84×
единений 4, 5 при титровании в системе CH3CN-DBU.
10-3 моль/л.
В индивидуальном растворителе координация
средственно с дважды депротонированными фор-
порфиринов 4 и 5 в системах CH3CN-Zn(OAc)2 и
мами в среде ацетонитрила.
CH3CN-Zn(OAc)2-DBU ацетатом цинка протекает
Анализируя ЭСП и скорость реакций образова-
согласно уравнениям (3), (4) [9]:
ния комплексов для молекулярных и дважды де-
протонированных форм порфиринов 4 и 5, можно
отметить, что во всех изученных случаях в ЭСП
(3)
реагирующих систем наблюдались четкие изосбе-
стические точки (рис. 2), а реакции (3) и (4) под-
(4)
чинялись первому порядку по порфирину, о чем
Здесь H2P и P2- - молекулярная и дважды депрото-
свидетельствует линейный характер зависимостей
нированная формы порфиринов 4 и 5; OAc - аци-
ln(с0H2P/сH2P) от времени в интервале температур
долиганд (ацетат-ион); Solv - лиганд (молекула
298-318 K. Полученные параметры ЭСП для пор-
растворителя); n - координационное число катиона
фиринов 4 и 5 и их цинковых комплексов, а также
металла. Учитывая процессы депротонирования
кинетические параметры реакций (3) и (4) в систе-
молекулярных форм (2) и (3) и ранее полученные
мах CH3CN-Zn(OAc)2 и CH3CN-Zn(OAc)2-DBU
значения соответствующих констант кислотной
представлены в табл. 2 и 3. Расчет констант скоро-
диссоциации в системе ацетонитрил-DBU [11] для
сти k298 и активационных параметров Ea и ΔS≠ про-
соединений 4 и 5, а также уравнение материаль-
цессов (3) и (4) выполнен по известной методике
ного баланса (5) (пропорциональность оптической
[9]. Попытки получить цинковые комплексы непо-
плотности растворенного вещества его концен-
средственно из молекулярных форм соединения 6
трации согласно закону Бугера-Ламберта-Бера),
в ацетонитриле не увенчались успехом даже при
было получено распределение концентраций мо-
нагревании. Порфирин 6 в среде ацетонитрил-
лекулярной и дважды депротонированных форм
DBU, как отмечено выше, не депротонируется и
для приведенных соединений в указанной системе
не образует цинковых комплексов в исследованных
(рис. 1).
системах. Анионные формы порфиринов лучше
(5)
сольватируются, что способствует более сильной
Полученные данные позволили определить
поляризации молекулы лиганда [9]. Анализ табл. 3
концентрации органического основания DBU, при
показал практически двукратное увеличение кон-
которых молекулярная форма лигандов 4 и 5 пол-
стант скорости в случае образования цинковых
ностью переходила в дважды депротонированную
комплексов соединений 4 и 5 в системе CH3CN-
форму. Цинковые комплексы порфиринов 4 и 5 в
Zn(OAc)2-DBU по сравнению с системой CH3CN-
системе CH3CN-Zn(OAc)2-DBU получали непо-
Zn(OAc)2.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 11 2020
1728
ИВАНОВА и др.
Таблица 2. Параметры ЭСП галогензамещенных порфиринов, их депротонированных форм, а также цинковых ком-
плексов, полученных в системах CH3CN-Zn(OAc)2 и CH3CN-Zn(OAc)2-DBU
λ, нм (lgε)
Порфирины и их формы
pKb1,2
pKa1,2
полоса Соре
Q-полоса
H2Br8TPP [12]
471 (5.14)
646 (4.16), 765 (3.92)
16.60
10.77
Br8TPP2-
497 (5.30)
734 (4.80)
H2Br8(2,6-ClPh)Р (4) [11]
463 (5.13)
560 (4.21), 646 (3.92), 603 пл,
15.63
9.9
713 (3.73)
Br8(2,6-ClPh)Р2-
502 (4.97)
674 (3.90), 729 (3.99)
ZnBr8(2,6-ClPh)Р
367 (4.46), 467 (5.17)
603 (4.13), 667 (3.79)
Zn2+Br8(2,6-ClPh)Р2-
421 пл (4.49), 480 (5.08)
620 (4.07), 674 (3.93)
H2Cl8(2,6-ClPh)Р (5) [11]
449 (5.11)
548 (4.13), 590 пл, 636 (3.67),
13.25 pKb1 9.63,
8.82 pKb1 4.72,
706 (3.42)
pKb2 3.62
pKb2 4.1
Cl8(2,6-ClPh)Р2-
461 (4.77)
599 (3.84), 643 (3.82)
ZnCl8(2,6-ClPh)Р
362 пл (4.52), 452 (5.25)
428 пл (5.09), 547 (4.22), 592
(4.13)
Zn2+Cl8(2,6-ClPh)Р
361 (4.21), 457 (4.88)
593 (3.83), 648 (3.51)
H2T(2,6-ClPh)Р (6)
409 (5.42)
510 (4.20), 543 пл, 586 (3.78)
17.04
-
Таблица 3. Кинетические параметры реакции образования цинковых комплексов порфиринов в системах CH3CN-
Zn(OAc)2 и CH3CN-Zn(OAc)2-DBUа
Порфирин
[Zn(OAc)2]×103, моль/л
k298×103, л∙моль-1·с-1
Ea, кДж/моль
ΔS≠, Дж/(моль·K)
H2Br8TPP [15]
4.50
69±1
56±1
-88±2
H2Br8(2,6-ClPh)Р (4)
1.84
50±1
68±1
-48±2
Br8(2,6-ClPh)Р2-
1.84
98±1
38±1
-141±2
H2Cl8(2,6-ClPh)Р (5)
1.84
40±1
80±2
-11±2
Cl8(2,6-ClPh)Р2-
1.84
83±1
45±1
-122±2
а Точность определения величин k = 3-5%.
Сравнивая кинетические параметры реакции
ными атомами азота N→M в переходном состоя-
координации Zn(II) для порфиринов-лигандов 4 и
нии для более основного соединения 4 приводит
5, можно сделать вывод, что скорость образования
к увеличению скорости реакции комплексообразо-
цинковых комплексов зависит от кислотности ис-
вания по сравнению с соединением 5. Переход к
следуемых соединений. Наличие галогеновых за-
дважды депротонированным формам нивелирует
местителей в фенильных кольцах и β-положениях
разницу в процессах комплексообразования, ве-
макроцикла, очевидно, повышает NH-кислотность
роятно, вследствие большей симметричности ани-
и способствует депротонированию за счет стаби-
онных форм и уменьшения затрат на разрыв N-Н
лизации образующихся анионов. Соответственно,
связи. Следует отметить, что ЭСП цинковых ком-
самое кислое соединение 5, имеющее максималь-
плексов в системах CH3CN-Zn(OAc)2 и CH3CN-
ное значение константы депротонирования, имеет
Zn(OAc)2-DBU характеризуются батохромным
самую низкую константу скорости и наибольшую
сдвигом полос поглощения. В частности, для по-
энергию активации, по сравнению с соединением
лосы Соре у соединения 4 этот сдвиг составил
4 (табл. 3). К такому же выводу приводит анализ
27 нм, а для соединения 5 всего 5 нм в системе
литературных данных по 2,3,7,8,12,13,17,18-ок-
CH3CN-Zn(OAc)2-DBU по сравнению с системой
табром-5,10,15,20-тетрафенилпорфирину
CH3CN-Zn(OAc)2. Это объясняется экстракоорди-
(H2Br8TPP) [12] в сопоставлении с данными для
нацией образующегося цинкового комплекса ор-
соединений 4 и 5 в системе CH3CN-Zn(OAc)2
ганическим основанием DBU, как подробно опи-
(табл. 3). Вероятно, упрочнение связей с третич-
сано в литературе [13-15]. Увеличение константы
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 11 2020
СИНТЕЗ, СПЕКТР
АЛЬНЫЕ И КООРДИНАЦИОННЫЕ СВОЙСТВА
1729
скорости сопровождается понижением энергии
(матрица - дигидроксибензойная кислота). Ком-
активации, вследствие большей полярности обра-
плексообразующие свойства изучали по извест-
зующегося комплекса по сравнению с исходным
ным методикам [9, 10].
состоянием. Это предположение подтверждается и
Zn(II)-5,10,15,20-тетра(2,6-дихлорфенил)-
отрицательными значениями энтропии активации.
порфиринат (1). а. Смесь 0.04 г (0.0225 ммоль)
Таким образом, синтезированы и идентифици-
порфирина 6 и 0.082 г (0.450 ммоль) Zn(OAc)2 в
рованы
2,3,7,8,12,13,17,18-октабром-5,10,15,20-
30 мл ДМФА кипятили 30 мин. Реакционную
тетра-(2,6-дихлорфенил)порфиринат Zn(II) и
смесь охлаждали и выливали в воду. Осадок от-
2,3,7,8,12-13,17,18-октахлор-5,10,15,20-тетра-(2,6-
фильтровывали, промывали водой, сушили и хро-
дихлорфенил)порфиринат Zn(II). При обработке
матографировали на окиси алюминия хлорофор-
комплексов цинка трифторуксусной кислотой
мом. Выход 0.035 г (0. 0367 ммоль, 82%). Спектр
получены соответствующие порфириновые ли-
ЯМР 1Н (CDCl3), δ, м. д.: 8.75 с (8Н, пиррол), 7.79 д
ганды. Изучены спектральные свойства моле-
(8Н, Phm, J = 7.6 Гц), 7.70 т (4Н, Phn, J = 7.65 Гц).
кулярных и дважды депротонированных форм
Масс-спектр, m/z (Iотн, %): 952.9 (98) [M]+ (вычис-
2,3,7,8,12,13,17,18-октабром-5,10,15,20-тетра-(2,6-
лено для С44H20Cl8N4Zn: 953.7).
дихлорфенил)порфирина и
2,3,7,8,12-13,17,18-
б. Получали аналогично из 0.04 г (0.040 ммоль)
октахлор-5,10,15,20-тетра(2,6-дихлорфенил)пор-
комплекса 7, 0.054 г (0.40 ммоль) ZnCl2, 25 мл
фирина в ацетонитриле. Определены кинетиче-
ДМФА; время реакции - 2 мин. Выход 0.034 г
ские параметры образования цинковых комплек-
(0.0357 ммоль, 89%).
сов изученных порфиринов в системах ацетони-
Zn(II)-2,3,7,8,12,13,17,18-октабром-
трил-Zn(OAc)2 и ацетонитрил-Zn(OAc)2-DBU
5,10,15,20-тетра(2,6-дихлорфенил)порфиринат
при 298-318 K. Полученные результаты могут
(2). а. К раствору 0.02 г (0.0210 ммоль) комплекса
быть использованы при создании новых материа-
1 в смеси 5 мл хлороформа и 5 мл метанола при-
лов с увеличенной n-проводимостью.
бавляли 0.038 г (0.210 ммоль) NBS. Смесь кипя-
Проведенные исследования показали, что хи-
тили в течение 15 мин, затем прибавляли 0.038 г
мическая модификация порфиринового макро-
(0.210 ммоль) NBS и кипятили еще 15 мин. По-
цикла является важным средством управления
лученную смесь охлаждали и упаривали. Остаток
спектральными и координационными свойствами
растворяли в дихлорметане, хроматографировали
порфиринов, позволяющим создавать системы с
на окиси алюминия дихлорметаном, затем хло-
требуемыми физико-химическими свойствами.
роформом. Выход 0.024 г (0.0151 ммоль, 73%).
Спектр ЯМР 1Н (CDCl3), δ, м. д.: 7.71-7.62 м (8Н,
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Phm; 4Н, Phn). Масс-спектр, m/z (Iотн, %): 1584.7
В работе использовали ацетонитрил (Aldrich,
(98) [M - H]+ (вычислено для С44H12Br8Cl8N4Zn:
содержание воды 0.03%), DBU (Aldrich, 98%).
1584.9).
5,10,15,20-Тетра-(2,6-дихлорфенил)порфирин
б. К раствору 0.02 г (0.0210 ммоль) комплекса
(Porphychem), N-бромсукцинимид, N-хлорсукци-
1 в 5 мл ДМФА прибавляли 0.075 г (0.420 ммоль)
нимид, трифторуксусную кислоту (Acros), оксид
NBS. Полученную смесь выдерживали при ком-
алюминия, растворители, ацетат кадмия, ацетат и
натной температуре в течение 24 ч, затем прибав-
хлорид цинка (Merck) использовали без дополни-
ляли 0.075 г (0.420 ммоль) NBS и выдерживали
тельной обработки. 5,10,15,20-Тетра-(2,6-дихлор-
еще 6 ч, после чего прибавляли воду и NaCl. Оса-
фенил)порфиринат Cd(II) синтезировали по мето-
док отфильтровывали, промывали водой и суши-
дике, приведенной в работе [7].
ли. Выход 0.026 г (0.0164 ммоль, 80%).
Электронные спектры поглощения записыва-
Zn(II)-2,3,7,8,12,13,17,18-октахлор-5,10,15,20-
ли на спектрофотометре Cary-100 (Varian). Cпек-
тетра(2,6-дихлорфенил)порфиринат
(3). а. К
тры ЯМР 1Н получали на приборе Bruker AV
раствору 0.02 г (0.021 ммоль) комплекса 1 в сме-
III-500
(500 МГц), внутренний стандарт - ТМС.
си 5 мл хлороформа и 5 мл метанола прибавляли
Масс-спектры регистрировали на масс-спектроме-
0.028 г (0.21 ммоль) NСS. Реакционную смесь
тре Maldi ToF Shimadzu Biotech Axima Confidence
кипятили в течение 2 ч, затем прибавляли 0.028 г
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 11 2020
1730
ИВАНОВА и др.
(0.210 ммоль) NСS и кипятили в течение 3 ч. По-
ния Центра коллективного пользования Верхне-
сле охлаждения смесь упаривали. Остаток раство-
волжского регионального центра физико-химиче-
ряли в дихлорметане, хроматографировали на оки-
ских исследований.
си алюминия дихлорметаном, затем хлороформом.
ФОНДОВАЯ ПОДДЕРЖКА
Выход 0.017 г (0.0138 ммоль, 66%). Спектр ЯМР
1Н (CDCl3), δ, м. д.: 7.73-7.65 м (8Н, Phm; 4Н, Phn).
Работа выполнена при поддержке Российского
Масс-спектр, m/z (Iотн, %): 1231.04 (97) [M + 2H]+
фонда фундаментальных исследований (проект
(вычислено для С44H12Cl16N4Zn: 1229.3).
№ 18-43-370001_р-а, синтез галогензамещенных
б. К раствору 0.02 г (0.021 ммоль) комплекса
порфиринатов цинка и их порфиринов-лигандов;
1 в смеси 5 мл хлороформа и 5 мл бутанола при-
проект № 19-03-00078 А, исследование спектраль-
бавляли 0.028 г (0.21 ммоль) NСS. Реакционную
ных и координационных свойств молекулярных и
смесь кипятили в течение 30 мин, затем прибавля-
дважды депротонированных форм порфиринов и
ли 0.028 г (0.210 ммоль) NСS и кипятили еще 30
их комплексов с катионом цинка).
мин. После охлаждения растворители упаривали.
КОНФЛИКТ ИНТЕРЕСОВ
Остаток растворяли в дихлорметане, хроматогра-
фировали на окиси алюминия дихлорметаном, за-
Авторы заявляют об отсутствии конфликта
тем хлороформом. Выход 0.018 г (0.0146 ммоль,
интересов.
70%).
СПИСОК ЛИТЕРАТУРЫ
2,3,7,8,12,13,17,18-Октабром-5,10,15,20-
1. Li L.-L., Diau E.W.-G. // Chem. Soc. Rev. 2013. Vol. 42.
тетра-(2,6-дихлорфенил)порфирин (4). К раство-
N 1. P. 291. doi 10.1039/C2CS35257E
ру 0.02 г (0.0126 ммоль) комплекса 2 в 7 мл хлоро-
2. Stuzhin P.A., Goryachev M.Yu., Ivanova S.S., Nazarova A.,
форма прибавляли 2 мл трифторуксусной кислоты.
Pimkov I., Koifman O.I. // J. Porph. Phthal. 2013.
Реакционную смесь перемешивали при комнатной
Vol. 17. P. 905. doi 10.1142/S1088424613500892
температуре в течение 20 мин, затем прибавляли
3. Chumakov D.E., Khoroshutin A.V., Anisimov A.V.,
воду. Органический слой отделяли, промывали во-
Kobrakov K.I. // Chem. Heterocycl. Compd. 2009.
дой, раствором бикарбоната натрия, снова водой
Vol. 45. N 3. P. 259. doi 10.1007/s10593-009-0277-8
и сушили. После удаления растворителя остаток
4. Chorghade M.S., Dolphin D., Dupré D., Hill D.R.,
хроматографировали на окиси алюминия хлоро-
Lee E.C., Wijesekera T.P. // Syhthesis. 1996. Vol. 11.
формом. Выход 0.014 г (0.0092 ммоль, 75%). ЭСП
P. 1320. doi 10.1055/s-1996-4401
(СН2Cl2), λ, нм, (lgε): 369 (4.43), 462 (5.13), 558
5. Иванова, Ю.Б. Чижова Н.В., Мамардашвили Н.Ж. //
(4.21), 604 пл, 645 (3.92), 713 (3.73). Спектр ЯМР
ЖОрХ. 2019. Т. 55. № 10. С. 1609; Ivanova Yu.B.,
1Н (CDCl3), δ, м. д.: 7.71-7.67 м (8Н, Phm; 4Н, Phn),
Chizhova N.V., Mamardashvili N. Zh. // Russ. J. Org.
-1.26 с (2H, NH). Масс-спектр, m/z (Iотн, %): 1523.7
Chem. 2019. Vol. 55. N 10. Р. 1554. doi 10.1134/
(96) [M + 2H]+ (вычислено для С44H14Br8Cl8N4:
S0514749219100149
1521.6).
6. Мамардашвили Н.Ж., Иванова Ю.Б., Чижова Н.В.
// Макрогетероциклы. 2019. Т. 12. № 1. С. 22. doi
2,3,7,8,12,13,17,18-Октахлор-5,10,15,20-
10.6060/mhc180900m
тетра-(2,6-дихлорфенил)порфирин (5) получали
7. Чижова Н.В., Мамардашвили Г.М., Дмитриева О.Г.,
аналогично из 0.02 г (0.0163 ммоль) комплекса 3 и
Мамардашвили Н.Ж., Койфман О.И. // Макроге-
3 мл трифторуксусной кислоты; время реакции -
тероциклы. 2019. Т. 12. № 4. С. 364. doi 10.6060/
1.5 ч. Выход 0.013 г (0.0112 ммоль, 70%). ЭСП
mhc190556m
(СН2Cl2), λ, нм, (lgε): 446 (5.11), 543 (4.13), 585
8. Хембрайт П. // Усп. хим. 1977. Т. 46. C. 1207.
пл, 631 (3.67), 700 (3.42). Спектр ЯМР 1Н (CDCl3-
9. Berezin B.D. Coordination compounds of porphyrins
CF3COOH), δ, м. д.: 7.85-7.79 м (8Н, Phm; 4Н, Phn),
and phthalocyanines. New York: John Wiley & Sons,
-1.03 с (4NH). Масс-спектр, m/z (Iотн, %): 1168.3
1981. P. 323.
(96)
[M + 2H]+ (вычислено для С44H14Cl16N4:
10. Иванова Ю.Б., Пуховская С.Г., Семейкин А.С.,
1165.9).
Сырбу С.А. // ЖОХ. 2013. Т. 83. № 7. С. 1156; Ivano-
va Yu.B., Pukhovskaya S.G., Semeikin A.S., Syrbu S.A. //
БЛАГОДАРНОСТИ
Russ. J. Gen. Chem. 2013. Vol. 83. N 7. Р.1406. doi
Работа выполнена с привлечением оборудова-
10.1134/S1070363213070177
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 11 2020
СИНТЕЗ, СПЕКТР
АЛЬНЫЕ И КООРДИНАЦИОННЫЕ СВОЙСТВА
1731
11. Иванова Ю.Б., Чижова Н.В., Шумилова И.А., Руса-
Kruk N.N. // Russ. J. Gen. Chem. 2013. Vol. 83. N 3.
нов А.И., Мамардашвили Н.Ж. // ЖОрХ. 2020. Т. 56.
P. 558. doi 10.1134/S1070363213030250
14. Иванова Ю.Б., Семейкин А.С., Пуховская С.Г.,
№ 6. С. 957; Ivanova Yu.B., Chizhova N.V., Shumilo-
Мамардашвили Н.Ж. // ЖОрХ. 2019. Т. 55. № 12.
va I.A., Rusanov A.I., Mamardashvili N.Zh. // Russ. J.
С. 1888; Ivanova Yu.B., Semeykin A.S., Pukhovskaya S.G.,
Org. Chem. 2020. Vol. 56. N 6. Р. 957. doi 10.31857/
Mamardashvili N.Zh. // Russ. J. Org. Chem. 2019.
S0514749220060142
Vol. 55. N 12. Р. 1888. doi 10.1134/S051474921912
12. Пуховская С.Г., Иванова Ю.Б., Семейкин А.С.,
15. Лебедева Н.Ш., Павлычева Н.А., Вьюгин А.И. //
Сырбу С.А, Крук Н.Н. // Рос. хим. ж. 2017. Т. 61.
ЖОрХ. 2004. Т. 40. № 12. С. 1776; Lebedeva N.Sh.,
№ 1. C. 56.
Pavlycheva N.A., V’yugin A.I. // Russ. J. Org. Chem.
13. Иванова Ю.Б., Чижова Н.В., Крук Н.Н. // ЖОХ.
2004. Vol. 40. N 12. P. 1727. doi 10.1007/s11178-005-
2013. Т. 83. № 3. С. 505; Ivanova Yu.B., Chizhova N.V.,
0090-5
Synthesis, Spectral and Coordination Properties
of Perhalogenated Tetraphenylporphyrins
Yu. B. Ivanova*, N. V. Chizhova, and N. Zh. Mamardashvili
G.A. Krestov Institute of Chemistry of Solutions of the Russian Academy of Sciences, Ivanovo, 153040 Russia
*e-mail: jjiv@yandex.ru
Received June 17, 2020; revised June 17, 2020; accepted June 29, 2020
The reaction of Zn(II)-5,10,15,20-tetra-(2,6-dichlorophenyl)porphyrinate with N-halosuccinimides in a chloro-
form-methanol and chloroform-butanol mixtures or DMF was used to synthesize Zn(II) 2,3,7,8,12,13,17,18-
octachloro(bromo)-5,10,15,20-tetra-(2,6-dichlorophenyl)porphyrinates. Their treatment with trifluoroacetic
acid furnished the corresponding free porphyrin ligands. The obtained compounds, as well as their doubly
deprotonated forms, were studied by electron and 1H NMR spectroscopy and mass spectrometry methods. The
kinetic parameters of the formation of zinc complexes with the porphyrins in the acetonitrile-Zn(OAc)2 and
acetonitrile-Zn(OAc)2-1,8-diazabicyclo[5.4.0]undec-7-ene systems were determined in the temperature range
of 298-318 K.
Keywords: halogenated tetraphenylporphyrins, zinc(II) complexes, bromination, chlorination, spectral and
coordination properties
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 11 2020