ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2020, том 90, № 11, с. 1749-1757
УДК 541.49:546.562:548.736:547.484.3
СИНТЕЗ, СТРОЕНИЕ И БИОЛОГИЧЕСКАЯ
АКТИВНОСТЬ КООРДИНАЦИОННЫХ СОЕДИНЕНИЙ
МЕДИ(II), НИКЕЛЯ(II), КОБАЛЬТА(III) И ЖЕЛЕЗА(III)
C 2-{2-[(ПРОП-2-ЕН-1-ИЛ)КАРБАМОТИОИЛ]
ГИДРАЗИНИЛИДЕН}ПРОПАНОВОЙ КИСЛОТОЙ
© 2020 г. А. П. Гуляa, В. О. Граурa,*, Е. К. Дюричa, Я. И. Улькинаa, П. Н. Боурошb,
Г. Г. Бэланc, О. С. Бурдунюкc,d, В. И. Цапковa, В. Ф. Рудикe
a Молдавский государственный университет, ул. Матеевича 60, Кишинев, MD-2009 Молдова
b Институт прикладной физики, Кишинев, MD-2028 Молдова
c Государственный университет медицины и фармации имени Н. Тестемицану, Кишинев, MD-2001 Молдова
d Национальное агентство общественного здоровья, Кишинев, MD-2028 Молдова
e Институт микробиологии и биотехнологии Академии наук Республики Молдова, Кишинев, MD-2028 Молдова
*e-mail: vgraur@gmail.com
Поступило в Редакцию 26 июня 2020 г.
После доработки 26 июня 2020 г.
Принято к печати 16 июля 2020 г.
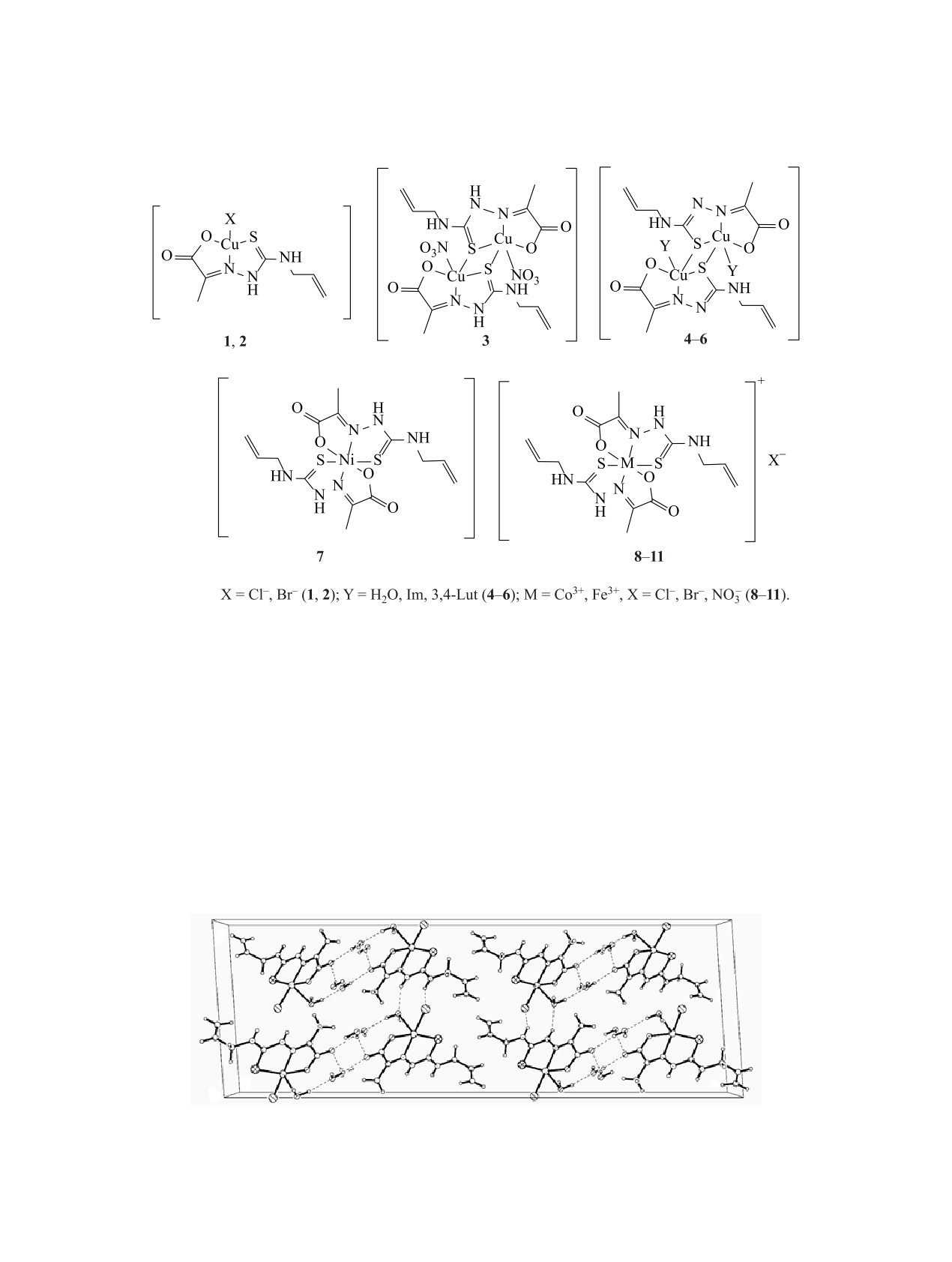
2-Оксопропановая кислота реагирует в этаноле с N-(проп-2-ен-1-ил)гидразинкарботиоамидом в мо-
лярном отношении 1:1, образуя тиосемикарбазон H2L. При взаимодействии H2L с солями меди(II),
никеля(II), кобальта(II) и железа(III) образуются координационные соединения Cu(HL)X [X = Cl-, Br-,
NO3-], Cu(H2O)(L), Ni(HL)2, Co(HL)2X [X = Cl-, Br-], Fe(HL)2X [X = NO3-, Br-]. Взаимодействие комплек-
са Cu(H2O)(L) с имидазолом (Im) и 3,4-диметилпиридином (3,4-Lut) приводит к смешанно-лигандным
комплексам Cu(A)(L) [A = Im, 3,4-Lut]. Строение двух комплексов меди установлено методом рентге-
ноструктурного анализа. Синтезированные комплексы проявляют селективную противомикробную
и противогрибковую активности в интервале концентраций 15.62-1000 мкг/мл. Введение аминов во
внутреннюю сферу комплексов меди приводит к усилению противомикробной активности.
Ключевые слова: координационные соединения, 4-аллилтиосемикарбазон пировиноградной кислоты,
противомикробная активность, противогрибковая активность
DOI: 10.31857/S0044460X20110165
Тиосемикарбазоны и координационные соеди-
согласуется с их строением [9], то введение ами-
нения переходных металлов с ними представляют
нов во внутреннюю сферу комплексов меди может
собой важный класс биологически активных сое-
привести к изменению их биологических свойств
динений [1-4]. Введение различных заместителей
[3, 10, 11].
в состав тиосемикарбазонов приводит к измене-
Hами синтезированы и исследованы новые ко-
нию способа координации к центральному атому
ординационные соединения меди(II), никеля(II),
металла, влияет на биологическую активность и
кобальта(III) и железа(III) c 2-{2-[(проп-2-ен-1-ил)-
усиливает селективность их действия. Ранее у ко-
карбамотиоил]гидразинилиден}пропановой кис-
ординационных соединений тиосемикарбазонов
лотой (H2L, схема 1).
оксокарбоновых кислот и их производных были
выявлены противомикробные, противогрибковые
Тиосемикарбазон H2L получен взаимодействи-
[5, 6] и противораковые [7, 8] свойства. Так как
ем
N-(проп-2-ен-1-ил)гидразинкарботиоамида
биологическая активность таких веществ часто
(4-аллилтиосемикарбазида) с
2-оксопропановой
1749
1750
ГУЛЯ и др.
ридином (3,4-лутидином, 3,4-Lut) в молярном от-
Схема 1.
ношении 1:1. Полученные комплексы 5, 6 имеют
состав Cu(A)(L), где A = Im (5), 3,4-Lut (6).
Координационные соединения
1-11 нера-
створимы в диэтиловом эфире, мало раство-
римы в воде, лучше - в спиртах, хорошо рас-
творимы в ДМФА и ДМСО. По результатам
определения молярной электропроводности (æ)
комплексов в ДМФА, соединения 1-3, 8-11 пред-
ставляют собой бинарные электролиты, 1:1, (æ = 61-
кислотой (пировиноградной кислотой), взятыми в
89 Ом-1.см2.моль-1), а комплексы 4-7 - неэлектро-
молярном отношении 1:1, в этаноле. Его строение
литы (æ = 8-13 Ом-1.см2.моль-1) (табл. 1).
подтверждено с помощью ЯМР 1H и 13С.
Магнетохимическое исследование синтезиро-
При взаимодействии горячего (50-55°С) эта-
ванных координационных соединений показало,
нольного раствора тиосемикарбазона H2L с эта-
что комплексы меди 1 и 2 обладают эффективны-
нольными растворами хлорида, бромида или
ми магнитными моментами, характерными для
нитрата меди(II) в молярном отношении 1:1 обра-
одного неспаренного электрона, что дает основа-
зуются мелкокристаллические комплесы Cu(HL)X
ние предположить для них мономерное строение.
1-3, где X=Cl- (1), Br- (2), NO3- (3). При взаимодей-
Комплексы 3-6 обладают заниженной величиной
ствии этанольного раствора H2L с гидратом аце-
эффективного магнитного момента по сравнению
тата меди(II) образуется соединение Cu(H2O)(L)
с чисто-спиновым значением для одного неспа-
4. Взаимодействие раствора H2L с тетрагидратом
ренного электрона, что указывает на их полиядер-
ацетата никеля, а также с растворами хлоридов,
ное строение. Эффективный магнитный момент
бромидов или нитратов кобальта(II) и железа(III)
комплекса никеля 7 (μэф = 2.84 М.Б.) указывает на
в молярном отношении 2:1 приводит к комплек-
его октаэдрическое строение. Комплексы кобаль-
сам Ni(HL)2 7, Co(HL)2X 8, 9 [X = Cl- (8), Br-(9)],
та 8 и 9 диамагнитны, следовательно, они имеют
Fe(HL)2X 10, 11 [X = NO‒ (10), Br- (11)].
октаэдрическое строение; в ходе синтеза произо-
С целью получения комплексов меди с включен-
шло окисление иона кобальта(II) до кобальта(III)
ными в их состав гетероароматическими аминами
кислородом воздуха. Эффективный магнитный
были проведены реакции этанольных растворов
момент комплексов железа 10 и 11 характерен
комплекса 4 с имидазолом (Im) и 3,4-диметилпи-
для пяти неспаренных электронов, следовательно
Таблица 1. Физико-химические характеристики координационных соединений меди, никеля, кобальта и железа с
2-{2-[(проп-2-ен-1-ил)карбамотиоил]гидразинилиден}пропановой кислотой
а
Выход,
æ,
Найдено, %
Вычислено, %
№
μэф,a М.Б.
Формула
%
Ом-1·см2·моль-1
Mб
N
S
Mб
N
S
1
82
1.94
86
20.96
13.99
10.87
C7H10ClCuN3O2S
21.24
14.04
10.72
2
79
1.85
89
18.72
12.41
9.03
C7H10BrCuN3O2S
18.49
12.23
9.33
3
86
1.24
87
19.75
17.46
9.70
C7H10CuN4O5S
19.51
17.20
9.84
4
72
0.65
10
22.88
14.68
11.45
C7H11CuN3O3S
22.63
14.96
11.42
5
83
1.18
9
19.52
21.12
9.45
C10H13CuN5O2S
19.21
21.17
9.69
6
81
0.96
8
17.42
15.11
8.72
C14H18CuN4O2S
17.18
15.15
8.67
7
81
2.84
13
12.83
12.76
13.86
C14H20N6NiO4S2
12.78
12.78
13.97
в
8
84
76
11.64
16.96
13.11
C14H20ClCoN6O4S2
11.91
16.98
12.96
в
9
75
62
11.05
15.49
11.81
C14H20BrCoN6O4S2
10.93
15.58
11.89
10
68
5.96
64
10.42
19.19
12.15
C14H20FeN7O7S2
10.77
18.92
12.37
11
78
5.80
61
10.64
15.84
12.25
C14H20BrFeN6O4S2
10.41
15.67
11.96
а При 293 K.
б М - металл.
в Диамагнитен.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 11 2020
СИНТЕЗ, СТРОЕНИЕ И БИОЛОГИЧЕСКАЯ АКТИВНОСТЬ
1751
Таблица 2. Кристаллографические характеристики, данные эксперимента и уточнения структуры комплексов 1а и
6
Параметр
1а
6
Формула
C7H14ClCuN3O4S
C28H36Cu2N8O4S2
М
335.26
739.85
Сингония
Моноклинная
Моноклинная
Пространственная группа
I2/c
C2/c
Z
8
4
a , Å
12.6727(6)
16.5934(8)
b, Å
5.5548(4)
16.6627(6)
c, Å
36.920(2)
12.3321(6)
β, град
93.821(5)
101.648(4)
V, Å 3
2593.2(3)
3339.5(3)
dвыч, г/см3
1.717
1.472
μ, см-1
2.057
1.444
F(000)
1368
1528
Размеры образца, мм
0.60 × 0.10 × 0.03
0.75 × 0.50 × 0.40
θmax, град
25.05
25.05
Пределы h, k, l
-15 ≤ h ≤15,
-19 ≤ h ≤19,
-6 ≤ k ≤ 6,
-14 ≤ k ≤ 19,
–39 ≤ l ≤ 43
-14 ≤ l ≤ 12
Число измеренных/независимых рефлексов
6432/2295 [R(int) = 0.0286]
5999/2948 [R(int) = 0.0275]
Число рефлексов с I > 2σ(I)
1945
2262
Число параметров
162
206
GOOF
1.004
1.005
R-Факторы [I > 2σ(I)]
R1 = 0.0303,
R1 = 0.0390,
wR2 = 0.0760
wR2 = 0.1026
R-Факторы (по всему массиву)
R1 = 0.0396,
R1 = 0.0569,
wR2 = 0.0811
wR2 = 0.1110
Δρ max/ΔΔρ mon, e/Å
0.281/-0.348
0.459/-0.377
ион железа находится в высокоспиновом состоя-
тральному атому посредством депротонированно-
нии. Так как комплексы кобальта низкоспиновые,
го карбоксильного атома кислорода, азометино-
а комплексы железа - высокоспиновые, исследуе-
вого атома азота и атома серы в тионной форме.
мый тиосемикарбазон H2L представляет собой ли-
В спектрах комплексов 4-6 отсутствует полоса
ганд среднего поля.
поглощения ν(С=S) и появляется полоса ν(С=N),
что указывает на переход H2L в тиольную форму.
Для определения способа координации лиган-
В ИК спектрах всех комплексов появляется ряд
да с центральными атомами был проведен срав-
новых полос поглощения в области 550-405 см-1,
нительный анализ ИК спектров H2L и комплексов
обусловленных колебаниями ν(М-N), ν(М-O) и
1-11. В ИК спектрах присутствуют полосы погло-
ν(М-S).
щения валентных колебаний координированных
молекул лиганда в областях 3400-3100, 1630-1560,
При перекристаллизации координационных
870-790 см-1. В области 3400-3300 см-1 в спек-
комплекса 1 из воды и комплекса 6 из этанола по-
трах всех комплексов исчезает полоса поглощения
лучены монокристаллы, структура которых была
ν(O-H), что указывает замещение протона в моле-
установлена методом РСА. При перекристаллиза-
куле лиганда. Кроме того, в спектрах комплексов
ции из воды комплекса 1 зеленого цвета из воды
1-3, 7-11 наблюдается смещение полосы ν(С=N)
получены синие монокристаллы комплекса 1а.
в низкочастотную область на 12-43 см-1, а поло-
Кисталлы комплекса 1а относятся к простран-
сы ν(С=S) - в высокочастотную область на 19-
ственной группе I2/c моноклинной сингонии
26 см-1. Это указывает на координацию H2L к цен-
(табл. 2), одноядерные молекулярные комплексы
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 11 2020
1752
ГУЛЯ и др.
Таблица 3. Некоторые межатомные расстояния и валентные углы в молекулах комплексов 1а и 6
d, Å
ω, град
Связь
Угол
1а
6
1а
6
Cu1-N1
1.960(2)
1.944(2)
N1Cu1O1
80.88(9)
82.03(9)
Cu1-O1
1.975(2)
1.969(2)
N1Cu1Cl1/N4
173.19(7)
174.45(10)
Cu1-S1
2.2575(8)
2.2773(8)
N1Cu1S1
85.41(7)
83.40(7)
Cu1-Cl1/N4
2.2005(8)
1.995(3)
N1Cu1O1w/S1*
92.6
100.8(4
Cu1-O1w/S1*
2.571(5)
2.943(3)
O1Cu1Cl1/N4
94.48(7)
93.83(10)
N1-N2
1.365(3)
1.365(3)
O1Cu1S1
163.81(7)
164.21(7)
N2-C4
1.362(3)
1.327(4)
O1Cu1O1w/S1*
99.3
94.5(9)
N3-C4
1.316(3)
1.330(3)
Cl1/N4Cu1S1
98.36(3)
100.29(8)
S1-C4
1.702(3)
1.752(3)
Cl1/N4Cu1O1w/S1*
93.1
83.2(10)
S1Cu1O1w/S1*
89.9
94.2(9)
N1N2C4
116.5(2)
110.7(2)
N2C4N3
116.9(2)
118.1(3)
N2C4S1
121.42(19)
125.0(2)
N3
C4S1
121.7(2)
116.9(2)
[Cu(H2O)(HL)Cl] включают кристаллизационные
полиэдра металла в комплексе 1а занимает анион
молекулы воды. Координационное число централь-
Cl-, а аксиальную позицию занимает атом кисло-
ного атома Cu(I) равно 5, а его координационный
рода молекулы воды (рис. 1).
полиэдр представляет собой искаженную квадрат-
Межатомные расстояния Cu-O1, Cu-N1 и Cu-S1
ную пирамиду. В составе комплекса тридентатный
[d = 1.975(2), 1.960(2) и 2.2575(8) Å] укорочены по
монодепротонированный лиганд HL- координиру-
отношению к найденным [8], a рaсстояния Cu-Cl1
ется к центральному атому посредством донорных
и Cu-O1W равны 2.2005(8) и 2.571(4) Å (табл. 3).
атомов O, N, S с образованием двух пятичленных
Координационное соединение 6 кристаллизует-
металлоциклов. В тиометаллоцикле обнаружено
ся в пространственной группе С2/c моноклинной
сильное разупорядочение электронной плотности,
сингонии (табл. 2). В независимой части элементар-
межатомные расстояния S-C и N-C, d = 1.702(3) и
ной ячейки кристалла комплекса [Cu(3,4-Lut)(L)]
1.316(3) Å, указывают на стабилизацию тионной
находится один атом меди и органические лиган-
формы лиганда (табл. 3). Аналогичное явление ра-
ды L2- и 3,4-Lut. Объединение комплекса в двуя-
нее наблюдалось в полимерном комплексе Cu(II)
дерный происходит посредством двух межатом-
с
4-метилтиосемикарбазоном α-кетоглутаровой
ных связей Cu-S1*, где S* - атом второго лиганда
кислотой [8]. Четвертое координационное место
L2-. Окончательная химическая формула соедине-
в основании пирамидального координационного
ния 6 - [Cu(3,4-Lut)(L)]2. Координационный поли-
эдр атомов меди в комплексе 6 представляет собой
искаженную квадратную пирамиду и образован
органическим лигандом L2-, координированным
к центральному атому металла, как и в комплексе
1а, через набор донорных атомов O, N, S; в основа-
нии пирамиды находится атом азота 3,4-диметил-
пиридина. Так как лиганд H2L вовлечен в комплекс
как мостиковый дважды депротонированный ли-
ганд L2-, в аксиальной позиции полиэдра металла
находится атом серы второго подобного лиганда.
Аналогичный способ координации лиганда об-
наружен в комплексах Cu(II) с 4-метил- и 4-этил-
Рис. 1. Общий вид молекулы комплекса Сu(II) 1а в
тиосемикарбазонами пировиноградной кислоты
кристалле.
[12, 13]. Межатомные расстояния Cu-O1, Cu-N1 и
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 11 2020
СИНТЕЗ, СТРОЕНИЕ И БИОЛОГИЧЕСКАЯ АКТИВНОСТЬ
1753
Таблица 4. Геометрические параметры водородных связей в кристаллах комплексов 1а и 6
Расстояние, Å
Угол DHA,
Контакт D-H∙∙∙A
Координаты атомов А
D-H
H∙∙∙A
D∙∙∙A
град
1а
N2-H2∙∙∙O1w
0.86
2.08
2.877(3)
155
x-1/2, -y+3/2, z
N3-H3∙∙∙Cl1
0.86
2.52
3.213(6)
139
x-1/2, -y+3/2, z
O1w-H1∙∙∙O2w
0.88
1.82
2.688(4)
170
x, y, z
O1w-H1∙∙∙O3w
0.88
1.82
2.688(4)
170
x, y, z
O1w-H2∙∙∙Cl1
0.92
2.94
3.508(2)
122
x, y+1, z
O1w-H2∙∙∙O1
0.92
2.10
2.996(3)
165
x, y+1, z
O2w-H1∙∙∙O2
0.88
2.03
2.816(5)
148
x, y+1, z
O2w-H2∙∙∙O2
0.96
1.91
2.789(4)
152
-x+3/2, -y+1/2, -z+1/2
O3w-H1∙∙∙O2
0.90
2.12
2.96(2)
155
-x+3/2, -y+1/2, -z+1/2
O3w-H2∙∙∙O2w
0.82
2.14
2.96(2)
177
-x+2, y, -z+1/2
C5-H5∙∙∙Cl1
0.97
2.92
3.465(3)
117
x-1/2, -y+3/2, z
O6-H6∙∙∙S1
0.93
3.02
3.904(3)
-x+3/2, y+1/2, -z+1
6
N3-H4∙∙∙O2
0.86
1.97
2.798(3)
160
x-1/2, -y+2/2, z-1/2
C5-H5B∙∙∙O1
0.97
2.60
3.403(4)
140
x-1/2, -y+2/2, z-1/2
C9-H9∙∙∙O1
0.93
2.47
2.999(4)
116
x, y, z
C13-H13∙∙∙S1
0.93
2.86
3.387(3)
117
x, y, z
Cu-S1 в комплексе 6 [d = 1.969(2), 1.944(2) и
тричные димеры. Остальные межмолекулярные
2.2773(8) Å] (табл. 3) подобны найденным в ра-
водородные связи с вовлечением в качестве донора
боте [12] и немного отличаются от найденных в
протона как координированных, так и кристалли-
работе [13], а межатомные расстояния в комплек-
зационных молекул воды, объединяют комплексы
се 6 Cu-N4 и Cu-S1 равны 1.995(3) и 2.943(2) Å
в слои O1W-H∙∙∙Cl1 и O2W3-H∙∙∙O2. Стабилизирова-
(-x + 1, y, -z + 3/2). Анализ межатомных рассто-
ны эти слои слабыми водородными связями С5-
яний в тиометаллоцикле указывает на стабили-
H∙∙∙Сl1, а между собой ассоциированы лишь сла-
зацию тиольной формы лиганда, так длина связи
быми водородными связями С3-H∙∙∙S1.
C-S [d = 1.752(3)] больше укороченной связи в
В кристаллической структуре комплекса
6
комплексе 1а [d =1.702(3) Å] (табл. 3) и сравнима
вдоль оси а можно выделить цепи, образованные
c найденными в комплексах Cu(II) с другими ти-
двуядерными комплексами, ассоциированными
осемикарбазонами пировиноградной кислоты [12,
водородными связями N3-H∙∙∙O2 и стабилизиро-
13]. Геометрические параметры диметилпиридина
соответствуют найденным в комплексах меди с
подобным лигандом из Кембриджской базы струк-
турных данных [14].
Различная степень депротонирования органи-
ческого лиганда в комплексах 1а и 6 и присутствие
как координированных, так и кристаллизацион-
ных молекул воды в комплексе 1а обусловило об-
разование различной системы водородных связей
в кристаллах этих соединений. В кристалле ком-
плексa 1а за счет водородных связей N2-H∙∙∙O1W и
N3-H∙∙∙Cl1 молекулы связываются в бесконечные
цепи вдоль оси а (табл. 4, рис. 3). Эти цепи объ-
единяются с центросимметричными комплексами
Рис. 2. Общий вид молекулы двухъядерного комплекса
соседних цепей посредством водородных связей
Cu(II) 6 в кристалле.
O1W-H∙∙∙O2W и O2W-H∙∙∙O2, образуя центросимме-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 11 2020
1754
ГУЛЯ и др.
Схема 2.
ванные слабыми связями C5-H∙∙∙O1 (табл. 4, рис.
aureus (ATCC
25923), грамотрицательных ки-
4). Сами комплексы стабилизированы внутримо-
шечных палочек Escherichia coli (ATCC 25922) и
лекулярными водородными связями C13-H∙∙∙S1 и
представителя дрожжеподобных грибов Candida
C9-H∙∙∙O1.
albicans (ATCC 10231) показало, что некоордини-
Полученные физико-химические данные по-
рованный H2L не проявляет противомикробной
зволяют представить распределение химических
активности в исследованном интервале концен-
связей в молекулах комплексов 1-11 в следующем
траций и подавляет рост Candida albicans толь-
виде (схема 2).
ко при концентрации 500 мкг/мл. Координация
Изучение in vitro противомикробной и проти-
H2L к ионам 3d-металлов приводит к изменению
вогрибковой активности H2L и координационных
биологической активности. Синтезированные
соединений 1-11 в отношении стандартных штам-
координационные соединения проявляют проти-
мов грамположительных бактерий Staphylococcus
вомикробную и противогрибковую активность и
a
0
c
b
Рис. 3. Фрагмент кристаллической упаковки комплекса 1а.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 11 2020
СИНТЕЗ, СТРОЕНИЕ И БИОЛОГИЧЕСКАЯ АКТИВНОСТЬ
1755
Рис. 4. Образование цепей в кристалле комплекса 6 (а); фрагмент кристаллической упаковки комплекса 6 (б).
обладают минимальной подавляющей концентра-
шего поиска селективных противомикробных ве-
цией (МПК) и минимальной бактерицидной кон-
ществ среди координационных соединений меди с
центрацией (МБК) в интервале 15.62-1000 мкг/мл
тиосемикарбазонами кетокислот, а также смешан-
но-лигандных аминных комплексов меди.
(табл. 5). Основное влияние на противомикроб-
ную активность оказывает природа центрального
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
атома. Противомикробная активность значительно
Рентгеноструктурный анализ. Эксперимен-
усиливается у комплексов меди(II) 1-6. Среди со-
тальные данные для комплексов 1a и 6 получены
единений этой группы выделяются комплексы 5,
при комнатной температуре 293(2) K на дифрак-
6, обладающие более высокой противомикробной
тометре Xсalibur Е с МоKα излучением и графи-
активностью в отношении Staphylococcus aureus и
товым монохроматором. Параметры элементар-
Eschirichia coli.
ной ячейки, уточненные по всему массиву, и
Полученные результаты противомикробной ак-
остальные экспериментальные данные получены
тивности указывают на перспективность дальней-
c использованием комплекса программ CrysAlis
Таблица 5. Минимальные подавляющие (МПК) и бактерицидные (МБК) концентрации (мкг/мл) координационных
соединений 1-11 по отношению к тест-микробам
Eschirichia coli
Staphylococcus aureus
Candida albicans
Соединение
ATCC 25922
ATCC 25923
ATCC 10231
МПК
МБК
МПК
МБК
МПК
МБК
Исходные солиа
>1000
>1000
>1000
>1000
>1000
>1000
H2L
>1000
>1000
>1000
>1000
500
>1000
1
125
250
62.5
125
125
500
2
>1000
>1000
>1000
500
31.25
62.5
3
125
250
62.5
125
125
>1000
4
125
250
31.25
62.5
62.5
250
5
31.25
62.5
15.62
31.25
31.25
62.5
6
15.62
31.25
15.62
31.25
125
250
7
500
>1000
250
>1000
250
>1000
8
>1000
>1000
>1000
>1000
62.5
250
9
500
>1000
250
500
125
500
10
>1000
>1000
>1000
>1000
62.5
250
11
>1000
>1000
>1000
>1000
125
500
а CuCl2·2H2O, CuBr2, Cu(NO3)2·3H2O, Cu(CH3COO)2·H2O, Ni(CH3COO)2·4H2O, CoCl2·6H2O, CoBr2·6H2O, Fe(NO3)2·6H2O, FeBr3.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 11 2020
1756
ГУЛЯ и др.
Oxford Diffraction [15]. Их структуры решены пря-
(C=S).
мыми методами и уточнены МНК в анизотропном
{2-[2-(Проп-2-ен-1-илкарбамотиоил)ги-
приближении для неводородных атомов по про-
дразинилиден]пропаноато}хлоромедь
(1).
К
граммам SHELX-97 [16]. Атомы водорода вклю-
этанольному раствору тиосемикарбазона H2L в
чены в уточнение в геометрически рассчитанных
20 мл спирта при непрерывном перемешива-
позициях, а их температурные факторы UH приня-
нии и нагревании (50-55°С) прибавляли раствор
ты в 1.2 или 1.5 раза большими, чем у связанных
10 ммоль дигидрата хлорида меди(II) в 20 мл эта-
с ними атомов углерода, азота и кислорода. Кри-
нола. Реакционную смесь нагревали 50-60 мин.
сталлизационные молекулы воды в комплексе 1а
После охлаждения до комнатной температуры вы-
локализованы в двух позициях с коэффициентом
падало мелкокристаллическое вещество, которое
заполнения 0.85 и 0.15. В комплексе 6 аллильный
отфильтровывали, промывали небольшим количе-
фрагмент лиганда L2- локализован в двух позициях
ством спирта, эфира и сушили на воздухе до по-
с коэффициентом заполнения 0.5. Основные пара-
стоянной массы.
метры эксперимента, решение и уточнение струк-
Аналогично, используя вместо гидрата хлори-
тур приведены в табл. 2, а некоторые межатомные
да меди(II) бромид меди(II), тригидрат нитрата ме-
расстояния, валентные углы и водородные связи -
ди(II), гидрат ацетата меди(II), синтезировали со-
в табл. 3 и 4. Координаты базисных атомов иссле-
единения 2-4. Синтез комплексов 7-11 проводили
дованных структур депонированы в Кембридж-
аналогично при взаимодействии гидратов ацетата
ский банк данных (CCDC 2010166-2010167).
никеля(II), хлорида и бромида кобальта(II), нитра-
Сопротивление растворов комплексов 1-11 в
та и бромида железа(III) c тиосемикарбазоном H2L
ДМФА (20°С, с = 0.001 моль/л) измеряли с помо-
в молярном отношении 1:2.
щью реохордного моста Р-38. ИК спектры веществ
{2-[2-(Проп-2-ен-1-илкарбамотиоил)гидра-
регистрировали на спектрофотометре Bruker
зинилиден]пропаноато}имидазоломедь
(5). К
ALPHA (4000-400 см-1). Эффективные магнитные
20 мл горячего (50-55°С) этанольного раствора
моменты соединений 1-11 определяли методом
10 ммоль комплекса 4, добавляли 10 ммоль ими-
Гуи. Расчет молярной магнитной восприимчиво-
дазола, перемешивали при нагревании 40-50 мин.
сти с поправкой на диамагнетизм проводили исхо-
При охлаждении образовывался осадок, который
дя из теоретических значений магнитной воспри-
отфильтровывали, промывали небольшим количе-
имчивости органических соединений.
ством этанола и сушили на воздухе.
Противомикробную и противогрибковую ак-
Аналогично, используя вместо имидазола
тивности изучали по стандартным методикам [17, 18].
3,4-диметилпиридин синтезировали соединение
2-{2-[(Проп-2-ен-1-ил)карбамотиоил]гидра-
6. Выходы и физико-химические характеристики
зинилиден}пропановая кислота (H2L). Сме-
полученных комплексов 1-11 приведены в табл. 1.
шивали горячий (55-60°С) спиртовый раствор
ФОНДОВАЯ ПОДДЕРЖА
10 ммоль пировиноградной кислоты в 15 мл этано-
ла с раствором 10 ммоль 4-аллилтиосемикарбази-
Работа выполнена в рамках Государствен-
да в 20 мл этанола. При охлаждении реакционной
ной программы Республики Молдова (проект
смеси выпадал светло-желтый осадок, который
20.80009.5007.10).
отфильтровывали на стеклянном фильтре, про-
КОНФЛИКТ ИНТЕРЕСОВ
мывали небольшим количеством спирта и сушили
Авторы заявляют об отсутствии конфликта
на воздухе. Выход 95%, т. пл. 150-152°С. Хорошо
интересов.
растворим в ДМФА, ДМСО, а при нагревании - в
СПИСОК ЛИТЕРАТУРЫ
спиртах. Спектр ЯМР 1H (ДМСО-d6), δ, м. д.: 2.09
1. Beraldo H., Gambino D. // Mini Rev. Med. Chem. 2004.
с (3H, CH3), 4.26 т (2H, CH2NH, J = 5.6 Гц), 5.16 д.
Vol. 4. N 1. P. 31. doi 10.2174/1389557043487484
д (2H, CH2, J = 1.7 Гц), 5.89 м (1H, CH2=C), 9.33
2. Гуля А.П., Граур В.О., Чумаков Ю.М., Петренко П.А.,
уш. с (1H, NH), 10.78 уш. с (1H, NH), 12.17 уш. с
Бэлан Г.Г., Бурдунюк О.С., Цапков В.И., Рудик В.Ф. //
(1H, OH). Спектр ЯМР 13C (ДМСО-d6), δС, м. д.:
ЖОХ. 2019. Т. 89. Вып. 5. С. 766. doi 10.1134/
12.63 (CH3), 46.54 (CH2N), 116.54 (CH2=), 134.76
S0044460X19050159; Gulea A.P., Graur V.O., Chuma-
(CHаллил), 139.03 (C=N), 165.31 (C=O),
179.00
kov Yu.M., Petrenko P.A., Balan G.G., Burduniuc O.S.,
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 11 2020
СИНТЕЗ, СТРОЕНИЕ И БИОЛОГИЧЕСКАЯ АКТИВНОСТЬ
1757
Tsapkov V.I., Rudic V.F. // Russ. J. Gen. Chem. 2019.
Byrke M.S., Gulya A.P. // Pharm. Chem. J. 2005. Vol. 39.
Vol. 89. N 5. P. 953. doi 10.1134/S1070363219050153
N 6. P. 313. doi 10.1007/s11094-005-0142-8
3. Pahontu E., Fala V., Gulea A., Poirier D., Tapcov V.,
11. Самусь Н.М., Гуля А.П., Цапков В.И., Чумаков Ю.М.,
Rosu T. // Molecules. 2013. Vol. 18. N 8. P. 8812. doi
Рошу Т. // ЖОХ. 2006. Т. 76. Вып. 7. С. 1148; Sa-
10.3390/molecules18088812
mus’ N.M., Gulya A.P., Tsapkov V.I., Chumakov Y.M.,
4. Lukmantara A.Y., Kalinowski D., Kumar N., Richard-
Roshu T. // Russ. J. Gen. Chem. 2006. Vol. 76. N 7.
son D.R. // J. Inorg. Biochem. 2014. Vol. 141. P. 43. doi
P. 1100. doi 10.1134/s1070363206070164
10.1016/j.jinorgbio.2014.07.020
12. Belicchi-Ferrari M., Bisceglie F., Buluggiu E., Pelosi
5. Diaz A., Cao R., Garcia A. // Monatsh. Chem. 1994. Bd
G., Tarasconi P. // Polyhedron. 2010. Vol. 29. N 10. P.
125. H. 8-9. S. 823. doi 10.1007/BF00812694
2134. doi 10.1016/j.poly.2010.04.009
13. Belicchi-Ferrari M., Bisceglie F., Buluggiu E., Pelosi G.,
6. Pathan A.H., Bakale R.P., Naik G.N., Frampton C.S.,
Tarasconi P. // Polyhedron. 2009. Vol. 28. N 6. P. 1160.
Gudasi K.B. // Polyhedron. 2012. Vol. 34. N 1. P. 149.
doi 10.1016/j.poly.2009.01.013
doi 10.1016/j.poly.2011.12.033
14. Allen. F.H. // Acta Crystallogr. 2002. Vol. B58. P. 380.
7. Pathan A.H., Ramesh A.K., Bakale R.P., Naik G.N.,
doi 10.1107/S0108768102003890
Rohit Kumar H.G., Frampton C.S., Advi Rao G.M.,
15. CrysAlis RED, Oxford Diffraction Ltd., Version
Gudasi K.B. // Inorg. Chim. Acta. 2015. Vol. 430. P. 216.
1.171.34.76, 2003.
doi 10.1016/j.ica.2015.03.013
16. Sheldrich G.M. // Acta Crystallogr. (А). 2008. Vol. 64.
8. Baldini M., Belicchi-Ferrari M., Bisceglie F., Dall’-
Р. 112. doi 10.1107/S0108767307043930
Aglio P. P., Pelosi G., Pinelli S., Tarasconi, P. // Inorg.
17. Gulea A., Poirier D., Roy J., Stavila V., Bulimestru I.,
Chem. 2004. Vol. 43. N 22. P. 7170. doi 10.1021/
Tapcov V., Popovschi L // J. Enzyme Inhib. Med.
ic049883b
Chem. 2008. Vol. 23. N 6. P. 806. doi 10.1080/
9. Pelosi G. // Open Crystallogr. J. 2010. Vol. 3. P. 16. doi
14756360701743002
10.2174/1874846501003010016
18. Pahontu E., Usataia I., Graur V., Chumakov Yu., Pe-
10. Присакарь В.И., Цапков В.И., Бурачева С.А., Быр-
trenko P., Gudumac V., Gulea A. // Appl. Organomet-
кэ М.С., Гуля А.П. // Хим.-фарм. ж. 2005. T. 39.
№ 6. С. 30. doi 10.30906/0023-1134-2005-39-6-
al. Chem. 2018. Vol. 32. N 12. P. e4544. doi 10.1002/
30-32; Prisakar’ V.I., Tsapkov V.I., Buracheeva S.A.,
aoc.4544
Synthesis, Structure and Biological Activity of Copper(II),
Nickel(II), Cobalt(III) and Iron(III) Coordination Compounds
with 2-{2-[(Prop-2-en-1-yl)carbamothioyl]hydrazinylidene}-
propanoic Acid
А. P. Guleaa, V. О. Graura,*, E. C. Diuricia, Ia. I. Ulchinaa, P. N. Bouroshb,
G. G. Balanc, O. S. Burduniucc,d, V. I. Tsapkova, and V. F. Rudice
a State University of Moldova, Kishinev, MD-2009 Moldova
b Institute of Applied Physics, Kishinev, MD-2028 Moldova;
c State University of Medicine and Pharmacy „Nicolae Testemitanu”, Kishinev, MD-2001 Moldova
d National Agency of Public Health, Kishinev, MD-2028 Moldova;
e Institute of Microbiology and Biotechnology of Academy of Sciences of Moldova, Kishinev, MD-2028 Moldova
*e-mail: vgraur@gmail.com
Received June 26, 2020; revised June 26, 2020; accepted July 16, 2020
2-Oxopropanoic acid reacts in ethanol with N-(prop-2-en-1-yl)hydrazinecarbothioamide in a 1:1 molar ratio to
form thiosemicarbazone H2L. Coordination compounds Cu(HL)X [X = Cl-, Br-, NO3-], Cu(H2O)(L), Ni(HL)2,
Co(HL)2X [X = Cl-, Br-], Fe(HL)2X [X = NO3-, Br-] are formed by reacting H2L with copper(II), nickel(II), co-
balt(II) and iroν(III) salts. Mixed-ligand amine-containing complexes Cu(A)(L) [A = Im, 3,4-Lut] were obtained
through the reaction of Cu(H2O)(L) with imidazole (Im) and 3,4-dimethylpyridine (3,4-Lut). The structures of
two copper complexes were determined by single crystal X-ray diffraction analysis. The synthesized complexes
exhibit selective antimicrobial and antifungal activity in the concentration range of 15.62-1000 μg/mL. The
introduction of amines into the inner sphere of copper complexes leads to an increase in antimicrobial activity.
Keywords: coordination compounds, pyruvic acid 4-allylthiosemicarbazone, antimicrobial activity, antifungal activity
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 11 2020