ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2020, том 90, № 11, с. 1758-1764
УДК 544.18:547-31/-39:548.3
СИНТЕЗ, МОЛЕКУЛЯРНАЯ СТРУКТУРА И
СПЕКТРАЛЬНЫЕ ХАРАКТЕРИСТИКИ КОМПЛЕКСНЫХ
СОЕДИНЕНИЙ СВИНЦА(II) C 1,5-ДИМЕТИЛ-
4-[2-(3-МЕТИЛ-5-ОКСО-1-ФЕНИЛ-1,5-ДИГИДРО-
4Н-ПИРАЗОЛ-4-ИЛИДЕН)ГИДРАЗИНИЛ]-2-ФЕНИЛ-
1,2-ДИГИДРО-3Н-ПИРАЗОЛ-3-ОНОМ
© 2020 г. Т. Н. А. Вуa, А. Н. Утенышевb,c, Н. А. Полянскаяa,*,
В. А. Нгуенd,e, О. В. Ковальчуковаa,f
a Российский университет дружбы народов, ул. Миклухо-Маклая, Москва, 117198 Россия
b Институт проблем химической физики, Черноголовка, 142432 Россия
c Первый Московский государственный медицинский университет имени И. М. Сеченова,
Москва, 119146 Россия
d Лаборатория прикладной физики, Высший институт материаловедения, Университет имени Тон Дык Тханга,
Хошимин, 729000 Вьетнам
e Факультет прикладных наук, Университет имени Тон Дык Тханга, Хошимин, 729000 Вьетнам
f Российский государственный университет имени А. Н. Косыгина, Москва, 117997 Россия
*e-mail: polyanskaya-na@rudn.ru
Поступило в Редакцию 6 июня 2020 г.
После доработки 6 июня 2020 г.
Принято к печати 21 июня 2020 г.
Катионы Pb(II) образуют комплексы с 1,5-диметил-4-[2-(3-метил-5-оксо-1-фенил-1,5-дигидро-4Н-пира-
зол-4-илиден)гидразинил]-2-фенил-1,2-дигидро-3Н-пиразол-3-оном (HL) в водно-этанольном растворе. В
кристаллическом состоянии выделено соединение состава C42H41N13O9Pb2, определены его спектральные
характеристики, методом РСА установлено, что оно представляет собой сокристаллизат биядерного ком-
плекса Pb2L2(OH)2·(H2O)2 и димерного ассоциата PbLNO3. Согласно расчетам по методу Бейдера, взаимо-
действие между катионами свинца как в биядерной структуре, так и в димерном ассоциате, отсутствует.
Ключевые слова: комплексные соединения, производные азопиразолона, свинец(II), квантово-хими-
ческое моделирование, рентгеноструктурный анализ
DOI: 10.31857/S0044460X20110177
Комплексные соединения свинца(II) с поли-
иона устанавливают обычно по совокупности кри-
функциональными лигандами отличаются много-
сталлографических данных и квантово-химиче-
образием возможных типов координации, образуя
ских расчетов [6].
мономерные, димерные и даже полимерные струк-
Рентгеноструктурные исследования комплекс-
туры [1-5]. Детальный анализ их кристаллической
ных соединений свинца(II) с азаароматическими
решетки [2, 3] указывает на то, что ассоциация
лигандами [7-9] показали, что ð-стекинг играет
соединений происходит за счет слабых взаимо-
важную роль в формировании кристаллической
действий, которые в некоторой мере обусловле-
решетки подобных соединений.
ны неподеленной парой электронов на валентной
оболочке свинца(II). Ее роль в реализации той или
Производные азопиразолона - давно извест-
иной координационной геометрии центрального
ный класс соединений, широко используемых в
1758
СИНТЕЗ, МОЛЕКУ
ЛЯРНАЯ СТРУКТУРА И СПЕКТРАЛЬНЫЕ ХАРАКТЕРИСТИКИ
1759
Рис. 2. Молекулярная структура биядерного комплекса
свинца в сокристаллизате. Атомы водорода не пока-
заны.
затов двух комплексных соединений свинца(II) с
1,5-диметил-4-[2-(3-метил-5-оксо-1-фенил-1,5-ди-
гидро-4Н-пиразол-4-илиден)гидразинил]-2-фенил-
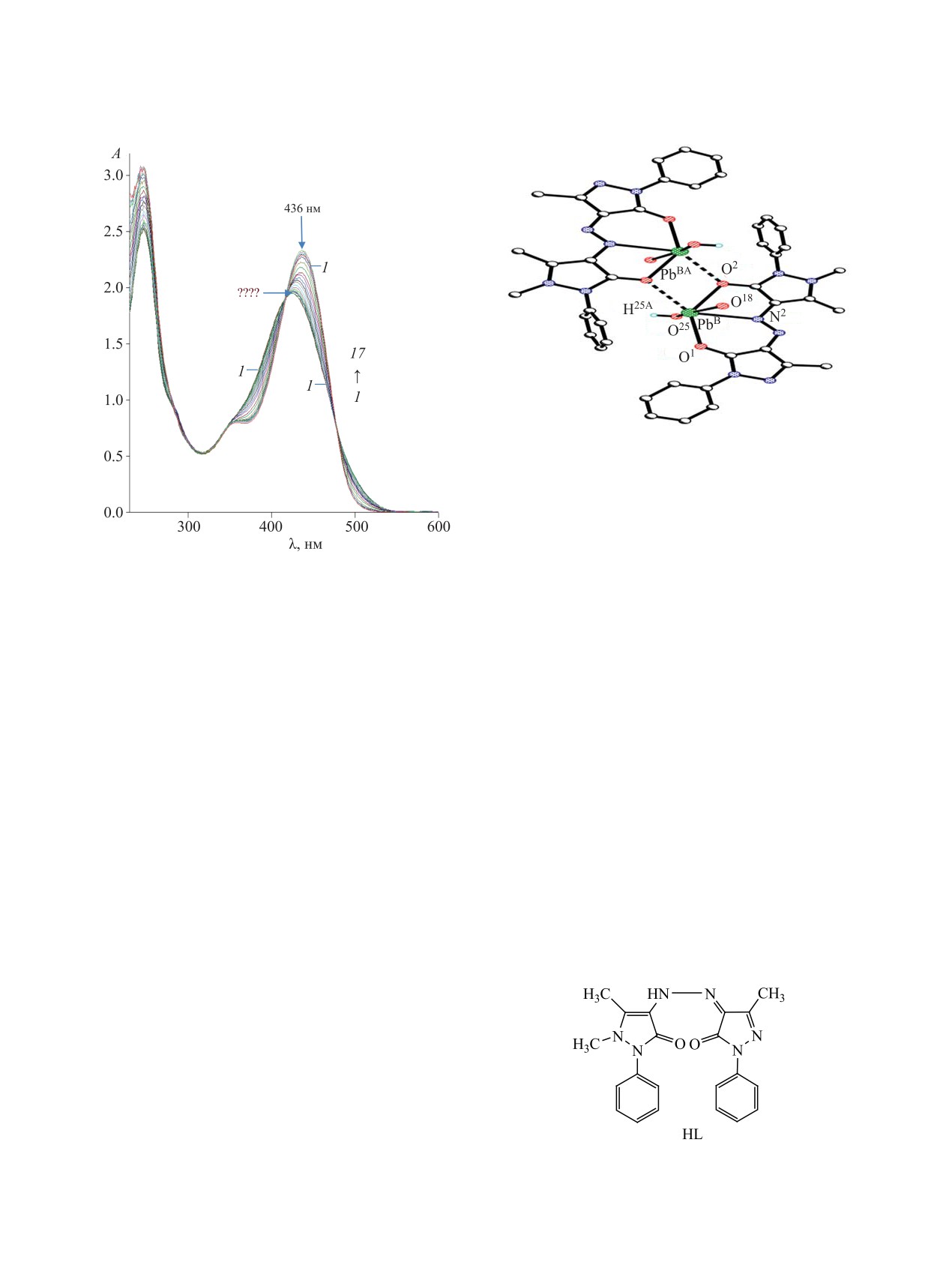
Рис. 1. Изменение ЭСП водно-этанольного раствора со-
единения HL (1) при постепенном добавлении водного
1,2-дигидро-3Н-пиразол-3-оном (HL, схема 1).
раствора Pb(NO3)2 и образование комплекса PbL2 (17).
ИК спектры поглощения соединения HL ха-
рактеризуются интенсивным поглощением в об-
качестве красителей и пигментов в текстильной
ласти валентных колебаний карбонильных групп
[10, 11] и пищевой промышленности [12, 13], в
(1668 см-1) [27], положение которых свидетель-
производстве полимеров [14] и в других областях.
ствует об их участии в образовании прочных
Биологическая активность пиразолонового цикла,
внутримолекулярных водородных связей, что
который находится в основе препаратов жаропо-
подтверждается результатами РСА [27]. В ИК
нижающего, бактерицидного и противоопухоле-
спектре комплекса со свинцом(II) полосы ν(С=О)
вого действия [15], расширяет области примене-
смещаются в область низких частот до 1604 см-1
ния азопроизводных пиразолона, сочетающих ряд
(Δν = 64 см-1). Значительную величину смещения
полезных свойств. Производные азопиразолона,
можно объяснить переходом гидразо-таутомера
содержащие несколько гетероциклических фраг-
HL в азо-таутомер при ионизации и последую-
ментов, не только имеют лучшие колористические
щем комплексообразовании [29], а также значи-
характеристики по сравнению с арилазопиразоло-
тельной степенью ковалентности связей Pb-O
нами [16-23], но и обладают противоопухолевой и
[2, 3]. Интенсивные полосы поглощения при 1500 и
антиоксидантной активностью [24, 25], ценными
1285 см-1 в ИК спектре комплексного соединения
оптическими свойствами [26] и др.
Производные азопиразолона с несколькими
Схема 1.
электронодонорными центрами в молекулах -
хорошие лиганды для образования координацион-
ных соединений. О синтезе, строении и спектраль-
ных характеристиках комплексных соединений
переходных металлов с арил- и гетарилпроизво-
дными пиразолона сообщалось в работах [27-30].
Мы исследовали синтез, молекулярную структу-
ру и спектральные характеристики сокристалли-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 11 2020
1760
ВУ и др.
Рис. 3. Молекулярная структура димерного комплекса
свинца в сокристаллизате. Атомы водорода не пока-
заны.
относятся соответственно к антисимметричным и
симметричным валентным колебаниям нитрат-и-
Рис. 4. Координационный полиэдр свинца в димерном
комплексе сокристаллизата.
она димерного ассоциата PbLNO3. Значительная
величина расщепления (Δν = 225 см-1) указывает
в растворе образуются комплексное соединение
на бидентатную координацию нитрат-ионов, что
PbL2. Вычисленный логарифм константы образо-
не противоречит данным РСА [31].
вания комплекса (lgK = 12.99±0.52) свидетельству-
Сигнал в области 12.90 м. д. в спектре ЯМР 1Н
ет о высокой устойчивости комплекса в растворе.
соединения HL относится к протону группы NH
Согласно данным РСА, выделенные моно-
гидразо-таутомера [29]. Для соединений с азо/
кристаллы представляют собой сокристалли-
гидразо-таутомерией характерно исчезновение
зат двух комплексных соединений свинца(II)
сигнала протона группы NH при образовании ком-
с лигандом HL. Общий вид первого типа ком-
плексного соединения, что подтверждает иониза-
плекса представлен на рис. 2 и соответствует
цию лиганда при комплексообразовании.
биядерному комплексу Pb2L2(OH)2(H2O)2. Каж-
Для изучения комплексообразования в раство-
дый атом свинца (PbВ и PbВА) имеет коорди-
рах выполнено спектрофотометрическое титро-
национное число 6 и связан с двумя атомами
вание соединения HL раствором нитрата свин-
кислорода карбонильных групп пиразолоно-
ца(II) по методу насыщения, которое позволяет
вых фрагментов лиганда HL [r(Pb-Oпиразолон) =
определить максимумы длинноволновой полосы
2.471(9) и 2.489(9) Å], с атомами кислорода ги-
поглощения, константы образования и состав ком-
дроксильной группы и молекулы воды [r(Pb-O) =
плексов в растворах. Электронный спектр погло-
2.549(15) и 2.475(13) Å] и с атомом азота депротони-
щения водно-этанольного раствора соединения HL
рованной гидразогруппы [r(Pb-N) = 2.548(12) Å].
(рис. 1, 1) характеризуется интенсивным поглоще-
Шестая координационная связь атомов свинца
нием в области 423 нм. Титрование раствора НL
образуется с атомом кислорода карбонильной
раствором нитрата свинца(II) приводит к увеличе-
группы соседней молекулы лиганда [r(Pb-OА) =
нию интенсивности длинноволновой полосы по-
2.815(9) Å]. Таким образом, один из атомов кисло-
глощения и ее небольшому батохромному сдвигу
рода органического лиганда координируется с уча-
до 436 нм. Наличие изобестических точек, а также
стием двух своих неподеленных пар, выступая в
смещение длинноволновой полосы на 13 нм может
виде мостикового фрагмента, связывающего коор-
свидетельствовать о протекании комплексообразо-
динационные сферы атомов свинца в биядерный
вания в растворе (рис. 1, 17) и о вхождении соеди-
комплекс. Координационный полиэдр центросим-
нения HL в состав комплекса в анионной форме.
метричных катионов Pb(II) - искаженный октаэдр.
Анализ ЭСП и кривых насыщения 1-17, по-
Центральный узел биядерного комплекса имеет
лученных при титровании, свидетельствует, что
ромбическую форму.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 11 2020
СИНТЕЗ, МОЛЕКУ
ЛЯРНАЯ СТРУКТУРА И СПЕКТРАЛЬНЫЕ ХАРАКТЕРИСТИКИ
1761
Рис. 6. Критические точки (3, -1) в биядерном комплек-
Рис 5. Критические точки (3, -1) в димерном комплек-
се. Желтым цветом обозначены атомы свинца, зеленым
се. Желтым цветом обозначены атомы свинца, зеленым
цветом - критические точки, красным - критические
цветом обозначены критические точки.
точки цикла.
Второе комплексное соединение в сокристал-
функция каждого димера была получена расчетом
лизате соответствует формуле PbLNO3 (рис. 3).
геометрии комплексов в точке методом B3LYP/
Внутренняя сфера атома свинца включает два ато-
LANL2DZ по программе GAUSSIAN-09 [33]. За-
ма кислорода карбонильных групп двух пиразо-
ряд димерных комплексов - 0, мультиплетность -
лоновых фрагментов [r(Pb-Oпиразолон) = 2.463(12)
1. Полученные волновые функции использова-
и 2.434(10) Å], двух атомов кислорода бидентат-
ны для поиска критических точек при анализе по
но координированного нитрат-аниона [r(Pb-O) =
Бейдеру в межмолекулярных контактах по про-
2.695(14) и 2.661(13) Å] и атома азота депротони-
грамме AIMALL [34].
рованной гидразогруппы [r(Pb-N) = 2.452(13) Å].
Как следует из расчета димерного комплекса
Координационное число центрального атома КЧ =
(рис. 5), критическая точка (3, -1), ответственная
5. Координационный полиэдр можно описать как
за связь между атомами свинца в газовой фазе,
искаженную пентагональную пирамиду, в верши-
отсутствует. Таким образом, между атомами свин-
не которой расположен катион свинца (рис. 4).
ца в димере, скорее всего, отсутствует электрон-
В пространстве электронодонорные атомы рас-
ное взаимодействие. Также нет взаимодействия и
полагаются таким образом, что возникает псев-
между соседними атомами кислорода нитратных
до-контакт Pb-Pb’, что приводит к образованию
групп. На рис. 6 представлены координационные
димерных структур, r(Pb-Pb′) = 3.797 Å, что боль-
точки в биядерном комплексе. Из расчета видно,
ше суммы ионных радиусов катионов Pb2+ (1.36±
что связевая координационная точка (3, -1) воз-
0.08 Å) [36]. Длины связей в молекулах органиче-
никает не между атомами свинца, а между карбо-
ских лигандов в обоих комплексах стандартные
нильными атомами кислорода. Следовательно, в
и коррелируют с таковыми в других металлоком-
биядерном комплексе также отсутствует электрон-
плексах азопиразолонов [27-30].
ное взаимодействие между атомами свинца.
С целью изучения возможного взаимодействия
Таким образом, выделен и изучен метода-
между атомами свинца в димерах, представлен-
ми РСА и квантово-химического моделиро-
ных на рис. 2 и 3, были проведены их квантово-
вания сокристаллизат биядерного комплекса
химические расчеты с использованием геометрии
Pb2L2(OH)2(H2O)2 и димерного ассоциата PbLNO3,
из данных РСА. Анализ электронного строения
где L - 1,5-диметил-4-[2-(3-метил-5-оксо-1-фенил-
проводили методом Бейдера. Исходная волновая
1,5-дигидро-4Н-пиразол-4-илиден)гидразинил]-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 11 2020
1762
ВУ и др.
2-фенил-1,2-дигидро-3Н-пиразол-3-он. Согласно
(-17 ≤ h ≤ 17; -19 ≤ k ≤ 19; -22 ≤ l ≤ 22). Структура
расчетам по методу Бейдера, взаимодействие меж-
расшифрованы прямым методом [35]. Позицион-
ду катионами свинца как в биядерной структуре,
ные и температурные параметры не водородных
так и в димерном ассоциате, отсутствует.
атомов уточнены в анизотропном приближении
полноматричным МНК [36]. Позиции атомов во-
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
дорода выявлены из разностных синтезов Фурье
Спектры ЯМР 1Н записывали на спектроме-
и уточнены с наложением ограничений по моде-
тре JEOL JNM-ECA 600 (Япония) в растворе ДМ-
ли наездника. Все расчеты выполнены по ком-
СО-d6 (внутренний стандарт - ТМС) при 22-24°С
плексу программ SHELXTL [37]. Окончательное
в Центре коллективного пользования (научно-об-
значение факторов расходимости R1 = 0.0947 (для
разовательном центре) Российского университета
8280 независимых отражений с I >> 2σ(I) и wR2 =
дружбы народов. ИК спектры регистрировали на
0.2497 по всему массиву данных. GOОF = 1.358.
приборе ФТ 801 в интервале частот 4000-400 см-1
Кристаллографические данные для структуры
в таблетках KBr. Электронные спектры поглоще-
C42H41N13O9Pb2 депонированы в Кембриджском
ния водно-этанольных растворов соединения HL
банке структурных данных (CCDC 1831198).
и их смесей с нитратом свинца(II) в различных
ФОНДОВАЯ ПОДДЕРЖКА
соотношениях (спектрофотометрическое титрова-
ние) записаны на спектрофотометре Varian Cary 50
Работа выполнена при финансовой поддерж-
Scan в интервале длин волн 250-600 нм в кюветах
ке Минобрнауки РФ [проект № 075-03-2020-223
(l = 1 см). Концентрация органического вещества
(FSSF-2020-0017)].
составляла 10-4 моль/л. Состав и константу об-
КОНФЛИКТ ИНТЕРЕСОВ
разования комплексного соединения в водно-эта-
Авторы заявляют об отсутствии конфликта ин-
нольных растворах рассчитывали по методу насы-
тересов.
щения [38, 39].
Синтез комплексных соединений HL с нитра-
СПИСОК ЛИТЕРАТУРЫ
том свинца(II) проводили в этанольном растворе
1. Krisyuk V.V., Baidina I.A., Igumenov I.K. // Main Group
при соотношении реагентов 1:5 соответственно.
Met. Chem. 1998. Vol. 21. P. 199
Раствор выдерживали 20 мин при 70°С, после чего
2. Pettinari C., Marchetti F., Pettinari R., Cingolani A.,
добавляли воду (40% по объему), кипятили 30 мин
Rivarola E., Phillips C., Tanski J., Rossi M., Caruso F. //
и охлаждали до комнатной температуры. Ярко-о-
Eur. J. Inorg. Chem. 2004. P. 3484
ранжевые кристаллы выпадали из маточного рас-
3. Harrowfield J.M., Maghaminia S., Soudi A.A. // Inorg.
Chem. 2004. Vol. 43. P. 1810. doi 10.1021/ic034835x
твора после частичного испарения растворителя в
4. Harrowfield J.M., Marandi F., Soudi A.A. // Inorg.
течение 2 сут. Выход 45%. Найдено, %: C 39.37;
Chim. Acta 2005. Vol. 358. N 13. P. 4099. doi 10.1016/j.
N 13.89; Н 3.65; Pb 32.14. C42H41N13O9Pb2. Вы-
ica.2005.06.015
числено, %: C 39.22; N 14.16; Н 3.21; Pb 32.22 (М
5. Marandi F., Morsali A., Soudi A. A. // Z. anorg. allg.
1286.27)
Chem. 2007. Bd 633. H. 4. S. 661. doi 10.1002/
РСА кристалла сокристаллизата двух комплек-
zaac.200600384
сных соединений в форме призм размером
6. Shimoni-Livny L., Glusker J. P., Bock C. W. // Inorg.
1.560×1.085×1.380 мм выполнен на автомати-
Chem. 1998. Vol. 37. N 8. P. 1853. doi 10.1021/
ic970909r
ческом дифрактометре КМ4 фирмы KUMA
7. Harrowfield J.M., Shahverdizadeh GH., Soudi A.A. //
DIFFRACTION, Польша, λ(МоKα) = 0.71073 Å,
Supramol. Chem. 2003. Vol. 15. P. 367. doi
графитовый монохроматор, ω/2θ сканирование
10.1080/1061027031000104897
при 150.00(10) K. Кристаллы триклинные, пр. гр.
8. Harrowfield J.M., Miyamae H., Skelton B.W., Soudi A.A.,
P-1, a = 12.6894(4), b = 14.2393(5), c = 16.3339(6) Å,
White A.H.. // Aust. J. Chem. 1996. Vol. 49. P. 1029. doi
α = 99.577(3), β = 107.764(3), γ = 113.676(3)°, V =
10.1071/CH9961051
2428.75(14) Å3, Z = 2, dвыч. = 1.756 г/см3. Интенсив-
9. Hall A.K., Harrowfield J.M., Morsali A., Soudi A.A.,
ности 11427 отражения (из них 8280 независимые)
Yanovsky A. // Cryst. Eng. Commun. 2000. Vol. 2. P. 82.
измерены в интервале 2.7715° < θ << 29.4388°
doi 10.1039/b001972k
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 11 2020
СИНТЕЗ, МОЛЕКУ
ЛЯРНАЯ СТРУКТУРА И СПЕКТРАЛЬНЫЕ ХАРАКТЕРИСТИКИ
1763
10. Nadim C.S., Zumbuehl S., Delavy F., Fritsch A.,
29. Kovalchukova O.V., Ryabov M.A., Dorovatovskii P.V.,
Kuehnen R. // Spectrochim. Acta (A). 2009. Vol. 73.
Zubavichus Ya.V., Utenyshev A.N., Kuznetsov D.N.,
P. 505. doi 10.1016/j.saa.2008.11.029
Volyansky O.V., Voronkova V.K., Khrustalev V.N. //
11. Степанов Б.И. Введение в химию и технологию
Polyhedron. 2017. Vol. 121. N 10. P. 41. doi 10.1016/j.
органических красителей. М.: Химия, 1984. 592 с.
poly.2016.09.047
12. Jones R., Ryan A.J., Sternhell S., Wright S.E. //
30. Kovalchukova O.V., Dorovatovskii P.V., Zubavi-
Tetrahedron. 1963. Vol. 19. P. 1497. doi 10.1016/S0040-
chus Ya.V., Bozhenko K.V., Utenyshev A.N., Alabada R.,
4020(01)99223-3
Volyansky O.V., Khrustalev V.N. // Inorg. Chim.
13. Elgemeie G.E.H., Maher H.H., Heba M. // Pigm. Resin
Acta. 2017. Vol. 466. N 1. P. 266. doi 10.1016/j.
Technol. 2001. Vol. 30. P. 210.
ica.2017.06.036
14. Koh J., Greaves A.J. // Dyes Pigments. 2001. Vol. 50.
31. Curtis N.F., Curtis Y.M. // Inorg. Chem. 1965. Vol. 4.
P. 117. doi 10.1016/S0143-7208(01)00028-6
N 6. P. 804. doi 10.1021/ic50028a007
15. Willey R.H. The Chemistry of Heterocyclic Compounds.
32. Бугаенко Л.Т., Рябых С.М., Бугаенко А.Л. // Вестн.
New York: John Willey & sons press. 1964. 539 p.
Московск. унив. Сер. 2. Химия. 2008. Т. 49. С. 363
16. Fati K., Fikret K. // Dyes Pigments. 2008. Vol. 76.
33. Frisch M.J., Trucks G.W., Schlegel H.B., Scuseria G.E.,
P. 147. doi 10.1016/j.dyepig.2006.07.029
Robb M.A., Cheeseman J.R., Scalmani G., Barone V.,
17. Emeleus L.C., Cupertino D.C., Harris S.G., Owens S.,
Mennucci B., Petersson G.A., Nakatsuji H., Caricato M.,
Parsons S., Swart R.M., Tasker P.A., White D.J. // J.
Li X., Hratchian H.P., Izmaylov A.F., Bloino J., Zheng G.,
Chem. Soc. Dalton Trans. 2001. Vol. 8. P. 1239. doi
Sonnenberg J.L., Hada M., Ehara M., Toyota K.,
10.1039/B101780M
Fukuda R., Hasegawa J., Ishida M., Nakajima T.,
18. Wang M., Funabiki K., Matsui M. // Dyes Pigments.
Honda Y., Kitao O., Nakai H., Vreven T., Montgo-
2003. Vol. 57. P. 77. doi 10.1016/S0143-7208(03)00011-1
mery, J.A., Jr., Peralta J.E., Ogliaro F., Bearpark M.,
19. Yen M.S., Wang I.J. // Dyes Pigments. 2004. Vol. 62.
Heyd J.J., Brothers E., Kudin K.N., Staroverov V.N.,
N 2. P. 173. doi 10.1016/j.dyepig.2003.11.018
Keith T., Kobayashi R., Normand J., Raghavachari K.,
20. Fikret K., Ertan N. // Dyes Pigments. 2002. Vol. 55.
Rendell A., Burant J.C., Iyengar S.S., Tomasi J., Cossi M.,
N 2. P. 99. doi 10.1016/S0143-7208(02)00102-X
Rega N., Millam J.M., Klene M., Knox J.E., Cross J.B.,
21. Ertan N. // Dyes Pigments. 1999. Vol. 44. N 1. P. 41. doi
Bakken V., Adamo C., Jaramillo J., Gomperts R.,
10.1016/S0143-7208(99)00066-2
Stratmann R.E., Yazyev O., Austin A.J., Cammi R.,
22. Emandi A., Serban I., Bandula R. // Dyes Pigments.
Pomelli C., Ochterski J.W., Martin R.L., Morokuma K.,
1999. Vol. 41. N 1-2. P. 63. doi 10.1016/S0143-
Zakrzewski V.G., Voth G.A., Salvador P., Dannen-
7208(98)00064-3
berg J.J., Dapprich S., Daniels A.D., Farkas O.,
23. Shawali A.S., Abdallah M.A., Kandil M.A. // J. Adv. Res.
Foresman J.B., Ortiz J.V., Cioslowski J., Fox D.J.
2015. Vol. 6. N 5. P. 721. doi 10.1016/j.jare.2014.04.001
Gaussian 09. Revision D.01. Gaussian Inc., Wallingford
24. Metwally M.A., Gouda M.A., Harmal N.A., Khalil A.M. //
CT. 2013.
Int. J. Mod. Org. Chem. 2012. Vol. 1. P. 96.
34. AIMAll (Version 15.05.18). Todd A. Keith, TK
25. Raman N., Selvan A., Manisankar P. // Spectrochim.
Gristmill Software. Overland Park KS. USA. 2015 (aim.
Acta. (A). 2010. Vol. 76. N 2. P. 161. doi 10.1016/j.
tkgristmill.com).
saa.2010.03.007
35. Sheldrik G.M. SHELX-86. Program for the Crystal
26. Xiaoyi L., Wu Y., Gu D., Fuxi G. // Dyes Pigments. 2010.
Structure Determination. Cambridge, 1986.
Vol. 86. N 2. P. 182. doi 10.1016/j.dyepig.2010.01.002
36. Sheldrick G.M. // Acta Crystallogr. (A). 2008. Vol. 64.
27. Ковальчукова О.В., Нгуен Ван, Полякова И.Н.,
P. 112. doi 10.1107/S0108767307043930
Страшнова С.Б., Сергиенко В.С., Страшнов П.В. //
37. Sheldrick G.M. SHELXTL. Version 6.14. Structure
ЖHX. 2015. Т. 60 № 1. C. 58; Kovalchukova O.V.,
Determination Software Suite. Madison: Bruker AXS,
Nguyen Van, Polyakova I.N., Strashnova S.B., Sergien-
2000.
ko V.S., Strashnov Р.V. // Russ. J. Inorg. Chem. 2015.
38. Бек М., Надьпал И. Исследование комплексообразо-
Vol. 60. N 1. P. 55. doi 10.1134/S0036023614120122
вания новейшими методами. М.: Мир, 1989. 549 с.
28. Kovalchukova O., Van N., Strashnova S., Kuznetsov D.,
39. Россотти Ф., Россотти Х. Определение констант
Berikashvili T. // Acta Crystallogr. (Е). 2015. Vol. 71.
устойчивости и других констант равновесия в рас-
P. 124. doi 10.1107/S205698901402756X
творах. M.: Мир, 1965. 564 с.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 11 2020
1764
ВУ и др.
Synthesis, Molecular Structure and Spectral Characteristics
of Complexes of Lead(II) with 1,5-Dimethyl-4-[2-(3-methyl-5-
oxo-1-phenyl-1,5-dihydro-4H-pyrazol-4-ylidene)-
hydrazinyl]-2-penyl-1,2-dihydro-3H-pyrazol-3-one
T. N. A. Vua, A. N. Utenyshevb,c, N. A. Polyanskayaa,*, V. A. Nguyend,e, and O. V. Kovalchukovaa,f
a Russian Peoples’ Friendship University, Moscow, 117198 Russia
b Institute of Problems of Chemical Physics, Chernogolovka, 142432 Russia
c I.M. Sechenov First Moscow State Medical University, Moscow, 119146 Russia
d Laboratory of Applied Physics, Graduate Institute of Materials Science, Dong Duc Thang University,
Ho Chi Minh City, 729000 Vietnam
e Faculty of Applied Sciences, Ton Duc Thang University, Ho Chi Minh City, 729000 Vietnam
f A.N. Kosygin Russian State University, Moscow, 117997 Russia
*e-mail: polyanskaya-na@rudn.ru
Received June 6, 2020; revised June 6, 2020; accepted June 21, 2020
Pb(II) cations form complexes with 1,5-dimethyl-4-[2-(3-methyl-5-oxo-1-phenyl-1,5-dihydro-4H-pyrazol-4-
ylidene)hydrazinyl]-2-phenyl-1,2-dihydro-3H-pyrazol-3-one (HL) in aqueous ethanol solution. In the crystalline
state, a compound of the composition C42H41N13O9Pb2 was isolated, its spectral characteristics were determined.
By X-ray diffraction data, it is a co-crystallizate of the binuclear complex Pb2L2(OH)2·(H2O)2 and the dimeric
associate PbLNO3. According to calculations by the Bader method, there is no interaction between lead cations
both in the binuclear structure and in the dimeric associate.
Keywords: complex compounds, azopyrazolone derivatives, lead(II), quantum chemical modeling, X-ray
diffraction analysis
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 11 2020