ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2020, том 90, № 11, с. 1765-1772
УДК 547.458.88
ОБРАЗОВАНИЕ КОМПЛЕКСОВ МЕДИ(II) С НИЗКО- И
ВЫСОКОМЕТОКСИЛИРОВАННЫМИ ПЕКТИНАМИ,
МОДИФИЦИРОВАННЫМИ САЛИЦИЛОВОЙ И
АНТРАНИЛОВОЙ КИСЛОТАМИ
© 2020 г. Р. Х. Мударисоваа,*, О. С. Куковинецb, С. В. Колесова
а Уфимский институт химии Уфимского исследовательского центра Российской академии наук,
пр. Октября 71, Уфа, 450054 Россия
b Башкирский государственный университет, Уфа, 450014 Россия
*e-mail: mudarisova@anrb.ru
Поступило в Редакцию 15 июля 2020 г.
После доработки 15 июля 2020 г.
Принято к печати 29 июля 2020 г.
Синтезированы низко- и высокометоксилированные пектины, модифицированные антраниловой и сали-
циловой кислотами для получения эффективных полимерных лигандов. На их основе получены новые
металлополимерные комплексы меди(II), определен их состав, рассчитаны константы устойчивости
и термодинамические характеристики процесса комплексообразования. Эффективность связывания
металла с полимерным лигандом зависит, главным образом, от степени метоксилирования пектина,
кислотности среды, температуры процесса, а также от структуры фармакологически активной кисло-
ты-модификатора. Термическая устойчивость полимерных комплексов меди(II) возрастает при введении
в полисахарид органического комплексона и с уменьшением степени метоксилирования пектина.
Ключевые слова: комплексообразование, яблочный пектин, степень метоксилирования, медь(II), фар-
макофоры, константы устойчивости
DOI: 10.31857/S0044460X20110189
Полимерные металлокомплексы на основе по-
бенности молекул полисахарида создают разноо-
лисахаридов обладают разнообразной биологиче-
бразие физико-химических параметров пектина,
ской активностью. В частности, это было показано
что отражается на их комплексообразующих, био-
для металлокомплексов, полученных с использо-
логических и фармакологических свойствах [7-
ванием в качестве высокомолекулярного лиганда
10]. Усиление комплексообразующей способности
нативного пектина [1-6]. Известно, что пектино-
биополимеров по отношению к ионам металлов
вые вещества являются кислыми полисахаридами,
также возможно путем модификации полисахари-
состояние карбоксильных групп которых опреде-
да органическими соединениями, содержащими
ляет их свойства - способность к взаимодействию
активные нуклеофильные группировки [11-14].
с катионами металлов, аминами и с другими ком-
Целью настоящего исследования является изу-
плексообразователями органической и неоргани-
чение влияния степени метоксилирования яблоч-
ческой природы. В зависимости от относитель-
ного пектина, модифицированного фармаколо-
ного количества карбоксильных групп в остатках
гически активными карбоновыми кислотами, на
галактоуроновой кислоты, этерифицированных
особенности комплексообразования c ионами ме-
метиловым спиртом, различают высокометокси-
ди(II). Основной интерес к комплексам меди(II) с
лированные (со степенью этерификации >50%) и
пектинами связан с возможностью создания на их
низкометоксилированные (со степенью этерифи-
основе новых эффективных лекарственных препа-
кации <50%) пектины. Данные структурные осо-
ратов, обладающих, в частности, противоанемиче-
1765
1766
МУДАРИСОВА и др.
Таблица 1. Элементный состав металлокомплексов НL1-9-Cu2+
Найдено, мас%
Вычислено, мас%
Соединение
С
Н
N
Cu 2+
С
Н
N
Cu 2+
НL1-Cu2+
29.44
4.88
-
11.08
29.41
3.39
-
12.06
НL2-Cu2+
23.96
3.02
-
11.65
29.91
3.45
-
12.27
НL3-Cu2+
23.04
2.93
-
11.99
27.97
2.95
-
12.43
НL4-Cu2+
43.21
4.17
-
7.71
41.75
4.84
-
7.68
НL5-Cu2+
43.85
3.98
-
7.82
42.27
4.81
-
7.96
НL6-Cu2+
42.66
3.25
-
7.95
42.62
4.79
-
8.08
НL7-Cu2+
43.29
4.89
3.25
7.64
41.77
5.10
3.39
7.96
НL8-Cu2+
43.34
4.22
3.14
7.93
42.24
5.09
3.51
8.05
НL9-Cu2+
43.07
3.98
3.27
7.99
42.59
5.07
3.55
8.11
ским действием [1, 5], а также с их использованием
На второй стадии, взаимодействием полимерных
в качестве моделей медьпротеидов (например, ге-
лигандов с сульфатом меди(II) получены медные
моцианина), способных переносить кислород, или
комплексы фармакофорсодержащих пектинов.
катализаторов окислительно-восстановительных
Элементный состав полученных металлокомплек-
процессов в организме [15]. В качестве модифици-
сов приведен в табл. 1. Образование металлоком-
рующей органической компоненты использованы
плексов изучали спектрофотометрически. Следует
антраниловая (1) и салициловая (2) кислоты, об-
отметить, что пектиновые лиганды НL1-НL9 не
ладающие широким спектром фармакологической
поглощают в видимой области спектра. Измене-
активности [16].
ние положения и интенсивности основных полос
Синтез медных комплексов высокометоксили-
в электронных спектрах поглощения водных рас-
рованных НL1 (со степенью этерификации 66%);
творов пектинатов меди(II) в видимой области по
низкометоксилированных НL2 (со степенью эте-
сравнению с раствором сульфата меди(II) и в УФ
рификации 34%); НL3 (со степенью этерифика-
области по сравнению с растворами полимерных
ции 10%) пектинов и фармакофорсодержащих
лигандов подтверждает образование металлоком-
пектинов: НL4 (Пектин-66-2); НL5 (Пектин-34-2);
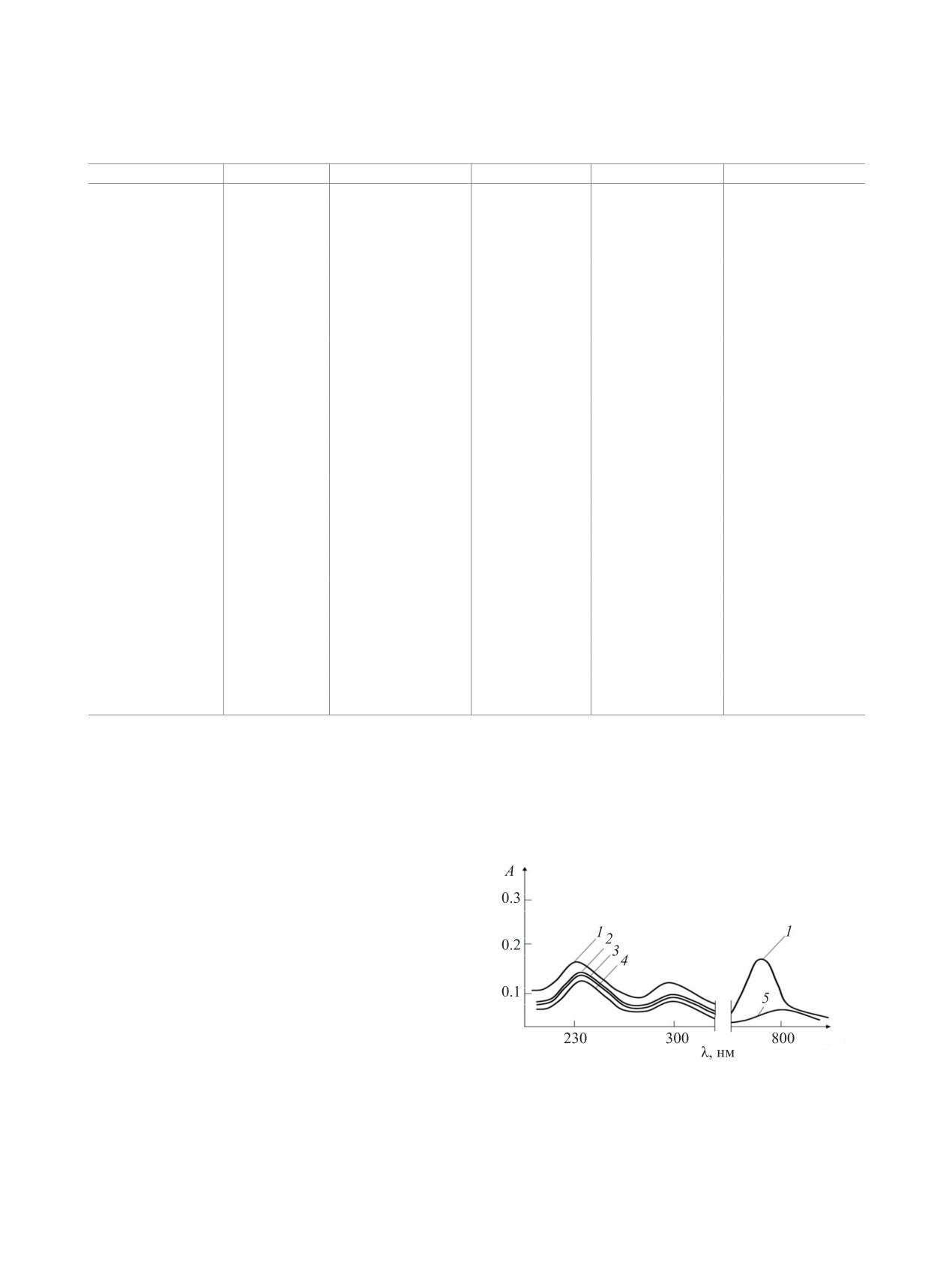
плексных соединений (рис. 1). Так как замещение
НL6 (Пектин-10-2); НL7 (Пектин-66-1); НL8 (Пек-
молекул воды в координационной сфере катио-
тин-34-1); НL9- (Пектин-10-1) осуществляли в
на Cu2+ на более прочно связываемые лиганды
две стадии. На первой стадии, реакцией низко- и
(лучшие доноры электронных пар) увеличивает
высокометоксилированных пектинов с салицило-
разность энергий расщепленных d-подуровней
вой (2) или антраниловой (1) кислотой получены
комплексообразователя, то и его d-d-полоса по-
фармакофорсодержащие пектиновые лиганды.
глощения смещается в сторону более коротких
волн (гипсохромный эффект) (рис. 1).
Для установления влияния кислотности среды
на процесс комплексообразования и определения
областей существования комплексов были изуче-
ны зависимости светопоглощения растворов сме-
си сульфата меди(II) с исследуемыми полимерны-
ми лигандами от рН среды (спектральные данные
представлены на примере металлокомплекса НL4-
Cu2+). На рис. 2 видно, что комплексообразование
начинается уже при низких значениях рН. Опти-
мальной величиной рН при которой оптическая
плотность металлокомплекса как в УФ, так и в
Рис. 1. Электронные спектры поглощения водных
видимой области достигает наибольшего значе-
растворов сульфата меди(II) (1), НL6 (2), смеси НL6 и
сульфата меди(II) (3). [НL6] = 5.0×10-4 моль/л, [Cu(II)] =
ния 6-7. Дальнейшее увеличение рН ведет к об-
5.0×10-4 моль/л, рН = 7, l = 1.0 см, 25
разованию осадка. Измерение оптической плотно-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 11 2020
ОБР
АЗОВАНИЕ КОМПЛЕКСОВ МЕДИ(II)
1767
Таблица 2. Константы устойчивости и термодинамические характеристики металлокомплексов НL1-9-Cu2+
Соединение
Т, K
βк×10-3, л/моль
∆H°, кДж/моль
∆S°, Дж/(моль·K)
∆G°, кДж/моль
НL1-Cu2+
273
1.2±0.1
-9.1±0.1
35.6±0.2
-19.8±0.1
298
0.6±0.1
333
1.0±0.1
НL2-Cu2+
273
1.8±0.1
-14.9±0.1
9.1±0.1
-17.6±0.1
298
1.1±0.1
333
0.5±0.1
НL3-Cu2+
273
2.4±0.2
-14.8±0.1
5.6±0.1
-18.3±0.1
298
1.3±0.1
333
0.7±0.1
НL4-Cu2+
273
24.0±0.2
-16.2±0.1
35.3±0.2
-26.8±0.2
298
10.0±0.1
333
12.0±0.1
НL5-Cu2+
273
2.2±0.1
-20.3±0.2
3.7±0.1
-21.4±0.2
298
8.5±0.2
333
7.8±0.2
НL6-Cu2+
273
1.1±0.1
-15±0.1
19.9±0.1
-21±0.1
298
5.0±0.1
333
16.0±0.2
НL7-Cu2+
273
90.0±0.1
-15.3±0.2
50.2±0.1
-30.4±0.1
298
80.0±0.2
333
23.0±0.2
НL8-Cu2+
273
1.5±0.1
-3.8±0.1
12±0.1
-21.36±0.1
298
1.7±0.1
333
2.0±0.1
НL9-Cu2+
273
1.5±0.1
-8.1±0.1
36.1±0.1
-19.0±0.1
298
2.0±0.1
333
2.7±0.1
сти растворов металлокомплексов в области рН =
комплексообразования указывают на то, что они
2-7 во времени свидетельствует о стабильности
во всех случаях и энтальпийно, и энтропийно
растворов металлокомплексов в течение не менее
благоприятны (∆H°<0, ∆S°>0) и протекают само-
2 сут.
произвольно (ΔG° < 0) (табл. 2). Экзотермичность
комплексообразования указывает на то, что обра-
Анализ изменения поглощения, наблюдаемого
при добавлении раствора неорганической соли к
раствору полимерного лиганда в различных кон-
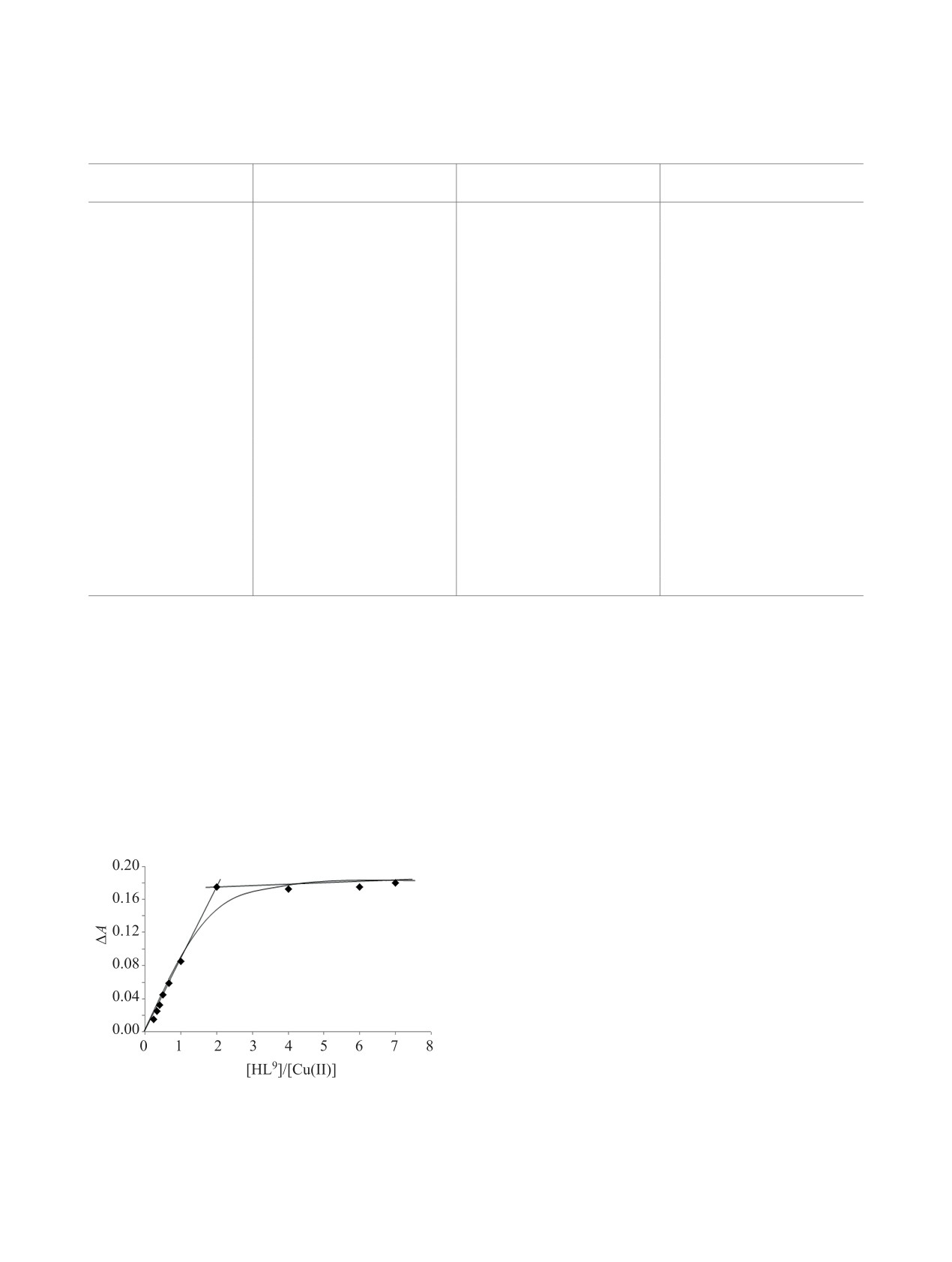
центрациях позволил рассчитать состав и устой-
чивость продуктов взаимодействия. Эксперимен-
тальные данные метода мольных отношений и
изомолярных серий показали, что для всех лиган-
дов как на основе низкометоксилированные пек-
тины, так и высокометоксилированные пектины
образуются комплексы состава CuL2 (рис. 3).
Термодинамические характеристики процесса
комплексообразования и константы устойчиво-
Рис. 2. Электронные спектры поглощения водных рас-
сти металлокомплексов, рассчитанные методом
творов смеси НL4 и сульфата меди(II) при разных рН:
мольных отношений, приведены в табл. 2. Зна-
6.9 (1), 4.5 (2), 2.5 (3); НL4 (4), CuSO4·5H2O (5). [НL4] =
5.0×10-4моль/л, [Cu(II)] = 5.0×10-4 моль/л, l = 1.0 см, 25°C.
чения термодинамических параметров процесса
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 11 2020
1768
МУДАРИСОВА и др.
Таблица 3. Термические свойства лигандов и металлокомплексов НL1-9-Cu2+
Температурный интервал
Образец
Потеря массы, %
Tmax на кривых ДТА, °С
разложения, °С
HL1
37-133
6.7
72.5
HL2
28-134
10.0
55.2
HL3
29-123
10.9
51.2
HL4
32-134
3.2
65.0
HL7
36-128
3.0
66.0
НL1-Cu2+
50-177
7.7
94.1
НL2-Cu2+
43-129
7.2
61.1
НL3-Cu2+
43-129
4.0
90.6
НL4-Cu2+
55-147
7.4
115.0
НL7-Cu2+
50-182
6.6
91.0
HL1
134-300
51.2
238.2
HL2
163-312
64.6
230.3
HL3
161-391
62.6
230.3
HL4
135-300
70.2
201.0
HL7
114-300
49.5
191.0
НL1-Cu2+
178-233
42.4
262.1
НL2-Cu2+
167-297
44.0
234.8
НL3-Cu2+
169-312
40.3
233.1
НL4-Cu2+
148-223
19.6
195.0
НL7-Cu2+
183-300
31.8
272.0
зование связей между центральным ионом и ли-
НL7. Видно, что устойчивость металлокомплексов
гандом энтальпийно выгодный процесс, величина
на основе лигандов НL1-НL3 растет с увеличени-
которого компенсирует затраты, связанные с деги-
ем количества карбоксильных групп в полимер-
дратацией центрального атома и лиганда. Положи-
ной матрице. Известно, что степень метоксили-
тельные величины энтропии образования металло-
рования пектина определяет линейную плотность
комплексов связаны с высвобождением большого
заряда макромолекулы и, следовательно, силу
количества молекул воды из гидратных оболочек
связи с катионом [17]. При высокой степени ме-
исходных ионов, что перекрывает эффект умень-
токсилирования свободные карбоксильные груп-
шения числа частиц при комплексообразовании.
пы или карбокси-анионы удалены друг от друга.
Устойчивость металлокомплексов растет в ряду
При уменьшении степени метоксилирования они
НL1 < НL2 < НL3 < НL8 < НL9 < НL5 < НL6 < НL4 <
сближаются, происходит увеличение плотности
заряда макромолекулы и, соответственно, возрас-
тание силы связывания пектинов с катионами.
Модификация как низкометоксилированных, так
и высокометоксилированных пектинов фарма-
кологически активными кислотами также повы-
шает устойчивость металлокомплексов. Следует
отметить интересную взаимосвязь между степе-
нью метоксилирования фармакофорсодержащих
пектинов и устойчивостью металлокомплексов.
Если для высокометоксилированных пектинов
введение фармакофора повышает устойчивость
металлокомплекса примерно в 16-130 раз, то для
Рис. 3. Кривая насыщения смеси HL9 с сульфатом меди
низкометоксилированных пектинов эта величина
(II). [НL9] = 1.0×10-4 моль/л, [Cu(II)] = 1.0×10-4 моль/л,
становится значительно меньше. Так, для ком-
25°С, λ = 316 нм, l = 1.0 см, растворитель - вода.
плекса НL5-Cu2+ устойчивость возрастает в 8 раз,
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 11 2020
ОБР
АЗОВАНИЕ КОМПЛЕКСОВ МЕДИ(II)
1769
для системы НL6-Cu2+ - в 4 раза, а для комплексов
Схема 1.
НL8-Cu2+ и НL9-Cu2+ - в 1.5 по сравнению с ме-
таллокомплексами на основе немодифицирован-
ных полимерных лигандов.
На устойчивость металлокомплексов влияет
природа модифицирующего агента. Введение в
орто-положение бензольного кольца фармакофора
вместо гидроксигруппы аминогруппы в составе
макромолекулы низкометоксилированные пекти-
ны понижает устойчивость металлокомплексов в
1650 см-1. Спектры металлокомплексов содержат
2.5-5 раз, тогда как для высокометоксилирован-
интенсивные полосы асимметричных и симме-
ные пектины, наоборот, происходит существенное
тричных колебаний ионизированной карбоксиль-
увеличение устойчивости металлокомплекса при-
ной группы СОО-, вовлеченной в координацию с
мерно в 8 раз. Расположение аминной функции в
катионом металла. Кроме того, в спектрах метал-
антраниловой кислоте в орто-положении по от-
локомплексов наблюдается смещение максимума
ношению к карбоксильной, вследствие орто-эф-
поглощения в области 3600-3100 см-1, соответ-
фекта приводит к дополнительному увеличению
ствующего валентным колебаниям гидроксильных
кислотности и некоторому повышению βк для вы-
групп, на 130-75 см-1, и смещение максимумов
сокометоксилированных пектинов.
поглощения валентных колебаний эфирной С-О
Температура процесса по-разному влияет на
связи пиранозного цикла в области 1140-1013 см-1
устойчивость металлокомплексов на основе мо-
на 50-54 см-1 в низкочастотную область. Для со-
дифицированных и исходных пектиновых лиган-
единений НL4-Cu2+-НL9-Cu2+ в области 1600-
дов. В случае последних, устойчивость металло-
1500 см-1 наблюдается уменьшение интенсивно-
комплексов уменьшается с температурой как для
сти, либо высокочастотный сдвиг полос, обуслов-
высокометоксилированных, так и для низкоме-
ленных колебаниями ароматического кольца орга-
токсилированных пектинов. В случае модифици-
нической компоненты комплекса.
рованных высокометоксилированных пектинов
Ранее было показано, что макроциклический
сохраняется такая же зависимость, как и для исход-
водорастворимый комплекс Cu(II) с высокоме-
ных лигандов, тогда как для модифицированных
токсилированным пектином имеет конфигурацию
низкометоксилированных пектинов наблюдается
искаженного квадрата, образующего межцепные
обратная картина: их устойчивость с температу-
двухъядерные комплексы типа китайского фона-
рой увеличивается. Как отмечено выше, молекулы
рика [координационное число Cu(II) равно 4] [1,
модифицированного низкометоксилированного
18], при этом процесс координации (хелатирова-
пектина сближаются, соединяясь друг с другом
ния) сопровождается изменением конформации
при помощи водородных мостиков между карбок-
сильными и гидроксильными группами, что может
полимерных цепей пектина. Такой межмолекуляр-
приводить к формированию более свернутых кон-
ный механизм комплексообразования для полиса-
формационных структурных образований, имею-
харидных полимеров за счет образования гидро-
щих меньшую доступность для катионов металла.
фильной полости между мономерными звеньями
С ростом температуры облегчается процесс раз-
соседних цепей постулируется для металлоком-
ворачивания макромолекул и межмолекулярные
плексов всех известных анионных полисахари-
взаимодействия облегчаются, что и способствует
дов, в том числе и пектинов, при координации их
повышению устойчивости металлокомплексов.
с s-, p- и d-металлами [4]. Опираясь на экспери-
ментальные и литературные данные, образование
Для определения функциональных групп, уча-
металлокомплексов на основе как высоко-, так и
ствующих в комплексообразовании с ионами ме-
низкометоксилированных пектинов можно пред-
ди(II) были сняты ИК спектры полимерных лиган-
дов и их металлокомплексов. Спектры лигандов
ставить следующей схемой 1.
НL1-НL9 характеризуются полосами валентных
Важной характеристикой металлокомплексов,
колебаний карбонильной группы в области 1750-
которая определяет их применение, является тер-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 11 2020
1770
МУДАРИСОВА и др.
мическая устойчивость. Данные термического
новое масло). Электронные спектры поглощения
анализа образцов представлены в табл. 3. В ре-
водных растворов соединений снимали в кварце-
жиме динамического подъема температуры на на-
вых кюветах толщиной 1 см на спектрофотометре
чальном этапе имеет место незначительная потеря
Specord M-40 в области 220-900 нм. Кислотность
массы с небольшим поглощением тепла. Вероят-
растворов определяли на pH-метре АНИОН 4100.
нее всего это связано с потерей слабосвязанной
Необходимую кислотность раствора создавали
воды. Для комплексов потеря воды начинается при
растворами Н2SO4 и NaOH. Для изучения терми-
более высоких температурах, чем для полимерных
ческого разложения образцов использован метод
лигандов, и в интервале 43-55°C составляет 4.0-
совмещенного термического анализа (термогра-
7.7%. Это важно с практической точки зрения, так
виметрия-дифференциальная сканирующая кало-
как свидетельствует об устойчивости комплексов
риметрия). Измерения проводили на приборе син-
в условиях применения комплексов как физиоло-
хронного термического анализа ТГА-ДСК Mettler
гически активных соединений. Термическое раз-
Toledo при скорости нагрева 5 град/мин, в интер-
ложение комплексов также происходит при более
вале температур от 25 до 500°C. Для измерений
высоких температурах и с меньшей потерей мас-
использовали образцы полимеров массой 5-8 мг,
сы, если сравнивать соответствующие лиганды и
применяли тигли из оксида алюминия объемом
комплексы. По-видимому, это обусловлено обра-
70 мкл.
зованием более прочных связей ионов меди(II) с
Состав продуктов взаимодействия пектина с
кислородными атомами воды и с карбоксильными
катионами меди(II) определяли спектрофотоме-
группами модифицированных полимерных лиган-
трически, методами изомолярных серий и моль-
дов, для разрушения которых требуется более вы-
сокая температура. Общее снижение массы метал-
ных отношений [19]. Суммарная концентрация
локомплексов при 300°С на 17.6-60.6% меньше,
компонентов в изомолярной серии составляла 1.0×
по сравнению с образцами, не содержащими медь.
10-4 моль/л. В сериях растворов с постоянной кон-
Причем наибольшей термической устойчивостью
центрацией катиона меди(II) 5.0×10-4 моль/л, кон-
характеризуются фармакофорсодержащие метал-
центрацию полисахарида варьировали от 2.5×10-5
локомплексы НL4-Cu2+ и НL7-Cu2+ (потеря массы
до 5×10-3 моль/л. Постоянство ионной силы под-
19.6, 31.8 % соответственно).
держивали 0.1 М. раствором Na2SO4 марки ХЧ.
Таким образом, показано образование устой-
Образцы яблочного пектина со степенью эте-
чивых медных комплексов низко- и высокоме-
рификации 34, 10% получали суспендированием
токсилированных пектиновых полисахаридов,
10 г порошка нативного пектина в 100 мл 50%-
модифицированных салициловой и антраниловой
ного этанола и добавлением 1 М. раствора NaOH в
кислотами в слабокислой и нейтральной средах.
50%-ном этаноле порциями по 1-2 мл, индикатор -
Относительная устойчивость металлокомплек-
фенолфталеин. После достижения заданной степе-
сов зависит от степени этерификации пектина, от
ни этерификации реакционную смесь подкисляли
природы модифицирующего полисахарид агента
при интенсивном перемешивании 1 М. раствором
и от температуры. Уменьшение степени метокси-
НCl в 50%-ном этаноле до pH = 5-6. Готовый пек-
лирования биополимера, а также его модификация
тин отделяли от водно-спиртового раствора на
фармакофорами повышает устойчивость металло-
фильтре и промывали 300 мл 50%-ного этанола,
комплексов.
затем 150 мл 95%-ного этанола и сушили в вакуу-
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
ме [20]. Степень этерификации образцов опреде-
ляли по методике [21]. Все полученные соедине-
В экспериментах использовали яблочный пек-
ния растворимы в воде.
тин марки Unipectine XPP 240 с молекулярной
массой 26000 Да и степенью этерификации 66%.
НL1. ИК спектр, ν, см-1: 3388 (ОН), 1741 (С=О),
CuSO4·5H2O, салициловая и антраниловая кисло-
1149, 1024 (С-О-С). УФ спектр, λmax, нм: 210. Най-
ты, все марки ЧДА, использовали без дополни-
дено, %: С 40.25; Н 5.49. Вычислено, %: С 42.11;
тельной очистки.
Н 4.86.
ИК спектры регистрировали на спектрометре
НL2 . Выход 91%. ИК спектр, ν, см-1: 3372 (ОН),
Shimadzu IR-Prestige-21 (400-4000 см-1, вазели-
1732 (С=О), 1146, 1017 (С-О–С). УФ спектр, λmax,
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 11 2020
ОБР
АЗОВАНИЕ КОМПЛЕКСОВ МЕДИ(II)
1771
нм: 210. Найдено, %: С 36.10; Н 5.09. Вычислено,
при 50°С и перемешивании в течение 1.0-1.5 ч
%: С 41.16; Н 4.85.
0.1 М. раствор NaOH в дистиллированной воде в
НL3 . Выход 87%. ИК спектр, ν, см-1: 3372 (ОН),
количестве 0.1 г щелочи на 0.2 г полимерного ли-
1732 (С=О), 1145, 1017 (С-О-С). УФ спектр, λmax,
ганда, затем добавляли раствор сульфата меди(II)
концентрации 0.01 моль/л. Через 30 мин целевой
нм: 210. Найдено, %: С 35.20; Н 4.85. Вычислено,
продукт осаждали ацетоном, центрифугировали,
%: С 40.59; Н 4.55.
промывали этанолом, затем диэтиловым эфиром
Общая методика получения пектинов НL4-
и сушили при 40-50°С в вакууме [22]. Все синте-
НL9. 1 г (5.68 ммоль) полисахарида растворяли в
зированные вещества анализировали на медь [23],
20 мл воды (pH = 7-7.1). Затем 5.68 ммоль фарма-
углерод и водород на анализаторе марки EUKO
кофора суспендировали в 20 мл воды и доводили
EA-3000 (табл. 1).
pH до 7-7.1. К раствору полисахарида при интен-
сивном перемешивании прибавляли раствор фар-
ФОНДОВАЯ ПОДДЕРЖКА
макофора при 25°С. Полученную смесь выдержи-
Работа выполнена в рамках Программы фе-
вали 4 ч. По окончании реакции продукт осаждали
деральных научных исследований государствен-
этанолом, затем переосаждали в спирт. Осадок
ных академий на 2013-2020 г. г. (госзадание
отделяли, трижды промывали спиртом, затем ди-
№ АААА-А20-120012090024-5) с использовани-
этиловым эфиром и сушили в вакууме.
ем оборудования Центра коллективного пользова-
НL4 . Выход 82%. ИК спектр, ν, см-1: 3237
ния «Химия» Уфимского института химии РАН и
(ОН), 1746 (С=О), 1626, 1593 (С=СAr), 1100, 1021
Регионального центра коллективного пользования
(С-О-С). УФ спектр, λmax, нм: 232, 303. Найдено,
«Агидель» Уфимского федерального исследова-
%: С 47.22; Н 4.07. Вычислено, %: С 50.39; Н 4.61.
тельского центра РАН.
НL5. Выход 84%. ИК спектр, ν, см-1: 3222
КОНФЛИКТ ИНТЕРЕСОВ
(ОН), 1745 (С=О), 1629, 1587 (С=СAr), 1144, 1013
(С-О-С). УФ спектр, λmax, нм: 230, 304. Найдено,
Авторы заявляют об отсутствии конфликта
%: С 45.97; Н 3.25. Вычислено, %: С 50.27; Н 4.46.
интересов.
НL6. Выход 85%. ИК спектр, ν, см-1: 3276
СПИСОК ЛИТЕРАТУРЫ
(ОН), 1728 (С=О), 1622, 1575 (С=СAr), 1143, 1012
1. Minzanova S.T., Mironov V.F., Vyshtakalyuk A.B.,
(С-О-С). УФ спектр, λmax, нм: 230, 304. Найдено,
Tsepaeva O.V., Mironova L.G., Mindubaev A.Z.,
%: С 44.88; Н 3.11. Вычислено, %: С 49.68; Н 4.42.
Nizameev I.R., Kholin K.V., Milyukov V.A. //
НL7. Выход 91%. ИК спектр, ν, см-1: 3304
Carbohydrate Polym. 2015. Vol. 134. P. 524. doi
(ОН), 1740 (С=О), 1612, 1581 (С=СAr), 1157, 1014
10.1016/j.carbpol.2015.07.034
(С-О-С). УФ спектр, λmax, нм: 317. Найдено, %: С
2. Сибикина О.В., Иозеп А.А., Москвин А.В. // Хим-фарм.
46.01; Н 5.21; N 4.95. Вычислено, %: С 50.27; Н
ж. 2009. Т. 43. № 6. С. 35; Sibikina O.V., Iozep A.A.,
Moskvin A.V. // Pharm. Chem. J. 2009. Vol. 43. N 6.
4.34; N 4.81.
P. 341. doi 10.1007/s11094-009-0292-1.
НL8. Выход 92%. ИК спектр, ν, см-1: 3287
3. Miyada T., Nakajima A., Ebihara K. // British Journal
(ОН), 1735 (С=О), 1610, 1581 (С=СAr), 1102, 1013
of Nutritio. 2011. Vol. 106. Р. 73. doi 10.1017/
(С-О-С). УФ спектр, λmax, нм: 316. Найдено, %: С
S0007114510005842.
46.33; Н 4.87; N 4.83. Вычислено, %: С 50.03; Н
4. Алексеев Ю.Е., Гарновский А.Д., Жданов Ю.А. //
4.41; N 4.79.
Усп. хим. 1998. Т. 67. № 8. С. 723; Alekseev Yu.E.,
НL9. Выход 92%. ИК спектр, ν, см-1: 3289
Garnovskii A.D., Zhdanov Yu.A. // Russ. Chem.
Rev. 1998. Vol. 67. N 8. P. 649. doi 10.1070/
(ОН), 1730 (С=О), 1608, 1581 (С=СAr), 1103, 1015
RC1998v067n08ABEH000343.
(С-О-С). УФ спектр, λmax, нм: 316. Найдено, %: С
5. Минзанова С.Т., Хаматгалимов А.Р., Рыжкина И.С.,
45.93; Н 4.55; N 4.82. Вычислено, %: С 49.62; Н
Муртазина Л.И., Миронова Л.Г., Кадиров М.К.,
4.45; N 4.77.
Выштакалюк А.Б., Милюков В.А., Миронов В.Ф. //
Общая методика получения металлосодер-
Докл. АН. 2016. Т. 467. № 4. С. 431; Minzanova S.T.,
жащего полимерного комплекса. К 20 мл рас-
Khamatgalimov A.R., Ryzhkina I.S., Murtazina L.I.,
твора полимерного лиганда НL1-НL9 прибавляли
Mironova L.G., Kadirov M.K., Vyshtakalyuk A.B.,
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 11 2020
1772
МУДАРИСОВА и др.
Milyukov V.A., Mironov V.F // Doklady Phys.
14. Мударисова Р.Х., Куковинец О.С, Сагитова А.Ф.,
Chem. 2016. Vol. 467. N 2. P. 45. doi 10.7868/
Колесов С.В. // ЖОХ. 2020. Т. 90. № 4. С. 604;
S0869565216100157
Mudarisova R.Kh., Kukovinets O.S. Sagitova A.F,
6. Кайшева Н.Ш., Кайшев А.Ш. Фармакохимические
Kolesov S.V. // Russ. J. Gen. Chem. 2020. Vol. 90. N 4.
основы применения пектинов и альгинатов. Пяти-
P. 660. doi 10.1134/S1070363220040167
горск: РИА-КМВ, 2016. 260 с.
15. Пейве Я.В., Хайлова Г.Ф. Биологическая роль микро-
7. Kastner H., Einhorn-Stoll U., Senge B. // Food
элементов и их применение в сельском хозяйстве и
Hydrocolloids. 2012. Vol. 27. N 1. P.42. v 10.1016/j.
foodhyd.2011.09.001
медицине М.: Наука, 1974. 438 с.
8. Хотимченко Ю.С., Одинцова М.В., Ковалев В.В.
16. Машковский М.Д. Лекарственные средства. М.: Ме-
Полисорбовит. Томск: НТЛ, 2001. 132 с.
дицина, 1984. Т. 2. 405 с.
9. Einhorn-Stoll U., Kastner H., Hecht T., Zimathies A.,
17. Донченко Л.В., Фирсов Г.Г. Пектин: основные свой-
Drusch S. // Food Hydrocolloids. 2015. Vol. 51. P. 338.
ства, производство и применение М.: ДеЛи, 2007.
doi 10.1016/j.foodhyd.2015.05.031
276 с.
10. Аймухамедова Г.Б., Каракеева З.К., Шелухина Н.П.
18. Кайшева Н.Ш., Кайшев А.Ш // ЖФХ. 2013. Т. 87. № 9.
Зависимость свойств пектиновых веществ от их
С. 1527; Kaisheva N.S., Kaishev A.S // Russ. J. Phys.
метоксильной составляющей. Фрунзе: Илим, 1990.
210 с.
Chem. (A). 2013. Vol. 87. N 12. P. 2044. doi 10.1134/
11. Сагитова А.Ф, Мударисова Р.Х., Куковинец О.С. //
S0036024413120108
ЖОХ. 2019. Т. 89. № 7. С. 1079; Sagitova A.F,
19. Булатов М.И., Калинкин И.П. Практическое руко-
Mudarisova R.Kh., Kukovinets O.S. // Russ. J. Gen.
водство по фотометрическим методам анализа. Л.:
Chem. 2019. Vol. 89. N 7. P. 1433. doi 10.1134/
Химия, 1986. 432 с.
S1070363219070132
20. Хотимченко М.Ю. // Биология моря. 2009. Т. 35. № 4.
12. Минзанова С.Т., Миронов В.Ф., Выштакалюк А.Б.,
С. 302.
Цепаева О.В., Миндубаев А.З., Миронова Л.Г., Гу-
21. Афанасьев С.П., Панова Е.П., Кацева Г.Н., Кух-
байдуллин А.Т., Зобов В.В., Ланцова А.В., Петро-
ва Г.Р., Зиатдинова Ф.Х., Коновалов А.И. //
та Э.П., Чирва В.Я. // ХПС. 1984. № 4. С. 428;
Докл. АН. 2010. Т. 434. № 3. С. 356; Minzanova S.T.,
Afanas’ev S.P., Panova É.P., Katseva G.N., Kukhta E.P.,
Mironov V.F., Vyshtakalyu A.B., Tsepaeva O.V.,
Chirva V.Ya. // Chem. Nat. Compd. 1984. Vol. 20.
Mindubaev A.Z., Mironova L.G., Gubaidullin A.T.,
P. 404. doi 10.1007/BF00574322
Zobov V.V., Lantsova A.V., Petrova G.R., Ziatdino-
22. Карасева А.Н., Миронов В.Ф., Цепаева О.В. // Химия
va F.Kh., Konovalov A.I. // Doklady Chem. 2010.
и компьютерное моделирование. Бутлеровск. сообщ.
Vol. 434. N 1. P. 249. doi 10.1134/S0012500810090107
2004. Т. 5. № 1. С. 33.
13. Сливкин Д.А., Лапенко В.Л., Сафонова О.А., Сусли-
на С.Н., Беленова А.С. // Вестн. ВГУ. Серия: Химия,
23. Золотов Ю.А. Основы аналитической химии. Прак-
Биология, Фармация. 2011. № 2. С. 214.
тическое руководство. М.: ВШ, 2001. 463 с.
Formation of Copper(II) Complexes with Low- and High-
Metoxylated Pectins Modified with Salicylic and Anthranylic Acids
R. Kh. Mudarisovaa,*, O. S. Kukovinetsb, and S. V. Kolesova
a Ufa Institute of Chemistry, Ufa Research Center, Russian Academy of Sciences, Ufa, 450054 Russia
b Bashkir State University, Ufa, 450014 Russia
*e-mail: mudarisova@anrb.ru
Received July 15, 2020; revised July 15, 2020; accepted July 29, 2020
Low and high methoxylated pectins were synthesized and modified with anthranilic and salicylic acids to obtain
effective polymeric ligands. On their basis, new metal-polymer complexes with copper(II) were obtained, their
composition was determined, stability constants and thermodynamic characteristics of the complexation process
were calculated. The efficiency of binding of the metal to the polymer ligand depends mainly on the degree of
pectin methoxylation, the acidity of the medium, the temperature of the process, and also on the structure of
the pharmacologically active modifier acid. The thermal stability of polymeric copper(II) complexes increases
with the introduction of an organic complexone into the polysaccharide and with a decrease in the degree of
pectin methoxylation.
Keywords: complexation, apple pectin, degree of methoxylation, copper(II), pharmacophores, stability constants
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 11 2020