ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2020, том 90, № 11, с. 1780-1785
УДК 546.76:546.92:546.06
ВЗАИМОДЕЙСТВИЕ [Pt(NH3)4]Cl2 И NH4VO3 В
ЩЕЛОЧНОМ РАСТВОРЕ В АВТОКЛАВЕ ПРИ 190°С
© 2020 г. Е. В. Фесика,*, Т. М. Буслаеваа, И. А. Архипушкинb
a МИРЭА - Российский технологический университет (Институт тонких химических технологий
имени М. В. Ломоносова), пр. Вернадского 86, Москва, 119571 Россия
b Институт физической химии и электрохимии имени А. Н. Фрумкина Российской академии наук,
Москва, 119071 Россия
*e-mail: 1707-fesik@mail.ru
Поступило в Редакцию 12 июля 2020 г.
После доработки 12 июля 2020 г.
Принято к печати 29 июля 2020 г.
Изучено взаимодействие [Pt(NH3)4]Cl2 и NH4VO3 в щелочном растворе в автоклаве при 190°С. Методами
рентгенофазового анализа, сканирующей электронной микроскопии, энергодисперсионной рентгенов-
ской спектроскопии, динамического рассеяния света и элементного анализа охарактеризован твердый
продукт автоклавного термолиза, представленный двумя фазами: Pt и твердым раствором на основе
платины (Pt3V) - двумя видами частиц разной морфологии с размером менее 1 мкм. Стехиометрия
взаимодействия реагентов (9[Pt(NH3)4]Cl2, 18NH4VO3, 18KOH) соответствует найденному количеству
образующегося свободного аммиака (14NH3) в выбранных условиях.
Ключевые слова: платина, ванадий, автоклавный термолиз, повышенные температуры
DOI: 10.31857/S0044460X20110207
Платина и платиновые сплавы - важные со-
Pt-NT и V2O5-NT и к увеличению на поверхности
ставляющие катализаторов, используемых в хими-
носителя количества кислотных центров Льюиса
ческих реакциях, при очистке отходящих автомо-
и Бренстеда соответственно и, как следствие, к
бильных газов, электродов топливных элементов с
повышению степени конверсии и селективности
протонообменной мембраной, материалов для дат-
гетерогенно-каталитических реакций [4]. Катали-
чиков высокой температуры и коррозии, электрон-
затор Pt-V-MCM-411 обладает высокой катали-
тической активностью в широком диапазоне тем-
ных и оптических устройств [1]. Каталитические
ператур в реакции селективного каталитического
свойства сплава Pt-V проявляются в различных
восстановления NO пропаном [5].
процессах [2-5]. Ванадий, обладающий большим
сродством к кислороду и имеющий отрицатель-
Для получения каталитических систем Pt-V
ный электродный потенциал, при добавлении к
применяют гидротермальный (автоклавный) син-
тез [1-5], который обладает несомненными преи-
платине повышает ее активность как катализатора
муществами перед наиболее часто используемы-
в реакции электровосстановления кислорода [2,
ми методами, основанными на пропитке носителя
3]. Катализатор Pt/V-TiO2 по своим функциональ-
растворами соединений металлов с последующей
ным характеристикам превосходит нелегирован-
сушкой при комнатной температуре и прокалива-
ный носитель TiO2 и Pt/TiO2 в указанной реакции,
нием при 500°С в инертных и восстановительных
причем система Pt-V долговечнее, чем мономе-
средах [6]. При проведении процессов в растворах
таллическая платина. Добавление соединений
при повышенных температурах в автоклаве отсут-
платины и ванадия к титанатным нанотрубкам
(NT) с последующей обработкой в гидротермаль-
1 МСМ-41 - мезопористый алюмоситикатный материал на
ных условиях приводит к образованию частиц
основе цеолита (Si:Al = 41).
1780
ВЗАИМОДЕЙСТВИЕ [Pt(NH
3
)4]Cl2 И NH4VO3
1781
ствуют локальные перегревы, облегчается стан-
дартизация условий эксперимента (температура,
концентрация реагентов и др.).
При автоклавном термолизе аммиакатов пла-
тиновых металлов в щелочных растворах в тем-
пературном интервале
(110-220°C) происходит
образование высокодисперсных металлических
фаз [7-10]. В щелочных водных растворах при
110-220°С в автоклаве происходит восстановле-
ние тетраамминплатины(II) дихлорида [8]:
3[Pt(NH3)4]Cl2 + 6KOH → 3Pt0 + N2 + 10NH3
+ 6H2O + 6KCl.
Рис. 1. Гистограмма, характеризующая распределение
частиц дисперсной фазы по размерам.
Изучение химических процессов в растворах
при повышенных температурах имеет важное зна-
двумя фазами: металлической платиной Pt0 [a =
чение для разработки физико-химических основ
3.935(4) Å] и твердым раствором на основе плати-
формирования полиметаллических фаз с драго-
ны Pt3V [a = 3.934(4) Å] (табл. 1).
ценными металлами [11].
По результатам исследования продукта авто-
С целью синтеза биметаллического сплава
клавного термолиза методом РФЭС, элементный
Pt-V нами проведена реакция солей [Pt(NH3)4]Cl2
состав поверхности можно выразить соотноше-
и NH4VO3 в щелочном растворе в автоклаве при
нием Pt:V:O ≈ 42.1:7.5:50.4 (ат%), что удовлетво-
190°С и получен серый порошок. Согласно данным
рительно согласуется с данными EDX. Рентгено-
электронно-микроскопических исследований, ча-
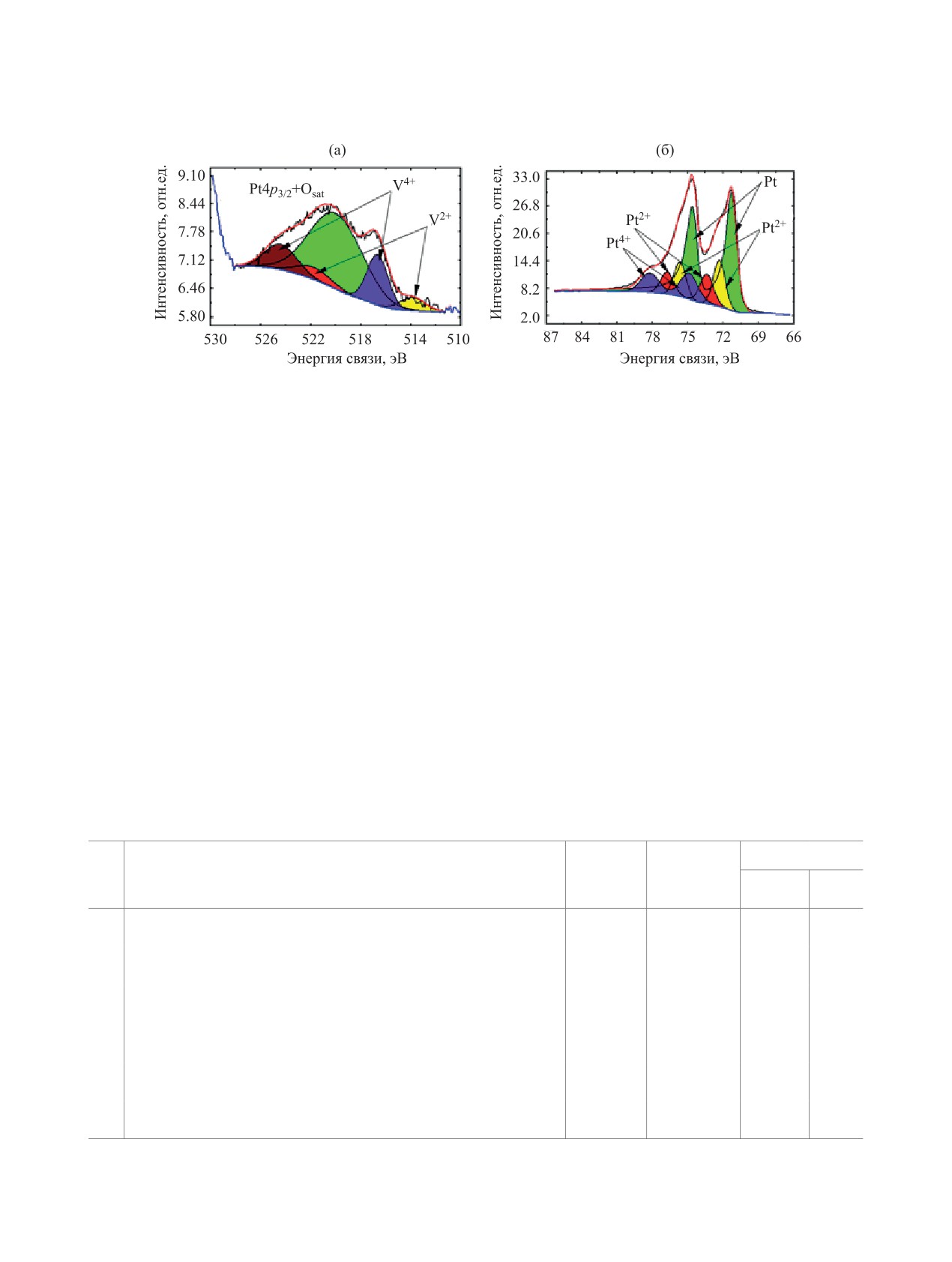
фотоэлектронные (РФЭ) спектры (рис. 2) ванадия
стицы полученного образца морфологически не-
и платины для продукта автоклавного термолиза
однородны: имеются частицы правильной сфери-
характеризуют химические состояния этих эле-
ческой формы, собранные в объемистые пористые
ментов.
образования, и частицы, состоящие из игольча-
тых кристаллов (50-200 нм). Атомное отношение
Спектр платины (рис. 2б) представлен несколь-
Pt-V-O, найденное на основании EDX-спектров,
кими спин-орбитальными дублетами с максиму-
составляет примерно 24:5:70, однако существова-
мом 71.2 эВ. Из спектра можно выделить три со-
ние оксидных фаз методом рентгенофазового ана-
стояния: Pt0 (Есв = 71.2 эВ), Pt2+ (Есв = 72.3, 73.4 эВ)
лиза (РФА) не зарегистрировано.
и Pt4+ (Есв = 74.9 эВ). Более половины обнаружен-
Гистограмма, характеризующая распределе-
ной в образце платины (56%) находится в метал-
ние частиц по размерам в полученном растворе,
лическом состоянии.
согласно данным динамического рассеяния света
Анализ линии V2p осложнен малым содержа-
(ДСР), представлена на рис. 1 (средний размер ча-
нием ванадия в образцах и наложением сателлит-
стиц - 708 нм).
ной линии Al Kα3,4 от спектра O1s. На спектр вана-
Рентгенофазовым анализом подтверждено, что
дия (рис. 2а) накладывается также линия Pt4p3/2.
твердый продукт взаимодействия
[Pt(NH3)4]Cl2
Разделение РФЭ-спектра V2p на дублеты, Есв =
с NH4VO3 в автоклавных условиях представлен
516.7, 513.8 эВ, указывает на присутствие вана-
Таблица 1. Данные рентгенофазового анализа продукта автоклавного термолиза
Экспериментальные данные
База данных ICDD PDF-2
Pt, пространственная группа
Pt3V, пространственная группа
№
I, %
2θ, град
d, Å
Fm-3m (88-2343)
Fm-3m (65-8335)
d, Å
hkl
I, %
d, Å
hkl
I, %
1
100
39.616
2.2729
2.2920
111
100
2.2228
111
100
2
52
46.103
1.9670
1.9850
200
45.9
1.9250
200
46.3
3
38
67.358
1.3889
1.4036
220
23.5
1.3611
220
22.6
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 11 2020
1782
ФЕСИК и др.
Рис. 2. РФЭ-Спектры ванадия V2p (а) и платины Pt4f (б).
дия V4+ и V2+ соответственно. Следовательно, на
практически до нуля. Следовательно, в указанных
поверхности порошка находятся оксиды ванадия
условиях платина(II) полностью восстанавливает-
VO и VO2, которые не были обнаружены методом
ся, а ванадат-ион только на - 50%, и образуются
РФА из-за незначительного количества или высо-
частицы металлической платины и твердого рас-
твора на основе платины - Pt3V. Их присутствие на
кой дисперсности.
поверхности и в объеме образца подтверждается
Спектр кислорода O1s можно представить не-
методами РФА, РФЭС, СЭМ и энергодисперсион-
сколькими компонентами, Eсв(O1s) = 529.9, 531.5,
ным микроанализом.
533.3 эВ. Первая компонента относится к кислоро-
Факт неполного восстановления ванадия(V) в
ду в составе оксидов, а вторая и третья - к гидрок-
рассматриваемом процессе ставит вопрос о форме
сильной группе и воде соответственно; их при-
его существования в растворе. Многочисленные
сутствие объясняется адсорбцией воды из воздуха
сведения о составе и строении ванадатов в раство-
при подготовке образца к анализу.
рах часто противоречивы, а формулы их не всегда
В процессе автоклавных экспериментов кон-
достаточно обоснованы. Противоречия возникают
центрации платины(II) и ванадия(V) в растворе
из-за неправильного учета ионного состояния вана-
снижаются не одинаково. Через 150 мин в щелоч-
дия(V) [19]. В области pH = 7-11 наряду с мономе-
ном растворе при 190°C концентрация ванадия(V)
рами существуют димеры, тримеры, тетра- и пен-
в растворе уменьшается наполовину, а платины -
тамеры ванадат-ионов. Расшифровку равновесия
Таблица 2. Варианты взаимодействия [Pt(NH3)4]Cl2·H2O с NH4VO3 в водном щелочном растворе в автоклаве при
190°С
Исходное
NH3 свободный
№
Возможные реакции
Pt:V (ат)
число ионов
число
%
NH+
молекул
1
[Pt(NH3)4]Cl2 + 2NH4VO3
+ 2KOH → Pt0 + 2V0 + 2NH3 + 2N2 +
1:2
6
2
33.3
2KCl + 8H2O
2
3[Pt(NH3)4]Cl2 + 6NH4VO3
+ 6KOH → 3Pt0 + 3(NH4)4V2O7 +
3:6 (1:2)
18
4
22.2
4NH3 + N2 + 6KCl + 3H2O
3
9[Pt(NH3)4]Cl2 + 18NH4VO3
+ 18KOH → 9Pt0 + 12V + 3(NH4)4V2O7 +
9:18 (1:2)
54
16
29.6
16NH3 + 13N2 +18KCl + 51H2O
4
6[Pt(NH3)4]Cl2 + 12NH4VO3
+ 12KOH → 6Pt0 + 6V + 3(NH4)4V2O7 +
6:12 (1:2)
36
2
5.5
10NH3 + 3N2 + 12KCl + 27H2O
5
9[Pt(NH3)4]Cl2 + 18NH4VO3
+ 18KOH → 9Pt0 + 6V + 6(NH4)4V2O7 +
9:18 (1:2)
54
14
25.9
12NH3 + 9N2 +18KCl + 30H2O
6
6[Pt(NH3)4]Cl2 + 12NH4VO3
+ 12KOH → 6Pt0 + 2V + 5(NH4)4V2O7 +
6:12 (1:2)
36
10
24
26/3NH3 + 11/3N2 + 12KCl + 13H2O
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 11 2020
ВЗАИМОДЕЙСТВИЕ [Pt(NH
3
)4]Cl2 И NH4VO3
1783
ванадатов в растворах проводят, обычно используя
[Pt(NH3)4]Cl2·H2O с NH4VO3 в водном щелочном
метод математического моделирования, но и метод
растворе в автоклаве при 190°С протекает с об-
pH-метрии и метод моделирования равновесий яв-
разованием смеси Pt3V [a = 3.934(4) Å] и Pt0 [a =
ляются косвенными методами и не позволяют не-
3.936(5)Å]. В рассматриваемых условиях происхо-
посредственно установить состав ванадат-ионов
дит неполное (на 50%) восстановления ванадат-и-
и их строение в растворах. Прямые эффективные
она и образование биметаллических частиц Pt3V.
физико-химические методы исследования, позво-
Полученные результаты демонстрируют преиму-
ляющие определить степень гидролиза изополи-
щества автоклавного синтеза, позволяющего по-
ванадат-ионов в растворах, отсутствуют, поэтому
лучать в одну стадию биметаллические порошки,
можно только предполагать в той или иной мере
перспективные для использования в качестве ката-
обоснованные формы их существования в раство-
лизаторов в промышленно важных реакциях.
ре [20]. Учитывая вышесказанное и принимая во
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
внимание диаграмму состояния системы HVO2--
H2O-NaOH [20], с большой вероятностью можно
В работе использовали
[[Pt(NH3)4]Cl2·H2O,
полагать, что ванадат-ион находится в растворе в
синтезированный из H2[PtCl6]·6H2O (ТУ 2612-059-
форме димера V2O74-.
00196533-2002, ОАО «Красцветмет» им. В.Н. Гу-
лидова) по стандартной методике [21] и NH4VO4
Количество свободного аммиака, выделяюще-
(CAS № 7803-55-6, ЧДА). Прочие реактивы имели
гося в результате реакции, определяли методом
квалификацию не ниже ХЧ.
кислотно-основного титрования (табл. 2), его ко-
личество в реакционной смеси - 20-30% от об-
Эксперименты проводили в аналогичных ра-
щего количества аммиака, среднее количество
нее описанным условиях [15, 16]. Навески солей
свободного аммиака в системе - 24%. Количество
[Pt(NH3)4]Cl2∙Н2О и NH4VO3 вносили в 0.1 М.
свободного аммиака в системе, образование ме-
раствор KOH, реакционную смесь заливали во
таллической платины и твердого раствора Pt3V,
фторопластовый автоклав и насыщали азотом для
а также неполное (на 50%) восстановление вана-
предотвращения протекания побочных реакций
дия дают основания предложить варианты реак-
окисления. Автоклав со щелочным раствором сме-
ций (1)-(6) между [Pt(NH3)4]Cl2·H2O и NH4VO3 в
си солей герметизировали и непрерывно встряхи-
водном щелочном растворе в автоклаве при 190°С
вали 150 мин при 190°С (оптимальные условия
(табл. 2).
для восстановления солей). Затем автоклав бы-
Судя по количеству свободного аммиака и со-
стро охлаждали до комнатной температуры, после
ставу продуктов автоклавного термолиза, наиболее
чего раствор замораживали для снижения потерь
близки к стехиометрическому описанию процесса
свободного аммиака в системе. Образовавший-
уравнения (2), (3), (5), (6), а варианты (1) и (4) не
ся порошок серого цвета отфильтровывали через
удовлетворяют этим условиям. Так как после про-
стеклянный фильтр, промывали дистиллирован-
ведения термолиза в растворе обнаружена только
ной водой и сушили до постоянной массы при
половина ванадия, уравнение (2) также отпада-
90-100°С.
ет. По уравнению (3) восстанавливается большая
Количество свободного аммиака в реакци-
части ванадия, тогда как в растворе обнаружена
онной системе после проведения автоклавного
только половина его исходного количества. Урав-
термолиза определяли методом кислотно-основ-
нение (6) более предпочтительно по среднему зна-
ного титрования. Анализ растворов проводили
чению количества свободного аммиака (24%), но
методом атомно-эмиссионной спектроскопии на
не согласуется с количеством ванадия, оставшим-
оптическом эмиссионном спектрометре с индук-
ся в растворе. Таким образом, взаимодействию
тивно-связанной плазмой iCAP 6300 Duo (Thermo
[Pt(NH3)4]Cl2·H2O с NH4VO3 в водном щелочном
Scientific США). Элементный состав и микрофо-
растворе в автоклаве при 190°С в наибольшей сте-
тографию продукта термолиза получали методом
пени соответствует уравнение (5).
рентгеноспектрального микроанализа (РСМА)
Принимая во внимание представленные ре-
на сканирующем электронном микроскопе Jeol
зультаты, можно считать, что взаимодействие
JSM 6390A с EDS приставкой Jeol JED-2200. Раз-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 11 2020
1784
ФЕСИК и др.
меры частиц полученного порошка исследовали
Ellert O.G., Tsodikov M.V., Nikolaev S.A., Novotortsev
методом динамического рассеяния на анализато-
V.M. // Russ. Chem. Rev. 2014. Vol. 83 N 8. P. 718. doi
ре размера частиц 90Plus/BI-MAS (Brookhaven).
10.1070/RC2014v083n08ABEH004432?locatt
7. Фесик Е.В., Мальчиков Г.Д., Гребнев В.В. // Вест.
Морфологию образцов изучали с использовани-
СамГУ Естеств. сер. 2007. Т. 59. № 9-1. С. 287.
ем сканирующего электронного микроскопа (Carl
8. Коваленко Н.Л., Мальчиков Г.Д., Вершков А.В. // Ко-
Zeiss NVision 40, Япония). Химический состав
орд. хим. 1987. Т.13. № 4. С.554.
поверхности исследован с помощью соответ-
9. Белоусов О.В., Сиротина А.В., Белоусова Н.В., Фе-
ствующей приставки для энергодисперсионного
сик Е.В., Борисов Р.В., Мальчиков Г.Д. // Ж. Сиб. фед.
рентгеновского анализа (EDX). Фазовый состав
унив. Техн. и технол. 2014. Т. 7. № 2. С. 138.
твердого продукта изучали на дифрактометре ARL
10. Коваленко Н.Л., Рогин Н.Я., Мальчиков Г.Д. // Коорд.
X’TRA (TermoFisherScientific, Швейцария) (CuKα,
хим. 1985. Т. 11. № 9. С.1276.
λ = 1.54056 Å, интервал углов 2θ = 5-80°). Фазы
11. Белоусова Н.В., Сиротина А.В., Белоусов О.В., Пар-
идентифицировали, пользуясь автоматизирован-
фенов В.А. // ЖНХ. 2012. Т. 57. № 1. С. 18; Belousova
N.V., Sirotina A.V., Belousov O.V., Parfenov V.A. // Rus.
ной базой данных PCPDFWIN PDF2. Параметры
J. Inorg. Chem. 2012. Vol. 57. N 1. С. 15. doi 10.1134/
элементарной ячейки уточняли с помощью про-
S0036023612010044
граммы DICVOL04 [22].
12. Борисов Р.В., Белоусов О.В., Жижаев А.М., Бело-
Фотоэлектронные спектры исследуемых по-
усова Н.В., Кирик С.Д. // ЖНХ. 2018. Т. 63. № 3.
рошков получали на рентгенофотоэлектрон-
С. 289. doi 10.7868/S0044457X18030030; Borisov R.V.,
ном спектрометре Omicron ESCA+ (OMICRON
Belousov O.V., Zhizhayev A.M., Belousova N.V.,
nanoscience, ФРГ) при возбуждении монохрома-
Kirik S.D. // Rus. J. Inorg. Chem. 2018. Vol. 63. N 3.
тическим Al-излучением с энергией 1486.6 эВ и
P. 308. doi 10.1134/S0036023618030038
13. Fesik E.V., Grebnev V.V., Zarazhevskii V.I., Malchi-
мощностью 252 Вт. Давление в камере анализато-
kov G.D. // Russ. J. Appl. Chem. 2014. Vol. 87. N 5.
ра не превышало 10-9 Торр. Энергия пропускания
P. 591. doi 10.1134/S1070427214050097
анализатора 20 эВ. Положение линий элементов,
14. Борисов Р.В., Белоусов О.В. // Ж. Сиб. фед. унив.
входящих в состав поверхностного слоя, стандар-
Химия. 2014. Т. 7. № 3. С. 331.
тизовали по спектру C1s осаждаемых из атмосфе-
15. Фесик Е.В., Буслаева Т.М., Мельникова Т.И. //
ры и в ходе синтеза углеводородных загрязнений.
ЖОХ. 2019. Т. 89. № 2. С. 319. doi 10.1134/
Энергию связи пика принимали равной 285.0 эВ.
S0044460X19020227; Fesik E.V., Buslaeva T.M.,
Melnikova T.I. // Rus. J. Inorg. Chem. 2019. Vol. 89.
КОНФЛИКТ ИНТЕРЕСОВ
N 2. P. 309. doi 10.1134/S1070363219020221
Авторы заявляют об отсутствии конфликта
16. Фесик Е.В., Буслаева Т.М., Мельникова Т.И. // ЖОХ.
интересов.
2017. Т. 87. № 2. С. 177; Fesik E.V., Buslaeva T.M.,
Melnikova T.I. // Rus. J. Gen. Chem. 2017. Vol. 87. N
СПИСОК ЛИТЕРАТУРЫ
2. P.159. doi 10.1134/S1070363217020013
1. Corbel G., Topi´c M., Gibaud A., Lang C. I. // J.
17. Wang D., Peng Q., Li Y. // Nano Res. 2010. Vol. 3. P.
Alloys Compd. 2011. Vol. 509. P. 6532. doi 10.1016/j.
574. doi 10.1007/s12274-010-0018-4
jallcom.2011.03.079
18. Sankar M.1, Dimitratos N., Miedziak P. J., Wells P. P.,
2. Bharti A., Cheruvally G. // J. Power Sources. 2017. Vol.
Kielye C. J., Hutchings G. J. // Chem. Soc. Rev. 2012.
363. P. 413. doi 10.1016/j.jpowsour.2017.07.111
Vol. 41. P. 8099. doi 10.1039/c2cs35296f
3. Kim J.-H., Kwon G., Lim H., Zhu C., You H., Kim
19. Музгин В.Н., Хамзина Л.Б., Золотавин В.Л., Безру-
Y.-T. // J. Power Sources. 2016. Vol. 320. P. 188. doi
ков И.Я. Аналитическая химия ванадия. Серия:
10.1016/j.jpowsour.2016.04.019
«Аналитическая химия элементов» М.: Наука, 1981.
4. Camposeco R., Castillo S., Mejia-Centeno I.,
216 с.
Navarrete J., Rodriguez-Gonzalez V. // Micropor.
20. Спицын В.И., Мартыненко Л.И. Неорганическая
Mesopor. Mat. 2016. Vol. 236. P. 235. doi 10.1016/j.
химия. М.: МГУ, 1994, 624 с.
micromeso.2016.08.033
21. Синтез комплексных соединений металлов платино-
5. Jeon J.Y., Kim H.Y., Woo S.I. // Appl. Catal. (B). 2003.
вой группы: Справочник / Под ред. И.И. Черняева.
Vol. 44. P. 301. doi 10.1016/S0926-3373(03)00078-X
М.: Наука, 1964. 339 с.
6. Эллерт О.Г., Цодиков М.В., Николаев С.А., Ново-
22. Boultif A., Louer D. // J. Appl. Cryst. 2004. Vol. 37.
торцев В.М. // Усп. хим. 2014. Т. 83. № 8. С. 718;
P. 724. doi 10.1107/S0021889804014876
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 11 2020
ВЗАИМОДЕЙСТВИЕ [Pt(NH
3
)4]Cl2 И NH4VO3
1785
Reaction of [Pt(NH3)4]Cl2 with NH4VO3 in an Alkaline Solution
at 190°C in Autoclave
E. V. Fesika,*, T. M. Buslaevaa, and I. A. Arkhipushkinb
a MIREA - Russian Technological University (M.V. Lomonosov Institute of Fine Chemical Technologies), Moscow, 119571
b A.N. Frumkin Institute of Physical Chemistry and Electrochemistry of the Russian Academy of Sciences, Moscow, 119071
Russia
*e-mail: 1707-fesik@mail.ru
Received July 12, 2020; revised July 12, 2020; accepted July 29, 2020
The reaction of [Pt(NH3)4]Cl2 with NH4VO3 in an alkaline solution at 190°C under autoclave conditions was
studied. The solid reaction product, which is represented by two phases: Pt (a = 3.936 (5) Å) and solid solution
Pt3V (a = 3.934 (4) Å), was characterized by the methods of XRD, XPS, DSR, SEM, and elemental analysis.
The presence of two types of particles of different morphology is shown. The particle size of the powder is
less than 1 micron. A reaction equation is proposed that describes the process that occurs when [Pt(NH3)4]Cl2
and NH4VO3 react in an alkaline solution at 190°C under autoclave conditions. The results can be used as the
basis for the synthesis of catalysts that are promising for use in a number of industrially important reactions.
Keywords: platinum, vanadium, autoclave thermolysis, elevated temperatures
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 11 2020