ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2020, том 90, № 11, с. 1791-1794
КРАТКИЕ
СООБЩЕНИЯ
УДК 547.794.2:547.652.1
СИНТЕЗ ДИАЛКИЛАМИДОВ
2-НАФТИЛСЕЛЕНОУКСУСНЫХ КИСЛОТ ИЗ
4-(2-НАФТИЛ)-1,2,3-СЕЛЕНАДИАЗОЛА
© 2020 г. M. Ихлевa, М. Л. Петровb,*, Л. М. Певзнерb, А. И. Поняевb
a Университет г. Джиджель, 18000 Алжир
b Санкт-Петербургский государственный технологический институт (технический университет),
Московский пр. 26, Санкт-Петербург, 190013 Россия
*e-mail: mlpetrov@lti-gti.ru
Поступило в Редакцию 4 июля 2020 г.
После доработки 24 июля 2020 г.
Принято к печати 1 августа 2020 г.
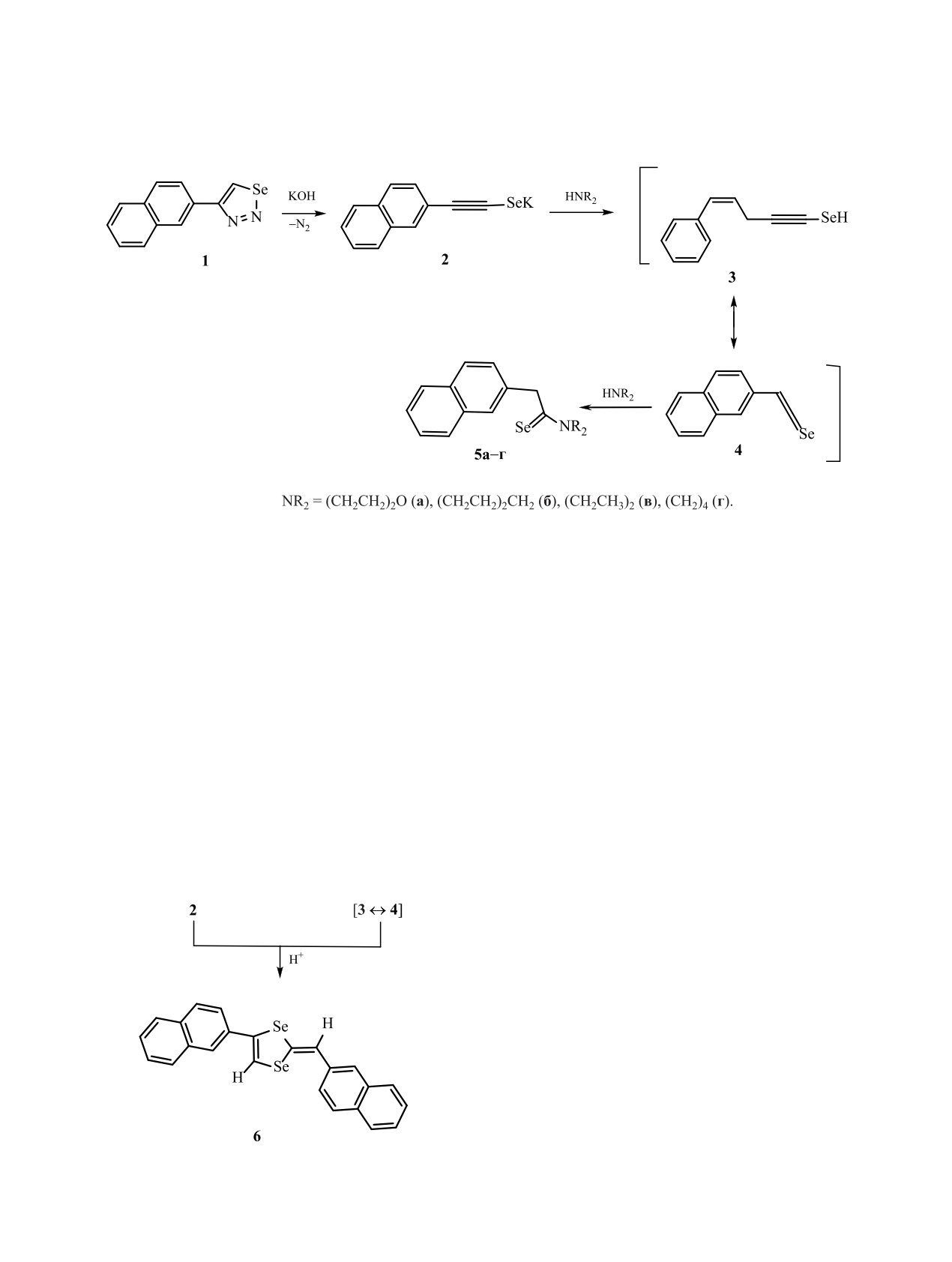
4-(2-Нафтил)-1,2,3-селенадиазол под действием гидроксида кaлия легко разлагается с выделением азота
и образованием 2-(2-нафтил)этинселенолята калия. Дальнейшая обработка реакционной смеси избытком
вторичных аминов привела к образованию соответствующих диалкиамидов 2-нафтилселеноуксусных
кислот с выходом 64-92%.
Ключевые слова: нафталин, 1,2,3-селенадиазол, диалкиламиды 2-нафтилселеноуксусных кислот,
2-нафтилселеноуксусная кислота
DOI: 10.31857/S0044460X20110220
Для 2-нафталинзамещенных 1,2,3-халькогена-
действием трет-бутилaтa кaлия в абсолютном
диазолов исследована реакционная способность
ТГФ легко разлагается с выделением азота и обра-
4-(2-нафтил)-1,2,3-тиадиазола [1]. Под действием
зованием 2-(2-нафтил)этинселенолята калия. При
сильных оснований 4-(2-нафтил)-1,2,3-тиадиазол
дальнейшей обработке реакционной смеси избыт-
разлагается с выделением азота и образованием
ком галогеналкила были получены соответствую-
2-нафтилацетиленового тиолята. При использова-
щие алкил-2-(2-нафтил)-1-этинилселениды [5].
нии избытка вторичных аминов из 2-нафтилаце-
В данной работе нами изучено действие силь-
тиленового тиолята образуются соответствующие
ных оснований в апротонной среде на 4-(2-наф-
амиды 2-нафтилтиоуксусной кислоты, а под дей-
тил)-1,2,3-селенадиазол
1 в присутствии вто-
ствием таких протонодоноров, как вода, спирт или
ричных алифатических аминов. Исходный
кислота 2-нафтилацетиленовый тиолят образует
4-(2-нафтил)-1,2,3-селенадиазол
1 получали из
димер ацетиленовых тиолятов - 4-(2-нафтил)-2-
2-нафтилметилкетона по модифицированной ме-
[1-(2-нафтил)метилиден]-1,3-дитиол [1].
тодике [5].
Замена серы в 1,2,3-тиадиазоле на селен при-
4-(2-Нафтил)-1,2,3-селенадиазол
1 под дей-
водит к появлению новой биологической активно-
ствием гидроксида калия в абсолютном диоксане
сти и изменению физико-химических свойств [2].
в присутствии избытка вторичного алифатическо-
Известен термически нестабильный селеновый
го амина легко разлагается с выделением азота и
аналог 4-(2-нафтил)-1,2,3-тиадиазола [3]. При на-
образованием 2-(2-нафтил)этинселенолата калия
гревании 4-(2-нафтил)-1,2,3-селенадиазол разла-
2. Данное предполагаемое промежуточное соеди-
гается до 2-нафтилацетилена с выделением азота
нение 2 при протонировании аминами образует
и селена [4]. 4-(2-Нафтил)-1,2,3-селенадиазол под
таутомерную смесь: 2-(2-нафтил)этинселенол 3 и
1791
1792
ИХЛЕВ и др.
Схема 1.
2-(2-нафтил)селенокетен 4 (схема 1). Под действи-
щается в димер - 2-(2-нафтил)метилен-4-(2-наф-
ем вторичных аминов на 2-(2-нафтил)селенокетен
тил)-2H-1,3-диселенол 6.
4 образуются соответствующие диалкиламиды
Таким образом, установлено, что в присутствии
2-нафтилселеноуксусных кислот 5а-г.
безводного гидроксида калия и аминов 4-(2-наф-
СПо данным ТСХ реакционных смесей, про-
тил)-1,2,3-селенадиазол разлагается до соответ-
цесс образования диалкилселеноамидов
5а-г
ствующего селенолята, а дальнейшее протекание
сопровождается образованием побочного про-
реакции с образованием либо амидов 2-нафтилсе-
дукта реакции протонирования 2-(2-нафтил)этин-
леноуксусных кислот либо соответствующего ди-
селенолат калия 2 - 2-(2-нафтил)метилен-4-(2-наф-
мера определяется природой амина.
тил)-2H-1,3-диселенола 6 [5] (схема 2).
Строение диалкиламидов 2-нафтилселеноук-
При использовании первичных алифатических
сусных кислот 5а-г доказано при помощи спек-
(бутиламина, бензиламина) или ароматических
троскопии ЯМР 1Н, 13С и масс-спектрометрии.
аминов (анилина) в этой реакции амиды 2-наф-
Морфолиламид
2-нафтилceлeноуксусной
тилселеноуксусных кислот 5 не образуются. Вме-
кислоты (5a). К суспензии 0.29 г (5.2 ммоль) мел-
сто этого после раскрытия селенадиазольного
корастертого гидрокcида калия в 5 мл диоксана
кольца 2-(2-нафтил)этинселенолат калия 2 только
добавляли раствор 0.44 г (1.7 ммоль) 4-(2-наф-
при обработке реакционной смеси водой превра-
тил)-1,2,3-cеленaдиазола 1 в 5 мл диоксана и 5 мл
(48.5 ммоль) морфолина. Реакционную смесь пере-
Схема 2.
мешивали 5 мин до прекращения выделения газа,
затем кипятили при перемешивании в течение 2 ч.
После удаления диоксана остаток суспензировали
в воде, нейтрализовали разбавленной соляной кис-
лотой и экстрагировали хлороформом. Экстракт
сушили хлористым кальцием, затем отгоняли хло-
роформ. Остаток кристаллизовали из этанола. Вы-
ход 0.48 г (89 %), белый порошок, т. пл. 122-124°C,
Rf 0.36 (этилацетат-гексан, 3:5). Спектр ЯМР 1Н
(СDCl3), δ, м. д.: 3.48 м (4H, CSeNCH2,), 3.68 м
(4H, CH2CH2O), 3.91 с (2H, CH2CSe), 7.39-7.42 м
(1H, Ar), 7.46-7.51 м (2H, Ar), 7.70 с (1H, Ar), 7.79-
7.82 м (1H, Ar), 7.84 д (2H, Ar, J = 8.0 Гц). Спектр
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 11 2020
СИНТЕЗ ДИАЛКИЛАМИДОВ
1793
ЯМР 13C (СDCl3), δС, м. д.: 41.05 и 42.20 (NCH2),
(5H, Ar), 7.59-7.62 м (2H, Ar), 7.81-7.89 м (7H, Ar).
46.56 (CH2CSe), 66.49 и 66.82 (CH2O), 125.83 (C6ʹ),
Спектр ЯМР 13C (СDCl3), δC, м. д.: 48.99 и 51.98
126.28 (C7ʹ), 126.74 (C8ʹ), 127.04 (C5ʹ), 127.57 (C1ʹ),
(CH2CH2), 55.21, 58,26 (NCH2), 64.42 (CH2CSe),
127.69 (C4ʹ), 128.55 (C3ʹ), 132.32 (C10ʹ), 132.38 (C9ʹ),
125.87 (C6ʹ), 126.24 (C7ʹ), 126.76 (C8ʹ), 127.03 (C5ʹ),
133.56 (C2ʹ), 169.60 (C=Se). Масс-спектр, m/z :
127.71 (C1ʹ), 127.78 (C4ʹ), 128.49 (C3ʹ), 132.14 (C10ʹ),
320.0554 [М + H]+ (вычислено для C16H18SeON:
132.51 (C9ʹ), 133.51 (C2ʹ), 199.27 (C=Se). Масс-
320.0549).
спектр, m/z: 304.0599 [М + H]+(вычислено для
Пиперидиламид
2-нафтилселеноуксусной
C16H18SeN: 304.0604)
кислоты (5б) получали аналогично из 0.29 г
Температуры плавления измерены на прибо-
(5.2 ммоль) гидрокcида калия, 0.5 г (1.9 ммоль)
ре Boetius. Спектры ЯМР 1H и 13C зарегистриро-
4-(2-нафтил)-1,2,3-cеленaдиазола
1 и
4.0 мл
ваны на приборе Bruker Avance III HD (400.13 и
(48.5 ммоль) пиперидина. Выход 0.56 г (92%), ко-
100.16 МГц соответственно). Масс-спектры высо-
ричневый порошок, т. пл. 118-120°C, Rf 0.3 (эти-
кого разрешения (HRMS-ESI) зарегистрированы
лацетат-гексан, 1:4). Спектр ЯМР 1Н (СDCl3), δ,
на приборе Micromass 70-VSE c электроспрей-и-
м. д.: 1.61 м и 1.77 м [6Н, N(CH2)2(CH2)3], 3.61 т и
онизацией электронов. Контроль за ходом реакции
4.45 т (4Н, NCH2, J = 5.2 Гц), 4.70 с (2Н, CH2CSe),
осуществляли методом ТСХ на пластинах Silufol
7.51 м (2H, Ar), 7.58 д. д (1H, Ar, J = 3.2 Гц), 7.84 м
UV-254 (этилацетат-гексан), проявление УФ све-
(4H, Ar). Спектр ЯМР 13C (СDCl3), δС, м. д.: 25.35
том и парами иода. Все растворители, использо-
и 26.06 (NCH2CH2), 29.70 (CH2CH2CH2), 52.49,
ванные в работе, очищены и абсолютированы по
54.85 и 56.54 (CSeNCH2), 126.12 (C6ʹ), 126.26 (C7ʹ),
стандартным методикам.
126.29 (C8ʹ,5ʹ), 127.70 (C1ʹ,4ʹ), 128.57 (C3ʹ), 132.45
(C10ʹ), 132.92 (C9ʹ), 133.57 (C2ʹ), 201.55 (C=Se).
ФОНДОВАЯ ПОДДЕРЖКА
Масс-спектр, m/z: 318.0765 [М + H]+ (вычислено
Работа выполнена при поддержке Министер-
для C17H20SeN: 318.0761).
ства образования и науки России в рамках гос-
N,N-Диэтиламид
2-нафтилселеноуксус-
задания (проект № 785.00Х6019) с использова-
ной кислоты (5в) получали аналогично из 0.1 г
нием оборудования Инжинирингового центра
(1.8 ммоль) гидрокcида калия, 0.3 г (1.2 ммоль)
Санкт-Петербургского государственного техноло-
4-(2-нафтил)-1,2,3-cеленaдиазола
1 и
4 мл
гического института.
(32.4 ммоль) диэтиламина. Выход 0.26 г (75%),
красные кристаллы, т. пл. 142-145°C (изопропа-
КОНФЛИКТ ИНТЕРЕСОВ
нол), Rf 0.3 (этилацетат-гексан, 4:1). Спектр ЯМР
Авторы заявляют об отсутствии конфликта ин-
1Н (СDCl3), δ, м. д.: 1.14 т и 1.39 т (6H, NCH2CH3,
тересов.
J = 7.2 Гц), 3.56 к и 4.17 к (4H, NCH2, J = 7.2 Гц), 4.64
с (CH2CSe), 7.46-7.55 м (2H, Ar), 7.56-7.57 м (1H,
СПИСОК ЛИТЕРАТУРЫ
Ar), 7.79-7.84 м (4H, Ar). Спектр ЯМР 13C (СDCl3),
1. Ихлев М., Петров М.Л., Певзнер Л.М. // ЖОХ. 2014.
δС, м. д.: 11.03 и 12.13 (2CH3CH2), 47.17 и 51,70
Т. 84. Вып. 9. С. 1580; Yekhlef M., Petrov M.L., Pevz-
(NCH2CH3), 54.49 (CH2CSe), 125.61 (C6ʹ), 125.84
ner L.M. // Russ. J. Gen. Chem. 2014. Vol. 84. N 9.
(C7ʹ), 126.19(C8ʹ), 126.27 (C5ʹ), 127.04 (C1ʹ), 127.71
(C4ʹ), 128.54 (C3ʹ), 132.47 (C10ʹ), 133.04 (C9ʹ), 133.58
P. 1863. doi 10.1134/S1070363214090382
(C2ʹ), 202,21 (C=Se). Масс-спектр, m/z : 306.0756
2. Bakulev V.A., Dehaen W. The Chemistry of 1,2,3-
[М+H]+(вычислено для C16H10SeN:306.0781).
Thiadiazoles. New York: J. Wiley & Sons, 2004. p. 225.
3. Caplin A. // J. Chem. Soc. Perkin Trans. 1. 1974. P. 30.
Пирoлидиламид
2-нафтилселеноуксусной
doi 10.1039/P19740000030
кислоты (5г) получали аналогично из 0.116 г
4. Golgolab H., Lalezari I. // J. Heterocycl. Chem. 1975.
(2.07 ммоль) гидрокcида калия, 0.2 г ( 0.77 ммоль)
4-(2-нафтил)-1,2,3-cеленaдиазола
1 и
1.0 мл
Vol. 12. N 4. P. 801. doi 10.1002/jhet.5570120442
(12.0 ммоль) пирoлидина. Выход 0.17 г (64%), ко-
5. Ихлев М., Петров М.Л., Певзнер Л.М., Поняев А.И. //
ричневый порошок, т. пл. 96-97°C (изопропанол),
ЖОХ. 2018. Т. 88. Вып. 1. С. 150; Yekhlef M.,
Rf 0.6 (этилацетат-гексан, 3:5). Спектр ЯМР 1Н
Petrov M.L., Pevzner L.M., Ponyaev A.I. // Russ. J.
(СDCl3), δ, м. д.: 2.00 м [4H, N(CH2)2(CH2)2], 3.41
Gen. Chem. 2018. Vol. 88. N 1. P. 159. doi 10.1134/
м и 4.01 м (NCH2), 4.52 с (CH2CSe), 7.47-7.52 м
S1070363218010279
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 11 2020
1794
ИХЛЕВ и др.
Synthesis of 2-Naphthylselenoacetic Acid Dialkylamides
from 4-(2-Naphthyl)-1,2,3-selenadiazole
M. Yekhlefa, M. L. Petrovb,*, L. M. Pevznerb, and A. I. Ponyaevb
a University of Jijel, 18000 Algeria
b St. Petersburg State Institute of Technology (Technical University), St. Petersburg, 190013 Russia
*e-mail: mlpetrov@lti-gti.ru
Received July 4, 2020; revised July 24, 2020; accepted August 1, 2020
Under the action of potassium hydroxide, 4-(2-naphthyl)-1,2,3-selenadiazole readily decomposes with the
evolution of nitrogen and the formation of potassium 2-(2-naphthyl)ethynylselenolate. Further treatment of the
reaction mixture with an excess of secondary amines led to the formation of the corresponding dialkamides of
2-naphthylselenoacetic acids in 64-92% yield.
Keywords: naphthalene, 1,2,3-selenadiazole, 2-naphthylselenoacetic acid dialkylamides, 2-naphthylseleno-
acetic acid
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 11 2020