ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2020, том 90, № 12, с. 1807-1813
УДК 547.816:547.556.93:535.37
ПОЛИФУНКЦИОНАЛЬНЫЕ ИОНОХРОМНЫЕ
АРОИЛГИДРАЗОНЫ 1,3-ДИГИДРОКСИ-6-ОКСО-
6H-БЕНЗО[c]ХРОМЕН-2,4-ДИКАРБАЛЬДЕГИДА
© 2020 г. О. Г. Николаеваa, О. Ю. Карлутоваa, А. Д. Дубоносовb,*,
В. А. Бреньa, В. И. Минкинa
a Научно-исследовательский институт физической и органической химии Южного федерального университета,
Ростов-на-Дону, 344090 Россия
b Федеральный исследовательский центр Южный научный центр Российской академии наук,
пр. Чехова 41, Ростов-на-Дону, 344006 Россия
*e-mail:aled@ipoc.sfedu.ru
Поступило в Редакцию 22 июля 2020 г.
После доработки 22 июля 2020 г.
Принято к печати 4 августа 2020 г.
Синтезированы ионохромные ди(ароилгидразоны) нового 1,3-дигидрокси-6-оксо-6H-бензо[c]хро-
мен-2,4-дикарбальдегида. Полученные соединения представляют собой полифункциональные хемосенсо-
ры, способные детектировать фторид-, цианид- и ацетат-анионы, а также катионы переходных металлов.
Образование комплексов с анионами приводит к изменению окраски раствора в ДМСО со светло-желтой
на оранжево-красную. Добавление хлоридов двухвалентных никеля, кобальта и цинка изменяет цвет
раствора на оранжевый. Одновременно наблюдается существенное тушение исходной флуоресценции.
Ключевые слова: бензо[c]хромен, кумарин, ионохромизм, поглощение, флуоресценция, ионохромный
эффект (naked-eye effect)
DOI: 10.31857/S0044460X2012001X
Кумарины (производные 2Н-хромен-2-она) со-
Мы разработали метод получения 1,3-диги-
ставляют обширную группу гетероциклических
дрокси-6-оксо-6H-бензо[c]хромен-2,4-дикарбаль-
соединений, интенсивно изучаемых в органиче-
дегида с двумя активными гидроксиформильными
ской, физической и медицинской химии [1-4].
центрами, способными к дальнейшей модифика-
Некоторые кумарины используются в качестве
ции. Сплавление 1,3-дигидрокси-6H-бензо[c]хро-
базовых структур для дизайна лекарственных пре-
мен-6-она 1 [18] с п-толуидином в присутствии
паратов [5-7], на их основе получен ряд противоо-
триэтил ортоформиата приводит к 2,4-бис{[(4-ме-
пухолевых, антипролиферативных, антиоксидант-
тилфенил)амино]метилиден}-1H-бензо[c]хро-
ных, противогрибковых, противовоспалительных
мен-1,3,6(2H,4H)-триону
2 с выходом
75%
и противовирусных средств [8-13]. Замещенные
(схема 1). Гидролиз соединения 2 в соляной кисло-
кумарины, как правило, обладают флуоресценци-
те приводит к 1,3-дигидрокси-6-оксо-6H-бензо[c]-
ей в видимой части спектра, а также другими по-
хромен-2,4-дикарбальдегиду 3.
лезными фотофизическими свойствами, благодаря
В спектре ЯМР 1Н соединения 2 в ДМСО на-
которым они применяются в лазерных красителях,
блюдается расщепление сигналов протонов CHNH
светоизлучающих устройствах, фотоэлементах;
в дублеты, J = 13-14 Гц, что однозначно свиде-
2Н-хромен-2-он можно считать одним из наибо-
тельствует о его нахождении в кето-енаминной
лее универсальных каркасов для создания флуо-
форме [19]. Одновременно происходит удвоение
ресцентных, ионохромных, хемо- и биосенсорных
всех сигналов, связанное, согласно литературным
систем [3, 14-17].
данным [20], с Z/E-изомеризацией по связи C=С.
1807
1808
НИКОЛАЕВА и др.
Схема 1.
В спектре ЯМР 1Н дикарбальдегида 3 проявля-
протонов групп СH и NH гидразоновых фрагмен-
ются триплетные сигналы протонов Н8 и Н9 анне-
тов соответственно. Сигналы 1- и 3-гидроксигрупп
лированого бензольного кольца при 7.63 и 7.93 м. д.
кумаринового фрагмента проявляются в виде
двух однопротонных синглетов при 13.72-13.81 и
и дублеты протонов Н7 и Н10 при 8.24 м. д. и
14.88-14.96 м. д.
8.96 м. д. Синглеты протонов формильных групп в
положениях 2 и 4 фиксируются в слабом поле при
Как следует из литературных данных, гидрок-
10.21 и 10.24 м. д.
сиениминное строение соединений
4 должно
способствовать не только ESIPT-флуоресценции
Кипячение дикарбальдегида 3 в смеси пропан-
(Excited-State Intramolecular Proton Transfer), обу-
2-ол-ДМФА (1:2) с гидразидами ароматических
словленной быстрым внутримолекулярным O→N
кислот (схема 1) привело к получению ароилгидра-
переносом протона в синглетном возбужденном
зонов 4а-д. В ИК спектрах ароилгидразонов 4а-д
состоянии, но и ее ингибированию при образова-
присутствуют полосы колебаний карбонильных
нии комплексов in situ с катионами переходных
групп кумаринового и гидразонового фрагментов
металлов [21-25]. Кроме того, соединения 4 име-
в области 1706-1727 и 1645-1692 см-1 соответ-
ют дополнительные центры координации - груп-
ственно. Полосы колебаний групп C=N наблюда-
пы NH ароилгидразоновых фрагментов, которые
ются при 1617-1625 cм-1.
способны детектировать анионы [26, 27].
В спектрах ЯМР 1Н соединений 4а-д при 8.88-
Оценку ионохромной и хемосенсорной актив-
9.01 и 12.09-12.38 м. д. присутствуют синглеты
ности соединений 4 по отношению к анионам и
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 12 2020
ПОЛИФУНКЦИОНАЛЬНЫЕ ИОНОХРОМНЫЕ АРОИЛГИДРАЗОНЫ
1809
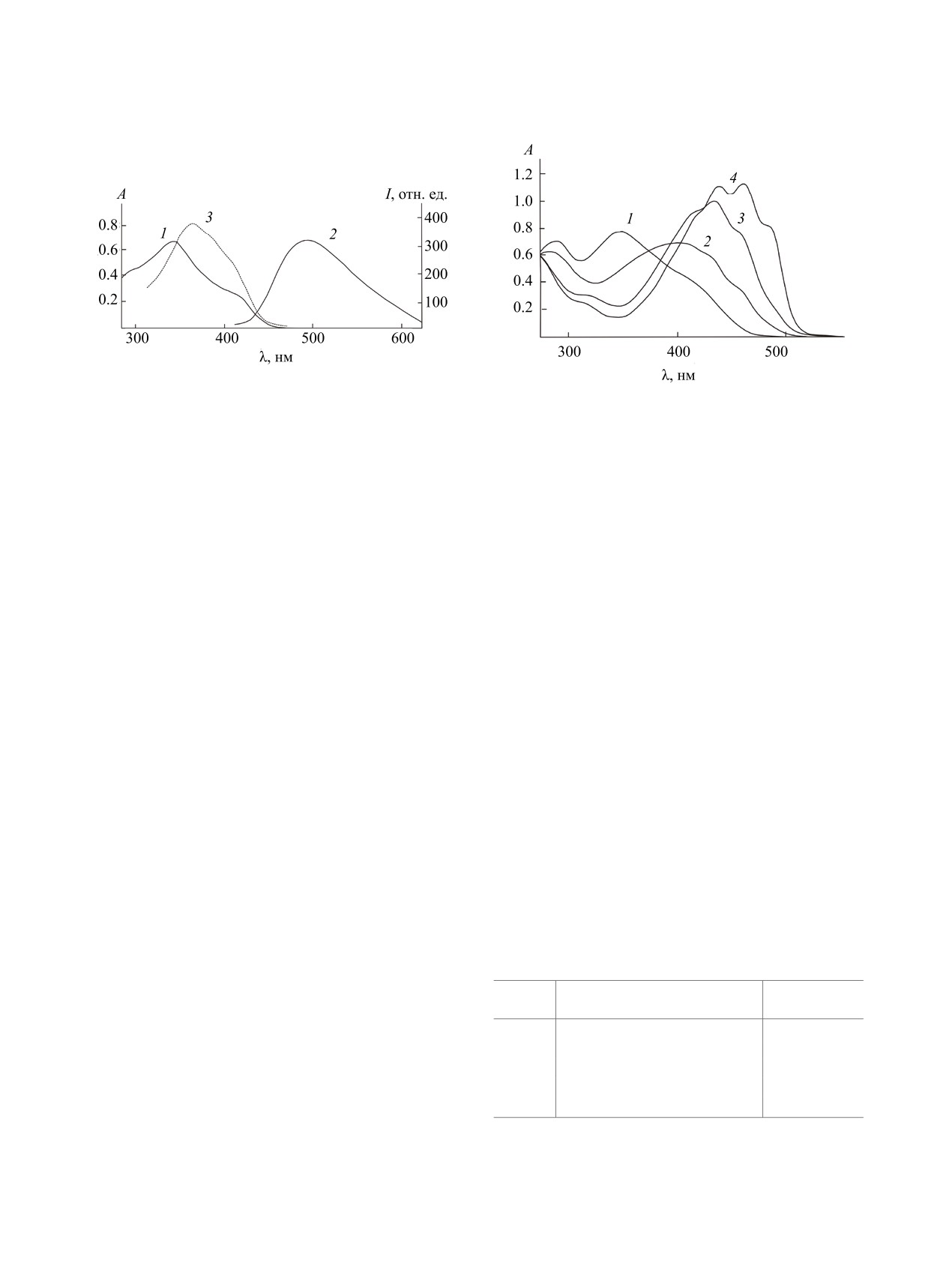
Рис. 1. Спектры поглощения (1), флуоресценции (2)
и возбуждения флуоресценции (3) соединения 4б в
Рис. 2. Спектры поглощения ароилгидразона 4в в
ДМСО (λвозб = 350 нм, λнабл = 490 нм, c = 2.5×
ДМСО (с = 2.5×10-5 моль/л) до (1) и после прибавления
10-5 моль/л).
анионов AcO- (2), CN- (3) и F- (4) (с = 5.0×10-5 моль/л).
катионам d-металлов проводили по данным элек-
дорода гидразинилиденовых групп NH (вплоть
тронных спектров поглощения и флуоресценции.
до полного отрыва протона при взаимодействии с
Электронные спектры ароилгидразонов 4а-д в
фторид-анионом). Одновременно происходит ба-
ДМСО характеризуются длинноволновыми мак-
тохромный сдвиг полосы испускания на 10-20 нм,
симумами при 335-347 нм c широким плечом в
сопровождающийся значительным уменьшением
области 390-440 нм (см. таблицу, рис. 1).
интенсивности эмиссии. По данным спектрофото-
метрического титрования и метода изомолярных
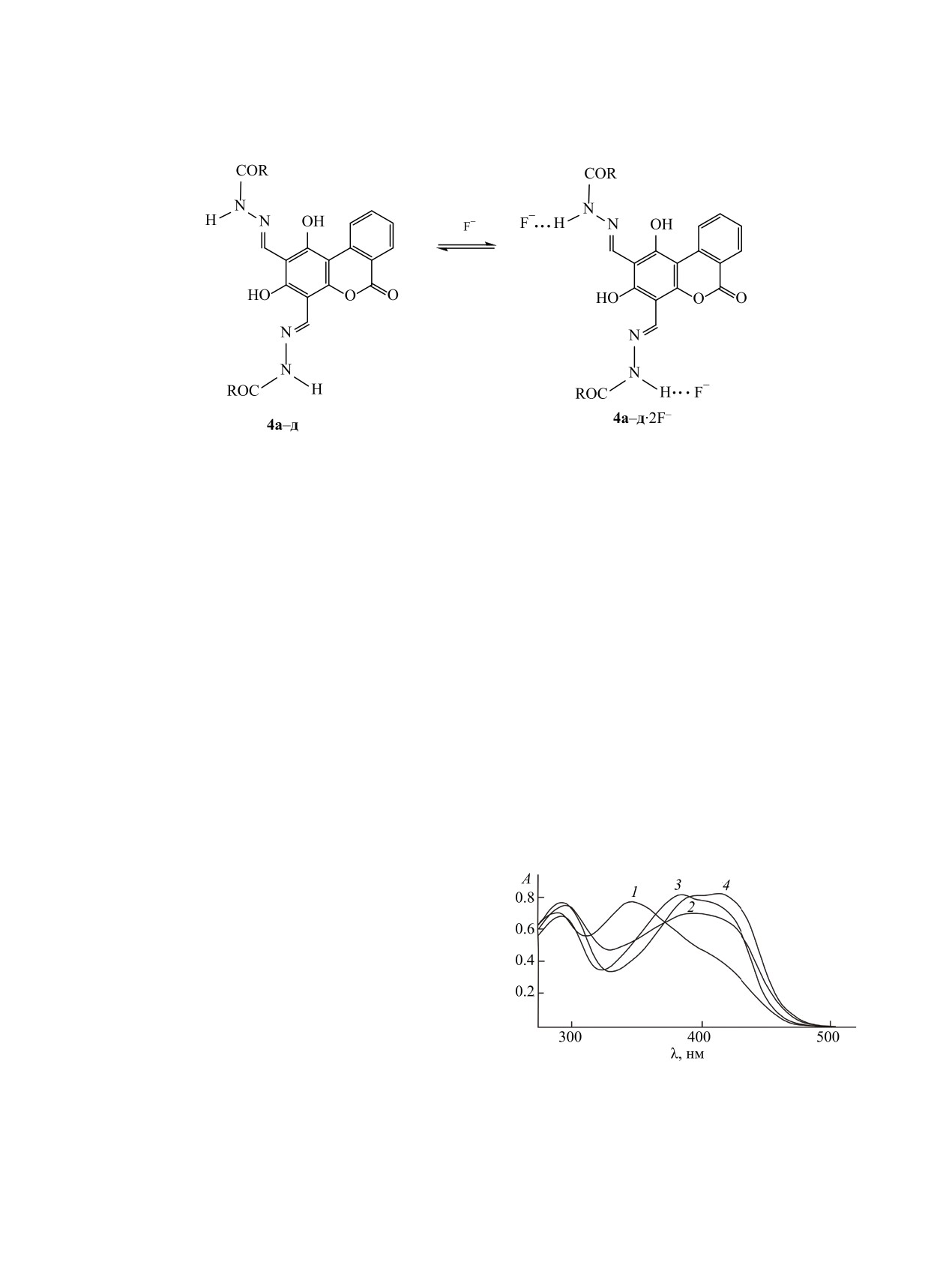
Ароилгидразоны 4а-д проявляют характерную
серий соединения, 4а-д образуют с анионами F-
ESIPT-флуоресценцию в области 497-502 нм с
комплексы состава 1:2 (схема 2).
большой величиной сдвига Стокса (см. таблицу,
рис. 1) [21, 22]. Перекрывание полос поглощения
Ароилгидразоны 4 по-разному реагируют на
и эмиссии практически отсутствует, а величина
добавление хлоридов Na+, K+, Ca2+, Ba2+, Zn2+,
Δν достигает 6015 см-1 (4г). Спектры возбужде-
Hg2+, Cu2+, Cd2+, Ni2+, Co2+, Pb2+ к их растворам
ния флуоресценции соединений 4а-д достаточно
в ДМСО. В спектрах бензоилгидразонов 4а-в по-
хорошо совпадают с их спектрами поглощения
являются новые уширенные максимумы поглоще-
(рис. 1, кривая 3).
ния в видимой области спектра при 390-440 нм
(рис. 3), окраска растворов изменяется со свет-
Добавление анионов в виде тетрабутиламмони-
ло-желтой на оранжевую в присутствии катионов
евых солей Bu4NX (X = F, Cl, Br, I, CN, SCN, AcO,
никеля(II), кобальта(II) и цинка(II) вследствие об-
NO3, HSO4, H2PO4) к растворам ароилгидразонов
разования комплексов. Катионы остальных метал-
4а-д в ДМСО приводит к появлению новых длин-
лов оказывают лишь незначительное влияние на
новолновых максимумов поглощения в видимой
спектры поглощения.
области спектра в случае фторид-, ацетат- и циа-
нид-анионов (рис. 2), тогда как остальные анионы
Одновременно наблюдается практически пол-
оказывают незначительное влияние на интенсив-
ное тушение исходной флуоресценции раствора,
ность абсорбции.
Поглощение и флуоресценция ароилгидразонов 4а-д в
Батохромный сдвиг полосы поглощения обра-
ДМСО
зующегося комплекса увеличивается в ряду AcO-
λfl , нм
№
λabs, нм (ε, л·моль-1·см-1)
< CN- < F-. Наиболее отчетливый ионохромный
(I, отн. ед.)а
эффект (naked-eye effect [26]), сопровождающийся
4а
336 (56800), 417 пл (14000)
525 (245)
изменением окраски со светло-желтой на оранже-
4б
341 (54000), 420 пл (22400)
496 (320)
во-красную, наблюдается в присутствии фторид-а-
4в
347 (63200), 423 пл (40800)
531 (110)
4г
335 (48100), 430 пл (14400)
580 (130)
нионов. По аналогии с известными литературны-
4д
341 (69600), 425 пл (14800)
543 (185)
ми данными [26, 27] можно полагать, что анионы
а c = 2.0×10-6 моль/л.
образуют координационные связи с атомами во-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 12 2020
1810
НИКОЛАЕВА и др.
Схема 2.
что вызвано ингибированием транспорта прото-
2,4-Бис{[(4-метилфенил)амино]метилиден}-
нов вследствие частичного или полного замеще-
1H-бензо[c]хромен-1,3,6(2H,4H)-трион (2). Смесь
ния протонов групп OH катионами металлов [22,
20 ммоль (4.56 г) соединения 1, 40 ммоль (4.28 г)
24]. Гидразоны 4г, д - производные нафталинкар-
п-толуидина и 40 ммоль (6 мл) этил ортоформиата
боновых кислот - демонстрируют аналогичное
выдерживали 7 ч при 170°С. Темно-желтый сплав
изменение спектров поглощения и испускания в
промывали этанолом (150 мл) и перекристалли-
присутствии катионов d-металлов.
зовывали из ДМФА. Выход 7.00 г (75%), желто-
Таким образом, полученные нами ди(ароил-
оранжевый порошок, т. пл. 285-287°С (ДМФА).
гидразоны)
1,3-дигидрокси-6-оксо-6H-бензо[c]-
ИК спектр, ν, см-1: 1600, 1580, 1500. Спектр ЯМР
хромен-2,4-дикарбальдегида представляют собой
1H (ДМСО-d6), δ, м.д. (J, Гц): 2.30 с (6Н, 2Me),
полифункциональные ионохромные соединения,
7.24-7.40 м (9H, 8ArН, H8), 7.75 т (1Н, Н9, J = 7.5,
способные к детектированию фторид-, цианид- и
J = 6.9), 8.09 д (1Н, Н7, J = 7.5), 8.51 д (1Н, СНN,
ацетат-анионов, а также катионов d-металлов.
J = 14.1, Z-изомер), 8.57 д (1Н, СНN, J = 13.2, E-и-
зомер), 8.74 д (1Н, СНN, J = 14.1, Z-изомер), 8.76
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
д (1Н, СНN, J = 13.8, E-изомер), 9.46 д (1Н, Н10,
Спектры ЯМР 1Н получены на спектрометре
J = 7.8), 13.18 д (1Н, NН, J = 14.1, Z-изомер), 13.23
Bruker DPX-250 (250 MГц) в ДМСО-d6. В качестве
д (1Н, NН, J = 14.1, Z-изомер), 13.65 д (1Н, СНN,
внутреннего стандарта использовали остаточные
J = 13.5, E-изомер), 14.04 д (1Н, СНN, J = 12.6, E-и-
сигналы протонов дейтерорастворителя. Колеба-
зомер). Соотношение изомеров Z/E ~ 2:1. Найдено,
тельные спектры записывали на приборе Varian
Excalibur 3100 FT-IR методом нарушенного полно-
го внутреннего отражения с использованием кри-
сталла ZnSe. Электронные спектры поглощения
снимали на спектрофотометре Varian Cary 100,
спектры люминесценции измерены на спектро-
флуориметре Varian Cary Eclipse. Для приготовле-
ния растворов использовали ДМСО спектральной
чистоты, хлориды d-металлов и тетрабутиламмо-
ниевые соли (Aldrich). Температуры плавления
определяли в стеклянных капиллярах на приборе
ПТП (М). Элементный анализ выполняли класси-
Рис. 3. Электронные спектры поглощения ароилги-
ческим методом [29].
дразона 4в в ДМСО (с = 2.5×10-5 моль/л) до (1) и после
1,3-Дигидрокси-6H-бензо[c]хромен-6-он 1 по-
прибавления катионов Co2+ (2), Zn2+ (3) и Ni2+ (4), (с =
5.0×10-5 моль/л).
лучали по методике [18].
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 12 2020
ПОЛИФУНКЦИОНАЛЬНЫЕ ИОНОХРОМНЫЕ АРОИЛГИДРАЗОНЫ
1811
%: C 75.46; Н 4.93; N 6.18. C29H22N2O4. Вычисле-
c (1H, NН), 12.13 c (1H, NН), 13.74 c (1H, OН),
но, %: C 75.31; Н 4.79; N 6.06.
14.90 c (1H, OН). Найдено, %: C 64.26; Н 4.23; N
1,3-Дигидрокси-6-оксо-6H-бензо[c]хромен-
9.73. C31H24N4O8. Вычислено, %: C 64.14; Н 4.17;
N 9.65.
2,4-дикарбальдегид (3). К раствору 10 ммоль
(4.62 г) соединения 2 в 500 мл CH3COOH добав-
Nʹ,Nʹʹʹ-[(1,3-Дигидрокси-6-оксо-6H-бензо[c]-
ляли 300 мл 18%-ной HCl. Реакционную смесь
хромен-2,4-диил)диметилиден]ди([1,1ʹ-бифе-
кипятили 2 ч, охлаждали и разбавляли водой
нил]-4-карбогидразид) (4в). Выход 0.21 г (63%),
(500 мл). Осадок отфильтровывали, сушили и пе-
желтый порошок, т. пл. > 300°С (ДМФА). ИК
рекристаллизовывали из CH3COOH. Выход 1.05 г
спектр, ν, см-1: 3280, 3194, 2954, 2930, 2921, 2854,
(37%), коричневато-розовый порошок, т. пл. 287-
1716, 1678, 1644, 1623, 1568, 1551, 1505. Спектр
290°С (AcOH). ИК спектр, ν, см-1: 1740, 1640,
ЯМР 1H (ДМСО-d6), δ, м. д.: 7.38-7.44 м (7Н, 6НAr,
1600. Спектр ЯМР 1H (ДМСО-d6), δ, м. д. (J, Гц):
Н8), 7.65-7.73 м (9Н, 8НAr, Н9), 7.98-7.99 м (5Н,
7.63 т (1Н, Н8, J = 7.2, J = 7.8), 7.93 т (1Н, Н9, J =
4НAr, Н7), 8.98 c (2H, СН, Н10), 8.99 c (1H, CН), 12.38
7.5, J = 7.2), 8.25 д (1Н, Н7, J = 7.5), 8.96 д (1Н,
c (2H, 2NН), 13.78 c (1H, OН), 14.94 c (1H, OН).
Н10, J = 7.8), 10.21 с (1Н, СНО), 10.24 с (1Н, СНО).
Найдено, %: C 73.32; Н 4.23; N 8.43. C38H28N4O6.
Найдено, %: C 63.23; Н 2.75. C15H8O6. Вычислено,
Вычислено, %: C 73.21; Н 4.20; N 8.33.
%: C 63.39; Н 2.84.
Nʹ,Nʹʹʹ-[(1,3-Дигидрокси-6-оксо-6H-бензо-
Ди(ароилгидразоны) 1,3-дигидрокси-6-оксо-
[c]хромен-2,4-диил)диметилиден]ди(нафта-
6H-бензо[c]хромен-2,4-дикарбальдегида (4a-д).
лин-1-карбогидразид) (4г). Выход 0.13 г (43%),
Смесь 1 ммоль (0.284 г) диальдегида 3 и 2 ммоль
желтый порошок, т. пл. > 300°С (ДМФА). ИК
соответствующего гидразида ароматической кис-
спектр, ν, см-1: 3274, 2954, 2922, 2854, 1727, 1677,
лоты в 25 мл смеси i-PrOH-ДМФА, 1:2, кипяти-
1622, 1595, 1509. Спектр ЯМР 1H (ДМСО-d6), δ,
ли 1.5 ч. Осадок отфильтровывали, промывали
м. д.: 7.57-7.60 м (12Н, 10НAr, Н8, Н9), 7.61-8.03
i-PrOH и перекристаллизовывали из ДМФА.
м (6Н, 4НAr, Н7, Н10), 9.00 c (1H, СН), 9.02 c (1H,
Nʹ,Nʹʹʹ-[(1,3-Дигидрокси-6-оксо-6H-бензо[c]-
CН), 12.47 c (1H, NН), 12.59 c (1H, NН), 13.75 c
хромен-2,4-диил)диметилиден]дибензогидра-
(1H, OН), 15.01 c (1H, OН). Найдено, %: C 71.52; Н
зид (4а). Выход 0.14 г (56%), желтый порошок,
4.03; N 9.11. C37H24N4O6. Вычислено, %: C 71.61;
т. пл. > 300°С (ДМФА). ИК спектр, ν, см-1: 3341,
Н 3.90; N 9.03.
3226, 3049, 2926, 2853, 1706, 1692, 1645, 1617, 1597,
Nʹ,Nʹʹʹ-[(1,3-Дигидрокси-6-оксо-6H-бензо[c]-
1583, 1568, 1529. Спектр ЯМР 1H (ДМСО-d6), δ, м. д.:
хромен-2,4-диил)диметилиден]ди(6-метокси-
7.48-7.49 м (5Н, 4ArН, Н8), 7.80 т (1Н, Н9, J = 7.5,
нафталин-2-карбогидразид) (4д). Выход 0.29 г
J = 8.1), 7.80 т (1Н, Н9, J = 7.5, J = 8.1), 7.88 д (2НAr,
(87%), желтый порошок, т. пл. > 300°С (ДМФА).
J = 8.9), 7.90 д (2НAr, J = 8.4), 8.10 д (1Н, Н7, J =
ИК спектр, ν, см-1: 3236, 2950, 2923, 2854, 1714,
6.8), 8.93 c (1H, СН), 8.98 д (1Н, Н10, J = 8.3), 9.00 c
1645, 1625, 1588, 1541, 1509. Спектр ЯМР 1H
(1H, CН), 12.26 c (1H, NН), 12.30 c (1H, NН), 13.72
(ДМСО-d6), δ, м. д.: 3.86 с (6H, 2ОMe), 7.16-7.26 м
c (1H, OН), 14.88 c (1H, OН). Найдено, %: C 66.86;
(5Н, 4НAr, Н8), 7.46 c (1НAr), 7.77-7.89 м (8Н, 7НAr,
Н 4.03; N 10.63. C29H20N4O6. Вычислено, %: C
Н9), 8.11 д (1H, Н7, J = 6.8), 8.40-8.42 м (2НAr),
66.92; Н 3.87; N 10.76.
9.00-9.02 м (2H, CН, Н10), 9.06 c (1H, CН), 12.34 c
Nʹ,Nʹʹʹ-[(1,3-Дигидрокси-6-оксо-6H-бензо[c]-
(1H, NН), 12.35 c (H, NН), 13.81 c (1H, OН), 14.96
хромен-2,4-диил)диметилиден]ди(4-метокси-
c (1H, OН). Найдено, %: C 68.75; Н 4.28; N 8.35.
бензогидразид) (4б). Выход 0.21 г (73%), желтый
C39H28N4O8. Вычислено, %: C 68.82; Н 4.15; N 8.23.
порошок, т. пл. > 300°С (ДМФА). ИК спектр, ν, см-1:
ФОНДОВАЯ ПОДДЕРЖКА
3259, 3236, 3060, 2932, 2849, 1713, 1682, 1667,
1615, 1572, 1512. Спектр ЯМР 1H (ДМСО-d6), δ,
Исследование выполнено при финансовой
м. д.: 3.79 с (6H, 2ОМе), 6.95 д (4НAr, J = 8.9), 7.40
поддержке Министерства науки и высшего обра-
т (1Н, Н8, J = 7.4, J = 7.5), 7.77 т (1Н, Н9, J = 7.4,
зования РФ в рамках государственного задания
J = 8.0), 7.84 д (2НAr, J = 8.6), 7.85 д (2НAr, J = 8.6),
в сфере научной деятельности (№ 0852-2020-
8.05 д (1Н, Н7, J = 7.7), 8.91 м (3Н, Н10, 2СН), 12.09
0019), а также в рамках государственного задания
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 12 2020
1812
НИКОЛАЕВА и др.
Южного научного центра РАН (№ 01201354239,
13.
Hassan M.Z., Osman H., Ali M.A., Ahsan M.J. // Eur.
А.Д. Дубоносов).
J. Med. Chem. 2016. Vol. 123. P. 236. doi 10.1016/j.
ejmech.2016.07.056
КОНФЛИКТ ИНТЕРЕСОВ
14.
Yamaji M., Hakoda Y., Okamoto H., Tani F. // Photochem.
Photobiol. Sci. 2017. Vol. 12. N 4. P. 555. doi 10.1039/
Авторы заявляют об отсутствии конфликта ин-
c6pp00399k
тересов.
15.
Al-Masoudi N.A., Al-Salihi N.J., Marich Y.A., Markus T. //
СПИСОК ЛИТЕРАТУРЫ
J. Fluoresc. 2015. Vol. 25. N 6. P. 1847. doi 10.1007/
s10895-015-1677-z
1.
Advances in Structure and Activity Relationship of
16.
Nazir R., Stasyuk A.J., Gryko D.T. // J. Org. Chem. 2016.
Coumarin Derivatives / Ed. S. Penta. Amsterdam:
Vol. 81. N 22. P. 11104. doi 10.1021/acs.joc.6b02094
Elsevier-Academic Press, 2015. 190 p.
17.
Wang Z.S., Cui Y., Hara K., Dan-oh Y., Kasada C.,
2.
Дубоносов А.Д., Николаева О.Г., Тихомирова К.С.,
Shinpo A. // Adv. Mater. 2007. Vol. 19. N 8. P.
Брень В.А. Кумарины: Химия и биологическая ак-
1138-1141. doi 10.1002/adma.200601020
тивность / Под ред. В.Г. Карцева. М.: ICSPF Press,
18.
Krzeszewski M., Vakuliuk O., Gryko D.T. // Eur. J. Org.
2019. С. 111.
Chem. 2013. Vol. 2013. N 25. P. 5631. doi 10.1002/
3.
Cao D., Liu Z., Verwilst P., Koo S., Jangjili P., Kim J.S.,
ejoc.201300374
Lin W. // Chem. Rev. 2019. Vol. 119. N 18. P. 10403. doi
19.
Brown N.M.D., Nonhebel D.C. // Tetrahedron. 1968.
10.1021/acs.chemrev.9b00145
Vol. 24. N 16. P. 5655. doi 10.1016/0040-4020(68)88164-5
4.
Calcio G. E., Tagliapietra S., Martina K., Palmisano G.,
20.
Sauer M., Yeung C., Chong J.H., Patrick B.O.,
Cravotto G. // RSC Adv. 2016. Vol. 6. P. 46394. doi
MacLachlan M.J. // J. Org. Chem. 2006. Vol. 71. N 2.
10.1039/C6RA07071J
P. 775. doi 10.1021/jo052277t
5.
Privileged Scaffolds in Medicinal Chemistry. Design,
21.
Hu J.-W., Tsai H.-Y., Fang S.-K., Chang C.-W., Wang L.-C.,
Synthesis, Evaluation / Ed. S. Bräse. Cambridge: RSC,
Chen K.-Y. // Dyes Pigm. 2017. Vol. 145. P. 493. doi
2015. 476 p.
10.1016/j.dyepig.2017.06.037
6.
Anamika U.D., Ekta J.N., Sharma S. // Curr. Org. Chem.
22.
Zhao J., Ji S., Chen Y., Guo H., Yang P. // Phys. Chem.
Chem. Phys. 2012. Vol. 14. P. 8803. doi 10.1039/
2019. Vol. 22. N 26. P. 2509. doi 10.2174/1385272822
C2CP23144A
666181029102140
23.
Kwon J.E., Park S.Y. // Adv. Mater. 2011. Vol. 23. N 32.
7.
Grover J., Jachak S.M. // RSC Adv. 2015. Vol. 5. N 49.
P. 3615. doi 10.1002/adma.201102046
P. 38892. doi 10.1039/C5RA05643H
24.
Dubonosov A.D., Bren V.A., Minkin V.I. Tautomerism:
8.
Emami S., Dadashpour S. // Eur. J. Med. Chem. 2015.
Concepts and Applications in Science and Technology /
Vol. 102. P. 611. doi 10.1016/j.ejmech.2015.08.033
Ed. L. Antonov. Weinheim: Wiley-VCH, 2016. P. 229.
9.
Medina F.G., Marrero J.G., Macias-Alonso M., Gon-
25.
Suganya S., Naha S., Velmathi S. // ChemistrySelect.
zález M.C., Córdova-Guerrero I., Teissier García A.G.,
2018. Vol. 3. N 25. P. 7231. doi 10.1002/slct.201801222
Osegueda-Robles S. // Nat. Prod. Rep. 2015. Vol. 32.
26.
Kaur B., Kaur N., Kumar S. // Coord. Chem. Rev. 2018.
N 10. P. 1472. doi 10.1039/c4np00162a
Vol. 358. P. 13. doi 10.1016/j.ccr.2017.12.002
10.
An R., Hou Z., Li J.-T., Yu H.-N., Mou Y.-H., Guo C. //
27.
Kaur N., Kaur G., Fegade U.A., Singh A., Sahoo S.K.,
Molecules. 2018. Vol. 23. N 9. P. 2281. doi 10.3390/
Kuwar A.S., Singh N. // Trends Anal. Chem. 2017.
molecules23092281
Vol. 95. P. 86. doi 10.1016/j.trac.2017.08.003
11.
Matos M.J., Vazquez-Rodriguez, S., Fonseca A.. Uriarte, E.,
28.
Anslyn E.V., Wang B. Chemosensors: Principles,
Santana L., Borges F. // Curr. Org. Chem. 2017. Vol. 21.
Strategies, and Applications. Hoboken: Wiley, 2011.
N 4. P. 311. doi 10.2174/1385272820666161017170652
540 p.
12.
Kathiravan. M.K., Salake A.B., Chothe A.S., Dudhe P.B.,
29.
Гельман Н.Э., Терентьева Н.А., Шанина Г.М., Кипа-
Watode R.P., Mukta M.S., Gadhwe S. // Bioorg. Med.
ренко Л.М., Резл В. Методы количественного орга-
Chem. 2012. Vol. 20. N 19. P. 5678. doi 10.1016/j.
нического элементного микроанализа. М.: Химия,
bmc.2012.04.045
1987.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 12 2020
ПОЛИФУНКЦИОНАЛЬНЫЕ ИОНОХРОМНЫЕ АРОИЛГИДРАЗОНЫ
1813
Polyfunctional Ionochromic 1,3-Dihydroxy-6-oxo-6H-benzo[c]-
chromene-2,4-dicarbaldehyde Aroylhydrazones
O. G. Nikolaevaa, O. Yu. Karlutovaa, A. D. Dubonosovb,*, V. A. Brena, and V. I. Minkina
a Institute of Physical and Organic Chemistry, Southern Federal University, Rostov-on-Don, 344090 Russia
b Federal Research Center “The Southern Scientific Center of the Russian Academy of Sciences”,
Rostov-on-Don, 344006 Russia
*e-mail:aled@ipoc.sfedu.ru
Received July 22, 2020; revised July 22, 2020; accepted August 4, 2020
Bisaroylhydrazones of a novel 1,3-dihydroxy-6-oxo-6H-benzo[c]chromene-2,4-dicarbaldehyde were
synthesized. The obtained compounds represent multifunctional chemosensors capable of detecting fluoride,
cyanide, and acetate anions and transition metal cations. The formation of complexes with anions leads to a
change in the color of the solution in DMSO from light yellow to orange-red. The addition of bivalent nickel,
cobalt and zinc chlorides changes the color of the solution to orange. At the same time, there is a significant
quenching of the initial fluorescence.
Keywords: benzo[c]chromene, coumarin, ionochromism, absorption, fluorescence, naked-eye effect
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 12 2020