ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2020, том 90, № 12, с. 1814-1818
УДК 547.745
СИНТЕЗ И СВОЙСТВА 5-АРИЛ-4(-4-ГАЛОГЕНАРОИЛ)-
3-ГИДРОКСИ-1-ЦИАНОМЕТИЛ-3-ПИРРОЛИН-2-ОНОВ
© 2020 г. В. Л. Гейна,*, Е. В. Пастуховаа, А. Н. Корольа, Н. В. Дозмороваа, Э. В. Воронинаа,b
а Пермская государственная фармацевтическая академия, ул. Полевая 2, Пермь, 614990 Россия
b Пермский институт, филиал Российского экономического университета имени Г. В. Плеханова,
Пермь, 614990 Россия
*e-mail: geinvl48@mail.ru
Поступило в Редакцию 29 июня 2020 г.
После доработки 29 июня 2020 г.
Принято к печати 7 июля 2020 г.
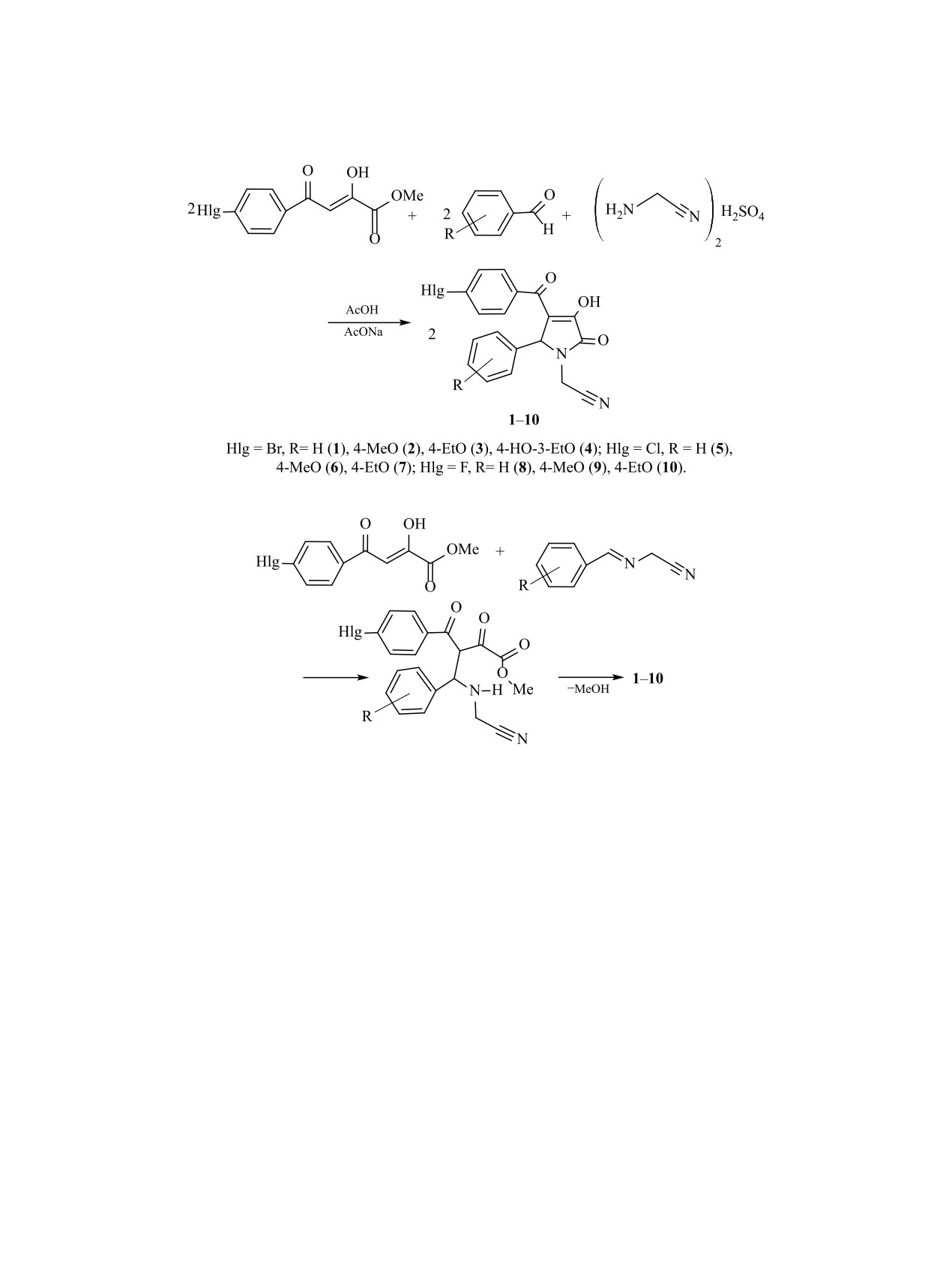
Трехкомпонентной реакцией метилового эфира ароилпировиноградной кислоты со смесью аромати-
ческого альдегида и 2-аминоацетонитрилсульфата в среде ледяной уксусной кислоты в присутствии
безводного ацетата натрия синтезированы 5-арил-4-ароил-3-гидрокси-1-цианометил-3-пирролин-2-оны.
Показана возможность их взаимодействия с п-толуидином и гидразингидратом.
Ключевые слова: 5-арил-4-ароил-3-гидрокси-1-цианометил-3-пирролин-2-оны, 2-аминоацетонитрил-
сульфат, тетрагидропиррол-2,3-дионы, трехкомпонентные реакции
DOI: 10.31857/S0044460X20120021
Замещенные
3-гидрокси-3-пирролин-2-оны
новых соединений. Ранее в литературе было опи-
являются пятичленными азотсодержащими гете-
сано получение 5-арил-4-ароил-3-гидрокси-1-циа-
роциклическими соединениями, которые входит в
нометил-3-пирролин-2-онов [5]. С целью оценки
структуру ряда биологически активных веществ и
влияния галогена в п-положении метилового эфи-
лекарственных препаратов, что обусловливает их
ра ароилпировиноградной кислоты на протекание
интерес для медицины и фармации [1, 2].
реакции и биологическую активность полученных
Для органической химии они интересны тем,
соединений нами была изучена трехкомпонентная
что легко вступают в реакции с различными ну-
реакция метилового эфира п-галогенбензоилпи-
клеофильными реагентами благодаря наличию
ровиноградной кислоты со смесью ароматиче-
двух карбонильных групп в положении 3 гетеро-
ского альдегида и 2-аминоацетонитрилсульфата.
цикла и боковой цепи в положении 4, что позво-
Данная реакция протекает при кратковременном
ляет формировать различные гетероциклические
нагревании эквимолярного количества реаген-
конденсированные системы [1, 2].
тов в присутствии безводного ацетата натрия в
Ранее было установлено, что заместитель в
среде ледяной уксусной кислоты с образованием
5-арил-4-(-4-галогенароил)-3-гидрокси-1-циано-
положении 1 гетероцикла значительно влияет на
биологическую активность и химические свойства
метил-3-пирролин-2-онов 1-10 (схема 1).
1,4,5-тризамещенных
3-гидрокси-3-пирролин-2-
2-Аминоацетонитрил, который в свободном
онов [1, 3].
виде в обычных условиях не существует, был по-
Известно, что цианогруппа входит в состав ряда
лучен известной реакцией 2-аминоацетонитрил-
используемых в настоящее время лекарственных
сульфатата с безводным ацетатом натрия в уксус-
средств [4]. Поэтому представляло интерес ввести
нокислой среде непосредственно в ходе реакции.
в первое положение гетероцикла цианометильную
Предположительно, реакция протекает с образо-
группу и в дальнейшем оценить ее влияние на хи-
ванием промежуточного основания Шиффа, по
мические свойства и биологическую активность
двойной связи которого присоединяется исход-
1814
СИНТЕЗ И СВОЙСТВА 5-АРИЛ-4(-4-ГАЛОГЕНАРОИЛ)-3-ГИДРОКСИ-...
1815
Схема 1.
Схема 2.
ный эфир с последующей циклизацией промежу-
содержащей группы приводит к значительному
точного эфира 4-арил- 4-амино-2-оксобутановой
уменьшению интенсивности полосы поглощения
кислоты в соответствующие 3-гидрокси-3-пирро-
C≡N [6], причем влияние этой группы больше тогда,
лин-2-оны 1-10 (схема 2).
когда она присоединена к тому же атому углерода,
что и нитрил, и может быть вообще неразличима.
Полученные соединения 1-10 представляют
собой кристаллические вещества, растворимые в
В спектрах ЯМР 1Н соединений 1-10 присут-
ДМСО, ДМФА, при нагревании - в этаноле и ле-
ствуют сигналы ароматических протонов (6.35-
дяной уксусной кислоте, нерастворимые в воде. В
8.46 м. д.), характерный синглет метинового про-
ИК спектрах соединений 1-10 наблюдаются поло-
тона в положении 5 гетероцикла (5.36-5.69 м. д.),
сы поглощения лактамной карбонильной группы
два дублета протонов цианометильной группы у
при 1696-1664 см-1 и интенсивная полоса погло-
атома азота гетероцикла (3.96-4.54 м. д., J 16.7-
щения енольной гидроксильной группы при 3200-
18.6 Гц) и сигнал протона ОН-группы в положении
3040см-1. Полоса поглощения карбонильной груп-
3 гетероцикла (11.98-12.31 м. д.). Сигнал протона
пы боковой цепи наблюдается при 1632-1604 см-1.
ОН-группы в положении 3 гетероцикла в спектрах
соединений 1-10 сильно уширен вследствие ин-
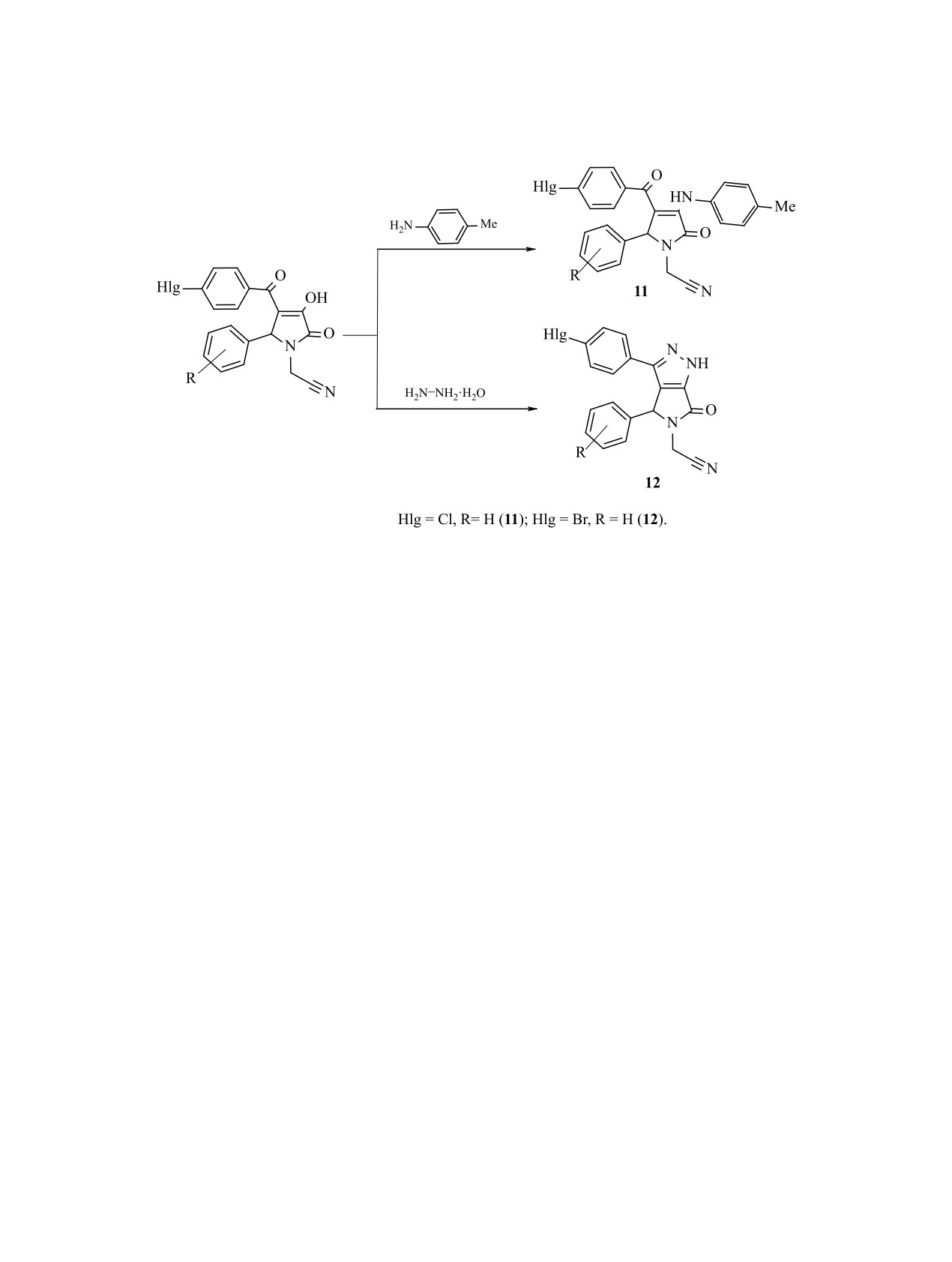
Следует отметить, что нам не удалось обна-
тенсивного обмена [2].
ружить полосу поглощения группы C≡N в ИК
спектрах соединений 1-10. По-видимому, это объ-
С целью изучения химических свойств и рас-
ясняется тем, что введение в молекулу кислород-
ширения ряда соединений 1-10 мы исследовали
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 12 2020
1816
ГЕЙН и др.
Схема 3.
их реакции с п-толуидином и гидразингидратом
1 и гидразингидрата в ледяной уксусной кислоте
[7, 8]. При изучении реакции соединения 5 с п-то-
был получен
6-п-бромфенил-5-фенил-4-циано-
луидином было установлено, что при кипячении
метил-3,5-дигидропирроло[3,4-с]пиразол-3-он
12
эквимолярных количеств 5-фенил-4-(4-хлорбензо-
(схема 3).
ил)-3-гидрокси-1-цианометил-3-пирролин-2-она и
Структура соединения 12 подтверждена дан-
п-толуидина в уксусной кислоте в течение 2 ч об-
ными спектроскопии ЯМР 1Н. В спектрах ЯМР 1Н
разуется 5-фенил-4-(4-хлорбензоил)-3- (4-метил-
соединения 12 присутствуют сигналы ароматиче-
фениламино)-1-цианометил-3-пирролин-2-он
11
ских протонов в области 7.26-7.54 м. д., синглет
(схема 3). Структура соединения 11 подтверждена
NH-протона при 13.88-13.96 м. д., синглет мети-
данными ЯМР 1Н.
нового протона при атоме C5 в области 6.0 м. д.,
В спектрах ЯМР 1Н соединения 11 присутству-
два дублета протонов метиленовой группы в по-
ют сигналы ароматических протонов в области
ложении α цианометильного заместителя при 4.56,
6.78-7.33 м. д., синглет метинового протона при
4.52 м. д. (CαHAHB) и 4.20, 4.15 м. д. (CαHAHB).
атоме C5 в области 5.64 м. д., два дублета протонов
Таким образом, введение галогена в п-поло-
метиленовой группы в положении α цианометиль-
жение метилового эфира ароилпировиноградной
ного заместителя при 4.20, 4.24 м. д. (CαHAHB) и
кислоты не оказывает существенного влияния на
4.48, 4.53 м. д. (CαHAHB). Сигнал протона NH-груп-
образование конденсированной гетероциклице-
пы аминотолильного заместителя в положении 3
ской системы и реакционную способность карбо-
гетероцикла находятся в области 9.04 м. д., а син-
нильной группы в положении 3 гетероцикла.
глет протонов п-метильной группы - при 1.92 м. д.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
5-Арил-4-(4-галогенароил)-3-гидрокси-1-циа-
ИК спектры записаны на спектрометре Specord
нометил-3-пирролин-2-оны имеют в своей струк-
M-80 в таблетках KBr. Спектры ЯМР 1Н получены
туре два реакционных центра в положениях 3 и 4
пиррольного гетероцикла, что позволяет, при взаи-
на приборе Bruker АМ-300 (300 МГц) в ДМСО-d6,
модействии данных соединений с таким бинуклео-
внутренний стандарт - ТМС.
фильными реагентом, как гидразингидрат, получать
Общая методика получения соединений
конденсированную гетероциклическую систему
1-10. К раствору 0.05 моль аминоацетонитрил-
[8]. Так, при кипячении 5-фенил-4-бромбензо-
гидросульфата в уксусной кислоте прибавляли
ил-3-гидрокси-1-цианометил-3-пирролин-2-она
0.1 моль ацетата натрия, смесь перемешивали
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 12 2020
СИНТЕЗ И СВОЙСТВА 5-АРИЛ-4(-4-ГАЛОГЕНАРОИЛ)-3-ГИДРОКСИ-...
1817
до полного растворения. Далее добавляли смесь
пл. 217-226°С. ИК спектр, ν, см-1: 3176 (OH),
0.1 моль ароматического альдегида и 0.01 моль ме-
1696 (CON), 1638 (CO). Спектр ЯМР 1Н, δ, м. д.:
тилового эфира 4-ароилпировиноградной кислоты
4.35 д (НАНВ, CH2CN, J = 17.6 Гц), 4.20 д (НАНВ,
в диоксане. Полученную смесь нагревали до рас-
CH2CN, J = 18.5 Гц), 5.41 с (1H, С5Н), 7.26-7.68 м
творения компонентов и выдерживали при комнат-
(9Н, CHAr), 11.49 с (1Н, ОН). Найдено, %: C 64.69;
ной температуре в течение 1 сут. Выпавший при
H 3.71; N 7.94. C19H13ClN2O3. Вычислено, %: C
охлаждении осадок отфильтровывали и перекри-
64.39; H 3.41; N 7.64.
сталлизовали из этанола.
3-Гидрокси-5-(4-метоксифенил)-4-хлорбен-
4-Бромбензоил-3-гидрокси-5-фенил-1-ци-
зоил-1-цианометил-3-пирролин-2-он (6). Выход
анометил-3-пирролин-2-он (1). Выход 77%, т.
62%, т. пл. 205-210°С. ИК спектр, ν, см-1: 3160
пл. 252-256°С. ИК спектр, ν, см-1: 3160 (OH),
(OH), 1700 (CON), 1636 (CO). Спектр ЯМР 1Н, δ,
1698 (CON), 1638 (CO). Спектр ЯМР 1Н, δ, м. д.:
м. д.: 3.67 с (3Н, ОСН3), 4.33 д (НАНВ, CH2CN, J =
4.36 д (НАНВ, CH2CN, J = 17.6 Гц), 4.21 д (НАНВ,
17.4 Гц), 4.17 д (НАНВ, CH2CN, J = 16.7 Гц), 5.36 с
CH2CN, J = 17.6 Гц), 5.43 с (1H, С5Н), 7.27-7.55 м
(1H, С5Н), 7.17-7.69 м (8Н, CHAr), 11.28 с (1Н, ОН).
(9Н, CHAr), 11.62 с (1Н, ОН). Найдено, %: C 57.45;
Найдено, %: C 62.75; H 3.95; N 7.32. C20H15ClN2O4.
H 3.30; N 7.05. C19H13BrN2O3. Вычислено, %: C
Вычислено, %: C 62.45; H 3.65; N 7.02.
57.15; H 3.00; N 6.75.
3-Гидрокси-4-хлорбензоил-1-цианометил-
4-Бромбензоил-3-гидрокси-5-(4-метоксифе-
5-(4-этоксифенил)-3-пирролин-2-он (7). Выход
нил)-1-цианометил-3-пирролин-2-он (2). Выход
52%, т. пл. 210-215°С. ИК спектр, ν, см-1: 3180
59%, т. пл. 234-236°С. ИК спектр, ν, см-1: 3176
(OH), 1700 (CON), 1636 (CO). Спектр ЯМР 1Н, δ,
(OH), 1698 (CON), 1638 (CO). Спектр ЯМР 1Н, δ,
м. д.: 1.26 т (5Н, ОСН2СН3), 3.88 к (5Н, ОСН2СН3),
м. д.: 3.66 с (3Н, ОСН3), 4.33 д (НАНВ, CH2CN, J =
4.33 д (НАНВ, CH2CN, J = 17.7 Гц), 4.20 д (НАНВ,
17.7 Гц), 4.19 д (НАНВ, CH2CN, J = 17.6 Гц), 5.37 с
CH2CN, J = 17.6 Гц), 5.38 с (1H, С5Н), 6.73-7.69 м
(1H, С5Н), 6.75-7.55 м (8Н, CHAr), 12.15 с (1Н, ОН).
(8Н, CHAr), 11.37 с (1Н, ОН). Найдено, %: C 63.56;
Найдено, %: C 56.22; H 3.54; N 6.56. C20H15BrN2O4.
H 4.32; N 7.06. C21H17ClN2O4. Вычислено, %: C
Вычислено, %: C 55.92; H 3.24; N 6.26.
63.26; H 4.02; N 6.76.
4-Бромбензоил-3-гидрокси-1-цианометил-
3-Гидрокси-5-фенил-4-фторбензоил-1-циа-
5-(4-этоксифенил)-3-пирролин-2-он
(3).
Вы-
нометил-3-пирролин-2-он (8). Выход 71%, т. пл.
ход 64%, т. пл. 230-234°С. ИК спектр, ν, см-1:
223-227°С. ИК спектр, ν, см-1: 3056 (OH), 1712
3180 (OH),
1698 (CON),
1638 (CO). Спектр
(CON), 1625 (CO). Спектр ЯМР 1Н, δ, м. д.: 4.36 д
ЯМР 1Н, δ, м. д.: 1.34 т (5Н, ОСН2СН3), 3.96
(НАНВ, CH2CN, J = 17.6 Гц), 4.22 д (НАНВ, CH2CN,
к (5Н, ОСН2СН3), 4.33 д (НАНВ, CH2CN, J =
J = 17.6 Гц), 5.43 с (1H, С5Н), 7.07-7.73 м (9Н,
18.6 Гц), 4.19 д (НАНВ, CH2CN, J = 16.7 Гц), 5.37 с
CHAr), 11.57 с (1Н, ОН). Найдено, %: C 67.85; H
(1H, С5Н), 6.75-7.56 м (8Н, CHAr) , 12.09 с (1Н, ОН).
3.90; N 8.33. C19H13FN2O3. Вычислено, %: C 67.55;
Найдено, %: C 57.16; H 3.88; N 6.35. C21H17BrN2O4.
H 3.60; N 8.03.
Вычислено, %: C 56.86; H 3.58; N 6.05.
3-Гидрокси-5-(4-метоксифенил)-4-фторбен-
4-Бромбензоил-3-гидрокси-5-(4-гидрокси-
зоил-1-цианометил-3-пирролин-2-он (9). Выход
3-этоксифенил)-1-цианометил-3-пирролин-2-он
94%, т. пл. 210-214°С. ИК спектр, ν, см-1: 3064
(4). Выход 70%, т. пл. 239-242°С. ИК спектр, ν,
(OH), 1712 (CON), 1607 (CO). Спектр ЯМР 1Н, δ,
см-1: 3054 (OH), 1712 (CON), 1632 (CO). Спектр
м. д.: 3.68 с (3Н, ОСН3), 4.34 д (НАНВ, CH2CN, J =
ЯМР 1Н, δ, м. д.: 4.32 д (СНАНВ, CH2CN, J = 17.6
17.6 Гц), 4.20 д (НАНВ, CH2CN, J = 17.6 Гц), 5.40 с
Гц), 4.21 д (НАНВ, CH2CN, J = 17.6 Гц), 5.33 с (1H,
(1H, С5Н), 6.75-7.91 м (8Н, CHAr), 11.64 с (1Н, ОН).
С5Н), 6.69-7.58 м (7Н, CHAr), 11.40 с (1Н, ОН).
Найдено, %: C 65.57; H 4.13; N 7.65. C20H15FN2O4.
Найдено, %: C 55.16; H 3.75; N 6.13. C21H17BrN2O5.
Вычислено, %: C 65.27; H 3.83; N 7.35.
Вычислено, %: C 54.86; H 3.45; N 5.83.
3-Гидрокси-4-фторбензоил-1-цианометил-
3-Гидрокси-5-фенил-4-хлорбензоил-1-ци-
5-(4-этоксифенил)-3-пирролин-2-он
(10). Вы-
анометил-3-пирролин-2-он (5). Выход 68%, т.
ход 85%, т. пл. 201-206°С. ИК спектр, ν, см-1:
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 12 2020
1818
ГЕЙН и др.
3168 (OH),
1712 (CON),
1604 (CO). Спектр
16.0 Гц), 4.54 д (НАНВ, CH2CN, J = 20.0 Гц), 6.0 с
ЯМР 1Н, δ, м. д.: 1.26 т (5Н, ОСН2СН3), 3.96
(1H, С5Н), 7.26-7.54 м (9H, CHAr). Найдено, %: C
к (5Н, ОСН2СН3), 4.34 д (НАНВ, CH2CN, J =
58.03; H 3.33; N 14.25. C19H13BrN4O. Вычислено,
17.6 Гц), 4.21 д (НАНВ, CH2CN, J = 17.6 Гц), 5.39 с
%: C 57.73; H 3.03; N 13.95.
(1H, С5Н), 6.74-7.80 м (8H, CHAr), 12.29 с (1Н, ОН).
КОНФЛИКТ ИНТЕРЕСОВ
Найдено, %: C 66.31; H 4.50; N 7.36. C21H17FN2O4.
Вычислено, %: C 66.01; H 4.2; N 7.06.
Авторы заявляют об отсутствии конфликта
интересов.
3-(4-Метилфениламино)-5-фенил-4-(4-хлор-
бензоил)-1-цианометил-3-пирролин-2-он (11). К
СПИСОК ЛИТЕРАТУРЫ
раствору 0.002 моль соединения 5 в 10 мл ледяной
1. Гейн В.Л. Тетрагидропиррол- и тетрагидрофу-
уксусной кислоты добавляли 0.004 моль п-толуи-
ран-2,3-дионы. Пермь: ПГФА, 2004. С. 130.
дина. Полученную смесь кипятили в течение 2 ч.
2. Андрейчиков Ю.С., Гейн В.Л., Аникина И.Н. // ЖОрХ.
Выпавший при охлаждении осадок отфильтровы-
1986. Т. 22. Вып. 8. С. 1749.
вали и перекристаллизовывали из уксусной кисло-
3. Король А.Н. Автореф. дис
канд. фарм. наук.
Пермь, 2015. С. 23.
ты. Выход 35%, т. пл. 150-156°С. Спектр ЯМР 1Н,
4. Машковский М.Д. Лекарственные средства. М.: РИА
δ, м. д.: 1.92 c (3H, CH3), 4.22 д (НАНВ, CH2CN, J =
Новая волна, 2008. С. 826.
20.0 Гц), 4.51 д (НАНВ, CH2CN, J = 16.0 Гц), 5.64 с
5. Гейн В.Л., Булдакова Е.А., Король А.Н., Вейхман Г.А.,
(1H, С5Н), 6.78-7.33 м (14H, CHAr), 11.82 с (1Н,
Дмитриев М.В. // ЖОХ. 2018 Т. 88. Вып. 5. С. 764;
ОН), 9.04 c (1H, NH). Найдено, %: C 70.67; H 4.56;
Gein V.L., Buldakova E.A., Korol A.N., Veihman G.A.,
Dmitriev M.V. // Russ. J. Gen. Chem. 2018. Vol. 88 N 5.
N 9.51. C26H20ClN3O2. Вычислено, %: C 70.37; H
P. 908. doi 10.1134/S1070363218050110
4.26; N 9.21.
6. Беллами Л. Инфракрасные спектры сложных моле-
6-(4-Бромфенил)-5-фенил-4-цианометил-
кул. М.: ИЛ, 1963. С. 381.
3,5-дигидропирроло[3,4-с]пиразол-3-он (12). К
7. Гейн В.Л., Булдакова Е.А., Дмитриев М.В., Мокру-
раствору 0.002 моль соединения 1 в 10 мл ледя-
шин И.Г. // ЖОХ. 2020 Т. 90. Вып. 1. С. 50; Gein V.L.,
Buldakova E.A., Dmitriev M.V., Mokrushin I.G. // Russ.
ной уксусной кислоты добавляли 0.002 моль ги-
J. Gen. Chem. 2020. Vol. 90 N 1. P. 39. doi 10.1134/
дразина гидрата. Полученную смесь кипятили в
S1070363220010065
течение 2 ч. Выпавший при охлаждении осадок
8. Гейн В.Л., Булдакова Е.А., Дмитриев М.В. // ЖОрХ.
отфильтровывали и перекристаллизовывали из
2019 Т. 55. Вып. 7. С. 1046; Gein V.L., Buldakova E.A.,
уксусной кислоты. Выход 57%, т. пл. 265-267°С.
Dmitriev M.V. // Russ. J. Org. Chem. 2019. Vol. 55 N 7.
Спектр ЯМР 1Н, δ, м. д.: 4.18 д (НАНВ, CH2CN, J =
P. 951. doi 10.1134/S051474921907005X
Synthesis and Some Transformations of 5-Aryl-4-
(4-halogenaroyl)-3-hydroxy-1-cyanomethyl-3-pyrrolin-2-ones
V. L. Geina,*, E. V. Pastukhovaa, A. N. Korola, N. V. Dozmorovaa, and E. V. Voroninaa,b
a Perm State Pharmaceutical Academy, Perm, 614990 Russia
b Perm Institute, Plekhanov Russian University of Economics, Perm, 614990 Russia
*e-mail: geinvl48@mail.ru
Received June 29, 2020; revised June 29, 2020; accepted July 7, 2020
5-Aryl-4-aroyl-3-hydroxy-1-cyanomethyl-3-pyrrolin-2-ones were synthesized by a three-component reaction
of aroylpyruvic acid methyl ester with a mixture of aromatic aldehyde and 2-aminoacetonitrile sulfate in glacial
acetic acid in the presence of anhydrous sodium acetate. The possibility of their reactions with p-toluidine and
hydrazine hydrate was shown.
Keywords: 5-aryl-4-aroyl-3-hydroxy-1-cyanomethyl-3-pyrrolin-2-ones, 2-aminoacetonitrile sulfate, tetrahy-
dropyrrole-2,3-diones, three-component reactions
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 12 2020