ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2020, том 90, № 12, с. 1832-1838
УДК 547.83;547.728
СТРУКТУРНАЯ МОДИФИКАЦИЯ ПИРИДОКСАЛЯ.
СИНТЕЗ НОВЫХ 4-ХЛОР- И 4-АЛКИЛ(ДИАЛКИЛ)-
АМИНОМЕТИЛ-2-ГЕТАРИЛ(ГЕТАРОИЛ)ФУРО[2,3-c]-
ПИРИДИНОВ И ИХ АНТИИНФЕКЦИОННАЯ
АКТИВНОСТЬ
© 2020 г. А. А. Зубенкоa, Л. Н. Диваеваb,*, А. С. Морковникb, Л. Н. Фетисовa,
В. С. Сочневb, К. Н. Кононенкоa, А. Н. Бодряковa, А. И. Клименкоa
a Северо-Кавказский зональный научно-исследовательский ветеринарный институт, филиал Федерального
Ростовского аграрного научного центра, Новочеркасск, 346406, Россия
b Научно-исследовательский институт физической и органической химии Южного федерального университета,
пр. Стачки 194/2, Ростов-на-Дону 344090, Россия
*e-mail: divaevaln@mail.ru
Поступило в Редакцию 20 июля 2020 г.
После доработки 20 июля 2020 г.
Принято к печати 4 августа 2020 г.
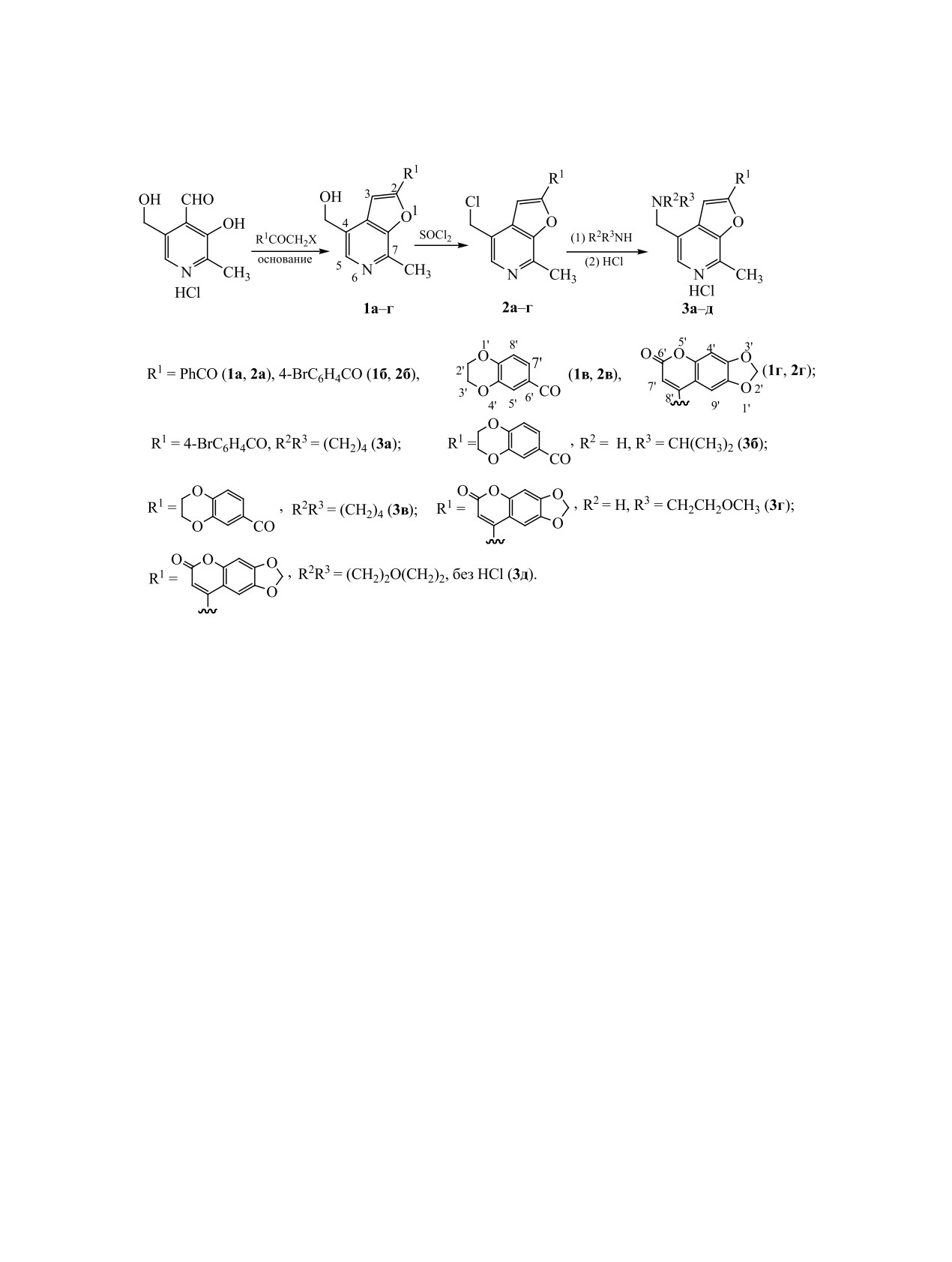
Продукты фурановой циклизации пиридоксаля ацилметил- и гетарилметилгалогенидами, 4-гидрокси-
метил-2-гетарил(гетароил)фуро[2,3-c]пиридины, под действием тионилхлорида в ДМФА легко превра-
щаются в неописанные ранее 4-хлорметил-2-гетарил(гетароил)фуро[2,3-c]пиридины, из которых далее
обменом хлора на вторичную либо третичную аминогруппу получены соответствующие аминометил-
производные. Исследование антиинфекционной активности синтезированных таким образом 4-RCH2-фу-
ропиридинов продемонстрировало высокую протистоцидную активность некоторых их представителей
в отношении простейших Colpoda steinii и умеренную антибактериальную против золотистого стафи-
лококка и кишечной палочки.
Ключевые слова: фурановая циклизация пиридоксаля, 4-гидроксиметил-2-гетарил(гетароил)фуро[2,3-c]-
пиридины, 4-хлорметил-2-гетарил(гетароил)фуро[2,3-c]пиридины, 4-алкил(диалкил)аминометил-2-
гетарил(гетароил)фуро[2,3-c]пиридины, антиинфекционная активность
DOI: 10.31857/S0044460X20120045
Одним из ключевых источников новых био-
биохимических процессов [2, 3]. Среди продук-
активных соединений для создания на их основе
тов модификации витамина B6 обнаружены анта-
инновационных лекарственных препаратов явля-
гонисты пуриновых рецепторов P2X и P2Y типа
ется структурная модификация низкомолекуляр-
[4], ингибиторы глюкокиназы [5], ацетил- и бути-
ных природных соединений, таких как алкалоиды,
рилхолинэстеразы [6], превосходящие по своему
различные витамины, кофакторные молекулы. Что
профилю безопасности ныне используемые, вы-
касается витаминов, то здесь немалое внимание
сокоактивные адреноблокаторы [7], соединения
привлекает витамин B6 [1], основными формами
с кардиопротекторной [8], противоопухолевой [9,
которого являются пиридоксаль, пиридоксаль-
10], противомалярийной [11] и антибактериальной
фосфат и пиридоксин. В фосфорилированном
активностью [12], в том числе обладающие низ-
состоянии пиридоксаль является универсальным
ким риском развития резистентности [13] и дей-
кофактором для самых различных форм жиз-
ствующие на устойчивые к антибактериальным
ни, обеспечивающим протекание разнообразных
агентам биопленочные формы [14]. Кроме того, в
1832
СТРУКТУРНАЯ МОДИФИКАЦИЯ ПИРИДОКСАЛЯ
1833
Схема 1.
ряду 4-деоксипроизводных пиридоксина, содер-
ция при участии различных ацилметил-, а также
жащих вместо гидроксиметильной диалкилами-
в достаточной мере метиленактивных гетарилме-
нометильную группу, обнаружены соединения с
тилгалогенидов. Ее продуктами являются ранее
высокой активностью в отношении метицилинре-
неизвестные4-гидроксиметил-2-гетарил(гетароил)-
зистентного золотистого стафиллакокка [15]. Про-
фуро[2,3-c]пиридины 1 (схема 1). В настоящей ра-
дукты же фурановой циклизации пиридоксаля под
боте показано, что эти соединения удобны для по-
действием гетариламинов и алкилизоцианидов,
лучения продуктов более глубокой трансформации
2-алкиламино-3-гетариламино-4-гидроксиметил-
пиридоксаля, отвечающих не только аннелирова-
фуро[2,3-c]пиридины, обладают иммуностимули-
нию фуранового цикла, но и замене гидроксиль-
рующим действием, обусловленным селективной
ной группы пиридоксаля на атом хлора (2a-г) или
активацией ими толл-подобных рецепторов TLR8
алкил(диалкил)аминогруппу (3a-д). Для соедине-
[16]. Отметим в этой связи, что пиридоксальная
ний 1-3 была исследована активность в отноше-
форма витамина B6, содержащая формильную
нии бактерий Staphylococcus aureus и Escherichia
группу, особенно удобна для проведения реакций
coli, а также простейших Colpoda steinii.
циклизации, и именно эти реакции и их продук-
Схема синтеза исходных 4-гидроксиметилфу-
ты [17-25], а также различные металлокомплексы
ропиридинов 1a-г и их хлор- (2a-г) и алкил(диал-
витамина B6 в той или иной его форме и произ-
кил)аминосодержащих аналогов (3a-д) представ-
водные этих форм в последние годы привлекают
лена выше.
наибольшее внимание при изучении структурной
Замену в соединениях 1 гидроксильной груп-
модификации указанного витамина.
пы на атом хлора проводили с выходами целевых
Ранее мы показали, что простым и эффектив-
соединений 77-95% действием тионилхлорида в
ным вариантом трансформации циклизации пи-
ДМФА, а дальнейший, также протекающий доста-
ридоксаля в производные фуро[2,3-c]пиридинов
точно гладко, обмен в образующихся хлорметил-
является его основно-катализируемая циклиза-
производных 2 атома хлора на вторичную либо
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 12 2020
1834
ЗУБЕНКО и др.
Антибактериальная и проистоцидная активность 2-ге-
В результате проведенных исследований уста-
тарил(гетароил)фуро[2,3-c]пиридинов 1-3
новлено, что 4-гидроксиметил-2-гетарил(гетаро-
ил)фуро[2,3-c]пиридины 1а, б, их хлорметильный
Зона задержки, мм
c,
(2a) и аминометильные аналоги (3a-г) обладают
Соединение
мкг/мл
высокой протистоцидной активностью, значитель-
St. aureus
E. coli
Colpoda steinii
но превосходя в этом отношении один из лучших
современных противококцидиозных препаратов
1а
0
10
3.9
толтразурил (Байкокс). Наряду с этим большинство
1б
12
10
3.9
изученных
гетарил(гетароил)фуро[2,3-c]пири-
1в
0
12
>500
динов (1a-г, 2a-г, 3б-д) проявляют умеренное ан-
1г
12
8
250
тибактериальное действие в отношении кишечной
2a
0
10
3.9
палочки и золотистого стафилококка (см. таблицу).
2б
18
10
>500
В то же время фунгистатической активностью
2в
0
12
>500
против грибка Penicillium italicum не обладает ни
2г
12
12
>500
один из изученных гетарил(гетароил)фуро[2,3-c]-
3a
0
0
31.25
пиридинов 1-3.
3б
0
10
7.8
3в
0
10
31.25
Таким образом, 4-гидроксиметил-2-гетарил(ге-
3г
0
0
31.25
тароил)фуро[2,3-c]пиридины и образующиеся из
3д
0
0
>500
них заменой OH-группы продукты более глубо-
Контроль
26а
28а
62.5б
кой структурной модификации пиридоксаля мо-
а Фуразолидон.
гут представлять практический интерес в качестве
б Байкокс.
протистоцидных агентов.
третичную аминогруппу - путем их реакции с
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
алкил- и диалкиламинами. Строение соединений
Спектры ЯМР в ДМСО-d6 (30°C) соедине-
1-3 подтверждено данными элементного анализа
ний 1в, 2в, 3б, в сняты на спектрометре Bruker
и спектроскопии ЯМР, в том числе двумерной (на
Avance-600 (600 МГц); для всех остальных со-
примере фуропиридина 3в).
единений использован прибор Varian Unity-300
Предполагалось, что
2-гетарил(гетароил)фу-
(300 МГц). Температуры плавления определены
ро[2,3-c]пиридины могут действовать как пи-
на приборе Fisher-Johns Melting Point Apparatus.
ридоксальмиметики и благодаря этому обла-
Элементный анализ проведен классическим мето-
дать антиинфекционной активностью. С учетом
дом микроанализа [29]. Контроль за протеканием
этого нами были проведено исследование ан-
реакций и индивидуальностью полученных сое-
тибактериальной, протистоцидной и фунгиста-
динений осуществлялся методом ТСХ (пластины
тической активности соединений 1-3 in vitro. Ан-
с Al2O3 III степени активности, элюент - CHCl3,
тибактериальная активность была определена для
Staphylococcus aureus (штамм P-209) и Escherichia
проявление парами иода во влажной камере). Для
coli (полевой штамм 078), типичных представи-
проведения спектроскопических исследований ис-
телей грамположительных и грамотрицательных
пользовано оборудование Центра коллективного
бактерий, методом диффузии в агар с использова-
пользования Южного федерального университета.
нием в качестве препарата сравнения фуразолидо-
В работе использованы коммерчески доступ-
на [27, 28]. Необходимые бактериальные культуры
ные реагенты. Синтез соединений 1a, б, г описан
выращивали на агаризованной питательной среде
в работе [30].
в течение суток при 37°С. Антипротозойное дей-
(2,3-Дигидробензо[b][1,4]диоксин-6-ил)(4-
ствие соединений было оценено для специально
подготовленных полевых изолятов Colpoda steinii
гидроксиметил)-7-метилфуро[2,3-с]пири-
[26]. Было изучено также фунгистатическое дей-
дин-2-ил)метанон (1в). Смесь 0.67 г (4 ммоль)
ствие гетарил(гетароил)фуро[2,3-c]пиридинов 1-3
пиридоксаля, 0.85 г (4 ммоль) 2-хлор-1-(2,3-ди-
для грибка Penicillium italicum методом диффузии
гидробензо[b][1,4]диоксин-6-ил)этан-1-она, 10 мл
в агар [27, 28].
насыщенного раствора K2CO3 и 0.05 г бромида те-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 12 2020
СТРУКТУРНАЯ МОДИФИКАЦИЯ ПИРИДОКСАЛЯ
1835
траэтилбензиламмония в 10 мл ДМФА интенсив-
тионилхлорида в 10 мл абсолютного ДМФА. При
но перемешивали сначала 30 мин при 25°C, затем
этом образуется раствор, который в течение 5 мин
30 мин при 35°C и 10 мин при 50°C. Далее реакци-
превращается в суспензию. Последнюю переме-
онную смесь охлаждали и добавляли 100 мл воды.
шивали в течение 1 ч при 20-25°С, затем охлажда-
образовавшийся осадок фуропиридина 1в отфиль-
ли до 0°С. Осадок отфильтровывали и промывали
тровывали и промывали водой (3 × 15 мл). Выход
холодным ДМФА (3×5 мл), затем обрабатывали
1.03 г (79%), бледно-желтые кристаллы, т. пл. 196-
водным раствором NaHCO3 до рН = 8. Основание
198°С (CH3CN). Спектр ЯМР 1H, δ, м. д.: 2.71 с
отфильтровывали и промывали водой (3×10 мл).
(3Н, CH3), 4.32-4.34 м (2Н, CH2), 4.37-4.38 м (2Н,
Выход 2.9 г (83%), бледно-желтые кристаллы, т. пл.
СН2), 4.79 с (2Н, СН2), 5.43 уш. с (1H, OH), 7.08
173-175°С (EtOH). Спектр ЯМР 1Н, δ, м. д.: 2.74 с
д (1Н, Н7′, J = 8.5 Гц), 7.57 д (1Н, Н5′, J = 2.2 Гц),
(3Н, CH3), 4.32-4.34 м (2Н, CH2), 4.38-4.39 м (2Н,
7.61-7.63 м (1Н, Н8′), 7.84 с (1Н, Н5), 8.28 с (1Н,
CH2), 5.15 с (2Н, СН2), 7.09 д (1H, H7′, J = 8.5 Гц),
H3). Найдено, %: 66.18; Н 4.40; N 4.12. С18H15NO5.
7.59 д (1Н, Н5′, J = 2.2 Гц), 7.64-7.65 м (1Н, Н8′),
Вычислено, %: 66.46; Н 4.65; N 4.31.
7.94 с (1H, H5), 8.43 с (1H, H3). Найдено, %: 62.54;
[4-(Хлорметил)-7-метилфуро[2,3-c]пири-
Н 4.00; Cl 10.46; N 4.32. С18H14ClNO4. Вычислено,
дин-2-ил](фенил)метанон (2a). К 20 мл охлаж-
%: 62.89; Н 4.11; Cl 10.31; N 4.07.
денного до 0°С абсолютного ДМФА прибавляли
8-[(4-(Хлорметил)-7-метилфуро[2,3-c]пири-
2.38 г (1.45 мл, 0.02 моль) тионилхлорида. Смесь
дин-2-ил)]-6Н-[1,3]диоксоло[4,5-g]хромен-6-он
выдерживали 10 мин при комнатной температуре,
(2г) получали аналогично из фуропиридина 1г и
затем прибавляли 4.01 г (0.015 моль) фуро[2,3-c]-
тионилхлорида. Выход 95%, т. пл. 195°С (ДМФА-
пиридина 1a. Полученную смесь перемешивали
EtOH, 2:1, разл.). Спектр ЯМР 1Н, δ, м. д.: 2.90 с
1 ч при 50-55°С, затем охлаждали и обрабатыва-
(3Н, CH3), 5.20 с (2Н, CH2), 6.24 с (2Н, OCH2O),
ли 100 мл воды. Осадок отфильтровывали, про-
6.96 с (1Н, Н9′), 7.28 с (1Н, Н3), 7.67 с (1H, H5), 8.22
мывали водой (3×20 мл) и сушили при комнатной
с (1H, Н4′), 8.62 с (1H, H7′). Найдено, %: 62.36; Н
температуре. Выход 3.47 г (81%), т. пл. 138-141°С
3.01; Cl 9.36; N 3.62. С19H12ClNO5. Вычислено, %:
(EtOH). Спектр ЯМР 1Н, δ, м. д.: 2.70 с (3Н, CH3),
61.72; Н 3.27; Cl 9.59; N 3.79.
5.13 с (2Н, CH2), 7.86 д (2H, H2′,6′, J = 8.7 Гц), 7.92
4-Бромфенил-[7-метил-4-(пирролидин-1-ил-
т (1H, Н4′, J = 7.8 Гц), 7.93 с (1H, H5), 8.12 д (2H,
метил)фуро[2,3-c]пиридин-2-ил]метанона ги-
Н3′,5′, J = 9.0 Гц), 8.52 с (1H, H3). Найдено, %: С
дрохлорид (3a). Смесь 1.46 г (4 ммоль) 4-хлорме-
67.00; Н 4.05; Cl 12.11; N 4.66. С16H12ClNO2. Вы-
тилпроизводного 2б и 0.85 г (0.98 мл, 12 ммоль)
числено, %: С 67.26; Н 4.23; Cl 12.41; N 4.90.
пирролидина в 10 мл ДМФА перемешивали при
(4-Бромфенил)(4-(хлорметил)-7-метилфуро-
95°С 1 ч. Реакционную смесь охлаждали до ком-
[2,3-c]пиридин-2-ил)метанон (2б) получали ана-
натной температуры и добавляли 50 мл воды. Об-
логично из 5.19 г (0.015 моль) фуро[2,3-c]пириди-
разовавшийся осадок отфильтровывали и промы-
на 1б и 2.38 г (1.45 мл, 0.02 моль) тионилхлори-
вали водой (3×5 мл). Для превращения основной
да. Выход 4.21 г (77%), т. пл. 145-147°С (EtOH).
формы амина в гидрохлорид 3a ее обрабатывали
Спектр ЯМР 1Н, δ, м. д.: 2.74 с (3Н, CH3), 5.14 с
насыщенным раствором HCl в изопропаноле до
(2Н, CH2), 7.86 д (2H, H2′,6′, J = 8.7 Гц), 7.97 с (1H,
слабокислой реакции (рН ~ 3). Выход 1.03 г (59%),
H5), 8.01 д (2H, Н3′,5′, J = 9.0 Гц), 8.45 с (1H, H3).
т. пл. 163-165°С (EtOH). Спектр ЯМР 1Н, δ, м. д.:
Найдено, %: 52.39; Н 3.38; Br+Cl 31.44; N 3.66.
1.87 уш. т (2Н, СН2, пирролидин-1-ил), 2.01 уш. т
С16H11BrClNO2. Вычислено, %: 52.71, Н 3.04; Br
(2Н, СН2, пирролидин-1-ил), 2.85 с (3Н, CH3), 3.11
21.91; Cl 9.72; N 3.84.
уш. т (2Н, СН2, пирролидин-1-ил), 3.39 уш. т (2Н,
[4-(Хлорметил)-7-метилфуро[2,3-c]пиридин-
СН2, пирролидин-1-ил), 4.74 д (1Н, СН2, J = 5.7 Гц),
2-ил](2,3-дигидробензо[b][1,4]диоксин-6-ил)-
7.86 д (2Н, Н2′,6′ J = 8.7 Гц), 8.06 д (2Н, Н3′,5,, J =
метанон (2в). К охлажденной до 5°С суспензии
8.4 Гц), 8.40 с (1H, H5), 8.72 с (1H, Н3), 11.32 с (1H,
3.25 г (0.01 моль) фуропиридина 1в в 25 мл абсо-
+NH). Найдено, %: C 55.44; Н 4.80; Br + Cl 26.37; N
лютного ДМФА прибавляли при перемешивании
6.21. С20H19BrN2O2·HCl. Вычислено, %: C 55.13; Н
охлажденный раствор 1.43 г (0.87 мл, 0.012 моль)
4.63; Br 18.34; Cl 8.14; N 6.43.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 12 2020
1836
ЗУБЕНКО и др.
отфильтровывали, промывали этанолом (3×3 мл)
и сушили. Выход 1.05 г (65%), т. пл. 193-195°С
(EtOH). Спектр ЯМР 1Н, δ, м. д.: 1.36 с (3Н, СН3),
1.37 с (3Н, СН3), 2.91 с (3Н, CH3), 3.41-3.43 м (1Н,
СН), 4.33-4.34 м (2Н, CH2), 4.38-4.40 м (2Н, CH2),
4.57 т (2Н, СН2, J = 6.2 Гц),7.09 д (1H, H7′, J =
8.5 Гц), 7.63 д (1Н, Н5′, J = 2.2 Гц), 7.73-7.75 м (1Н,
Н8′), 8.35 с (1H, H5), 8.81 с (1H, H3), 9.69 с (2Н,
). Найдено, %: 62.40; Н 5.46; Cl 8.44; N 6.80.
+NH2
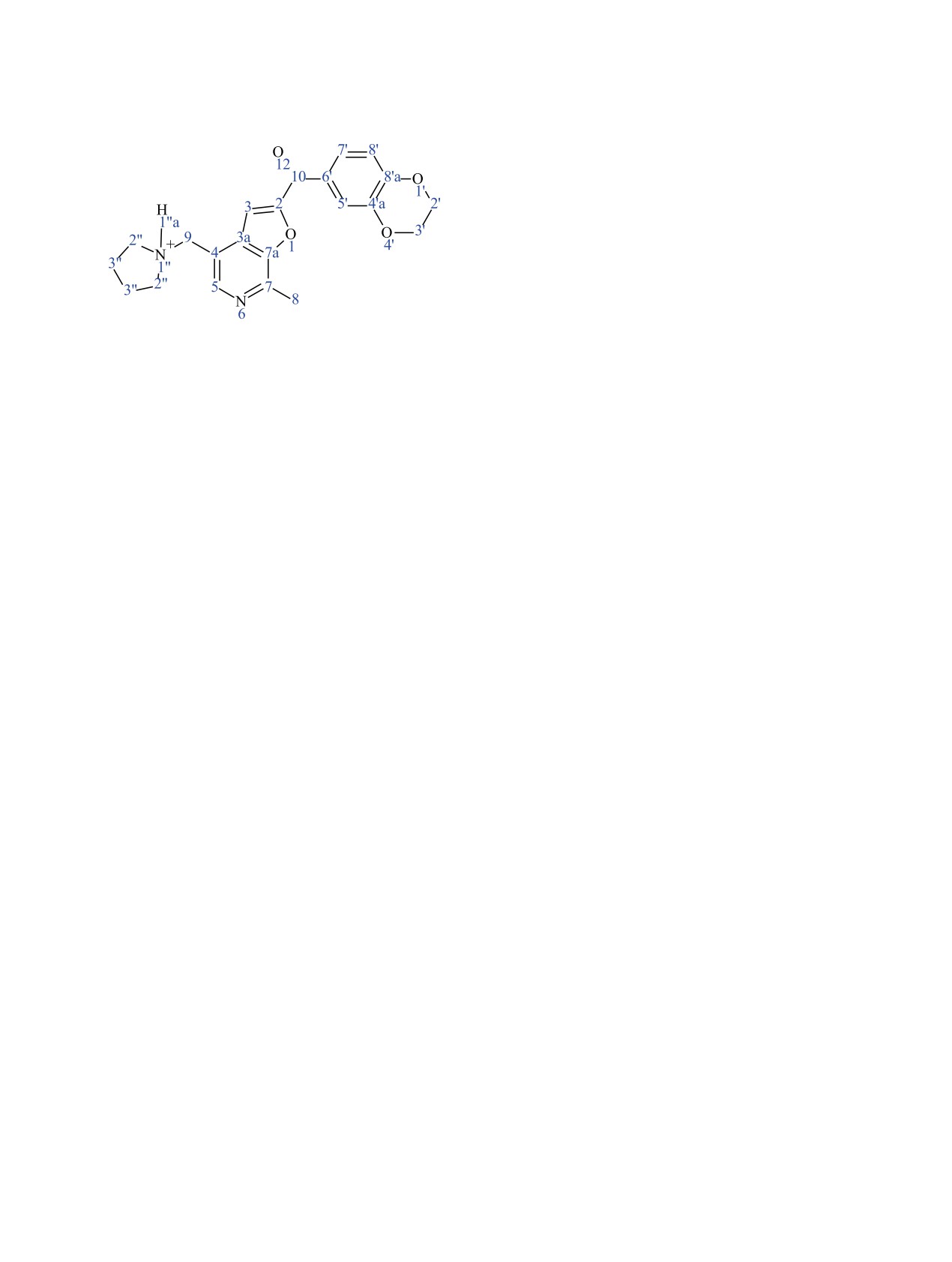
Спектр HMBC 13C-1H, δΗ/δC (Iотн, JCH, Гц):
С21H22N2O4·HCl. Вычислено, %: 62.61; Н 5.75; Cl
1.84-1.92/22.44 (0.06, H3′′, C3′′), 1.98-2.04/22.43
8.80; N 6.95.
(0.07, H3′′, C3′′), 2.90/16.24 (2.97, H8, C8, J = 130.3),
(2,3-Дигидробензо[b][1,4]диоксин-6-ил)(7-
2.90/120.96 (0.25, CH3, C4), 2.90/143.64 (8.13, CH3,
метил-4-(пирролидин-1-илметил)фуро[2,3-c]-
C7a), 2.90/149.61 (5.13, CH3, C7), 3.08-3.16/22.44
пиридин-2-ил)метанона гидрохлорид (3в) полу-
(0.06, H2′′, C3′′), 3.40/22.44 (0.05, H2′′, C3′′), 4.19-
чали аналогично из метанона 2в и пирролидина.
4.53/63.90 (64.60, H2′, C2′; H3′, C3′), 4.34/143.42 (0.53,
Выход 76%, кремовые кристаллы, т. пл. 198-200°С
H3′, C4′a), 4.39/148.97 (0.33, H2′, C8′a), 4.79/52.69
(EtOH). Спектр ЯМР 1Н, δ, м. д.: 1.87-1.89 м (2Н,
(0.89, H9, C2′′), 4.79/120.86 (1.15, H9, C4), 4.80/136.25
СН2, пирролидин-1-ил), 2.01-2.03 м (2Н, СН2, пир-
(0.67, H9, C3a), 4.80/140.73 (0.2, H9, C5), 7.10/117.38
ролидин-1-ил), 3.10 с (3H, CH3), 3.11-3.13 м (2Н,
(1.18, H8′, C8′, J = 163.40), 7.09/118.56 (0.08, H8′,
СН2, пирролидин-1-ил), 3.39-3.43 м (2Н, СН2, пир-
С5′), 7.10/128.81 (2.05, H8′, C6′, J = 9.0), 7.10/143.43
ролидин-1-ил), 4.79 уш. д (1Н, экзоцикл. OCH2),
(1.68, H8′, C4′a, J = 8.0), 7.10/148.94 (1.12, H8′, C8′a),
4.80 д (1Н, экзоцикл. OCH2), 7.09 д (1H, H7′, J =
7.09/181.15 (0.07, H8′, C10), 7.62/117.69 (0.03, H5′,
8.5 Гц), 7.62 д (1Н, Н5′, J = 2.2 Гц), 7.73-7.75 м
C8′), 7.62/118.46 (0.44, H5′, C5′, J = 81.8), 7.62/124.12
(1Н, Н8′), 8.40 с (1H, H5), 8.81 с (1H, H3), 11.61 c
(1.25, H5′, C7′, J = 9.5), 7.62/128.80 (0.12, H5′, C7′),
(1H, +NH). Спектр ЯМР 13С (150 МГц), δС, м. д.:
7.62/143.42 (0.93, H5′, C6′), 7.62/148.92 (1.18, H5′,
16.56 (СН3), 22.44 (С3′′), 50.36 (NC9H2), 52.60 (С2′′),
C8′a, J = 7.1), 7.62/181.21 (0.74, H5′, C10), 7.75/118.51
63.94 (OC3′H2), 64.69 (OC2′H2), 113.86 (С3), 117.54
(0.91, H7′, C5′), 7.74/124.12 (0.64, H7′, C7′, J = 82.6),
(С8′), 118.51 (С5′), 120.80 (С4), 124.14 (С7′), 128.78
7.74/143.40
(0.26, H7′, C4′a),
7.73/148.93
(0.93,
(С6′), 136.23 (С3а), 140.74 (С5), 143.30 (С4а), 143.63
H7′, C8′a), 7.74/181.21 (0.66, H7′, C10), 8.40/113.86
(С7а), 148.95 (С8′а), 149.56 (С7), 154.90 (С2), 181.22
(1.75, H3, C3, J = 186.7), 8.40/120.81 (0.18, H3,
(С=О). Найдено, %: 63.44; Н 5.30; Cl 8.14; N 6.57.
C4), 8.40/136.22 (1.00, H3, C3a), 8.40/149.61 (2.56,
С22H22N2O4·HCl. Вычислено, %: 63.69; Н 5.59; Cl
H3, C7, J = 6.8), 8.40/155.01 (1.91, H3, C2, J = 9.7),
8.54; N 6.75.
8.40/181.64 (0.10, H3, C10), 8.81/50.36 (0.36, H5, C9),
8.81/113.87 (0.07, H5, C3), 8.81/120.90 (1.42, H5, C4,
8-(4-{[(2-Метоксиэтил)амино]метил}-7-метил-
J = 5.8), 8.81/136.25 (1.08, H5, C3a, J = 7.0),
фуро[2,3-c]пиридин-2-ил)-6Н-[1,3]диоксо-
8.81/140.72 (0.37, H5, C5, J = 184.5), 8.80/143.63
ло[4,5-g]хромен-6-она гидрохлорид (3г) получа-
(1.41, H5, C7a, J = 9.8), 8.81/149.55 (0.23, H5, C7).
ли аналогично соединению 3a из хлорметилпро-
изводного 2г и 2-метоксиэтиламина. Выход 54%,
2,3-Дигидробензо[b][1,4]диоксин-6-ил-{4-
т. пл. 207-210°С (EtOH). Спектр ЯМР 1Н, δ, м. д.:
[(изопропиламино)метил]-7-метилфуро[2,3-c]-
2.91 уш. т (2Н, СН2), 3.15 уш. т (2Н, СН2), 3.28 с
пиридин-2-ил}метанона гидрохлорид
(3б).
(3Н, CH3), 3.69 с (3Н, ОСН3), 4.58 уш. т (2Н, CH2),
Смесь 1.38 г (4 ммоль) хлорметилпроизводного 2в,
6.24 с (2Н, OCH2O), 6.93 с (1Н, Н9′), 7.28 с (1Н,
0.71 г (1.03 мл, 12 ммоль) изопропиламина в 5 мл
Н7′), 7.80 с (1H, H4′), 8.44 с (1H, Н5), 8.72 с (1H,
ДМФА нагревали в ампуле при 70-75°C 30 мин.
H3), 10.02 уш. с (2Н, +NH). Найдено, %: 59.22; Н
После охлаждения содержимое ампулы обрабаты-
4.61; Cl 7.67; N 6.00.С22H20N2O6·HCl. Вычислено,
вали 25 мл воды и экстрагировали хлороформом
%: 59.40; Н 4.76; Cl 7.97; N 6.30.
(2×10 мл). Экстракт сушили Na2SO4, хлороформ
отгоняли в вакууме, остаток обрабатывали рас-
8-(7-Метил-4-(морфолинометил)фуро[2,3-c]-
твором HCl в изопропаноле. Выпавший осадок
пиридин-2-ил)-6Н-[1,3]диоксоло[4,5-g]хромен-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 12 2020
СТРУКТУРНАЯ МОДИФИКАЦИЯ ПИРИДОКСАЛЯ
1837
6-он (3д). Смесь 1.48 г (4 ммоль) хлорметилпроиз-
Aliev G. // Sci. Rep. 2017. Vol. P. 16072. doi 10.1038/
водного 2г, 1.05 г (1.03 мл, 12 ммоль) морфолина в
s41598-017-16405-2
6.
Strelnik A.D., Petukhov A.S., Zueva I.V., Zobov V.V.,
6 мл ДМФА выдерживали 1 ч при 100°С, затем ох-
Petrov K.A., Nikolsky E.E., Balakin K.V., Bachurin S.O.,
лаждали и добавляли 40 мл воды. Образовавшийся
Shtyrlin Y.G. // Bioorg. Med. Chem. Lett. 2016. Vol. 26.
осадок отфильтровывали и промывали водой (3 ×
P. 4092. doi 10.1016/j.bmcl.2016.06.070
5 мл). Выход 1.53 г (91%), т. пл. 198-200°С (EtOH).
7.
Павельев Р.С., Хайруллина Р.Р., Кошкин С.А., Икса-
Спектр ЯМР 1Н, δ, м. д.: 2.41 уш. т (4Н, СН2-мор-
нова А.Г., Лодочникова О.А., Хаертдинов Н.Н., Сит-
фолин-4-ил), 2.71 с (3Н, CH3), 3.54-3.55 м (4Н,
дикова Г.Ф., Сафина А.Ф., Александрова Э.Г., Зи-
СН2-морфолин-4-ил), 3.76 с (2Н, СН2), 6.22 с (2Н,
ганшина Л.Е., Штырлин Ю.Г. // Изв. АН. Сер. хим.
2016. С. 519; Pavelyev R.S., Khairullina R.R., Kosh-
OCH2O), 6.87 с (1Н, Н9′), 7.23 с (1Н, Н7′), 7.67 с
kin S.A., Iksanova A.G., Lodochnikova O.A., Khaertdi-
(1H, H4′), 7.96 с (1H, Н5), 8.22 с (1H, H3). Найдено,
nov N.N., Sitdikova G.F., Safina A.F., Aleksandro-
%: 65.42; Н 4.53; N 6.29. С23H20N2O6. Вычислено,
va E.G., Ziganshina L.E., Shtyrlin Y.G. // Russ. Chem.
%: 65.71; Н 4.80; N 6.66.
Bull. 2016. Vol. 65. P. 519. doi 10.1007/s11172-016-
1332-0
ФОНДОВАЯ ПОДДЕРЖКА
8.
Pham V., Zhang W., Chen V., Whitney T., Yao J., Froese D.,
Работа выполнена при финансовой поддержке
Friesen A.D., Diakur J.M., Haque W. // J. Med. Chem.
Министерства науки и высшего образования РФ
2003. Vol. 46. P. 3680. doi 10.1021/jm0300678
9.
Пугачев М.В., Павельев Р.С., Нгуен Т.Н.Т., Иксано-
(Южный федеральный университет, грант № БАЗ
ва А.Г., Лодочникова О.А., Штырлин Ю.Г. // Изв.
0110/20-3-11ИХ, синтез соединений 3в-д). Синтез
АН. Сер. хим. 2016. С. 532; Pugachev M.V., Pave-
соединений 1a, 2a-г, 3a, б и изучение антиинфек-
lyev R.S., Nguyen T.N.T., Iksanova A.G., Lodochniko-
ционной активности проводили в Северо-Кавказ-
va O.A., Shtyrlin Y.G. // Russ. Chem. Bull. 2016. Vol. 65.
ском зональном ветеринарном институте в рамках
P. 532. doi 10.1007/s11172-016-1333-z
выполнения программы фундаментальных на-
10.
Pavelyev R.S., Bondar O.V., Nguyen T.N.T., Ziganshi-
учных исследований государственных академий
na A.A., Al Farroukh M., Karwt R., Alekbaeva G.D.,
наук на 2013-2020 годы (тема № 0710-2019-0044).
Pugachev M.V., Yamaleeva Z.R., Kataeva O.N., Bala-
kin K.V., Shtyrlin Y.G. // Bioorg. Med. Chem. 2018.
КОНФЛИКТ ИНТЕРЕСОВ
Vol. 26. P. 5824. doi 10.1016/j.bmc.2018.10.031
11.
Müller I.B., Wu F., Bergmann B., Knockel J., Walter R.D.,
Авторы заявляют об отсутствии конфликта
Gehring H., Wrenger C. // PLoS ONE. 2009. Vol. 4.
интересов.
e4406. doi 10.1371/journal.pone.0004406
12.
Sapozhnikov S.V., Shtyrlin N.V., Kayumov A.R., Zamal-
СПИСОК ЛИТЕРАТУРЫ
dinova A.E., Iksanova A.G., Nikitina Р.V., Krylo-
1. Штырлин Ю.Г., Петухов А.С., Стрельник А.Д.,
va Р.S., Grishaev D.Y., Balakin K.V., Shtyrlin Y.G. //
Штырлин Н.В., Иксанова А.Г., Пугачев М.В., Па-
Med. Chem. Res. 2017. Vol. 26. P. 3188. doi 10.1007/
вельев Р.С., Дзюркевич М.С., Гарипов М.Р., Бала-
s00044-017-2012-9
кин К.В. // Изв. АН. Сер. хим. 2019. С. 911; Shtyrlin Y.G.,
13.
Nikitina E.V., Zeldi M.I., Pugachev M.V., Sapozhni-
Petukhov A.S., Strelnik A.D., Shtyrlin N.V.,
kov S.V., Shtyrlin N.V., Kuznetsova S.V., Evtygin V.E.,
Iksanova A.G., Pugachev M.V., Pavelyev R.S., Dzyurke-
Bogachev M.I., Kayumov A.R., Shtyrlin Y.G. // World J.
vich M.S., Garipov M.R., Balakin K.V. // Russ. Chem.
Microbiol. Biotechnol. 2016. Vol. 32. P. 1. doi 10.1007/
Bull. 2019. Vol. 68. P. 911. doi 10.1007/s11172-019-
s11274-015-1969-0
2504-5
14.
Garipov M.R., Pavelyev R.S., Lisovskaya S.A., Nikiti-
2. di Salvo M.L., Contestabile R., Safo M.K. // Biochim.
na E.V., Kayumov A.R., Sabirova A.E., Bondar O.V.,
Biophys. Acta - Proteins and Proteomics. 2011.
Malanyeva A.G., Aimaletdinov A.M., Iksanova A.G.,
Vol. 1814. P. 1597. doi 10.1016/j.bbapap.2010.12.006
Balakin K.V., Shtyrlin Y.G. // J. Chem. 2017. Article
3. Peracchi R., Peracchi A. // EMBO Rep. 2003. Vol. 4.
no. 4761650. doi 10.1155/2017/4761650
P. 850. doi 10.1038/sj.embor.embor914
15.
Shtyrlin N.V., Sapozhnikov S.V., Galiullina A.S.,
4. Ziganshin A.U., Kalinina O.S., Strelnik A.D., Gari-
Kayumov A.R., Bondar O.V., Mirchink E.P., Isako-
pov M.R., Koshkin S.A., Ziganshina L.E., Shtyrlin Y.G. //
va E.B., Firsov A.A., Balakin K.V., Shtyrlin Y.G. //
Int. J. Pharm. 2015. Vol. 11. P. 400. doi 10.3923/
BioMed Res. Int. 2016. Article no.
3864193.
ijp.2015.400.404
doi 10.1155/2016/3864193
5. Dzyurkevich M.S., Babkov D.A., Shtyrlin N.V., May-
16.
Salunke D.B., Yoo E., Shukla N.M., Balakrishna R.,
ka O.Y., Iksanova A.G., Vassiliev P.M., Balakin K.V.,
Malladi S.S., Serafin K.J., Day V.W., Wang X., Da-
Spasov A.A., Tarasov V.V., Barreto G., Shtyrlin Y.G.,
vid S.A. // J. Med. Chem. 2012. Vol. 55. P. 8137. doi
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 12 2020
1838
ЗУБЕНКО и др.
10.1021/jm301066h
25. Dale Tr.J., Sather A.C., Rebek J. // Tetrahedron Lett.
17. Pham V., Zhang W., Chen V., Whitney T., Yao J., Froese D.,
2009. Vol. 50. P. 6173. doi 10.1016/j.tetlet.2009.08.086
Friesen A.D., Diakur J.M., Haque W. // J. Med. Chem.
26. Фетисов Л.Н., Зубенко А.А., Бодряков А.Н., Бодря-
2003. Vol. 46. P. 3680. doi 10.1021/jm0300678
кова М.А. // Вопросы нормативно-правового регули-
18. Ponticelli F., Marinello E., Pagani R., Terzuoli L. // J.
рования в ветеринарии. Материалы международного
Heterocycl. Chem. 1991. Vol. 28. P. 1225. doi 10.1002/
паразитологического симпозиума «Современные
jhet.5570280512
проблемы общей и частной паразитологии». 2012.
19. Zhuravel’ I.O., Kovalenko S.M., Zaremba O.V.,
С. 70.
Detistov O.S., Kovalenko S.S., Chernykh V.P. //
27. Попов Л.Д., Зубенко А.А., Фетисов Л.Н., Дро-
Synth.Commun. 2008. Vol. 38. P. 3778. doi
бин Ю.Д., Клименко А.И., Бодряков А.Н., Бород-
10.1080/00397910802219445
кин С.А., Мелкозерова И.Е. // Биоорг. хим. 2018. Т. 44.
20. Журавель И.А., Коваленко С.Н., Черных В.П., Шин-
С. 225; Popov L.D., Zubenko A.A., Fetisov L.N., Dro-
каренко П.Е. // Изв. вузов. Сер. хим. и хим. технол.
bin Y.D., Bodryakov A.N., Klimenko A.I., Borodkin S.A.,
2007. Т. 50. Р. 10.
Melkozerova I.E. // Russ. J. Bioorg. Chem. 2018.
21. Zhuravel’ I.O., Kovalenko S.M., Ivachtchenko A.V.,
Vol. 44. P. 238. doi 10.7868/S013234231802015X
Chernykh V.P., Shinkarenko P.E. // J. Heterocycl. Chem.
28. Burlov A.S., Koshchienko Y.V., Makarova N.I., Borod-
2004. Vol. 41. P. 517. doi 10.1002/jhet.5570410407
kin G.S., Metelitsa A.V., Vlasenko V.G., Zubenko A.A.,
22. Шинкаренко П.Е., Власов С.В., Журавель И.О., Ко-
Drobin Y.D., Zubavichus Y.V., Garnovskii D.A. //
валенко С.М., Федосов А.И., Черных В.П. // Ж. орг. и
Polyhedron. 2018. Vol. 144. P. 249. doi 10.1016/j.
фарм. хим. 2010, Т. 8. С. 51.
poly.2018.01.020
23. Derbisbekova U.B., Datkhayev U.M., Kiyekbayeva L.N.,
29. Гельман Н.Э., Терентьева Е.А., Шанина Т.М., Кипа-
Zhuravel I.A., Omarova R.A., Turgumbayeva A.A. //
ренко Л.М. // Методы количественного органическо-
Oriental J. Chem. 2017. Vol. 33. P. 1914. doi 10.13005/
го элементного анализа. М.: Химия, 1987.
ojc/330437
30. Morkovnik A.S., Zubenko A.A., Divaeva L.N., Kart-
24. Sosnovskikh V.Ya., Korotaev V.Yu., Barkov A.Yu.,
sev V.G., Borodkin G.S., Klimenko A.I. // Mendeleev
Sokovnina A.A., Kodess M.I. // J. Fluorine Chem. 2012.
Commun. 2018. Vol. 29. P. 116. doi 10.1016/j.men-
Vol. 141. P. 58. doi 10.1016/j.jfluchem.2012.06.001
com.2019.01.040
Structural Modification of Pyridoxal. Synthesis and Evaluation
of Anti-Infective Activity of New 4-Chloro- and 4-Alkyl(dialkyl)-
aminomethyl-2-hetaryl(hetaroyl)furo[2,3-c]pyridines
A. A. Zubenkoa, L. N. Divaevab,*, A. S. Morkovnikb, L. N. Fetisova, V. S. Sochnevb,
K. N. Kononenkoa, A. N. Bodryakova and A. I. Klimenkoa
a North Caucasian Zonal Veterinary Research Institute, Federal Rostov Agrarian Scientific Center, Novocherkassk, 346406 Russia
b Institute of Physical and Organic Chemistry of Southern Federal University, Rostov-on-Don, 344090 Russia
*e-mail: divaevaln@mail.ru
Received July 20, 2020; revised July 20, 2020; accepted August 4, 2020
4-Hydroxymethyl-2-hetaryl(hetaroyl)furo[2,3-c]pyridines, the products of furan cyclization of pyridoxal by
acylmethyl- and heteroarylmethyl halides, easily react with thionyl chloride in DMF and are converted into
previously unknown 4-chloromethylmethyl-2-heteroaryl[2,3-c]pyridines. Further, action of primary or secondary
amines on these chlorine derivatives leads to the nucleophilic substitution of chlorine atoms with the formation
products of corresponding aminomethyl derivatives. The study of the anti-infective activity of the 4-RCH2-
furo[2,3-c]pyridines (R = OH, Cl, NR1R2) demonstrated the significant protistocidal and moderate antibacterial
activity of some of representatives of these compounds.
Keywords: furan cyclization of pyridoxal, 4-hydroxymethyl-2-hetaryl(hetaroyl) furo[2,3-c]pyridines, 4-chloro-
methyl-2-hetaryl(hetaroyl)furo[2,3-c]pyridines, 4-alkyl(dialkyl)aminomethyl-2-hetaryl(hetaroyl)furo[2,3-c]-
pyridines, anti-infective activity
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 12 2020