ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2020, том 90, № 12, с. 1839-1846
УДК 547.857.7:66.095.253
ВЗАИМОДЕЙСТВИЕ АДЕНИНА И ЕГО ЗАМЕЩЕННЫХ
ПО ЭКЗОЦИКЛИЧЕСКОМУ АТОМУ АЗОТА С
ФЕНИЛГЛИЦИДИЛОВЫМ ЭФИРОМ
© 2020 г. О. В. Непорожнева, Е. П. Студенцов, С. М. Рамш*
Санкт-Петербургский государственный технологический институт (Технический университет),
Московский пр. 26, Санкт-Петербург, 190013 Россия
*e-mail: sramsh@technolog.edu.ru
Поступило в Редакцию 10 августа 2020 г.
После доработки 10 августа 2020 г.
Принято к печати 20 августа 2020 г.
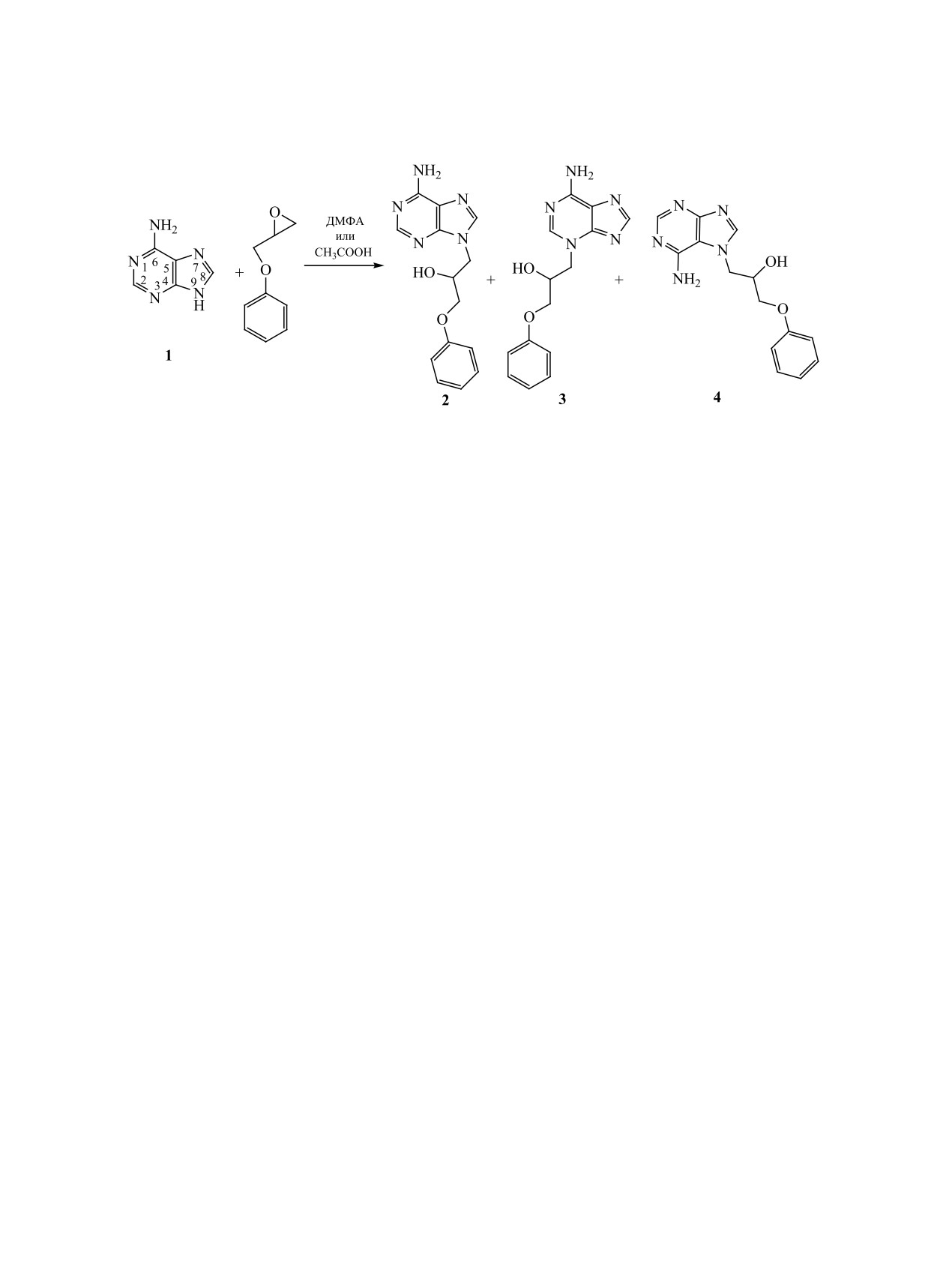
Изучены особенности взаимодействия аденина с фенилглицидиловым эфиром в зависимости от природы
растворителя. В ДМФА в присутствии K2CO3 образуется преимущественно продукт N9-алкилирования
аденина - экспериментальный противовирусный препарат 9-(2-гидрокси-3-феноксипропил)аденин.
Алкилирование в уксусной кислоте приводит к образованию кроме N9- также N3- и N7-замещенных.
Алкилированием 6-R(R2)-аминопуринов фенилглицидиловым эфиром в ДМФА получены замещенные
по экзоциклическому атому азота аналоги 9-(2-гидрокси-3-феноксипропил)аденина.
Ключевые слова: аденин, фенилглицидиловый эфир, 9-(2-гидрокси-3-феноксипропил)аденин, 6-R(R2)-
амино-9-(2-гидрокси-3-феноксипропил)пурины
DOI: 10.31857/S0044460X20120057
Производные гуанина и аденина 1 занимают
нения 2 [6]. В этой реакции наряду с продуктом
важное место в медицинской химии. Например,
N9-алкилирования могут образоваться изомерные
N9-производные гуанина - ацикловир, пенцикло-
продукты N3- и N7-алкилирования. Используя
вир [1], фамцикловир [2] и др. являются мощными
возможности указанного метода, из 6-[алкил(ди-
противовирусными агентами, широким спектром
алкил)амино]пуринов мы получили ряд аналогов
противовирусного действия обладают адениновые
соединения 2, замещенных по экзоциклическому
аналоги ацикловира - 9-(S)-(2,3-дигидроксипро-
атому азота, потенциально обладающих противо-
пил)аденин [4] и 9-(3-гидрокси-2-фосфонилметок-
вирусными свойствами.
сипропил)аденин [5].
Спектральный (ЯМР 1Н) и ТСХ анализ неочи-
Производные пиримидина с ароматическим
щенного вещества 2, полученного при взаимодей-
фрагментом в боковой цепи рассматриваются как
ствии аденина 1 с фенилглицидиловым эфиром
структурные предшественники для дизайна сое-
в присутствии K2CO3 в безводном ДМФА при
динений с потенциальной противовирусной и про-
105-110°C, выявил наличие в образце продуктов
тивоопухолевой активностью [3]. У 9-(2-гидрок-
N3- и N7-алкилирования (3, 4), а также других не-
си-3-феноксипропил)аденина
2 было выявлено
идентифицированных примесей (схема 1). Пре-
противовирусное действие в отношении цитоме-
обладающий N9-изомер 2 был выделен перекри-
галовируса и ВИЧ I [6, 7].
сталлизацией продукта реакции из пропан-2-ола с
Нами изучены особенности алкилирования
выходом 69%. Таким образом, при взаимодействии
аденина 1 фенилглицидиловым эфиром в зависи-
аденина 1 с фенилглицидиловым эфиром в ука-
мости от природы растворителя при получении
занных условиях, как и при его взаимодействии с
экспериментального противовирусного соеди-
окисью пропилена в щелочной среде [8], протека-
1839
1840
НЕПОРОЖНЕВА и др.
Схема 1.
ет параллельное алкилирование всех атомов азота
низкой температуре 166-169°С (169-172°C [6]).
пуриновой системы, кроме атома N1. Избиратель-
УФ спектры поглощения изомеров (Н2О, рН 7)
ный разрыв связи CH2-O эпоксидного кольца по
существенно различаются (табл. 1), их λmax соот-
правилу Красуского подтверждается присутстви-
ветствуют значениям λmax у модельных изомерных
ем в спектрах ЯМР 1Н продуктов алкилирования
N-метилпроизводных аденина, которые обычно
2-4 однопротонного уширенного синглета или ду-
используются для определения положения заме-
блета в области 5.49-5.68 м. д., соответствующего
стителя в пуриновой системе [9, 10].
вторичной гидроксильной группе.
Спектр ЯМР 1Н соединения 3 отличается от
Для выяснения влияния растворителя на соот-
спектров ЯМР 1Н соединений 2, 4 с ненарушенной
ношение образующихся изомерных соединений
ароматичностью пуриновой системы положением
2-4 нами изучено взаимодействие аденина с фе-
сигналов протонов при атомах C2 и С8: у соедине-
нилглицидиловым эфиром в уксусной кислоте, так
ния 3 они находятся при 8.25 и 7.77 м. д. соответ-
как при проведении реакции в протонном раство-
ственно, а у соединений 2 и 4 - при 8.08 и 7.99 м. д.
рителе направление конкурентного N-алкилиро-
В спектре ЯМР 13С соединения 3 по сравнению со
вания аденина может измениться [9]. При взаимо-
спектром соединения 2 сигнал С8 незначительно
действии аденина 1 и фенилглицидилового эфира,
смещен в слабое поле (144.70 против 142.07 м. д.)
взятых в эквимольном соотношении, в уксусной
(табл. 1). Спектры ЯМР 1Н и 13С образцов соедине-
кислоте при 110°С за 5 ч происходит полная кон-
ния 2, полученных как в ДМФА, так и в уксусной
версия аденина (данные ТСХ). При охлаждении
кислоте, совпадают со спектрами образца этого
реакционной массы кристаллизуется смесь N9-,
соединения, полученного из силилзамещенного
N3- и N7-изомеров (2-гидрокси-3-феноксипропил)-
аденина [11, 12]. Спектр ЯМР 13С соединения 4
аденина 2-4 (по данным ТСХ и ЯМР 1Н). Перекри-
записать не удалось из-за малого количества кон-
сталлизацией смеси из диоксана удалось выделить
диционного материала.
с 19%-ным выходом индивидуальный относитель-
Таким образом, при алкилировании аденина 1
но трудно растворимый N3-изомер 3. Остаток по-
фенилглицидиловым эфиром в уксусной кислоте
сле выпаривания диоксанового маточного раство-
удалось выделить с количественным выходом не
ра подвергли дробной кристаллизации сначала из
этилацетата, затем из пропан-2-ола и получили в
только известный
9-(2-гидрокси-3-феноксипро-
индивидуальном виде N9-изомер 2 с выходом 15%,
пил)аденин 2, но и его ранее не описанные N3- и
а также небольшое количество (~5%) индивиду-
N7-изомеры 3 и 4.
ального N7-изомера 4, растворимого в пропан-2-оле.
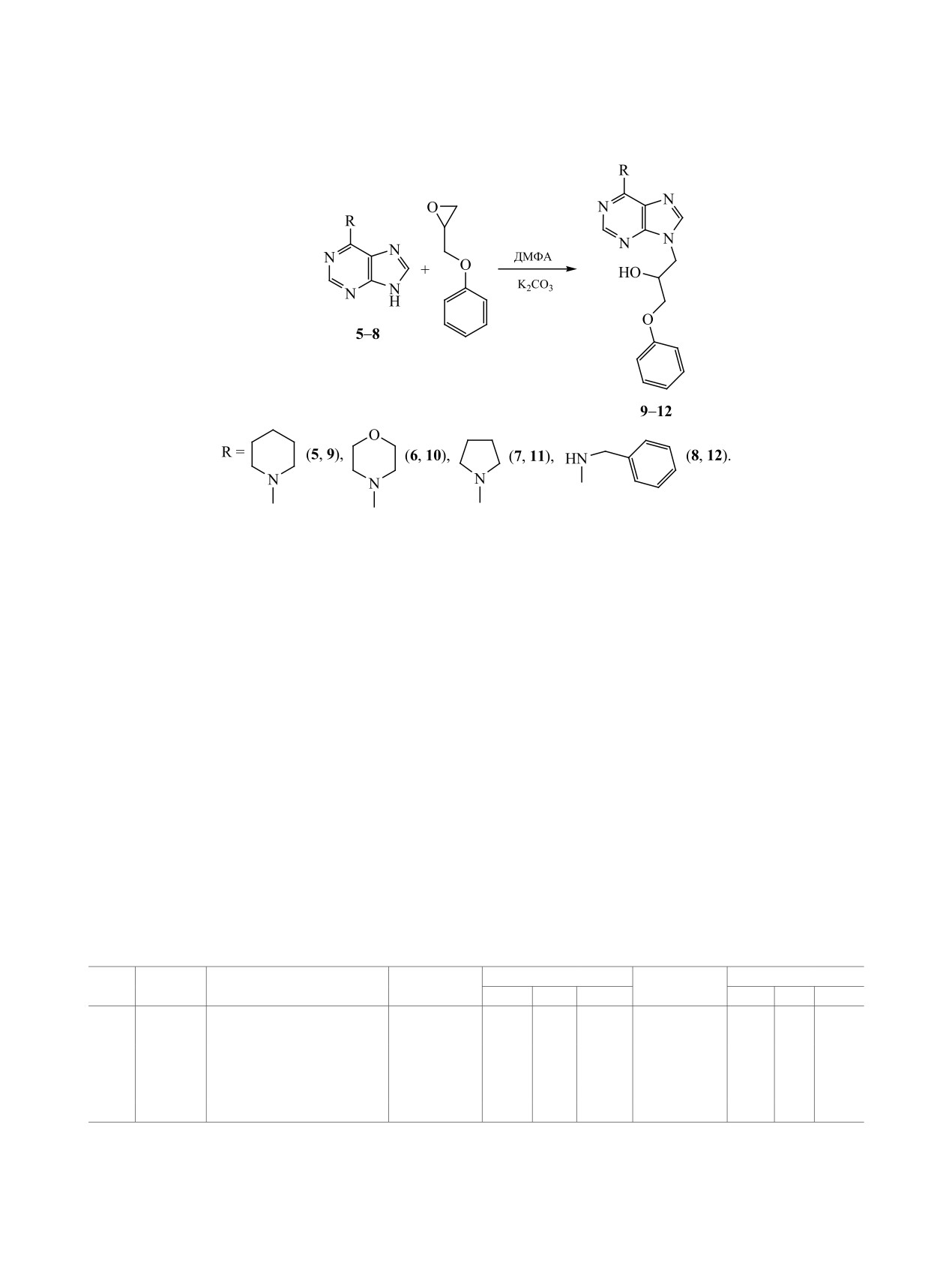
Алкилированием
6-R(R2)-аминопуринов
5-8
Из вновь полученных соединений N7-изомер
фенилглицидиловым эфиром (1:1) по методу [6]
4 имеет более высокую температуру плавления
(безводный ДМФА, K2CO3) получен ряд замещен-
(262°С), чем N3-изомер 3 (255°С), тогда как из-
ных по экзоциклическому азоту аналогов 9-(2-ги-
вестный N9-изомер 2 плавится при гораздо более
дрокси-3-феноксипропил)аденина
2
-
6-R(R2)-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 12 2020
ВЗАИМОДЕЙСТВИЕ АДЕНИНА И ЕГО ЗАМЕЩЕННЫХ
1841
Таблица 1. Спектральные характеристики 9-, 3-, 7-(2-гидрокси-3-феноксипропил)аденинов 2-4 и 6-R(R2)-амино-9-
(2-гидрокси-3-феноксипропил)пуринов 9-12
№
λmax, нм (lgɛ),
δH (ДМСО-d6), м. д.
δC (ДМСО-d6), м. д.
2
262 (4.15), Н2О
4.23-4.64 м (3H, OCH2CHO), 3.99-4.00 м
46.88 (N9CH2), 66.62 (CH2OPh), 70.37
(2H, N9CH2), 5.49 уш. с (1Н, OH), 6.9-7.26
(CНOH),
114.95
(2Со,
119.45 (C5),
м (5НAr), 7.05 с (2H, NH2), 7.99 c (1H,
121.19 (Сп), 129.95 (2См), 142.07 (C8),
C8H), 8.08 c (1H, C2H)
150.17 (C4), 152.76 (C2), 156.40 (C6),
158.81 (Си)
3
275 (4.14), Н2О
3.99-4.03 м (2H, N3CH2), 4.24-4.64 м (3H,
53.21 (N3CH2), 66.57 (CH2OPh), 70.50
OCH2CHO), 5.68 д (1Н, OH, J = 4.0 Гц),
(CНOH),
114.99
(2Со), 120.88 (C5),
7.24-7.28 м (5HAr), 7.77 c (1H, C8H), 7.99 с
121.26 (Сп), 129.99 (2См), 144.7 (C8),
(2H, NH2), 8.25 c (1H, C2H)
150.26 (C4), 152.69 (C2), 155.55 (C6),
158.86 (Си)
4
270 (4.14), Н2О
4.20-4.64 м (3H, OCH2CHO), 3.80-3.99 м
(2H, N7CH2), 5.49 уш. с (1Н, OH), 6.9-7.26
м (5НAr), 7.01 с (2H, NH2), 7.99 c (1H,
C8H), 8.08 c (1H, C2H)
9
278 (4.56), CH3OH
1.61-1.71 м (6Н, 2CβH2, CγH2), 3.91-3.99
24.57 (Cγ), 26.16 (2Cβ), 46.48 (N9CH2),
м (2H, N9CH2), 4.16-4.27 м (4H, 2CαH2),
53.07
(2Cα), 67.55 (CH2OPh),
70.38
4.36-4.63 м (3Н, OCH2CH,), 5.49 д (1H,
(CHOH),
114.95
(2Со), 119.29 (C5),
OH, J = 4.4 Гц), 6.88-7.27 м (5HAr), 8.01 с
121.18 (Сп), 129.93 (2См), 140.88 (C8),
(1Н, С8Н), 8.13 с (1Н, С2Н)
150.73 (C4), 151.6 (C2), 153.56 (C6),
158.86 (Си)
10
278 (4.45 ), CH3OH
3.42-3.44 м (2H, N9CH2), 3.70-3.76 м (4H,
44.66 (N9CH2),
46.89
(2CαH2),
66.75
2CαH2), 3.91-3.99 м (3Н, OCH2CHO),
(CH2OPh),
67.52
(2CβH2),
71.84
4.21-4.43 м (4H, 2CβH2), 5.63 уш. c (1H,
(CHOH),
114.95
(2Со), 119.47 (C5),
OH), 6.88-7.27 м (5HAr), 8.06 с (1Н, С8Н),
121.18 (Сп), 129.82 (2См), 141.43 (C8),
8.17 с (1Н, С2Н)
151.33 (C4), 152.08 (C2), 153.65 (C6),
158.86 (Си)
11
268 (4.43), CH3OH
1.96-2.04 м (4Н, 2CβH2), 3.64-3.73 м (2H,
24.26
(2CβH2), 46.78 (N9CH2),
53.03
N9CH2), 3.90-4.06 м (3Н, OCH2CHO),
(2CαH2),
67.61
(CH2OPh),
70.35
4.17-4.40 м (4H, 2CαH2), 5.60 уш. c (1H,
(CHOH),
114.96
(2Со), 119.71 (C5),
OH), 6.88-7.26 м (5HAr), 7.96 с (1Н, С8Н),
121.20 (Сп), 129.94 (2См), 141.32 (C8),
8.11 с (1Н, С2Н)
150.11 (C4), 150.58 (C2), 152.50 (C6),
158.87 (Си)
12
277 (4.61 ), CH3OH
3.94 м (2H, N9CH2), 4.19-4.41 м (3H,
42.7 (NHCH2), 46.95 (N9CH2),
67.62
OCH2CHO), 4.71 с (2Н, СН2NH), 5.49 уш.
(CH2OPh),
70.39 (CНOH),
114.96
c (1H, OH), 6.88-7.35 м (10HAr), 8.01 с
(2СоPh),
119.45 (C5),
121.19 (СпPh),
(1Н, С8Н), 8.14 с (1Н, С2Н)
127.02 (СпBn), 127.61 (2СоBn),
128.63
(2СмBn), 129.94 (2СмPh), 140.71 (CиBn),
142.07 (C8), 149.63 (C4), 152.73 (C2),
154.85 (C6), 158.86 (СиPh)
амино-9-(2-гидрокси-3-феноксипропил)пурины
Продолжительность реакции изменялась в зави-
9-12 (схема 2, табл. 2).
симости от заместителя в положении 6 пуриновой
Соединения 9-12 образовывались в виде осад-
системы: 1 ч для морфолинового (10), 2 ч - для
ка или осаждались из соответствующего раство-
пиперидинового (9) и бензиламинового (12), 6 ч -
рителя, которым обрабатывали остаток реакцион-
для пирролидинового производного (11). Стро-
ной массы после отделения соли фильтрованием и
ение соединений 9-12 подтверждено данными
отгонки ДМФА, при этом минорные N7-изомеры,
ЯМР 1Н и 13С, в которых помимо набора сигналов
по данным ТСХ, оставались в маточном растворе.
алкильного фрагмента в положении 9 присутство-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 12 2020
1842
НЕПОРОЖНЕВА и др.
Схема 2.
вал набор сигналов, относящихся к заместителю в
мина, а при получении соединения 8 использовали
положении 6.
в качестве растворителя воду (схема 3).
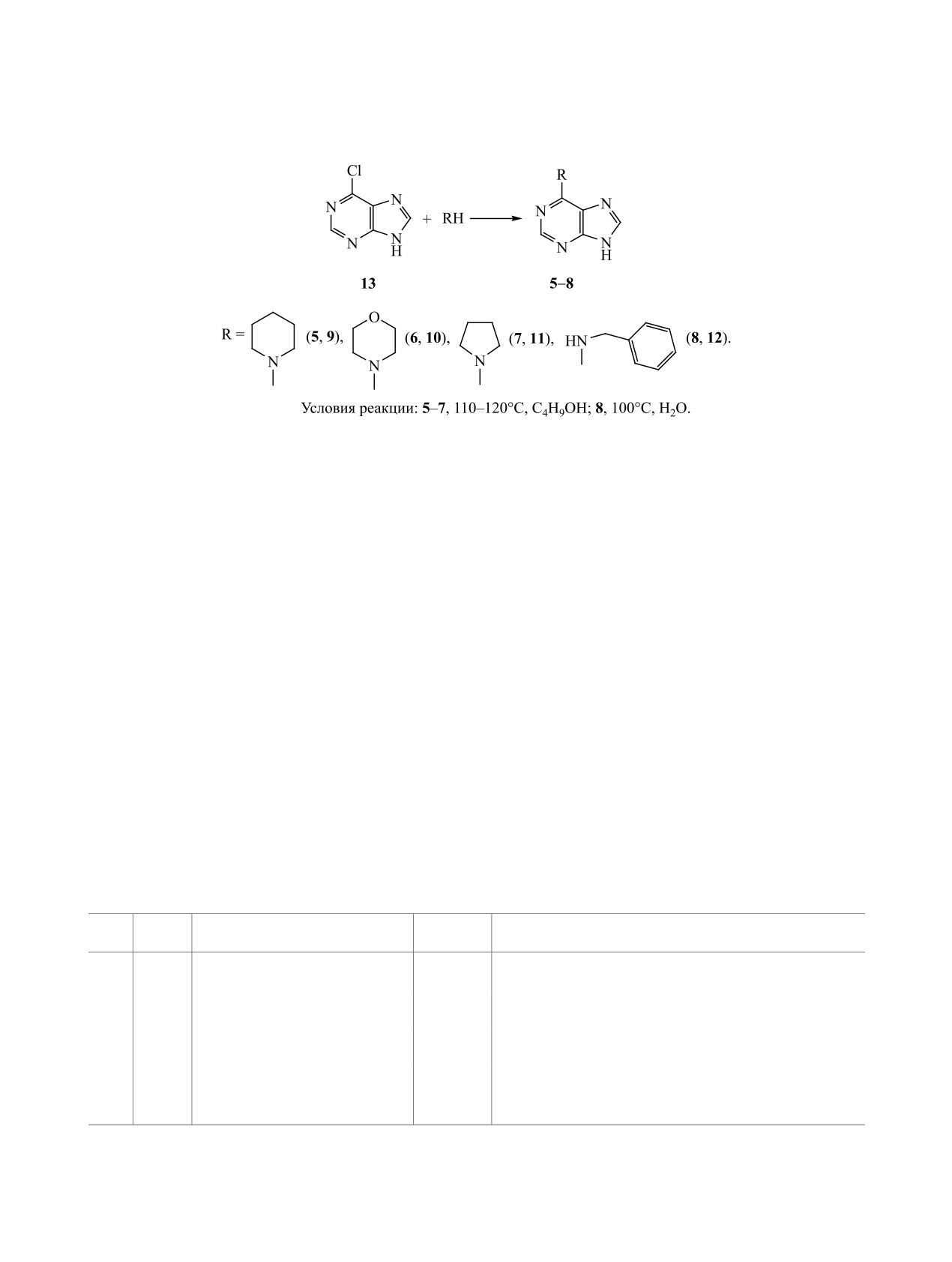
Получение большинства 6-замещенных пури-
По данным ТСХ, при взаимодействии 6-хлор-
нов 5-8, основанное на взаимодействии 6-хлор-
пурина 13 с бензиламином (соотношение реаген-
пурина 13 с соответствующим амином, довольно
тов 1:2-2.5) полное замещение хлора на бензила-
трудоемко и имеет другие недостатки: необходимо
миногруппу при кипячении в метилцеллозольве
очищать продукт реакции на силикагеле [13], для
и бутан-1-оле происходит примерно с одинаковой
проведения реакции необходимы инертная атмос-
скоростью (за 2 ч). При использовании метилцел-
фера [14], микроволновая активация [15], высокая
лозольва получалось сильно окрашенное соедине-
температура (200-210°C ) [16] либо большой из-
ние 8, значительная часть которого оставалась в
быток амина [17]; в качестве растворителя исполь-
растворе, поэтому для полноты выделения нужно
зуется токсичный ацетонитрил [18].
было выпаривать растворитель, а затем дважды
Мы получали исходные соединения 5-8 из
перекристаллизовывать остаток из спирта с углем
6-хлорпурина 13 и соответствующего азотистого
для достижения необходимой чистоты соединения
основания, взяв за основу описанный [17, 19-22]
8, выход которого составил 70%. В бутан-1-оле по-
метод синтеза в бутан-1-оле в присутствии триэ-
лучался более чистый продукт реакции, который
тиламина. В модифицированном варианте синтеза
кристаллизовался непосредственно из реакцион-
выделяющийся HCl связывали избытком исходно-
ной массы с выходом ~80%. Наилучшие резуль-
го основания, обходясь без добавления триэтила-
таты были достигнуты при проведении реакции в
Таблица 2. Условия синтеза и свойства соединений 9-12
Выход,
Время
Найдено, %
Вычислено, %
№
Т. пл., °С
Формула
%
выдержки, ч
С
Н
N
С
Н
N
9
52
99 разл. (CH2Cl2-
2
64.40
6.63
19.95
C19H23N5O2
64.57
6.56
19.82
петролейный эфир)
10
85
84-86 разл. (CH2Cl2-
1
60.66
6.02
19.83
C18H21N5O2
60.83
5.96
19.71
петролейный эфир)
11
63
135-137 разл. (CH2Cl2)
6
63.54
6.35
20.81
C18H21N5O2
63.70
6.24
20.64
12
47
145-147 разл. (i-PrOH)
2
67.03
5.73
18.69
C21H21N5O2
67.18
5.64
18.65
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 12 2020
ВЗАИМОДЕЙСТВИЕ АДЕНИНА И ЕГО ЗАМЕЩЕННЫХ
1843
Схема 3.
воде, полная конверсия исходного хлорпурина 13
Для получения исходного хлорпурина 13 мы
происходила за 45 мин, и соединение 8 в чистом
использовали способ [23], позволяющий синте-
виде кристаллизовалось из реакционной массы с
зировать это соединение с высоким выходом при
выходом 90%.
взаимодействии гипоксантина с хлорокисью фос-
С учетом легкости выделения продукта ами-
фора при атмосферном давлении в присутствии
нолиза из реакционной массы, обусловленной его
диалкиланилинов (оптимальное соотношение ги-
растворимостью в используемом растворителе,
поксантин-хлорокись фосфора-диметил- или диэ-
для аминопуринов 5-7 при двукратном избытке
тиланилин 1:4.1:2.75, продолжительность реакции
вторичного амина наиболее подходящей средой
не более 10-15 мин - для предотвращения обра-
из трех растворителей (метилцеллозольв, бутан-
зования побочных соединений). 6-Хлорпурин 13
1-ол, вода) оказался бутан-1-ол. Соединения 5-7
выделяли без отгонки хлорокиси фосфора, после-
кристаллизовались непосредственно из реакцион-
довательно обрабатывая реакционную массу спир-
ной массы практически в чистом виде с выходами
том, водой, 25%-ным раствором аммиака (до pH =
60-80% после кипячения при 120-125°С в течение
10-10.5 с количественной регенерацией диалкила-
0.5 (5), 1.5 (7) или 3.5 ч (6).
нилина) и соляной кислотой (до pH = 1-1.5).
Модернизированный нами метод получения
Таким образом, при взаимодействии аденина с
6-R(R2)-аминопуринов 5-8 отличается бóльшим
фенилглицидиловым эфиром в ДМФА наряду с ос-
выходом, меньшим временем проведения реакции,
новным продуктом алкилирования по положению
не требует добавления к реакционной смеси три-
9 - 9-(2-гидрокси-3-феноксипропил)аденином
2
этиламина, а при получении бензилпроизводного
образуются изомерные продукты N3- и N7-алки-
8 используется экологичный растворитель - вода
лирования 3 и 4. При проведении алкилирования
(табл. 3).
в уксусной кислоте удалось выделить в индивиду-
Таблица 3. Условия синтеза и свойства 6-R(R2)-аминопуринов 5-8
Выход,
№
Т. пл., °С
Время, ч
δН, м. д.
%
5
94
274-275 (MeOH) (277-278°C
0.50
1.62-1.70 м (6Н, 2CβH2, CγH2), 4.16 м (4H, 2CαH2), 7.86 с
[24])
(1Н, С8Н), 8.11 с (1Н, С2Н), 12.81 уш. с (1Н, N9H)
6
91
302-304 (EtOH) (300°C [18])
3.50
3.70-3.73 м (4H, 2CαH2), 4.20 м (4H, 2CβH2), 7.89 с (1Н,
С8Н), 8.16 с (1Н, С2Н), 12.86 уш. с (1Н, N9H)
7
90
299-301, разл. (MeOH)
1.50
1.98 м (4Н, 2CβH2), 3.85 м (4H, 2CαH2), 7.84 с (1Н, С8Н),
(297-300°C [25])
8.13 с (1Н, С2Н), 12.69 уш. с (1Н, N9H)
8
92
235-236 (236°C [18])
0.75
4.71 с (2Н, CH2NH), 7.17-7.35 м (5НAr), 7.96 с (1H,
C8H), 8.04 уш. с (1Н, CH2NH), 8.10 с (1Н, С2Н), 12.83
уш. с (1Н, N9H)
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 12 2020
1844
НЕПОРОЖНЕВА и др.
альном виде 3-(2-гидрокси-3-феноксипропил)аде-
этилацетатом, нагревали до кипения и оставляли
нин 3 и 7-(2-гидрокси-3-феноксипропил)аденин
на ночь. Осадок отфильтровывали, промывали
4, которые могут быть использованы для иденти-
этилацетатом, затем диэтиловым эфиром и су-
фикации примесей в экспериментальном лекар-
шили на воздухе до постоянной массы. К высу-
ственном препарате 2, а также могут оказаться
шенному осадку добавляли 20 мл диоксана, до-
потенциальными противовирусными агентами.
водили до кипения и фильтровали полученную
Алкилированием 6-R(R2)-аминопуринов 5-8 фе-
суспензию в горячем виде. Получили 0.54 г (19%)
нилглицидиловым эфиром в ДМФА получены
xроматографически однородного 1-(6-амино-3Н-
6-R(R2)-амино-9-(2-гидрокси-3-феноксипропил)
пурин-3-ил)-3-феноксипропан-2-ола
[3-(2-ги-
пурины 9-12, которые могут расширить арсенал
дрокси-3-феноксипропил)аденинa] (3). Rf 0.82,
противовирусных производных аденина.
т. пл. 255°С. Найдено, %: С 58.39; Н 5.43; N 24.69.
C14H15N5O2. Вычислено, %: С 58.94; Н 5.30; N
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
24.55.
Спектры ЯМР 1Н растворов веществ в ДМ-
Диоксановый маточный раствор упаривали,
СО-d6 записывали на спектрометре WM-Bruker с
остаток дважды перекристаллизовывали снача-
рабочей частотой 400 МГц. Электронные спектры
ла из этилацетата, затем из пропан-2-ола. Выход
растворов соединений записывали на спектрофо-
0.42 г (15%), Rf 0.75, т. пл. 166-169°C.
тометре СФ-26 в кварцевых кюветах (толщина
Маточный раствор в изопропиловом спирте
слоя - 1 см, концентрация вещества - 10-4-10-5
пропускали через колонку с силикагелем, упари-
моль/л в воде или в метаноле). Индивидуальность
вали на 2/3, осадок отфильтровывали. Получили
синтезированных соединений установлена с по-
0.14 г
(5%) xроматографически однородного
мощью тонкослойной хроматографии на пласти-
1-(6-амино-7Н-пурин-7-ил)-3-феноксипропан-
нах Sorbfil UV 254, детекция в УФ свете, элюент -
2-ола
[7-(2-гидрокси-3-феноксипропил)аде-
хлороформ-метанол, 5:1, 10:1. Температуры плав-
нинa] (4), Rf 0.42, т. пл. 262°C . Найдено, %: С
ления определяли на приборе для измерения тем-
58.38; Н 5.39; N 24.65. C14H15N5O2. Вычислено, %:
пературы плавления ПТП.
С 58.94; Н 5.30; N 24.55. Спектральные характери-
1-(6-Амино-9Н-пурин-9-ил)-3-феноксипро-
стики соединений 2-4 приведены в табл. 1.
пан-2-ол
[9-(2-гидрокси-3-феноксипропил)аде-
Общая методика синтеза
6-R(R2)-амино-
нин] (2). а. Смесь 1.50 г (11.1 ммоль) аденина и
9-(2-гидрокси-3-феноксипропил)пуринов 9-12.
1.60 г (11.6 ммоль) свежепрокаленного карбоната
К раствору 0.01 моль 6-R(R2)-аминопурина 5-8
калия перемешивали 1 ч при 105-110°С в 40 мл
в 30 мл безводного ДМФА прибавляли 1.38 г
безводного диметилформамида, затем добавляли
(0.01 моль) карбоната калия. Смесь нагревали при
раствор 1.69 г (11.3 ммоль) фенилглицидилового
перемешивании до 105-110°С, затем по каплям
эфира в 10 мл диметилформамида и перемеши-
прибавляли раствор 1.50 г (0.01 моль) фенилгли-
вали при той же температуре 2 ч. Реакционную
цидилового эфира в 10 мл ДМФА, после чего пе-
массу охлаждали, затем фильтровали. Фильтрат
ремешивали 1 ч при 105-110°С для морфолино-
упаривали в вакууме, остаток дважды перекри-
(10), 2 ч для пиперидино- (9) и бензиламино- (12)
сталлизовали из 50 мл пропан-2-ола. Выход 2.18 г
и 6 ч для пирролидинопроизводного (11) (контроль
(69%), белое кристаллическое вещество, Rf 0.66, т.
ТСХ до исчезновения пятна исходного соединения
пл. 163-165°C (т. пл. 169-172°C [6]). Найдено, %:
5-8). После удаления карбоната калия фильтрат
С 58.41; Н 5.41; N 24.70. C14H15N5O2. Вычислено,
упаривали в вакууме, маслообразный остаток рас-
%: С 58.94; Н 5.30; N 24.55.
творяли при кипении в минимальном количестве
б. Растворяли 1.35 г (10 ммоль) аденина в 20 мл
подходящего растворителя (табл. 2). При стоянии
кипящей уксусной кислоты, затем при переме-
раствора соединения 11 и 12 кристаллизовались
шивании в течение 10 мин по каплям прибавляли
при комнатной температуре в течение ночи, а со-
1.51 г (10 ммоль) фенилглицидилового эфира и
единения 9 и 10 осаждали на следующий день пе-
продолжали перемешивание при кипении раство-
тролейным эфиром. Условия синтеза и свойства
рителя 5 ч. Затем растворитель удалили в вакуу-
полученных соединений представлены в табл. 2,
ме, остаток - светло-коричневое масло - заливали
спектральные характеристики - в табл. 1.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 12 2020
ВЗАИМОДЕЙСТВИЕ АДЕНИНА И ЕГО ЗАМЕЩЕННЫХ
1845
6-(Пиримидин-1-ил)пурин
(5),
6-(морфо-
ляли 55-56 мл 25%-ного водного аммиака, доводя
лин-4-ил)пурин (6), 6-(пирролидин-1-ил)пурин
рН до 10-10.5. Смесь переносили в делительную
(7). Смесь 5.00 г (0.03 моль) 6-хлорпурина 13 с
воронку и через 15-20 мин отделяли диметилани-
2-2.5-кратным избытком соответствующего гете-
лин. Возврат диметиланилина почти количествен-
роцикла в 50 мл бутан-1-ола перемешивали при
ный. К охлажденному до 10-15°С водному рас-
кипячении (110-120°С) до полного исчезновения
твору аммонийной соли 6-хлорпурина постепенно
6-хлорпурина (контроль ТСХ). Реакционную мас-
прибавляли 20-21 мл конц. HCl (d = 1.19), доводя
су охлаждали ледяной водой, выпавший осадок
рН раствора до 1-1.5. 6-Хлорпурин кристаллизо-
отфильтровывали, промывали бутан-1-олом и ле-
вался в виде желтого осадка. Смесь выдерживали
дяной водой (до отрицательной реакции на ион
10-12 ч при 0-5°С, осадок (желтые кристаллы)
хлора по Фольгардту), сушили до постоянной мас-
отфильтровывали, отжимали, промывали ледяной
сы и кристаллизовали из 70-80%-ного этилового
водой и сушили на листах фильтровальной бумаги
спирта. Условия синтеза и свойства соединений
до постоянной массы. Выход 14.2 г (92%), т. пл.
5-7 представлены в табл. 3.
300°C (т. пл. >300°C [26]), Rf = 0.43 (элюент - хло-
роформ-этанол, 2:1). Найдено, %: C 38.85; H 1.96;
6-Бензиламинопурин
(8). Смесь
5.00 г
N 36.25. C5H3ClN4. Вычислено, %: C 38.70; H 2.22;
(0.03 моль) 6-хлорпурина 13 и 6.48 г (6.6 мл, 0.06
N 36.05.
моль) бензиламина в 50 мл воды кипятили при пе-
ремешивании до полного исчезновения 6-хлорпу-
ФОНДОВАЯ ПОДДЕРЖКА
рина (контроль ТСХ). Затем реакционную массу
Работа выполнена в рамках программы
охлаждали ледяной водой, выпавшее кристалли-
Министерства науки и высшего образования РФ
ческое вещество отфильтровывали, промывали
(№ 785.00Х60.19).
сначала водой, а затем этанолом (2×3 мл) и сушили
до постоянной массы. Светло-желтые хроматогра-
КОНФЛИКТ ИНТЕРЕСОВ
фически однородные кристаллы, Rf = 0.61. Усло-
Авторы заявляют об отсутствии конфликта
вия синтеза и свойства соединения 8 представле-
интересов.
ны в табл. 3.
СПИСОК ЛИТЕРАТУРЫ
6-Хлорпурин (13) [23]. К 68.7 г (41 мл,
0.45 моль) хлорокиси фосфора приливали в те-
1. Prasse C., Wagner M., Schulz R., Ternes T.A. // Sci.
чение
20-30 мин при перемешивании
34.1 г
Technol. 2011. Vol. 45. P. 2761. doi 10.1021/es103732y
2. Cirelli R., Herne K., McCrary M., Lee P., Tyring S.K. //
(36 мл, 0.28 моль) осушенного диметиланилина
Antiviral Res. 1996. Vol. 29. N 2-3. P.141. doi
при комнатной температуре. К образовавшему-
10.1016/0166-3542(95)00941-8
ся желто-зеленому раствору прибавляли 13.6 г
3. Новиков М.С., Озеров А.А., Брель А.К., Солодуно-
(0.1 моль) сухого порошкообразного гипоксантина.
ва Г.Н., Озерова Т.П. // ХГС. 1996. № 3. С. 380; No-
Смесь нагревали при перемешивании до 70-80°С,
vikov M.S., Ozerov A.A., Brel’ A.K., Solodunova G.N.,
после чего реакционная масса самопроизвольно
Ozerova T.P. // Chem. Heterocycl. Compd. 1996.
нагревалась до 90-95°С, и гипоксантин раство-
Vol. 32. P. 328. doi 10.1007/BF01169253
рялся. Темный раствор кипятили при перемеши-
4. De Clercq E., Descamps J., De Somer P. // Science.
вании 10-15 мин (температура бани 120-125°С).
1978. Vol. 200. N 4341. P. 563. doi 10.1126/
Смесь охлаждали до 10-15°С и затем осторожно
science.200.4341.563
5. Balzarini J., De Clercq E. // J. Biol. Chem. 1991.
при перемешивании в сильном токе азота (отдувка
Vol. 266. N. 14. P. 8686.
HCl) разлагали остаток хлорокиси фосфора, мед-
6. Новиков М.С., Озеров А.А., Брель А.К. // ХГС. 1999.
ленно прибавляя 15 мл этилового спирта, не допу-
№ 1. C. 82; Ozerov A.A., Novikov M.S., Brel’ A.K. //
ская повышения температуры реакционной массы
Chem. Heterocycl. Compd. 1999. Vol. 35. P. 78. doi
выше 30°С. Затем постепенно добавляли 28 мл ле-
10.1007/BF02251667
дяной воды, не допуская повышения температуры
7. Петров В.И., Озеров А.А., Новиков М.С., Покров-
реакционной массы выше 25°С. Смесь перемеши-
ский В.И., Покровский В.В., Де Клерк Э., Бальза-
вали до растворения основной массы выпавшего
рини Я. Пат. 2233842 (2004). Россия.
осадка, после чего при 10-15°С по каплям прибав-
8. Kondo K., Sato S., Takemoto K. // Chem. Lett. 1973.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 12 2020
1846
НЕПОРОЖНЕВА и др.
P. 967.
17. Wang Y.-N., Bheemanaboina R.R.Y., Cai G.-X.,
9.
Lister J.H. The Chemistry of Heterocyclic Compounds.
Zhou C.-H. // Bioorg. Med. Chem. Lett. 2018. Vol. 28.
Fused Pyrimidines London.: Wiley-Interscience, 1971.
N 9. P. 1621. doi 10.1016/j.bmcl.2018.03.046
655 p.
18. Staderini M., Bolognesi M.L., Menndez J.C., Carlos J. //
10.
Преч Э., Бюльманн Ф., Аффольтер К. Определение
Adv. Synth. Catal. 2015. Vol. 357. N 1. P. 185. doi
строения органических соединений. Таблицы спек-
10.1002/adsc.201400674
19. Van De Bittner G., Hooker J.M. Pat. WO 201611394
тральных данных. М.: Мир; БИНОМ. Лаборатория
(2016).
знаний, 2006. 439 с.
20. Caldwell J.J., Davies T.G., Donald A., McHardy T.,
11.
Khalafi-Nezhad A., Divar M., Panahi F. // Tetrahe-
Rowlands M.G., Aherne G.W., Hunter L.K., Taylor K.,
dron Lett. 2013. Vol. 54. N 3. P. 220. doi 10.1016/j.
Ruddle R., Raynaud F.I., Verdonk M., Workman P.,
tetlet.2012.11.003
Garrett M.D., Collins I. // J. Med. Chem. 2008. Vol. 51.
12.
Somayeh B., Mohammad N.S.R., Mohammad A.P. //
N 7. P. 2147. doi 10.1021/jm701437d
Chem. Pap. 2019. doi 10.1007/s11696-019-00863-1
21. Wang X., Han C., Wu K., Luo L., Wang Y., Du X., He Q.,
13.
Chen L., Chen D., Tang L., Ren J., Chen J., Zhen X.,
Ye F. // Eur. J. Med. Chem. 2018. Vol. 149. P. 10. doi
Liu Y.-C., Zhang C., Luo H., Shen J., Xiong B. // Bioorg.
10.1016/j.ejmech.2018.02.018
Med. Chem. 2017. Vol. 25. N 13. P. 3315. doi 10.1016/j.
22. Pat. CN 106632339 (2017) Chinese.
bmc.2017.04.019
23. Студенцов Е.П., Иванов Г.В., Ивин Г.А. А. с. СССР
14.
Murthy B., Siva S., Bhilare S., Chrysochos N., Gayakhe V.,
1089093 (1982).
Trentin I., Schulzke C., Kapdi A.R. // Org. Lett. 2018.
24. Alves M.J., Carvalho M.A., Carvalho S., Dias A.M.,
Vol. 20. N 2. P. 473. doi 10.1021/acs.orglett.7b03854
Fernandes F.H., Proenca M.F. // Eur. J. Org. Chem.
15.
Huang L.-K., Cherng Y.-C., Cheng Y.-R., Jang J.-P.,
2007. N 29. P. 4881. doi 10.1002/ejoc.200700416
Chao Y.-L., Cherng Y.-J. // Tetrahedron. 2007. Vol. 63.
25. Schering AG. Pat. DE 2163873 (1971).
N 24. P. 5323. doi 10.1016/j.tet.2007.02.124
26. LaMontagne M.P., Smith D.C., Wu G.-S. // J. Hete-
16.
Микстайс У.Я., Апене И.Б. А. с. CCCP 2792363/23-
rocycl. Chem. 1983. Vol. 20. P. 295. doi 10.1002/
24 (1983).
jhet.5570200208
Reactions of Adenine and Its N-Exo Substituted Analogues
with Phenyl Glycidyl Ether
O. V. Neporozhneva, E. P. Studentzsov, and S. M. Ramsh*
St. Petersburg State Institute of Technology (Technical University), St. Petersburg, 190013 Russia
*e-mail: sramsh@technolog.edu.ru
Received August 10, 2020; revised August 10, 2020; accepted August 20, 2020
The features of reactions of adenine with phenyl glycidyl ether depending on the nature of the solvent were
studied. In DMF in the presence of K2CO3, an N9-alkyl derivative, an experimental antiviral drug 9-(3-phe-
noxy-2-hydroxypropyl)adenine, wss formed predominantly. During alkylation in acetic acid, N3- and N7-al-
kylation products, that are isomeric to the N9-alkyl derivative were isolated. Alkylation of 6-[alkyl(dialkyl)-
amino]purines with phenyl glycidyl ether in DMF produced N-exo substituted 9-(3-phenoxy-2-hydroxypropyl)-
adenine analogues.
Keywords: adenine, phenyl glycidyl ether, 9-(3-phenoxy-2-hydroxypropyl)adenine, 6-R(R2)-amino-9-(2-hy-
droxy-3-phenoxypropyl)purines
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 12 2020