ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2020, том 90, № 12, с. 1851-1857
УДК 543.645.2:543.429.2:547.548.68
СУПРАМОЛЕКУЛЯРНЫЙ КОМПЛЕКС 3-АЦЕТАТА
20-ГИДРОКСИЭКДИЗОНА С β-ЦИКЛОДЕКСТРИНОМ
И ЕГО БИОЛОГИЧЕСКАЯ АКТИВНОСТЬ
© 2020 г. Б. И. Тулеуовa,*, Б. С. Темиргазиевa,b, А. М. Кожановаa, Р. Б. Сейдахметоваa,
К. М. Турдыбековb, Т. М. Сейлхановc, О. Т. Сейлхановc, П. Драшарd, С. М. Адекеновa
a Международный научно-производственый холдинг «Фитохимия», ул. М. Газалиева 4, Караганда, 100009 Казахстан
b Карагандинский государственный университет имени Е. А. Букетова, Караганда, 100028 Казахстан
c Кокшетауский государственный университет имени Ш. Уалиханова, Кокшетау, 020000 Казахстан
d Университет химии и технологии, Прага, 16628 Чехия
*e-mail: info@phyto.kz
Поступило в Редакцию 18 августа 2020 г.
После доработки 18 августа 2020 г.
Принято к печати 30 августа 2020 г.
С целью получения новых потенциально биоактивных веществ и изучения влияния объемных функци-
ональных групп на образование супрамолекулярных комплексов, синтезирован триацетат 20-гидрокси-
экдизона, исследовано его пространственное строение и методом ЯМР изучено комплексообразование
с β-циклодекстрином. Исследована противовоспалительная активность полученного водорастворимого
комплекса.
Ключевые слова: триацетат 20-гидроксиэкдизона, β-циклодекстрин, супрамолекулярный комплекс,
рентгеноструктурный анализ, спектроскопия ЯМР
DOI: 10.31857/S0044460X20120070
Образование супрамолекулярных комплексов
дена попытка синтеза новых супрамолекулярных
фитоэкдистероидов с циклодекстринами позво-
комплексов на основе вицинально замещенного
ляет получать инкапсулированные лекарственные
полиоксистероида.
формы, способствует стабилизации действующих
Выбор триацетата
20-гидроксиэкдизона
веществ к внешнему воздействию света, тепла,
[2,3,22-ацетокси-14,20,25-гидрокси-5,9(Н)-хо-
кислорода воздуха, а также увеличивает их раство-
лест-7-ен-6-она] 1 (схема 1) в качестве синтона и
римость [1-3]. В связи с этим, применение наибо-
субстрата супрамолекулярной самосборки с β-ци-
лее распространенных α-, β- и γ-циклодекстринов
клодекстрином обусловлен тем, что 20-гидрокси-
для создания новых комплексов включения биоло-
экдизон и его ацильные производные обладают
гически активных соединений, фармацевтических
ранозаживляющим действием, эффективность ко-
препаратов и лекарственных средств является од-
торых значительно повышается при включении в
ним из главных направлений развития супрамоле-
липосомы, и плохо растворимы в воде [9].
кулярной химии [4-6].
С целью получения новых потенциально биоак-
Ранее нами был синтезирован ряд новых цикло-
тивных веществ, определения влияния объемных
декстриновых комплексов
20-гидроксиэкдизона
функциональных групп на процесс образования
и других фитоэкдистероидов [7, 8], но получение
супрамолекулярных комплексов и повышения их
супрамолекулярных водорастворимых комплексов
водорастворимости исследована тонкая структура
на основе их модифицированных производных не
исходного синтона. Методом рентгеноструктурно-
было описано. В настоящей работе впервые прове-
го анализа был исследован триацетат 20-гидрокси-
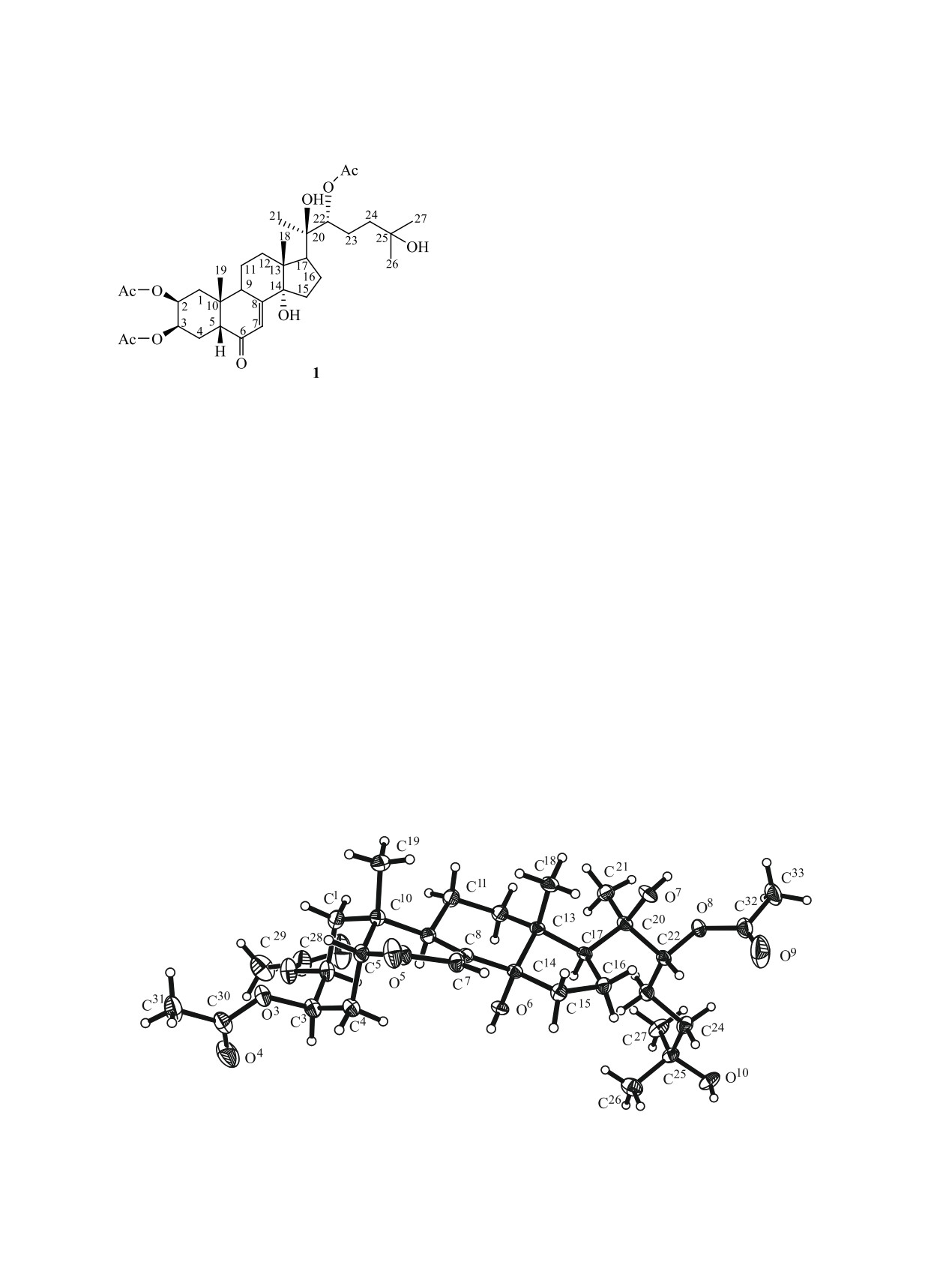
1851
1852
ТУЛЕУОВ и др.
Схема 1.
3.612 Å, тогда как ван-дер-ваальсов радиус ме-
тильной группы равен 2.0 Å [11]. В целом, иска-
жения циклов A-D близки к наблюдаемым в кри-
сталлических структурах 20-гидроксиэкдизона и
его кристаллогидрата [12]. Параметр Флека близок
к нулю [0.05(12)] [13] и на основании этого моле-
куле 1 приписано строение 2β,3β,22R-ацетокси-
14α,20R,25-гидрокси-5β,9α(Н)-холест-7-ен-6-она.
В кристалле молекула соединения 1 и молеку-
лы воды связаны межмолекулярными водородны-
ми связями O7-H (x, y, z)···O5 (1.5-x, 0.5+y, 1-z)
[расстояния O···O 2.896(2) Å, H···O 2.19(3) Å, угол
экдизона в виде кристаллогидрата 2 (1∙2.5 Н2О).
O-H···O 158(3)°], O6-H···O2w (x, y, z) [2.714(3),
Общий вид молекулы триацетата 20-гидроксиэк-
1.95(3) Å, 174(3)°], O10-H···O1w (1.5-x, -0.5+y,
дизона 1 показан на рисунке.
–z) [2.737(3), 1.90(4) Å, 169(3)°], O1w-H···O6 (x, y,
Длины связей и валентные углы в кристаллоги-
z) [2.832(2), 1.95(6) Å, 159(4)°], O1w-H···O4 (1-x,
драте 2 близки к обычным [10]. Конформация цик-
y, -z) [2.847(3), 1.94(5) Å, 176(4)°], O2w-H···O2
ла С1С2С3С4С5С10 (А) близка к идеальному креслу
(x, -1+y, z) [2.785(2), 1.96(3) Å, 161(3)°], O2w-
(минимальный параметр асимметрии ΔС3 = 0.4°,
H···O10 (1.5-x, -0.5+y, -z) [2.737(3), 1.91(5) Å,
172(4)°], O3w-H···O2 (1-x, y, -z) [расстояние O···O
внутрициклические торсионные углы приведены
2.878(3) Å], O3w-H···O3w (1-x, y, -z) [расстояние
в табл. 1). Конформация цикла В, содержащего
O···O 2.839(3) Å], образуя трехмерные сетки.
двойную связь С7=С8, отклоняется от идеального
5α,10β-полукресла в сторону 5α-софы (ΔС8 = 16.0°
Поскольку в супрамолекулярной химии опре-
и ΔС7,8 = 9.3°) вследствие наличия двойной связи
деляющую роль играют размеры и строение вза-
С6=О и сопряжения с двумя 6-членными карбоци-
имодействующих компонентов, для получения су-
клами. Вследствие сочленения с ненасыщенным
прамолекулярных комплексов экдизона 1 выбран
циклом В значительно отклоняется от идеального
β-циклодекстрин. Комплексы получены взаимо-
кресла и конформация цикла С8С9С11С12С13С14 (С)
действием эквимолекулярных количеств триаце-
(ΔС9 = 3.7°). Конформация 5-членного карбоцик-
тата 20-гидроксиэкдизона 1 с циклодекстрином в
ла D - 14α,13β-полукресло (ΔС13,14 = 5.4°), значи-
водно-этанольном растворе при 50°С в течение 8 ч.
тельное искажение которого обусловлено оттал-
Исследование строения супрамолекулярных
киванием метильных групп при атомах С13 и С20.
комплексов методом спектроскопии ЯМР основа-
Расстояние между атомами С18 и С21 составляет
но на изменении химических сдвигов 1Н субстра-
Общий вид молекулы [2,3,22-ацетокси-14,20,25-гидрокси-5,9(Н)-холест-7-ен-6-она] 1.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 12 2020
СУПР
АМОЛЕКУЛЯРНЫЙ КОМПЛЕКС 3-АЦЕТАТА 20-ГИДРОКСИЭКДИЗОНА
1853
Таблица 1. Внутрициклические торсионные углы в кристаллогидрате 2
Угол
τ , град
Угол
τ , град
Цикл А
Цикл C
C10C1C2C3
56.5(2)
C14C8C9C11
–48.8(2)
C1C2C3C4
-52.1(2)
C8C9C11C12
46.5(2)
C2C3C4C5
51.7(2)
C9C11C12C13
-52.0(3)
C3C4C5C10
-56.1 (2)
C11C12C13C14
57.0(2)
C4C5C10C1
56.4(2)
C12C13C14C8
-60.0(2)
C2C1C10C5
-56.6(2)
C9C8C14C13
57.1(2)
Цикл В
Цикл D
C10C5C6C7
-47.9(2)
C17C13C14C15
45.8(2)
C5C6C7C8
15.4(3)
C13C14C15C16
-35.3(2)
C6C7C8C9
5.6(3)
C14C15C16C17
10.5(2)
C7C8C9C10
6.6(3)
C15C16C17C13
17.6(2)
C8C9C10C5
-38.1(2)
C14C13C17C16
-38.0(2)
C6C5C10C9
58.3(2)
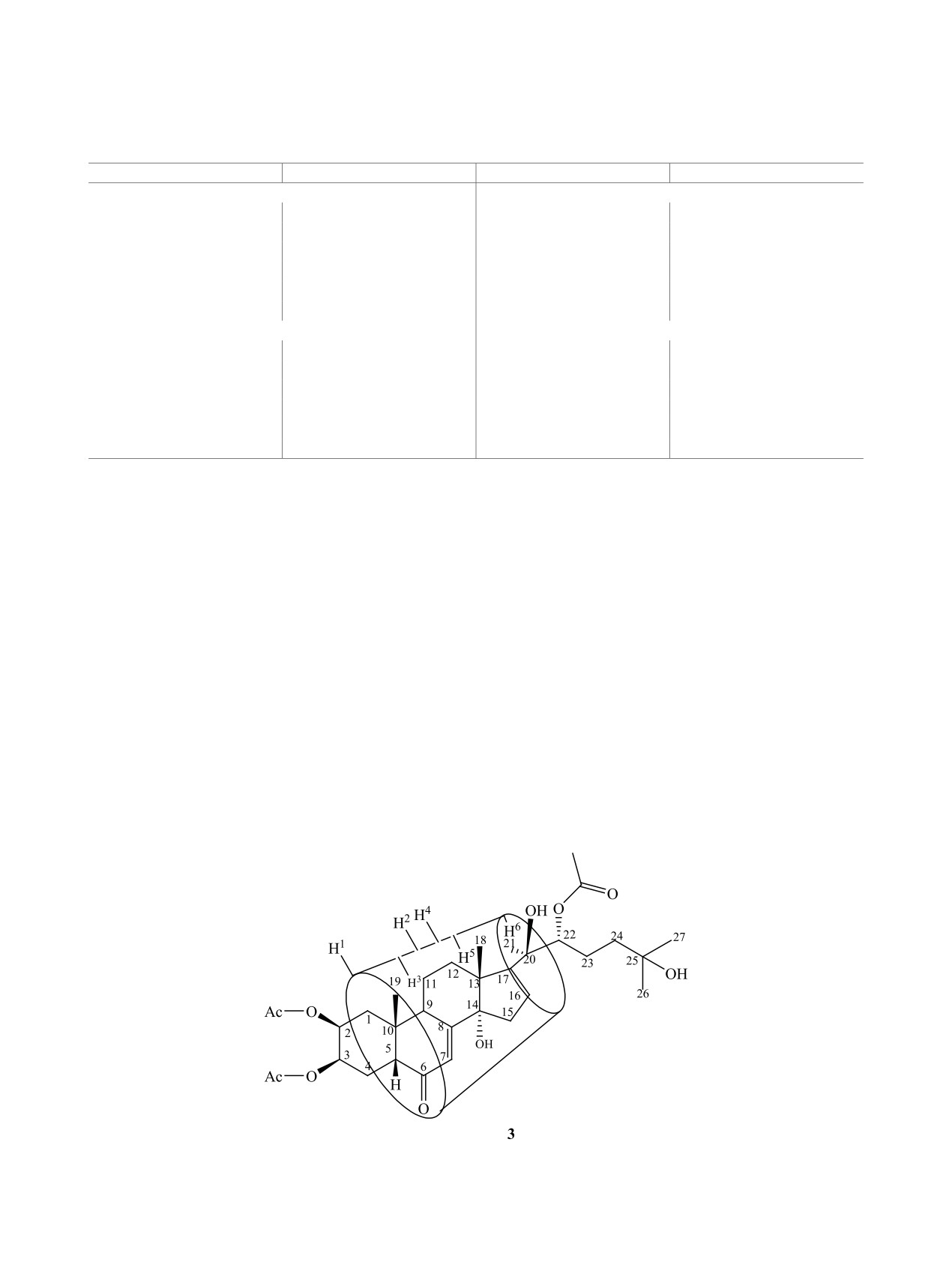
та 1 и β-циклодекстрина в свободном состоянии
ческих сдвигов протонов глюкопиранозного зве-
и в составе комплекса. По величине изменения
на претерпевают внутренние протоны Н-3 и Н-5,
химических сдвигов внутренних или внешних
входящие во внутреннюю часть усеченного ци-
протонов циклодекстрина можно выявить образо-
клодекстринового конуса (схема 3). Это позволяет
вание, соответственно, внутренних, внешних или
сделать вывод о вхождении молекулы субстрата
смешанных комплексов. Изменение химических
1 во внутреннюю полость β-циклодекстринами с
сдвигов 1Н и 13С в спектрах субстрата позволяет
образованием комплекса включения 3 (схема 2).
определить направление вхождения последнего в
Комплекс 3 сравнительно хорошо растворим в
полость циклодекстрина [14-16].
воде. Соотношение интегральных интенсивностей
сигналов протонов субстрата 1 и β-циклодекстри-
Строение соединения 1 установлено методом
на в комплексах показало, что на одну молекулу
спектроскопии ЯМР 1Н и 13С в растворе ДМСО-d6
субстрата 1 приходится одна молекула β-цикло-
(табл. 2). Отнесение сигналов в одномерных спек-
декстрина.
тров ЯМР 1Н и 13С подтверждено данными дву-
мерных корреляций 1Н-1Н COSY, 1Н-1Н ROESY,
Результаты биоскрининга по изучению про-
1Н-13C HMQC и 1Н-13C HMВC (табл. 2). Как видно
тивовоспалительной активности триацетата
из данных табл. 2, наибольшее изменение хими-
20-гидроксиэкдизона 1 и его комплекса с β-ци-
Схема 2.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 12 2020
1854
ТУЛЕУОВ и др.
Таблица 2. Химические сдвиги ядер 1Н и 13С субстрата 1 и β-циклодекстрина в свободном состоянии (δ0) и в составе
комплекса 3 (δ)
δ0, м. д.
δ, м. д.
∆δ = δ - δ0
№ атома
Группа
1Н
13С
1Н
13С
1Н
13С
Субстрат 1
1ax1eq
CН2
1.65-1.70 м
37.19
1.65-1.70 м
0.00
2.11-2.22 м
2.11-2.20 м
2
СН
4.95 д, 3J = 12.0 Гц
68.75
4.94 д
-0.01
3
СН
5.17 уш. с
67.34
5.16
-0.01
4ax4eq
CH2
1.65-1.70 м
31.41
1.65-1.70 м
0.00
1.90-1.93 м
1.90-1.92 м
-0.01
5
СН
2.11-2.22 м
51.10
2.11-2.20 м
0.02
6
>C=O
-
201.32
-
7
CH
5.65 с
121.07
5.66
0.01
8
>C<
-
165.83
-
9
CH
3.02-3.08 м
34.09
3.02-3.08 м
0.00
10
>C<
-
38.24
11ax11eq
CН2
1.65-1.70 м
21.37
1.65-1.70 м
0.00
1.78-1.81 м
1.76-1.82 м
0.01
12ax12eq
CН2
1.90-1.93 м
30.81
1.90-1.92 м
-0.01
2.44-2.48 м
2.44-2.48 м
0.00
13
>C<
-
47.34
-
14
>C<
-
83.51
-
15ax15eq
CН2
1.91 с
33.52
1.90 с
-0.01
2.11-2.22
2.11-2.20
-0.02
16ax16eq
CН2
2.11-2.22 м
21.70
2.11-2.20
-0.02
2.44-2.48
2.44-2.48
0.00
17
СН
3.02-3.08
49.58
3.02-3.08
0.00
18
-СН3
0.88 с
23.90
0.88 с
0.00
19
-СН3
0.73 с
17.68
0.72 с
-0.01
20
>C<
-
79.11
-
21
-СН3
1.13 с
23.91
1.12 с
-0.01
22
СН
4.63 д, 3J = 10.0 Гц
81.86
4.63 д
0.00
23ax23eq
CН2
1.78-1.81 м
26.54
1.76-1.82 м
0.01
2.11-2.22 м
2.11-2.20 м
-0.02
24ax24eq
CН2
1.78-1.81 м
40.63
1.76-1.82 м
0.01
2.11-2.22 м
2.11-2.20 м
-0.02
25
>C<
-
75.24
-
26
-СН3
1.28 с
26.29
1.27 с
-0.01
27
-СН3
1.33 с
29.09
1.32 с
-0.01
2
-ООС-СН3
1.88 с
170.31
1.87 с
-0.01
3
-ООС-СН3
1.98 с
170.18
1.97 с
-0.01
22
-ООС-СН3
2.05 с
172.92
2.04 с
-0.01
β-Циклодекстрин
1
CH
4.77 д, 3J = 4.0 Гц
102.40
4.78 д
102.45
0.01
0.05
2
CH
3.26 д, 3J = 12.1 Гц
72.83
3.26 д
72.92
0.00
0.09
3
CH
3.58 т, 3J = 8.3 Гц
73.54
3.60 т
73.56
0.02
0.02
4
CH
3.28 т, 3J = 10.0 Гц
81.98
3.28 т
82.03
0.00
0.05
5
CH
3.50 с
72.50
3.53 с
72.55
0.03
0.05
6
CH2
3.58 с
60.42
3.59 с
60.42
0.01
0.00
клодекстрином 3 показали, что комплекс в дозе
триацетат 20-гидроксиэкдизона в данной дозе об-
25 мг/кг обладает противовоспалительной актив-
ладает слабой противовоспалительной активно-
ностью на модели острой экссудативной реакции
стью.
и по активности сопоставим с препаратом срав-
Таким образом, получен триацетат 20-гидрок-
нения Диклофенаком натрия, тогда как исходный
сиэкдизона, структура которого подтверждена ме-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 12 2020
СУПР
АМОЛЕКУЛЯРНЫЙ КОМПЛЕКС 3-АЦЕТАТА 20-ГИДРОКСИЭКДИЗОНА
1855
тодами рентгеноструктурного и ЯМР-спектроско-
и -0.337 е/Å3. Структура расшифрована и уточне-
пического анализов. Супракомплекс триацетата
на по программам SIR-97 [19] и SHELXL-2018/3
20-гидроксиэкдизона с β-циклодекстрином пока-
[20] соответственно. Структурные данные депони-
зал противовоспалительную активность.
рованы в Кембриджском центре кристаллострук-
турных данных (CCDC 1919742).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Комплекс 3. Комплекс получен взаимодей-
В работе использовали β-циклодекстрин (99%)
ствием эквимолекулярных количеств соедине-
производства фирмы «Fluka».
ния 1 с β-циклодекстрином. К раствору 0.050 г
Спектры ЯМР 1Н и 13С записаны на спектро-
(0.83 ммоль) 1 в 3 мл абс. этанола добавляли рас-
метре Jeol JNM-ECA 400 (399.78 и 100.53 МГц на
твор 0.094 г (0.83 ммоль) β-циклодекстрина в
ядрах 1Н и 13С соответственно) в растворе ДМСО-
4 мл дистиллированной воды, смесь перемешива-
d6 при комнатной температуре. Химические сдви-
ли при 50°Св течение 8 ч. Осадок отфильтровы-
ги измерены относительно остаточных сигналов
вали, промывали этанолом и сушили в вакуум-
протонов или атомов углерода растворителя.
ном шкафу при 40°С. Белый порошок, т. пл. 267°
Рентгеноструктурный анализ. Параметры
(разл.). ИК спектр (KВr), v, см-1: 579, 609, 707, 757,
ячейки и интенсивности 55472 отражений (8130
858, 947, 1029, 1081, 1157, 1254, 1216, 1254, 1336,
независимых, Rint = 0.0363) измерены на дифрак-
1371, 1426, 1660 (C=O), 1742, 2928, 3445 (OH), УФ
тометре Bruker Kappa APEX2 CCD (MoKα, гра-
спектр, λmax: 245 нм.
фитовый монохроматор, φ,ω-сканирование, 2.33
Исследование противовоспалительной ак-
≤ θ ≤ 27.48°) при температуре 180 K. Кристал-
тивности. Эксперименты выполнены на 32 белых
лы моноклинные, a = 31.052(6), b = 7.995(2), c =
беспородных крысах обоего пола, массой 250-
15.196(3) Å, β = 110.55(3)°, V = 3533(1) Å3, Z = 4
320 г. Противовоспалительное действие изучали
(C33H50O10·2.5H2O), пространственная группа C2,
на модели острой экссудативной реакции воспале-
dвыч = 1.242 г/см3, μ = 0.095 мм-1. Обработку исход-
ния (перитонит). Антиэкссудативную активность
ного массива измеренных интенсивностей и учет
оценивали по объему экссудата, образовавшегося
поглощения проводили по программам SAINT
в брюшной полости. Острую экссудативную ре-
[17] и SADABS [18], включенных в программный
акцию (перитонит) вызывали внутрибрюшинным
пакет APEX2.
введением 1%-ного раствора АсОН в объеме 1 мл
Структура расшифрована прямым методом.
на 100 г массы тела крыс. Исследование прово-
Позиции неводородных атомов уточнены в ани-
дили по методике [21]. Исследуемые объекты из-
зотропном приближении полноматричным МНК.
учали в дозе 25 мг/кг при пероральном введении
Атомы водородов гидроксильных групп и двух
в виде крахмальной слизи. Препарат сравнения
кристаллогидратных молекул воды (O1w и O2w)
(диклофенак натрия) изучали в дозе 25 мг/кг. Кон-
выявлены из разностного синтеза и их позиции
трольные животные получали эквиобъемное коли-
уточнены в изотропном приближении. Атомы во-
чество крахмальной слизи. Исследуемые объекты
дорода третьей молекулы воды (O3w) выявить не
вводили однократно за 1 ч до введения 1%-ного
удалось из-за того, что ее заселенность составляет
раствора АсОН.
1/2 молекулы на элементарную ячейку. Осталь-
ные атомы водорода помещали в геометрически
Статистическую обработку результатов прово-
рассчитанные положения и их позиции уточняли
дили с использованием пакета программ Statistica
в изотропном приближении с фиксированными
6.0. Межгрупповые отличия оценивали непараме-
позиционными и тепловыми параметрами (модель
трическим U-критерием Манна-Уитни. Достовер-
наездника). В расчетах использовано 7591 отра-
ными считались различия при достигнутом уровне
жение с I ≥ 2σ(I), число уточняемых параметров
значимости p < 0.05. Животные были разделены
451. Окончательные факторы расходимости: R1 =
на 4 группы с массой тела: группа «Контроль»
0.0476, WR2 = 0.1010 (по отражениям с I ≥ 2σ(I),
(n = 8) - 293.0±15.4; группа «Диклофенак натрия»
R1 = 0.0414, WR2 = 0.1032 (по всем отражениям),
(n = 8) - 319.5±25.9; группа «1» (n = 8) - 275.3±17.7;
GooF 1.046. Пики остаточной плотности: Δρ = 0.667
группа «3» (n = 8) - 263.8±12.9.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 12 2020
1856
ТУЛЕУОВ и др.
В результате проведенного эксперимента пока-
8.
Темиргазиев Б.С., Тулеуов Б.И., Романова М.А.,
зано, что образец 3 в дозе 25 мг/кг обладает проти-
Сейдахметова Р.Б., Сейлханов Т.М., Сейлханов
О.Т., Салькеева Л.К., Адекенов С.М. // ЖОХ. 2019.
вовоспалительной активностью на модели острой
Т. 89. Вып. 3. С. 394; Temirgaziev B.S., Tuleuov B.I.,
экссудативной реакций (количество экссудата
Romanova M.A., Seidakhmetova R.B., Seilkhanov T.M.,
4.9±0.5 мл) и по активности сопоставим с препара-
Seilkhanov O.T., Salkeeva L.K., Adekenov S.M. // Russ.
том сравнения Диклофенаком натрия (количество
J. Gen. Chem. 2019. Vol. 89. N 3. P. 394. doi 10.1134/
экссудата 4.4±0.7 мл). Образец 1 в дозе 25 мг/кг
S1070363219030095
обладает слабой противовоспалительной актив-
9.
Политова Н.К., Ковлер Л.А., Володин В.В., Лукша В.Г.,
ностью на модели острой экссудативной реакций
Пшунетлева Е.А. // Хим. раст. сырья. 2001. № 2.
(количество экссудата 6.5±1.2 мл)
С. 69.
Работа выполнена с соблюдением всех приме-
10.
Allen F.H., Kennard O., Watson D.G., Brammer L.,
нимых международных, национальных и институ-
Orpen A.G., Taylor R. // J. Chem. Soc. Perkin Trans. 2,
1987. N 12. P. S1. doi 10.1039/P298700000S1
циональных руководящих принципов по уходу и
11.
Зефиров Ю.В., Зоркий П.М. // Усп. хим. 1989.
использованию животных.
Т. 58. С. 713; Zefirov Yu.V., Zorkii P.M. // Russ.
ФОНДОВАЯ ПОДДЕРЖКА
Chem. Rev. 1989. Vol. 58. P. 421. doi 10.1070/
RC1989v058n05ABEH003451
Работа выполнена при поддержке Комитета
12.
Fabian L., Argay G., Kalman A., Bathori M. // Acta
науки Министерства образования и науки Респу-
Crystallogr. 2002. Vol. 58. P. 710. doi 10.1107/
блики Казахстан (грант АР05133718
«Синтез,
S0108768102005608
строение и биологическая активность новых водо-
13.
Parsons S., Flack H.D., Wagner T. // Acta Crystallogr.
растворимых производных полиоксистероидов»).
2013. Vol. 69. P. 249. doi 10.1107/S2052519213010014
14.
Demarco P.V., Thakkar A.I. // J. Chem. Soc. Chem.
КОНФЛИКТ ИНТЕРЕСОВ
Commun. 1970. N 1. P. 2. doi 10.1039/C29700000002
Авторы заявляют об отсутствии конфликта
15.
Hazra S., Hossain M., Kumar G.S. // J. Incl. Phenom.
интересов.
Macrocycl. Chem. 2014. Vol. 78. N 1-4. P. 311. doi
10.1007/s10847-013-0301-6
СПИСОК ЛИТЕРАТУРЫ
16.
Loftsson T., Masson M., Brewster M.E. // J. Pharm. Sci.
1. Rinaldi L., Binello A., Stolle A., Curini M., Cravotto G. //
2004. Vol. 93. N 5. P. 1091. doi 10.1002/jps.20047
Steroids. 2015. Vol. 98. P. 58. doi 10.1016/j.
17.
SMART V5.051 and SAINT V5.00, Area detector
steroids.2015.02.016
control and integration software. Bruker AXS Inc.,
2. Forgo P., Vincze I., Kover K.E. // Steroids. 2003. Vol. 68.
Madison, WI-53719, USA,1998.
P. 321. doi 10.1016/S0039-128X(03)00041-2
18.
Sheldrick G. M., SADABS, Bruker AXS Inc., Madison,
3. Jover A., Budal R.M., Al-Soufi W., Meijide F., Tato J.V.,
WI-53719, USA, 1997.
Yunes R.A. // Steroids. 2003. Vol. 68. P. 55. doi 10.1016/
19.
Altomare A., Burla M.C., Camalli M., Cascarano G.L.,
S0039-128X(02)00115-0
Giacovazzo C., Guagliardi A., Moliterni A.G.G.,
4. Szejtli J. Cyclodextrins and Their Inclusion Complexes.
Polidori G., Spagna R. // J. Appl. Cryst. 1999. Vol. 32.
Budapest: Akademiai Kiado, 1982. 296 р. doi 10.1002/
P. 115. doi 10.1107/S0021889898007717
S19820341113
20.
Sheldrick G.M. // Acta Crystallogr. 2015. Vol. 71. Р. 3.
5. Uekama K., Hirayama F., Irie T. // Chem. Rev. 1998.
doi 10.1107/S2053229614024218
Vol. 98. N 5. P. 2045. doi 10.1021/cr970025p
21.
Руководство по проведению доклинических ис-
6. Rasheed A., Kumar A.S.K., Sravanthi V.V. // Sci. Pharm.
следований лекарственных средств / Под ред.
2008.Vol. 76. N 4. P. 567. doi 10.3797/scipharm.0808-05
А.Н. Миронова, Н.Д. Бунятяна, А.Н. Васильева,
7. Temirgaziyev B., Kucakova K., Baizhigit E., Jurasek M.,
О.Л. Верстаковой, М.В. Журавлевой, В.К. Лепахи-
Dzubak P., Hajduch M., Dolensky B., Drasar P., Tule-
на, Н.В. Коробова, В.А. Меркулова, С.Н. Орехова,
uov B., Adekenov S. // Steroids. 2019. Vol. 147. P. 37.
И.В. Сакаевой, Д.Б. Утешева, А. Яворского. М.:
doi 10.1016/j.steroids.2018.11.007
Гриф и К, 2012. Ч. 1. 944 с.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 12 2020
СУПР
АМОЛЕКУЛЯРНЫЙ КОМПЛЕКС 3-АЦЕТАТА 20-ГИДРОКСИЭКДИЗОНА
1857
Supramolecular Complex of 20-Hydroxyecdysone-3-acetate
with β-Cyclodextrin and Its Biological Activity
B. I. Tuleuova,*, B. S. Temirgazieva,b, A. M. Kozhanovaa, R. B. Seydakhmetovaa, K. M.
Turdybekovb, T. M. Seilkhanovc, O. T. Seilkhanovc, P. Drasard, and S. M. Adekenova
a International Scientific and Production Holding “Phytochemistry”, Karaganda, 100009 Kazakhstan
b E.A. Buketov Karaganda State University, Karaganda, 100028 Kazakhstan
c Sh. Ualikhanov Kokshetau State University, Kokshetau, 020000 Kazakhstan
d University of Chemistry and Technology, Prague, 16628 Czech Republic
*e-mail: info@phyto.kz
Received August 18, 2020; revised August 18, 2020; accepted August 30, 2020
In order to obtain new potentially bioactive substances and to study the effect of bulky functional groups on the
formation of supramolecular complexes, 20-hydroxyecdysone triacetate was synthesized, its spatial structure
was studied, and complexation with β-cyclodextrin was studied by NMR method. The anti-inflammatory activity
of the obtained water-soluble complex was studied.
Keywords: 20-hydroxyecdysone triacetate, β-cyclodextrin, supramolecular complex, X-ray structural analysis,
NMR spectroscopy
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 12 2020