ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2020, том 90, № 12, с. 1858-1866
УДК 547.571:547.539.141:547.539.141
РЕАКЦИИ ПОЛИФТОРАРОМАТИЧЕСКИХ
ЦИНКОРГАНИЧЕСКИХ СОЕДИНЕНИЙ С
ОКСАЛИЛХЛОРИДОМ В ДМФА.
СИНТЕЗ ПОЛИФТОРАРОМАТИЧЕСКИХ
АЛЬДЕГИДОВ
© 2020 г. А. С. Виноградов, В. Е. Платонов*
Новосибирский институт органической химии имени Н. Н. Ворожцова Сибирского отделения
Российской академии наук, пр. Академика Лаврентьева 9, Новосибирск, 630090 Россия
*e-mail: platonov@nioch.nsc.ru
Поступило в Редакцию 17 июля 2020 г.
После доработки 17 июля 2020 г.
Принято к печати 27 июля 2020 г.
Взаимодействие полифторароматических цинкорганических соединений с оксалилхлоридом в ДМФА
протекает с участием реагента Вильсмайера-Хаака и образованием полифторароматических альдегидов
в качестве основных продуктов. Использование CuI позволяет повысить выход целевых альдегидов.
Ключевые слова: полифторароматические цинкорганические соединения, оксалилхлорид, ДМФА,
реагент Вильсмайера-Хаака, полифторароматические альдегиды
DOI: 10.31857/S0044460X20120082
Цинкорганические соединения являются важ-
межуточных иминиевых солей с ароматическими
ными металлоорганическими реагентами, исполь-
цинкорганическими соединениями, приводящими
зуемыми в органическом и металлоорганическом
к синтезу ароматических функциональных произ-
синтезе. Из ароматических цинкорганических
водных [1].
соединений получено значительное число функ-
Полифторароматические альдегиды использу-
циональных производных аренов, включая кар-
ются в качестве исходных соединений для получе-
бонилсодержащие соединения [1]. Для получения
ния фторсодержащих продуктов, представляющих
карбонилсодержащих функциональных произво-
интерес для медицины [5, 6], сельского хозяйства
дных полифтораренов целесообразно использо-
[7] и электроники [8].
вать полифторарилцинкорганические соединения,
Ранее пентафторбензальдегид синтезировали
поскольку в последние годы были разработаны
по реакции Гриньяра или из литийорганических
удобные общие методы их получения [2-4]. В
соединений, полученных из иод-, бром- и хлорпен-
реакциях этих соединений с хлорангидридами
тафторбензола, с этилформиатом, этилортоформи-
карбоновых кислот в присутствии CuCl в ДМФА
атом, N-метилформанилидом. Эти и другие синте-
получаются полифторароматические кетоны [3,
зы пентафторбензальдегида описаны в обзоре [9].
4]. Для выявления возможности синтеза полифто-
Нами для синтеза пентафторбензальдегида и
рароматических альдегидов из полифтораромати-
других полифторароматических альдегидов изуче-
ческих цинкорганических соединений представ-
ны реакции полифторароматических цинкоргани-
лялось целесообразным исследовать их реакции
ческих соединений с реагентом Вильсмайера-Ха-
с реагентом Вильсмайера-Хаака (соль иминия),
ака. Удобным способом получения этого реагента
принимая во внимание результаты реакций про-
является взаимодействие оксалилхлорида с ДМФА
1858
РЕАКЦИИ ПОЛИФТОР
АРОМАТИЧЕСКИХ ЦИНКОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
1859
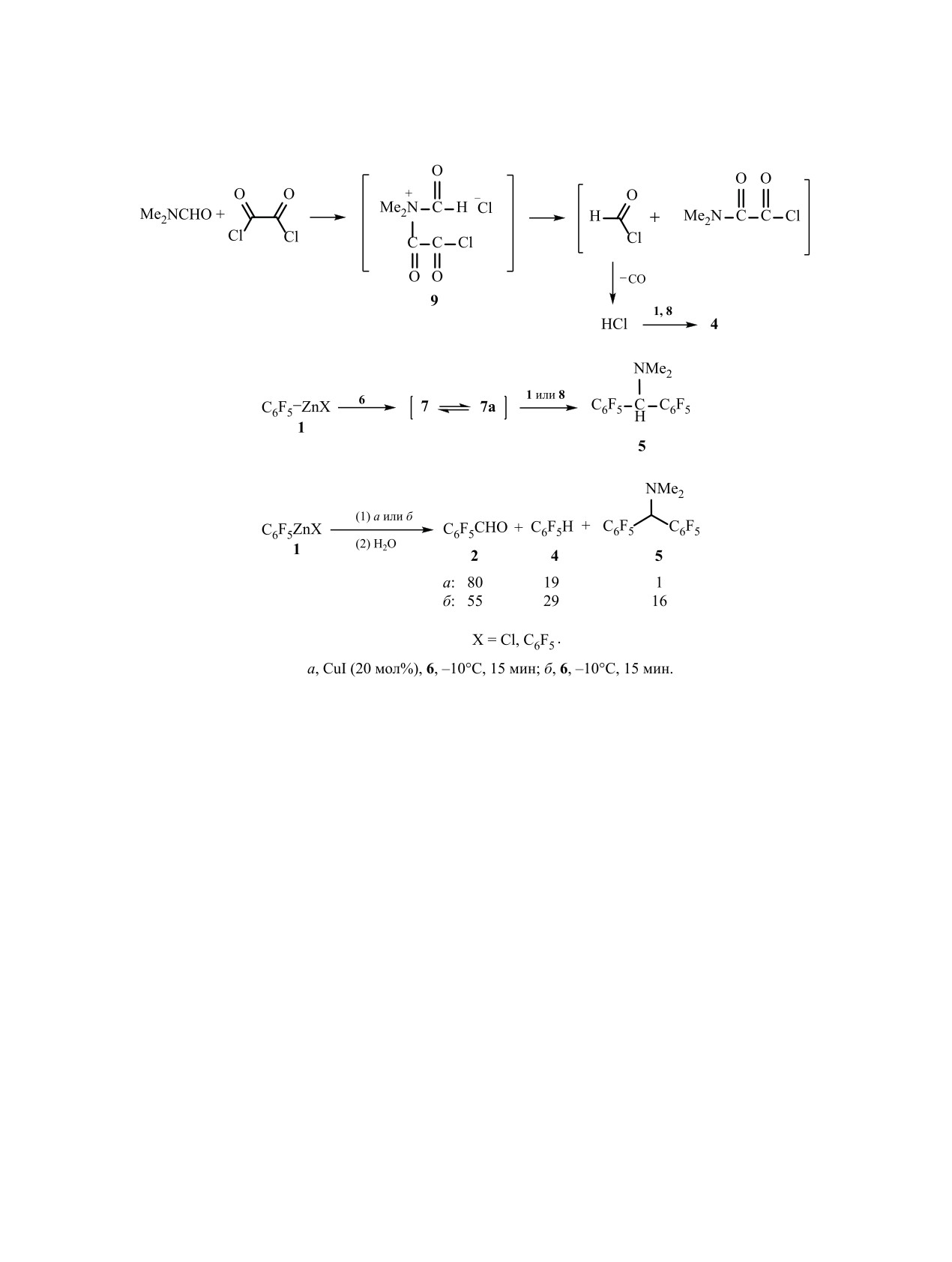
Схема 1.
Схема 2.
[10-12]. Этот метод и был использован для изуче-
7 содержание продуктов реакции представлено по
ния возможности синтеза полифторароматических
данным спектроскопии ЯМР 19F.
альдегидов. Было также интересно исследовать
Альдегид 2, по-видимому, образуется с участи-
влияние CuI на превращение полифторарилцинк-
ем реагента Вильсмайера-Хаака 6, образующего-
органических соединений с оксалилхлоридом
ся при взаимодействии оксалилхлорида с ДМФА
в ДМФА, приводящее к образованию реагента
(схема 2). Промежуточные соединения 7 и 7а могли
Вильсмайера-Хаака. Ранее в реакциях полифтор-
образоваться в результате взаимодействия соеди-
арилцинкорганических соединений с хлор-
нения 6 с реагентами 1 и 8. Появление последнего
ангидридами карбоновых кислот в ДМФА в при-
возможно в результате переметаллирования цин-
сутствии CuCl были получены полифторарома-
корганических соединений 1 под действием CuI.
тические кетоны, тогда как в их отсутствие при
При обработке водой соединений 7 и 7а должен
использовании реагента Вильсмайера-Хаака - N,N-
получаться альдегид 2 (схема 2). Промежуточные
диметилбис(полифторарил)метанамины [3, 4, 13].
соединения 7 и 7а соответствуют реагентам тако-
Установлено, что при взаимодействии C6F5ZnX
го типа, предлагаемым в реакциях реагентов Гри-
1 (X = Cl, C6F5) с оксалилхлоридом в присутствии
ньяра с солями иминия, полученных из N,N-диизо-
CuI в ДМФА реагенты 1 полностью претерпева-
пропилформамида, N,N-дициклогексилформамида
ют превращения, и после обработки реакционной
и фосгена [14].
смеси водой в качестве основного продукта полу-
чается пентафторбензальдегид 2 наряду с неболь-
Можно представить различные пути образо-
шими количествами перфторбензила 3, пента-
вания соединений 3-5. Так, синтез бензила 3, ве-
фторбензола 4 и N,N-диметилбис(пентафторфе-
роятно, происходит в результате взаимодействия
нил)метанамина 5 (схема 1). Здесь и на схемах 5 и
соединения
8 с оксалилхлоридом подобно об-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 12 2020
1860
ВИНОГРАДОВ, ПЛАТОНОВ
Схема 3.
Схема 4.
Схема 5.
разованию полифторароматических кетонов из
ских кетонов и альдегидов соответственно, тре-
ArFZnX и хлорангидридов карбоновых кислот в
бует отдельного исследования. Можно предполо-
присутствии CuCl [4]. Соединение 4 образуется
жить, что на направление этих процессов влияет
при действии HCl на реагенты 1 и 8 [2, 3, 15-18].
степень образования реактивов Вильсмайера-Ха-
Появление HCl может происходить в результате
ака из ДМФА, хлорангидридов карбоновых кис-
переамидирования ДМФА под действием окса-
лот и оксалилхлорида. Этому предположению не
противоречит полученный результат синтеза аль-
лилхлорида. Этот процесс включает промежуточ-
ное участие соли аммония 9 (cхема 3) аналогично
дегида 2 из соединений 1, оксалилхлорида, CuI в
ДМФА без образования бензила 3. С этой целью
превращению ДМФА под действием хлорангидри-
эта реакция была проведена смешением отдельно
дов карбоновых кислот [19, 20].
приготовленного реагента 6 с соединениями 1, CuI
Образование амина 5, вероятно, происходит в
и ДМФА. Действительно, в этом случае удается
результате взаимодействия промежуточных сое-
избежать образования бензила 3. Обработка реак-
динений 7 и 7а с реагентами 1 и 8 [13] (cхема 4).
ционной смеси водой привела в основном к альде-
Амины, подобные соединению 5, были также по-
гиду 2 наряду с ареном 4 (схема 5). В идентичных
лучены в качестве основных продуктов реакций
условиях была проведена реакция реагентов 1 с
солей иминия с реагентами Гриньяра и соединени-
имином 6 в отсутствие CuI. Имин 6 был приготов-
ями алкиллития [14].
лен в одной емкости для его использования, как
Различие в механизмах реакций C6F5ZnX (X =
в предыдущем опыте, так и для реакции в отсут-
Cl, C6F5) с хлорангидридами карбоновых кислот,
ствие CuI с целью сравнения результатов. Как ока-
CuCl в ДМФА, c оксалилхлоридом, CuI в ДМФА,
залось, альдегид 2 в последнем случае получился
приводящих к получению полифторароматиче-
в меньшем количестве по отношению к продуктам
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 12 2020
РЕАКЦИИ ПОЛИФТОР
АРОМАТИЧЕСКИХ ЦИНКОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
1861
Схема 6.
4 и 5. Сравнение этих результатов свидетельствует
метил)бензальдегид 11. Аналогично, соединения
о целесообразности использования CuI для синте-
4-циано-2,3,5,6-тетрафторфенилцинка
12 дают
за альдегида 2.
в качестве основного продукта 2,3,5,6-тетраф-
тор-4-формилбензонитрил 13 (схема 6). Более тща-
Образование альдегида 2 в качестве основного
тельное изучение этой реакции показало наличие
продукта реакции соединений 1 с заведомо приго-
товленным реагентом 6 в ДМФА по сравнению с
в реакционной смеси, кроме альдегида 13, побоч-
ных продуктов - 2,3,5,6-тетрафторбензонитрила
синтезом амина 5 в реакции соединений 1 с бен-
14, 4,4ʹ-бис(циано)октафторбифенила 15 и N,N-ди-
зоилхлоридом в ДМФА [13], видимо, обусловлено
метилбис(4-циано-2,3,5,6-тетрафторфенил)-
проведением последнего процесса в более жест-
метанамин 16.
ких условиях (60-65°С, 4 ч) и использованием из-
бытка бензоилхлорида.
Аналогичные превращения происходили при
взаимодействии соединений нонафториндан-5-ил-
Увеличение относительного содержания аль-
дегида 2 по сравнению с ареном 4 в реакционной
цинка 17, полученных из перфториндана, с CuI
и реагентом 6. Перфториндан-5-карбальдегид 18
смеси, полученной при взаимодействии реагентов
был получен в качестве основного продукта реак-
1 с имином 6 в присутствии CuI, могло быть об-
ции (схема 6), наряду с 1,1,2,2,3,3,4,5,7-нонафто-
условлено участием в процессе с CuI анионного
ринданом 19, перфторбиинданилом 20 и N,N-ди-
комплекса ат-типа. Образующийся органокупрат
метилбис(нонафториндан-5-ил)метанамином 21 в
[C6F5CuII]─ZnCl+ должен обладать большей ну-
клеофильностью, чем соединение 8 (ср. [21]), что
качестве побочных продуктов.
должно приводить к большему содержанию аль-
Образование продуктов реакции из соединений
дегида 2 и уменьшению количества арена 4. При
10, 12, 17, реагента 6 и CuI можно объяснить с по-
проведении реакции с увеличением загрузок реа-
мощью процессов, предложенных выше для ана-
гентов 1, 6 и CuI альдегид 2 синтезирован с выхо-
логичных превращений соединений 1.
дом 57% (схема 6).
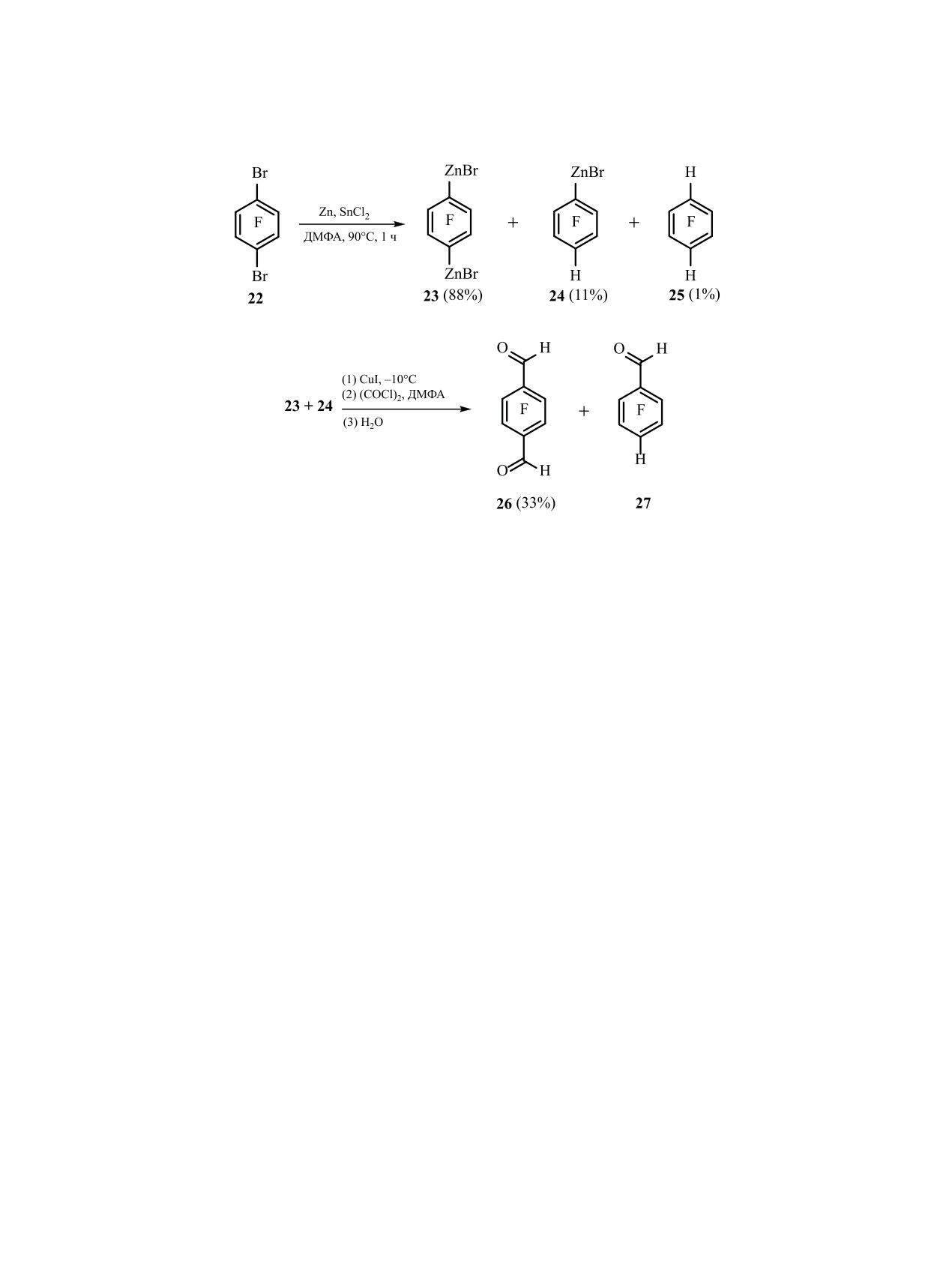
С целью расширения возможностей синтеза
Из соединений
4-(трифторметил)-2,3,5,6-те-
полифторароматических альдегидов мы изучи-
трафторфенилцинка 10, полученных из октафтор-
ли подобные превращения полифторароматиче-
толуола, в реакции с 6 в присутствии CuI с выходом
ских дицинкорганических призводных. Недавно
52% был получен 2,3,5,6-тетрафтор-4-(трифтор-
было выдвинуто предположение, что при синтезе
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 12 2020
1862
ВИНОГРАДОВ, ПЛАТОНОВ
Схема 7.
Схема 8.
тетрафторгидрохинона в качестве промежуточ-
стых соединений в смеси CCl4-CDCl3. Спектры
ного продукта образуется тетрафтор-п-фенилен-
ЯМР 13C записаны на приборе Bruker DRX 400
дицинкпроизводное из бистриметилсилилового
(101 МГц) в CDCl3. ИК и УФ спектры записаны
эфира тетрафтортерефталевой кислоты и ацетата
на приборах Bruker Vector 27 FTIR и Agilent Cary
цинка в ДМФА [22]. Нами показано, что 1,4-ди-
5000 соответственно. Молекулярные массы и эле-
бром-2,3,5,6-тетрафторбензол 22 в реакции с Zn в
ментный состав определены на масс-спектрометре
присутствии SnCl2 в ДМФА при 90°C дает соот-
высокого разрешения Thermo Electron Corporation
ветствующее дицинкорганическое призводное -
DFS (энергия ионизации - 70 эВ). Для ГХ-МС ис-
2,3,5,6-тетрафторфенил-1,4-дицинкбромид 23 - в
пользовали хроматограф HP 5890 с масс-селектив-
качестве основного продукта. В небольших коли-
ным детектором HP G1801A. Разделение веществ
чествах также образуется 2,3,5,6-тетрафторфенил-
осуществляли с помощью колонки HP-5 (5% би-
цинкбромид 24, наряду с 1,2,4,5-тетрафторбензо-
фенила и 95% диметилсилоксана, 30 м × 0.25 мм ×
лом 25 (схема 7).
0.25 мкм), газ-носитель - гелий, скорость потока -
1 мл/мин, температура колонки - 50-280°C, источ-
При обработке данной смеси реагентом 6 в при-
ника ионов - 173°С. ГХ-Анализ проводили на
сутствии CuI получены 2,3,5,6-тетрафтортерефта-
приборе HP 5890 серии II c колонкой HP-5 (5% би-
левый альдегид 26 и 2,3,5,6-тетрафторбензальде-
фенила и 95% диметилсилоксана, 30 м × 0.52 мм ×
гид 27 (схема 8).
2.6 мкм) и детектором по теплопроводности. Тем-
Таким образом, в результате изучения взаимо-
пературы плавления определяли на приборе Elec-
действия полифторароматических цинкоргани-
trothermal IA9100.
ческих соединений с оксалилхлоридом в ДМФА,
Все реакции проводили в атмосфере аргона.
показано, что процесс c участием реагента Виль-
ДМФА перегоняли в атмосфере аргона над CaH2
смайера-Хаака преобладает над прямым взаимо-
и хранили над молекулярными ситами 4 Å. Цин-
действием оксалилхлорида с цинкорганическим
корганические соединения 1, 10, 12 и 17 получе-
реагентом, приводя к синтезу полифтораромати-
ны, как описано нами ранее [17]. Соединения 2
ческих альдегидов.
[23-25], 3 [26, 27], 4 [23], 5 [13], 11 [28], 14 [29], 15
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
[30], 16 [13], 19 [31] и 21 [13] идентифицированы с
Спектры ЯМР 19F и 1H записаны на приборе
помощью данных ЯМР 1H и 19F.
Bruker AV-300 (282.4 и 300 МГц соответствен-
Для проведения каждого из трех последующих
но) для реакционных смесей в ДМФА и для чи-
экспериментов по взаимодействию соединений 1 с
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 12 2020
РЕАКЦИИ ПОЛИФТОР
АРОМАТИЧЕСКИХ ЦИНКОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
1863
оксалилхлоридом в ДМФА готовили раствор сое-
ционная смесь содержала аддукты 7 и 7а (79%),
динений 1 (4.52 г, 6 ммоль) в реакции хлорпентаф-
соединения 2 (1%), 4 (19%) и 5 (1%). Аддукты
торбензола (3.65 г, 18 ммоль) и Zn пыли (3.53 г, 54
7 и 7а. Спектр ЯМР 19F, δF, м. д.: -130.8 м (2F,
ммоль) в ДМФА (10 мл) по методу [17].
F2,6), -144.3 т. т (1F, F4, 3JF4F3,5 = 21.0, 4J F4F2,6 =
6.5 Гц), -160.0 м (2F, F3,5).
Взаимодействие C6F5ZnX 1 (X = Cl, C6F5) с
оксалилхлоридом в присутствии CuI в ДМФА.
Реакционную смесь выливали в воду (50 мл),
Раствор соединений 1 (4.52 г, 6 ммоль) смешива-
экстрагировали CH2Cl2 (2×20 мл). Органический
ли с CuI (0.23 г, 1.2 ммоль). Затем к этой смеси
слой отделяли и сушили MgSO4. Согласно данным
добавляли по каплям при -10°C оксалилхлорид
ЯМР 19F, смесь содержала соединения 2 (80%), 4
(1.14 г, 9 ммоль). Реакция сопровождалась выделе-
(19%) и 5 (1%). После перегонки с паром и отгон-
нием газа. Согласно ЯМР 19F, реакционная смесь
ки растворителя в вакууме получили 0.55 г альде-
содержала аддукты 7 и 7а (65%), а также соедине-
гида 2 с чистотой ~98% (ЯМР 19F).
ния 2 (1%), 3 (11%), 4 (20%) и 5 (2%). Реакционную
Пентафторбензальдегид (2). К раствору сое-
смесь выливали в воду (50 мл) и экстрагировали
динений 1, полученному из хлорпентафторбензо-
CH2Cl2 (2×20 мл). Органический слой отделяли и
ла (40.50 г, 0.2 моль) и Zn пыли (39.22 г, 0.6 моль) в
сушили MgSO4. Согласно данным ЯМР 19F, смесь
ДМФА (108 мл), добавляли CuI (7.62 г, 40 ммоль).
содержала соединения 2 (66%), 3 (14%), 4 (16%) и
Полученный раствор добавляли по каплям в тече-
5 (4%).
ние 4.5 ч при -10°С к реагенту 6, приготовленно-
Приготовление реагента Вильсмайера-Ха-
му из оксалилхлорида (38.8 г, 0.3 моль) и ДМФА
ака (6). К охлажденному ДМФА (-15°C) добав-
(100 мл). Согласно данным ЯМР 19F, реакционная
ляли свежеперегнанный оксалилхлорид. Реакция
смесь содержала аддукты 7 и 7а (84%), соедине-
сопровождалась выделением газа и образованием
ния 4 (4.5%), 5 (10%). Реакционную смесь выли-
белого осадка. Реакционную смесь перемешивали
вали в воду и перегоняли с паром. Органический
в течение 30 мин при -10°C, затем летучие про-
слой отделяли и сушили MgSO4. Получили смесь
дукты удаляли в вакууме (~2 мм рт. ст.), получая
(29.35 г), содержащую, по данным ГХ, соединения
реагент 6, использованный в дальнейших опытах.
2 (85.4%) (выход 64%), 4 (3.0%), 5 (9.5%), иден-
Взаимодействие цинкорганических сое-
тифицированные с помощью ЯМР 1H и 19F. Пе-
динений 1 с реагентом 6. а. В отсутствие CuI.
регонкой в вакууме выделена фракция (15.54 г)
Раствор соединений 1 (4.52 г, 6 ммоль) по каплям
с т. кип. 56-58°C (~14 мм рт. ст.), содержащая
добавляли к реагенту 6, приготовленному из окса-
(ГХ) 97.8% соединения 2 и фракцию (6.89 г) с
лилхлорида (1.14 г, 9 ммоль) и ДМФА (2 мл), при
т. кип. 58-59°С (~14 мм рт. ст.) (59-59.5°С, 11 мм
-10°C в течение 15 мин. Согласно данным ЯМР
рт. ст. [24]), содержащую (ГХ) 98.4% соединения
19F, реакционная смесь содержала аддукты 7 и 7а
2. Общий выход соединения 2 составил 57%, бес-
(53%), соединения 2 (1%), 4 (30%) и 5 (16%). Реак-
цветная жидкость. ИК спектр (KBr), ν, см-1: 2930
ционную смесь выливали в воду (50 мл) и экстра-
(C-H), 2889 (C-H), 1715 (C=O). Спектр ЯMР 1Н,
гировали CH2Cl2 (2×20 мл). Органический слой
δ, м. д.: 10.23 м (1H, CHO). Спектр ЯMР 19F, δF,
отделяли и сушили MgSO4. Согласно данным ЯМР
м. д.: -145.7÷-145.5 м (3F, F4 + F2,6), -161.8 м (2F,
19F, смесь содержала соединения 2 (55%), 4 (29%)
F3,5). Спектральные данные согласуются с опубли-
и 5 (16%). После перегонки с паром и отгонки рас-
кованными ранее [23-25].
творителя в вакууме получили 0.34 г смеси, содер-
2,3,5,6-Тетрафтор-4-(трифторметил)бензаль-
жащей, по данным ЯМР 19F, соединения 2 (69%) и
дегид (11). Раствор соединений 10, полученный
5 (31%).
из октафтортолуола (11.80 г, 50 ммоль), Zn пыли
б. В присутствии CuI. Раствор соедине-
(9.81 г, 150 ммоль), SnCl2 (0.95 г, 5 ммоль) в ДМФА
ний 1 (4.52 г, 6 ммоль) смешивали с CuI (0.23 г,
(27 мл), смешивали с CuI (1.90 г, 10 ммоль) и до-
1.2 ммоль). Полученный раствор по каплям добав-
бавляли по каплям в течение 2.5 ч при -10°C к
ляли в течение 15 мин при -10°C к реагенту 6, при-
реагенту 6, приготовленному из оксалилхлорида
готовленному из оксалилхлорида (1.14 г, 9 ммоль)
(10.15 г, 80 ммоль) и ДМФА (25 мл). Реакционную
и ДМФА (2 мл). Согласно данным ЯМР 19F, реак-
смесь выливали в воду и перегоняли с паром. Ор-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 12 2020
1864
ВИНОГРАДОВ, ПЛАТОНОВ
ганический слой отделяли и сушили MgSO4. По-
Перфториндан-5-карбальдегид (18). Раствор
лучили смесь (9.94 г), содержащую, по данным
соединений 17, полученный из перфториндана
ГХ, 84.7% соединения 11 (выход 69%). Перегон-
(14.90 г, 50 ммоль), Zn пыли (9.81 г, 150 ммоль),
кой в вакууме получили фракцию (6.39 г) с т. кип.
SnCl2 (0.95 г, 5 ммоль) в ДМФА (27 мл), смешива-
66-70°С (~14 мм рт. ст.) (т. кип. 52°С, 2 мм рт. ст.
ли с CuI (1.90 г, 10 ммоль) и добавляли по каплям
[28]) с содержанием (ГХ) соединения 11 99% (вы-
в течение 2.5 ч при -10°C к реагенту 6, приготов-
ход 52%), легкоплавкое бесцветное вещество, т.
ленному из оксалилхлорида (10.15 г, 80 ммоль) и
пл. 27-30°С. ИК спектр (CCl4), ν, см-1: 2882 (C-H),
ДМФА (25 мл). Согласно данным ЯМР 19F, реакци-
1719 (C=O). Спектр ЯMР 1Н, δ, м. д.: 10.32 с (1H,
онная смесь содержала аддукты типа 7 и 7а (76%)
CHO). Спектр ЯMР 19F, δF, м. д.: -57.8 т (3F, CF3,
[спектр ЯMР 19F, δF, м. д.: -107.0 м и -105.7 м (2F,
4JCF3F3,5 = 22.0 Гц), -140.3 м (2F, F3,5), -144.3 м (2F,
F1, F3), -107.6 д. м (1F, F4, J = 18.0 Гц), -112.9 уш.
F2,6). Спектральные данные согласуются с опубли-
д (1F, F6, J ~ 20.0 Гц), -128.8 м (2F, F2), -139.8 т. т
кованными данными [28].
(1F, F7, J ~ 20.0, J = 5.5 Гц)], соединения 19 (9%),
20 (3%) и 21 (12%). Реакционную смесь выливали
2,3,5,6-Тетрафтор-4-формилбензонитрил
в воду и перегоняли с паром. Органический слой
(13). Раствор соединений 12, полученный из пен-
отделяли и сушили MgSO4. Смесь (9.97 г) содер-
тафторбензонитрила (9.65 г, 50 ммоль), Zn пыли
жала (ГХ) соединения 18 (78.1%, выход 51%), 19
(9.81 г, 150 ммоль), SnCl2 (0.95 г, 5 ммоль) в ДМФА
(8.6%), 20 (3.0%). Перегонка в вакууме дала фрак-
(27 мл), смешивали с CuI (1.90 г, 10 ммоль) и до-
цию (6.24 г) с т. кип. 63-68°С (~4 мм рт. ст.) с со-
бавляли по каплям в течение 1.5 ч при -10°C к
держанием соединения 18 (ГХ) 96% (выход 39%),
реагенту 6, приготовленному из оксалилхлорида
светло-желтая жидкость. ИК спектр (CCl4), ν, см-1:
(10.15 г, 80 ммоль) и ДМФА (25 мл). Согласно дан-
2879 (C-H), 1722 (C=O), 1649, 1499, 1460, 1383,
ным ЯМР 19F, реакционная смесь содержала аддук-
1331, 1256, 1205, 1163, 1099, 1040, 999, 941. УФ
ты 7 и 7а (81%) (спектр ЯMР 19F, δF, м. д.: -129.5 м,
-131.2 м), соединения 14 (11%), 15 (2%) и 16 (6%).
спектр (гексан), λmax, nm (ε×10-4, л·см-1·моль-1):
Реакционную смесь выливали в воду, органиче-
206 (0.389), 232 (0.166), 278 (0.056). Спектр ЯМР
ский слой промывали водой (100 мл), отделяли и
1Н, δ, м. д.: 10.35 с (1H, CHO). Спектр ЯМР 13C,
δC, м. д.: 112.35 т. квинт (С2, 1JCF = 276.7, 2JCF =
сушили MgSO4. Растворитель отгоняли в вакууме,
25.2 Гц), 113.38 т. т. м (С1(3), 1JCF = 262.8, 2JCF =
коричневый твердый остаток отделяли фильтрова-
25.7 Гц), 113.47 т. т. м (С3(1), 1JCF = 260.1, 2JCF =
нием. Получили 6.88 г продукта, содержащего, по
25.4 Гц), 117.08 м, 120.11 т (С5, 2JCF = 10.4 Гц),
данным ЯМР 19F и 1H, 77% альдегида 13 (выход
126.04 м, 143.91 д. д. д (С6, 1JCF = 265.2, 2JCF = 14.6,
52%). После колоночной хроматографии на сили-
3JCF = 5.1 Гц), 154.11 д. д. д (С7, 1JCF = 275.6, 2JCF =
кагеле (70-230 меш, элюент - CHCl3) получено
13.2, 4JCF = 3.9 Гц), 154.91 д. т (С4, 1JCF = 274.2, 3JCF =
3.91 г (38%) альдегида 13 с чистотой 98% (ГХ).
3.9 Гц), 181.15 уш. c (CHO). Спектр ЯМР 19F, δF,
Твердое вещество желтого цвета, т. пл. 105-106°С
м. д.: -109.2 м и -108.1 м (2F, F1, F3), -120.4 д. к
(CHCl3). ИК спектр (KBr), ν, см-1: 2938 (CH), 2911
(1F, F4, J = 21.9, J = 7.6 Гц), -127.5 д. м (1F, F6, J =
(CH), 2253 (C≡N), 1701 (C=O), 1654, 1491, 1420,
20.4 Гц), -131.1 квинтет (2F, F2, J = 3.8 Гц), -141.4
1395, 1310, 1266, 1089, 997, 909, 807, 629, 492. УФ
т. т (1F, F7, J = 21.2, J = 6.8 Гц). Масс-спектр, m/z:
спектр (EtOH), λmax, нм (ε×10-4, л·см-1·моль-1):
307.9872 [M]+. Найдено, %: C 39.4; H 0.4; F 55.6.
201 (0.933), 228 (1.202), 235 (1.202), 292 (0.204).
C10HF9O. Вычислено, %: C 39.0; H 0.3; F 55.5. М
Спектр ЯМР 1Н, δ, м. д.: 10.31 с (1H, CHO). Спектр
307.9878.
ЯМР 13C, δC, м. д.: 99.17 т. т (С1, 2JCF = 17.1, 3JCF =
2.9 Гц), 106.65 т. м (CN, 3JCF = 3.7 Гц), 119.20 т (С4,
Реакция
1,4-дибром-2,3,5,6-тетрафтор-
2JCF = 9.7 Гц), 146.47 д. м (СAr, 1JCF = 265.6 Гц),
бензола 22 с Zn. Смесь соединения 22 (1.85 г,
147.40 д. д. д. д (СAr, 1JCF = 265.6, 2JCF = 15.4, 3JCF
6.0 ммоль), Zn пыли (1.96 г, 30 ммол), SnCl2 (0.23
= 5.3, 4JCF = 2.2 Гц), 181.19 м (СHO). Спектр ЯМР
г, 1.2 ммоль) и ДМФА (6 мл) нагревали в при пере-
19F, δF, м. д.: -132.8 м (2F, F3,5), -143.9 м (2F, F2,6).
мешивании при 90°C в течение 1 ч. После охлаж-
Масс-спектр, m/z: 202.9985 [М]+. Найдено, %: C
дения до комнатной температуры реакционную
47.5; H 0.4; F 36.8; N 7.1. C8HF4NO. Вычислено, %:
смесь центрифугировали (5000 об/мин, 15 мин),
C 47.3; H 0.5; F 37.4; N 6.9. М 202.9989.
раствор цинкорганических соединений декантиро-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 12 2020
РЕАКЦИИ ПОЛИФТОР
АРОМАТИЧЕСКИХ ЦИНКОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
1865
вали и анализировали методом ЯМР 19F. Согласно
3.
Vinogradov A.S., Krasnov V.I., Platonov V.E. //
данным ЯМР 19F, раствор содержал соединения 23
Mendeleev Commun. 2008. Vol. 18. N 4. P. 227. doi
(88%), 24 (11%) и 25 (1%). 2,3,5,6-Тетрафторфе-
10.1016/j.mencom.2008.07.022
4.
Виноградов А.С., Краснов В.И.,Платонов В.Е. //
нил-1,4-дицинкбромид 23. Спектр ЯМР 19F, δF,
ЖОрХ. 2010. Т. 46. Вып. 3. С. 352; Vinogradov A.S.,
м. д.: -119.3 уш. с (4F, FAr). 2,3,5,6-Тетрафтор-
Krasnov V.I., Platonov V.E. // Russ. J. Org. Chem. 2010.
фенилцинкбромид 24. Спектр ЯМР 19F, δF, м. д.:
Vol. 46. N 3. P. 344. doi 10.1134/S1070428010030073
-118.2 м (2F, F2,6), -140.3 м (2F, F3,5).
5.
Soloshonok V.A. In: Biomedical Fronties of Fluorine
2,3,5,6-Тетрафтортерефталевый альдегид
Chemistry / Eds I. Ojima, J.R. McCarthy, J.T. Welch.
(26). Раствор цинкорганических соединений, по-
Washington: American Chemical Society, 1996. P. 26.
лученный из 1,4-дибром-2,3,5,6-тетрафторбензола
6.
Kirk K.L., Nie J.-Y. In: Biomedical Fronties of Fluorine
22 (4.46 г, 14.50 ммоль), Zn пыли (5.69 г, 87 ммоль),
Chemistry / Eds I. Ojima, J.R. McCarthy, J.T. Welch.
SnCl2 (0.55 г, 2.9 ммоль) в ДМФА (14 мл), смешива-
Washington: American Chemical Society, 1996. P. 312.
ли с CuI (0.55 г, 2.89 ммоль) и добавляли по каплям
7.
Teixeira R.R., Barbosa L.C.A., Forlani G., Piló-Vel-
в течение 30 мин при -10°C к реагенту 6, приго-
oso D., Walkimar de Mesquita Carneiro J. // J. Agric.
Food Chem. 2008. Vol. 56. N 7. P. 2321. doi 10.1021/
товленному из оксалилхлорида (7.36 г, 58 ммоль)
jf072964g
и ДМФА (9 мл). Реакционную смесь выливали в
8.
Ota M., Fujii M., Horiguchi T., Otani S., Kojima A.,
воду (150 мл) и экстрагировали CHCl3 (3×40 мл),
Takahashi Y. // Mol. Cryst. Liq. Cryst. 1995. Vol. 272.
экстракт промывали водой (100 мл). Органический
N 1. P. 167. doi 10.1080/10587259508055285
слой отделяли, сушили MgSO4 и анализировали
9.
Pazitny A., Solcan T., Vegh D. // J. Fluorine Chem. 2009.
методом ГХ-МС. Согласно анализу, экстракт со-
Vol. 130. P. 267. doi 10.1016/j.jfluchem.2008.12.013
держал в основном смесь соединения 26 (ГХ-МС,
10.
Comprehensive Organic Chemistry. The Synthesis and
m/z: 206 [M]+) и 27 (ГХ-МС, m/z: 178 [M]+); иденти-
Reactions of Organic Compounds / Eds D.H.R. Barton,
фикация соединения 27 была также осуществлена
W.D. Ollis. Oxford: Pergamon Press, 1979. Vol. 1.
по данным ЯMР 19F [32]. После удаления раство-
P. 1118.
рителя в вакууме остаток (коричневое твердое ве-
11.
Majid T.N., Knochel P. // Tetrahedron Lett. 1990. Vol. 31.
щество, 2.25 г) возгоняли при 110°С (4 мм рт. ст.)
N 31. P. 4413. doi 10.1016/S0040-4039(00)97635-4
и получили 0.98 г альдегида 26 (выход 33%). Бес-
12.
Arrieta A., Lecea B., Palomo C. // J. Chem. Soc. Perkin
цветные игольчатые кристаллы, т. пл. 130-132°С
Trans. 1. 1987. P. 845. doi 10.1039/P19870000845
13.
Vinogradov A.S, Krasnov V.I., Platonov V.E. // Coll.
(CHCl3) (т. пл. 131-132°С [33]). Спектр ЯМР 1Н, δ,
Czech. Chem. Commun. 2008. Vol. 73. N 12. P. 1623.
м. д.: 10.31 с (2H, CHO) [34]. Спектр ЯМР 19F, δF,
doi 10.1135/cccc20081623
м. д.: -145.7 (4F, FAr) [34]. Масс-спектр, m/z: 206
14.
Wieland G., Simchen G. // Lieb. Ann. Chem. 1985. Vol.
[M]+.
1985. N 11. P. 2178. doi 10.1002/jlac.198519851108
БЛАГОДАРНОСТЬ
15.
Krasnov V.I., Platonov V.E. // J. Fluorine Chem.
1992. Vol. 58. N 2-3. P. 247. doi 10.1016/S0022-
Авторы выражают благодарность Химическо-
1139(00)80699-5
му исследовательскому центру коллективного
16.
Краснов В.И., Платонов В.Е. // ЖОрХ. 2000. Т. 36.
пользования Сибирского отделения РАН за прове-
Вып. 10. С. 1524; Krasnov V.I., Platonov V.E. // Russ.
дение спектральных и аналитических измерений.
J. Org. Chem. 2000. Vol. 36. N 10. P. 1488.
17.
Виноградов А.С., Краснов В.И., Платонов В.Е. //
КОНФЛИКТ ИНТЕРЕСОВ
ЖОрХ. 2008. Т. 44. Вып. 1. C. 101; Vinogradov A.S.,
Авторы заявляют об отсутствии конфликта
Krasnov V.I., Platonov V.E. // Russ. J. Org. Chem. 2008.
интересов.
Vol. 44. N 1. P. 95. doi 10.1134/S1070428008010119
18.
DePasquale R.J., Tamborski C. // J. Org. Chem. 1969,
СПИСОК ЛИТЕРАТУРЫ
Vol. 34. N 6. P. 1736. doi 10.1021/jo01258a046
1. The chemistry of organozinc compounds / Eds Z.
19.
Coppinger G.M. // J. Am. Chem. Soc. 1954. Vol. 76.
Rappoport, I. Marek. Chichester: John Wiley & Sons,
N 5. P. 1372. doi 10.1021/ja01634a056
2006. P. 1099.
20.
Кнунянц И.Л., Чебурков Ю.А., Аронов Ю.Е. // Изв.
2. Miller A.O., Krasnov V.I., Peters D., Platonov V.E.,
АН СССР. Сер. хим. 1966. № 6. С. 1038.
Miethchen R. // Tetrahedron Lett. 2000. Vol. 41. N 20.
21.
Лупи А., Чубар Б. Солевые эффекты в органической и
P. 3817. doi 10.1016/S0040-4039(00)00527-X
металлоорганической химии. М.: Мир, 1991. C. 376.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 12 2020
1866
ВИНОГРАДОВ, ПЛАТОНОВ
22. Boyko V.E., Don V.L., Igumnov S.M. // Fluorine Notes.
P. 1797. doi 10.1016/S0040-4020(96)01090-3
2019. N 4(125). doi 10.17677/fn20714807.2019.04.01
29. Tamborski C., Soloski E.J. // J. Org. Chem. 1966. Vol. 31.
23. Ando S., Matsuura T. // Magn. Res. Chem. 1995. Vol. 33.
N 3. P. 746. doi 10.1021/jo01341a023
N 8. P. 639. doi 10.1002/mrc.1260330805
30. Chapman N.B., Clarke K., Pinder R.M., Sawhney S.N. //
24. Ворожцов Н.Н., Бархаш В.А., Иванова Н.Г., Анички-
J. Chem. Soc. C. 1967. P. 293. doi 10.1039/
на С.А., Андреевская О.И. // Докл. АН СССР. 1964.
J39670000293
Т. 159. № 1. С. 125.
31. Фурин Г.Г., Малюта Н.Г., Платонов В.Е., Якоб-
25. Olah G.A., Mo Y.K. // J. Org. Chem. 1973. Vol. 38. N 15.
сон Г.Г. // ЖОрХ. 1974. Т. 10. С. 830.
P. 2682. doi 10.1021/jo00955a023
32. Lv H., Zhan J.-H., Cai Y.-B., Yu Y., Wang B., Zhang J.-L. //
26. Chambers R.D., Clark M., Spring D.J. // J. Chem.
J. Am. Chem. Soc. 2012. Vol. 134. N 39. P. 16216. doi
Soc. Perkin Trans. 1. 1972. P. 2464. doi 10.1039/
10.1021/ja305204y
P19720002464
33. Krebs F.C., Jensen T. // J. Fluorine Chem. 2003. Vol. 120.
27. Dua S.S., Jukes A.E., Gilman H. // J. Organomet.
N 1. P. 77. doi 10.1016/S0022-1139(02)00289-0
Chem. 1968. Vol. 12. N 2. P. 24. doi 10.1016/S0022-
328X(00)93842-7
34. Zhu S., Zhao J., Cai X. // J. Fluorine Chem. 2004.
28. Krasnov V.I., Platonov V.E., Beregovaya I.V.,
Vol.
125. N
3. P.
451. doi
10.1016/j.
Shchegoleva L.N. // Tetrahedron. 1997. Vol. 53. N 5.
jfluchem.2003.11.017
Reactions of Polyfluoroaromatic Organozinc Compounds
with Oxalyl Chloride in DMF. Synthesis of Polyfluoroaromatic
Aldehydes
A. S. Vinogradov and V. E. Platonov*
Vorozhtsov Novosibirsk Institute of Organic Chemistry, Siberian Branch of the Russian Academy of Sciences,
Novosibirsk, 630090 Russia
*e-mail: platonov@nioch.nsc.ru
Received July 17, 2020; revised July 17, 2020; accepted July 27, 2020
The reaction of polyfluoroaromatic organozinc compounds with oxalyl chloride in DMF proceeds with the
participation of the Vilsmeier-Haack reagent and the formation of polyfluoroaromatic aldehydes as the major
products. The use of CuI makes it possible to increase the yield of the target aldehydes.
Keywords: polyfluoroaromatic organozinc compounds, oxalyl chloride, DMF, Vilsmeier-Haack reagent,
polyfluoroaromatic aldehydes
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 12 2020